Method Article
יצירת מיקרו-סביבה תאית רב-תכליתית על-ידי UV-Photopatterning של מצעי תרביות תאים תלת-ממדיים
In This Article
Summary
באופן מסורתי, תרבית תאים מבוצעת על מצעים מישוריים המחקים בצורה גרועה את הסביבה הטבעית של תאים in vivo. כאן אנו מתארים שיטה לייצור מצעי תרביות תאים עם גיאומטריות מעוגלות רלוונטיות מבחינה פיזיולוגית וחלבונים חוץ-תאיים מיקרו-פטרייתיים, המאפשרת חקירה שיטתית של חישה תאית של רמזים חוץ-תאיים אלה.
Abstract
המטריצה החוץ-תאית היא מווסת חשוב של תפקוד התא. רמזים סביבתיים הקיימים במיקרו-סביבה התאית, כגון התפלגות ליגנד וגיאומטריה של רקמות, הוכחו יותר ויותר כממלאים תפקידים קריטיים בשליטה על הפנוטיפ וההתנהגות של התא. עם זאת, רמזים סביבתיים אלה והשפעתם על תאים נחקרים לעתים קרובות בנפרד באמצעות פלטפורמות in vitro המבודדות רמזים בודדים, אסטרטגיה המפשטת בכבדות את המצב המורכב in vivo של רמזים מרובים. גישות הנדסיות יכולות להיות שימושיות במיוחד כדי לגשר על פער זה, על ידי פיתוח מערכי ניסוי הלוכדים את המורכבות של המיקרו-סביבה in vivo , אך שומרים על מידת הדיוק והמניפולציה של מערכות in vitro .
מחקר זה מדגיש גישה המשלבת דפוסים של חלבונים אולטרה סגולים (UV) ומיקרו-פבריקציה של מצעים מבוססי ליתוגרפיה, אשר יחדיו מאפשרים חקירה בתפוקה גבוהה של התנהגויות תאים בסביבות מרובות-חתכים. באמצעות צילום UV ללא מסיכה, ניתן ליצור התפלגויות חלבונים מורכבות ודבקות על מצעי תרביות תאים תלת-ממדיים (תלת-ממדיים) על שבבים המכילים מגוון רמזים גיאומטריים מוגדרים היטב. ניתן להשתמש בטכניקה המוצעת עבור מצעי תרבית העשויים מחומרים פולימריים שונים ובשילוב עם אזורים בתבנית דבק של מגוון רחב של חלבונים. עם גישה זו, תאים בודדים, כמו גם monolayers, יכולים להיות כפופים לשילובים של רמזים גיאומטריים ורמזי הנחיית מגע המוצגים על ידי מצעים דפוס. מחקר שיטתי תוך שימוש בשילובים של חומרי שבבים, תבניות חלבונים וסוגי תאים יכול אפוא לספק תובנות בסיסיות על תגובות תאיות לסביבות רב-תכליתיות.
Introduction
In vivo, תאים נתונים למגוון רחב של רמזים סביבתיים שיכולים להיות בעלי אופי מכני, פיזיקלי וביוכימי שמקורם במטריצה החוץ-תאית (ECM). רמזים סביבתיים רבים זוהו כממלאים תפקידים חיוניים בוויסות התנהגות התאים, כגון התפשטות, התמיינות והגירה 1,2,3,4,5. אחת התופעות הנחקרות ביותר היא הנחיית מגע, המתארת יישור תאים בתיווך הידבקות לאורך תבניות ביוכימיות או טופוגרפיות אניזוטרופיות הנמצאות על המצע החוץ-תאי 6,7,8,9,10,11. מעבר להכוונת יישור התאים, הוכח כי רמזים להנחיית מגע משפיעים גם על תכונות אחרות של תאים כגון נדידת תאים, ארגון חלבונים תוך-תאיים, צורת התא וגורל התא 12,13,14,15. בנוסף, הארכיטקטורה הגיאומטרית של הסביבה התאית התלת-ממדית זכתה להכרה גם בהשפעתה הרגולטורית על התנהגותהתאים 16,17. בגוף האדם, התאים נחשפים למגוון של גיאומטריות מעוקלות, החל מסיבי קולגן בקנה מידה זעיר, נימים וגלומרולי, ועד לדלקות מזוקליות ועורקים18,19. באופן מעניין, מחקרים במבחנה שנערכו לאחרונה הראו שתאים יכולים לחוש ולהגיב לרמזים פיזיקליים כאלה, מהננו-זירה ועד ל-20,21,22,23.
עד כה, רוב המחקרים שחקרו את תגובת התאים לרמזים סביבתיים בוצעו ברובם באמצעות מערכי ניסוי המבודדים רמזים בודדים. בעוד שגישה זו אפשרה התקדמות אדירה בהבנת המנגנונים הבסיסיים העומדים מאחורי החישה התאית של רמזים סביבתיים, היא משחזרת בצורה גרועה את סביבת in vivo המציגה בו זמנית רמזים מרובים. כדי לגשר על הפער הזה, כדאי לפתח פלטפורמות תרבות שבמסגרתן ניתן לשלוט ברמזים סביבתיים מרובים באופן עצמאי ובו-זמני. תפיסה זו צברה אחיזה גוברת לאחרונה24,25, עם מחקרים המשלבים נוקשות מטריצה וצפיפות ליגנד 26,27,28,29, נוקשות מצע ונקבוביות 30, נוקשות המצע ונפח מיקרוניש תלת-ממדי31, טופוגרפיית פני השטח ורמזי הנחיית מגע 32,33,34 ורמזי הנחיית מגע בקנה מידה ננומטרי עם רמזי הנחיית עקמומיות מזוקליים23., עם זאת, עדיין מאתגר לשלב רמזים להנחיית מגע עם מגוון גיאומטריות תלת-ממדיות באופן מבוקר ותפוקה גבוהה.
פרוטוקול מחקר זה נותן מענה לאתגר זה ומציג שיטה ליצירת מצעי תרביות תאים עם שילוב מבוקר של אזורי דבק בתבנית של חלבוני ECM (רמזים להנחיית מגע) ועקמומיות המצע (רמזים גיאומטריים). גישה זו מאפשרת לנתח את תגובת התאים בסביבה רב-תכליתית ביומימטית באופן שיטתי ובעל תפוקה גבוהה. הידע הנרכש יכול לסייע בהבנה נוספת של התנהגות התאים בסביבות מורכבות וניתן להשתמש בו כדי לתכנן חומרים מאלפים עם תכונות המנווטות את תגובות התאים לתוצאה הרצויה.
פוטו-פטרינג של חלבון תלת-ממדי
יצירת אזורי דבק של חלבוני ECM (רמזים להנחיית מגע) על חומרי תרבית תאים יכולה להתבצע באמצעות מגוון טכניקות, לדוגמה, על ידי דפוס אולטרה סגול עמוק (DEEP-UV) או הדפסה מיקרו-קונקרטית35,36. דפוס UV עמוק עושה שימוש באור UV המוקרן דרך מסכה על חומר פולימרי כדי לפרק פולימרים של פסיבציה במיקומים ספציפיים על מצע תרבית התאים. המצע המעוצב מודגר לאחר מכן עם ליגנד של עניין, וכתוצאה מכך נוצרים אזורי דבק התומכים בהתקשרות תאים ובתרבית במקומות מוגדרים מראש 12,37,38. דרך חלופית להחדרת תבניות חלבונים היא באמצעות הדפסה מיקרו-קונטיקט, שבה חותמות אלסטומריות המכילות צורה רצויה מצופים בחלבון מועדף ונלחצים על מצע תרבית תאים, ובכך מעבירים את ציפוי החלבון שאליו תאים יכולים להיצמד ל-35,37,39,40 . למרבה הצער, מכיוון ששתי הטכניקות מסתמכות על הכנת מסכות ושיטות ליתוגרפיה רכות, הניסויים גוזלים זמן רב ועתירי עבודה, כמו גם מוגבלים מבחינת גמישות התבנית. בנוסף, הן דפוס UV עמוק והן הדפסה מיקרו-קונטיקט מתאימים ביותר לחומרים מישוריים והם קשים מבחינה טכנית, אם לא בלתי אפשריים, לדפוס ליגנדות בסביבה תלת-ממדית.
כדי לשפר את השיטות הקונבנציונליות הללו, Waterkotte et al. שילבו ליתוגרפיה ללא מסיכה, תצהיר אדים כימיים ותרמופורמינג כדי ליצור מצעים פולימריים תלת-ממדיים מיקרו-פטרייתיים41. עם זאת, טכניקה זו מסתמכת על שימוש ביריעות פולימריות הניתנות לתרמופורמציה ומציעה רזולוציה נמוכה של תבנית חלבונים (7.5 מיקרומטר), בעוד שדווח כי תאים מגיבים לתבניות חלבונים גיאומטריות הקטנות עד 0.1 מיקרומטר 2,42. Sevcik et al. תיארו שיטה מבטיחה נוספת לננו-ליגנדות ECM על מצעים המכילים טופוגרפיות של ננו ומיקרומטר43. באמצעות הדפסה מיקרו-קונטקונטקטית, חלבוני ECM הועברו מבולי פולידימתילסילוקסן (PDMS) למצע פולי-רספונסיבי תרמו-רספונסיבי (N-איזופרופילאקרילאמיד) (pNIPAM). לאחר מכן, התכונה התרמו-תגובתית של רשת pNIPAM אפשרה להם להעביר את תבנית החלבון הדו-ממדית (2D) למצע PDMS טופוגרפי (חריצים בעומק 10-100 מיקרומטר), ובכך לשלוט בלוקליזציה של אתרי הידבקות בתכונות טופוגרפיות. עם זאת, לא ניתן לעצב את כל המיקרוטופוגרפיות האפשריות מכיוון שבעיות רטיבות מופחתות מקשות על דפוס מצעים טופוגרפיים עמוקים יותר. דווח כי תעלות עם יחס רוחב-רוחב של עומק לרוחב של 2.4 הן הגבול האולטימטיבי להעברת התבנית בהצלחה למצע הטופוגרפי43. בנוסף, הגמישות של דפוסים משתנים והרזולוציה של התבניות שנוצרו ירודה בשל הדרישה להדפסה מיקרו-קונטקונטקט.
מאמר זה מתאר שיטה המתגברת על צווארי הבקבוק שהוזכרו לעיל ומציעה שיטה גמישה ותפוקה גבוהה ליצירת מצעים מרובי רמזים שיכולים לשמש לתרבית תאים (ראו איור 1). גיאומטריות רלוונטיות מבחינה פיזיולוגית (צילינדרים, כיפות, אליפסות ומשטחי אוכף) עם עקמומיות הנעה בין ĸ = 1/2500 ל- ĸ = 1/125 μm-1 מתוכננות מראש ומיקרו-פבריקט בשבבי PDMS. לאחר מכן, רמזים להנחיית מגע נוצרים על גבי הגיאומטריות התלת-ממדיות באמצעות מגוון עיצובי תבניות דיגיטליות על ידי שימוש בטכניקת פוטו-פטרינג עם רזולוציה של עד 1.5 מיקרומטר44. לשם כך, שבבי PDMS עוברים בתחילה פסיביזציה כדי למנוע מתאים וחלבונים להידבק; לאחר מכן ניתן להסיר את שכבת הפסיביזציה הזו על ידי שילוב של פוטו-יניטיטור 4-בנזואילבנזיל-טרימתילמוניום כלוריד (PLPP) וחשיפה לאור UV45. מסכה דיגיטלית נועדה לציין את מיקומי החשיפה לקרינת UV, וכך גם את האזור שבו מסירים את שכבת הפסיביציה. חלבונים יכולים להיצמד לאחר מכן לאזורים אלה, מה שמאפשר חיבור תאים. מכיוון שהדפוסים מבוצעים באמצעות מסכה דיגיטלית (ולא פיזית), ניתן ליצור במהירות מגוון דוגמאות ללא הטרחה והעלות הכרוכות בעיצוב וייצור מסכות צילום נוספות. בנוסף, ניתן לעצב על המצע מגוון רחב של חלבוני ECM (למשל, קולגן מסוג I, ג'לטין ופיברונקטין). למרות שפרוטוקול זה מבוצע באמצעות שבבי תרבית תאים העשויים מ- PDMS, ניתן להחיל את העיקרון על כל חומר אחר בעל עניין46.
Protocol
במחקרים המתוארים בפרוטוקול זה נעשה שימוש בקרטוציטים אנושיים ראשוניים. מחקר זה בוצע בהתאם לעקרונות הצהרת הלסינקי. קרטוציטים ראשוניים בודדו משאריות של רקמות קרנית-רקמות קדבריות אנושיות מניתוחי קרטופלסטיה של ממברנת Descemet, אשר התקבלו ממחלקת הקרנית של המרכז הרב-רקמתי ETB-BISLIFE (Beverwijk, הולנד) לאחר שקיבלו הסכמה מקרב קרובי משפחה של כל התורמים שנפטרו.
הערה: עיין בטבלת החומרים לקבלת פרטים על כל החומרים, הריאגנטים, הציוד והתוכנות המשמשים בפרוטוקול זה.
1. ייצור מצעי תרביות תאים תלת-ממדיות
- צור תבנית זכוכית שלילית (#1) המכילה את כל התכונות המעניינות, במקרה זה, העשויה מזכוכית באמצעות טכניקת כתיבה ישירה של femtosecond-laser (ראו איור 2).
- בזהירות מניחים את תבנית הזכוכית השלילית (#1) בתחתית צלחת פטרי.
- הכינו פרפולימר PDMS על ידי הצבת צינור חרוטי ריק של 50 מ"ל על סולם, טארסו את קנה המידה ושפכו את הכמות הרצויה של בסיס אלסטומר סיליקון לתוך הצינור.
- הוסף סוכן ריפוי באמצעות פיפט פסטר כך שהיחס הסופי בין בסיס אלסטומר לסוכן הריפוי הוא 10:1 (w/w).
- ערבבו היטב את הרכיבים בצינור החרוטי באמצעות מרית.
- צנטריפוגה ב 2,000 × גרם במשך 70 שניות כדי להסיר את כל בועות האוויר.
- יוצקים את הפרפולימר PDMS על גבי תבנית הזכוכית השלילית (#1) בצלחת פטרי כדי לכסות אותה לחלוטין.
- מניחים את צלחת הפטרי עם תבנית הזכוכית השלילית (#1) ואת הפר-פולימר PDMS במפענח הוואקום ומפעילים את משאבת הוואקום. ברגע שמגיעים לוואקום, המתן 5 דקות כדי להסיר את כל הבועות הקיימות בממשק שבין משטח התבנית לבין הפרפולימר PDMS.
- מוציאים את הוואקום ומוציאים את צלחת הפטרי מהמייבש.
- יש לרפא את הפרפולימר PDMS למשך הלילה בתנור בטמפרטורה של 65 מעלות צלזיוס.
- הסר בזהירות את שבב ה- PDMS החיובי החדש (#2) מתבנית הזכוכית השלילית (#1) על ידי הרמת הקצוות של ה- PDMS באמצעות מרית. אם שבב ה-PDMS החיובי (#2) נוטה להיצמד לתבנית הזכוכית השלילית (#1), הוסיפו אתנול או מים לשולי החותם בזמן ההרמה.
הערה: הנוזל יפעל בין שתי השכבות ויקל על ההפרדה בין תבנית הזכוכית השלילית (#1) לבין שבב ה-PDMS החיובי (#2). - באמצעות להב, חתכו את הצדדים של שבב ה-PDMS החיובי (#2) כך שיישאר שבב מלבני.
- מניחים את שבב ה-PDMS החיובי (#2) במייבש ייבוש ליד בקבוקון קטן עם טיפה של טרידקפלואורו(1,1,2,2,2-טטרהידרוקטיל)טריכלורוסילן, חומר סילאניזציה, ויוצאים תחת ואקום למשך הלילה.
הערה: סילוניזציה תוודא שהחותם לא ייקשר לשכבות PDMS אחרות בהמשך הפרוטוקול. סוכני סילואניזציה אחרים ו/או שיטות עשויים גם הם לפעול כדי להבטיח שהמשטחים של שבבי ה-PDMS לא יידבקו לשכבות PDMS אחרות.
אזהרה: Tridecafluoro(1,1,2,2-tetrahydrooctyl)trichlorosilane הוא דליק (H226) וגורם לכוויות עור קשות ולפגיעה בעיניים (H314). לבשו ציוד מגן אישי, עבדו במכסה אדים ושטפו ידיים ביסודיות לאחר הטיפול. הרחיקו את חומר הסילאניזציה מחום, משטחים חמים, ניצוצות, להבות פתוחות ומקורות הצתה אחרים. אחסן בין 15 ל-30 מעלות צלזיוס (P280, P210, P240, P403, P235, P310). - הסר את השואב והנח את שבב ה-PDMS החיובי (#2) בתחתית צלחת פטרי. יש לשפוך את הפר-פולימר PDMS (10:1) למעלה כדי לייצר מספר תבניות PDMS שליליות (#3).
- שים את צלחת הפטרי תחת ואקום במייבש למשך 15 דקות כדי להסיר את כל הבועות.
- יש לרפא את הפרפולימר של PDMS בטמפרטורה של 65 מעלות צלזיוס במהלך הלילה, ולאחר מכן ניתן לקלף את תבנית ה-PDMS השלילית (#3) משבב ה-PDMS החיובי (#2) באמצעות מרית.
- צללו את תבנית ה-PDMS השלילית הסופית (#3) באמצעות סוכן סילאניזציה במייבש ואקום למשך הלילה.
- הפק שבבי תרבית תאים מרובים (#4, ראו איור 2) בעובי של כ-5 מ"מ על-ידי שפיכת פרפולימר PDMS בתבנית PDMS השלילית (#3), הסרת בועות באמצעות המייבש וריפוי למשך 3 שעות בטמפרטורה של 65 מעלות צלזיוס. בעזרת סכין גילוח, חתכו את השבב לגודל הסופי כפי שניתן לראות באיור 2. אחסנו את השבבים בטמפרטורת החדר.
הערה: חספוס פני השטח עשוי להשפיע על התגובה התאית. במידת הצורך, שכבה דקה נוספת של PDMS יכולה לשמש כציפוי על שבב PDMS חיובי (#2) כדי להחליק את פני השטח. כדי לעשות זאת, לשפוך טיפה קטנה של PREPOLYMER PDMS על השבב ולפזר אותו על השבב השלם באמצעות אוויר בלחץ. לרפא את השבב המצופה ב-65 מעלות צלזיוס למשך 3 שעות ולהמשיך עם שלב 1.12.
2. ייצור דגימות PDMS שטוחות (דגימות בקרה)
- הכן פרפולימר PDMS (10:1) בהתאם לשלבים 1.3-1.6.
- הניחו כיסוי זכוכית על עמוד הוואקום המעוגל במרכז מעיל הספין.
- הפעילו את השואב כדי לחבר את מכסה הזכוכית למכונה והזרימו טיפה של PDMS באמצע הכיסוי באמצעות פיפטת פסטר.
- פזרו את הפרפולימר PDMS מעל מצע הזכוכית באמצעות הפרוטוקול הבא כדי לקבל שכבה בעובי של כ-10 מיקרומטר.
- מעיל ספינים ל-10 שניות ב-0.45 × גרם, תאוצה: 0.2 × גרם לשנייה.
- מעיל ספינים ל-50 שניות ב-44.8 × גרם, תאוצה: 0.54 × גרם לשנייה.
- כבו את השואב, הסירו את הכיסוי ממעיל הספין באמצעות פינצטה, והניחו אותו בצלחת פטרי. יש לרפא את ה-PDMS למשך הלילה בתנור בטמפרטורה של 65 מעלות צלזיוס ולאחסן בטמפרטורת החדר לאחר מכן.
3. פסיבציה מצעית של מצעי תרבית תאים תלת-ממדית
- הפעל את קבוצות ההידרוקסיל על פני השטח של שבב PDMS (#4) באמצעות O2-plasma. באמצעות פינצטה, מניחים את השבב בסל של הפלזמה אשר.
- הפעל מחזור אפר באמצעות הספק של 20 W במשך 30 שניות. פתח את תא האפר באמצעות N2.
- הוציאו את השבב מהסל והניחו אותו במיכל PDMS קטן (ראו איור 1).
- באמצעות צינור פסטר, הוסף 500 μL של פולי-L-ליזין (PLL, 0.01%) על החלק העליון של השבב, כך שהמשטח השלם שקוע בתמיסת PLL. דגירה למשך 30 דקות בטמפרטורת החדר.
- הסר 450 μL של ה-PLL משבב תרבית התאים באמצעות פיפטה ושטפו את משטח השבב שלוש פעמים עם 500 μL של 0.1 M HEPES buffer (8 < pH < 8.5). השאירו תמיד נפח קטן של נוזל על שבב ה-PDMS כדי למנוע ייבוש מהדגימה, מה שיפחית את איכות התבנית הסופית.
- הכינו 500 μL של מתוקסיפוליאתילן גליקול-סוקינימידיל ולרט של 50 מ"ג/מ"ל (mPEG-SVA; MW 5,000 Da) תמיסה ב-0.1 M HEPES buffer (8 <-pH < 8.5) לכל שבב תרבית תאים ונותנים לו לדגום על הדגימה במשך 60 דקות. מכיוון של- mPEG-SVA יש זמן מחצית חיים של 15 דקות, הקפד להכין את הכמות הנדרשת ממש לפני השימוש.
הערה: mPEG-SVA מתמוסס כאשר הפתרון שקוף לחלוטין. - הסר 450 μL של תמיסת mPEG-SVA באמצעות מיקרו-פיפט, ושטפו את משטח השבב חמש פעמים עם מלח בעל מאגר פוספט (PBS). הקפידו לטפטף למעלה ולמטה מספר פעמים בכל שטיפה כדי להבטיח שכל ה-mPEG-SVA הלא מאוגד יוסר. כדי למנוע את התייבשות הדגימה, צמצמו את הזמן שבין שלבי הכביסה והקפידו להשתמש בעודף (500 μL או יותר) של PBS לכביסה.
- אחסן את הדגימות על-ידי טבילתן ב- PBS או המשך לשלב ההדפסה של הפרוטוקול.
הערה: אם תרצה, ניתן לבצע פסיביזציה בתנאים סטריליים בעת עבודה בארון תרבית ועבודה עם פתרונות וציוד סטריליים.
4. אחסון מצעי תרביות תאים מעוצבים
הערה: ניתן לאחסן מצעי תרביות תאים תלת-ממדיים במהלך שלבים שונים בתהליך.
- אחסנו שבבי תרבית תאי PDMS שנרפאו בתנאים יבשים בטמפרטורת החדר.
- אחסן את שבבי תרביות התאים המפוסיבים באחת משתי הדרכים הבאות:
- יש לאחסן ב-PBS בטמפרטורה של 4 מעלות צלזיוס למשך עד 7 ימים.
- יש לאחסן בתנאים יבשים עד מספר חודשים. לקבלת דגימות יבשות, יש להסיר את ה-PBS ולשטוף מספר פעמים באמצעות מים מזוקקים כפולים (ddH2O). מתייבשים באמצעות אקדח חנקן או אוויר.
5. עיצוב מסכות דיגיטליות המשמשות לצילום תמונות
הערה: ניתן לבצע דפוס של מצעים תלת-ממדיים באמצעות מישורי מוקד יחידים או מרובים (ראו איור 3). ניתן להשתמש במישור מוקד יחיד על תכונות שאינן גדולות יותר מהתקן מראה דיגיטלי אחד (DMD, כ-300 מיקרומטר x 500 מיקרומטר) ושאינן גבוהות מדי (50-100 מיקרומטר). במקרה כזה, עצב תבנית דיגיטלית באמצעות מצב TIFF. עבור תכונות החורגות מהממדים של דושן אחד והן גבוהות יחסית, חלקו את התבנית של המצע למספר שלבים. במקרה זה, תבניות מרובות מתוכננות באמצעות מצב PDF שכולם מתמקדים בנפרד במישורי מוקד בודדים.
- עצבו מסכה דיגיטלית באמצעות כלי תוכנה לעיצוב.
- תבנית במצב TIFF (פיקסלים): צור משטח יצירה שחור לחלוטין של 1,140 x 1,824 פיקסלים (הגודל המדויק של 1 DMD, כ- 300 μm x 500 μm) ומלא את משטח היצירה בצורות המעניינות. ייצא את משטח היצירה כקובץ TIFF של 8 סיביות.
הערה: רמות אפורות שונות בעיצוב התבנית קובעות את כמות החשיפה שתבוצע במיקום זה. - תבנית במצב PDF (יחידות מטריות): צרו משטח קשיח שחור בגודל הרצוי במ"מ ומלאו את משטח היצירה בכל צורה מעניינת. חלק את התבנית לקבצים מרובים אם יש צורך לעצב את המצע התלת-ממדי באמצעות מישורי מוקד מרובים. שמור את משטח העורקים כקובץ PDF.
הערה: רמות אפורות שונות בעיצוב התבנית קובעות את כמות החשיפה שתבוצע במיקום זה.
- תבנית במצב TIFF (פיקסלים): צור משטח יצירה שחור לחלוטין של 1,140 x 1,824 פיקסלים (הגודל המדויק של 1 DMD, כ- 300 μm x 500 μm) ומלא את משטח היצירה בצורות המעניינות. ייצא את משטח היצירה כקובץ TIFF של 8 סיביות.
6. צילום UV של מצעי תרבית תאים תלת-ממדיים
- כיול
הערה: כיול הלייזר נעשה כדי לקבל מיקוד נכון בחומר המעניין. מאחר שמצעי תרביות התאים של PDMS עבים מכדי שניתן יהיה לדרוס אותם, השתמשו בשקופית זכוכית שעליה מונח השבב הפוך. מכיוון שהלייזר נתקל תחילה במגלשת הזכוכית, השתמשו בזכוכית כדי לכייל את הלייזר.- יש למרוח סימון פלואורסצנטי על מכסה זכוכית ולהניח את כיסוי הזכוכית בשלב של המיקרוסקופ הפלואורסצנטי. ודא שהמשטח המודגש פונה כלפי מעלה.
- הפעילו את המיקרוסקופ ואת ציוד ה-PRIMO ופתחו את המיקרו-מנג'ר כדי לגשת לתוכנת לאונרדו תחת 'תוספים'.
- בחר כיול בתפריט הראשוני, ולאחר מכן בחר את המטרה 20x הן במיקרוסקופ והן בתוכנה. לחץ על הבא.
- מקם את שקופית הזכוכית עם סימון פלואורסצנטי בנתיב האופטי של המיקרוסקופ. עברו למצב פלואורסצנט והתמקדו בזהירות בתמונת PRIMO שמופיעה, וודאו שגם הלוגו וגם הטקסט נמצאים בפוקוס. לחץ על הבא כדי לסיים את הליך הכיול.
- רשום את מיקום ה- Z של השלב בעת הכיול והשתמש במיקום זה כהפניה בהמשך הפרוטוקול.
הערה: חומר הכיול צריך להתאים לחומר המשמש לדפוס בהמשך הפרוטוקול. השלבים הנ"ל מתארים את הכיול הדרוש למצעי תרביות התאים. לכיול דגימות בקרת PDMS שטוחות, יש למרוח סימון פלואורסצנטי על גבי דגימת PDMS שטוחה נוספת ולכייל באמצעות שלבים 6.1.2-6.1.5.
- תבנית תכונות תלת-ממדיות באמצעות מישור מוקד יחיד
הערה: דפוס באמצעות מישור מוקד יחיד נעשה בתכונות תלת-ממדיות שאינן עולות על הממדים של דושן אחד (כ-300 מיקרומטר x 500 מיקרומטר). סכמטיות של מערך מישור המוקד מתוארת באיור 3.- הסר את שקופית הכיול מהבמה והנח שקופית זכוכית המכילה טיפה (~ 50 μL) של פוטוסיניטיטור (PLPP) בשלב.
אזהרה: PLPP מגרה את העיניים, את מערכת הנשימה ואת העור (R36-38). ללבוש ציוד מגן אישי, להרחיק אותו מחומרים נפיצים, לעולם לא להוסיף מים למוצר זה, לנקוט אמצעי זהירות מפני הפרשות סטטיות, ולמנוע הלם וחיכוך (S26-36). - מקם את מצע תרבית התאים PDMS הפוך בטיפה של פוטו-יניטיטור. ודא שתכונות התלת-ממד על פני השטח של מצע תרבית התאים פונות לשקופית הזכוכית ושוקעות במלואן ב- PLPP כדי להבטיח דפוס תקין.
- בחר תבנית בתוכנה.
- עברו למצב שדה בהיר במיקרוסקופ והזיזו את הבמה לתכונת העניין.
- התמקדו בחלק העליון או התחתון של מבנים קמורים וקעורים בהתאמה (איור 3).
- בחר PRIMO כדי להוסיף תבנית בחירה. שימו לב לתצוגה המקדימה של התבנית בכתום על גבי תמונת השדה הבהיר החי.
- התאם את הגדרות התבנית בהתאם לתכונה (מיקום, זווית, חזרות) ובחר מנה של 1,000 mJ/mm2.
- לחץ על נעל והעבר את המיקרוסקופ למצב פלואורסצנטי .
- לחץ על לחצן הפעל בתחתית הימנית של המסך כדי להתחיל את התבנית. לאחר שתסיים, התבונן בתבנית המוצגת בירוק.
- לאחר שתסיים עם כל התכונות על שבב תרבית תאים, הסר את השבב משקופית התבנית ואחסן ב- PBS בטמפרטורה של 4 °C (76 °F).
- הסר את שקופית הכיול מהבמה והנח שקופית זכוכית המכילה טיפה (~ 50 μL) של פוטוסיניטיטור (PLPP) בשלב.
- תבניות של תכונות תלת-ממדיות באמצעות מישורי מוקד מרובים
הערה: דפוס באמצעות מישורי מוקד מרובים נעשה בתכונות תלת-ממדיות הגדולות יותר מ-DMD אחד (כ-300 מיקרומטר x 500 מיקרומטר) או שהן גבוהות יחסית. במקרה זה, התכונות התלת-ממדיות צריכות להיות מעוצבות במספר שלבים, כלומר, יש להתאים את עיצוב התבנית לפי הדוגמה באיור 3.- הסר את שקופית הכיול מהבמה והנח שקופית זכוכית המכילה טיפה (~ 50 μL) של פוטוסיניטיטור (PLPP) בשלב.
- מקם את שבב תרבית התאים PDMS הפוך בטיפה של פוטו-יניטיטור באמצעות פינצטה.
- בחר תבנית בתוכנה. עברו למצב שדה בהיר במיקרוסקופ והזיזו את הבמה לתכונת העניין.
- התמקדו באזור השבב במיקום הנכון. מאחר שהדפוסים מבוצעים במישור מוקד יחיד והתכונות גדולות יותר מ-DMD יחיד, השתמשו במישורי מוקד מרובים ולפיכך בסיבובים מרובים של דוגמה לכל מצע תלת-ממדי כדי להבטיח רזולוציית תבנית מספקת לאורך הגובה והרוחב המלאים של התכונה (ראו איור 3). לדוגמה, עבור תכונה עם גובה של 150 מיקרומטר, עצבו את התכונה בשלושה סיבובים (± 1 מישור מוקד לכל 50 מיקרומטר של Z-travel), תוך התמקדות סביב 25 מיקרומטר, 75 מיקרומטר ו-125 מיקרומטר מתחתית התכונה. ודא שהחלק התחתון של התכונה הוא סביב הערך הרשום למטה בשלב 6.1.5.
- בחר PRIMO כדי להוסיף את תבנית הבחירה. שימו לב לתצוגה המקדימה של התבנית המוצגת בכתום על גבי תמונת השדה הבהיר החי.
- התאם את הגדרות התבנית בהתאם לתכונה (מיקום, זווית) ובחר מנה של 1,000 mJ/mm2.
- לחץ על נעל והעבר את המיקרוסקופ למצב פלואורסצנטי .
- לחץ על לחצן הפעל בתחתית הימנית של המסך כדי להתחיל את התבנית. לאחר שתסיים, התבונן בתבנית המוצגת בירוק.
- חזור על שלבים 6.3.4-6.3.8 בתכונת העניין כאשר נעשה שימוש במישורי מוקד מרובים.
- לאחר שתסיים עם כל התכונות על שבב תרבית תאים, הסר את השבב משקופית התבנית ואחסן אותו ב- PBS ב- 4 °C (7 °F).
הערה: אם תרצה, יש למרוח את ה-UV-photopatterning בתנאים סטריליים, תוך שימוש בצלחות פטרי עם תחתית זכוכית ולהכין את כל המצעים בארונות תרבית סטריליים. אחסן את הדגימות המעוצבות ב- PBS למשך עד שבועיים. כאשר נשטפים עם ddH2O ומיובשים באמצעות אוויר בלחץ, ניתן לאחסן דגימות עד מספר חודשים בטמפרטורה של 4 מעלות צלזיוס.
7. דגירה של חלבונים
הערה: מומלץ להשתמש במצעים דגירה טריים של חלבון עבור תרבית תאים. המשך לחלק זה של הפרוטוקול רק אם זריעת התא (שלב 8) נעשית מיד לאחר מכן.
- העבר את שבב תרבית התאים המעוצב למיכלי PDMS סטריליים בארון התרבית.
- לשטוף את שבבי תרבית התאים המעוצבים פי 3 עם עודף של PBS סטרילי אם התבנית לא בוצעה בתנאים סטריליים.
- הכינו תמיסת חלבון טרייה ב-PBS.
- פיברונקטין: הוסיפו 2 מ"ל של PBS באמצעות מיקרופיפט לבקבוקון של 20 מיקרוגרם של פיברונקטין עם תווית רודמין כדי להשיג ריכוז של 10 מיקרוגרם/מ"ל. פיפט בעדינות כדי למנוע היווצרות של גושי חלבון ולהגן מפני אור.
- ג'לטין: להפשיר 200 μL aliquot של ג'לטין מומס-פלואורסצין. הגן מפני אור.
- הוסף 200-500 μL של תמיסת החלבון לשבב תרבית התא באמצעות מיקרופיפט. התאימו את זמן הדגירה והטמפרטורה בהתאם לחלבון המועדף: פיברונקטין: 5 דקות בטמפרטורת החדר, ג'לטין: 15 דקות ב-37 מעלות צלזיוס. הקפידו לכסות את הדגימה (למשל, בנייר אלומיניום).
- הסר את תמיסת החלבון ושטף פי 5 עם 500 μL של PBS סטרילי. הקפידו לטפטף את ה-PBS למעלה ולמטה מספר פעמים מעל כל התכונות הרלוונטיות של שבב תרבית התאים כדי להסיר כל חלבון לא מאוגד.
הערה: במהלך שלבי הכביסה, חיוני שהדגימה לעולם לא תתייבש. בעת הסרת תמיסת החלבון או ה-PBS במהלך השינה, הוסיפו מיד PBS חדש כדי למנוע היווצרות של גושים חלבוניים (ראו איור 4). תכונות קמורות רגישות במיוחד לייבוש מכיוון שהן מוגבהות מעל פני השטח של המצע. - אופציונלי: לסקור את תבניות החלבונים תחת מיקרוסקופ פלואורסצנטי. שמור על הדגימות סטריליות וטבולות ב- PBS.
8. זריעת תאים
הערה: פרוטוקול זה משתמש בקרטוציטים ראשוניים אנושיים ובפיברובלסטים עוריים אנושיים. הקרטוציטים נקטפו מרקמת הקרנית האנושית מחולים, בהתאם להנחיות ההולנדיות לשימוש משני בחומרים, ואופיינו בעבר כקרטוציטים47. תאים אלה מתורבתים ב-DMEM בתוספת 5% סרום בקר עוברי (FBS), 1% פניצילין/סטרפטומיצין (P/S), וחומצה 1 mM L-אסקורבית 2-פוספט sesquimagnesium מלח הידרט (ויטמין C) ב-37 °C לכל היותר לארבעה מעברים. פיברובלסטים עוריים אנושיים נרכשו ותרבית ב-DMEM בתוספת 10% FBS ו-1% P/S ב-37 מעלות צלזיוס למשך 15 מעברים לכל היותר. לזריעה של קרטוציטים ופיברובלסטים עוריים על שבב תרבית התאים הפוטו-פטרייתי, נעשה שימוש ב-20,000 תאים לכל שבב.
- נתקו את התאים המעניינים (למשל, באמצעות טריפסין) והכינו 1 מ"ל של תרחיף תא של ± 10,000-50,000 תאים/מ"ל במדיום תרבית לכל שבב. התאם את המספר המדויק של התאים שנוספו לכל מצע בהתאם לגודל התא ולקריאה הרצויה.
- הסר את ה- PBS משבב תרבית התא והוסף 1 מ"ל של תרחיף התא.
- העבירו בעדינות את שבב תרבית התאים עם התאים לאינקובטור והדגמו במשך 60 דקות בטמפרטורה של 37 מעלות צלזיוס.
- בדוק את ההדבקה של התאים בשבב תרבית התאים המעוצב תחת מיקרוסקופ שדה בהיר. חפשו מורפולוגיות של תאים מוארכים במקרה של תבניות קו (ראו איור 5). אם התאים התחילו להידבק גם מחוץ לאזור התבניתי, הסירו אותם על ידי צנרת של מדיום למעלה ולמטה ישירות מעל התאים שעל המצע.
הערה: תאים המחוברים לאזור המעוצב יישארו מחוברים, בעוד שתאים מחוץ לאזורים המעוצבים יתנתקו. - הסר את שבב תרבית התאים ממיכל PDMS והשתמש בפינצטה סטרילית כדי לשים אותו בצלחת של 6 בארות מלאה בכ-5 מ"ל של מדיום תרבית.
- תרבית את התאים למשך הזמן הרצוי. החלף את מדיום תרביות התאים כל 2-3 ימים. כדי להבטיח הדמיה של תבנית החלבון לאחר תרבית התא, הפחיתו את כמות החשיפה של הדגימה לאור במהלך התרבית.
9. צביעה, רכישת תמונה וניתוח
- קיבוע וכתמים
- לאחר אורך התרבות הרצוי, להסיר כמעט את כל המדיום ולשטוף שלוש פעמים עם עודף PBS. לאחר מכן, דגירה עם 3.7% פורמלין למשך 15 דקות בטמפרטורת החדר ואחריה שלושה שלבי כביסה עם PBS במשך 5 דקות לכל שטיפה בטמפרטורת החדר. לעולם אל תתנו לדגימה להתייבש.
אזהרה: פורמלין מזיק אם הוא נבלע או אם הוא נשאף (H302, H332), עלול לגרום לתגובת עור אלרגית (H317), חשוד בגרימת פגמים גנטיים (H341), ועלול לגרום לסרטן (H350). לבשו ציוד מגן אישי ועבדו במכסה אדים. - הכתימו את מצע תרבית התאים בחומרי ההכתמה או הנוגדנים הרצויים. כדי להקטין את הנפחים של חומרי הכתם, הניחו את שבבי תרבית התאים במהופך בתוך טיפה של תמיסת צביעה המודבקת על מגלשת זכוכית.
- אחסן את הדגימות ב- PBS (לטווח קצר) או מחוברות לכיסוי באמצעות הרכבה בינונית (לטווח ארוך) ב- 4 °C (74 °C).
- לאחר אורך התרבות הרצוי, להסיר כמעט את כל המדיום ולשטוף שלוש פעמים עם עודף PBS. לאחר מכן, דגירה עם 3.7% פורמלין למשך 15 דקות בטמפרטורת החדר ואחריה שלושה שלבי כביסה עם PBS במשך 5 דקות לכל שטיפה בטמפרטורת החדר. לעולם אל תתנו לדגימה להתייבש.
- רכישת תמונה
- הניחו את הדגימה המוכתמת במהופך בטיפה של PBS על מגלשת זכוכית. שים את הדגימה בשלב של מיקרוסקופ קונפוקלי.
- בהתאם לרמת הפירוט הנדרשת, צור ערימות Z עם מטרה מתאימה (10x, 20x או 40x) ומרווח Z כדי להבטיח רכישת תמונה נכונה.
- ניתוח תמונות והדמיה חזותית
- פתח את קבצי התמונה הגולמיים בתוכנת ניתוח תמונות ובדוק שמאפייני התמונה (לדוגמה, מידות, רזולוציה) נכונים.
- התאם את הבהירות והניגודיות לכל ערוץ במידת הצורך.
- חתכו את אזור העניין המכיל את התבנית והתאים.
- אופציונלי: בצע שלב טיהור במידת הצורך.
- צור עיבוד תלת-ממדי של מחסנית Z באמצעות תוכנת עיבוד תלת-ממדית.
- מטב את הגדרות הניגודיות והרווח עבור כל ערוץ בנפרד.
- כדי ליצור תמונה של העיבוד התלת-ממדי, צור תמונת מצב ויצא כ- . קובץ TIFF.
- כדי ליצור סרט של העיבוד התלת-ממדי, הגדר את המסגרת ההתחלתית והאחרונה וכן את מסגרת הזמן לפני רישום הסרט. ייצא כ.avi.
תוצאות
באמצעות הפרוטוקול המתואר, מצעי תרביות תאי PDMS תלת-ממדיים ניתנים לצילום UV כדי ליצור אזורי דבק מדויקים ותפוקה גבוהה המתאימים לחיבור תאים. בדרך זו, התאים נתונים הן לגיאומטריות המצע הרלוונטיות והן לתבניות ליגנד דביקות בו זמנית. ניתן לנטר בקלות תכונות של תאים כגון כיוון, אזור תא ומספר הידבקויות מוקדיות ולהשתמש בהן כדי להבין טוב יותר את התנהגות התא בסביבות מורכבות דמויות in vivo.
כדי לאמת את אירועי התבנית במצעי PDMS התלת-ממדיים, נמדדו הרכבי פני השטח האטומיים של החומר בשלבים שונים של הפרוטוקול באמצעות ספקטרוסקופיית פוטו-אלקטרונית של קרני רנטגן אטומיות (XPS)48. לסיכום, מדידות ה-XPS הראו את נוכחותן של שרשראות PEG עם אות פחמן מוגבר על דגימות פסיבציה, אשר הופחתה לאחר פוטו-פטרינג. דגירה עם פיברונקטין גרמה לעלייה באות הפחמן, מה שמצביע שוב על הידבקות מוצלחת של חלבון על פני השטח של שבב תרבית התאים. לאחר מכן, רזולוציית התבנית ויישור התכונות התלת-ממדיות אופיינו במגוון בורות קעורים בדוגמת מעגל (ĸ = 1/250 μm-1, ĸ = 1/1,000 μm-1, ו- ĸ = 1/3,750 μm-1, ראו איור 6). מתוך הקרנות בעוצמה המרבית, ניתן להסיק כי תבנית החלבון עוצבה בהצלחה על כל שלוש התכונות התלת-ממדיות. פרופיל העוצמה באיור 6A מראה רזולוציית דפוס גבוהה עם מעברים חדים בין אזורים מעוצבים לאזורים שאינם מעוצבים. בנוסף, הושגה עוצמת חלבון עקבית על פני התבנית השלמה בבור.
הבור הקעור עם ĸ = 1/250 μm-1 עוצב בשיטת מישור המוקד היחיד (תבנית אחת), ואילו הבורות עם ĸ = 1/1,000 μm-1 ו- ĸ = 1/3,750 μm-1 עוצבו באמצעות שניים ושלושה מישורי מוקד (תבניות), בהתאמה. כפי שניתן לראות בהקרנות בעוצמה המרבית באיור 6, שתי השיטות מביאות ליישור מושלם של התבניות על גבי התכונות. לא ניתן להבחין במעברים לא מיושרים בין שני מישורי המוקד והדפוסים השונים.
באמצעות הפרוטוקול המתואר, ניתן ליישם מגוון רחב של עיצובים של תבניות חלבונים על מגוון גיאומטריות (ראו איור 7 ווידאו 1). כדי להמחיש את הרבגוניות של שיטה זו, עוצבו חצאי-גליליים (קמורים וקעורים), משטח אוכף ובור באמצעות קווים ועיגולים ברוחבים שונים. לאחר מכן ניתן להשתמש בחומרים המצולמים לתרבית תאים (ראו איור 7, איור 8, וידאו 2, וידאו 3 ווידאו 4). דוגמה לפיברובלסטים עוריים שעברו תרבית על תבנית (קווי פיברונקטין, אדום, רוחב 5 מיקרומטר ומרווחים של 5 מיקרומטר) קעורה למחצה מוצגת באיור 8, איור 9 ווידאו 4. במהלך הניסוי, התאים חשים ונצמדים למצע תרבית התאים הרב-קוטבי ונשארים בני קיימא לאורך זמן. כפי שניתן לראות מהכתמים האימונופלואורסצנטיים באיור 8, תאים יוצרים הידבקויות מוקדיות (אשכולות וינקולין) בעיקר על קווי הפיברונקטין.
מחקר לדוגמה נוסף העושה שימוש בחומרי תרביות תאים אלה פורסם לאחרונה על ידי קבוצה48 שלנו. במחקר זה, מיופיברובלסטים אנושיים ותאי אנדותל היו נתונים לשילוב של רמזי הנחיית מגע וטופוגרפיות גיאומטריות. In vivo, שני סוגי התאים חווים רמזים של עקמומיות והנחיית מגע ברקמות מקומיות, כגון בכלי הדם האנושיים. על ידי הכפפת התאים במבחנה לסביבה המשלבת את שני הרמזים הסביבתיים, ניתן לשחזר את המצב in vivo , ולספק הבנה מעמיקה יותר של תפקיד המיקרו-סביבה על התנהגות התאים. הודגם כי מיופיברובלסטים אנושיים מתיישרים עם רמזי הנחיית מגע (קווי פיברונקטין מקבילים) על מצעים גליליים קעורים48. עם זאת, על מבנים קמורים עם עקמומיות גוברת, הרמזים הגיאומטריים ביטלו את הרמזים הביוכימיים, מה שמרמז על כך שמיופיברובלסטים יכולים לחוש הן את מידת העקמומיות והן את הסימן של העקמומיות. באופן מעניין, תאי אנדותל יכלו לדבוק רק במצעים הרב-חדים הקעורים ולא במצעי ה-PDMS הקמורים. על מצעים קעורים, בעלי תבנית חלבונים, תאי האנדותל מכוונים לכיוון רמז הנחיית המגע. לידע בסיסי זה במבחנה יש רלוונטיות פיזיולוגית בתחום הנדסת רקמות כלי הדם והוא יכול בסופו של דבר לסייע בתכנון מבנים חכמים להנדסת רקמות.
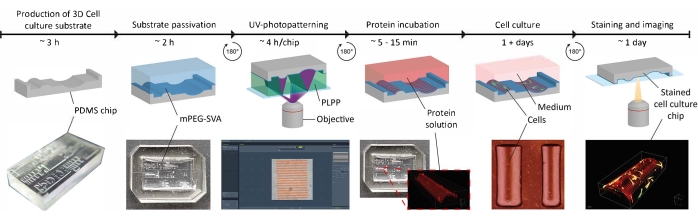
איור 1: ציר הזמן הניסויי של יישום רמזי הנחיית מגע על מצעי תרביות תאים תלת-ממדיות. ראשית, שבבי תרבית תאים חיוביים מיוצרים מתבנית PDMS שלילית המכילה מגוון של גיאומטריות. PDMS לא מרוסק נשפך לתוך התבנית ונרפא במשך 3 שעות ב 65 °C (65 °F). לאחר מכן, ה-PDMS מטופל ב-O2-פלזמה ומדגר עם PLL ו-mPEG-SVA (כחול, מסומן) כדי להעביר את פני השטח של מצע תרבית התאים. לאחר הכביסה, המצע מתהפך הפוך בטיפה של פוטו-יניטיטור (PLPP, ירוק, מסומן) ו-UV-photopatterned באמצעות גישת LIMAP. כאן, מסיכה דיגיטלית עם תבנית המוגדרת על-ידי המשתמש משמשת כדי לבקע את שכבת הפסיביציה במיקומים מוגדרים. לאחר מכן, ניתן לדוגר תמיסת חלבון (אדום, מסומן) והיא תיצמד רק למקומות שבהם מסירים את שכבת הפסיביציה. תאים שנזרעו על המצע נתונים הן לגיאומטריה והן לדפוסי חלבונים, מה שמאפשר לחקור את התנהגות התאים בסביבות מורכבות המחקות in vivo. קיצורים: PDMS = פולידימתילסילוקסן; mPEG-SVA = מתוקסיפוליאתילן גליקול-סוקינימידיל ולראט; PLPP = 4-בנזואילבנזיל-טרימתילמוניום כלוריד; LIMAP = ספיחה מולקולרית הנגרמת על ידי אור של חלבונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: שלבים שונים במהלך הייצור וההתפשטות של מצע תרביות התאים התלת-ממדיות. תבנית הזכוכית השלילית (#1) תוכננה עם תוכנת תכנון בסיוע מחשב ומיוצרת באמצעות טכניקת כתיבה ישירה של femtosecond-laser. תבנית זו משמשת לייצור שבב PDMS חיובי ביניים (#2) ועובש PDMS שלילי (#3), המשמשים לאחר מכן לייצור שבב תרבית התאים הסופי (#4). קיצור: PDMS = פולידימתילסילוקסן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: המחשה סכמטית של שתי שיטות התבנית. משמאל: צילום UV מתבצע על תכונות קטנות יותר (בערך DMD אחד) באמצעות מישור מוקד יחיד ותבנית. כתוצאה מכך, התכונה המלאה מעוצבת בבת אחת. מימין: כאשר נעשה שימוש בתכונות גדולות יותר (גדול יותר מ-DMD אחד), התבנית מחולקת על פני מישורי מוקד ותבניות מרובים. קיצור: DMD = התקן מראה דיגיטלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
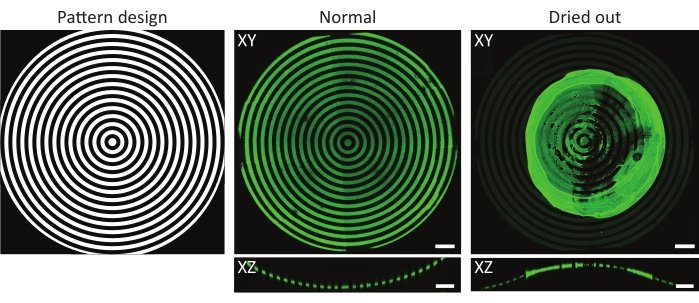
איור 4: דוגמה טיפוסית למצע רגיל ומיובש עם דגירה בחלבון. הקרנות בעוצמה מרבית (XY) ותצוגות אורתוגונליות (XZ) של מצעים רגילים ומיובשים עם דגירה בחלבון. בעת שטיפת מצע תרבית תאים בתבנית לאחר הדגירה עם תמיסת חלבון, חשוב תמיד לשמור על הדגימה רטובה. אף על פי שהתבנית זהה בכל התמונות המופיעות בתכונות (ĸ = 1/1,000 μm-1), הג'לטין-פלואורסציין (ירוק) הצטבר ויצר גוש מרכזי כאשר הדגימה הושארה לייבוש למשך מספר שניות. אם הדגימה תמיד נשארת רטובה, ניתן להבחין בדפוסי חלבון נכונים. סרגלי קנה מידה = 100 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: תמונות ברייטפילד לאחר הזריעה. קרטוציטים ראשוניים (משמאל) ופיברובלסטים עוריים (מימין) 4 שעות לאחר זריעה על תכונות גיאומטריות תלת-ממדיות (בור קעור של ĸ = 1/1,000 מיקרומטר-1 וחצי-גליליים של ĸ = 1/500, 1/375, 1/250, 1/175 ו-1 /125 μm-1). התוספות השמאליות העליונות מייצגות את תבנית השורה המשמשת ליצירת התבניות של הגיאומטריות. חצים לבנים מציינים תאים מתפשטים שכבר מראים יישור. סרגלי קנה מידה = 250 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
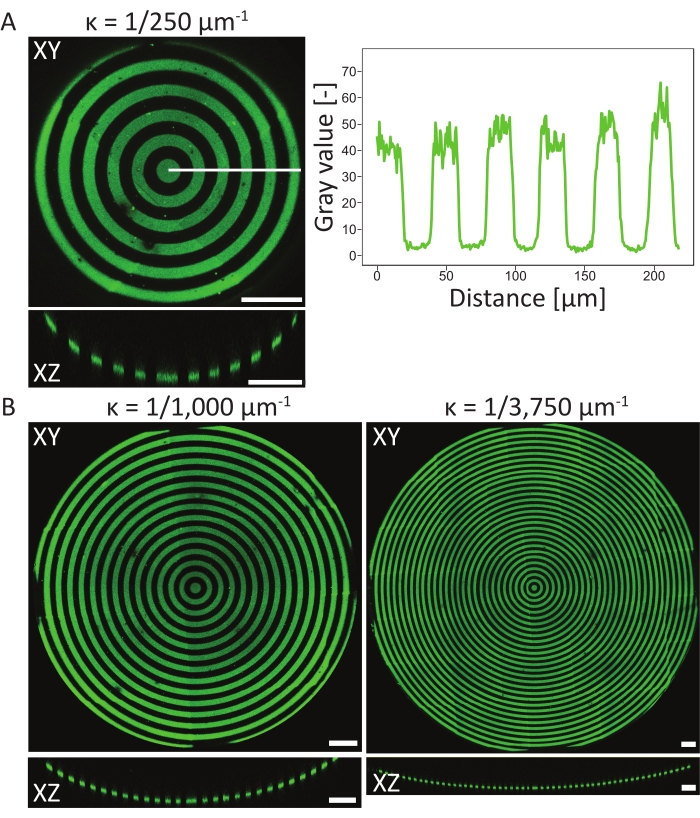
איור 6: אפיון תבניות מעגליות בבורות קעורים. (A) ההטלה בעוצמה המרבית (XY) והראייה האורתוגונלית (XZ) של בור אקונקאב (ĸ = 1/250 μm-1) בתבנית LIMAP (linewidth: 20 μm, רוחב רווח: 20 μm) ודגירה עם ג'לטין-פלואורסצין (ירוק). פרופיל העוצמה לאורך הקו הלבן משורטט כנגד המרחק, ומציג איכות ורזולוציה עקבית של תבנית. (B) דפוסים נוספים המבוצעים בבורות קעורים עם ĸ = 1/1,000 μm-1 ו- ĸ = 1/3750 μm-1, ומראים גמישות במונחים של תכונות גיאומטריות שיכולות לשמש לדפוס. שוב, הן הקרנות העוצמה המרבית (XY) והן התצוגות האורתוגונליות (XZ) מוצגות באופן חזותי. סרגלי קנה מידה = 100 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
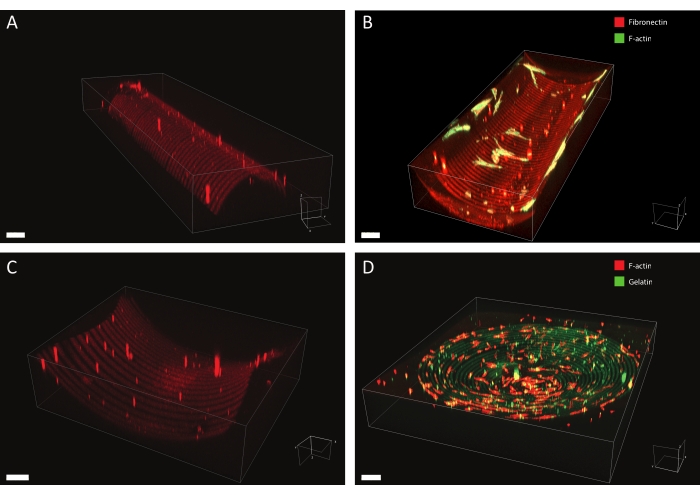
איור 7: נתוני מיקרוסקופיה תלת-ממדית של מבנים מעוצבים. דוגמאות אופייניות לחומרים תלת-ממדיים בתבנית תרבית תאים לאחר פוטו-פטריה ותרבית תאים, שהומחשו באמצעות תוכנת עיבוד תלת-ממדית. (A) חצי-צילינדר קמור עם קווים ברוחב 10 מיקרומטר (רודמין-פיברונקטין, אדום) ופערים ברוחב 10 מיקרומטר. סרגל קנה מידה = 5 μm. (B) פיברובלסטים עוריים מוכתמים עבור F-אקטין (ירוק) מתורבתים על סמי-גלילינדר קעור עם קווים ברוחב 20 מיקרומטר (רודמין-פיברונקטין, אדום) ומרווחים ברוחב 20 מיקרומטר. סרגל קנה מידה = 5 μm. (C) משטח אוכף עם קווים ברוחב 20 מיקרומטר (רודמין-פיברונקטין, אדום) ומרווחים ברוחב 20 מיקרומטר. סרגל קנה מידה = 5 μm. (D) בור קעור עם עיגולים קונצנטריים של קווים ברוחב 20 מיקרומטר (ג'לטין-פלואורסציין, ירוק) ומרווחים ברוחב 20 מיקרומטר. שלד ה-F-אקטין של הקרטוציטים האנושיים מוכתם באמצעות פאלואידין ומודגם באדום. סרגל קנה מידה = 200 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 8: צביעה אימונופלואורסצנטית של פיברובלסטים עוריים אנושיים על פיברובלסטים עוריים אנושיים על גבי חצי-גליל קעור פוטו-פוטר, קעורים ( A) (A) של הקרנה בעוצמה מרבית (XY) ומקטעים אורתוגונליים (XZ ו-YZ) של פיברובלסטים עוריים אנושיים שעברו תרבית במשך 24 שעות על תבנית (קווי פיברונקטין, אדום, ברוחב 5 מיקרומטר ו-5 מיקרומטרים) של סמיצילינדר קעור. התאים מוכתמים עבור F-אקטין (magenta), וינקולין (ירוק) וגרעינים (כחול). סרגל קנה מידה = 100 μm. (B) זום-אין של תא הנצמד לסביבה הרב-תכליתית. סרגלי קנה מידה = 50 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 9: תמונות בהילוך מהיר של ברייטפילד של פיברובלסטים עוריים אנושיים על גליל קעור בדוגמת תבנית. החצי-צילינדר הקעור (ĸ = 1/250 μm-1) עוצב בקווים מקבילים (ברוחב 5 מיקרומטר ובפערים של 5 מיקרומטר) והודגם עם רודמין-פיברונקטין לפני זריעת התא. הדמיית ההפסקה בזמן מתחילה שעה אחת לאחר זריעת התאים הראשונית (שמאלה, 0 דקות), כאשר התאים עדיין מעוגלים ואינם דבקים (חצים). לאחר כ-24 שעות (באמצע, 1,420 דקות), התאים דבקו במצע הרב-קוטבי והראו תגובת יישור על פי תבנית הנחיית המגע. הן תגובת היישור והן יכולת הכדאיות של התא נשמרות לאורך כל משך התרבית (מימין, 3,180 דקות). סרגלי קנה מידה = 200 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
סרטון 1: תבנית לדוגמה על מצע גלילי תלת-ממדי. ייצוג תלת-ממדי של גליל קמור בדוגמת רודמין-פיברונקטין (אדום). אנא לחץ כאן כדי להוריד את הסרטון הזה.
סרטון 2: ייצוג תלת-ממדי של פיברובלסטים עוריים שעברו תרבית על מצע גלילי תלת-ממדי (ĸ = 1/500 מיקרומטר-1). פיברובלסטים עוריים תרבית במשך 24 שעות על תבנית (קווי פיברונקטין, אדום, רוחב 10 מיקרומטר ומרווחים של 10 מיקרומטר) חצי-גלילית קמורה. התאים מוכתמים עבור F-אקטין (magenta), וינקולין (ירוק) וגרעינים (כחול). אנא לחץ כאן כדי להוריד את הסרטון הזה.
וידאו 3: ייצוג תלת-ממדי של קרטוציטים אנושיים בתרבית בבור תלת-ממדי מעוצב (ĸ = 1/3,750 μm-1). ייצוג תלת-ממדי של קרטוציטים אנושיים שעברו תרבית במשך 24 שעות בבור קעור ומעוצב (מעגלי ג'לטין, ירוקים, ברוחב 20 מיקרומטר וברווחים של 20 מיקרומטר). התאים מוכתמים עבור F-אקטין (אדום). אנא לחץ כאן כדי להוריד את הסרטון הזה.
וידאו 4: הדמיית בהילוך מהיר של ברייטפילד של פיברובלסטים עוריים אנושיים על גליל קעור בדוגמת תבנית. החצי-צילינדר הקעור (ĸ = 1/250 μm-1) עוצב בקווים מקבילים (ברוחב 5 מיקרומטר ובפערים של 5 מיקרומטר) והודגם עם רודמין-פיברונקטין לפני זריעת התא. ההדמיה בזמן מתחילה שעה אחת לאחר זריעת התאים הראשונית, כאשר התאים מראים היצמדות ראשונית לסביבה הרב-תכליתית. במהלך ההפסקה המלאה, התאים מכוונים בעיקר לאורך רמזי הנחיית המגע, בעוד שחיוניות התא נשמרת. אנא לחץ כאן כדי להוריד את הסרטון הזה.
Discussion
כיום, התנהגות התא נחקרת לעתים קרובות על מצעי תרבית שטוחים חסרי המורכבות של המיקרו-סביבה של התא המקומי. סביבות תלת מימד כגון פיגומים והידרוג'לים משמשות כחלופה. אף על פי שסביבות תרביות תאים אלה משפרות את הרלוונטיות של in vivo, הן מחקרים שיטתיים על התנהגות תאים והן על ההיתכנות של שיטות קריאה נותרים מאתגרים. כדי לחקור באופן שיטתי את התנהגות התאים על מצעי תרביות מייצגים, יש צורך במצעים רב-תכליתיים עקביים המאפשרים קריאה מיקרוסקופית. לכן, בפרוטוקול זה, אנו מתארים שיטה ליצירת מצעי תרביות תאים רב-תכליתיים עם גיאומטריות רלוונטיות מבחינה פיזיולוגית וחלבוני ECM מעוצבים. האתגר העיקרי בשילוב רמזים סביבתיים כגון גיאומטריה של רקמות ורמזים להנחיית מגע בפלטפורמות במבחנה הוא במידה רבה בעל אופי טכנולוגי. שיטות קונבנציונליות ליישום רמזים להנחיית מגע (למשל, ליתוגרפיה רכה, דפוס UV עמוק והדפסה מיקרו-קונקרטית35,36) על חומרי תרביות תאים הותאמו למצעים מישוריים. הצורך בחומרי תרבית תאים תלת-ממדיים בשילוב עם רמזים להנחיית מגע הדגישו מספר אתגרים טכנולוגיים, כגון יישור תבניות לקוי, רזולוציה וגמישות. כדי להתגבר על אתגרים אלה, ניתן להשתמש בשיטת דפוס מבוססת אור בתפוקה גבוהה, ללא מסכה, 45,49. כאן, מיקרוסקופ אופטי מאפשר יישור תבנית מדויק ורזולוציה בסדר המיקרומטרים (ראו איור 6). יתר על כן, השימוש במסכה דיגיטלית מאפשר לחוקרים לחקור את התנהגות התאים במגוון רחב של דפוסים ללא צורך בייצור מסכות פיזיות עתירות עבודה.
ניתן להשתמש בגישת ה-UV-photopatterning בשילוב עם מגוון גיאומטריות תלת-ממדיות (למשל, צילינדרים, אוכפים, כיפות, בורות) המופקות ממגוון חומרים48. מצעי תרביות התאים התלת-ממדיים ששימשו במחקר זה מיוצרים מ-PDMS; עם זאת, ניתן להשתמש גם בחומרים אחרים. זה עשוי לדרוש שלבים שונים כדי לייצר את מצע תרבית התא הסופי המכיל את התכונות המעניינות. מאחר שהתאים הוכחו כרגישים לחספוס פני השטח של חומרי תרבית תאים, חשוב ליצור את שבבי תרבית התאים עם משטח חלק, כך שניתן יהיה לייחס את תגובת התאים הנצפים באופן מלא לגיאומטריה התלת-ממדית ולרמזי הנחיית המגע50,51. שיטות מדידה כגון פרופילומטריה אופטית, מיקרוסקופיית אלקטרונים סורקת או מיקרוסקופיית כוח אטומי יכולות לשמש למדידת חספוס פני השטח. לאחר ייצור חומר תרבית התאים, ניתן לבחור שיטת דפוס המבוססת על מישור מוקד אחד או יותר, בהתאם לממדים הספציפיים של תכונת העניין (ראו איור 3). בדרך כלל, מישור מוקד יחיד משמש ליצירת תבנית אזור בטווח Z של כ-50 מיקרומטר. רזולוציית התבנית הוכחה כעקבית באמצעות כלל אצבע זה (ראו איור 6). עם זאת, חיסרון של שיטה זו הוא זמן הדפוסים המוגבר עם כניסתם של מישורי מוקד ותבניות מרובות. בידנו, באמצעות מישורי מוקד מרובים, תכונות גיאומטריות תלת-ממדיות של עד 16 מ"מ x 16 מ"מ x 0.17 מ"מ (X x Y x Z) עוצבו בהצלחה עם איכות תבנית גבוהה.
בנוסף, חשוב לציין כי הגובה (ציר Z) של תכונות גיאומטריות שניתן להשתמש בהן בשילוב עם פרוטוקול זה מוגבל. מכיוון שגם ה-UV-photopatterning וגם קריאות תאיות רבות מסתמכים על מערך מיקרוסקופיה, מרחק העבודה של המטרות קובע את הגובה המרבי של תכונה. בידנו, גיאומטריות העולות על גובה של 300 מיקרומטר עדיין יכולות להיות פוטו-פוטו-פוטרות UV, וקריאות בוצעו באמצעות מיקרוסקופ קונפוקלי עם מטרות פי 40. לפיכך, מחקר מכניוביולוגי הנע בין תוך תאי לקנה מידה תאי לקנה מידה תאי ורקמות אפשרי באמצעות הפרוטוקול המתואר.
גורם נוסף שיש לקחת בחשבון הוא הסיכון שדגימות יתייבשו במהלך או אחרי צילום UV49. זה רלוונטי במיוחד כאשר משתמשים בגיאומטריות תלת-ממדיות, מכיוון שקמורים נחשפים לעתים קרובות מחוץ לחומרי תרבית תאים. כפי שניתן לראות באיור 4, הדבר עלול לגרום לדפוסים לא אחידים כאשר אגרגטי חלבונים נוצרים על גבי תכונת העניין. שטיפת שבבי תרביות התאים לאחר דגירה של חלבונים ובמהלך תרבית תאים היא קריטית לציפוי נכון של גיאומטריות תלת-ממדיות. לכן, מומלץ תמיד להשאיר כמויות קטנות של תמיסה עובדת (PBS, PLPP, תמיסת חלבון, מדיום תרבית תאים) על גבי שבב תרבית התאים.
עד כה, מספר ציפויי חלבון (פיברונקטין, קולגן מסוג I ו- IV, ג'לטין, FNC) וסוגי תאים (תאים סטרומליים של מח עצם אנושי, מיופיברובלסטים אנושיים, תאי אנדותל אנושיים, קרטוציטים אנושיים ופיברובלסטים עוריים) שימשו בשילוב עם גישת הפוטו-פטרינג המתוארת על חומרי תרבית תאים מובנים. כפי שהוכח במחקר קודם48, אופטימיזציה של פרמטרים של דגירה של חלבונים היא המפתח לחקירה שיטתית בסוגי תאים חדשים. לכן, לפני ביצוע ניסוי חדש עם חלבונים או תאים חדשים, מומלץ לבדוק מגוון של ריכוזי חלבונים, טמפרטורות דגירה וזמני דגירה. על ידי השוואת מורפולוגיה של תאים לאחר הידבקות ראשונית על אזורים שטוחים הומוגניים ותבניתיים עם מורפולוגיה של תאים בתנאי תרבית תאים 'רגילים', ניתן לקבל קבוצה אופטימלית של פרמטרים ניסיוניים. בנוסף, כל סוג תא עשוי לדרוש פרק זמן שונה לאחר הזריעה כדי להראות מורפולוגיה של הידבקות הניתנת לזיהוי בסביבה מרובת רמזים ספציפית (ראו איור 5). לשם כך, חיוני לייעל את הזמן הנדרש לכל סוג תא כדי להציג אירועי מגע על האזור המעוצב במהלך הכביסה בשלב 8.4. לדוגמה, ראינו כי על דפוסי הקו, קרטוציטים אנושיים מראים מורפולוגיות מוארכות בתוך 30 הדקות הראשונות לאחר הזריעה, בעוד שתאי אנדותל ופיברובלסטים עוריים דורשים מספר שעות לפני שהם מראים שינוי במורפולוגיית ההידבקות. הפרמטרים הניסיוניים הנדרשים לדגירה של חלבונים (שלב 7) ולזריעת תאים (שלב 8) עשויים אפוא להיות תלויים בחלבון ובסוג התא המועדף.
הגישה המוצגת ליישום רמזים להנחיית מגע על גיאומטריות תלת-ממדיות יכולה לסייע ביצירת הבנה עמוקה יותר של התנהגות תאים בסביבות מורכבות ורב-תחומיות. זה יכול לכלול חקירות של רכיבים תוך תאיים, כגון הידבקויות מוקדיות וגרעינים, ויכול לכלול גם ניסויים המבוצעים בקנה מידה גדול יותר, של תאים או רקמות, באמצעות השיטה המוצעת. בסופו של דבר, הצפי הוא שהידע שנצבר יכול לשמש בתכנון יישומים של הנדסת רקמות, שבהם סביבות תאיות מורכבות מתוכננות לכוון את התנהגות התאים לעבר תוצאה רצויה.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לד"ר נלו פורמיסאנו (מכון MERLN לרפואה רגנרטיבית בהשראת טכנולוגיה) על מתן קרטוציטים ראשוניים אנושיים. עבודה זו נתמכה על ידי ה- InSciTe של Chemelot (פרויקט BM3.02); המועצה האירופית למחקר (מענק 851960); ומשרד החינוך, התרבות והמדע לתכנית הכבידה 024.003.013 "התחדשות מונעת חומרים". המחברים רוצים להודות ל-Alvéole על ההתכתבויות, העזרה ופתרון הבעיות שלהם.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-vinculin antibody, mouse monoclonal IgG1 | Sigma | V9131 | Dilution: 1/600 |
| Bovine Serum albumin, Fraction V | Roche | 10735086001 | |
| DMEM, high glucose, pyruvate | Gibco | 41966029 | |
| DMEM/F-12 + GlutaMAX (1x) | Gibco | 10565018 | |
| DMi8 epifluorescent microscope | Leica Microsystems | ||
| Ethanol | Biosolve | 0005250210BS | |
| Fetal Bovine Serum | Serana | 758093 | |
| Fiji/ImageJ, version v1.53k | www.imageJ.nih.gov | ||
| Fluorescent highlighter | Stabilo | 4006381333627 | |
| Fluorescin-labeled gelatin | Invitrogen | G13187 | Concentration: 0.01% |
| Formaldehyde solution | Merck | F8775 | |
| Glass coverslips 24 x 60 mm, #1 | VWR | 631-1575 | |
| Glass coverslips, ø = 32 mm, #1 | Menzel-Gläser | ||
| HCX PL fluotar L 20X/0.40na microscope objective | Leica | 11506242 | |
| HEPES | Gibco | 15630080 | |
| Human dermal fibroblasts | Lonza | CC-2511 | |
| Human primary keratocytes | MERLN Institute for Technology-Inspired Regenerative Medicine | ||
| Illustrator, Version 26.0.1 | Adobe | ||
| Laboratory oven | Carbolite | ||
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | |
| Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Leonardo software, version 4.16 | Alvéole | ||
| Micro-manager, version 1.4.23 | Open imaging | ||
| Mowiol 4-88 | Sigma-Aldrich | 81381 | mounting medium |
| mPEG-succinimidyl valerate MW 5,000 Da | Laysan Bio | MPEG-SVA-5000 | Concentration: 50 mg/mL |
| Negative glass mold | FEMTOprint | ||
| NucBlue Live Readyprobes Reagent (Hoechst 33342) | Invitrogen | R37605 | 2 drops/mL |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140163 | |
| Petri dish (ø=100 mm) | Greiner Bio-one | 664160 | |
| Phalloidin Atto 647N | Sigma | 65906 | Dilution: 1/250 |
| Phosphate Buffered Saline | Sigma | P4417 | |
| Plasma asher | Emitech | K1050X | |
| PLPP (photoinitiator) | Alvéole | ||
| Poly-L-lysine, sterile-filtered | Sigma-Aldrich | P4707 | Concentration: 0.01% |
| PRIMO | Alvéole | ||
| Rhodamine-labeled fibronectin | Cytoskeletn, Inc. | FNR01 | Concentration: 10 µg/mL |
| Secondary antibody with Alexa 488, Goat anti-mouse IgG1 (H) | Molecular Probes | A21121 | Dilution: 1/300 |
| Secondary antibody with Alexa 555, Goat anti-mouse IgG1 (H) | Molecular Probes | A21127 | Dilution: 1/300 |
| Spin coater | Leurell Technologies Corporation | model WS-650MZ-23NPPB | |
| SYLGARD 184 Silicone Elastomer Kit | DOW | 1673921 | |
| TCS SP8X confocal microscope | Leica Microsystems | ||
| tridecafluoro(1,1,2,2-tetrahydrooctyl)trichlorosilane | ABCR | AB111444 | |
| TrypLE Express Enzyme (1x), no phenol red | Gibco | 12604013 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 |
References
- Wang, Y., Wang, G., Luo, X., Qiu, J., Tang, C. Substrate stiffness regulates the proliferation, migration, and differentiation of epidermal cells. Burns. 38, 414-420 (2012).
- Viswanathan, P., et al. 3D surface topology guides stem cell adhesion and differentiation. Biomaterials. 52, 140-147 (2015).
- Peyton, S. R., et al. Marrow-derived stem cell motility in 3D synthetic scaffold is governed by geometry along with adhesivity and stiffness. Biotechnology and Bioengineering. 108 (5), 1181-1193 (2011).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nature Reviews Molecular Cell Biology. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584, 535-546 (2020).
- Guido, S., Tranquillo, R. T. A methodology for the systematic and quantitative study of cell contact guidance in oriented collagen gels. Correlation of fibroblast orientation and gel birefringence. Journal of Cell Science. 105 (2), 317-331 (1993).
- Teixeira, A. I., Abrams, G. A., Bertics, P. J., Murphy, C. J., Nealey, P. F. Epithelial contact guidance on well-defined micro- and nanostructured substrates. Journal of Cell Science. 116, 1881-1892 (2003).
- Driscoll, M. K., Sun, X., Guven, C., Fourkas, J. T., Losert, W. Cellular contact guidance through dynamic sensing of nanotopography. ACS Nano. 8 (4), 3546-3555 (2014).
- Buskermolen, A. B. C., et al. Cellular contact guidance emerges from gap avoidance. Cell Reports Physical Science. 1 (5), 100055 (2020).
- Thrivikraman, G., et al. Cell contact guidance via sensing anisotropy of network mechanical resistance. Proceedings of the National Academy of Sciences of the United States of America. 118 (29), 1-11 (2021).
- Buskermolen, A. B. C., et al. Entropic forces drive cellular contact guidance. Biophysical Journal. 116 (10), 1994-2008 (2019).
- Vignaud, T., et al. Reprogramming cell shape with laser nano-patterning. Journal of Cell Science. 125 (9), 2134-2140 (2012).
- Pouthas, F., et al. In migrating cells, the Golgi complex and the position of the centrosome depend on geometrical constraints of the substratum. Journal of Cell Science. 121 (14), 2406-2414 (2008).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Théry, M., et al. Anisotropy of cell adhesive microenvironment governs cell internal organization and orientation of polarity. Proceedings of the National Academy of Sciences of the United States of America. 103 (52), 19771-19776 (2006).
- Huang, G., et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chemical Reviews. 117 (20), 12764-12850 (2017).
- Callens, S. J. P., Uyttendaele, R. J. C., Fratila-Apachitei, L. E., Zadpoor, A. A. Substrate curvature as a cue to guide spatiotemporal cell and tissue organization. Biomaterials. 232, 119739 (2020).
- Yilmaz, C. O., Xu, Z. S., Gracias, D. H. Curved and Folded Micropatterns in 3D Cell Culture and Tissue Engineering. Methods in Cell Biology. 121, (2014).
- Silver, F. H., Freeman, J. W., Seehra, G. P. Collagen self-assembly and the development of tendon mechanical properties. Journal of Biomechanics. 36 (10), 1529-1553 (2003).
- Werner, M., Kurniawan, N. A., Bouten, C. V. C. Cellular geometry sensing at different length scales and its implications for scaffold design. Materials. 13 (4), 963 (2020).
- Di Cio, S., Bøggild, T. M. L., Connelly, J., Sutherland, D. S., Gautrot, J. E. Differential integrin expression regulates cell sensing of the matrix nanoscale geometry. Acta Biomaterialia. 50, 280-292 (2017).
- Fioretta, E. S., Simonet, M., Smits, A. I. P. M., Baaijens, F. P. T., Bouten, C. V. C. Differential response of endothelial and endothelial colony forming cells on electrospun scaffolds with distinct microfiber diameters. Biomacromolecules. 15 (3), 821-829 (2014).
- Werner, M., Kurniawan, N. A., Korus, G., Bouten, C. V. C., Petersen, A. Mesoscale substrate curvature overrules nanoscale contact guidance to direct bone marrow stromal cell migration. Journal of The Royal Society Interface. 15 (145), 20180162 (2018).
- Ruprecht, V., et al. How cells respond to environmental cues - insights from bio-functionalized substrates. Journal of Cell Science. 130 (1), 51-61 (2017).
- Bao, M., Xie, J., Huck, W. T. S. Recent advances in engineering the stem cell microniche in 3D. Advanced Science. 5 (1800448), 1-16 (2018).
- Zhan, X. Effect of matrix stiffness and adhesion ligand density on chondrogenic differentiation of mesenchymal stem cells. Journal of Biomedical Materials Research - Part A. 108 (3), 675-683 (2020).
- Jiang, T., et al. Untangling the response of bone tumor cells and bone forming cells to matrix stiffness and adhesion ligand density by means of hydrogels. Biomaterials. 188, 130-143 (2019).
- Choi, J. S., Harley, B. A. C. The combined influence of substrate elasticity and ligand density on the viability and biophysical properties of hematopoietic stem and progenitor cells. Biomaterials. 33, 4460-4468 (2012).
- Rape, A. D., Zibinsky, M., Murthy, N., Kumar, S. A synthetic hydrogel for the high-throughput study of cell-ECM interactions. Nature Communications. 6 (8129), 1-9 (2015).
- Camarero-Espinosa, S., et al. 3D printed dual-porosity scaffolds: the combined effect of stiffness and porosity in the modulation of macrophage polarization. Advanced Healthcare Materials. 11 (2101415), 1-16 (2022).
- Bao, M., et al. Cellular volume and matrix stiffness direct stem cell behavior in a 3D microniche. ACS Applied Materials and Interfaces. 11 (2), 1754-1759 (2019).
- Charest, J. L., Eliason, M. T., García, A. J., King, W. P. Combined microscale mechanical topography and chemical patterns on polymer cell culture substrates. Biomaterials. 27, 2487-2494 (2006).
- Bilem, I., et al. Interplay of Geometric Cues and RGD/BMP-2 crosstalk in directing stem cell fate. ACS Biomaterials Science and Engineering. 3 (10), 2514-2523 (2017).
- Nam, K. -. H., et al. Multiscale cues drive collective cell migration. Scientific Reports. 6, 29749 (2016).
- Alom Ruiz, S., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Protein Micropatterns. A Direct Printing Protocol Using Deep UVs. Methods in Cell Biology. 97, (2010).
- Kane, R. S., Takayama, S., Ostuni, E., Ingber, D. E., Whitesides, G. M. Patterning proteins and cells using soft lithography. Biomaterials. 20 (23-24), 2363-2376 (1999).
- Azioune, A., Storch, M., Bornens, M., Théry, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab on a Chip. 9 (11), 1640 (2009).
- Offenhäusser, A., et al. Microcontact printing of proteins for neuronal cell guidance. Soft Matter. 3 (3), 290-298 (2007).
- Ricoult, S. G., Sanati Nezhad, A., Knapp-Mohammady, M., Kennedy, T. E., Juncker, D. Humidified microcontact printing of proteins: universal patterning of proteins on both low and high energy surfaces. Langmuir. 30 (40), 12002-12010 (2014).
- Waterkotte, B., et al. Biofunctional Micropatterning of Thermoformed 3D Substrates. Advanced Functional Materials. 24 (4), 442-450 (2014).
- Lehnert, D., et al. Cell behaviour on micropatterned substrata: Limits of extracellular matrix geometry for spreading and adhesion. Journal of Cell Science. 117 (1), 41-52 (2004).
- Sevcik, E. N., Szymanski, J. M., Jallerat, Q., Feinberg, A. W. Patterning on topography for generation of cell culture substrates with independent nanoscale control of chemical and topographical extracellular matrix cues. Current Protocols in Cell Biology. 75, 1-25 (2017).
- Micropatterning: Surface functionalization. Alvéole Available from: https://www.alveolelab.com/technology/micropatterning-surface-functionalization/ (2022)
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- van Gaal, R. C., Miltenburg, R. P. R. S., Kurniawan, N. A., Bouten, C. V. C., Dankers, P. Y. W. Renal epithelial cell responses to supramolecular thermoplastic elastomeric concave and convex structures. Advanced Materials Interfaces. 8 (1), 2001490 (2021).
- Foster, J. W., Gouveia, R. M., Connon, C. J. Low-glucose enhances keratocyte-characteristic phenotype from corneal stromal cells in serum-free conditions. Scientific Reports. 5, 1-16 (2015).
- Van Der Putten, C., et al. Protein micropatterning in 2.5D: an approach to investigate cellular responses in multi-cue environments. ACS Applied Materials and Interfaces. 13 (22), 25589-25598 (2021).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Hou, Y., et al. Surface roughness gradients reveal topography-specific mechanosensitive responses in human mesenchymal stem cells. Small. 16 (10), 1905422 (2020).
- Bourkoula, A., et al. Roughness threshold for cell attachment and proliferation on plasma micro-nanotextured polymeric surfaces: The case of primary human skin fibroblasts and mouse immortalized 3T3 fibroblasts. Journal of Physics D: Applied Physics. 49 (30), 304002 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved