A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام التقسيم الثنائي لتقليل الحمض النووي للميتوكوندريا في بويضة البقر
* These authors contributed equally
In This Article
Summary
هنا ، نقدم بروتوكولا لتقليل أعداد نسخ الحمض النووي للميتوكوندريا بشكل كبير في بويضة البقر (P < 0.0001). تستخدم هذه الطريقة الطرد المركزي والتقسيم الثنائي للحد بشكل كبير من الميتوكوندريا البويضية وقد تسمح بزيادة فرصة التطور في أجنة النقل النووي للخلايا الجسدية بين الأنواع المعاد بناؤها.
Abstract
يمكن استخدام النقل النووي للخلايا الجسدية بين الأنواع (iSCNT) لإنقاذ الأنواع المهددة بالانقراض، ولكن توجد مجموعتان متميزتان من الحمض النووي للميتوكوندريا (mtDNA) داخل الجنين المعاد بناؤه: واحدة داخل البولازم المتلقي والأخرى داخل الخلية الجسدية المانحة. يمكن أن تؤدي هذه الميتوكوندريا غير المتجانسة إلى مشاكل في النمو في الجنين والجنين. وتشمل بروتوكولات الاستنساخ المصنوعة يدويا الاستئصال الثنائي للبويضة، والتي يمكن استخدامها لتقليل عدد نسخ الحمض النووي MTDNA، مما يقلل من درجة التباين في الميتوكوندريا في الجنين المعاد بناؤه. أنتج الطرد المركزي للبويضات البقرية العارية والناضجة جزءا مرئيا كثيفا من الميتوكوندريا في قطب واحد من البويضات. تمت إزالة البويضات من zonae pellucidae عن طريق التعرض لمحلول pronase. تم إجراء التشريح الثنائي باستخدام شفرة صغيرة لإزالة جزء الميتوكوندريا المرئي. تم استخدام qPCR لقياس كمية mtDNA الموجودة في عينات الحمض النووي المستخرجة من البويضات الكاملة والبلاستيدات المجزأة ، مما يوفر مقارنة بين أرقام نسخ mtDNA قبل وبعد التشريح. تم حساب أرقام النسخ باستخدام قيم عتبة الدورة ، وصيغة خط الانحدار للمنحنى القياسي ، والنسبة التي تضمنت الأحجام الخاصة بمنتجات mtDNA PCR ومنتجات PCR الجينومية. كان لدى إحدى البويضات البقرية متوسط عدد نسخ mtDNA (± الانحراف المعياري) من 137,904 ± 94,768 (n = 38). كان لدى أحد الأوبلاست المستنفدة للميتوكوندريا متوسط عدد نسخ mtDNA يبلغ 8,442 ± 13,806 (n = 33). بلغ متوسط نسخ mtDNA الموجودة في أوبلاست غنية بالميتوكوندريا 79,390 ± 58,526 مليون نسخة من الحمض النووي (n = 28). تشير الاختلافات بين هذه المتوسطات المحسوبة إلى أن الطرد المركزي والتقسيم الثنائي اللاحق يمكن أن يقلل بشكل كبير من أعداد نسخ mtDNA الموجودة في البلاست المستنفد للميتوكوندريا عند مقارنته بالبويضة الأصلية (P < 0.0001 ، التي تحددها ANOVA أحادية الاتجاه). يجب أن يقلل الانخفاض في mtDNA من درجة عدم التغاير الميتوكوندريا في الجنين المعاد بناؤه ، وربما يعزز النمو الجنيني والجنيني القياسي. قد تكون المكملات الغذائية بمستخلص الميتوكوندريا من الخلية المانحة الجسدية ضرورية أيضا لتحقيق نمو جنيني ناجح.
Introduction
يشمل النقل النووي للخلايا الجسدية (SCNT) اندماج بويضة منزوعة النواة من واحد وخلية جسدية من من نفس النوع. في معظم الحالات ، تنشأ البويضة والخلية الجسدية من نفس النوع ، ومعدلات المواليد الأحياء أقل من 6٪ 1. تتضمن بعض الأبحاث استخدام SCNT بين الأنواع (iSCNT) ، والذي يتضمن اندماج خلية جسدية وبويضة تنشأ من نوعين مختلفين. في هذه الدراسات ، تكون معدلات المواليد الأحياء أقل مما هي عليه في SCNT - عادة أقل من 1٪ 1. ومع ذلك ، فإن iSCNT لديه القدرة على استخدامه كوسيلة لإنقاذ الأنواع المهددة بالانقراض ، لأن الخلايا الجسدية من هذه الحيوانات يمكن الوصول إليها أكثر من خلاياها الجرثومية1. غالبا ما تكون البويضات المتلقية المستخدمة في iSCNT من الأنواع المختبرية المحلية أو الشائعة ، مثل الأبقار والخنازير والفئران. وقد نجحت بعض المحاولات التي بذلت حتى الآن في إنتاج صغار أحياء، على الرغم من أن النسل المنتج كان داخل الجنيسة (كانت أنواع البويضات المتلقية وأنواع الخلايا المانحة أعضاء من نفس الجنس)2،3،4. النماذج البينية (التي تستخدم خلية بويضية وجسدية من الحيوانات في أجناس مختلفة) لم تنتج بعد حية، وغالبية الأجنة المعاد بناؤها تقبض في مرحلة 8-16 خلية من التطور المختبري 5،6،7،8. أحد التفسيرات المحتملة لهذا الاعتقال التنموي الجنيني هو حدوث تباين الميتوكوندريا في الأجنة - وجود أكثر من نوع واحد من الحمض النووي للميتوكوندريا (mtDNA) في خلية واحدة. يمكن أن يؤدي التغايرية إلى مشاكل مثل عدم الكفاءة التنموية أو الفشل في الجنين أو في الحيوان الحي1. يمكن أن يحدث التسبب أيضا في وقت لاحق من حياة الحيوان9. على الرغم من أن هذه المشكلة موجودة أيضا في ذرية SCNT ، إلا أن المكون المشترك بين الأنواع داخل أجنة iSCNT يؤدي إلى تفاقم المشكلة.
عندما يأتي الحمض النووي الجنيني mtDNA من نوعين مختلفين ، فإن الميتوكوندريا البويضة المتلقية ، التي تمثل الأغلبية ، لا تعمل بكفاءة أو فعالية مع نواة الخلية المانحة 1,10. ومن المرجح أن تؤدي الفجوات التصنيفية الأكبر بين النوعين المستخدمين في نظام iSCNT إلى تفاقم هذه المشكلة؛ وقد تبين أن النسل الحي داخل الجنيسة المنتجة (نسل Bos gaurus و Bos indicus باستخدام بويضات Bos taurus) ، وكذلك النسل المنتج عبر SCNT التقليدي (مثل ذرية Ovis aries باستخدام بويضات Ovis aries) هي أوهمات (mtDNA من شخصين كان موجودا في هذه الحيوانات11،12،13). ومع ذلك ، فقد طوروا أبعد بكثير من أجنة SCNT بين الجنيسة14,15. يمكن أن يكون تبادل المعلومات بين الميتوكوندريا البويضة ونواة الخلية المانحة أكثر نجاحا في الجنين داخل الجنيسة منه في الجنين بين الجنيسة16.
كمية mtDNA في بويضة البقر الناضجة أكبر بحوالي 100 مرة من الكمية الموجودة في خلية جسدية واحدة12. يمكن أن يؤدي تقليل هذه النسبة إلى تشجيع الميتوكوندريا ذات الخلايا الجسدية على التكاثر داخل الجنين المعاد بناؤه ، مما يسمح بوجود عدد أكبر من الميتوكوندريا المنتجة16. وهذا بدوره يمكن أن يوفر المزيد من الطاقة لتلبية متطلبات الجنين النامي15. تشمل المحاولات السابقة التي بذلت لتقليل عدد نسخ mtDNA للبويضة أو الجنين التطبيق الكيميائي ، والتلاعب المجهري ، واستكمال البويضة أو الجنين بالميتوكوندريا الإضافية من أنواع الخلايا المانحة 16،17،18،19،20. ومع ذلك ، فإن التطبيق الكيميائي (مثل 2',3'-dideoxycytidine) ليس مثاليا للتطور الجنيني ، وقد قلل من أعداد نسخ mtDNA للبويضة بمقدار النصف تقريبا18. الحد من mtDNA البويضة السابقة عن طريق المعالجة الدقيقة قد أزال فقط ما معدله 64 ٪ من mtDNA17 في البويضة. على الرغم من أن مكملات الميتوكوندريا ذات الخلايا المانحة يمكن أن تكون خيارا قابلا للتطبيق ، إلا أن استخدامها لم ينتج بعد حيوانا حيا بين الأنواع في دراسات iSCNT21.
لم يتم بعد استخدام التقسيم الثنائي لتقليل عدد نسخ mtDNA للبويضة في الدراسات المنشورة. إن تقسيم البويضات بقصد دمج البلاستيدات مع خلية جسدية هو فرضية الاستنساخ اليدوي (HMC) ، والذي يستخدم عادة التقسيم الثنائي كوسيلة لإزالة الجسم القطبي والصفيحة الفوقية من بويضة الطور الثاني (MII). نجحت مؤسسة حمد الطبية في إنتاج ذرية في عدة أنواع، بما في ذلك الماعز والأبقار والخنازير والأغنام والخيول 22،23،24،25،26، ولكنها لا تتضمن عادة خطوة الطرد المركزي قبل التشريح. يسمح دمج الطرد المركزي عالي السرعة للبويضة بعزل الميتوكوندريا (وبالتالي mtDNA) في قطب واحد من البويضة ، والتي يمكن بعد ذلك تقسيمها باستخدام شفرة صغيرة لإزالة تلك الكسور الكثيفة من الميتوكوندريا. ويمكن بعد ذلك دمج اثنين من البلاستيدات المستنفدة للميتوكوندريا مع خلية جسدية، كما هو الحال في مؤسسة حمد الطبية، لتشكيل جنين أعيد بناؤه يحتوي على كمية أقل بكثير من الحمض النووي من أنواع البويضات.
السؤال الذي نحاول الإجابة عليه باستخدام هذا البروتوكول هو كيفية تقليل mtDNA في بويضة البقر من أجل إنتاج جنين قابل للحياة أعيد بناؤه يحتوي على mtDNA أقل غير متجانسة. في هذا البروتوكول ، تم طرد البويضات مركزيا وتقسيمها. تم حساب أرقام نسخ mtDNA للبويضة والبويضة السليمة لتحديد فعالية هذه التقنية في تقليل عدد نسخ mtDNA في بويضة البقر.
Protocol
يتبع البروتوكول التالي إرشادات رعاية الحيوانات والأخلاقيات التي تقدمها جامعة ولاية يوتا.
1. الإعداد الإعلامي
- قبل التعامل مع البويضات ، قم بإعداد المحاليل التالية ، كما هو موضح في الجدول 1: 400 ميكرولتر من محلول Hyaluronidase ، و 500 ميكرولتر من وسائط T2 ، و 1020 ميكرولتر من وسائط T20 ، و 800 ميكرولتر من وسائط T10.
- قسم وسائط T10 إلى بئرين من صفيحة من أربعة آبار ، 400 ميكرولتر لكل بئر. قم بتسمية بئر واحد ب "M" والبئر الثاني ب "MR". ضع في حاضنة CO2 بنسبة 5٪ حتى بعد القطع.
- تحضير 500 ميكرولتر من Cytochalasin B (CB) / السائل البيضاوي الاصطناعي مع HEPES (HSOF). Aliquot 50 ميكرولتر من محلول CB / HSOF في أنبوب طرد مركزي منفصل 1.5 مل.
- تحضير 40 ميكرولتر من محلول Pronase. جهاز طرد مركزي لمدة 30 ثانية على الأقل عند 2,680 × جم. مزيج 20 ميكرولتر من supernatant مع 20 ميكرولتر من T2 إلى أنبوب طرد مركزي جديد ؛ هذا يشكل محلول بروناس مخفف ، 5 ملغ / مل.
- تحضير 3 مل من HSOF. على لوحة البحث ، قم بإيداع أربع قطرات 400 ميكرولتر بشكل منفصل ؛ ضع هذه اللوحة تحت المجهر المجسم.
- تحضير 500 ميكرولتر من محلول CB / T20.
2. النضج في المختبر (IVM) من البويضات البقرية
- IVM: مجمعات الخلايا الركامية البويضية المستنشقة للاستزراع (COCs) عند 38.5 درجة مئوية في حاضنة CO2 بنسبة 5٪ لمدة 21 ساعة في طبق من أربعة آبار من وسائط النضج التي تحتوي على 10٪ FBS و 0.26 وحدة دولية / مل FSH و 100 U / mL البنسلين / الستربتومايسين.
- نفذ الخطوات التالية لتعرية البويضات.
- جمع العدد المطلوب من COCs باستخدام ماصة 200 ميكرولتر ، وإيداعها في الجزء السفلي من أنبوب الطرد المركزي 1.5 ميكرولتر.
- أضف نفس الحجم من 0.6 ملغم / مل هيالورونيداز إلى أنبوب الطرد المركزي مع البويضات (أي ، إذا كان حجم البويضات ووسائط IVM هو 100 ميكرولتر ، أضف 100 ميكرولتر من هيالورونيداز).
- ماصة الحل صعودا وهبوطا دون إنشاء فقاعات ، حتى تتم إزالة جميع الخلايا الركامية.
- تحقق من نضج البويضات.
- استخدم الماصة لإضافة 200 ميكرولتر من HSOF من إحدى قطرات HSOF الأربعة على لوحة البحث إلى محلول البويضة / الهيالورونيداز.
- انقل البويضات من قطرة هيالورونيداز / HSOF وضعها في 400 ميكرولتر غير مستخدمة من قطرة HSOF. اغسلها بقطرتين إضافيتين من HSOF للمساعدة في إزالة بقايا خلايا الهيالورونيداز والخلايا الركامية.
- باستخدام ماصة الفم (أو ماصة وطرف 10 ميكرولتر) والتكبير المجهري العالي ، قم بلف البويضات وتحديدها بناء على وجود الجسم القطبي.
- بعد فرز البويضات ، اجمع العدد المطلوب من بويضات MII المراد تقسيمها إلى قسمين ، وضعها في 400 ميكرولتر من قطرة HSOF.
ملاحظة: إذا كانت البويضات خارج الحاضنة لأكثر من 30 دقيقة، يمكن وضع البويضات مرة أخرى في بئر من وسائط النضج ووضعها في حاضنة يتم التحكم فيها بواسطة CO2 للراحة لمدة 30 دقيقة على الأقل. الحد من عدد البويضات المراد تقسيمها إلى كمية يمكن الانتهاء من تقسيمها في حوالي 30 دقيقة لتقليل الوقت خارج الحضانة. إذا كان من المقرر دمج البلاستيدات مع خلية جسدية ، وتنشيطها ، وزراعتها كأجنة ، فيجب استئصال البويضات في هذا الوقت.
3. الطرد المركزي للبويضات
ملاحظة: إذا تم وضع البويضات في الحاضنة في وسائط النضج، فانقلها إلى قطرة HSOF التي تم جمعها منها مؤخرا.
- باستخدام ماصة الفم ، اجمع البويضات الناضجة المختارة من قطرة HSOF ، وضعها في أنبوب 1.5 مل يحتوي على 50 ميكرولتر من محلول HSOF / CB. الطرد المركزي للبويضات عند 15000 × غرام لمدة 12 دقيقة.
ملاحظة: ليس من الضار أن تكون الفقاعات موجودة في أنبوب جهاز الطرد المركزي. - أثناء طرد البويضات مركزيا ، قم بإعداد لوحة المقطع الثنائي.
- اصنع النمط كما هو موضح في الشكل 1 على غطاء طبق بتري 60 مم (20 ميكرولتر لكل قطرة) ، وقم بتغطية القطرات بالكامل بالزيت المعدني.
- باستخدام علامة رفيعة الرؤوس ، ضع علامة على الخطوط الموجودة أسفل الطبق ، كما هو موضح في الشكل 2.
- ارسم صندوقا حول قطرة البروناس وخطا بين قطرات CB/T20 والصف السفلي من قطرات T20.
- قم بتغطية الطبق بغطاء غير شفاف حتى يكتمل الطرد المركزي لمنع تغيرات الأسمولية للقطرات الدقيقة.
- بمجرد اكتمال الطرد المركزي ، استخدم ماصة 200 ميكرولتر لجمع البويضات داخل المحلول ، ونقلها إلى جزء فارغ من لوحة بحث جديدة مع أربع قطرات HSOF 400 ميكرولتر.
- جمع وغسل البويضات من خلال قطرات HSOF الأربعة.
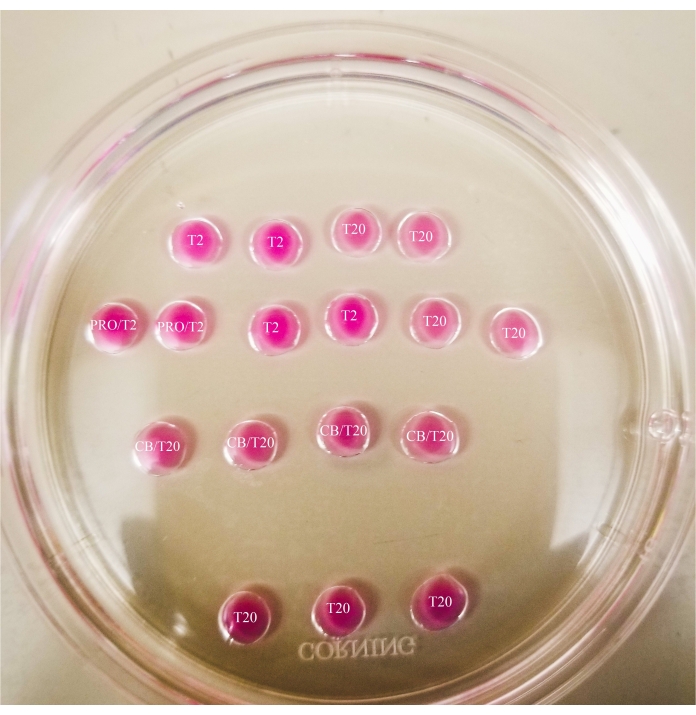
الشكل 1: لوحة المقطع الثنائي. جميع القطرات المعروضة لها حجم 20 ميكرولتر. يبلغ قطر اللوحة 60 ملم. تم تغطية قطرات بالكامل بالزيوت المعدنية. سيتم وضع البويضات أولا في الجزء العلوي والأيسر من T2 قطرة (يشار إليها هنا بنجمة). PRO / T2: 10 ميكرولتر من pronase و 10 ميكرولتر من T2 ، مجتمعة قبل إنشاء microdrops. CB / T20: 1 ميكرولتر من السيتوكالاسين B لكل 1 مل من T20 ، مجتمعة قبل إنشاء microdrops. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
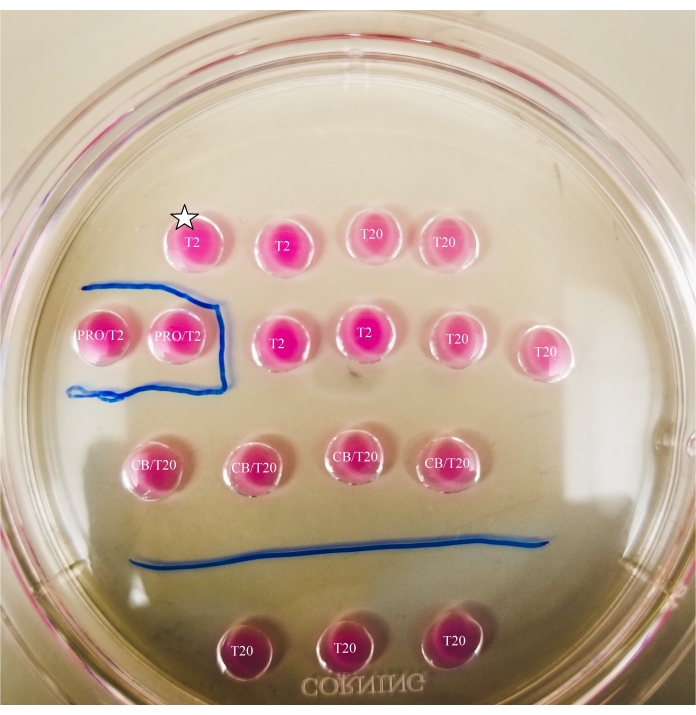
الشكل 2: لوحة ثنائية المقطع مميزة. يتم رسم الخطوط بعلامة رفيعة الرؤوس في الجزء السفلي من اللوحة ، لتوفير مراجع الموقع للملاحظات وعمليات نقل البويضات والبلاستيدات التي تتم تحت المجهر. سيتم وضع البويضات أولا في الجزء العلوي والأيسر من T2 قطرة (يشار إليها هنا بنجمة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. إعداد البويضة للاستئصال الثنائي
ملاحظة: تتضمن العملية التالية تحضير البويضات للاستئصال الثنائي.
- قم بتشغيل مرحلة التسخين إلى 37 درجة مئوية.
- استخدم ماصة الفم لنقل البويضات التي يتم طردها مركزيا من قطرة HSOF إلى أعلى يسار قطرة T2 من الصفيحة ثنائية المقطع ، ثم اغسل البويضات من خلال القطرات الثلاث التالية في الصف العلوي (T2 ، T20 ، T20).
- قم بإيداع البويضات في واحدة من قطرات pronase ، مما يضمن وجود اتصال ضئيل أو معدوم بينهما.
ملاحظة: يمكن أن تستغرق إزالة زونا بيلوسيدا كميات متفاوتة من الوقت ، ولكنها تحدث عادة بين 30-120 ثانية باستخدام مرحلة التسخين. عدم وجود مرحلة التدفئة سوف تمتد هذه المرة. - راقب البويضات حتى يكون هناك تشوه واضح في zonae pellucidae (انظر الشكل 3).
- بمجرد أن تصبح منطقة البويضة الواحدة مشوهة ، انقل تلك البويضة إلى قطرة T2 المجاورة. كرر ذلك عندما تصبح البويضات الإضافية مشوهة ، حتى تتم إزالة جميع البويضات من البروناس ووضعها في قطرة T2.
- راقب البويضات حتى تبقى طبقة رقيقة فقط من منطقة البيلوسيدا.
- اغسل البويضات من خلال القطرات الثلاث التالية داخل الصف (T2 ، T20 ، T20) ، ثم قم بإيداعها في خطوط رأسية داخل قطرات CB / T20 (انظر الشكل 4).
- ابدأ بعدد أقل من البويضات في الخطوط الرأسية وقم بزيادة عدد البويضات لكل قطرة مع تقدم مهارات القطع.
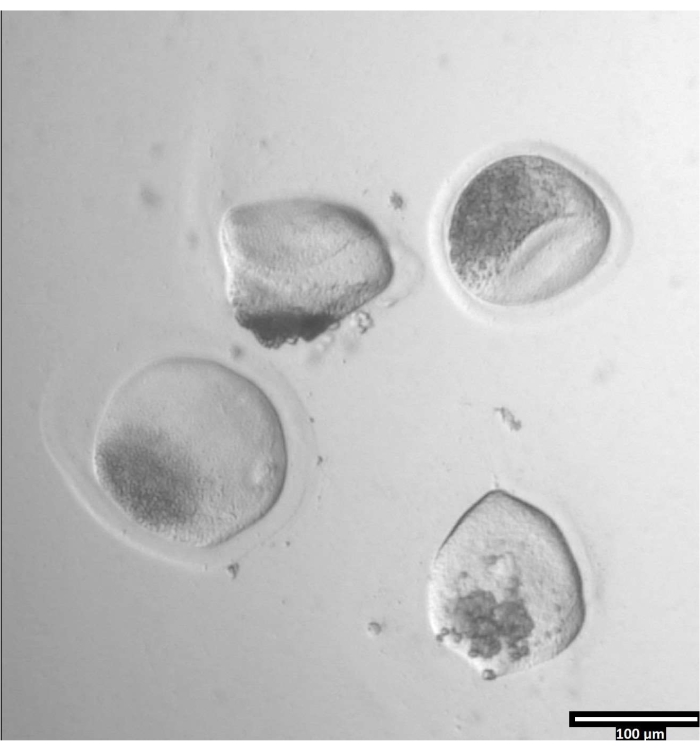
الشكل 3: إزالة زونا بيلوسيدا باستخدام البروناس. (80x) ستبدأ البويضة زونا بيلوسيدا في الظهور مشوهة عندما يؤثر البروناس على زونا بيلوسيدا بما يكفي لنقل البويضة إلى قطرة T2 المجاورة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: اتجاه البويضات في قطرات ثنائية القطع. (80x) تترسب البويضات الخالية من زونا في اتجاه شبه رأسي داخل كل قطرة CB / T20 قبل القطع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تقسيم البويضات
- ركز على أول قطرة CB/T20 (ثنائية القطع) في أقصى اليسار تحتوي على البويضات، واستخدم ماصة الفم لتدوير البويضات، بحيث يكون الجزء الكثيف من الميتوكوندريا من كل بويضة إما متجها نحو ذراع المجهر أو بعيدا عنه.
ملاحظة: لن يحتوي الجزء الكثيف من الميتوكوندريا على دهون، والتي تظهر كأحلك جزء من البويضة بعد الطرد المركزي. - ضع طرف الشفرة الدقيقة على يسار البويضة العلوية ، بما يتماشى مع المساحة الموجودة فوق الجزء الكثيف من الميتوكوندريا مباشرة. الحفاظ على طرف الشفرة في نفس المكان ، قم بخفض الشفرة بعناية لقطع كل الطريق من خلال البويضة.
- التأكد من أن البلاست الكثيف بالميتوكوندريا والأوبلاست المختزل بالميتوكوندريا متشابهان في الحجم ؛ يجب أن يقطع التقسيم الثنائي كل بويضة إلى نصفين لإنتاج اثنين من البلاستيدات البيضاء.
ملاحظة: قد تختلف الأحجام المقارنة للأوبلاستيدات المنتجة من بويضة واحدة بناء على أهداف البحث؛ إذا كان من المقرر دمج البلاستيدات المختزلة بالميتوكوندريا مع خلية جسدية ، فيجب أن يكون حجمها أكبر من البلاستيدات الكثيفة بالميتوكوندريا. - تأكد من أن الشفرة تقسم البويضة فوق الجزء الكثيف من الميتوكوندريا وأسفل الجزء الكثيف من الدهون ، في أوضح جزء من بويضة الطرد المركزي.
- التأكد من أن البلاست الكثيف بالميتوكوندريا والأوبلاست المختزل بالميتوكوندريا متشابهان في الحجم ؛ يجب أن يقطع التقسيم الثنائي كل بويضة إلى نصفين لإنتاج اثنين من البلاستيدات البيضاء.
- عند رفع الشفرة ، تأكد من الحفاظ على نفس الخط ، وأن طرف الشفرة يبقى في نفس المكان ، ثم ارفع الطرف برفق من اللوحة.
- كرر خطوات الاستئصال الثنائي لجميع البويضات خلال قطرة المقطع الثنائي الأولى. إذا كانت البويضات موجودة في قطرات إضافية ، فقم بتوجيه البويضات المتبقية وتقسيمها.
- باستخدام ماصة الفم ، اجمع البلاستيدات المختزلة بالميتوكوندريا من أول قطرة مقطعة. ضعها في قطرة T20 اليسرى الموجودة في الصف السفلي من اللوحة. كرر ذلك لجميع قطرات المقطع الثنائي المتبقية.
ملاحظة: ستحتوي البلاستيدات المختزلة بالميتوكوندريا على دهون أغمق لونا من بقية البويضات. - باستخدام ماصة الفم ، اجمع البلاستيدات كثيفة الميتوكوندريا من أول قطرة ثنائية القطع. ضعها في قطرة T20 اليمنى الموجودة في الصف السفلي من اللوحة. كرر ذلك لجميع قطرات المقطع الثنائي المتبقية.
ملاحظة: سيكون للمناطق كثيفة الميتوكوندريا تكتل مرئي من العضيات التي ستكون رمادية فاتحة في المظهر. - استرجع طبق T10 المكون من أربعة آبار من الحاضنة. باستخدام ماصة فم، حرك جميع البلاستيدات المختزلة بالميتوكوندريا إلى البلاستيدات المسماة جيدا "MR"، وانقل البلاستيدات كثيفة الميتوكوندريا إلى البلاستيدات المصنفة جيدا "M".
- ضع اللوحة ذات الأربعة آبار مرة أخرى في الحاضنة التي يتم التحكم فيها بواسطة CO2. اسمح للأوبلاستيدات بالراحة لمدة 30 دقيقة على الأقل قبل تحديد كمية mtDNA.
6. القياس الكمي للحمض النووي الريبوزي منقوص الأكسجين
- استخدم مجموعة أدوات استخراج الحمض النووي المصممة لاستخراج المواد من عينة صغيرة لاستخراج الحمض النووي من عينات فردية (بويضات مفردة ، أوبلاستيدات واحدة كثيفة الميتوكوندريا ، أوبلاستيدات واحدة مستنفدة للميتوكوندريا).
- استخدم طريقة قياس كمية الحمض النووي المختارة لضمان استخراج الحمض النووي بنجاح من كل عينة. إذا لم يكتمل تفاعل البوليميراز المتسلسل الكمي (qPCR) في ذلك الوقت ، فقم بتجميد الحمض النووي المستخرج في أنبوب ملصق في ثلاجة -80 درجة مئوية.
- أداء qPCR
- ارجع إلى الجدول 2 لتحديد حجم كل كاشف لإضافته إلى كل أنبوب qPCR ، إلى جانب تسلسلات التمهيدي. تم تصميم هذه الاشعال لتضخيم منطقة 12S من mtDNA البقري.
- اضبط وقت تمسخ الأولي لمدة 10 دقائق ، تليها 35 دورة من: 30 ثانية من تمسخ عند 94 درجة مئوية ، و 15 ثانية من التلدين عند 60 درجة مئوية ، و 15 ثانية من التمديد عند 72 درجة مئوية. عند اكتمال التفاعل، سجل قيم عتبة الدورة (Ct).
ملاحظة: من أجل الحصول على قيم عدد نسخ mtDNA النسبية، يجب إنتاج منحنى قياسي باستخدام عينات تحتوي على كميات معروفة من أرقام نسخ mtDNA، والتي تزداد أضعافا مضاعفة. ثم يجب معالجة قيم عتبة الدورة باستخدام الصيغ التالية لتحديد أرقام نسخ mtDNA النسبية. - احصل على تركيز الحمض النووي باستخدام المعادلة أدناه:
تركيز الحمض النووي = (10 (Ct-intercept/slope)) × الحجم المختبر - احصل على رقم النسخة باستخدام المعادلة أدناه:
رقم النسخة =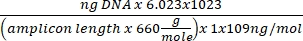
- احصل على رقم النسخة باستخدام المعادلة أدناه:
رقم النسخ لكل خلية = 2 ×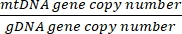
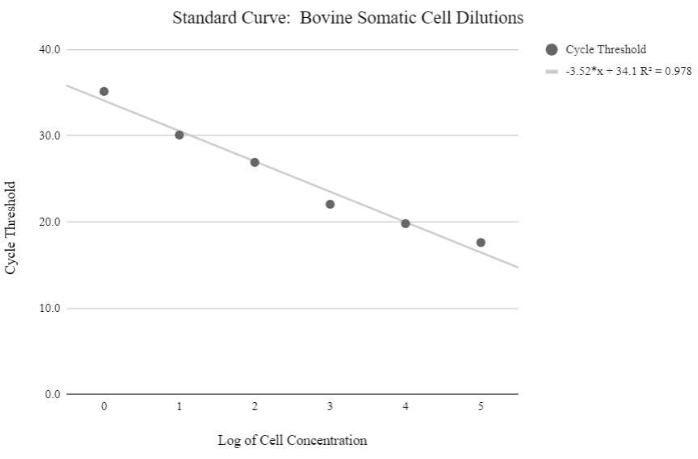
الشكل 5: منحنى الحمض النووي الريبوزي منقوص الأكسجين MTDNA للخلايا الجسدية. تم إنشاء هذا المنحنى القياسي من خلال القياس الكمي mtDNA للتركيزات اللوغاريتمية للخلايا الجسدية البقرية باستخدام كواشف qPCR والبرنامج كما هو موضح في خطوة البروتوكول 6.3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تستخدم نتائج PCR الكمية (qPCR) لتحديد الكميات النسبية من mtDNA الموجودة في كل ooplast. تم تصميم التفاعل الموصوف لتضخيم منطقة 12S من mtDNA البقري.
إذا نجح التقسيم الثنائي ، فإن العينات من البويضات الكاملة والبلاستيدات كثيفة الميتوكوندريا سيكون لها قيم Ct مماثلة. سيكون للعينات من البل...
Discussion
الطرق المستخدمة سابقا لتقليل أعداد نسخ mtDNA في البويضات لها عيوبها الخاصة. إزالة الميتوكوندريا القائمة على المعالجة الدقيقة من البويضات تقلل من أعداد نسخ mtDNA بمعدل 64٪ 27. تتضمن الطريقة الفريدة ، التي كانت تستخدم سابقا للاستئصال ، استخدام ماصات باستور ذات القطر الصغير وتقسيم بو?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يود المؤلفون أن يشكروا زملائهم في جامعة ولاية يوتا ، وباحثي العلوم الإنجابية في حديقة سان دييغو ، والدكتورة ريبيكا كريشر في Genus PLC.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tubes | Fisher Scientific | 5408129 | |
| 60 mm dish | Sigma-Aldrich | D8054 | |
| Centrifuge | Eppendorf | 5424 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Fetal Bovine Serum | Sigma-Aldrich | F2442 | |
| M199 Media | Sigma-Aldrich | M4530 | |
| Mineral Oil | Sigma-Aldrich | M8410 | |
| Mini Centrifuge | SCILOGEX | D1008 | |
| mtDNA Primer: Forward (12S) | GGGCTACATTCTCTACACCAAG | ||
| mtDNA Primer: Reverse (12S) | GTGCTTCATGGCCTAATTCAAC | ||
| NanoDrop Spectrophotometer | Thermo Scientific | ND2000 | |
| Opthalmic Scalpel with Aluminum Handle | PFM Medical | 207300633 | Microblade for bisection |
| Protease/pronase | Sigma-Aldrich | P5147 | |
| QIAamp DNA Micro Kit | Qiagen | 56304 | |
| QuantStudio™ 3 - 96-Well 0.2-mL | ThermoFisher | A28567 | |
| Search plate | Fisher Scientific | FB0875711A | |
| SYBR Green qPCR Master Mix | ThermoFisher | K0221 | qPCR master mix |
| Synthetic Oviductal Fluid with HEPES (HSOF) | |||
| ThermoPlate | Tokai Hit | TPi-SMZSSX | Heating stage |
References
- Loi, P., Modlinski, J. A., Ptak, G. Interspecies somatic cell nuclear transfer: A salvage tool seeking first aid. Theriogenology. 76 (2), 217-228 (2011).
- Wani, N. A., Vettical, B. S., Hong, S. B. First cloned Bactrian camel (camelus bactrianus) calf produced by interspecies somatic cell nuclear transfer: A step towards preserving the critically endangered wild Bactrian camels. PLOS ONE. 12 (5), 0177800 (2017).
- Oh, H. J., et al. Cloning endangered gray wolves (canis lupus) from somatic cells collected postmortem. Theriogenology. 70 (4), 638-647 (2008).
- Srirattana, K., et al. Full-term development of gaur-bovine interspecies somatic cell nuclear transfer embryos: Effect of trichostatin a treatment. Cellular Reprogramming. 14 (3), 248-257 (2012).
- Kwon, D. K., et al. Blastocysts derived from adult fibroblasts of a rhesus monkey (macaca mulatta) using interspecies somatic cell nuclear transfer. Zygote. 19 (3), 199-204 (2011).
- Lee, E., et al. Production of cloned sei whale (Balaenoptera borealis) embryos by interspecies somatic cell nuclear transfer using enucleated pig oocytes. Journal of Veterinary Science. 10 (4), 285 (2009).
- Lorthongpanich, C., Laowtammathron, C., Chan, A. W., Kedutat-Cairns, M., Parnpai, R. Development of interspecies cloned monkey embryos reconstructed with bovine enucleated oocytes. Journal of Reproduction and Development. 54 (5), 306-313 (2008).
- Hong, S. G., et al. Production of transgenic canine embryos using interspecies somatic cell nuclear transfer. Zygote. 20 (1), 67-72 (2011).
- Stewart, J. B., Chinnery, P. F. The dynamics of mitochondrial DNA heteroplasmy: Implications for human health and disease. Nature Reviews Genetics. 16 (9), 530-542 (2015).
- Takeda, K. Mitochondrial DNA transmission and confounding mitochondrial influences in cloned cattle and pigs. Reproductive Medicine and Biology. 12 (2), 47-55 (2013).
- Lanza, R. P., et al. Cloning of an endangered species (Bos Gaurus) using interspecies nuclear transfer. Cloning. 2 (2), 79-90 (2000).
- Evans, M. J., et al. Mitochondrial DNA genotypes in nuclear transfer-derived cloned sheep. Nature Genetics. 23 (1), 90-93 (1999).
- Meirelles, F. V., et al. Complete replacement of the mitochondrial genotype in a Bos indicus calf reconstructed by nuclear transfer to a Bos taurus oocyte. Genetics. 158 (1), 351-356 (2001).
- Beyhan, Z., Iager, A. E., Cibelli, J. B. Interspecies nuclear transfer: Implications for embryonic stem cell biology. Cell Stem Cell. 1 (5), 502-512 (2007).
- Lagutina, I., Fulka, H., Lazzari, G., Galli, C. Interspecies somatic cell nuclear transfer: advancements and problems. Cellular Reprogramming. 15 (5), 374-384 (2013).
- Jiang, Y., et al. Interspecies somatic cell nuclear transfer is dependent on compatible mitochondrial DNA and reprogramming factors. PLoS ONE. 6 (4), 14805 (2011).
- Chiaratti, M. R., et al. Embryo mitochondrial DNA depletion is reversed during early embryogenesis in cattle. Biology of Reproduction. 82 (1), 76-85 (2010).
- Spikings, E. C., Alderson, J., John, J. C. Regulated mitochondrial DNA replication during oocyte maturation is essential for successful porcine embryonic development. Biology of Reproduction. 76 (2), 327-335 (2007).
- Cagnone, G. L., et al. Restoration of normal embryogenesis by mitochondrial supplementation in pig oocytes exhibiting mitochondrial DNA deficiency. Scientific Reports. 6 (1), 1-15 (2016).
- Spikings, E. C., Alderson, J., John, J. C. Regulated mitochondrial DNA replication during oocyte maturation is essential for successful porcine embryonic development. Biology of Reproduction. 76 (2), 327-335 (2007).
- Ferreira, A. F., et al. Does supplementation with mitochondria improve oocyte competence? A systematic review. Reproduction. 161 (3), 269-287 (2021).
- Bhat, M. H., et al. Live birth of a pashmina goat kid after transfer of handmade cloned embryos. Journal of Reproduction and Development. , (2019).
- Tecirlioglu, R. T., et al. Birth of a cloned calf derived from a vitrified hand-made cloned embryo. Reproduction, Fertility and Development. 15 (7), 361 (2003).
- Zhang, P., et al. Handmade cloned transgenic piglets expressing the nematode fat-1 gene. Cellular Reprogramming. 14 (3), 258-266 (2012).
- Zhang, P., et al. Handmade cloned transgenic sheep rich in omega-3 fatty acids. PLOS ONE. 8 (2), 55941 (2013).
- Lagutina, I., et al. Somatic cell nuclear transfer in horses: Effect of oocyte morphology, embryo reconstruction method and donor cell type. Reproduction. 130 (4), 559-567 (2005).
- Chiaratti, M. R., et al. Embryo mitochondrial DNA depletion is reversed during early embryogenesis in cattle. Biology of Reproduction. 82 (1), 76-85 (2010).
- Hosseini, S. M., et al. and efficient method of manual oocyte enucleation using a pulled pasteur pipette. In Vitro Cellular and Developmental Biology - Animal. 49 (8), 569-575 (2013).
- Zampolla, T., Spikings, E., Rawson, D., Zhang, T. Cytoskeleton proteins F-actin and tubulin distribution and interaction with mitochondria in the granulosa cells surrounding stage III zebrafish (danio rerio) oocytes. Theriogenology. 76 (6), 1110-1119 (2011).
- International Union for Conservation of Nature. The IUCN Red List of Threatened Species. International Union for Conservation of Nature. , (2021).
- Berg, D. K., Li, C., Asher, G., Wells, D. N., Oback, B. Red deer cloned from antler stem cells and their differentiated progeny. Biology of Reproduction. 77 (3), 384-394 (2007).
- Gómez, M. C., et al. Birth of African wildcat cloned kittens born from domestic cats. Cloning and Stem Cells. 6 (3), 247-258 (2004).
- Lanza, R. P., et al. Cloning of an endangered species (Bos gaurus) using interspecies nuclear transfer. Cloning. 2 (2), 79-90 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved