Method Article
تقديم العلاجات القلبية في نموذج احتشاء عضلة القلب الخنازير
* These authors contributed equally
In This Article
Summary
يصف البروتوكول الحالي ثلاث طرق لإدارة العوامل العلاجية القلبية في نموذج الخنازير. تلقت إناث الخنازير البرية العلاج من خلال: (1) بضع الصدر والحقن عبر اللب ، (2) حقن الشغاف القائم على القسطرة ، أو (3) التسريب في الوريد عبر مضخة صغيرة تناضحية الوريد الوداجي.
Abstract
احتشاء عضلة القلب هو أحد الأسباب الرئيسية للوفاة والعجز في جميع أنحاء العالم ، وهناك حاجة ملحة لاستراتيجيات جديدة لحماية القلب أو التجديد. أحد المكونات الأساسية لتطوير الأدوية هو تحديد كيفية إعطاء علاج جديد. تعتبر النماذج الحيوانية الكبيرة ذات الصلة من الناحية الفسيولوجية ذات أهمية حاسمة في تقييم جدوى وفعالية استراتيجيات التسليم العلاجي المختلفة. نظرا لتشابهها مع البشر في فسيولوجيا القلب والأوعية الدموية ، وتشريح الأوعية الدموية التاجية ، ونسبة وزن القلب إلى وزن الجسم ، تعد الخنازير واحدة من الأنواع المفضلة في التقييم قبل السريري للعلاجات الجديدة لاحتشاء عضلة القلب. يصف البروتوكول الحالي ثلاث طرق لإدارة العوامل العلاجية القلبية في نموذج الخنازير. بعد احتشاء عضلة القلب الناجم عن طريق الجلد ، تلقت إناث الخنازير البرية علاجا بعوامل جديدة من خلال: (1) بضع الصدر والحقن عبر القلب ، (2) حقن الشغاف القائم على القسطرة ، أو (3) التسريب في الوريد عبر مضخة صغيرة تناضحية الوريد الوداجي. الإجراءات المستخدمة لكل تقنية قابلة للتكرار ، مما يؤدي إلى توصيل الأدوية القلبية بشكل موثوق. يمكن تكييف هذه النماذج بسهولة لتناسب تصميمات الدراسة الفردية ، ويمكن استخدام كل من تقنيات التسليم هذه للتحقيق في مجموعة متنوعة من التدخلات الممكنة. لذلك ، تعد هذه الطرق أداة مفيدة للعلماء الانتقاليين الذين يتبعون مناهج بيولوجية جديدة في إصلاح القلب بعد احتشاء عضلة القلب.
Introduction
مرض الشريان التاجي (CAD) واحتشاء عضلة القلب المرتبط بارتفاع ST (STEMI) هي الأسباب البارزة للوفاة في جميع أنحاء العالم. في العقدين الماضيين ، تم إحراز تقدم كبير في الحد من الوفيات داخل المستشفى للمرضى الذين يعانون من STEMI ، من خلال ظهور التدخل التاجي عن طريق الجلد ، والعلاجات المحللة للفبرين ، وتوحيد خوارزميات العلاج لضمان تحقيق إعادة التروية في الوقت المناسب1،2،3. على الرغم من ذلك ، لا تزال المراضة المرتبطة ب STEMI عبئا كبيرا ، مما يخلق حاجة كبيرة لتطوير علاجات جديدة لحماية القلب والتجديد 2,3. أحد المكونات الأساسية للتطوير العلاجي هو تحديد كيفية إعطاء علاج جديد4. يجب مطابقة سلامة وفعالية وجدوى كل طريقة مع خصائص العلاج نفسه.
تعتبر النماذج الحيوانية الكبيرة ذات الصلة من الناحية الفسيولوجية حاسمة في تقييم هذه السمات لاستراتيجيات التسليم العلاجية المختلفة5. نظرا لتشابهها مع البشر في فسيولوجيا القلب والأوعية الدموية ، وتشريح الأوعية الدموية التاجية ، ونسبة وزن القلب إلى وزن الجسم ، تعد الخنازير واحدة من الأنواع المفضلة في التقييم قبل السريري للعلاجات الجديدة لاحتشاء عضلة القلب6. لقد استخدمنا سابقا نموذج STEMI للخنزير لإثبات القدرة التعويضية للعلاج بالبروتين المؤتلف7 ، ونواصل التحقيق في العلاجات الدوائية والخلوية والجينية الجديدة باستخدام هذا النموذج. هنا ، يتم وصف ثلاث تقنيات للإعطاء العلاجي المستخدمة في نماذج الخنازير بعد إنشاء احتشاء: بضع الصدر والحقن عبر النخاب ، وحقن الشغاف عن طريق الجلد ، وزرع مضخة صغيرة تناضحية ووديجية. تتيح الطريقتان الأوليان توصيل الأنسجة المحلية ، وتقليل الجرعات المطلوبة ، والتأثيرات غير المستهدفة ، والتمثيل الغذائي الكبدي الأول8،9،10. تسمح المضخة الصغيرة التناضحية بالتسليم المستمر للدواء ذي عمر النصف القصير ، مما يلغي الاعتماد على مضخة التسريب والقنية الوريدية الحاصلة على براءة اختراع ، وكلاهما يمثل تحديا في النماذج الحيوانية الكبيرة.
من خلال وصف هذه التقنيات ، من المأمول أن تساعد هذه المقالة العلماء الانتقاليين في التحقيق في العوامل الجديدة لحماية القلب أو التجدد بعد احتشاء عضلة القلب في النماذج الحيوانية الكبيرة.
Protocol
تم إجراء جميع التجارب وفقا ل "القانون الأسترالي لرعاية واستخدام الحيوانات للأغراض العلمية" وتمت الموافقة عليها من قبل لجنة أخلاقيات الحيوان في منطقة غرب سيدني الصحية المحلية. تم استخدام جيلات بيضاء كبيرة x landrace قبل سن البلوغ ، تزن 18-20 كجم ، في هذه الدراسة.
1. تربية الحيوانات
- إيواء الحيوانات وفقا للوائح لجنة أخلاقيات الحيوان المحلية.
ملاحظة: يتم إيواء الحيوانات المدرجة في هذا البروتوكول بشكل فردي لتجنب القتال والإصابة وضمان عدم وجود منافسة على الطعام. ومع ذلك ، يمكن لجميع الحيوانات رؤية وسماع وشم رائحة محددة. تحتوي أقلامهم على أرضيات خرسانية لسهولة التنظيف ، ولها جزء محمي داخلي وخارجي. يتم تزويد الخنازير بفراش من القش في الجزء الداخلي و "ألعاب" إثراء في الجزء الخارجي.
2. التخدير والتخدير العام
- التخدير
- تأكد من صيام الحيوان لمدة 12 ساعة على الأقل قبل البدء في أي تخدير شديد أو تخدير عام.
- إذا لم يكن لدى الحيوان وصول الأوعية الدموية في شكل خط مركزي ، فاستخدم بروتوكول مهدئ عضلي.
- يتكون التخدير العضلي من 8 مغ/كغ من الكيتامين، و0.3 مغ/كغ من الميدازولام، و0.2 مغ/كغ من الميثادون، و10 ميكروغرام/كغ من ميديتوميدين (انظر جدول المواد). إدارة هذا الخليط في العضلات المحورية للحيوان مع إبرة 21 غرام. في المتوسط ، تستغرق الحيوانات من 5 إلى 10 دقائق لتصبح مخدرة بشدة.
ملاحظة: الخنزير المجهد أكثر مقاومة للتخدير. تأكد من أن المعالج الهادئ والواثق يخدر الحيوان وأن الحيوان لا يتعرض للتوتر بشكل غير مبرر. إذا أصبح الحيوان متوترا ، فمن الأفضل تركه بمفرده لمدة 5-10 دقائق والمحاولة مرة أخرى. - قم بإجراء التخدير الوريدي إذا كان هناك خط مركزي في مكانه وبراءة اختراع. يتكون التخدير الوريدي من 2 مغ/كغ من الكيتامين، و0.2 مغ/كغ من الميدازولام، و0.2 ملغ/كغ من الميثادون، و2 ميكروغرام/كغ من ميديتوميدين.
- اغسل الخط الوريدي ب 0.9٪ كلوريد الصوديوم أولا لضمان المباح. ثم ، ادفع ببطء نصف المحقنة المختلطة عبر الخط واغسلها بنسبة 0.9٪ كلوريد الصوديوم.
- مراقبة الحيوان ، الذي يجب أن يكون مخدرا بشدة في غضون 20-30 ثانية. إذا لم يتم تخدير الحيوان بعد ، فقم بغسل النصف المتبقي من المحقنة ، كما هو موضح في الخطوة 2.1.5.
- الوصول إلى الأوعية الدموية
- بمجرد تخديره بشكل مناسب ، انقل الخنزير إلى غرفة العمليات.
- قبل أكسجة الخنزير بقناع للوجه ومعدل تدفق أكسجين 5 لتر / دقيقة. قم بتوصيل مقياس التأكسج النبضي بذيل الخنزير أو أذنيه أو لسانه لمراقبة الحيوان طوال الوقت.
- باستخدام قنية 22 أو 24 G ، يمكنك الوصول إلى كل من أوردة الأذن الهامشية اليسرى واليمنى وتأمينها بشريط.
- التخدير العام
- ضع الخنزير في راقد القصة.
- يتم تطبيق 1-3 ملغم/كغ من البروبوفول (انظر جدول المواد) عن طريق الوريد كدفعة بطيئة معايرة. اطلب من مساعد أن يمسك فم الحيوان مفتوحا (يجب أن يكون الفك متراخيا في هذه المرحلة) ويمد الرقبة.
- استخدم منظار الحنجرة (انظر جدول المواد) لخفض قاعدة اللسان ولسان المزمار لفضح الغضاريف الأريتينية للحنجرة.
- مرر أنبوبا رغاميا مشحما (مقاس 5.5 أو 6.0 ؛ انظر جدول المواد) مع نمط من خلال الغضاريف الأرتينية إلى القصبة الهوائية. في بعض الأحيان ، قد تشعر بالمقاومة أثناء المرور عبر الحنجرة. يمكن مواجهة ذلك بالدوران اللطيف للأنبوب الرغامي. إذا كان الحيوان يقاوم التنبيب ، فقم بتطبيق المزيد من البروبوفول عن طريق الوريد.
- إزالة stylet من أنبوب القصبة الهوائية. قم بنفخ سوار الأنبوب الرغامي حتى تقتنع بعدم وجود تسرب للهواء حول الأنبوب. بشكل عام ، مطلوب 4-6 مل من الهواء ، على الرغم من أن الحجم يمكن أن يختلف اعتمادا على حجم الأنبوب والحيوان.
- تأمين الأنبوب الرغامي خلف آذان الحيوان.
- قم بتوصيل الحيوان بدائرة مخدر لإعادة التنفس باستخدام وظيفة جهاز التنفس الصناعي للتحكم في مستوى الصوت. عندما يكون الحيوان متصلا ، قم بإيقاف تشغيل جهاز التنفس الصناعي.
ملاحظة: تأكد من أن صمام حد الضغط القابل للتعديل (APL) أو "الصمام المنبثق" مفتوح في جميع الأوقات. يمكن أن يؤدي عدم ترك الصمام مفتوحا إلى رضح ضغطي مميت للحيوان. - تقليل معدل تدفق الأكسجين في دائرة التخدير إلى 2 لتر / دقيقة.
- اضبط جهاز التنفس الصناعي بالضغط الإيجابي على وضع "التحكم في مستوى الصوت". اضبط حجم المد والجزر على 10 مل / كجم ومعدل التنفس على 20 نفسا / دقيقة. تأكد من ضبط نسبة الشهيق: الزفير على 1: 2.
- طوال العملية ، تعامل مع معدل التنفس للتأكد من أن ثاني أكسيد الكربون في نهاية المد والجزر يقع بين 35-50 مم زئبق.
ملاحظة: يجب ألا يتجاوز ضغط الشهيق 20 سم H2O. الزيادات في الضغط الشهيقي تدفع إلى التحقيق في مكامن الخلل أو انسداد الأنابيب. للتخفيف من الضغوط المتزايدة غير المرتبطة بالأنابيب ، يمكن تقليل نسبة الشهيق: الزفير إلى 1: 1.5 ، وتقليل حجم المد والجزر. - إذا كان الحيوان مستقرا ديناميكيا ، فاحتفظ به بتخدير استنشاقي. إذا لم يكن الحيوان مستقرا من الناحية الديناميكية الدموية ، فاحتفظ به بالتخدير الوريدي الكلي ، كما هو موضح في الخطوة 2.3.14.
- إذا كان سيتم إعطاء الحيوان تخديرا مستنشقا ، فابدأ ب 2.5٪ إيزوفلوران من لحظة توصيل دائرة التخدير لأول مرة.
- خلال ال 30 دقيقة التالية ، فطم الحيوان تدريجيا إلى 1.5٪ من الإيزوفلوران المستنشق. الحفاظ على الحيوان على 1.5 ٪ isoflurane حتى نهاية الإجراء.
- قم بتقييم عمق التخدير كل 10 دقائق عن طريق فحص ردود الفعل الجفنية واختبار نغمة الفك. اضبط الأيزوفلوران حسب الحاجة للحفاظ على عمق التخدير.
- إذا كان الحيوان غير مستقر ديناميكيا ، فاحتفظ به بالتخدير الوريدي الكلي ، مما يسمح بتحكم أكبر في عمق التخدير دون مضاعفات القلب والأوعية الدموية المرتبطة بعوامل التخدير المستنشقة.
- قم بإعداد إما مضخات المحاقن أو مضخات السوائل القياسية باستخدام البروبوفول والفنتانيل والميدازولام. قم بتوصيل هذه بالحيوان عبر خط مشترك.
ملاحظة: يمكن تشغيل البروبوفول عند 0.1-0.6 مجم / كجم / دقيقة ، ويمكن تشغيل الفنتانيل عند 1-5 ميكروغرام / كجم / ساعة ، ويمكن تشغيل الميدازولام عند 0.05-0.2 مجم / كجم / ساعة. - كما هو الحال مع التخدير المستنشق، قم بمعايرة هذه الأدوية لتأثيرها طوال فترة التخدير للحفاظ على عمق التخدير المناسب.
- قم بإعداد إما مضخات المحاقن أو مضخات السوائل القياسية باستخدام البروبوفول والفنتانيل والميدازولام. قم بتوصيل هذه بالحيوان عبر خط مشترك.
- توفير دعم السوائل عن طريق الوريد مع 0.9٪ كلوريد الصوديوم أو محلول هارتمان (انظر جدول المواد) بمعدل 5 مل / كجم / ساعة.
- راقب الحيوان بقياسات ضغط الدم ، والتصوير الكابنوغرافي ، ومراقبة غازات التخدير ، ودرجة الحرارة ، وقياس التأكسج النبضي ، وتخطيط القلب الكهربائي.
- خلال أي إجراء ، يجب توفير تسكين إضافي على شكل 0.2 مجم / كجم من الميثادون عن طريق الوريد كل 4 ساعات بعد التخدير المسبق.
ملاحظة: يمكن إعطاء التسكين على فترات أقصر إذا أظهر الحيوان علامات الألم أثناء التخدير (عدم انتظام دقات القلب ، عمق التخدير المخفف دون تغييرات في أدوية الصيانة).
3. وضع الخط المركزي
- ضع الخنزير في الاستلقاء الظهري مع تمديد الأطراف الخلفية ، وتمديد الطرف الأمامي الأيسر ، وثني الطرف الأمامي الأيمن وتثبيته برباط.
- تحضير عنق الخنزير بشكل معقم ، وتغطيتها بعناق.
- استخدم مسبار الموجات فوق الصوتية الخطي (انظر جدول المواد) مع غطاء معقم لتحديد موقع الوريد الوداجي الأيمن. من الأفضل تحقيق ذلك من خلال المسبار الموجه بشكل عمودي على القصبة الهوائية وتحريكه ببطء بشكل جانبي من الحنجرة.
- قم بتمكين وضع دوبلر الملون للمساعدة في تحديد الوريد الوداجي. يمكن تمييز الوريد الوداجي عن الشريان السباتي من خلال إظهار قابلية الانهيار والتدفق المستمر غير النابض.
- استخدم إبرة طبخ 18 جم (انظر جدول المواد) للوصول إلى الوريد تحت توجيه الموجات فوق الصوتية. بمجرد الوصول ، مرر سلك J-tip مقاس 0.035 بوصة (انظر جدول المواد) عبر الإبرة وقم بربطها في الوعاء. قم بإزالة الإبرة فوق السلك.
- قم بتمرير خط مركزي متدفق مسبقا فوق السلك وادفعه إلى الوريد. تأكد من أن السلك مرئي من الطرف البعيد للخط في جميع الأوقات.
ملاحظة: تم استخدام قسطرة وريدية مركزية 5 Fr ، ثنائية التجويف (انظر جدول المواد) للأشخاص الذين يحتاجون إلى الوصول عن طريق الوريد على مدى فترة 1-4 أسابيع. - إذا كانت هناك صعوبة في دفع الخط عبر الجلد ، فاستخدم مشرطا رقم 11 لإنشاء شق صغير 2-4 مم لتسهيل مرور الخط عبر السلك. ضع ضغطا سلبيا متبوعا بتدفق على كل خط خارجي لضمان المباح. المشبك كل سطر قبالة.
- قم بتوصيل المراسي المتوفرة بالخطوط الخارجية وثبتها في مكانها بخيوط 2-0 أو 3-0 غير قابلة للذوبان (انظر جدول المواد). ضع خيوط إضافية لتأمين الخطوط الخارجية ظهريا لتجنب مضغ الحيوان لها.
- قم بتوصيل خطوط التمديد المتدفقة بخطوط القسطرة الخارجية وقم بتثبيتها.
- قم بتركيب الحيوان مع سترة خنزير تجارية (انظر جدول المواد) وقم بتأمين الخطوط بداخله. إذا لم يتم إجراء إجراءات أخرى أثناء نفس المخدر ، فقم بتركيب السترة قبل تعافي الحيوان مباشرة.
4. احتشاء عضلة القلب
ملاحظة: تلقت الحيوانات المستخدمة في هذا النموذج احتشاء عضلة القلب بعد طريقة7 المنشورة مسبقا.
- أداء احتشاء عضلة القلب 2 أسابيع قبل إجراءات الحقن عبر القلب وعبر الشغاف8،9،10. تم إجراء زرع المضخة الصغيرة التناضحية مباشرة بعد إعادة التروية التاجية في نفس الإجراء.
5. إدارة الدواء أو الخلية
- بضع الصدر وحقن الخلايا النخابية
- تطبيق المضادات الحيوية الوقائية الوريدية على شكل 22 ملغ/كغ من سيفازولين (انظر جدول المواد). استمر كل 90 دقيقة طوال العملية.
- ضع الحيوان في وضع الاستلقاء الجانبي الأيمن.
- ضع رقعة فنتانيل 100 ميكروغرام / ساعة (انظر جدول المواد) على المستوى المسطح خلف آذان الخنزير. مع تغطية خلع الملابس لاصقة أو 2-0 خياطة.
ملاحظة: تعتبر هذه الرقعة "نشطة" بعد 12 ساعة من وضعها ، وتوفر تسكين لمدة 72 ساعة. - قم بإعداد كابلات وتصحيحات نظام رسم الخرائط الكهرومغناطيسية وفقا لمواصفات المنتج (انظر جدول المواد).
- ضع علامة على خط أفقي 10 سم بين الأضلاع 4 و 5 على الحيوان باستخدام قلم تلوين أو علامة جراحية.
- تحضير خليط من الليدوكائين (2 ملغ/كغ) وبوبيفاكايين (1 ملغ/كغ) في حقنة واحدة بإبرة 25 غرام.
- إعداد موقع الجراحة بشكل معقم وثنى الحيوان. قم بإجراء كتلة خط جلدي في موقع الشق المحدد عن طريق إدخال الإبرة في الجلد بزاوية ضحلة ، وسحب المكبس قليلا لضمان عدم ارتجاع الدم في المحقنة ، وحقن المحلول ببطء أثناء سحب الإبرة من الجلد. كرر هذه العملية أثناء التحرك لأسفل الخط.
ملاحظة: يجب تطبيق الضغط السلبي على المحقنة في كل موقع حقن جديد لضمان عدم إعطاء بوبيفاكايين داخل الأوعية الدموية. يمكن أن يكون البوبيفاكايين داخل الأوعية قاتلا بسرعة. - باستخدام مشرط رقم 22 ، قم بعمل شق جلدي 10 سم على طول الخط المحدد.
- باستخدام الكي أحادي القطب (انظر جدول المواد) ، قم بتعميق الشق من خلال طبقات العضلات الأساسية حتى يتم الوصول إلى العضلات الوربية.
- تحضير حقنة معقمة من 0.5 ملغ/كغ من بوبيفاكايين و1 ملغ/كغ من اللجنوكايين، وإرفاق إبرة 25 غرام.
- أدخل الإبرة بزاوية ضحلة على الحافة الذيلية للضلع الرابع. اضغط سلبا على المكبس للتأكد من أن الإبرة لم تمر عبر الوريد أو الشريان الوربي. حقن ببطء ربع حجم المحقنة مع الحفاظ على ثبات الإبرة.
- كرر الخطوة 5.1.12 في ثلاثة مواقع أخرى ، على بعد 3-5 سم على طول الحافة الذيلية للضلع الرابع.
- استخدم مقص Metzenbaum (انظر جدول المواد) لشق العضلات الوربية بعناية ، ثم شق غشاء الجنب بعد التأكيد مع طبيب التخدير.
- عند شق غشاء الجنب ، قم بإيقاف تشغيل جهاز التنفس الصناعي للسماح للرئتين بالسقوط بعيدا عن غشاء الجنب. بعد إجراء الشق ، أعد تشغيل جهاز التنفس الصناعي واضبط ضغط الزفير النهائي الإيجابي على 4 سمH 2O.
- ضع مبعدات الأضلاع ذاتية الاحتفاظ بين الضلوع وافتحها ببطء لكشف القلب. باستخدام ملقط الأنسجة ، أمسك التامور برفق ، وشق بمقص Metzenbaum حتى يكون القلب خارجيا.
ملاحظة: خلال هذه الخطوة والخطوات القليلة التالية ، يكون عدم انتظام ضربات القلب شائعا. يجب مراقبة تخطيط القلب عن كثب ، ويجب إيقاف أي تلاعب بالقلب مؤقتا إذا أصبح الحيوان غير مستقر ديناميكيا (متوسط الضغط الشرياني أقل من 55 مم زئبق). يجب إعطاء جرعات من الميتارامينول عن طريق الوريد (0.25 مجم) حسب الحاجة لتحسين ضغط الدم. - ضع خيوط إقامة مؤقتة 2-0 على طرفي وجانبي شق التامور لتثبيته على جدار الصدر وإنشاء بئر التامور. تأكد من دعم جوانب التامور لجعل بئر التامور ضحلا قدر الإمكان.
- استخدم مسحات مبللة أو إسفنجات فتح البطن لتعبئة المنطقة المحيطة بالقلب. سيساعد ذلك في الحفاظ على استقرار القلب ومنع جفاف الأنسجة المكشوفة.
- توصيل قمة القلب من داخل تجويف التامور بإصبع السبابة خلف البطين الأيسر. احرص على تقليل ضغط البطين الأيسر.
ملاحظة: يمكن للقلب السليم أن ينبض بشكل مريح مع توجيه القمة عموديا ، والجلوس على قاعدته بدعم لطيف ولكن بدون ضغط. هناك انخفاض أولي في ضغط الدم المرتبط بالتلاعب ، ولكن يجب أن يتعافى هذا إلى مستوى مقبول في حالة عدم وجود ضغط البطين الخارجي.- في حالة عدم حدوث أي انتعاش أو بطيء جدا في 15 ثانية ، أعد القلب على الفور إلى تجويف التامور واتخذ الخطوات اللازمة لتحسين المعلمات الدورة الدموية قبل مزيد من الخلع.
ملاحظة: إذا كان من الممكن خلع البطين ، فيمكن الحفاظ على موضع القمة خارج التامور عن طريق وضع حزم شاش بحجم مناسب داخل التامور لدعم البطين. وبالمثل ، يمكن وضع مسحة ممدودة ومبللة أسفل قاعدة القلب ، حيث تعمل بمثابة "حبال" توجه قمة القلب لأعلى نحو الشق (الشكل 1 أ).
- في حالة عدم حدوث أي انتعاش أو بطيء جدا في 15 ثانية ، أعد القلب على الفور إلى تجويف التامور واتخذ الخطوات اللازمة لتحسين المعلمات الدورة الدموية قبل مزيد من الخلع.
- قم بإنشاء خريطة جهد كهروتشيه لسطح البطين الأيسر باستخدام قسطرة رسم الخرائط الكهربية (الشكل 1 ب). حدد الندبات والحدود والمناطق النائية من خلال قطع الجهد القياسي.
ملاحظة: تم تعريف الندبة والمنطقة النائية بقطع ثنائي القطب يبلغ <0.5 مللي فولت أو >1.5 مللي فولت ، وقطع أحادي القطب يبلغ <3 مللي فولت أو >8.3 مللي فولت ، على التوالي11,12. - ثني إبرة حقنة التوصيل العلاجي 27 جم إلى زاوية 80-90 درجة تقريبا.
- دفع الإبرة إلى الأنسجة المستهدفة بزاوية ضحلة والضغط على مكبس المحقنة لتفريغ 1/4 إلى 1/3 من الحجم الكلي. يجب ملاحظة ابيضاض الأنسجة (الشكل 1C). استخدم قسطرة رسم الخرائط الكهربية للتعليق على موقع موقع الحقن على خريطة الجهد النقوي المتولد (الشكل 1 د).
ملاحظة: تم استخدام حقن المركبات التي تتكون من وسيط زراعة الخلايا (RPMI 1640) لأغراض العرض التوضيحي في بروتوكول الفيديو. - سحب الإبرة جزئيا وإعادة توجيهها داخل عضلة القلب. تفريغ 1/4 إلى 1/3 أخرى من حجم المحقنة. استمر حتى تصبح المحقنة فارغة.
- كرر الخطوات 5.1.20-5.1.24 حتى يتم تسليم الجرعة المطلوبة.
- قم بإزالة المسحات التي تحتوي على القلب ، وقم بإزالة "المعلقة" برفق أسفل القلب ، حتى تعود إلى الوضع المحايد. عدم انتظام ضربات القلب شائع خلال هذه الخطوة ، ويجب توخي الحذر كما هو موضح في الخطوة 5.1.17.
- قم بإزالة خيوط البقاء 2-0 من التامور. قم بفك المبعدة وإزالته من الصدر.
- استخدم خيوط بوليديوكسانون مقاس 1 (PDS) بإبرة مستديرة ذات رأس حاد لإغلاق الصدر عن طريق تمريره عبر الفراغات بين الضلعين 3 و 4 والأضلاع 5 و 6.
ملاحظة: توفر الغرز الضيقة الشكل الثامن تأثير بكرة لتقريب الأضلاع. يجب استخدام اثنين أو ثلاثة من هذه الغرز ، اعتمادا على حجم الحيوان. - قبل شد وربط الغرز التقريبية للأضلاع ، أدخل طولا قصيرا من أنبوب السيليكون في الحافة البطنية للشق.
- ضع الطرف الحر للأنبوب في وعاء من محلول ملحي معقم لتصريف مغلق تحت الماء للتجويف الجنبي.
- أغلق طبقات العضلات العلوية بنمط مستمر بسيط مع 2-0 خيوط قابلة للامتصاص. أغلق الجلد بنمط بسيط مستمر أو متشابكفورد 13 بخياطة 2-0 أو 3-0 غير قابلة للامتصاص.
- عند اكتمال إغلاق الجرح ، اطرد الهواء الحر من الصدر بتأثير تهوية الضغط الإيجابي.
- أدر جهاز التنفس الصناعي إلى إعداد "التنفس الحر". استخدم كيس الخزان على دائرة إعادة التنفس لتوفير ضغط إيجابي ثابت للممرات الهوائية (الحفاظ على 20-30 سمH 2O).
- استمر في هذا الضغط حتى لا يتم ملاحظة الفقاعات في الوعاء الملحي ، مما يشير إلى عدم وجود هواء حر داخل الصدر.
- قم بإزالة أنبوب السيليكون.
- ضع ضمادة لاصقة على موقع الجراحة ، وضع خيوط متقطعة بسيطة متناثرة للمساعدة في الحفاظ على الضمادة في مكانها.
- عند التعافي، يتم تطبيق 0.3 ملغ/كغ من الميثادون تحت الجلد و0.2-0.5 ملغ/كغ من أوندانسيترون (انظر جدول المواد) عن طريق الوريد.
- زرع مضخة صغيرة تناضحية الوريد الوداجي
- ضع الحيوان كما هو موضح في الخطوة 3.1. إعداد معقم وثنى الجانب الأيمن من رقبة الحيوان.
- باستخدام شفرة مشرط رقم 22 ، قم بعمل شق 8-10 سم يمتد بشكل جملجي من نقطة 2-3 سم جانبية إلى manubrium sterni. يجب أن يصبح هذا الشق جانبيا أكثر قليلا لأنه يتحرك بشكل قحفي.
- استخدم مقص Metzenbaum لتشريح العضلات الجلدية القولونية والقصية والعظمية. استخدم تقنيات التشريح الحاد لتعميق الشق حتى يصبح الوريد الوداجي الخارجي مرئيا.
- ضع مبعدات ذاتية الاحتفاظ في الشق وافتحها لتحسين الرؤية.
- باستخدام ملقط الأنسجة البنية Adson (انظر جدول المواد) ومقص Metzenbaum ، قم بإزالة الأنسجة الرخوة المحيطة بالوريد الوداجي ، أعلى وأسفل (الشكل 2 أ). هذه خطوة حاسمة ، كما هو الحال في المراحل اللاحقة ، يمكن للأنسجة الرخوة التي تغطي الوعاء أن تعيق مرور أنبوب المضخة الصغيرة.
- استخدم خياطة قابلة للامتصاص 5-0 من خلال الطرف الذيلي المكشوف للوريد ، حوالي 1 سم من الجمجمة من الحافة الذيلية المرئية للوعاء. مرر الخيط في "لدغات" مقاس 5 مم بالطريقة التالية: من الجمجمة إلى الذيلية على الجانب الأيمن ، ومن اليمين إلى اليسار ، والذيلية إلى الجمجمة على الجانب الأيسر. يجب أن يظهر النمط الناتج ك "ثلاثة جوانب من مربع". تأكد من أن ذيول الخيط من كلا الطرفين متساوية في الطول.
- قم بتجميع المضخة الصغيرة كما هو موضح في دليل تعليمات المنتج (انظر جدول المواد).
- ربط حلقة مرنة الأوعية الدموية حول الوعاء في كل من النهايات الجمجمة والذيلية. احتفظ بها فضفاضة في البداية. اطلب من مساعد وضع التوتر على روابط الأوعية الدموية لسد الوعاء.
- باستخدام إبرة 14 G ، قم بإنشاء ثقب في الوريد في وسط "المربع ثلاثي الجوانب" الذي تم إنشاؤه باستخدام مادة خياطة (الخطوة 5.2.7 ؛ الشكل 2 ب).
- خيط أنبوب المضخة الصغيرة في الثقب. يجب أن تمر بسهولة في الوعاء. إذا واجهت مقاومة ، فلا تستمر في الدفع ؛ بدلا من ذلك ، اسحب الأنبوب للخارج وحاول مرة أخرى.
- تقدم الأنبوب حتى يبقى 1-2 سم خارج الوعاء. شد مادة الخياطة حول أنبوب القسطرة واربطها في عقدة بسيطة متقطعة. اطلب من المساعد تحرير وإزالة الروابط الوعائية.
- لف خيطا غير قابل للامتصاص 2-0 حول جسم المضخة الصغيرة عدة مرات واربطه بحيث يكون الخيط آمنا على المضخة. بعد ذلك ، قم بتثبيت المضخة على الأنسجة الرخوة القريبة بعقدة بسيطة متقطعة (الشكل 2C ، D).
- قم بإزالة المبعدات من الشق. أغلق الشق في إغلاق مستمر بسيط من ثلاث طبقات.
- تطبيق 0.2 ملغ/ كغ من ميلوكسيكام تحت الجلد أثناء التعافي.
- حقن الشغاف عن طريق الجلد
- ضع الحيوان في راقد ظهري مع تمديد الأطراف الأمامية والخلفية ، وتأمينه برباط.
- إعداد معقم البطن الذيلية والفخذين الإنسي للحيوان. قم بثنى الحيوان بثنى تصوير الأوعية الفخذية المحصن (انظر جدول المواد).
- قم بإعداد كابلات وتصحيحات نظام رسم الخرائط الكهرومغناطيسية وفقا لمواصفات المنتج (انظر جدول المواد).
- استخدم مسبار الموجات فوق الصوتية الخطي لتحديد الشريان الفخذي. تحت توجيه الموجات فوق الصوتية ، قم بثقب الشريان الفخذي بإبرة طهي وخيط سلك توجيه 0.035 بوصة في الوعاء عبر الإبرة. قم بإزالة الإبرة فوق السلك.
- قم بتمرير غمد شرياني 8 Fr ومقدمه فوق السلك الشرياني وادفعه حتى يتعرض المحور فقط للجلد. تأكد من أن السلك مرئي دائما ، يخرج من محور الغمد.
ملاحظة: نظرا لأن هذا غمد أكبر ، فقد تكون هناك حاجة في بعض الأحيان إلى مشرط رقم 11 لإنشاء شق جلدي صغير لتسهيل المرور. - قم بإزالة مقدم الغمد والأسلاك. تطبيق الهيبارين الوريدي (100-200 وحدة/كغ).
- إدخال قسطرة الحقن عبر الشغاف من خلال الغمد والتقدم إلى البطين الأيسر عن طريق نهج الأبهر إلى الوراء.
- قم بإنشاء خريطة كهربية ذرية للبطين الأيسر عن طريق سحب القسطرة برفق عبر سطح الشغاف. قم بإجراء الدوران المحوري والتعديلات اللطيفة لثني الطرف لتحقيق اتصال جيد بالشغاف. تحديد الندبات والحدود والمناطق النائية عن طريق قطع الجهد القياسية.
- قم بتوجيه القسطرة بالمنظار الفلوري والتوجيه الكهربي التشريحي إلى موقع الحقن المفضل. قم بإجراء دوران محوري لطيف مع انحراف الطرف البعيد للانخراط والحفاظ على اتصال شغاف مستقر.
- تأكد من وضع طرف القسطرة مع اثنين على الأقل من وجهات النظر بالمنظار. دفع القسطرة الأساسية برفق ، ثم مد الإبرة إلى عمق داخل عضلة القلب المتحكم فيه (3.5 مم للحقن القمي ، 5 مم لحقن الحاجز).
- اغسل 4-6 مل من التباين المعالج باليود (انظر جدول المواد) من خلال قسطرة الحقن حتى تظهر في التنظير الفلوري. راقب التباين لمدة 10-30 ثانية التالية للتأكد من بقائه في الأنسجة (الشكل 3 أ).
- راقب مخطط كهربية القلب عن كثب أثناء تمديد الإبرة والحقن ، حيث أن عمليات تشغيل خارج الرحم البطيني شائعة.
ملاحظة: يحدث الانتباذ البطيني عندما يكون طرف الإبرة ملامسا لعضلة القلب. - إذا نجح حقن التباين ، فتابع بحقن العامل محل الاهتمام. اغسل هذا من خلال التباين حتى يتم ملاحظته بالمنظار.
ملاحظة: وكيل الاهتمام خاص بالمستخدم ، اعتمادا على العلاج الذي يختبره. - اسحب الإبرة. قم بإزالة قسطرة الحقن من غمد الشرايين.
- قم بإزالة الغمد الشرياني واضغط على المواقع لمدة تصل إلى 20 دقيقة حتى يتحقق الإرقاء.
6. التعافي من التخدير العام
- قم بإيقاف تشغيل مضخات التخدير المستنشقة أو الوريدية المستخدمة. خفض معدل التنفس على جهاز التنفس الصناعي إلى 8-10 أنفاس / دقيقة.
- بعد 2-5 دقائق ، قم بتبديل جهاز التنفس الصناعي إلى وضع "التنفس الحر" لمدة لا تزيد عن 30 ثانية في المرة الواحدة. مراقبة الحيوان والكابنوغراف للتنفس التلقائي.
- إذا حدث التنفس التلقائي ، اترك جهاز التنفس الصناعي مغلقا. إذا كان الحيوان يعاني من انقطاع النفس ، فقم بإعادة تشغيل جهاز التنفس الصناعي لمدة 1-2 دقيقة أخرى وحاول مرة أخرى حتى يتحقق التنفس التلقائي.
ملاحظة: الإطار الزمني للتعافي متغير اعتمادا على الخصائص الإجرائية والحيوانية ، ولكن قد يتراوح من 15 دقيقة إلى 1 ساعة. - بمجرد أن يتنفس الحيوان بشكل مريح (معدل التنفس من 15-30 نفسا / دقيقة ، ثاني أكسيد الكربون في نهاية المد والجزر أقل من 60 ، SpO2 أعلى من 95٪) ، افصل الأكسجين ، تاركا المراقبة الأخرى متصلة.
- إزالة المواقع المؤقتة للوصول إلى الأوعية الدموية والضغط لمنع تكوين ورم دموي. إذا ظل الحيوان مستقرا واستمر في الأكسجين جيدا خلال 5 دقائق التالية ، فيمكن نقله إلى منطقة التعافي.
- بعد ثلاث ابتلاع تلقائي متتالي ، قم بتفريغ صفعة الأنبوب الرغامي وإزالة الأنبوب برفق.
- راقب الحيوان لمدة 5 دقائق أخرى على الأقل للتأكد من استمراره في الأكسجين بشكل مناسب وعدم مواجهة أي ضائقة تنفسية. يجب استخدام الأكسجين المتدفق حسب الحاجة إذا كان الحيوان غير مشبع بعد نزع الأنبوب.
النتائج
بضع الصدر وحقن الخلايا النخابية
من بين 29 حيوانا خضعت لبضع الصدر وحقن النخاب ، نجا 26 حيوانا. أكد التحليل النسيجي تطعيم الخلايا البشرية بهذه الطريقة في جميع الحيوانات الباقية على قيد الحياة (الشكل 1E). عانى أحد الحيوانات من عدم انتظام ضربات القلب المميت أثناء حقن الخلايا ولم يكن من الممكن إنعاشه. شهد آخر نشاطا كهربائيا بلا نبضات أثناء الإغلاق والتطبيق المطول للضغط الإيجابي على الشعب الهوائية ولم يتمكن من استعادته. تقيأ ثالث وأصيب بتوقف التنفس عند نزع الأنبوب. هذا الحيوان لم يكن قادرا على الإنعاش.
عانى حيوانان من مضاعفات كبيرة لكنهما تمكنا من التعافي. أصيب أحد الحيوانات بالرجفان البطيني أثناء الحقن داخل عضلة القلب وكان قادرا على إنعاشه باستخدام مجاذيف إزالة الرجفان الداخلية وتدليك القلب. تقيأ الحيوان الثاني عند نزع الأنبوب وأصيب بتوقف تنفسي قصير ولكنه تمكن من إعادة التنبيب بسرعة وتعافى جيدا. حدثت كل هذه الأحداث خلال التجارب المبكرة ، مع انخفاض الأحداث الضائرة مع زيادة تجربة الفريق مع البروتوكول (الجدول 1).
زرع مضخة صغيرة تناضحية الوريد الوداجي
لم يتم الإبلاغ عن أي وفيات أو مضاعفات كبيرة مرتبطة بزرع مضخة صغيرة تناضحية وداجية. عانت معظم الحيوانات السبعة من تورم خفيف في موقع الجراحة خلال ال 24 ساعة الأولى ، والتي تم حلها دون تدخل. أظهر ELISA الذي تم إجراؤه على المصل في اليوم 3 بعد زرع المضخة فعالية المضخة ، حيث حقق تركيزا كبيرا في الدم لعامل النمو المشتق من الصفائح الدموية - AB البشري (PDGF-AB) مقارنة بالضوابط7 (الشكل 2E).
حقن الشغاف عن طريق الجلد
تلقى ما مجموعه 22 حيوانا حقن الشغاف. من بين هذه الحقن ، تم اعتبار 17 حقنا "ناجحا" ، تم تحديدها من خلال التألق أو تلطيخ الحبر الذي لوحظ في الأنسجة المستهدفة بعد الوفاة (الشكل 3 ب). لم تكن هناك وفيات مرتبطة بهذا الإجراء. أصيب أحد الحيوانات بانصباب تامور صغير الحجم من ثقب البطين الأيمن. كان هذا محدودا ذاتيا ولم يؤد إلى حل وسط للقلب والأوعية الدموية. هذا الحيوان نفسه مات. ومع ذلك ، كان هذا من إجراء إضافي غير ذي صلة بعد حقن عضلة القلب.
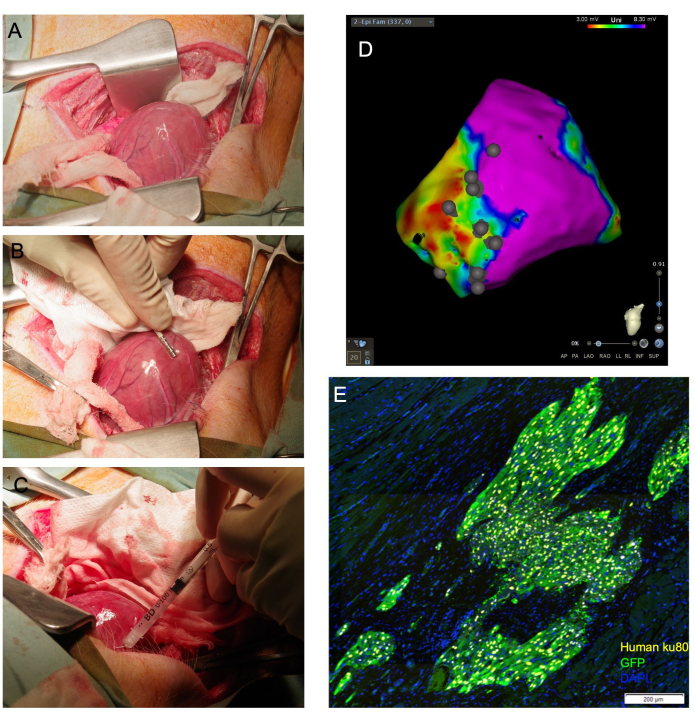
الشكل 1: يسمح حقن الخلايا العضلية القلبية عبر النخابية بالتصوير القلبي المباشر، ويحقق نسبة عالية من الخلايا القابلة للحياة التي تصل إلى عضلة القلب. أ: تنكشف القمة القلبية من خلال حبال شاش مبلل موجهة أسفل قاعدة القلب. (ب) تحدد قسطرة رسم الخرائط النخابية مناطق الندبات والحدود وتوضح مواقع الحقن. (ج) تستخدم إبرة وزنها 31 G لحقن الخلايا عبر القلب في عضلة القلب. (د) خريطة الجهد النتحابي مع تعليق توضيحي لموقع الحقن. الأرجواني: الجهد العادي ، عضلة القلب صحية. الأحمر: الجهد غير الطبيعي ، عضلة القلب المريضة. النقاط الرمادية: مواقع الحقن. بعد التضحية ، يتم جمع القلب وتثبيت الفورمالين للتقييم النسيجي في المصب. في (ه)، تكتشف الخلايا البشرية المطعمة عن طريق التلوين المناعي للجسم المضاد للنواة في الإنسان، Ku80، والجسم المضاد لحمض الأجيال التأسيسية. شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
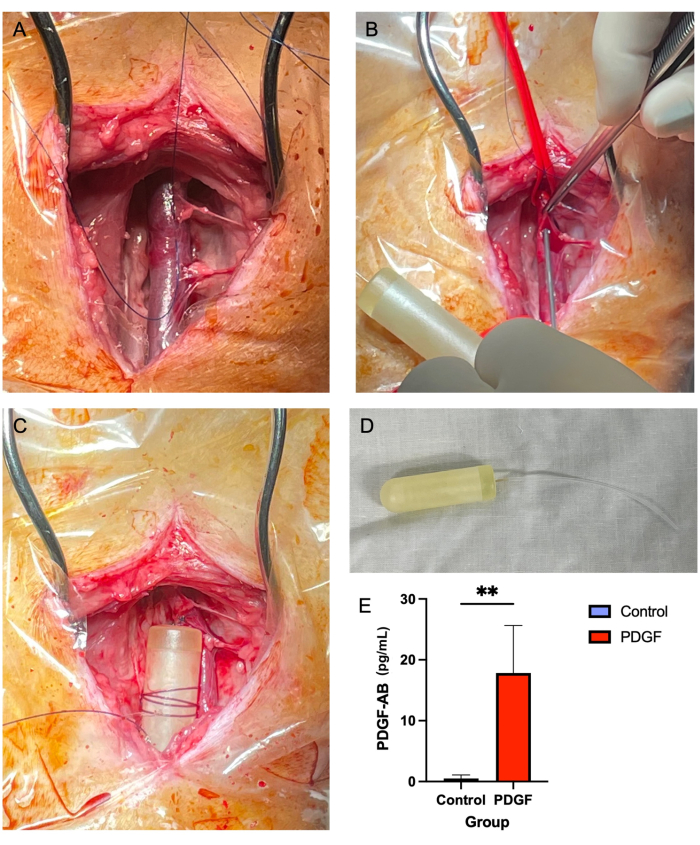
الشكل 2: يوفر إدخال مضخة الوريد الوداجي الصغيرة طريقة آمنة وموثوقة لتوصيل PDGF خلال فترة زمنية مدتها 7 أيام . (أ) ينكشف الوريد الوداجي الأيمن، وتزيل الأنسجة الرخوة بعيدا عن الوعاء. (ب) تسد الروابط الوعائية الوعاء الدموي، بينما تستخدم إبرة وزنها 14 G لعمل ثقب، يتم من خلاله تمرير أنبوب المضخة الصغيرة. (ج) يتم دفع أنبوب المضخة الصغيرة إلى الوريد ، ويتم تثبيت جسم المضخة الصغيرة في الأنسجة الرخوة المجاورة. د: جسم المضخة الصغيرة والأنبوب قبل الزرع. (ه) تم قياس تركيز مصل البروتين المؤتلف الذي يتم توصيله عبر المضخة الصغيرة و PDGF-AB باستخدام ELISA من كل في اليوم 3 بعد الزرع. ثبت أن الحيوانات التي تتلقى PDGF-AB لديها تركيز دم أعلى بكثير من PDGF-AB من الحيوانات الضابطة ، مما يؤكد فعالية طريقة إدارة المضخة الصغيرة التناضحية. ** يشير إلى وجود فرق ذي دلالة إحصائية بين المجموعات (p = 0.005 ، اختبار Mann-Whitney U) الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
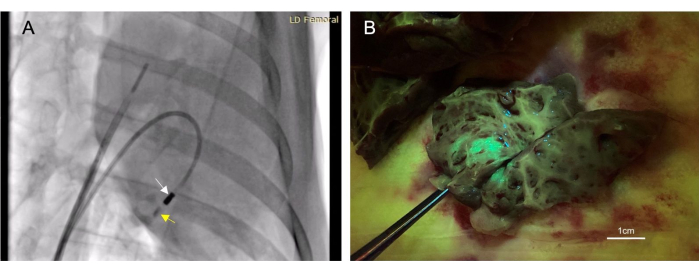
الشكل 3: يسمح الحقن داخل عضلة القلب عبر الشغاف بإعطاء طريقة علاجية طفيفة التوغل. (أ) صورة بالمنظار الفلوري المائل الأمامي الأيمن توضح القسطرة الحقنية (السهم الأبيض) التي تعطي مادة التباين (السهم الأصفر) في عضلة القلب. يسبق حقن مادة التباين الحقن العلاجي ويتبعه بحيث يمكن تأكيد وضع الإبرة داخل عضلة القلب. (ب) يعبر الناقل المحقون عن بروتين الفلورسنت الأخضر (GFP) بحيث تتألق المادة المحقونة عند جمع الأنسجة ، مما يؤكد نجاح الحقن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الحقن عبر اللب (ن = 29) | حقن الشغاف (ن = 22) | مضخة صغيرة تناضحية (ن = 7) | |
| وفيات | 3 | 0 | 0 |
| القيء بعد الجراحة وتوقف التنفس | 1 | 0 | 0 |
| الرجفان البطيني أثناء الحقن | 1 | 0 | 0 |
| نشاط كهربائي بدون نبض أثناء إغلاق الصدر | 1 | 0 | 0 |
| الاعتلال | 0 | 1 | 0 |
| استرواح الصدر | 0 | 0 | 0 |
| الانصباب الجنبي | 0 | 0 | 0 |
| ثقب غرفة القلب | 0 | 1 | 0 |
| نزف | 0 | 0 | 0 |
الجدول 1: قائمة المضاعفات.
Discussion
حقن عضلة القلب عبر النوى
هذا الإجراء له فائدة التصور القلبي المباشر وقد ثبت أنه يوفر احتفاظا محليا أكبر بالعلاجات من طرق الإدارة الجهازية9،10،14. ومع ذلك ، فإن عمليات استئصال الصدر غازية ، وتتطلب مهارة فنية كبيرة ، وتمثل خطرا أكبر للإصابة بالمراضة والوفيات مقارنة بالطرق الأخرى التي تمت مناقشتها10،15. يمكن أن تساعد معرفة المراحل الحرجة وغير المستقرة من الإجراء في الوساطة في هذا الخطر المتزايد.
يجب توخي الحذر الشديد عند التلاعب بالقلب لكشف قمة القلب بسبب ارتفاع خطر عدم انتظام ضربات القلب وما يرتبط به من تسوية الدورة الدموية. تسمح المراقبة المستمرة لضغط الدم الغازية وتخطيط القلب الكهربائي بالتعرف السريع على انخفاض ضغط الدم أو عدم انتظام ضربات القلب غير المستقر ، مما يسهل التدخل الفوري والتصحيح. يمكن علاج انخفاض ضغط الدم العابر بشكل عام باستخدام جرعات الميتارامينول. يمكن تخفيف ضغط الدم المستمر مؤقتا عن طريق تقليل التخدير المستنشق (المراقبة الدقيقة لعمق التخدير) والبدء في ضخ خافض للأوعية ، مع تحديد سبب ديناميكا الدم المتغيرة في نفس الوقت. يمكن علاج عدم انتظام ضربات القلب غير المستقر، مثل تسرع القلب البطيني أو الرجفان البطيني، عن طريق تقويم نظم القلب الكهربائي مع أو بدون مضادات اضطراب النظم في الوريد.
نفس القدر من الأهمية لبقاء الحيوان هو الإزالة الناجحة للغاز الحر من التجويف الجنبي قبل إغلاق الصدر. يمكن أن يؤدي الفشل في القيام بذلك إلى الإصابة باسترواح الصدر ، مما يترك الحيوان في خطر كبير من ضعف الجهاز التنفسي والموت بمجرد فصله عن جهاز التنفس الصناعي عند الشفاء. يجب الحفاظ على ضغط مجرى الهواء الإيجابي لمدة 30 ثانية على الأقل حتى لا يتم ملاحظة الفقاعات. تتم إزالة أنبوب السيليكون على الفور عند توقف الفقاعات ، ثم يتم إغلاق الصدر بسرعة. من الممكن أيضا وضع أنبوب فغر الصدر جراحيا عند الإغلاق ، مما يسمح بإزالة الهواء والسوائل الالتهابية يدويا خلال 24-72 ساعة القادمة. ومع ذلك ، من الصعب الحفاظ على هذا نظيفا وسليما ، خاصة إذا تم إيواء الحيوانات معا. يمكن أن يؤدي تلف الأنبوب أو تلوثه إلى تقيح الصدر أو استرواح الصدر أو الإنتان. في تجربتنا ، لا يلزم إدخال مصرف مؤقت للصدر إذا تمت إزالة الغاز الحر بشكل كاف قبل إغلاق الصدر.
حقن عضلة القلب عبر الشغاف عن طريق الجلد
هذه الطريقة في الإدارة العلاجية لها فائدة في السماح بتوصيل الأنسجة المحلية مع مخاطر أقل بسبب طبيعتها الأقل توغلا مقارنة بالنهج الجراحي10,14. تستخدم هذه التقنية بالفعل في الدراسات الحيوانية الكبيرة ، مع كل من التنظير الفلوري ورسم الخرائط الكهروميكانيكية كدليل في غياب التصور المباشر10،16،17.
نظرا لأن القلب ليس تحت الرؤية المباشرة ، فمن الحكمة أن يستخدم الإجرائي وجهات نظر متعامدة بالمنظار عند اختيار موقع الحقن. وعلاوة على ذلك, حقن المخفف اليود النقيض قبل وتسليم العلاج هو قيمة للغاية في تأكيد الاتصال عضلة القلب. يمكن تأكيد الاتصال المناسب من خلال مراقبة "أحمر الخدود في عضلة القلب" المميز ، والذي قد يكون أحد العلامات الوحيدة لنجاح الحقن قبل حصاد الأنسجة. نظرا لخطر ثقب الغرفة ، يوصى أيضا بأن يكون سمك جدار عضلة القلب في موقع الحقن المحدد أكبر من 9 مم14,16.
مضخة صغيرة تناضحية وريدية وداجية
المضخة الصغيرة التناضحية هي جهاز شائع الاستخدام في دراسات الحيوانات الصغيرة. كان هناك اهتمام متزايد باستخدام هذا الجهاز في النماذج الحيوانية الكبيرة7،18،19 ، نظرا لميزته الفريدة المتمثلة في إعطاء عامل علاجي بمعدل ثابت خلال فترة زمنية محددة. أحد القيود المحتملة لهذه الطريقة هو عدم القدرة على تغيير أو إيقاف معدلات ضخ الدواء دون استبدال أو إزالة المضخة. يجب مراعاة ذلك قبل تجربة العلاج بهذه الطريقة.
أظهرت هذه الدراسة أنه يمكن إجراء هذه الطريقة بمعدل نجاح مرتفع في الخنازير ، مع انخفاض معدلات المراضة والوفيات. تجدر الإشارة إلى أن العديد من الهياكل الحيوية مجاورة لموقع الجراحة ، بما في ذلك الغدد الليمفاوية والغدة الصعترية والشريان السباتي. يوصى بشدة بالالتزام بالطريقة والتشاور مع النصوص التشريحية20 لمنع حدوث ضرر غير مقصود لأي من هذه الهياكل. المضاعفات الأكثر إثارة للقلق لهذه الطريقة هي الصدمة النزفية بسبب الإصابة غير المقصودة للوريد الوداجي أو الهيكل المحيط. لذلك من الأهمية بمكان إزالة الأنسجة الرخوة المحيطة بالوريد الوداجي بعناية. يمكن أن يؤدي الفشل في إكمال هذه الخطوة بشكل صحيح إلى صعوبة في وضع أنبوب المضخة الصغيرة أو التحكم في النزيف غير المقصود.
وصفت هذه المقالة ثلاث طرق لتقديم العلاجات القلبية. على الرغم من النجاح المبلغ عنه لكل تقنية ، هناك قيود متأصلة يجب مراعاتها. تسمح الإجراءات الغازية (الحقن عبر النخاب) بزيادة دقة التسليم العلاجي ؛ ومع ذلك ، فإنها تجلب خطرا أكبر من المضاعفات القاتلة. علاوة على ذلك ، فإن الولادة الغازية تتطلب متطلبات أكبر للمهارات التقنية لتقليل مخاطر حدوث مضاعفات. وبالمثل ، يتطلب الحقن عبر الشغاف الموجه بالمنظار درجة من المهارة التقنية للقسطرة والتلاعب بالأجهزة. إذا تم تنفيذ هذه الطريقة بشكل غير صحيح ، فمن الممكن فشل الحقن والمضاعفات المميتة.
تسمح طرق الحقن المباشر الموصوفة بإعطاء علاجي لمرة واحدة في الأنسجة المستهدفة. تسمح المضخة الصغيرة التناضحية الوريدية الوداجية بالإدارة الجهازية للعلاج على مدار 7 أيام. نسبيا ، هذه الطريقة أبسط وترتبط بمخاطر أقل ، ومع ذلك ، فهي تعتمد على علاج جهازي يجد طريقه إلى عضلة القلب. بالإضافة إلى ذلك ، بمجرد وضع المضخة في مكانها ، من المستحيل التوقف عن الإدارة أو تغيير معدل الجرعة دون إعادة تخدير الحيوان وإزالة المضخة.
تم تنفيذ جميع الطرق الموضحة في هذه المقالة على الحيوانات في اليوم أو 2 أسابيع بعد احتشاء عضلة القلب. لذلك ، لا يمكن لهذا العمل الإبلاغ عن نجاح الطرق المذكورة في الحيوانات السليمة أو الحيوانات الخاضعة لأمراض القلب البديلة. أخيرا ، يجب النظر بعناية في علم الأدوية والتكنولوجيا الحيوية لأي عامل مقصود ، حيث سيتم ربط ذلك بطبيعته بفعالية طريق التسليم المختار. مناقشة مفصلة لهذا هو خارج نطاق هذه المخطوطة.
يفيد التصوير الشامل للطرق قبل السريرية رعاية الحيوان والمجتمع العلمي الأوسع. يؤدي التكاثر المعزز الناتج للإجراءات والنتائج إلى تقليل مضاعفات صحة الحيوان ، وانخفاض عدد الحيوانات المطلوبة لتحقيق نتائج مهمة ، وزيادة الثقة في النتائج التجريبية21،22. تم وصف ثلاث طرق لإدارة العلاجات الجديدة في هذه المقالة لعلاج احتشاء عضلة القلب في نموذج الخنازير. من خلال تفصيل التقنيات المستخدمة وتوضيح فوائد ومخاطر كل منها ، من المتوقع أن يتمكن الباحثون من إنشاء نماذج ما قبل سريرية متسقة وموثوقة تناسب أهدافهم البحثية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من خلال منح من المجلس الوطني للصحة والبحوث الطبية APP1194139 / APP1126276 (JC) ، والمؤسسة الوطنية للخلايا الجذعية في أستراليا ، ومكتب حكومة نيو ساوث ويلز للصحة والبحوث الطبية (JC). تم دعم DS من قبل الكلية الملكية الأسترالية للأطباء ، ومعهد علم الأمراض السريري والبحوث الطبية ، وبرنامج التدريب البحثي للحكومة الأسترالية. تم دعم TD من قبل معهد علم الأمراض السريري والبحوث الطبية ، ومنحة Penfolds Family الدراسية ، والمجلس الوطني للصحة والبحوث الطبية (APP2002783) ومؤسسة القلب الوطنية الأسترالية (104615).
Materials
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
References
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39 (2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483 (2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. . Veterinary Sutures Handbook. , (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392 (2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897 (2016).
- Singh, B., Dyce, K. M. . Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411 (2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved