Method Article
Domuz Miyokard Enfarktüsü Modelinde Kardiyoaktif Terapötiklerin Verilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, bir domuz modelinde kardiyoaktif terapötik ajanların uygulanmasının üç yöntemini açıklamaktadır. Dişi kara ırkı domuzları, (1) torakotomi ve transepikardiyal enjeksiyon, (2) kateter bazlı transendokardiyal enjeksiyon veya (3) juguler ven ozmotik mini pompa yoluyla intravenöz infüzyon yoluyla tedavi gördü.
Özet
Miyokard enfarktüsü, dünya çapında önde gelen ölüm ve sakatlık nedenlerinden biridir ve yeni kardiyoprotektif veya rejeneratif stratejilere acil ihtiyaç vardır. İlaç geliştirmenin önemli bir bileşeni, yeni bir terapötiğin nasıl uygulanacağının belirlenmesidir. Fizyolojik olarak ilgili büyük hayvan modelleri, çeşitli terapötik uygulama stratejilerinin fizibilitesini ve etkinliğini değerlendirmede kritik öneme sahiptir. Kardiyovasküler fizyoloji, koroner vasküler anatomi ve kalp ağırlığının vücut ağırlığına oranı açısından insanlarla benzerlikleri nedeniyle domuz, miyokard enfarktüsü için yeni tedavilerin klinik öncesi değerlendirmesinde tercih edilen türlerden biridir. Bu protokol, bir domuz modelinde kardiyoaktif terapötik ajanların uygulanmasının üç yöntemini açıklamaktadır. Perkütan olarak indüklenen miyokard enfarktüsünden sonra, dişi kara ırkı domuzu, (1) torakotomi ve transepikardiyal enjeksiyon, (2) kateter bazlı transendokardiyal enjeksiyon veya (3) juguler ven ozmotik mini pompa yoluyla intravenöz infüzyon yoluyla yeni ajanlarla tedavi edildi. Her teknik için kullanılan prosedürler tekrarlanabilir ve bu da güvenilir kardiyoaktif ilaç dağıtımı ile sonuçlanır. Bu modeller, bireysel çalışma tasarımlarına uyacak şekilde kolayca uyarlanabilir ve bu uygulama tekniklerinin her biri, çeşitli olası müdahaleleri araştırmak için kullanılabilir. Bu nedenle, bu yöntemler, miyokard enfarktüsünü takiben kardiyak onarımda yeni biyolojik yaklaşımlar peşinde koşan translasyonel bilim adamları için yararlı bir araçtır.
Giriş
Koroner arter hastalığı (KAH) ve buna bağlı ST yükselmeli miyokard enfarktüsü (STEMI) dünya çapında önde gelen ölüm nedenleridir. Son yirmi yılda, perkütan koroner girişim, fibrinolitik tedaviler ve reperfüzyonun zamanında elde edilmesini sağlamak için tedavi algoritmalarının standardizasyonu yoluyla STEMI ile başvuran hastaların hastane içi mortalitesinin azaltılmasında büyük ilerleme kaydedilmiştir 1,2,3. Buna rağmen, STEMI ile ilişkili morbidite önemli bir yük olmaya devam etmektedir, bu nedenle yeni kardiyoprotektif ve rejeneratif tedavilerin geliştirilmesine büyük ihtiyaç duyulmaktadır 2,3. Terapötik gelişimin önemli bir bileşeni, yeni bir tedavinin nasıl uygulanacağının belirlenmesidir4. Her yöntemin güvenliği, etkinliği ve uygulanabilirliği, tedavinin kendi özellikleriyle eşleştirilmelidir.
Fizyolojik olarak ilgili büyük hayvan modelleri, çeşitli terapötik uygulama stratejilerinin bu özelliklerini değerlendirmede kritik öneme sahiptir5. Kardiyovasküler fizyoloji, koroner vasküler anatomi ve kalp ağırlığı/vücut ağırlığı oranındaki benzerlikleri nedeniyle domuz, miyokard enfarktüsü için yeni tedavilerin klinik öncesi değerlendirmesinde tercih edilen türlerden biridir6. Daha önce bir rekombinant protein tedavisinin7 onarıcı kapasitesini göstermek için bir domuz STEMI modeli kullandık ve bu modeli kullanarak yeni farmakolojik, hücresel ve genetik tedavileri araştırmaya devam ettik. Burada, enfarktüs oluşturulduktan sonra domuz modellerinde kullanılan üç terapötik uygulama tekniği açıklanmaktadır: torakotomi ve transepikardiyal enjeksiyon, perkütan transendokardiyal enjeksiyon ve juguler venöz ozmotik mini pompa implantasyonu. İlk iki yöntem, lokal doku iletimini mümkün kılar, gerekli dozajları, hedef dışı etkileri ve hepatik ilk geçiş metabolizmasını azaltır 8,9,10. Ozmotik mini pompa, kısa bir yarı ömre sahip bir ilacın sürekli olarak verilmesine izin vererek, her ikisi de büyük hayvan modellerinde uygulanması zor olan bir infüzyon pompasına ve patentli intravenöz kanüle olan bağımlılığı ortadan kaldırır.
Bu teknikleri açıklayarak, bu makalenin büyük hayvan modellerinde miyokard enfarktüsünü takiben yeni kardiyoprotektif veya rejeneratif ajanları araştırmada translasyonel bilim adamlarına yardımcı olabileceği umulmaktadır.
Protokol
Tüm deneyler, 'Hayvanların bilimsel amaçlarla bakımı ve kullanımı için Avustralya koduna' uygun olarak gerçekleştirildi ve Batı Sidney Yerel Sağlık Bölgesi Hayvan Etik Komitesi tarafından onaylandı. Bu çalışmada 18-20 kg ağırlığında ergenlik öncesi büyük beyaz x landrace yaldızları kullanılmıştır.
1. Hayvancılık
- Hayvanları yerel hayvan etik kurulu düzenlemelerine göre barındırın.
NOT: Bu protokole dahil olan hayvanlar, kavga ve yaralanmaları önlemek ve yiyecek için rekabet olmamasını sağlamak için ayrı ayrı barındırılır. Bununla birlikte, tüm hayvanlar türdeşleri görebilir, duyabilir ve koklayabilir. Kalemleri, temizlik kolaylığı için beton zemine sahiptir ve hem iç hem de dış korunaklı bir kısma sahiptir. Domuzlara iç kısımda saman yatak takımı ve dış kısımda zenginleştirme 'oyuncakları' sağlanır.
2. Sedasyon ve genel anestezi
- Sedasyon
- Herhangi bir ağır sedasyon veya genel anesteziye başlamadan önce hayvanın en az 12 saat aç kaldığından emin olun.
- Hayvanın henüz merkezi bir hat şeklinde vasküler erişimi yoksa, kas içi yatıştırıcı bir protokol kullanın.
- İntramüsküler sedasyon 8 mg/kg ketamin, 0.3 mg/kg midazolam, 0.2 mg/kg metadon ve 10 μg/kg medetomidinden oluşur (bkz. Bu karışımı 21 G'lik bir iğne ile hayvanın epaxial kas sistemine uygulayın. Ortalama olarak, hayvanların yoğun bir şekilde sakinleşmesi 5-10 dakika sürer.
NOT: Stresli bir domuz sedasyona daha dirençlidir; Sakin ve kendine güvenen bir işleyicinin hayvanı sakinleştirdiğinden ve hayvanın gereksiz yere strese girmediğinden emin olun. Hayvan strese girerse, onları 5-10 dakika yalnız bırakmak ve tekrar denemek en iyisidir. - Merkezi bir hat varsa ve patentliyse intravenöz sedasyon gerçekleştirin. İntravenöz sedasyon 2 mg/kg ketamin, 0.2 mg/kg midazolam, 0.2 mg/kg metadon ve 2 μg/kg medetomidinden oluşur.
- Açıklığı sağlamak için intravenöz hattı önce %0.9 sodyum klorür ile yıkayın. Ardından, karışık şırınganın yarısını yavaşça çizgiden geçirin ve% 0.9 sodyum klorür ile yıkayın.
- 20-30 saniye içinde yoğun bir şekilde yatıştırılması gereken hayvanı gözlemleyin. Hayvan henüz sakinleştirilmemişse, adım 2.1.5'te açıklandığı gibi şırınganın kalan yarısını yıkayın.
- Vasküler erişim
- Uygun şekilde sakinleştirildikten sonra domuzu ameliyathaneye taşıyın.
- Domuzu bir yüz maskesi ve 5 L/dk oksijen akış hızı ile önceden oksijenlendirin. Hayvanı baştan sona izlemek için domuzun kuyruğuna, kulaklarına veya diline bir nabız oksimetresi bağlayın.
- 22 veya 24 G'lik bir kanül kullanarak hem sol hem de sağ marjinal kulak damarlarına erişin ve bantla sabitleyin.
- Genel anestezi
- Domuzu sternal yaslanmaya yerleştirin.
- Etkili olmak için titre edilmiş yavaş bir itme olarak intravenöz olarak 1-3 mg / kg propofol uygulayın (Malzeme Tablosuna bakınız). Bir asistanın hayvanın ağzını açık tutmasını sağlayın (bu aşamada çene gevşek olmalıdır) ve boynunu uzatın.
- Gırtlağın aritenoid kıkırdaklarını ortaya çıkarmak için dilin tabanını ve epiglotu bastırmak için bir laringoskop (Malzeme Tablosuna bakınız) kullanın.
- Yağlanmış bir endotrakeal tüpü (5.5 veya 6.0 boyutunda; Malzeme Tablosuna bakınız) bir stile ile aritenoid kıkırdaklardan ve trakeaya geçirin. Bazen, gırtlaktan geçerken direnç hissedilebilir; Bu, endotrakeal tüpün hafifçe döndürülmesiyle karşılanabilir. Hayvan entübasyona direniyorsa, intravenöz olarak daha fazla propofol uygulayın.
- Stileyi endotrakeal tüpten çıkarın. Tüpün etrafında hava sızıntısı olmadığından emin olana kadar endotrakeal tüp manşetini şişirin. Genel olarak, 4-6 mL hava gereklidir, ancak hacim tüp boyutuna ve hayvana bağlı olarak değişebilir.
- Endotrakeal tüpü hayvanın kulaklarının arkasına sabitleyin.
- Hayvanı, hacim kontrollü ventilatör işlevine sahip bir solunum anestezik devresine bağlayın. Hayvan bağlandığında, ventilatörü 'kapatın'.
NOT: Ayarlanabilir basınç sınırlama (APL) valfinin veya 'boşaltma valfinin' her zaman açık olduğundan emin olun. Valfin açık bırakılmaması, hayvanda ölümcül barotravmaya neden olabilir. - Anestezik devre oksijen akış hızını 2 L/dk'ya düşürün.
- Pozitif basınçlı ventilatörü 'ses kontrolü' moduna ayarlayın. Tidal hacmi 10 mL/kg ve solunum hızını 20 nefes/dk olarak ayarlayın. İnspiratuar: ekspiratuar oranının 1:2 olarak ayarlandığından emin olun.
- Prosedür boyunca, gelgit sonu karbondioksitin 35-50 mmHg arasında olduğundan emin olmak için solunum hızını manipüle edin.
NOT: İnspiratuar basınç 20cmH2O'yu geçmemelidir. İnspiratuar basınçtaki artışlar, boru bükülmeleri veya tıkanıklıkları için araştırma yapılmasını sağlar. Hortumla ilişkili olmayan artan basınçları hafifletmek için, inspiratuar: ekspiratuar oran 1: 1.5'e düşürülebilir ve gelgit hacmi azaltılabilir. - Hayvan hemodinamik olarak stabil ise, inhalan anestezi ile koruyun. Hayvan hemodinamik olarak stabil değilse, adım 2.3.14'te açıklandığı gibi toplam intravenöz anestezi ile bakımını yapın.
- Hayvana inhalan anestezi uygulanacaksa, anestezik devrenin ilk bağlandığı andan itibaren% 2.5 izofluran ile başlayın.
- Sonraki 30 dakika boyunca, hayvanı kademeli olarak% 1.5 inhale izoflurana kadar sütten kesin. İşlemin sonuna kadar hayvanı% 1.5 izofluran üzerinde tutun.
- Palpebral refleksleri kontrol ederek ve çene tonunu test ederek her 10 dakikada bir anestezi derinliğini değerlendirin. Anestezik derinliği korumak için izofluranı gerektiği gibi ayarlayın.
- Hayvan hemodinamik olarak kararsızsa, inhalan anestezik ajanlarla ilişkili kardiyovasküler komplikasyonlar olmadan daha fazla anestezik derinlik kontrolüne izin vererek bunları total intravenöz anestezi ile koruyun.
- Şırınga pompalarını veya propofol, fentanil ve midazolam içeren standart sıvı pompalarını hazırlayın. Bunları ortak bir hat üzerinden hayvana bağlayın.
NOT: Propofol 0.1-0.6 mg / kg / dak'da, fentanil 1-5 μg / kg / s'de ve midazolam 0.05-0.2 mg / kg / s'de çalıştırılabilir. - İnhalan anestezide olduğu gibi, uygun anestezik derinliği korumak için bu ilaçları anestezi boyunca etki edecek şekilde titre edin.
- Şırınga pompalarını veya propofol, fentanil ve midazolam içeren standart sıvı pompalarını hazırlayın. Bunları ortak bir hat üzerinden hayvana bağlayın.
- %0.9 sodyum klorür veya Hartmann solüsyonu (Malzeme Tablosuna bakınız) ile 5 mL/kg/s oranında intravenöz sıvı desteği sağlayın.
- Hayvanı kan basıncı ölçümleri, kapnografi, anestezik gaz izleme, sıcaklık, nabız oksimetresi ve elektrokardiyografi ile izleyin.
- Herhangi bir prosedür boyunca, premedikasyondan sonra her 4 saatte bir intravenöz olarak 0.2 mg / kg metadon şeklinde ek analjezi sağlayın.
NOT: Hayvan anestezi altındayken ağrı belirtileri gösteriyorsa (taşikardi, idame ilaçlarında değişiklik yapılmadan hafifletilmiş anestezik derinlik) analjezi daha kısa aralıklarla uygulanabilir.
3. Merkezi hat yerleşimi
- Domuzu arka ayakları uzatılmış, sol ön ayakları uzatılmış ve sağ ön ayakları bükülmüş ve bir bağ ile sabitlenmiş olarak sırt yaslanmış olarak konumlandırın.
- Domuzun boynunu aseptik olarak hazırlayın ve bir örtü ile örtün.
- Sağ juguler veni bulmak için steril bir örtüye sahip doğrusal bir ultrason probu ( Malzeme Tablosuna bakınız) kullanın. Bu en iyi şekilde, probun trakeaya dik olarak yönlendirilmesi ve yavaşça gırtlaktan yanal olarak hareket ettirilmesiyle elde edilir.
- Şah damarını tanımlamaya yardımcı olması için renkli doppler modunu etkinleştirin. Juguler ven, katlanabilirlik ve sürekli, pulsatil olmayan akış göstererek karotid arterden ayırt edilebilir.
- Ultrason rehberliğinde damara erişmek için 18 G Cook iğnesi (Malzeme Tablosuna bakın) kullanın. Erişim sağlandıktan sonra, iğneden 0.035 inçlik bir J-uçlu tel ( Malzeme Tablosuna bakın) geçirin ve kaba geçirin. İğneyi telin üzerinden çıkarın.
- Telin üzerinden önceden yıkanmış bir merkezi hat geçirin ve damarın içine doğru itin. Telin her zaman hattın distal ucundan çıkarken görünür olduğundan emin olun.
NOT: 1-4 haftalık bir süre boyunca intravenöz erişim gerektiren denekler için 5 Fr, iki lümenli santral venöz kateter (bkz. Malzeme Tablosu) kullanıldı. - Çizgiyi deriden ilerletmekte zorluk çekiyorsa, çizginin tel üzerinden geçişini kolaylaştırmak için küçük, 2-4 mm'lik bir kesi oluşturmak için 11 numaralı bir neşter kullanın. Açıklığı sağlamak için her bir dış hatta negatif basınç ve ardından yıkama uygulayın. Her satırı sıkıştırın.
- Sağlanan ankrajları dış hatlara takın ve 2-0 veya 3-0 çözünmeyen dikişlerle yerlerine sabitleyin (bkz. Hayvanın çiğnemesini önlemek için dış çizgileri dorsal olarak sabitlemek için ek dikişler yerleştirin.
- Yıkanmış uzatma hatlarını harici kateter hatlarına takın ve kelepçeleyin.
- Hayvana ticari bir domuz ceketi takın ( Malzeme Tablosuna bakın) ve içindeki çizgileri sabitleyin. Aynı anestezi sırasında başka prosedürler henüz gerçekleştirilmeyecekse, hayvan iyileşmesinden hemen önce ceketi takın.
4. Miyokard enfarktüsü
NOT: Bu modelde kullanılan hayvanlar, daha önce yayınlanmış bir yöntem7 izlenerek miyokard enfarktüsü aldı.
- Transepikardiyal ve transendokardiyal enjeksiyon prosedürlerinden 2 hafta önce miyokard enfarktüsü uygulayın 8,9,10. Aynı prosedür içinde koroner reperfüzyonu takiben ozmotik minipompa implantasyonu yapıldı.
5. İlaç veya hücre uygulaması
- Torakotomi ve epikardiyal hücre enjeksiyonu
- İntravenöz profilaktik antibiyotikleri 22 mg / kg sefazolin şeklinde uygulayın (bkz. İşlem boyunca her 90 dakikada bir devam edin.
- Hayvanı sağ yanal yaslanma pozisyonunda konumlandırın.
- Domuzun kulaklarının arkasındaki düz düzleme 100 μg/s'lik bir fentanil yaması ( Malzeme Tablosuna bakınız) uygulayın. Yapışkan bir pansuman veya 2-0 dikiş ile örtün.
NOT: Bu yama, yerleştirildikten 12 saat sonra 'aktif' olarak kabul edilir ve 72 saat boyunca analjezi sağlar. - Elektroanatomik haritalama sistemi kablolarını ve yamalarını ürün özelliklerine göre ayarlayın (bkz. Malzeme Tablosu).
- Hayvan üzerinde 4 ve 5 numaralı kaburgalar arasında 10 cm'lik yatay bir çizgiyi bir mum boya veya cerrahi işaretleyici ile işaretleyin.
- 25 G iğneli tek bir şırıngada lidokain (2 mg / kg) ve bupivakain (1 mg / kg) karışımı hazırlayın.
- Ameliyat bölgesini aseptik olarak hazırlayın ve hayvanı örtün. İğneyi cilde sığ bir açıyla sokarak, şırıngaya kanın geri akmamasını sağlamak için pistonu hafifçe geri çekerek ve iğne ciltten çekilirken çözeltiyi yavaşça enjekte ederek işaretli kesi bölgesinde bir kutanöz çizgi bloğu gerçekleştirin. Çizgide aşağı doğru ilerlerken bu işlemi tekrarlayın.
NOT: Bupivakainin intravasküler olarak uygulanmadığından emin olmak için her yeni enjeksiyon bölgesinde şırıngaya negatif basınç uygulanmalıdır. İntravasküler bupivakain hızla ölümcül olabilir. - 22 numaralı bir neşter kullanarak, işaretli çizgi boyunca 10 cm'lik bir cilt kesisi yapın.
- Monopolar koter kullanarak (bkz. Malzeme Tablosu), interkostal kaslara ulaşılana kadar insizyonu alttaki kas katmanlarından derinleştirin.
- 0.5 mg / kg bupivakain ve 1 mg / kg lignokain içeren steril bir şırınga hazırlayın ve 25 G'lik bir iğne takın.
- İğneyi dördüncü kaburganın kuyruk kenarına sığ bir açıyla yerleştirin. İğnenin interkostal ven veya arterden geçmediğinden emin olmak için pistona negatif basınç uygulayın. İğneyi sabit tutarken şırınganın hacminin dörtte birini yavaşça enjekte edin.
- Adım 5.1.12'yi dördüncü kaburganın kuyruk kenarı boyunca 3-5 cm aralıklarla üç yerde daha tekrarlayın.
- İnterkostal kasları dikkatlice kesmek için Metzenbaum makasını ( Malzeme Tablosuna bakınız) kullanın, ardından anestezist ile onayladıktan sonra plevrayı kesin.
- Plevra kesilirken, akciğerlerin plevradan uzaklaşmasına izin vermek için ventilatörü kapatın. Kesi yapıldıktan sonra ventilatörü tekrar açın ve pozitif ekspiratuar sonu basıncını 4 cmH2O'ya ayarlayın.
- Kendinden tutucu kaburga ekartörlerini kaburgaların arasına yerleştirin ve kalbi ortaya çıkarmak için yavaşça açın. Doku forseps kullanarak perikardın altını nazikçe kavrayın ve kalbin dışa açılabilmesi için Metzenbaum makasıyla kesin.
NOT: Bu adımda ve sonraki birkaç adımda aritmiler yaygındır. EKG'nin yakından izlenmesi gerekir ve hayvan hemodinamik olarak kararsız hale gelirse (ortalama arter basıncı 55 mmHg'nin altındaysa) herhangi bir kardiyak manipülasyon geçici olarak durdurulmalıdır. Kan basıncını iyileştirmek için intravenöz metaraminol bolusları (0.25 mg) uygulanmalıdır. - Göğüs duvarına sabitlemek ve perikardiyal bir kuyu oluşturmak için perikardiyal insizyonun her iki ucuna ve yanlarına geçici 2-0 kalıcı dikişler yerleştirin. Perikardın kenarlarının desteklendiğinden emin olun, perikardiyal mümkün olduğunca sığ hale getirin.
- Kalbi çevreleyen bölgeyi paketlemek için nemli bezler veya laparotomi süngerleri kullanın. Bu, kalbin stabil kalmasına ve açıkta kalan dokuların kurumasını önlemeye yardımcı olacaktır.
- Kalbin tepesini perikardiyal boşluğun içinden sol ventrikülün arkasında bir işaret parmağı ile verin. Sol ventrikül kompresyonunu en aza indirmeye özen gösterin.
NOT: Sağlıklı bir kalp, apeks dikey olarak bakacak şekilde, hafif bir destekle ancak sıkıştırma olmadan tabanına oturarak rahatça atabilir. Manipülasyonla ilişkili kan basıncında başlangıçta bir azalma vardır, ancak bu, dış ventriküler kompresyon olmadığında kabul edilebilir bir seviyeye geri dönmelidir.- 15 saniye içinde iyileşme olmazsa veya çok yavaş bir iyileşme meydana gelirse, kalbi hemen perikardiyal boşluğa geri getirin ve daha fazla çıkıktan önce hemodinamik parametreleri iyileştirmek için gerekli adımları atın.
NOT: Ventrikül yerinden çıkabiliyorsa, ventrikülü desteklemek için perikard içine uygun boyutta gazlı bez paketleri yerleştirilerek apeksin perikard dışındaki konumu korunabilir. Benzer şekilde, uzatılmış, nemlendirilmiş bir sürüntü, kalp apeksi yukarı doğru insizyona doğru yönlendiren bir 'askı' görevi gördüğü kalbin tabanının altına yerleştirilebilir (Şekil 1A).
- 15 saniye içinde iyileşme olmazsa veya çok yavaş bir iyileşme meydana gelirse, kalbi hemen perikardiyal boşluğa geri getirin ve daha fazla çıkıktan önce hemodinamik parametreleri iyileştirmek için gerekli adımları atın.
- Elektrofizyolojik haritalama kateteri kullanarak sol ventrikül epikardiyal yüzeyinin elektroanatomik voltaj haritasını oluşturun (Şekil 1B). Standart voltaj kesintileri ile yara izi, sınır ve uzak bölgeleri tanımlayın.
NOT: Skar ve uzak bölge, sırasıyla <0.5 mV veya >1.5 mV'lik bipolar kesmeler ve <3 mV veya >8.3 mV'lik tek kutuplu kesmeler ile tanımlandı11,12. - 27 G terapötik dağıtım şırıngasının iğnesini kabaca 80-90° açıyla bükün.
- İğneyi hedef dokuya sığ bir açıyla ilerletin ve toplam hacmin 1/4 ila 1/3'ünü boşaltmak için şırınga pistonuna basınç uygulayın. Dokunun beyazlamasına dikkat edilmelidir (Şekil 1C). Oluşturulan epikardiyal voltaj haritasında enjeksiyon bölgesi konumuna açıklama eklemek için elektrofizyolojik haritalama kateterini kullanın (Şekil 1D).
NOT: Hücre kültürü ortamından (RPMI 1640) oluşan araç enjeksiyonları, video protokolünde gösterim amacıyla kullanılmıştır. - İğneyi kısmen geri çekin ve miyokard içine yönlendirin. Şırınga hacminin 1/4 ila 1 / 3'ünü boşaltın. Şırınga boşalana kadar devam edin.
- İstenen doz verilene kadar 5.1.20-5.1.24 adımlarını tekrarlayın.
- Kalbi paketleyen swabları çıkarın ve kalbin altındaki 'askıyı' nazikçe çıkarın, böylece nötr konuma geri döner. Bu adımda aritmiler yaygındır ve adım 5.1.17'de açıklandığı gibi dikkatli olunmalıdır.
- 2-0 kalma dikişlerini perikarddan çıkarın. Ekartörü gevşetin ve göğüsten çıkarın.
- Kaburga 3 ve 4 ile kaburga 5 ve 6 arasındaki boşluklardan geçirerek göğüs kafesini kapatmak için künt uçlu, yuvarlak iğneli 1 numara polidioksanon sütürler (PDS) kullanın.
NOT: Dar şekil sekiz sütürler, kaburgalara yaklaşmak için bir makara etkisi sağlar. Hayvan büyüklüğüne bağlı olarak bu tür iki veya üç dikiş kullanılmalıdır. - Kaburgaya yaklaşan dikişleri sıkmadan ve bağlamadan önce, insizyonun ventral kenarına kısa bir silikon boru yerleştirin.
- Plevral boşluğun su altında sızdırmaz drenajı için borunun serbest ucunu bir steril salin kasesine yerleştirin.
- Üstteki kas katmanlarını 2-0 emilebilir dikişlerle basit ve sürekli bir düzende kapatın. Cildi 2-0 veya 3-0 emilmeyen bir sütür ile basit bir sürekli veya ford birbirine kenetlenen desen13 ile kapatın.
- Yara kapanması tamamlandığında, pozitif basınçlı ventilasyonun etkisi ile serbest havayı torakstan dışarı atın.
- Ventilatörü 'serbest solunum' ayarına getirin. Hava yollarına tutarlı pozitif basınç sağlamak için yeniden solunum devresindeki rezervuar torbasını kullanın (20-30 cmH2O'da tutun).
- Tuzlu su haznesinde artık kabarcıklanma gözlenmeyene kadar bu basınca devam edin, bu da göğüs kafesinde serbest hava olmadığını gösterir.
- Silikon tüpü çıkarın.
- Ameliyat bölgesine yapışkan bir pansuman uygulayın ve pansumanı yerinde tutmaya yardımcı olmak için dağınık basit kesintili dikişler yerleştirin.
- İyileşme sırasında, deri altından 0.3 mg / kg metadon ve intravenöz olarak 0.2-0.5 mg / kg ondansetron (bkz.
- Juguler ven ozmotik mini pompa implantasyonu
- Hayvanı adım 3.1'de açıklandığı gibi konumlandırın. Hayvanın boynunun sağ tarafını aseptik olarak hazırlayın ve örtün.
- 22 numaralı bir neşter bıçağı kullanarak, manubrium sterni'ye 2-3 cm yanal bir noktadan kraniyal olarak uzanan 8-10 cm'lik bir kesi yapın. Bu kesi kraniyal olarak hareket ettikçe biraz daha lateral hale gelmelidir.
- Kutanöz colli, sternohyoideus ve sternocephalicus kaslarını incelemek için Metzenbaum makasını kullanın. Dış juguler ven görünene kadar insizyonu derinleştirmek için künt diseksiyon tekniklerini kullanın.
- Kendinden tutucu ekartörleri insizyona yerleştirin ve görünürlüğü artırmak için açın.
- Adson kahverengi doku forseps (bkz . Malzeme Tablosu) ve Metzenbaum makası kullanarak, juguler veni çevreleyen yumuşak dokuyu hem üstte hem de altta çıkarın (Şekil 2A). Bu çok önemli bir adımdır, çünkü sonraki aşamalarda damarın üzerindeki yumuşak doku mini pompa hortumunun geçişini engelleyebilir.
- Damarın kaudal görünen ucundan, damarın en kaudal görünen kenarından yaklaşık 1 cm kraniyal 5-0 emilebilir sütür kullanın. Sütürü 5 mm'lik 'ısırıklar' halinde şu şekilde geçirin: sağ tarafta kraniyalden kaudal, sağdan sola ve sol tarafta kaudalden kranial. Ortaya çıkan desen 'bir karenin üç kenarı' olarak görünmelidir. Her iki ucun dikiş kuyruklarının eşit uzunlukta olduğundan emin olun.
- Mini pompayı ürün kullanım kılavuzunda açıklandığı gibi monte edin (bkz. Malzeme Tablosu).
- Hem kraniyal hem de kaudal uçlarda damarın etrafına ilmek elastik vasküler bağları bağlayın. Başlangıçta bunları gevşek tutun. Damarı tıkamak için damar bağlarına gerginlik yerleştiren bir asistan bulundurun.
- 14 G'lik bir iğne kullanarak, dikiş materyali ile oluşturulan 'üç taraflı karenin' ortasındaki damarda bir delik oluşturun (adım 5.2.7; Şekil 2B).
- Mini pompa borusunu deliğe geçirin. Gemiye kolayca geçmelidir. Dirençle karşılaşılırsa, itmeye devam etmeyin; bunun yerine hortumu dışarı çekin ve tekrar deneyin.
- Boruyu kabın dışında 1-2 cm kalana kadar ilerletin. Dikiş malzemesini kateter hortumunun etrafına sıkın ve basit bir kesintili düğümle bağlayın. Asistanın damar bağlarını serbest bırakmasını ve çıkarmasını sağlayın.
- Mini pompa gövdesinin etrafına birkaç kez 2-0 emilmeyen bir sütür sarın ve sütür pompaya sabitlenecek şekilde bağlayın. Ardından, pompayı basit bir kesintili düğümle yakındaki yumuşak dokuya sabitleyin (Şekil 2C,D).
- Ekartörleri kesiden çıkarın. Kesi işlemini standart üç katmanlı basit sürekli bir kapatma ile kapatın.
- İyileşme sırasında deri altına 0.2 mg / kg meloksikam uygulayın.
- Perkütan transendokardiyal enjeksiyon
- Hayvanı, ön ayakları ve arka ayakları uzatılmış olarak sırt yaslanmış olarak konumlandırın ve bağlarla sabitleyin.
- Aseptik olarak hayvanın kaudal karnını ve medial uyluklarını hazırlayın. Hayvanı fenestre femoral anjiyografi örtüsü ile örtün (bkz.
- Elektroanatomik haritalama sistemi kablolarını ve yamalarını ürün özelliklerine göre ayarlayın (bkz. Malzeme Tablosu).
- Femoral arteri tanımlamak için doğrusal bir ultrason probu kullanın. Ultrason rehberliğinde, femoral arteri bir pişirme iğnesi ile delin ve iğne yoluyla damara 0.035 inçlik bir kılavuz tel geçirin. İğneyi telin üzerinden çıkarın.
- 8 Fr'lik bir arteriyel kılıf ve tanıtıcıyı arteriyel telin üzerinden geçirin ve sadece göbek cilde maruz kalana kadar itin. Telin her zaman görünür olduğundan ve kılıfın göbeğinden çıktığından emin olun.
NOT: Bu daha büyük bir kılıf olduğundan, bazen geçişi kolaylaştırmak için küçük bir cilt kesisi oluşturmak için 11 numaralı bir neşter gerekebilir. - Kılıf tanıtıcıyı ve kabloyu çıkarın. İntravenöz heparin uygulayın (100-200 birim / kg).
- Transendokardiyal enjeksiyon kateterini kılıftan geçirin ve retrograd aort yaklaşımıyla sol ventriküle ilerleyin.
- Kateteri endokardiyal yüzey boyunca hafifçe sürükleyerek sol ventrikülün elektroanatomik bir haritasını oluşturun. İyi endokardiyal temas elde etmek için eksenel rotasyon ve uç fleksiyonunda hafif değişiklikler yapın. Standart voltaj kesintileri ile yara izi, sınır ve uzak bölgeleri tanımlayın.
- Kateteri floroskopik ve elektroanatomik kılavuzlukla tercih edilen enjeksiyon yerine yönlendirin. Stabil endokardiyal teması devreye sokmak ve sürdürmek için distal ucun sapmasıyla hafif eksenel rotasyon gerçekleştirin.
- Kateter ucunun yerleşimini en az iki floroskopik görünümle onaylayın. Çekirdek kateteri nazikçe ilerletin, ardından iğneyi kontrollü bir intramiyokardiyal derinliğe kadar uzatın (apikal enjeksiyon için 3,5 mm, septal enjeksiyon için 5 mm).
- Floroskopide görünene kadar enjeksiyon kateterinden 4-6 mL iyotlu kontrast (Malzeme Tablosuna bakınız) akıtın. Dokuda kaldığından emin olmak için sonraki 10-30 saniye boyunca kontrastı gözlemleyin (Şekil 3A).
- Ventriküler ektopi akıntıları yaygın olduğundan, iğnenin uzatılması ve enjeksiyon sırasında EKG'yi yakından izleyin.
NOT: Ventriküler ektopi, iğne ucunun miyokardiyal temasa geçtiği zamandır. - Kontrast enjeksiyonu başarılı olursa, ilgilenilen ajanın enjeksiyonunu takip edin. Floroskopik olarak gözlemlenene kadar bunu kontrastla yıkayın.
NOT: İlgilenilen ajan, hangi tedaviyi test ettiklerine bağlı olarak kullanıcıya özeldir. - İğneyi geri çekin. Enjeksiyon kateterini arteriyel kılıftan çıkarın.
- Arteriyel kılıfı çıkarın ve hemostaz elde edilene kadar bölgelere 20 dakikaya kadar basınç uygulayın.
6. Genel anestezik iyileşme
- Kullanılan inhalan anestezik veya intravenöz anestezik pompaları kapatın. Ventilatördeki solunum hızını 8-10 nefes/dk'ya düşürün.
- 2-5 dakika sonra, ventilatörü bir seferde en fazla 30 saniye boyunca 'serbest nefes alma' moduna geçirin. Spontan solunum için hayvanı ve kapnografı gözlemleyin.
- Spontan solunum meydana gelirse, ventilatörü kapalı bırakın. Hayvan apneli ise, ventilatörü 1-2 dakika daha açın ve spontan solunum sağlanana kadar tekrar deneyin.
NOT: İyileşme süresi, prosedür ve hayvan özelliklerine bağlı olarak değişkendir, ancak 15 dakika ile 1 saat arasında değişebilir. - Hayvan rahat bir şekilde nefes aldığında (solunum hızı 15-30 nefes/dk, gelgit sonu karbondioksit 60'tan az, SpO2 %95'in üzerinde), oksijeni kesin ve diğer izlemeyi bağlı bırakın.
- Geçici vasküler erişim bölgelerini çıkarın ve hematom oluşumunu önlemek için basınç uygulayın. Hayvan stabil kalırsa ve takip eden 5 dakika boyunca iyi oksijenlenmeye devam ederse, iyileşme alanına taşınabilir.
- Art arda üç spontan yutkunmadan sonra, endotrakeal tüpün manşetini söndürün ve tüpü yavaşça çıkarın.
- Uygun şekilde oksijenlenmeye devam ettiklerinden ve herhangi bir solunum sıkıntısı yaşamadıklarından emin olmak için hayvanı en az 5 dakika daha izleyin. Bir hayvan ekstübasyondan sonra doygunluğu giderirse, akış oksijeni gerektiği gibi kullanılmalıdır.
Sonuçlar
Torakotomi ve epikardiyal hücre enjeksiyonu
Torakotomi ve epikardiyal enjeksiyon yapılan 29 hayvandan 26'sı hayatta kaldı. Histolojik analiz, hayatta kalan tüm hayvanlarda bu yöntemle verilen insan hücrelerinin aşılandığını doğruladı (Şekil 1E). Bir hayvan hücre enjeksiyonu sırasında ölümcül aritmiler yaşadı ve yeniden canlandırılamadı. Bir diğeri, kapanma sırasında nabızsız elektriksel aktivite yaşadı ve hava yollarına uzun süreli pozitif basınç uygulandı ve geri kazanılamadı. Üçüncü bir hayvan hem kustu, hem de ekstübasyon sırasında solunum durmasına girdi. Bu hayvan hayata döndürülemedi.
İki hayvan büyük komplikasyonlar yaşadı ancak kurtarılabildi. Bir hayvanda intramiyokardiyal enjeksiyon sırasında ventriküler fibrilasyon gelişti ve dahili defibrilasyon kürekleri ve kalp masajı ile resüsitasyon yapılabildi. İkinci hayvan ekstübasyon üzerine kustu ve kısa bir solunum durması geçirdi, ancak hızla yeniden entübe edildi ve iyi bir şekilde iyileşti. Bu olayların tümü erken deneyler sırasında meydana geldi ve protokolle ilgili ekip deneyimi arttıkça advers olaylar azaldı (Tablo 1).
Juguler ven ozmotik mini pompa implantasyonu
Juguler ozmotik minipump implantasyonu ile ilişkili mortalite veya majör komplikasyon bildirilmemiştir. Yedi hayvanın çoğu, ilk 24 saat içinde ameliyat bölgesinde hafif şişlik yaşadı ve bu da müdahale edilmeden düzeldi. Pompa implantasyonundan sonraki 3. günde serum üzerinde gerçekleştirilen ELISA, kontrol7'ye kıyasla trombosit kaynaklı büyüme faktörü-AB insanının (PDGF-AB) önemli bir kan konsantrasyonuna ulaşarak pompanın etkinliğini gösterdi (Şekil 2E).
Perkütan transendokardiyal enjeksiyon
Toplam 22 hayvana endokardiyal enjeksiyon yapıldı. Bu enjeksiyonlardan 17'si, ölüm sonrası hedef dokuda gözlenen floresan veya mürekkep lekelenmesi ile belirlenen 'başarılı' olarak kabul edildi (Şekil 3B). Bu prosedürle ilişkili mortalite yoktu. Bir hayvanda sağ ventrikül perforasyonundan küçük hacimli perikardiyal efüzyon gelişti. Bu kendi kendini sınırladı ve kardiyovasküler uzlaşmaya neden olmadı. Aynı hayvan öldü; Bununla birlikte, bu, intramiyokardiyal enjeksiyondan sonra ilgisiz bir ek prosedürden kaynaklanıyordu.
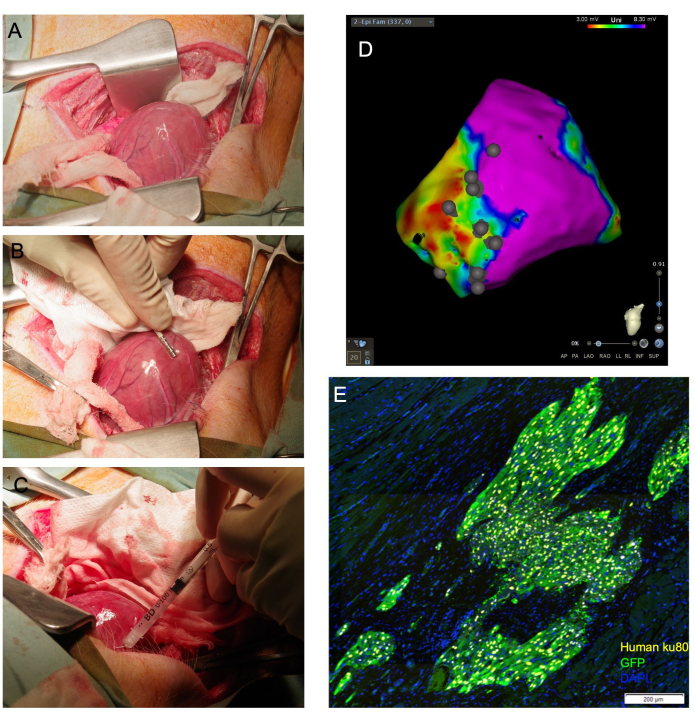
Şekil 1: Transepikardiyal kardiyomiyosit enjeksiyonu, doğrudan kardiyak görselleştirmeye izin verir ve miyokarda iletilen yüksek oranda canlı hücre sağlar. (A) Kalp apeksi, kalbin tabanının altına yönlendirilen nemli bir gazlı bez askısı ile açığa çıkar. (B) Bir epikardiyal haritalama kateteri, yara izini ve sınır bölgelerini tanımlar ve enjeksiyon bölgelerini açıklar. (C) Hücreleri miyokarda transepikardiyal olarak enjekte etmek için 31 G'lik bir iğne kullanılır. (D) Enjeksiyon bölgesi açıklamalı epikardiyal voltaj haritası. Mor: normal voltaj, sağlıklı miyokard; Kırmızı: anormal voltaj, hastalıklı miyokard; Gri noktalar: enjeksiyon bölgeleri. Kurban edildikten sonra, kalp toplanır ve aşağı akış histolojik değerlendirmesi için formalin ile sabitlenir. (E)'de, aşılanmış insan hücreleri, insan anti-nükleer antikoru, Ku80 ve bir anti-GFP antikoru için immün boyama ile tespit edilir. Ölçek çubuğu = 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
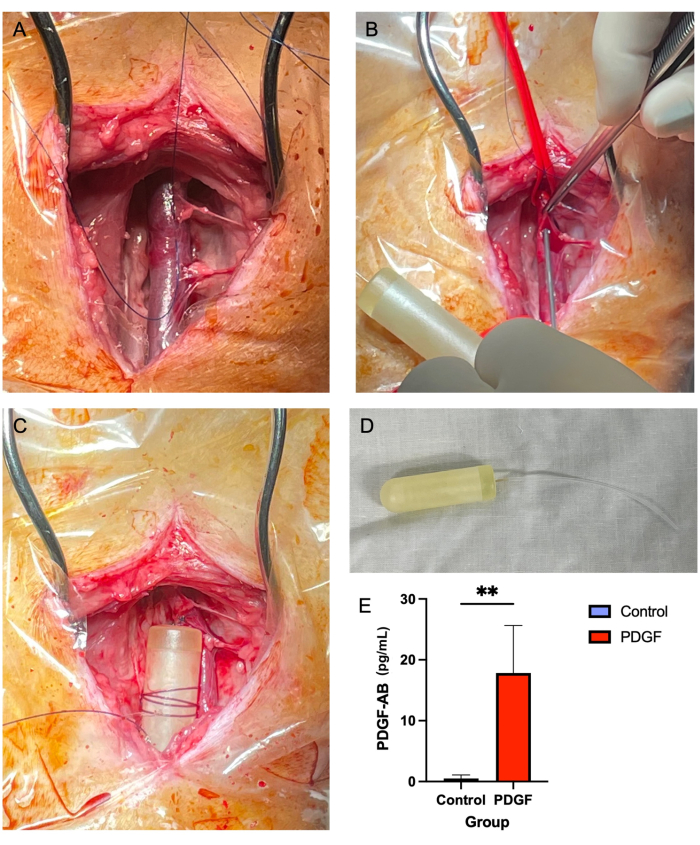
Şekil 2: Juguler ven mini pompa yerleştirilmesi, 7 günlük bir süre boyunca güvenli ve güvenilir bir PDGF iletimi yöntemi sağlar . (A) Sağ juguler ven açığa çıkar ve yumuşak doku damardan temizlenir. (B) Vasküler bağlar damarı tıkarken, mini pompa hortumunun içinden geçirildiği bir delik açmak için 14 G'lik bir iğne kullanılır. (C) Mini pompa hortumu damarın içine ilerletilir ve mini pompa gövdesi bitişik yumuşak dokuya sabitlenir. (D) İmplantasyondan önce mini pompa gövdesi ve hortumu. (E) Minipump ve PDGF-AB yoluyla verilen rekombinant proteinin serum konsantrasyonu, implantasyondan sonraki 3. günde her hayvandan ELISA kullanılarak ölçüldü. PDGF-AB alan hayvanların, kontrol hayvanlarına göre önemli ölçüde daha yüksek kan PDGF-AB konsantrasyonuna sahip olduğu gösterildi ve bu da ozmotik mini pompa uygulama yönteminin etkinliğini doğruladı. **gruplar arasında istatistiksel olarak anlamlı bir fark olduğunu gösterir (p = 0.005, Mann-Whitney U testi) Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
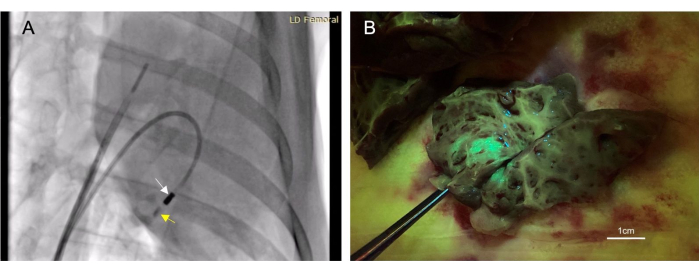
Şekil 3: Transendokardiyal intramiyokardiyal enjeksiyon, minimal invaziv bir terapötik uygulama yöntemine izin verir. (A) Miyokarda kontrast madde (sarı ok) uygulayan enjeksiyon kateterini (beyaz ok) gösteren sağ ön eğik floroskopik görüntü. Kontrast madde enjeksiyonu, terapötik enjeksiyondan önce ve sonra gelir, böylece miyokard içindeki iğne yerleşimi doğrulanabilir. (B) Enjekte edilen vektör, yeşil floresan proteini (GFP) eksprese eder, böylece enjekte edilen materyal doku toplandıktan sonra floresan olur, böylece enjeksiyonun başarısını doğrular. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Transepikardiyal Enjeksiyon (n = 29) | Transendokardiyal Enjeksiyon (n=22) | Ozmotik Mini Pompa (n = 7) | |
| Ölümlülük | 3 | 0 | 0 |
| Ameliyat sonrası kusma ve solunum durması | 1 | 0 | 0 |
| Enjeksiyon sırasında ventriküler fibrilasyon | 1 | 0 | 0 |
| Göğüs kapanması sırasında nabızsız elektriksel aktivite | 1 | 0 | 0 |
| Morbidite | 0 | 1 | 0 |
| Pnömotoraks | 0 | 0 | 0 |
| Plevral efüzyon | 0 | 0 | 0 |
| Kalp odası perforasyonu | 0 | 1 | 0 |
| Kanama | 0 | 0 | 0 |
Tablo 1: Komplikasyonlar listesi.
Tartışmalar
Transepikardiyal intramiyokardiyal enjeksiyon
Bu prosedür doğrudan kardiyak görselleştirme avantajına sahiptir ve terapötiklerin sistemik uygulama yöntemlerinden daha fazla lokal retansiyonu sağladığı gösterilmiştir 9,10,14. Bununla birlikte, torakotomiler invazivdir, önemli teknik beceri gerektirir ve tartışılan diğer yöntemlere göre daha fazla morbidite ve mortalite riski taşır10,15. Prosedürün kritik ve güvencesiz aşamaları hakkında bilgi sahibi olmak, bu artan riskin arabuluculuğuna yardımcı olabilir.
Yüksek aritmi riski ve buna bağlı hemodinamik bozukluk nedeniyle kalp apeksi ortaya çıkarmak için kalbi manipüle ederken çok dikkatli olunmalıdır. Sürekli invaziv kan basıncı izleme ve elektrokardiyografi, hipotansiyon veya kararsız aritmilerin hızlı bir şekilde tanımlanmasına olanak tanıyarak hızlı müdahale ve düzeltmeyi kolaylaştırır. Geçici hipotansiyon genellikle metaraminol bolusları ile tedavi edilebilir. Sürekli hipotansiyon, inhalan anesteziklerin azaltılması (anestezik derinliğin dikkatli bir şekilde izlenmesi) ve bir vazopresör infüzyonunun başlatılması ve aynı zamanda değişen hemodinamiğin nedeninin belirlenmesi ile geçici hale getirilebilir. Ventriküler taşikardi veya ventriküler fibrilasyon gibi kararsız aritmiler, intravenöz antiaritmikler olsun veya olmasın elektriksel kardiyoversiyon ile tedavi edilebilir.
Hayvanların hayatta kalması için eşit derecede önemli olan, göğsü kapatmadan önce plevral boşluktan serbest gazın başarılı bir şekilde çıkarılmasıdır. Bunun yapılmaması, bir pnömotoraks gelişmesiyle sonuçlanabilir ve hayvanı, iyileşme sırasında mekanik ventilatörden ayrıldıktan sonra büyük solunum yetmezliği ve ölüm riskiyle karşı karşıya bırakabilir. Pozitif hava yolu basıncı, kabarcıklanma artık gözlenene kadar en az 30 saniye boyunca korunmalıdır. Silikon boru, kabarcıklanmanın durması üzerine derhal çıkarılır ve daha sonra toraks hızla kapatılır. Ayrıca, bir torakostomi tüpünün cerrahi olarak kapatılmasına yerleştirilmesi de mümkündür, bu da sonraki 24-72 saat boyunca manuel hava ve enflamatuar sıvının çıkarılmasına izin verir. Bununla birlikte, özellikle hayvanlar bir arada barındırılıyorsa, bunun temiz ve sağlam tutulması zordur. Tüpün hasar görmesi veya kirlenmesi piyomotoraks, pnömotoraks veya sepsise yol açabilir. Deneyimlerimize göre, göğüs kapanmadan önce serbest gaz yeterince çıkarılırsa geçici bir göğüs dreni takılması gerekli değildir.
Perkütan transendokardiyal intramiyokardiyal enjeksiyon
Bu terapötik uygulama yöntemi, cerrahi yaklaşıma kıyasla daha az invaziv doğası nedeniyle daha düşük riskle lokal doku dağıtımına izin verme avantajına sahiptir10,14. Bu teknik, doğrudan görselleştirmenin yokluğunda kılavuz olarak hem floroskopi hem de elektromekanik haritalama ile büyük hayvan çalışmalarında zaten kullanılmaktadır10,16,17.
Kalbin doğrudan görüş altında olmadığı göz önüne alındığında, prosedür uzmanının bir enjeksiyon bölgesi seçerken ortogonal floroskopik görünümleri kullanması ihtiyatlıdır. Ayrıca, terapötik maddenin uygulanmasından önce ve verilmesinden önce seyreltilmiş iyot kontrastının enjeksiyonu, miyokardiyal teması doğrulamada son derece değerlidir. Uygun temas, doku alımından önce enjeksiyon başarısının tek belirteçlerinden biri olabilecek karakteristik bir 'miyokardiyal allık' gözlemlenerek doğrulanabilir. Hazne perforasyonu riski nedeniyle, seçilen enjeksiyon bölgesindeki miyokard duvar kalınlığının da 9 mm'den büyük olması önerilir14,16.
Juguler venöz ozmotik mini pompa
Ozmotik mini pompa, küçük hayvan çalışmalarında yaygın olarak kullanılan popüler bir cihazdır. Terapötik bir ajanın belirli bir süre boyunca tutarlı bir oranda uygulanmasının benzersiz avantajı göz önüne alındığında, bu cihazın büyük hayvan modellerinde 7,18,19 kullanılmasına artan bir ilgi olmuştur. Bu yöntemin olası bir sınırlaması, pompayı değiştirmeden veya çıkarmadan ilacın infüzyon hızlarını değiştirememesi veya durduramamasıdır. Tedaviyi bu şekilde denemeden önce bu düşünülmelidir.
Bu çalışma, bu yöntemin domuzlarda yüksek başarı oranı, düşük morbidite ve mortalite ile uygulanabileceğini göstermiştir. Lenf düğümleri, timus ve karotis arter dahil olmak üzere birçok hayati yapının cerrahi bölgeye bitişik olduğu unutulmamalıdır. Yönteme bağlı kalınması ve anatomik metinlerin20 konsültasyonu, bu yapılardan herhangi birinin kasıtsız olarak zarar görmesini önlemek için şiddetle tavsiye edilir. Bu yöntemin en önemli komplikasyonu, juguler venin veya çevresindeki bir yapının yanlışlıkla yaralanmasına bağlı hemorajik şoktur. Bu nedenle juguler veni çevreleyen yumuşak dokunun dikkatli bir şekilde çıkarılması çok önemlidir. Bu adımın düzgün bir şekilde tamamlanmaması, mini pompa hortumunun yerleştirilmesinde veya yanlışlıkla kanamanın kontrol edilmesinde zorluklara yol açabilir.
Bu makale, kardiyoaktif terapötiklerin verilmesi için üç yöntem tanımlamıştır. Her tekniğin bildirilen başarısına rağmen, dikkate alınması gereken doğal sınırlamalar vardır. İnvaziv prosedürler (transepikardiyal enjeksiyon) terapötik uygulamanın doğruluğunun artmasına izin verir; Bununla birlikte, potansiyel olarak ölümcül komplikasyon riski daha yüksektir. Ayrıca, invaziv doğum, komplikasyon riskini en aza indirmek için teknik becerilere daha fazla ihtiyaç duyar. Benzer şekilde, floroskopik kılavuzlu, transendokardiyal enjeksiyon, kateterizasyon ve donanımın manipülasyonu için bir dereceye kadar teknik beceri gerektirir. Bu yöntem yanlış yapılırsa, enjeksiyon başarısızlığı ve ölümcül komplikasyonlar mümkündür.
Tarif edilen doğrudan enjeksiyon yöntemleri, bir terapötiğin hedef dokuya bir defaya mahsus uygulanmasına izin verir. Juguler venöz ozmotik mini pompa, 7 günlük bir süre boyunca bir terapötiğin sistemik olarak uygulanmasına izin verir. Nispeten, bu yöntem daha basittir ve daha az riskle ilişkilidir, ancak miyokarda giden yolu bulan sistemik bir terapötik maddeye dayanır. Ek olarak, pompa yerleştirildikten sonra, hayvanı yeniden uyuşturmadan ve pompayı çıkarmadan uygulamayı durdurmak veya doz oranını değiştirmek mümkün değildir.
Bu makalede açıklanan tüm yöntemler, miyokard enfarktüsünden sonraki gün veya 2 hafta sonra hayvanlar üzerinde gerçekleştirildi. Bu nedenle, bu çalışma, sağlıklı hayvanlarda veya alternatif bir kardiyak patolojiye maruz kalan hayvanlarda söz konusu yöntemlerin başarısını bildirememektedir. Son olarak, amaçlanan herhangi bir ajanın farmakolojisi ve biyoteknolojisi dikkatlice düşünülmelidir, çünkü bu, doğal olarak seçilen dağıtım yolunun etkinliği ile bağlantılı olacaktır. Bunun ayrıntılı bir tartışması bu makalenin kapsamı dışındadır.
Klinik öncesi yöntemlerin kapsamlı tasvirleri, hayvan refahına ve daha geniş bilimsel topluluğa fayda sağlar. Sonuç olarak, prosedürlerin ve sonuçların tekrarlanabilirliğinin artması, daha az hayvan sağlığı komplikasyonuna, önemli sonuçlar elde etmek için gereken hayvan sayısının azalmasına ve deneysel sonuçlara daha fazla güvene yol açar21,22. Bu makalede, bir domuz modelinde miyokard enfarktüsünün tedavisi için yeni terapötiklerin üç uygulama yöntemi tanımlanmıştır. Kullanılan teknikleri detaylandırarak ve her birinin yararlarını ve risklerini dile getirerek, araştırmacıların araştırma hedeflerine uygun, tutarlı ve güvenilir klinik öncesi modelleri rahatça oluşturabilecekleri tahmin edilmektedir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Ulusal Sağlık ve Tıbbi Araştırma Konseyi APP1194139/APP1126276 (JC), Avustralya Ulusal Kök Hücre Vakfı ve Yeni Güney Galler Devlet Sağlık ve Tıbbi Araştırma Ofisi (JC) tarafından finanse edilmiştir. DS, Royal Australasian College of Physicians, Klinik Patoloji ve Tıbbi Araştırma Enstitüsü ve Avustralya Hükümeti Araştırma Eğitim Programı tarafından desteklenmiştir. TD, Klinik Patoloji ve Tıbbi Araştırma Enstitüsü, Penfolds Aile Bursu, Ulusal Sağlık ve Tıbbi Araştırma Konseyi (APP2002783) ve Avustralya Ulusal Kalp Vakfı (104615) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
Referanslar
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39 (2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483 (2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. . Veterinary Sutures Handbook. , (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392 (2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897 (2016).
- Singh, B., Dyce, K. M. . Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411 (2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır