Method Article
돼지 심근 경색 모델에서 심장 활성 치료제 전달
* 이 저자들은 동등하게 기여했습니다
요약
본 프로토콜은 돼지 모델에서 심장 활성 치료제를 투여하는 세 가지 방법을 설명합니다. 암컷 재래종 돼지는 (1) 개흉술 및 경심막 주사, (2) 카테터 기반 경심 주사 또는 (3) 경정맥 삼투압 미니 펌프 를 통한 정맥 주입을 통해 치료를 받았습니다.
초록
심근경색은 전 세계적으로 사망 및 장애의 주요 원인 중 하나이며 새로운 심장 보호 또는 재생 전략이 시급히 필요합니다. 약물 개발의 필수 구성 요소는 새로운 치료제를 투여하는 방법을 결정하는 것입니다. 생리학적으로 관련된 대형 동물 모델은 다양한 치료 전달 전략의 타당성과 효능을 평가하는 데 매우 중요합니다. 심혈관 생리학, 관상 동맥 혈관 해부학 및 심장 체중 대 체중 비율에서 인간과 유사하기 때문에 돼지는 심근 경색에 대한 새로운 치료법의 전임상 평가에서 선호되는 종 중 하나입니다. 본 프로토콜은 돼지 모델에서 심장 활성 치료제를 투여하는 세 가지 방법을 설명합니다. 경피적으로 유도된 심근경색 후, 암컷 재래돼지는 (1) 개흉술 및 경심외막 주사, (2) 카테터 기반 경심 주사 또는 (3) 경정맥 삼투압 미니펌프 를 통한 정맥 주입을 통해 새로운 약제로 치료를 받았습니다. 각 기법에 사용된 절차는 재현성이 뛰어나 신뢰할 수 있는 심장 활성 약물 전달이 가능합니다. 이러한 모델은 개별 연구 설계에 맞게 쉽게 조정할 수 있으며, 이러한 각 전달 기법을 사용하여 다양한 가능한 중재를 조사할 수 있습니다. 따라서 이러한 방법은 심근 경색 후 심장 복구에서 새로운 생물학적 접근 방식을 추구하는 중개 과학자에게 유용한 도구입니다.
서문
관상동맥 질환(CAD) 및 관련 ST 상승 심근경색(STEMI)은 전 세계적으로 가장 큰 사망 원인입니다. 지난 20년 동안 경피적 관상동맥 중재술, 섬유소 용해 요법 및 재관류가 적시에 이루어질 수 있도록 하는 치료 알고리즘의 표준화를 통해 STEMI를 보이는 환자의 병원 내 사망률을 줄이는 데 큰 진전이 있었습니다 1,2,3. 그럼에도 불구하고 STEMI와 관련된 이환율은 여전히 상당한 부담으로 남아 있으므로 새로운 심장 보호 및 재생 요법 개발이 크게 필요합니다 2,3. 치료제 개발의 필수 요소는 새로운 치료법을 어떻게 투여할 것인지를 결정하는 것이다4. 각 방법의 안전성, 효능 및 타당성은 치료 자체의 특성과 일치해야 합니다.
생리학적으로 관련된 대동물 모델은 다양한 치료 전달 전략의 이러한 특성을 평가하는 데 매우 중요하다5. 돼지는 심혈관 생리학, 관상동맥 혈관 해부학, 심박 대 체중 비율에서 인간과 유사하기 때문에 심근경색에 대한 새로운 치료법의 전임상 평가에서 선호되는 종 중 하나이다6. 우리는 이전에 돼지 STEMI 모델을 사용하여 재조합 단백질 치료제7의 회복 능력을 입증했으며, 이 모델을 사용하여 새로운 약리학적, 세포적, 유전적 치료법을 계속 조사하고 있습니다. 여기에서는 경색 발생 후 돼지 모델에 사용되는 세 가지 치료 투여 기술인 개흉술 및 경심외막 주사, 경피적 경심 주사 및 경정맥 삼투압 미니펌프 이식에 대해 설명합니다. 처음 두 가지 방법은 국소 조직 전달을 가능하게 하여 필요한 복용량, 표적 외 효과 및 간 1차 통과 대사를 줄입니다 8,9,10. 삼투압 미니 펌프를 사용하면 반감기가 짧은 약물을 지속적으로 전달할 수 있어 주입 펌프와 특허 받은 정맥 캐뉼라에 대한 의존도를 없애고 대형 동물 모델에서 도입하기 어렵습니다.
이러한 기술을 설명함으로써 이 논문이 대형 동물 모델에서 심근경색 후 새로운 심장 보호 또는 재생 제제를 조사하는 중개 과학자들에게 도움이 될 수 있기를 바랍니다.
프로토콜
모든 실험은 '과학적 목적을 위한 동물의 관리 및 사용에 관한 호주 규범'에 따라 수행되었으며 웨스턴 시드니 지역 보건 지구 동물 윤리 위원회의 승인을 받았습니다. 본 연구에는 18-20kg의 사춘기 이전의 대형 백색 x 재래종 금박이 사용되었습니다.
1. 축산
- 지역 동물 윤리 위원회 규정에 따라 동물을 수용하십시오.
참고: 이 프로토콜에 포함된 동물은 싸움과 부상을 피하고 먹이 경쟁이 없도록 개별적으로 수용됩니다. 그러나 모든 동물은 동족을 보고, 듣고, 냄새를 맡을 수 있었다. 그들의 펜은 청소가 용이하도록 콘크리트 바닥을 가지고 있으며 실내 및 실외 보호 부분이 모두 있습니다. 돼지는 실내에 짚으로 만든 침구를 제공하고 실외에는 풍부화 '장난감'을 제공합니다.
2. 진정 및 전신 마취
- 진정
- 강한 진정제나 전신 마취를 시작하기 전에 동물이 최소 12시간 동안 금식했는지 확인하십시오.
- 동물이 아직 중심선 형태의 혈관 접근이 없다면 근육 내 진정 프로토콜을 사용하십시오.
- 근육 내 진정은 케타민 8mg/kg, 미다졸람 0.3mg/kg, 메타돈 0.2mg/kg, 메데토미딘 10μg/kg으로 구성됩니다( 재료 표 참조). 이 혼합물을 21G 바늘로 동물의 내축 근육에 투여하십시오. 평균적으로 동물은 심하게 진정되는 데 5-10분이 걸립니다.
참고: 스트레스를 받은 돼지는 진정제에 더 잘 견딥니다. 침착하고 자신감 있는 조련사가 동물을 진정시키고 동물이 과도한 스트레스를 받지 않도록 하십시오. 동물이 스트레스를 받으면 5-10분 동안 그대로 두었다가 다시 시도하는 것이 가장 좋습니다. - 중심선이 제자리에 있고 특허가 있는 경우 정맥 진정제를 수행합니다. 정맥 진정은 케타민 2mg/kg, 미다졸람 0.2mg/kg, 메타돈 0.2mg/kg, 메데토미딘 2μg/kg으로 구성됩니다.
- 개통을 보장하기 위해 먼저 0.9% 염화나트륨으로 정맥 주사 라인을 씻어냅니다. 그런 다음 혼합 주사기의 절반을 라인을 통해 천천히 밀어 넣고 0.9% 염화나트륨으로 씻어냅니다.
- 20-30초 이내에 심하게 진정되어야 하는 동물을 관찰하십시오. 동물이 아직 진정제를 투여하지 않은 경우 2.1.5단계에 설명된 대로 주사기의 나머지 절반을 씻어냅니다.
- 혈관 접근
- 적절한 진정제가 투여되면 돼지를 수술실로 이송합니다.
- 안면 마스크와 5L/min의 산소 유량으로 돼지에 사전 산소를 공급합니다. 맥박 산소 측정기를 돼지의 꼬리, 귀 또는 혀에 연결하여 동물을 전체적으로 모니터링합니다.
- 22G 또는 24G 캐뉼라를 사용하여 왼쪽 및 오른쪽 가장자리 귀 정맥에 접근하고 테이프로 고정합니다.
- 전신 마취
- 돼지를 흉골 누운 곳에 놓습니다.
- 1-3mg/kg의 프로포폴( 재료 표 참조)을 천천히 밀어서 효과를 내기 위해 정맥 주사합니다. 조수에게 동물의 입을 벌리고(이 단계에서 턱이 느슨해야 함) 목을 뻗도록 합니다.
- 후두경( 재료 표 참조)을 사용하여 혀의 기저부를 누르고 후두개(epiglottis)를 눌러 후두의 아리테노이드 연골을 노출시킵니다.
- 탐침으로 윤활된 기관내관(크기 5.5 또는 6.0, 재료 표 참조)을 아리테노이드 연골을 통해 기관으로 통과시킵니다. 때때로 후두를 통과하는 동안 저항이 느껴질 수 있습니다. 이것은 기관내관의 부드러운 회전으로 상쇄될 수 있습니다. 동물이 삽관에 저항하는 경우 더 많은 프로포폴을 정맥 주사합니다.
- 기관내관에서 탐침을 제거합니다. 튜브 주변에 공기 누출이 없을 때까지 기관내 튜브 커프를 팽창시킵니다. 일반적으로 4-6mL의 공기가 필요하지만 부피는 튜브 크기와 동물에 따라 다를 수 있습니다.
- 동물의 귀 뒤에 기관내관을 고정합니다.
- 동물을 볼륨 조절 인공호흡기 기능이 있는 재호흡 마취 회로에 연결합니다. 동물이 연결되면 인공호흡기를 '끄십시오'.
알림: 조정 가능한 압력 제한(APL) 밸브 또는 '팝오프 밸브'가 항상 열려 있는지 확인하십시오. 밸브를 열어 두지 않으면 동물에게 치명적인 압력 외상을 초래할 수 있습니다. - 마취 회로 산소 유량을 2L/min으로 줄입니다.
- 양압 인공호흡기를 '볼륨 조절' 모드로 설정합니다. 일회 호흡량을 10mL/kg으로, 호흡수를 20호흡/분으로 설정합니다. 흡기:호기 비율이 1:2로 설정되어 있는지 확인합니다.
- 절차 전반에 걸쳐 호흡수를 조작하여 호기말 이산화탄소가 35-50mmHg 사이가 되도록 합니다.
알림: 흡기 압력은 20cmH2O를 초과해서는 안 됩니다. 흡기 압력이 증가하면 튜브 꼬임 또는 막힘에 대한 즉각적인 조사가 이루어집니다. 튜빙과 관련이 없는 압력 증가를 완화하기 위해 흡기:호기 비율을 1:1.5로 줄이고 일회 호흡량을 줄일 수 있습니다. - 동물이 혈역학적으로 안정되어 있으면 흡입 마취로 유지하십시오. 동물이 혈역학적으로 안정적이지 않은 경우 2.3.14단계에서 설명한 대로 전체 정맥 마취로 유지하십시오.
- 동물에게 흡입제 마취를 투여하는 경우, 마취 회로가 처음 연결되는 순간부터 2.5% 이소플루란으로 시작하십시오.
- 다음 30분 동안 동물을 1.5% 흡입 이소플루란으로 점진적으로 젖을 뗍니다. 절차가 끝날 때까지 동물을 1.5% 이소플루란으로 유지하십시오.
- 10분마다 손바닥 반사를 확인하고 턱 긴장도를 테스트하여 마취 깊이를 평가합니다. 마취 깊이를 유지하기 위해 필요에 따라 이소플루란을 조정합니다.
- 동물이 혈역학적으로 불안정한 경우 전체 정맥 마취로 유지하여 흡입 마취제와 관련된 심혈관 합병증 없이 마취 깊이 조절을 강화할 수 있습니다.
- 주사기 펌프 또는 프로포폴, 펜타닐 및 미다졸람이 포함된 표준 유체 펌프를 준비합니다. 공통 라인을 통해 동물에 연결하십시오.
참고: 프로포폴은 0.1-0.6mg/kg/min, 펜타닐은 1-5μg/kg/h, 미다졸람은 0.05-0.2mg/kg/h로 실행할 수 있습니다. - 흡입 마취와 마찬가지로 이러한 약물을 적정하여 마취 전반에 걸쳐 효과를 발휘하여 적절한 마취 깊이를 유지합니다.
- 주사기 펌프 또는 프로포폴, 펜타닐 및 미다졸람이 포함된 표준 유체 펌프를 준비합니다. 공통 라인을 통해 동물에 연결하십시오.
- 0.9% 염화나트륨 또는 Hartmann의 용액( 재료 표 참조)을 5mL/kg/h의 속도로 정맥 주사액 지원을 제공합니다.
- 혈압 측정, 카프노그래피, 마취 가스 모니터링, 체온, 맥박 산소 측정 및 심전도로 동물을 모니터링합니다.
- 모든 절차에서 투약 전 후 4시간마다 0.2mg/kg의 메타돈 형태로 추가 진통제를 정맥 주사합니다.
참고: 동물이 마취 중에 통증의 징후를 보이는 경우(빈맥, 유지 약물의 변경 없이 마취 깊이가 가벼워짐) 진통제는 더 짧은 간격으로 투여될 수 있습니다.
3. 중심선 배치
- 뒷다리를 뻗고 왼쪽 앞다리를 뻗고 오른쪽 앞다리를 구부리고 묶어 고정한 상태에서 돼지를 등쪽 누운 자세로 놓습니다.
- 돼지 목을 무균 상태로 준비하고 드레이프로 덮습니다.
- 멸균 덮개가 있는 선형 초음파 프로브( 재료 표 참조)를 사용하여 오른쪽 경정맥을 찾습니다. 이것은 프로브가 기관에 수직으로 향하고 후두에서 측면으로 천천히 움직일 때 가장 잘 달성됩니다.
- 컬러 도플러 모드를 활성화하면 경정맥을 식별하는 데 도움이 됩니다. 경정맥은 접힘 가능성과 연속적이고 박동성이 없는 흐름을 보여줌으로써 경동맥과 구별할 수 있습니다.
- 18G 쿡 바늘( 재료 표 참조)을 사용하여 초음파 유도 하에 정맥에 접근합니다. 접근이 완료되면 0.035인치 J-팁 와이어( 재료 표 참조)를 바늘에 통과시켜 용기에 끼웁니다. 와이어 위의 바늘을 제거합니다.
- 미리 세척된 중심선을 와이어 위에 끼우고 정맥으로 밀어 넣습니다. 와이어가 항상 라인의 말단 끝에서 나오는 것을 볼 수 있는지 확인하십시오.
참고: 5Fr, 2루멘 중심 정맥 카테터( 재료 표 참조)는 1-4주 동안 정맥 접근이 필요한 피험자에게 사용되었습니다. - 피부를 통해 라인을 전진시키는 데 어려움이 있는 경우 11번 메스를 사용하여 2-4mm의 작은 절개를 만들어 와이어 위로 라인이 쉽게 통과할 수 있도록 합니다. 개통성을 보장하기 위해 각 외부 라인에 음압을 가한 다음 플러시를 적용합니다. 각 줄을 고정합니다.
- 제공된 앵커를 외부 라인에 부착하고 2-0 또는 3-0 비용해성 봉합사로 제자리에 고정합니다( 재료 표 참조). 동물이 씹지 않도록 외부 라인을 등쪽으로 고정하기 위해 추가 봉합사를 배치하십시오.
- 플러시된 연장선을 외부 카테터 라인에 부착하고 clamp 오프.
- 상업용 돼지 재킷( 재료 표 참조)으로 동물을 끼우고 그 안에 선을 고정합니다. 동일한 마취 중에 다른 시술을 아직 수행하지 않은 경우 동물 회수 직전에 재킷을 착용하십시오.
4. 심근경색
참고: 이 모델에 사용된 동물은 이전에 발표된 방법7에 따라 심근경색을 받았다.
- 경심막 및 경심내막 주사 시술 2주 전에 심근경색 시행 8,9,10. 삼투압 미니펌프 이식은 동일한 절차 내에서 관상동맥 재관류 직후에 수행되었습니다.
5. 약물 또는 세포 투여
- 흉강절제술과 심외세포주사
- 22mg/kg의 세파졸린 형태로 예방적 항생제를 정맥 투여합니다( 재료 표 참조). 절차 내내 90분마다 계속하십시오.
- 동물을 오른쪽 측면 누운 자세에 놓습니다.
- 100μg/h 펜타닐 패치( 재료 표 참조)를 돼지 귀 뒤의 평평한 면에 바릅니다. 접착 드레싱 또는 2-0 봉합사로 덮습니다.
참고: 이 패치는 배치 후 12시간 후에 '활성'으로 간주되며 72시간 동안 진통을 제공합니다. - 제품 사양에 따라 전기해부학적 매핑 시스템 케이블링 및 패치를 설정합니다( 재료 표 참조).
- 동물의 갈비뼈 4와 5 사이에 10cm의 수평선을 크레용이나 수술용 마커로 표시하십시오.
- 리도카인(2mg/kg)과 부피바카인(1mg/kg)의 혼합물을 25G 바늘이 있는 단일 주사기에 준비합니다.
- 수술 부위를 무균 상태로 준비하고 동물을 드레이프합니다. 표시된 절개 부위에 바늘을 얕은 각도로 삽입하고 플런저를 약간 빼서 주사기로 혈액이 역류하지 않도록 한 후 바늘을 피부에서 빼면서 용액을 천천히 주입하여 피부 라인 차단을 수행합니다. 라인을 따라 이동하면서 이 과정을 반복합니다.
알림: 부피바카인이 혈관 내로 투여되지 않도록 각각의 새로운 주사 부위에서 주사기에 음압을 가해야 합니다. 혈관 내 부피바카인은 급속히 치명적일 수 있습니다. - 22번 메스를 사용하여 표시된 선을 따라 10cm의 피부를 절개합니다.
- 단극성 소작술( 재료 표 참조)을 사용하여 늑간근에 도달할 때까지 아래 근육층을 통해 절개를 심화합니다.
- 부피바카인 0.5mg/kg과 리그노카인 1mg/kg의 멸균 주사기를 준비하고 25G 바늘을 부착합니다.
- 네 번째 갈비뼈의 꼬리 가장자리에 얕은 각도로 바늘을 삽입합니다. 바늘이 늑간 정맥이나 동맥을 통과하지 않도록 플런저에 음압을 가합니다. 바늘을 고정한 상태에서 주사기 부피의 1/4을 천천히 주입합니다.
- 네 번째 갈비뼈의 꼬리 가장자리를 따라 3-5cm 간격으로 세 군데에서 5.1.12단계를 반복합니다.
- Metzenbaum 가위( 재료 표 참조)를 사용하여 늑간 근육을 조심스럽게 절개한 다음 마취과 전문의와 확인한 후 흉막을 절개합니다.
- 흉막이 절개되면 폐가 흉막에서 떨어질 수 있도록 인공호흡기를 끕니다. 절개 후 인공호흡기를 다시 켜고 호기말 양압을 4cmH2O로 조정합니다.
- 갈비뼈 사이에 자체 고정 갈비뼈 견인기를 놓고 천천히 열어 심장을 노출시킵니다. 조직 겸자를 사용하여 심낭을 부드럽게 잡고 Metzenbaum 가위로 절개하여 심장이 외부로 나올 수 있도록 합니다.
알림: 이 단계와 다음 몇 단계에서 부정맥이 일반적입니다. ECG를 면밀히 모니터링해야 하며, 동물이 혈역학적으로 불안정해지면(평균 동맥압이 55mmHg 미만) 심장 조작을 일시적으로 중단해야 합니다. 혈압 개선을 위해 필요에 따라 메타라미놀(0.25mg)을 정맥 주사로 투여해야 합니다. - 심낭 절개 부위의 양쪽 끝과 측면에 임시 2-0 스테이 봉합사를 삽입하여 흉벽에 고정하고 심낭 우물을 만듭니다. 심낭이 가능한 한 얕게 보이도록 심낭의 측면이 지지되는지 확인하십시오.
- 물에 적신 면봉이나 개복술 스폰지를 사용하여 심장 주변 부위를 포장합니다. 이것은 심장을 안정적으로 유지하고 노출된 조직의 건조를 방지하는 데 도움이 됩니다.
- 좌심실 뒤에 있는 검지로 심낭강 내에서 심장의 정점을 전달합니다. 좌심실 압박을 최소화하도록 주의하십시오.
알림: 건강한 심장은 정점이 수직을 향하고 부드럽게 지지되지만 압박되지 않은 바닥에 앉아 편안하게 박동할 수 있습니다. 조작과 관련된 초기 혈압 감소가 있지만 외부 심실 압박이 없는 경우 허용 가능한 수준으로 회복되어야 합니다.- 15초 이내에 회복이 없거나 매우 느린 경우 즉시 심장을 심낭강으로 되돌리고 추가 탈구 전에 혈류역학적 매개변수를 개선하기 위해 필요한 조치를 취하십시오.
알림: 심실이 탈구될 수 있는 경우 심실을 지지하기 위해 심낭 내에 적절한 크기의 거즈 팩을 배치하여 심낭 외부의 정점 위치를 유지할 수 있습니다. 마찬가지로, 길고 축축한 면봉은 심장 기저 아래에 위치할 수 있으며, 심장 정점을 절개 부위 쪽으로 위쪽으로 안내하는 '슬링' 역할을 합니다(그림 1A).
- 15초 이내에 회복이 없거나 매우 느린 경우 즉시 심장을 심낭강으로 되돌리고 추가 탈구 전에 혈류역학적 매개변수를 개선하기 위해 필요한 조치를 취하십시오.
- 전기생리학적 매핑 카테터를 사용하여 좌심실 심외막 표면의 전기해부학적 전압 맵을 생성합니다(그림 1B). 표준 전압 차단으로 흉터, 경계 및 원격 영역을 식별합니다.
알림: 흉터 및 원격 영역은 각각 <0.5mV 또는 >1.5mV의 양극 컷오프와 <3mV 또는 >8.3mV의 단극 컷오프로 정의되었습니다11,12. - 27G 치료 전달 주사기의 바늘을 약 80-90° 각도로 구부립니다.
- 바늘을 얕은 각도로 대상 조직에 전진시키고 주사기 플런저에 압력을 가하여 전체 부피의 1/4에서 1/3을 배출합니다. 조직의 희게를 관찰해야 합니다(그림 1C). 전기생리학적 매핑 카테터를 사용하여 생성된 심외막 전압 맵의 주입 부위 위치에 주석을 추가합니다(그림 1D).
참고: 세포 배양 배지(RPMI 1640)로 구성된 차량 주입은 비디오 프로토콜에서 시연 목적으로 사용되었습니다. - 바늘을 부분적으로 빼서 심근 내로 리디렉션합니다. 주사기 부피의 1/4에서 1/3을 더 배출합니다. 주사기가 비워질 때까지 계속합니다.
- 원하는 용량이 전달될 때까지 5.1.20-5.1.24단계를 반복합니다.
- 심장을 감싸고 있는 면봉을 제거하고 심장 아래에 있는 '슬링'을 부드럽게 제거하여 중립 위치로 돌아갑니다. 이 단계에서 부정맥이 흔하게 발생하며 5.1.17단계에서 설명한 대로 주의를 기울여야 합니다.
- 심낭에서 2-0 스테이 봉합사를 제거합니다. 견인기를 풀고 흉부에서 제거합니다.
- 끝이 뭉툭하고 둥근 바늘이 있는 크기 1 폴리디옥사논 봉합사(PDS)를 사용하여 흉부를 갈비뼈 3과 4, 갈비뼈 5와 6 사이의 공간을 통과시켜 흉부를 봉합합니다.
알림: 좁은 그림 8 봉합사는 갈비뼈를 근사화하기 위한 도르래 효과를 제공합니다. 동물의 크기에 따라 두세 개의 봉합사를 사용해야 합니다. - 갈비뼈 근사 봉합사를 조이고 묶기 전에 짧은 길이의 실리콘 튜브를 절개 부위의 복부 가장자리에 삽입합니다.
- 흉막강의 수중 밀봉 배수를 위해 튜브의 다른 쪽 끝을 멸균 식염수 그릇에 넣습니다.
- 위에 놓인 근육층을 2-0 흡수성 봉합사로 간단한 연속 패턴으로 닫습니다. 2-0 또는 3-0 비흡수성 봉합사로 단순 연속 또는 포드 연동 패턴(13 )으로 피부를 닫는다.
- 상처 봉합이 완료되면 양압 환기의 효과로 흉부에서 자유 공기를 배출합니다.
- 인공호흡기를 '자유 호흡' 설정으로 돌립니다. 재호흡 회로의 저장소 백을 사용하여 기도에 일관된 양압을 제공합니다(20-30cmH2O에서 유지).
- 식염수 그릇에서 기포가 더 이상 관찰되지 않을 때까지 이 압력을 계속하여 흉부 내에 자유 공기가 없음을 나타냅니다.
- 실리콘 튜브를 제거합니다.
- 수술 부위에 접착 드레싱을 바르고 흩어져 있는 단순 단속 봉합사를 배치하여 드레싱을 제자리에 유지하는 데 도움을 줍니다.
- 회복 시, 투여 0.3 메타돈의 mg/kg 피하 및 0.2-0.5 온단세트론의 mg/kg ( 자료표의 참조) 정맥 주사.
- 경정맥 삼투압 미니펌프 이식
- 3.1단계에서 설명한 대로 동물을 배치합니다. 무균 상태로 준비하여 동물의 목 오른쪽을 드레이프하십시오.
- 22번 메스 칼날을 사용하여 흉골 흉골 측면 2-3cm 지점에서 두개골로 연장된 8-10cm를 절개합니다. 이 절개는 두개골로 이동함에 따라 약간 더 측면이 되어야 합니다.
- Metzenbaum 가위를 사용하여 피부 대장균, 흉골 근육 및 흉골 근육을 해부합니다. 무딘 박리 기술을 사용하여 외부 경정맥이 보일 때까지 절개를 심화시킵니다.
- 절개부에 자체 고정 견인기를 놓고 열어 가시성을 높입니다.
- Adson 갈색 조직 겸자( 재료 표 참조)와 Metzenbaum 가위를 사용하여 위와 아래 모두에서 경정맥을 둘러싼 연조직을 제거합니다(그림 2A). 이는 중요한 단계이며, 이후 단계에서 용기 위에 있는 연조직이 미니펌프 튜브의 통과를 방해할 수 있습니다.
- 혈관의 가장 꼬리가 보이는 가장자리에서 약 1cm 떨어진 정맥의 꼬리 노출 끝을 통해 5-0 흡수성 봉합사를 사용합니다. 봉합사를 5mm '교합'하는 방식으로 통과시킵니다: 오른쪽은 두개골에서 꼬리로, 오른쪽에서 왼쪽으로, 왼쪽은 꼬리에서 두개골로. 결과 패턴은 '정사각형의 세 변'으로 나타나야 합니다. 양쪽 끝의 봉합사 꼬리의 길이가 같은지 확인하십시오.
- 제품 사용 설명서에 설명된 대로 미니펌프를 조립합니다( 재료 표 참조).
- 두개골과 꼬리 끝의 혈관 주위에 고리 탄성 혈관 타이를 묶습니다. 처음에는 느슨하게 유지하십시오. 조수가 혈관을 막기 위해 혈관 관계에 장력을 가하도록 합니다.
- 14G 바늘을 사용하여 봉합사 재료로 만든 '3면 사각형'중앙의 정맥에 구멍을 뚫습니다(5.2.7단계; 그림 2B).
- 미니 펌프 튜브를 구멍에 끼우십시오. 선박 안으로 쉽게 통과해야 합니다. 저항이 있으면 계속 밀지 마십시오. 대신 튜브를 당겨 빼내고 다시 시도하십시오.
- 용기 외부에 1-2cm가 남을 때까지 튜브를 전진시킵니다. 카테터 튜브 주변의 봉합사를 조이고 간단한 매듭으로 묶습니다. 보조자가 혈관 넥타이를 풀고 제거하도록 합니다.
- 미니 펌프 본체에 2-0 비흡수성 봉합사를 여러 번 감고 봉합사가 펌프에 고정되도록 묶습니다. 그런 다음 간단한 중단 매듭으로 펌프를 근처의 연조직에 고정합니다(그림 2C,D).
- 절개부에서 견인기를 제거합니다. 표준 3층 단순 연속 봉합으로 절개 부위를 봉합합니다.
- 회복 중 0.2mg/kg의 멜록시캠을 피하 투여합니다.
- 경피적 경심내막 주사
- 앞다리와 뒷다리를 뻗은 상태에서 동물을 등쪽 누운 곳에 놓고 끈으로 고정합니다.
- 동물의 꼬리 복부와 내측 허벅지를 무균으로 준비합니다. 창공 대퇴 혈관 조영술 드레이프로 동물을 드레이프합니다( 재료 표 참조).
- 제품 사양에 따라 전기해부학적 매핑 시스템 케이블링 및 패치를 설정합니다( 재료 표 참조).
- 선형 초음파 프로브를 사용하여 대퇴 동맥을 확인합니다. 초음파 유도 하에 쿡 바늘로 대퇴 동맥을 뚫고 바늘을 통해 0.035인치 가이드와이어를 혈관에 끼웁니다. 와이어 위의 바늘을 제거합니다.
- 8Fr 동맥 덮개와 인트로듀서를 동맥 와이어 위에 끼우고 허브만 피부에 노출될 때까지 밀어 넣습니다. 와이어가 항상 보이도록 하고 피복의 허브에서 나오도록 하십시오.
알림: 이것은 더 큰 칼집이기 때문에 때때로 통과를 용이하게 하기 위해 작은 피부 절개를 만들기 위해 11번 메스가 필요할 수 있습니다. - 피복 도입기와 와이어를 제거합니다. 헤파린 정맥 투여(100-200단위/kg).
- 초초를 통해 경심막 주사 카테터를 삽입하고 역행성 대동맥 접근법을 통해 좌심실로 전진합니다.
- 심내막 표면을 가로질러 카테터를 부드럽게 드래그하여 좌심실의 전기해부학적 지도를 만듭니다. 양호한 심내막 접촉을 얻기 위해 축 방향 회전과 팁 굴곡의 부드러운 변경을 수행합니다. 표준 전압 차단으로 흉터, 경계 및 원격 영역을 식별합니다.
- 형광 투시 및 전기 해부학적 유도가 있는 카테터를 원하는 주입 위치로 향하게 합니다. 원위부의 편향으로 부드러운 축 회전을 수행하여 안정적인 심내막 접촉을 결합하고 유지합니다.
- 최소 두 개의 형광 투시로 카테터 팁의 위치를 확인합니다. 코어 카테터를 부드럽게 전진시킨 다음 바늘을 제어된 심근 깊이(정점 주입의 경우 3.5mm, 중격 주입의 경우 5mm)까지 확장합니다.
- 형광 투시법에서 보일 때까지 주입 카테터를 통해 4-6mL의 요오드화 조영제( 재료 표 참조)를 플러시합니다. 다음 10-30초 동안 대비를 관찰하여 조직에 남아 있는지 확인합니다(그림 3A).
- 심실 외도피가 흔히 발생하므로 바늘을 연장하고 주사하는 동안 ECG를 면밀히 관찰하십시오.
알림: 심실 외피는 바늘 끝이 심근에 접촉하는 경우입니다. - 조영제 주입이 성공적이면 관심 약제를 주사합니다. 형광 투시로 관찰될 때까지 조영제로 씻어냅니다.
참고: 관심 있는 약제는 테스트 중인 치료법에 따라 사용자에 따라 다릅니다. - 바늘을 집어넣습니다. 동맥초에서 주사 카테터를 제거합니다.
- 동맥초를 제거하고 지혈이 이루어질 때까지 최대 20분 동안 해당 부위에 압력을 가합니다.
6. 전신 마취 회복
- 사용 중인 흡입 마취제 또는 정맥 마취 펌프를 끕니다. 인공호흡기의 호흡수를 분당 8-10회로 줄입니다.
- 2-5분 후 인공호흡기를 한 번에 30초 이상 '자유 호흡' 모드로 전환하지 마십시오. 자발적인 호흡을 위해 동물과 카프노그래프를 관찰하십시오.
- 자발적 호흡이 발생한 경우 인공호흡기를 끈 상태로 두십시오. 동물이 무호흡증 상태이면 인공호흡기를 다시 1-2분 더 켜고 자발적 호흡이 이루어질 때까지 다시 시도하십시오.
참고: 회복 시간은 절차 및 동물의 특성에 따라 다르지만 15분에서 1시간 사이일 수 있습니다. - 동물이 편안하게 숨을 쉬면(호흡수 15-30회/분, 호기말 이산화탄소 60% 미만, SpO2 95% 이상) 산소를 분리하고 다른 모니터링은 연결된 상태로 둡니다.
- 혈관 접근의 임시 부위를 제거하고 압력을 가하여 혈종 형성을 예방합니다. 동물이 안정을 유지하고 다음 5분 동안 계속 산소를 공급하면 회복 지역으로 이송할 수 있습니다.
- 세 번 연속으로 자연 삼킨 후 기관내 튜브의 커프를 수축시키고 튜브를 부드럽게 제거합니다.
- 최소 5분 동안 동물을 모니터링하여 계속해서 적절하게 산소를 공급하고 호흡 곤란을 겪지 않는지 확인합니다. 유동 산소는 동물이 발관 후 불포화되는 경우 필요에 따라 사용해야 합니다.
결과
흉강절제술과 심외세포주사
개흉술과 심외막 주사를 받은 29마리 중 26마리가 살아남았다. 조직학적 분석은 모든 생존 동물에서 이 방법에 의해 전달된 인간 세포의 생착을 확인했다(그림 1E). 한 동물은 세포 주입 중에 치명적인 부정맥을 경험했으며 소생할 수 없었습니다. 또 다른 환자는 폐쇄 중 맥박이 없는 전기 활동을 경험하고 기도에 양압을 장기간 가해 회복할 수 없었습니다. 세 번째 동물은 발관 시 구토와 호흡 정지 상태에 빠졌다. 이 동물은 소생할 수 없었다.
두 마리의 동물은 심각한 합병증을 겪었지만 회복될 수 있었습니다. 한 동물은 심내주사 중 심실세동이 발생하여 내부 제세동 패들과 심장 마사지로 소생할 수 있었습니다. 두 번째 동물은 발관 시 구토를 했고 짧은 호흡 정지를 겪었지만 신속하게 다시 삽관할 수 있었고 잘 회복되었습니다. 이러한 모든 사건은 초기 실험에서 발생했으며, 프로토콜에 대한 팀 경험이 증가함에 따라 부작용이 감소했습니다(표 1).
경정맥 삼투압 미니펌프 이식
보고된 사망률이나 주요 합병증은 경정맥 삼투압 미니펌프 이식과 관련이 없었습니다. 7마리의 동물 대부분은 처음 24시간 이내에 수술 부위에 경미한 부종을 경험했으며, 이는 중재 없이 해결되었습니다. 펌프 이식 후 3일째에 혈청에서 수행된 ELISA는 대조군에 비해 혈소판 유래 성장 인자-AB 인간(PDGF-AB)의 혈중 농도가 유의하여 펌프의 효능을 입증했습니다7 (그림 2E).
경피적 경심내막 주사
총 22마리의 동물이 심내막 주사를 맞았다. 이러한 주입 중 17건은 사후 표적 조직에서 관찰된 형광 또는 잉크 염색에 의해 '성공적'인 것으로 간주되었습니다(그림 3B). 이 시술과 관련된 사망자는 없었다. 한 동물은 우심실 천공으로 인해 소량의 심낭 삼출액이 발생했습니다. 이것은 자기 제한적이었고 심혈관 손상을 초래하지 않았습니다. 바로 이 동물이 죽었다. 그러나 이것은 심내주사 후 관련 없는 추가 시술에서 나온 것이었다.
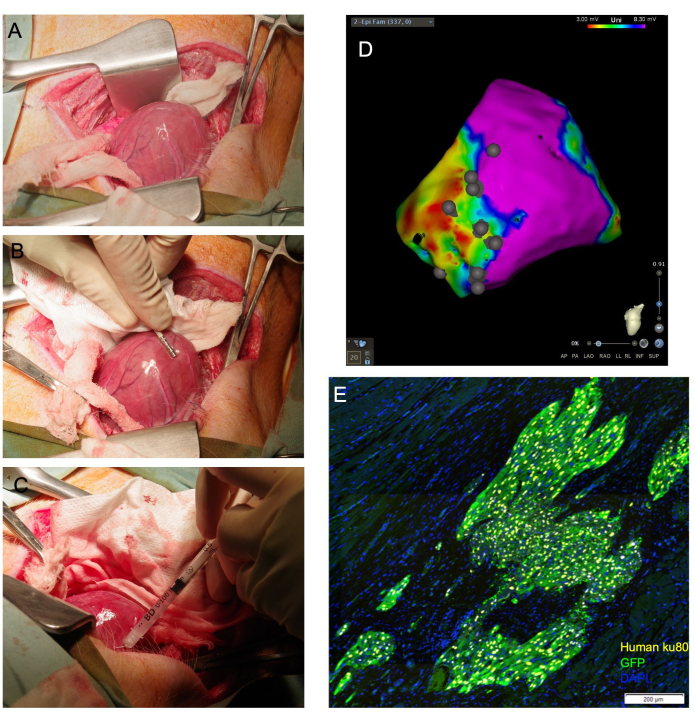
그림 1: 경심막 심근세포 주입은 심장을 직접 시각화할 수 있으며 심근에 전달되는 생존 가능한 세포의 높은 비율을 달성합니다. (A) 심장 정점은 심장 기저 아래로 유도되는 축축한 거즈 슬링을 통해 노출됩니다. (B) 심외막 매핑 카테터는 흉터와 경계 영역을 묘사하고 주사 부위에 주석을 답니다. (C) 31G 바늘은 심근에 세포를 경외막으로 주입하는 데 사용됩니다. (D) 주사 부위 주석이 있는 심외막 전압 맵. 보라색: 정상 전압, 건강한 심근; 빨간색: 비정상 전압, 병든 심근; 회색 점: 주사 부위. 희생 후 심장을 채취하여 다운스트림 조직학적 평가를 위해 포르말린으로 고정합니다. (E)에서 생착된 인간 세포는 인간 항핵 항체인 Ku80과 항 GFP 항체에 대한 면역염색에 의해 검출됩니다. 스케일 바 = 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
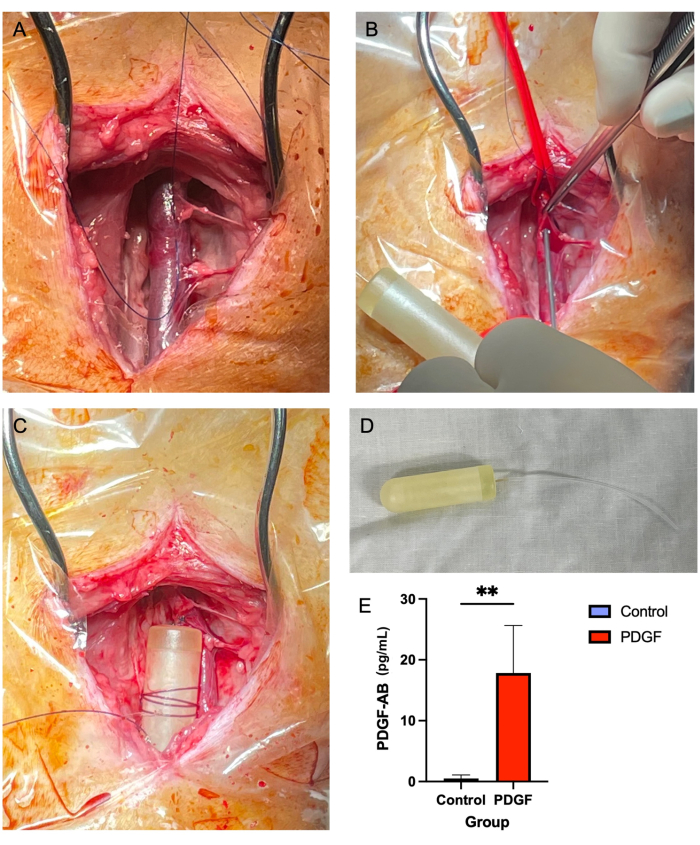
그림 2: 경정맥 미니펌프 삽입은 7일 동안 안전하고 신뢰할 수 있는 PDGF 전달 방법을 제공합니다. (A) 우측 경정맥이 노출되고 연조직이 혈관에서 제거됩니다. (B) 혈관 타이가 혈관을 막는 동안 14G 바늘을 사용하여 구멍을 뚫고 미니 펌프 튜브를 끼웁니다. (C) 미니펌프 튜브는 정맥 속으로 전진하고, 미니펌프 몸체는 인접한 연조직에 고정됩니다. (D) 이식 전의 미니펌프 본체와 튜브. (E) 미니펌프와 PDGF-AB를 통해 전달된 재조합 단백질의 혈청 농도는 이식 후 3일째에 각 동물의 ELISA를 사용하여 측정하였다. PDGF-AB를 투여받은 동물은 대조군 동물보다 PDGF-AB의 혈중 농도가 유의하게 높은 것으로 입증되어 삼투압 미니펌프 투여 방법의 효능을 확인하였다. **그룹 간 통계적으로 유의한 차이를 나타냄(p = 0.005, Mann-Whitney U 검정) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
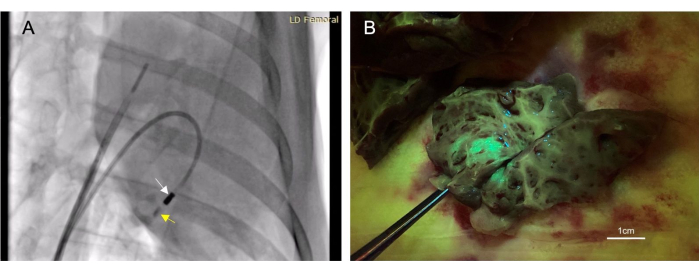
그림 3: 경심내막 심내막 주사는 최소 침습적 치료제 투여 방법을 가능하게 합니다. (A) 심근에 조영제(노란색 화살표)를 투여하는 주입 카테터(흰색 화살표)를 보여주는 우측 전방 경사 형광 투시 이미지. 조영제 주사는 심근 내 바늘 위치를 확인할 수 있도록 치료 주사 전후에 모두 투여됩니다. (B) 주입된 벡터는 녹색 형광 단백질(GFP)을 발현하여 주입된 물질이 조직 수집 시 형광을 발하도록 하여 주입의 성공을 확인했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 경심막 주사(n = 29) | 경심내막 주사(n = 22) | 삼투압 미니펌프(n = 7) | |
| 사망률 | 3 | 0 | 0 |
| 수술 후 구토 및 호흡 정지 | 1 | 0 | 0 |
| 주사 중 심실세동 | 1 | 0 | 0 |
| 흉부 폐쇄 중 펄스 없는 전기 활동 | 1 | 0 | 0 |
| 사망률 | 0 | 1 | 0 |
| 기흉 | 0 | 0 | 0 |
| 흉막 삼출 | 0 | 0 | 0 |
| 심실 천공 | 0 | 1 | 0 |
| 출혈 | 0 | 0 | 0 |
표 1: 합병증 목록.
토론
경심외막 심내막 주사
이 시술은 직접 심장 시각화의 이점이 있으며 전신 투여 방법보다 치료제의 국소 유지율이 더 높은 것으로 입증되었습니다 9,10,14. 그러나 개흉술은 침습적이고, 상당한 기술이 필요하며, 논의된 다른 방법보다 이환율과 사망률의 위험이 더 크다10,15. 절차의 중요하고 불안정한 단계에 대한 지식은 이러한 증가된 위험을 중재하는 데 도움이 될 수 있습니다.
부정맥 및 관련 혈역학적 손상의 위험이 높기 때문에 심장 정점을 노출하도록 심장을 조작할 때 세심한 주의를 기울여야 합니다. 지속적인 침습적 혈압 모니터링 및 심전도 검사를 통해 저혈압 또는 불안정한 부정맥을 신속하게 식별하여 신속한 개입 및 교정을 용이하게 합니다. 일과성 저혈압은 일반적으로 메타라미놀 볼루스로 치료할 수 있습니다. 지속적인 저혈압은 흡입 마취를 줄이고(마취 깊이를 주의 깊게 모니터링) 승압제 주입을 시작하는 동시에 혈류역학 변화의 원인을 결정함으로써 일시화할 수 있습니다. 심실 빈맥 또는 심실 세동과 같은 불안정 부정맥은 정맥 항부정맥제 유무에 관계없이 전기 심율동전환으로 치료할 수 있습니다.
동물의 생존에 똑같이 중요한 것은 흉부를 닫기 전에 흉막강에서 자유 가스를 성공적으로 제거하는 것입니다. 그렇게 하지 않으면 기흉이 발생할 수 있으며, 회복 시 기계 인공호흡기에서 분리되면 동물은 호흡 곤란과 사망의 큰 위험에 처할 수 있습니다. 기도 양압은 기포가 더 이상 관찰되지 않을 때까지 최소 30초 동안 유지되어야 합니다. 기포가 멈추면 실리콘 튜브를 즉시 제거하고 흉부를 빠르게 닫습니다. 또한 흉곽 절개술을 수술로 삽입하여 다음 24-72시간 동안 수동으로 공기와 염증성 유체를 제거할 수 있습니다. 그러나 이것은 특히 동물이 함께 사육되는 경우 깨끗하고 온전하게 유지하기가 어렵습니다. 튜브가 손상되거나 오염되면 농흉, 기흉 또는 패혈증이 발생할 수 있습니다. 경험상, 흉부를 봉합하기 전에 자유 가스가 적절하게 제거되면 임시 흉부 배액관을 삽입할 필요가 없습니다.
경피적 경심내막 심내막 주사
이러한 치료적 투여 방법은 외과적 접근법에 비해 덜 침습적인 특성으로 인해 위험이 낮은 국소 조직 전달을 허용하는 이점이 있다10,14. 이 기술은 이미 대규모 동물 연구에서 사용되고 있으며, 직접 시각화가 없는 경우 형광투시와 전기기계 매핑이 모두 가이드로 사용됩니다10,16,17.
심장이 직접 시야에 있지 않다는 점을 감안할 때, 시술 전문가는 주사 부위를 선택할 때 직교 형광 투시 보기를 사용하는 것이 현명합니다. 또한, 치료제 투여 전 희석된 요오드 조영제를 주입하고 전달하는 것은 심근 접촉을 확인하는 데 매우 중요합니다. 적절한 접촉은 특징적인 '심근 홍조'를 관찰하여 확인할 수 있으며, 이는 조직 채취 전에 주사 성공의 유일한 지표 중 하나일 수 있습니다. 챔버 천공의 위험으로 인해, 선택된 주사 부위의 심근벽 두께도 9mm보다 큰 것이 권장된다14,16.
경정맥 삼투압 미니펌프
삼투압 미니 펌프는 소동물 연구에서 일반적으로 사용되는 인기 있는 장치입니다. 정해진 기간 동안 일관된 속도로 치료제를 투여할 수 있는 고유한 이점을 감안할 때 대형 동물 모델 7,18,19에서 이 장치를 사용하는 것에 대한 관심이 증가하고 있습니다. 이 방법의 가능한 한계는 펌프를 교체하거나 제거하지 않고 약물의 주입 속도를 변경하거나 중지할 수 없다는 것입니다. 이러한 방식으로 치료를 시도하기 전에 이 점을 고려해야 합니다.
이 연구는 이 방법이 돼지에서 높은 성공률로 수행될 수 있고 이환율과 폐사율이 낮다는 것을 보여주었습니다. 림프절, 흉선, 경동맥을 포함한 많은 중요한 구조물이 수술 부위에 인접해 있다는 점에 유의해야 합니다. 이 방법을 고수하고 해부학 텍스트(20)를 참고하여 이러한 구조물의 부주의한 손상을 방지하는 것이 강력히 권장된다. 이 방법의 가장 우려되는 합병증은 경정맥 또는 주변 구조물의 부주의한 손상으로 인한 출혈성 쇼크입니다. 따라서 경정맥을 둘러싼 연조직을 조심스럽게 제거하는 것이 중요합니다. 이 단계를 제대로 완료하지 않으면 미니펌프 튜브를 배치하거나 의도하지 않은 출혈을 제어하는 데 어려움이 있을 수 있습니다.
이 기사에서는 심장 활성 치료제를 전달하는 세 가지 방법에 대해 설명했습니다. 각 기술의 보고된 성공에도 불구하고 고려해야 할 내재된 한계가 있습니다. 침습적 절차(경심막 주사)는 치료 전달의 정확도를 높일 수 있습니다. 그러나 잠재적으로 치명적인 합병증의 위험이 더 큽니다. 또한 침습적 분만은 합병증의 위험을 최소화하기 위한 기술적 능력에 대한 요구가 더 큽니다. 마찬가지로, 형광 투시 유도 경심 주사는 카테터 삽입 및 하드웨어 조작에 대한 어느 정도의 기술이 필요합니다. 이 방법을 잘못 수행하면 주입 실패 및 치명적인 합병증이 발생할 수 있습니다.
설명된 직접 주입 방법은 표적 조직으로의 치료제의 일회성 투여를 허용합니다. 경정맥 삼투압 미니 펌프는 7일 동안 치료제를 전신적으로 투여할 수 있습니다. 상대적으로 이 방법은 더 간단하고 위험이 적지만 심근으로 가는 전신 치료에 의존합니다. 또한, 일단 펌프가 제자리에 놓이면 동물을 다시 마취하고 펌프를 제거하지 않고는 투여를 중단하거나 투여율을 변경하는 것이 불가능합니다.
본 논문에 기술된 모든 방법은 심근경색 당일 또는 2주 후에 동물에게 수행하였다. 그러므로, 이 연구는 건강한 동물 또는 대체 심장 병리학을 받은 동물에서 언급된 방법의 성공을 보고할 수 없다. 마지막으로, 의도된 약제의 약리학 및 생명공학은 선택된 전달 경로의 효능과 본질적으로 연결되기 때문에 신중하게 고려되어야 합니다. 이에 대한 자세한 논의는 이 원고의 범위를 벗어납니다.
전임상 방법에 대한 포괄적인 묘사는 동물 복지와 더 넓은 과학계에 도움이 됩니다. 결과적으로 절차 및 결과의 재현성이 향상되어 동물 건강 합병증이 줄어들고, 유의미한 결과를 도출하는 데 필요한 동물의 수가 감소하며, 실험 결과에 대한 신뢰도가 높아집니다21,22. 돼지 모델에서 심근 경색 치료를 위해 새로운 치료제를 투여하는 세 가지 방법이 이 기사에 설명되어 있습니다. 사용된 기술을 자세히 설명하고 각 기술의 이점과 위험을 명확히 설명함으로써 연구자들은 연구 목표에 맞는 일관되고 신뢰할 수 있는 전임상 모델을 편안하게 만들 수 있을 것으로 기대됩니다.
공개
저자는 공개할 것이 없습니다.
감사의 말
이 연구는 국립 보건 및 의료 연구 위원회(National Health and Medical Research Council APP1194139/APP1126276(JC), 호주 국립 줄기 세포 재단(National Stem Cell Foundation of Australia) 및 뉴사우스웨일즈 정부 보건 및 의료 연구실(New South Wales Government Office of Health and Medical Research, JC)의 보조금으로 지원되었습니다. DS는 Royal Australasian College of Physicians, Institute of Clinical Pathology and Medical Research, Australian Government Research Training Program의 지원을 받았습니다. TD는 임상 병리학 및 의학 연구 연구소(Institute of Clinical Pathology and Medical Research), 펜폴즈 가족 장학금(Penfolds Family Scholarship), 국립 보건 및 의료 연구 위원회(National Health and Medical Research Council, APP2002783) 및 호주 국립 심장 재단(National Heart Foundation of Australia, 104615)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
참고문헌
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39 (2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483 (2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. . Veterinary Sutures Handbook. , (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392 (2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897 (2016).
- Singh, B., Dyce, K. M. . Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411 (2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유