Method Article
Administrer des traitements cardioactifs dans un modèle d’infarctus du myocarde porcin
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole décrit trois méthodes d’administration d’agents thérapeutiques cardioactifs dans un modèle porcin. Les porcs femelles ont reçu un traitement par : (1) thoracotomie et injection transépicardique, (2) injection transendocardique par cathéter, ou (3) perfusion intraveineuse par minipompe osmotique de la veine jugulaire.
Résumé
L’infarctus du myocarde est l’une des principales causes de décès et d’invalidité dans le monde, et il est urgent de mettre au point de nouvelles stratégies cardioprotectrices ou régénératives. Un élément essentiel du développement d’un médicament consiste à déterminer comment un nouveau traitement doit être administré. Les modèles animaux de grande taille physiologiquement pertinents sont d’une importance cruciale pour évaluer la faisabilité et l’efficacité de diverses stratégies d’administration thérapeutique. En raison de leurs similitudes avec les humains en matière de physiologie cardiovasculaire, d’anatomie vasculaire coronarienne et de rapport poids/poids cardiaque, les porcs sont l’une des espèces préférées dans l’évaluation préclinique de nouvelles thérapies pour l’infarctus du myocarde. Le présent protocole décrit trois méthodes d’administration d’agents thérapeutiques cardioactifs dans un modèle porcin. Après un infarctus du myocarde induit par voie percutanée, les porcs landrace femelles ont reçu un traitement avec de nouveaux agents par : (1) thoracotomie et injection transépicardique, (2) injection transendocardique par cathéter, ou (3) perfusion intraveineuse via minipompe osmotique de la veine jugulaire. Les procédures employées pour chaque technique sont reproductibles, ce qui permet d’administrer des médicaments cardioactifs fiables. Ces modèles peuvent être facilement adaptés pour s’adapter à des modèles d’étude individuels, et chacune de ces techniques d’administration peut être utilisée pour étudier une variété d’interventions possibles. Par conséquent, ces méthodes sont un outil utile pour les scientifiques translationnels qui poursuivent de nouvelles approches biologiques dans la réparation cardiaque après un infarctus du myocarde.
Introduction
La maladie coronarienne (coronaropathie) et l’infarctus du myocarde avec élévation du segment ST (STEMI) associé sont les principales causes de décès dans le monde. Au cours des deux dernières décennies, de grands progrès ont été réalisés dans la réduction de la mortalité hospitalière des patients présentant un STEMI, grâce à l’avènement de l’intervention coronarienne percutanée, des thérapies fibrinolytiques et de la standardisation des algorithmes de traitement pour garantir que la reperfusion est réalisée en temps opportun 1,2,3. Malgré cela, la morbidité associée au STEMI reste un fardeau important, créant ainsi un grand besoin de développer de nouvelles thérapies cardioprotectrices et régénératives 2,3. Une composante essentielle du développement thérapeutique est la détermination de la manière dont une nouvelle thérapie doit être administrée4. L’innocuité, l’efficacité et la faisabilité de chaque méthode doivent correspondre aux caractéristiques de la thérapie elle-même.
Des modèles de grands animaux physiologiquement pertinents sont essentiels pour évaluer ces attributs de diverses stratégies d’administration thérapeutique5. En raison de leurs similitudes avec les humains en matière de physiologie cardiovasculaire, d’anatomie vasculaire coronaire et de rapport poids/poids cardiaque, les porcs sont l’une des espèces préférées dans l’évaluation préclinique de nouvelles thérapies pour l’infarctus du myocarde6. Nous avons déjà utilisé un modèle STEMI porcin pour démontrer la capacité réparatrice d’une thérapie protéique recombinante7, et nous continuons à étudier de nouvelles thérapies pharmacologiques, cellulaires et génétiques à l’aide de ce modèle. Ici, trois techniques d’administration thérapeutique utilisées dans des modèles porcins après la création d’un infarctus sont décrites : la thoracotomie et l’injection transépicardique, l’injection transendocardique percutanée et l’implantation d’une minipompe osmotique veineuse jugulaire. Les deux premières méthodes permettent l’administration locale de tissus, ce qui réduit les doses requises, les effets hors cible et le métabolisme hépatique de premier passage 8,9,10. La minipompe osmotique permet l’administration continue d’un médicament à demi-vie courte, ce qui élimine la dépendance à l’égard d’une pompe à perfusion et d’une canule intraveineuse brevetée, qui sont toutes deux difficiles à instituer dans de grands modèles animaux.
En décrivant ces techniques, nous espérons que cet article pourra aider les scientifiques translationnels à étudier de nouveaux agents cardioprotecteurs ou régénératifs à la suite d’un infarctus du myocarde dans de grands modèles animaux.
Protocole
Toutes les expériences ont été réalisées conformément au « code australien pour le soin et l’utilisation des animaux à des fins scientifiques » et ont été approuvées par le comité d’éthique animale du district sanitaire local de Western Sydney. Des cochettes prépubères de grande taille blanche x landrace, pesant de 18 à 20 kg, ont été utilisées pour la présente étude.
1. L’élevage
- Hébergez les animaux conformément aux règlements du comité local d’éthique animale.
REMARQUE : Les animaux inclus dans ce protocole sont logés individuellement pour éviter les combats et les blessures et s’assurer qu’il n’y a pas de compétition pour la nourriture. Cependant, tous les animaux pouvaient voir, entendre et sentir leurs congénères. Leurs enclos ont un sol en béton pour faciliter le nettoyage et ont une partie abritée à l’intérieur et à l’extérieur. Les porcs reçoivent de la litière de paille dans la partie intérieure et des « jouets » d’enrichissement dans la partie extérieure.
2. Sédation et anesthésie générale
- Sédation
- Assurez-vous que l’animal a été à jeun pendant au moins 12 h avant de commencer toute sédation lourde ou anesthésie générale.
- Si l’animal n’a pas encore d’accès vasculaire sous la forme d’un cathéter central, utilisez un protocole de sédatif intramusculaire.
- La sédation intramusculaire se compose de 8 mg/kg de kétamine, 0,3 mg/kg de midazolam, 0,2 mg/kg de méthadone et 10 μg/kg de médétomidine (voir le tableau des matériaux). Administrez ce mélange dans la musculature épaxiale de l’animal à l’aide d’une aiguille de 21 G. En moyenne, les animaux mettent 5 à 10 minutes pour devenir fortement sédatifs.
REMARQUE : Un porc stressé est plus résistant à la sédation ; Assurez-vous qu’un maître calme et confiant met l’animal sous sédatif et qu’il n’est pas trop stressé. Si l’animal est stressé, il est préférable de le laisser seul pendant 5 à 10 minutes et de réessayer. - Effectuer une sédation intraveineuse si un cathéter central est en place et perméable. La sédation intraveineuse se compose de 2 mg/kg de kétamine, 0,2 mg/kg de midazolam, 0,2 mg/kg de méthadone et 2 μg/kg de médétomidine.
- Rincez d’abord la ligne intraveineuse avec du chlorure de sodium à 0,9 % pour assurer la perméabilité. Ensuite, poussez lentement la moitié de la seringue mélangée à travers la ligne et rincez avec du chlorure de sodium à 0,9 %.
- Observez l’animal, qui doit être fortement sédaté dans les 20 à 30 secondes. Si l’animal n’est pas encore sous sédatif, rincez la moitié restante de la seringue, comme décrit à l’étape 2.1.5.
- Accès vasculaire
- Une fois qu’il a reçu un sédatif approprié, transportez le porc dans la salle d’opération.
- Pré-oxygéner le porc à l’aide d’un masque facial et d’un débit d’oxygène de 5 L/min. Connectez un oxymètre de pouls à la queue, aux oreilles ou à la langue du porc pour surveiller l’animal tout au long de l’examen.
- À l’aide d’une canule de 22 ou 24 G, accédez aux veines marginales gauche et droite de l’oreille et fixez-les avec du ruban adhésif.
- Anesthésie générale
- Positionnez le porc en décubitus sternal.
- Administrer 1 à 3 mg/kg de propofol (voir le tableau des matériaux) par voie intraveineuse en poussant lentement et en titrant jusqu’à l’effet. Demandez à un assistant de tenir la gueule de l’animal ouverte (la mâchoire doit être relâchée à ce stade) et d’étendre le cou.
- Utilisez un laryngoscope (voir le tableau des matériaux) pour enfoncer la base de la langue et l’épiglotte afin d’exposer les cartilages aryténoïdes du larynx.
- Passer une sonde endotrachéale lubrifiée (taille 5,5 ou 6,0 ; voir le tableau des matériaux) avec un stylet à travers les cartilages aryténoïdes et dans la trachée. Parfois, une résistance peut être ressentie lors du passage à travers le larynx ; Cela peut être contré par une rotation douce de la sonde endotrachéale. Si l’animal résiste à l’intubation, administrez plus de propofol par voie intraveineuse.
- Retirez le stylet de la sonde endotrachéale. Gonflez le ballonnet de la sonde endotrachéale jusqu’à ce que vous soyez convaincu qu’il n’y a pas de fuites d’air autour de la sonde. En général, 4 à 6 ml d’air sont nécessaires, bien que le volume puisse varier en fonction de la taille du tube et de l’animal.
- Fixez le tube endotrachéal derrière les oreilles de l’animal.
- Connectez l’animal à un circuit d’anesthésie réinhalant avec une fonction de ventilateur à volume contrôlé. Lorsque l’animal est connecté, éteignez le ventilateur.
REMARQUE : Assurez-vous que, à tout moment, la soupape de limitation de pression réglable (APL) ou « soupape d’ouverture » est ouverte. Le fait de ne pas laisser la valve ouverte peut entraîner un barotraumatisme mortel pour l’animal. - Réduire le débit d’oxygène du circuit d’anesthésie à 2 L/min.
- Réglez le ventilateur à pression positive sur le mode « contrôle du volume ». Réglez le volume courant à 10 mL/kg et la fréquence respiratoire à 20 respirations/min. Assurez-vous que le rapport inspiratoire/expiratoire est fixé à 1 :2.
- Tout au long de la procédure, manipulez la fréquence respiratoire pour vous assurer que le dioxyde de carbone en fin de marée se situe entre 35 et 50 mmHg.
REMARQUE : La pression inspiratoire ne doit pas dépasser 20 cmH2O. Les augmentations de la pression inspiratoire incitent à rechercher des plis ou des blocages de la tubulure. Pour atténuer les pressions accrues qui ne sont pas associées à la tubulure, le rapport inspiratoire/expiratoire peut être réduit à 1 :1,5 et le volume courant réduit. - Si l’animal est stable sur le plan hémodynamique, maintenez-le sous anesthésie par inhalation. Si l’animal n’est pas stable sur le plan hémodynamique, maintenez-le sous anesthésie intraveineuse totale, comme décrit à l’étape 2.3.14.
- Si l’animal doit recevoir une anesthésie par inhalation, commencer par l’isoflurane à 2,5 % à partir du moment où le circuit anesthésique est connecté pour la première fois.
- Au cours des 30 minutes suivantes, sevrer progressivement l’animal à 1,5 % d’isoflurane inhalé. Maintenir l’animal sous isoflurane à 1,5 % jusqu’à la fin de l’intervention.
- Évaluez la profondeur de l’anesthésie toutes les 10 minutes en vérifiant les réflexes palpébraux et en testant le tonus de la mâchoire. Ajustez l’isoflurane au besoin pour maintenir la profondeur de l’anesthésie.
- Si l’animal est hémodynamiquement instable, maintenez-le sous anesthésie intraveineuse totale, ce qui permet un meilleur contrôle de la profondeur anesthésique sans les complications cardiovasculaires associées aux agents anesthésiques inhalés.
- Préparez des pousse-seringues ou des pompes à liquide standard avec du propofol, du fentanyl et du midazolam. Reliez-les à l’animal via une ligne commune.
REMARQUE : Le propofol peut être administré à une dose de 0,1 à 0,6 mg/kg/min, le fentanyl à une dose de 1 à 5 μg/kg/h et le midazolam à une dose de 0,05 à 0,2 mg/kg/h. - Comme pour l’anesthésie par inhalation, titrez ces médicaments pour qu’ils agissent tout au long de l’anesthésie afin de maintenir une profondeur d’anesthésie appropriée.
- Préparez des pousse-seringues ou des pompes à liquide standard avec du propofol, du fentanyl et du midazolam. Reliez-les à l’animal via une ligne commune.
- Fournir un soutien liquidien intraveineux avec du chlorure de sodium à 0,9 % ou une solution de Hartmann (voir le tableau des matériaux) à un taux de 5 mL/kg/h.
- Surveillez l’animal à l’aide de mesures de la pression artérielle, de la capnographie, de la surveillance des gaz anesthésiques, de la température, de l’oxymétrie de pouls et de l’électrocardiographie.
- Tout au long de l’intervention, administrer une analgésie supplémentaire sous forme de 0,2 mg/kg de méthadone par voie intraveineuse toutes les 4 heures après la prémédication.
REMARQUE : L’analgésie peut être administrée à des intervalles plus courts si l’animal présente des signes de douleur pendant l’anesthésie (tachycardie, anesthésie allégée sans modification des médicaments d’entretien).
3. Placement de la ligne centrale
- Placez le porc en décubitus dorsal avec les membres postérieurs étendus, le membre antérieur gauche étendu et le membre antérieur droit fléchi et attaché avec une attache.
- Préparez le cou du porc de manière aseptique et couvrez-le d’un drapé.
- Utilisez une sonde à ultrasons linéaire (voir le tableau des matériaux) avec un revêtement stérile pour localiser la veine jugulaire droite. La meilleure façon d’y parvenir est d’orienter la sonde perpendiculairement à la trachée et de la déplacer lentement latéralement à partir du larynx.
- Activez le mode Doppler couleur pour aider à identifier la veine jugulaire. La veine jugulaire peut être distinguée de l’artère carotide en démontrant une collapsibilité et un écoulement continu et non pulsatile.
- Utilisez une aiguille de Cook de 18 G (voir le tableau des matériaux) pour accéder à la veine sous guidage échographique. Une fois l’accès atteint, passez un fil de 0,035 pouce à pointe en J (voir le tableau des matériaux) dans l’aiguille et enfilez-le dans le récipient. Retirez l’aiguille sur le fil.
- Enfilez une ligne centrale pré-rincée sur le fil et poussez-la dans la veine. Assurez-vous que le fil est visible à partir de l’extrémité distale de la ligne à tout moment.
REMARQUE : Un cathéter veineux central à deux lumières de 5 Fr (voir le tableau des matériaux) a été utilisé pour les sujets nécessitant un accès intraveineux sur une période de 1 à 4 semaines. - S’il y a de la difficulté à faire avancer la ligne à travers la peau, utilisez un scalpel n° 11 pour créer une petite incision de 2 à 4 mm afin de faciliter le passage de la ligne sur le fil. Appliquez une pression négative suivie d’un rinçage sur chaque ligne externe pour assurer la perméabilité. Fixez chaque ligne.
- Fixez les ancrages fournis aux lignes externes et fixez-les en place avec des sutures 2-0 ou 3-0 non solubles (voir le tableau des matériaux). Placez des sutures supplémentaires pour fixer les lignes externes dorsalement afin d’éviter que l’animal ne les mâche.
- Fixez les lignes d’extension rincées aux lignes externes du cathéter et fixez-les.
- Équipez l’animal d’une veste de porc commerciale (voir le tableau des matériaux) et fixez les lignes à l’intérieur. Si d’autres procédures doivent encore être effectuées au cours de la même anesthésie, ajustez la veste juste avant la récupération de l’animal.
4. Infarctus du myocarde
REMARQUE : Les animaux utilisés dans ce modèle ont subi un infarctus du myocarde à la suite d’une méthode publiée précédemment7.
- Effectuer un infarctus du myocarde 2 semaines avant les procédures d’injection transépicardique et transendocardique 8,9,10. L’implantation d’une minipompe osmotique a été réalisée immédiatement après la reperfusion coronaire au cours de la même procédure.
5. Administration de médicaments ou de cellules
- Thoracotomie et injection de cellules épicardiques
- Administrer des antibiotiques prophylactiques par voie intraveineuse sous forme de 22 mg/kg de céfazoline (voir le tableau des matériaux). Continuez toutes les 90 minutes tout au long de la procédure.
- Positionnez l’animal dans la position latérale droite couchée.
- Appliquer un timbre de fentanyl de 100 μg/h (voir le tableau des matériaux) sur le plan plat derrière les oreilles du porc. Couvrir d’un pansement adhésif ou d’une suture 2-0.
REMARQUE : Ce timbre est considéré comme « actif » 12 h après la mise en place et procure une analgésie pendant 72 h. - Installez le câblage et les patchs du système de cartographie électroanatomique en suivant les spécifications du produit (voir le tableau des matériaux).
- Tracez une ligne horizontale de 10 cm entre les côtes 4 et 5 sur l’animal à l’aide d’un crayon ou d’un marqueur chirurgical.
- Préparer un mélange de lidocaïne (2 mg/kg) et de bupivacaïne (1 mg/kg) dans une seule seringue avec une aiguille de 25 G.
- Préparer de manière aseptique le site chirurgical et draper l’animal. Effectuez un blocage cutané au site d’incision marqué en insérant l’aiguille dans la peau à un angle peu profond, en retirant légèrement le piston pour éviter le reflux de sang dans la seringue et en injectant lentement la solution au fur et à mesure que l’aiguille est retirée de la peau. Répétez ce processus tout en descendant la ligne.
REMARQUE : Une pression négative doit être appliquée à la seringue à chaque nouveau site d’injection pour s’assurer que la bupivacaïne n’est pas administrée par voie intravasculaire. La bupivacaïne intravasculaire peut être rapidement mortelle. - À l’aide d’un scalpel n° 22, faites une incision cutanée de 10 cm le long de la ligne marquée.
- À l’aide d’un cautéris monopolaire (voir le tableau des matériaux), approfondissez l’incision à travers les couches musculaires sous-jacentes jusqu’à ce que les muscles intercostaux aient été atteints.
- Préparez une seringue stérile contenant 0,5 mg/kg de bupivacaïne et 1 mg/kg de lignocaïne, et fixez une aiguille de 25 G.
- Insérez l’aiguille à un angle peu prononcé sur le bord caudal de la quatrième côte. Appliquez une pression négative sur le piston pour vous assurer que l’aiguille n’a pas traversé la veine ou l’artère intercostale. Injectez lentement un quart du volume de la seringue tout en gardant l’aiguille immobile.
- Répétez l’étape 5.1.12 à trois autres endroits, espacés de 3 à 5 cm le long du bord caudal de la quatrième côte.
- À l’aide de ciseaux de Metzenbaum (voir tableau des matériaux), inciser soigneusement les muscles intercostaux, puis inciser la plèvre après confirmation avec l’anesthésiste.
- Au fur et à mesure que la plèvre est incisée, éteignez le ventilateur pour permettre aux poumons de s’éloigner de la plèvre. Une fois l’incision pratiquée, rallumez le ventilateur et ajustez la pression expiratoire positive à 4 cmH2O.
- Placez des écarteurs de côtes auto-retenant entre les côtes et ouvrez-les lentement pour exposer le cœur. À l’aide d’une pince à tissus, saisissez doucement le péricarde et incisez avec des ciseaux Metzenbaum afin que le cœur puisse être extériorisé.
REMARQUE : Au cours de cette étape et des étapes suivantes, les arythmies sont fréquentes. L’ECG doit être surveillé de près et toute manipulation cardiaque doit être arrêtée temporairement si l’animal devient hémodynamiquement instable (pression artérielle moyenne inférieure à 55 mmHg). Des bolus intraveineux de métaraminol (0,25 mg) doivent être administrés au besoin pour améliorer la pression artérielle. - Placez des sutures temporaires 2-0 aux extrémités et sur les côtés de l’incision péricardique pour la fixer à la paroi thoracique et créer un puits péricardique. Assurez-vous que les côtés du péricarde sont soutenus pour rendre le péricarde aussi peu profond que possible.
- Utilisez des écouvillons humidifiés ou des éponges de laparotomie pour tasser la région entourant le cœur. Cela aidera à maintenir le cœur stable et à prévenir le dessèchement des tissus exposés.
- Déposez l’apex du cœur à partir de l’intérieur de la cavité péricardique avec un index derrière le ventricule gauche. Prenez soin de minimiser la compression ventriculaire gauche.
REMARQUE : Un cœur en bonne santé peut battre confortablement avec l’apex pointant verticalement, assis sur sa base avec un soutien doux mais sans compression. Il y a une diminution initiale de la pression artérielle associée à la manipulation, mais celle-ci doit revenir à un niveau acceptable en l’absence de compression ventriculaire externe.- Si la récupération n’est pas lente ou très lente dans les 15 s, ramenez immédiatement le cœur dans la cavité péricardique et prenez les mesures nécessaires pour améliorer les paramètres hémodynamiques avant une nouvelle luxation.
REMARQUE : Si le ventricule peut être disloqué, la position de l’apex à l’extérieur du péricarde peut être maintenue en plaçant des compresses de gaze de taille appropriée à l’intérieur du péricarde pour soutenir le ventricule. De même, un écouvillon allongé et humidifié peut être placé sous la base du cœur, où il agit comme une « écharpe » qui guide l’apex cardiaque vers le haut vers l’incision (Figure 1A).
- Si la récupération n’est pas lente ou très lente dans les 15 s, ramenez immédiatement le cœur dans la cavité péricardique et prenez les mesures nécessaires pour améliorer les paramètres hémodynamiques avant une nouvelle luxation.
- Créer une carte de tension électroanatomique de la surface épicardique ventriculaire gauche à l’aide d’un cathéter de cartographie électrophysiologique (Figure 1B). Identifiez les cicatrices, les bordures et les zones éloignées par des coupures de tension standard.
NOTA : La cicatrice et la zone éloignée ont été définies avec des coupures bipolaires de <0,5 mV ou >1,5 mV, et des coupures unipolaires de <3 mV ou >8,3 mV, respectivement11,12. - Pliez l’aiguille de la seringue d’administration thérapeutique de 27 G à un angle d’environ 80 à 90°.
- Faites avancer l’aiguille dans le tissu cible à un angle peu profond et appliquez une pression sur le piston de la seringue pour décharger 1/4 à 1/3 du volume total. Un blanchiment des tissus doit être observé (figure 1C). Utilisez le cathéter de cartographie électrophysiologique pour annoter l’emplacement du site d’injection sur la carte de tension épicardique générée (Figure 1D).
NOTE : Des injections dans des véhicules constitués du milieu de culture cellulaire (RPMI 1640) ont été utilisées à des fins de démonstration dans le protocole vidéo. - Retirez partiellement l’aiguille et redirigez-la dans le myocarde. Déchargez encore 1/4 à 1/3 du volume de la seringue. Continuez jusqu’à ce que la seringue soit vide.
- Répétez les étapes 5.1.20 à 5.1.24 jusqu’à ce que la dose désirée ait été administrée.
- Retirez les écouvillons qui se détachent du cœur et retirez délicatement la « fronde » sous le cœur, afin qu’il revienne à la position neutre. Les arythmies sont fréquentes au cours de cette étape et il faut faire preuve de prudence comme décrit à l’étape 5.1.17.
- Retirez les sutures de séjour 2-0 du péricarde. Desserrez l’écarteur et retirez-le du thorax.
- Utilisez des sutures en polydioxanone (PDS) de taille 1 avec une aiguille ronde à bout émoussé pour fermer le thorax en le faisant passer dans les espaces entre les côtes 3 et 4 et les côtes 5 et 6.
REMARQUE : Les sutures étroites en forme de huit fournissent un effet de poulie pour se rapprocher des côtes. Deux ou trois sutures de ce type doivent être utilisées, selon la taille de l’animal. - Avant de serrer et d’attacher les sutures se rapprochant des côtes, insérez une courte longueur de tube en silicone dans le bord ventral de l’incision.
- Placez l’extrémité libre de la tubulure dans un bol de solution saline stérile pour un drainage étanche sous l’eau de la cavité pleurale.
- Fermez les couches musculaires sus-jacentes en un motif continu simple avec des sutures résorbables 2-0. Fermez la peau en un simple motif continu ou à emboîtementgué 13 avec une suture non résorbable 2-0 ou 3-0.
- Lorsque la fermeture de la plaie est terminée, expulsez l’air libre du thorax par l’effet d’une ventilation à pression positive.
- Mettez le ventilateur sur le réglage « respiration libre ». Utilisez le sac réservoir sur le circuit de réinspiration pour fournir une pression positive constante aux voies respiratoires (maintenir à 20-30 cmH2O).
- Continuez cette pression jusqu’à ce qu’il n’y ait plus de bulles dans le bol salin, ce qui indique qu’il n’y a pas d’air libre dans le thorax.
- Retirez le tube en silicone.
- Appliquez un pansement adhésif sur le site chirurgical et placez des sutures simples interrompues éparpillées pour aider à maintenir le pansement en place.
- Au moment de la récupération, administrer 0,3 mg/kg de méthadone par voie sous-cutanée et 0,2 à 0,5 mg/kg d’ondansétron (voir le tableau des matériaux) par voie intraveineuse.
- Implantation d’une minipompe osmotique de la veine jugulaire
- Positionnez l’animal comme décrit à l’étape 3.1. Préparez et drapez de manière aseptique le côté droit du cou de l’animal.
- À l’aide d’une lame de scalpel n° 22, faites une incision de 8 à 10 cm s’étendant crânienne à partir d’une pointe de 2 à 3 cm latérale jusqu’au manubrium sterni. Cette incision doit devenir légèrement plus latérale au fur et à mesure qu’elle se déplace crâniennement.
- Utilisez des ciseaux Metzenbaum pour disséquer les muscles cutanés colli, sternohyoideus et sterno-céphale. Utilisez des techniques de dissection contondante pour approfondir l’incision jusqu’à ce que la veine jugulaire externe soit visible.
- Placez des écarteurs auto-retenus dans l’incision et ouvrez-les pour améliorer la visibilité.
- À l’aide d’une pince à tissu brun Adson (voir le tableau des matériaux) et d’un ciseau Metzenbaum, retirez les tissus mous entourant la veine jugulaire, à la fois au-dessus et au-dessous (Figure 2A). Il s’agit d’une étape cruciale, car dans les stades ultérieurs, les tissus mous recouvrant le vaisseau peuvent obstruer le passage de la tubulure de la minipompe.
- Utilisez une suture résorbable 5-0 à travers l’extrémité exposée caudale de la veine, à environ 1 cm du bord visible le plus caudal du vaisseau. Passez la suture par « bouchées » de 5 mm de la manière suivante : crânienne-caudale sur le côté droit, droite à gauche et caudale à crânienne sur le côté gauche. Le motif résultant doit apparaître sous la forme « trois côtés d’un carré ». Assurez-vous que les queues de suture des deux extrémités sont de longueur égale.
- Assemblez la mini-pompe comme décrit dans le manuel d’instructions du produit (voir le tableau des matériaux).
- Attachez des liens vasculaires élastiques autour du vaisseau aux extrémités crânienne et caudale. Gardez-les lâches au début. Demandez à un assistant d’exercer une tension sur les liens vasculaires pour obstruer le vaisseau.
- À l’aide d’une aiguille de 14 G, faites une ponction dans la veine au centre du « carré à trois côtés » créé avec du matériau de suture (étape 5.2.7 ; Graphique 2B).
- Enfilez le tube de la mini-pompe dans la crevaison. Il doit passer facilement dans le navire. Si vous rencontrez de la résistance, ne continuez pas à pousser ; Au lieu de cela, retirez le tube et réessayez.
- Faites avancer le tube jusqu’à ce qu’il reste 1 à 2 cm à l’extérieur du récipient. Serrez le matériau de suture autour de la tubulure du cathéter et attachez-le en un simple nœud interrompu. Demandez à l’assistant de relâcher et de retirer les liens vasculaires.
- Enroulez plusieurs fois une suture non résorbable 2-0 autour du corps de la mini-pompe et attachez-la de manière à ce que la suture soit bien fixée sur la pompe. Ensuite, fixez la pompe aux tissus mous voisins à l’aide d’un simple nœud interrompu (Figure 2C,D).
- Retirez les écarteurs de l’incision. Fermez l’incision dans une fermeture continue simple standard à trois couches.
- Administrer 0,2 mg/kg de méloxicam par voie sous-cutanée pendant la convalescence.
- Injection transendocardique percutanée
- Placez l’animal en position couchée dorsale avec les membres antérieurs et postérieurs étendus, et fixez-le avec des attaches.
- Préparer de manière aseptique l’abdomen caudal et les cuisses médiales de l’animal. Draper l’animal d’un champ d’angiographie fémorale fenêtré (voir le tableau des matériaux).
- Installez le câblage et les patchs du système de cartographie électroanatomique en suivant les spécifications du produit (voir le tableau des matériaux).
- Utilisez une sonde à ultrasons linéaire pour identifier l’artère fémorale. Sous guidage échographique, ponctionnez l’artère fémorale avec une aiguille de cuisson et enfilez un fil-guide de 0,035 pouce dans le vaisseau via l’aiguille. Retirez l’aiguille sur le fil.
- Enfilez une gaine artérielle de 8 Fr et un introducteur sur le fil artériel et poussez jusqu’à ce que seul le moyeu soit exposé à la peau. Assurez-vous que le fil est toujours visible, sortant du moyeu de la gaine.
REMARQUE : Comme il s’agit d’une gaine plus grande, il peut parfois être nécessaire d’utiliser un scalpel n° 11 pour créer une petite incision cutanée afin de faciliter le passage. - Retirez l’introducteur de gaine et le fil. Administrer de l’héparine par voie intraveineuse (100-200 unités/kg).
- Introduire le cathéter d’injection transendocardique à travers la gaine et avancer vers le ventricule gauche par une approche aortique rétrograde.
- Créez une carte électroanatomique du ventricule gauche en faisant glisser doucement le cathéter sur la surface endocardique. Effectuez une rotation axiale et des modifications douces de la flexion de la pointe pour obtenir un bon contact endocardique. Identifiez les cicatrices, les frontières et les zones éloignées par des coupures de tension standard.
- Dirigez le cathéter avec guidage fluoroscopique et électroanatomique vers l’emplacement d’injection préféré. Effectuez une rotation axiale douce avec déviation de l’extrémité distale pour engager et maintenir un contact endocardique stable.
- Confirmez la mise en place de l’extrémité du cathéter à l’aide d’au moins deux vues fluoroscopiques. Avancez doucement le cathéter central, puis étendez l’aiguille jusqu’à une profondeur intramyocardique contrôlée (3,5 mm pour l’injection apicale, 5 mm pour l’injection septale).
- Prélever 4 à 6 mL de produit de contraste iodé (voir le tableau des matériaux) à travers le cathéter d’injection jusqu’à ce qu’il soit visible à la fluoroscopie. Observez le contraste pendant les 10 à 30 secondes suivantes pour vous assurer qu’il reste dans le tissu (Figure 3A).
- Observez attentivement l’ECG pendant l’extension de l’aiguille et l’injection, car les cycles d’ectopie ventriculaire sont fréquents.
REMARQUE : L’ectopie ventriculaire se produit lorsque la pointe de l’aiguille est entrée en contact avec le myocarde. - Si l’injection de produit de contraste réussit, faites suivre d’une injection de l’agent d’intérêt. Rincez cela avec un produit de contraste jusqu’à ce qu’il soit observé par fluoroscopie.
REMARQUE : L’agent d’intérêt est spécifique à l’utilisateur, en fonction du traitement qu’il teste. - Rétractez l’aiguille. Retirez le cathéter d’injection de la gaine artérielle.
- Retirez la gaine artérielle et appliquez une pression sur les sites jusqu’à 20 minutes jusqu’à ce que l’hémostase soit atteinte.
6. Récupération de l’anesthésie générale
- Éteignez les pompes d’anesthésie par inhalation ou par voie intraveineuse utilisées. Réduisez la fréquence respiratoire sur le ventilateur à 8-10 respirations/min.
- Après 2 à 5 minutes, mettez le ventilateur en mode « respiration libre » pendant 30 secondes à la fois. Observez l’animal et le capnographe pour une respiration spontanée.
- Si une respiration spontanée s’est produite, laissez le ventilateur éteint. Si l’animal est apnéique, rallumez le ventilateur pendant encore 1 à 2 minutes et réessayez jusqu’à ce que la respiration spontanée soit atteinte.
REMARQUE : Le délai de récupération varie en fonction de la procédure et des caractéristiques de l’animal, mais peut varier de 15 min à 1 h. - Une fois que l’animal respire confortablement (fréquence respiratoire de 15 à 30 respirations/min, dioxyde de carbone en fin de marée inférieur à 60, SpO2 supérieure à 95 %), débranchez l’oxygène, laissant les autres surveillances connectées.
- Retirez les sites temporaires d’accès vasculaire et appliquez une pression pour empêcher la formation d’hématomes. Si l’animal reste stable et continue de bien s’oxygéner pendant les 5 minutes suivantes, il peut être transporté vers sa zone de récupération.
- Après trois déglutitions spontanées consécutives, dégonflez le ballonnet de la sonde endotrachéale et retirez délicatement la sonde.
- Surveillez l’animal pendant au moins 5 minutes supplémentaires pour vous assurer qu’il continue à s’oxygéner correctement et qu’il ne rencontre aucune détresse respiratoire. L’oxygène à écoulement doit être utilisé au besoin si un animal se désature après l’extubation.
Résultats
Thoracotomie et injection de cellules épicardiques
Sur les 29 animaux qui ont subi une thoracotomie et une injection épicardique, 26 ont survécu. L’analyse histologique a confirmé la prise de greffe de cellules humaines par cette méthode chez tous les animaux survivants (Figure 1E). Un animal a présenté des arythmies mortelles lors de l’injection de cellules et n’a pas pu être réanimé. Un autre a connu une activité électrique sans pouls pendant la fermeture et l’application prolongée d’une pression positive sur les voies respiratoires et n’a pas pu être récupéré. Un troisième animal a vomi et a fait un arrêt respiratoire lors de l’extubation. Cet animal n’a pas pu être réanimé.
Deux animaux ont connu des complications majeures, mais ont pu être récupérés. Un animal a développé une fibrillation ventriculaire lors d’une injection intramyocardique et a pu être réanimé à l’aide de palettes de défibrillation interne et d’un massage cardiaque. Le deuxième animal a vomi lors de l’extubation et a eu un bref arrêt respiratoire, mais a pu être rapidement réintubé et s’est bien rétabli. Tous ces événements se sont produits au cours des premières expériences, avec une diminution des effets indésirables à mesure que l’expérience de l’équipe avec le protocole augmentait (tableau 1).
Implantation d’une minipompe osmotique de la veine jugulaire
Aucune mortalité ou complication majeure n’a été associée à l’implantation d’une minipompe osmotique jugulaire. La plupart des sept animaux ont présenté un léger gonflement au site chirurgical au cours des 24 premières heures, qui a disparu sans intervention. L’analyse ELISA réalisée sur le sérum au jour 3 après l’implantation de la pompe a démontré l’efficacité de la pompe, atteignant une concentration sanguine significative de facteur de croissance dérivé des plaquettes AB humain (PDGF-AB) par rapport aux témoins7 (Figure 2E).
Injection transendocardique percutanée
Au total, 22 animaux ont reçu des injections endocardiques. Parmi ces injections, 17 ont été considérées comme « réussies », déterminées par la fluorescence ou la coloration à l’encre observée dans le tissu cible à l’autopsie (Figure 3B). Il n’y a pas eu de mortalité associée à cette procédure. Un animal a développé un épanchement péricardique de petit volume à la suite d’une perforation ventriculaire droite. Cela s’est résolu d’elle-même et n’a pas entraîné de compromis cardiovasculaire. Ce même animal est mort ; Cependant, il s’agissait d’une procédure supplémentaire non liée après l’injection intramyocardique.
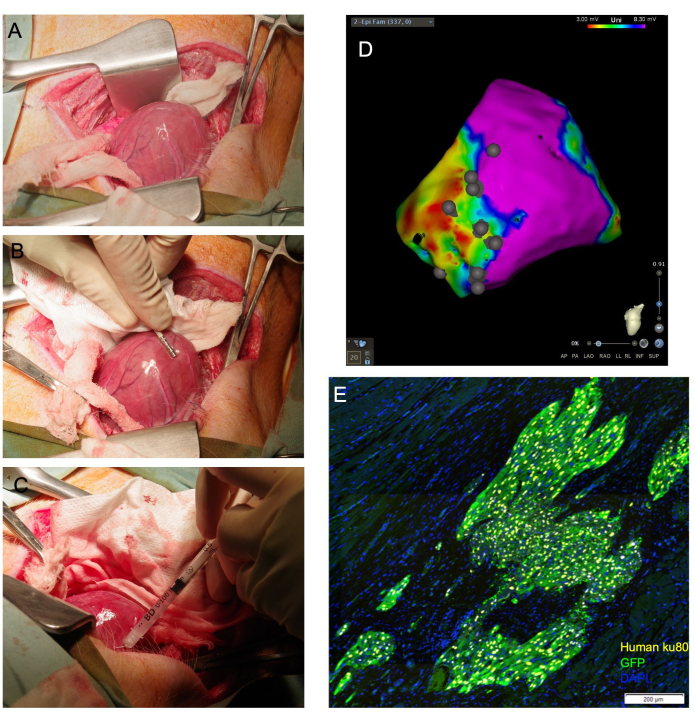
Figure 1 : L’injection transépicardique de cardiomyocytes permet une visualisation cardiaque directe et permet d’obtenir une proportion élevée de cellules viables délivrées au myocarde. (A) L’apex cardiaque est exposé à travers une écharpe de gaze humidifiée guidée sous la base du cœur. (B) Un cathéter de cartographie épicardique délimite les zones cicatricielles et frontalières et annote les sites d’injection. (C) Une aiguille de 31 G est utilisée pour injecter des cellules par voie transépicardique dans le myocarde. (D) Carte de tension épicardique avec annotation du site d’injection. Violet : tension normale, myocarde sain ; Rouge : tension anormale, myocarde malade ; Points gris : sites d’injection. Après le sacrifice, le cœur est recueilli et fixé au formol pour une évaluation histologique en aval. En (E), les cellules humaines greffées sont détectées par immunomarquage de l’anticorps antinucléaire humain, Ku80, et d’un anticorps anti-GFP. Barre d’échelle = 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
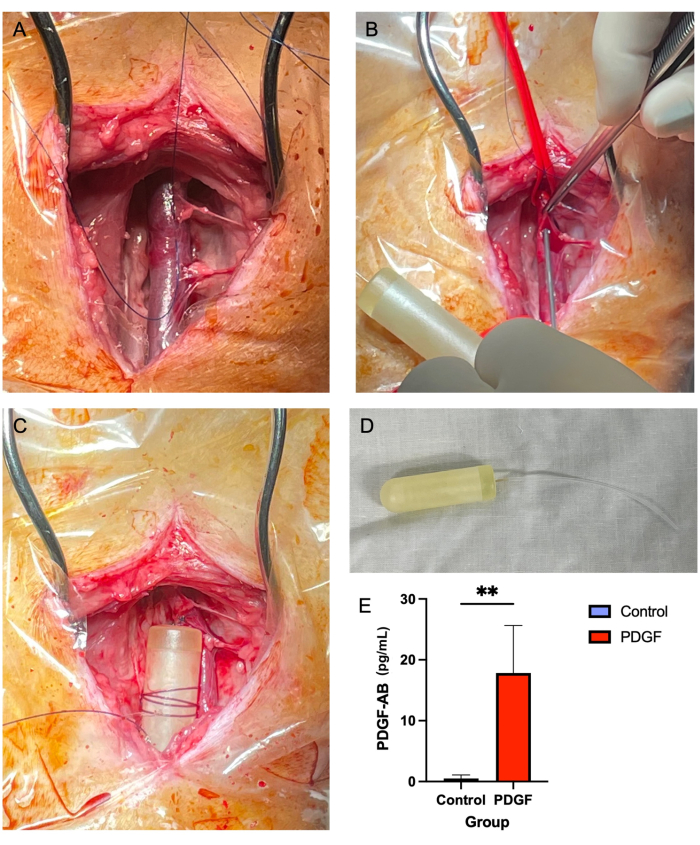
Figure 2 : L’insertion de la minipompe de la veine jugulaire constitue une méthode sûre et fiable d’administration de PDGF sur une période de 7 jours. (A) La veine jugulaire droite est exposée et les tissus mous sont dégagés du vaisseau. (B) Les attaches vasculaires obstruent le vaisseau tandis qu’une aiguille de 14 G est utilisée pour faire une ponction, à travers laquelle le tube de la minipompe est enfilé. (C) La tubulure de la minipompe est avancée dans la veine et le corps de la minipompe est fixé aux tissus mous adjacents. (D) Le corps de la minipompe et la tubulure avant l’implantation. (E) La concentration sérique de la protéine recombinante délivrée par la minipompe et le PDGF-AB a été mesurée à l’aide d’un test ELISA chez chaque animal le jour 3 après l’implantation. Il a été démontré que les animaux recevant le PDGF-AB avaient une concentration sanguine significativement plus élevée de PDGF-AB que les animaux témoins, ce qui confirme l’efficacité de la méthode d’administration de la minipompe osmotique. **indique une différence statistiquement significative entre les groupes (p = 0,005, test U de Mann-Whitney) Veuillez cliquer ici pour voir une version agrandie de cette figure.
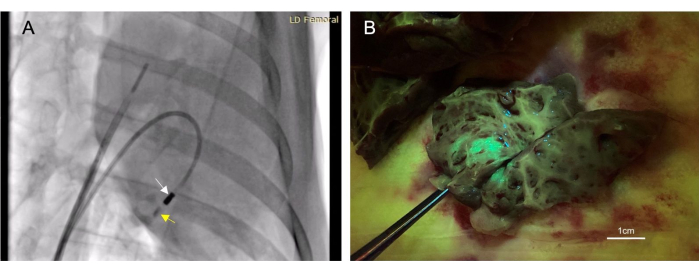
Figure 3 : L’injection intramyocardique transendocardique permet une méthode d’administration thérapeutique peu invasive. (A) Une image fluoroscopique oblique antérieure droite montrant le cathéter d’injection (flèche blanche) administrant un produit de contraste (flèche jaune) dans le myocarde. L’injection de produit de contraste précède et suit l’injection thérapeutique afin que la mise en place de l’aiguille dans le myocarde puisse être confirmée. (B) Le vecteur injecté exprimait une protéine fluorescente verte (GFP) de sorte que le matériel injecté devenait fluorescent lors du prélèvement de tissus, confirmant ainsi le succès de l’injection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Injection transépicardique (n = 29) | Injection transendocardique (n = 22) | Minipompe osmotique (n = 7) | |
| Mortalité | 3 | 0 | 0 |
| Vomissements postopératoires et arrêt respiratoire | 1 | 0 | 0 |
| Fibrillation ventriculaire lors de l’injection | 1 | 0 | 0 |
| Activité électrique sans pouls pendant la fermeture thoracique | 1 | 0 | 0 |
| Morbidité | 0 | 1 | 0 |
| Pneumothorax | 0 | 0 | 0 |
| Épanchement pleural | 0 | 0 | 0 |
| Perforation de la cavité cardiaque | 0 | 1 | 0 |
| Hémorragie | 0 | 0 | 0 |
Tableau 1 : Liste des complications.
Discussion
Injection intramyocardique transépicardique
Cette procédure présente l’avantage d’une visualisation cardiaque directe et il a été démontré qu’elle permet une plus grande rétention locale des agents thérapeutiques que les méthodes d’administration systémique 9,10,14. Cependant, les thoracotomies sont invasives, nécessitent des compétences techniques considérables et présentent un risque plus élevé de morbidité et de mortalité que les autres méthodes discutées10,15. La connaissance des étapes critiques et précaires de la procédure peut aider à la médiation de ce risque accru.
Il faut faire preuve d’une grande prudence lors de la manipulation du cœur pour exposer l’apex cardiaque en raison du risque élevé d’arythmie et de compromis hémodynamique associé. La surveillance invasive continue de la pression artérielle et l’électrocardiographie permettent d’identifier rapidement l’hypotension ou les arythmies instables, ce qui facilite une intervention et une correction rapides. L’hypotension transitoire peut généralement être traitée par des bolus de métaraminol. L’hypotension prolongée peut être retardée en réduisant l’anesthésique par inhalation (surveillance attentive de la profondeur de l’anesthésie) et en commençant une perfusion de vasopresseur, tout en déterminant simultanément la cause de l’hémodynamique altérée. Les arythmies instables, telles que la tachycardie ventriculaire ou la fibrillation ventriculaire, peuvent être traitées par cardioversion électrique avec ou sans antiarythmiques intraveineux.
Il est tout aussi important pour la survie de l’animal de réussir à éliminer les gaz libres de la cavité pleurale avant de fermer le thorax. Le non-respect de cette consigne peut entraîner le développement d’un pneumothorax, exposant l’animal à un risque élevé de compromission respiratoire et de décès une fois débranché du ventilateur mécanique au moment de la récupération. La pression positive des voies respiratoires doit être maintenue pendant au moins 30 s jusqu’à ce qu’il n’y ait plus de bulles. Le tube en silicone est rapidement retiré à l’arrêt du bouillonnement, et le thorax est alors rapidement fermé. Il est également possible de placer chirurgicalement une sonde de thoracostomie à la fermeture, ce qui permet l’élimination manuelle de l’air et du liquide inflammatoire au cours des prochaines 24 à 72 heures. Ceci, cependant, est difficile à garder propre et intact, surtout si les animaux sont logés ensemble. L’endommagement ou la contamination du tube peut entraîner un pyothorax, un pneumothorax ou une septicémie. D’après notre expérience, l’insertion d’un drain thoracique temporaire n’est pas nécessaire si le gaz libre est correctement éliminé avant la fermeture du coffre.
Injection intramyocardique transendocardique percutanée
Cette méthode d’administration thérapeutique a l’avantage de permettre l’administration locale de tissus avec un risque moindre en raison de sa nature moins invasive par rapport à une approche chirurgicale10,14. Cette technique est déjà utilisée dans les études sur les grands animaux, avec à la fois la fluoroscopie et la cartographie électromécanique comme guide en l’absence de visualisation directe10,16,17.
Étant donné que le cœur n’est pas sous vision directe, il est prudent pour le procédurier d’utiliser des vues fluoroscopiques orthogonales lors du choix d’un site d’injection. De plus, l’injection d’un produit de contraste iodé dilué avant et l’administration du traitement est extrêmement précieuse pour confirmer le contact myocardique. Un contact approprié peut être confirmé par l’observation d’un « rougissement myocardique » caractéristique, qui peut être l’un des seuls marqueurs du succès de l’injection avant le prélèvement de tissus. En raison du risque de perforation de la chambre, il est également recommandé que l’épaisseur de la paroi myocardique au site d’injection sélectionné soit supérieure à 9 mm14,16.
Minipompe osmotique veineuse jugulaire
La minipompe osmotique est un dispositif populaire couramment utilisé dans les études sur les petits animaux. Il y a eu un intérêt croissant pour l’utilisation de ce dispositif dans de grands modèles animaux 7,18,19, compte tenu de son avantage unique d’administrer un agent thérapeutique à un rythme constant sur une période de temps donnée. Une limite possible de cette méthode est l’incapacité de modifier ou d’arrêter les débits de perfusion du médicament sans remplacer ou retirer la pompe. Cela devrait être pris en compte avant d’essayer un traitement de cette manière.
Cette étude a démontré que cette méthode pouvait être réalisée avec un taux de réussite élevé chez les porcs, avec une faible morbidité et mortalité. Il convient de noter que de nombreuses structures vitales sont adjacentes au site chirurgical, notamment les ganglions lymphatiques, le thymus et l’artère carotide. L’adhésion à la méthode et la consultation des textes anatomiques20 sont fortement recommandées pour éviter d’endommager par inadvertance l’une de ces structures. La complication la plus préoccupante de cette méthode est le choc hémorragique dû à une lésion accidentelle de la veine jugulaire ou d’une structure environnante. Il est donc essentiel que les tissus mous entourant la veine jugulaire soient soigneusement retirés. Si vous n’effectuez pas correctement cette étape, il peut être difficile de placer la tubulure de la minipompe ou de contrôler les saignements involontaires.
Cet article a décrit trois méthodes d’administration de thérapies cardioactives. Malgré le succès rapporté de chaque technique, il y a des limites inhérentes à prendre en compte. Les procédures invasives (injection transépicardique) permettent d’augmenter la précision de l’administration thérapeutique ; Cependant, ils présentent un risque accru de complications potentiellement mortelles. De plus, l’accouchement invasif nécessite davantage de compétences techniques afin de minimiser le risque de complications. De même, l’injection transendocardique guidée par fluoroscopie nécessite un certain degré de compétence technique pour le cathétérisme et la manipulation du matériel. Si cette méthode n’est pas effectuée correctement, l’échec de l’injection et des complications fatales sont possibles.
Les méthodes d’injection directe décrites permettent l’administration unique d’un médicament dans le tissu cible. La minipompe osmotique veineuse jugulaire permet l’administration systémique d’un traitement sur une période de 7 jours. Comparativement, cette méthode est plus simple et associée à moins de risques, cependant, elle repose sur une découverte thérapeutique systémique du myocarde. De plus, une fois la pompe en place, il est impossible d’arrêter l’administration ou de modifier le débit de dose sans réanesthésier l’animal et retirer la pompe.
Toutes les méthodes décrites dans cet article ont été réalisées sur des animaux le jour ou 2 semaines après l’infarctus du myocarde. Par conséquent, ce travail ne peut pas rapporter le succès des méthodes mentionnées chez les animaux sains ou les animaux soumis à une pathologie cardiaque alternative. Enfin, la pharmacologie et la biotechnologie de tout agent envisagé doivent être soigneusement examinées, car elles seront intrinsèquement liées à l’efficacité de la voie d’administration choisie. Une discussion détaillée à ce sujet dépasse le cadre de ce manuscrit.
Des descriptions complètes des méthodes précliniques profitent au bien-être animal et à la communauté scientifique au sens large. L’amélioration de la reproductibilité des procédures et des résultats qui en résulte entraîne moins de complications pour la santé animale, une réduction du nombre d’animaux nécessaires pour produire des résultats significatifs et une plus grande confiance dans les résultats expérimentaux21,22. Trois méthodes d’administration de nouveaux traitements sont décrites dans cet article pour le traitement de l’infarctus du myocarde dans un modèle porcin. En détaillant les techniques utilisées et en articulant les avantages et les risques de chacune d’elles, on s’attend à ce que les chercheurs soient en mesure de créer confortablement des modèles précliniques cohérents et fiables qui répondent à leurs objectifs de recherche.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ces travaux ont été financés par des subventions du Conseil national de la santé et de la recherche médicale APP1194139/APP1126276 (JC), de la National Stem Cell Foundation of Australia et du Bureau de la santé et de la recherche médicale du gouvernement de la Nouvelle-Galles du Sud (JC). DS a été soutenu par le Royal Australasian College of Physicians, l’Institute of Clinical Pathology and Medical Research et le programme de formation à la recherche du gouvernement australien. La TD a reçu le soutien de l’Institute of Clinical Pathology and Medical Research, de la bourse d’études de la famille Penfolds, du National Health and Medical Research Council (APP2002783) et de la National Heart Foundation of Australia (104615).
matériels
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
Références
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39 (2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483 (2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. . Veterinary Sutures Handbook. , (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392 (2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897 (2016).
- Singh, B., Dyce, K. M. . Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411 (2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon