Method Article
猪心肌梗死模型中心脏活性疗法的递送
* 这些作者具有相同的贡献
摘要
本方案描述了在猪模型中施用心脏活性治疗剂的三种方法。雌性地方白猪通过以下任一方式接受治疗:(1)开胸术和经心外膜注射,(2)基于导管的经心内膜注射,或(3) 通过 颈静脉渗透微型泵静脉输注。
摘要
心肌梗死是全球死亡和残疾的主要原因之一,迫切需要新的心脏保护或再生策略。药物开发的一个重要组成部分是确定如何管理一种新型疗法。生理相关的大型动物模型对于评估各种治疗策略的可行性和有效性至关重要。由于猪在心血管生理学、冠状动脉血管解剖学和心脏重量与体重比方面与人类相似,因此是心肌梗死新疗法临床前评估的首选物种之一。本方案描述了在猪模型中施用心脏活性治疗剂的三种方法。经皮诱导心肌梗死后,雌性地方白猪通过以下任一方式接受新型药物治疗:(1)开胸和经心外膜注射,(2)基于导管的经心内膜注射,或(3) 通过 颈静脉渗透微型泵静脉输注。每种技术采用的程序都是可重复的,从而产生可靠的心脏活性药物递送。这些模型可以很容易地适应个人的研究设计,并且这些交付技术中的每一种都可用于研究各种可能的干预措施。因此,这些方法对于在心肌梗死后心脏修复中寻求新的生物学方法的转化科学家来说是一个有用的工具。
引言
冠状动脉疾病 (CAD) 和相关的 ST 段抬高型心肌梗死 (STEMI) 是全球死亡的主要原因。在过去的二十年中,通过经皮冠状动脉介入治疗、纤溶疗法和治疗流程的标准化,在降低 STEMI 患者的院内死亡率方面取得了巨大进展,以确保及时实现再灌注 1,2,3.尽管如此,与 STEMI 相关的发病率仍然是一个沉重的负担,因此迫切需要开发新的心脏保护和再生疗法 2,3。治疗开发的一个重要组成部分是确定如何实施新疗法4.每种方法的安全性、有效性和可行性都需要与治疗本身的特点相匹配。
生理相关的大型动物模型对于评估各种治疗递送策略的这些属性至关重要5.由于猪在心血管生理学、冠状动脉血管解剖学和心脏重量与体重比方面与人类相似,因此是心肌梗死新疗法临床前评估的首选物种之一6。我们之前曾使用猪 STEMI 模型来证明重组蛋白疗法的修复能力7,并继续使用该模型研究新的药物、细胞和基因疗法。在这里,描述了梗死产生后猪模型中使用的三种治疗给药技术:开胸术和经心外膜注射、经皮经心内膜注射和颈静脉渗透压微型泵植入术。前两种方法可实现局部组织递送,减少所需剂量、脱靶效应和肝脏首过代谢 8,9,10。渗透微型泵允许以较短的半衰期连续输送药物,从而消除了对输液泵和专利静脉插管的依赖,这两者都很难在大型动物模型中实现。
通过描述这些技术,希望本文可以帮助转化科学家在大型动物模型中研究心肌梗死后的新型心脏保护剂或再生剂。
研究方案
所有实验均按照"澳大利亚科学目的动物护理和使用规范"进行,并得到西悉尼地方卫生区动物伦理委员会的批准。本研究使用重达18-20公斤的青春期前大型白x长白后备母猪。
1. 畜牧业
- 根据当地动物伦理委员会的规定饲养动物。
注意:本协议中包含的动物是单独饲养的,以避免战斗和伤害,并确保没有食物竞争。然而,所有动物都能看到、听到和闻到同种动物。他们的围栏铺有混凝土地板,便于清洁,并有室内和室外的遮蔽部分。猪的室内部分有稻草垫料,室外部分有丰富的"玩具"。
2.镇静和全身麻醉
- 镇静
- 在开始任何重度镇静或全身麻醉之前,确保动物已经禁食至少 12 小时。
- 如果动物还没有以中心静脉导管的形式建立血管通路,请使用肌肉注射镇静方案。
- 肌内镇静包括 8 mg/kg 氯胺酮、0.3 mg/kg 咪达唑仑、0.2 mg/kg 美沙酮和 10 μg/kg 美托咪定(见 材料表)。用21G针将这种混合物施用到动物的外侧肌肉组织中。平均而言,动物需要 5-10 分钟才能变得高度镇静。
注意:应激猪对镇静剂的抵抗力更强;确保冷静和自信的处理者给动物镇静,并且动物不会受到过度的压力。如果动物感到压力,最好让它们独处 5-10 分钟,然后重试。 - 如果中心静脉插管已到位并通畅,则进行静脉镇静。静脉镇静包括氯胺酮 2 mg/kg、咪达唑仑 0.2 mg/kg、美沙酮 0.2 mg/kg 和美托咪定 2 μg/kg。
- 首先用 0.9% 氯化钠冲洗静脉输液管路以确保通畅。然后,慢慢地将混合注射器的一半推过管路,并用0.9%氯化钠冲洗。
- 观察动物,必须在 20-30 秒内进行大量镇静。如果动物尚未镇静,则冲洗注射器的剩余一半,如步骤2.1.5所述。
- 血管通路
- 适当镇静后,将猪运入手术室。
- 用面罩和5 L / min的氧气流速对猪进行预充氧。将脉搏血氧仪连接到猪的尾巴、耳朵或舌头上,以全程监测动物。
- 使用 22 或 24 G 套管,进入左右边缘耳静脉并用胶带固定。
- 全身麻醉
- 将猪置于胸骨卧位。
- 静脉内给予1-3mg / kg的丙泊酚(见 材料表),缓慢推动滴定至效果。让助手张开动物的嘴巴(此阶段下颌应松弛)并伸长脖子。
- 使用喉镜(见 材料表)压下舌根部和会厌,露出喉部的杓状软骨。
- 将带有管心针的润滑气管插管(尺寸 5.5 或 6.0;参见 材料表)穿过杓状软骨并进入气管。偶尔,通过喉部时可能会感觉到阻力;这可以通过轻轻旋转气管插管来抵消。如果动物抗拒插管,则静脉注射更多异丙酚。
- 从气管插管中取出管心针。给气管插管袖带充气,直到管子周围没有漏气。通常,需要 4-6 mL 空气,但体积可能因试管尺寸和动物而异。
- 将气管插管固定在动物耳朵后面。
- 将动物连接到具有容量控制呼吸机功能的再呼吸麻醉回路。连接动物后,将呼吸机"关闭"。
注意: 确保可调压力限制 (APL) 阀或"弹出阀"始终处于打开状态。未能保持瓣膜打开状态可能会对动物造成致命的气压伤。 - 将麻醉回路氧气流速降低至 2 L/min。
- 将正压呼吸机设置为"容量控制"模式。将潮气量设置为 10 mL/kg,呼吸频率设置为 20 次/分钟。确保吸气:呼气比设置为 1:2。
- 在整个过程中,控制呼吸频率以确保呼气末二氧化碳在 35-50 mmHg 之间。
注意: 吸气压力不得超过 20 cmH2O. 吸气压力升高会提示检查管道扭结或堵塞。为了缓解与管道无关的压力增加,吸气:呼气比可以降低到 1:1.5,并减少潮气量。 - 如果动物血流动力学稳定,则用吸入麻醉维持它们。如果动物血流动力学不稳定,则按照步骤 2.3.14 所述,用全静脉麻醉维持它们。
- 如果要对动物进行吸入麻醉,则从麻醉回路首次连接的那一刻起,从2.5%异氟烷开始。
- 在接下来的30分钟内,逐渐断奶至1.5%吸入异氟烷。将动物保持在1.5%异氟烷上,直到手术结束。
- 每 10 分钟通过检查睑反射和测试下颌张力来评估麻醉深度。根据需要调整异氟醚以保持麻醉深度。
- 如果动物血流动力学不稳定,则通过全静脉麻醉维持它们,从而更好地控制麻醉深度,而不会出现与吸入麻醉剂相关的心血管并发症。
- 准备注射泵或含有丙泊酚、芬太尼和咪达唑仑的标准流体泵。 通过 公共线将它们连接到动物。
注:丙泊酚的运行速度为0.1-0.6 mg/kg/min,芬太尼的运行速度为1-5μg/kg/h,咪达唑仑的运行速度为0.05-0.2 mg/kg/h。 - 与吸入麻醉一样,滴定这些药物以在整个麻醉过程中发挥作用,以保持适当的麻醉深度。
- 准备注射泵或含有丙泊酚、芬太尼和咪达唑仑的标准流体泵。 通过 公共线将它们连接到动物。
- 以 5 mL/kg/h 的速率提供 0.9% 氯化钠或 Hartmann 溶液(参见 材料表)的静脉输液支持。
- 通过血压测量、二氧化碳图、麻醉气体监测、体温、脉搏血氧饱和度和心电图监测动物。
- 在任何手术过程中,术前用药后每 4 小时静脉注射 0.2 mg/kg 美沙酮,提供额外的镇痛。
注意:如果动物在麻醉下表现出疼痛迹象(心动过速,麻醉深度减轻而没有改变维持药物),则可以以较短的间隔进行镇痛。
3. 中心线放置
- 将猪置于背卧位,后肢伸展,左前肢伸展,右前肢弯曲并用系带固定。
- 无菌准备猪的脖子,并用窗帘盖住。
- 使用带有无菌覆盖物的线性超声探头(参见 材料表)来定位右侧颈静脉。最好将探头垂直于气管,然后从喉部缓慢横向移动。
- 启用彩色多普勒模式以帮助识别颈静脉。颈静脉与颈动脉的区别在于可塌陷性和连续的、非搏动的血流。
- 使用 18 G Cook 针(参见 材料表)在超声引导下进入静脉。进入后,将 0.035 英寸的 J 形尖端线(参见 材料表)穿过针头并将其穿入容器中。在电线上取下针头。
- 将预冲洗的中心管穿过电线并推入静脉。确保始终可以看到从线的远端伸出的电线。
注意:5 Fr、双腔中心静脉导管(参见 材料表)用于需要在 1-4 周内静脉通路的受试者。 - 如果难以将线穿过皮肤,请使用 11 号手术刀创建一个 2-4 毫米的小切口,以方便线穿过线。施加负压,然后对每条外线进行冲洗,以确保通畅。夹住每条线。
- 将提供的锚连接到外线,并用 2-0 或 3-0 不可溶解缝合线将它们固定到位(参见 材料表)。放置额外的缝合线以将外线固定在背侧,以避免动物咀嚼它们。
- 将齐平的延长管连接到外部导管管上并夹紧。
- 给动物穿上商业猪夹克(见 材料表)并固定里面的线。如果在同一麻醉期间尚未进行其他手术,请在动物恢复前穿上夹克。
4.心肌梗塞
注:该模型中使用的动物按照先前发表的方法7 接受了心肌梗死。
- 在经心外膜和经心内膜注射程序前 2 周进行心肌梗死 8,9,10。在同一手术中,冠状动脉再灌注后立即进行渗透压微型泵植入术。
5.药物或细胞给药
- 开胸手术和心外膜细胞注射
- 以22mg / kg头孢唑啉的形式静脉内预防性抗生素(见 材料表)。在整个过程中每 90 分钟继续一次。
- 将动物置于右侧卧位。
- 将100μg/ h芬太尼贴片(见 材料表)涂在猪耳朵后面的平面上。用粘性敷料或 2-0 缝合线覆盖。
注意:该贴片在放置后 12 小时被认为是"活性"的,并提供 72 小时的镇痛作用。 - 按照产品规格设置电解剖映射系统布线和贴片(参见 材料表)。
- 用蜡笔或手术记号笔在动物的肋骨 4 和 5 之间标记一条 10 厘米的水平线。
- 用25G针头在单个注射器中制备利多卡因(2mg / kg)和布比卡因(1mg / kg)的混合物。
- 无菌准备手术部位并覆盖动物。在标记的切口部位进行皮肤线阻滞,方法是将针头以浅角度插入皮肤,稍微抽出柱塞以确保血液不会回流到注射器中,然后在针头从皮肤中抽出时缓慢注射溶液。在向下移动时重复此过程。
注意:必须在每个新注射部位对注射器施加负压,以确保布比卡因不会在血管内给药。血管内注射布比卡因可迅速致死。 - 使用 22 号手术刀,沿着标记线切开 10 厘米的皮肤。
- 使用单极烧灼术(见 材料表),通过下面的肌肉层加深切口,直到到达肋间肌肉。
- 准备0.5mg / kg布比卡因和1mg / kg利多卡因的无菌注射器,并连接25G针头。
- 将针头以浅角插入第四肋骨的尾缘。对柱塞施加负压,以确保针头没有穿过肋间静脉或动脉。缓慢注射注射器体积的四分之一,同时保持针头静止。
- 在另外三个位置重复步骤5.1.12,沿第四肋骨的尾缘相距3-5厘米。
- 使用Metzenbaum剪刀(见 材料表)仔细切开肋间肌,然后在与麻醉师确认后切开胸膜。
- 切开胸膜时,关闭呼吸机,让肺部脱离胸膜。切开后,重新打开呼吸机,将呼气末正压调节至 4 cmH2O。
- 将自固定肋骨牵开器放在肋骨之间,慢慢打开以露出心脏。使用组织镊轻轻抓住心包,并用 Metzenbaum 剪刀切开,以便心脏可以外切。
注意:在此步骤和接下来的几个步骤中,心律失常很常见。需要密切监测心电图,如果动物血流动力学不稳定(平均动脉压低于 55 mmHg),则必须暂时停止任何心脏操作。根据需要静脉推注间羟胺醇(0.25mg)以改善血压。 - 在心包切口的两端和两侧放置临时 2-0 缝合线,将其固定在胸壁上并形成心包孔。确保心包两侧得到支撑,以使心包孔尽可能浅。
- 使用湿润的棉签或剖腹海绵填充心脏周围的区域。这将有助于保持心脏稳定并防止暴露组织干燥。
- 用左心室后面的食指从心包腔内输送心脏的顶点。注意尽量减少左心室压迫。
注意:健康的心脏可以舒适地跳动,顶点垂直,坐在其底部,轻轻支撑但不压迫。与操作相关的血压最初会降低,但在没有心室外压迫的情况下,血压必须恢复到可接受的水平。- 如果在 15 秒内没有恢复或恢复非常缓慢,请立即将心脏送回心包腔,并在进一步脱位前采取必要措施改善血流动力学参数。
注意:如果心室可以脱位,可以通过在心包内放置适当大小的纱布包来支撑心室来维持心包外顶点的位置。同样,可以将细长的湿润拭子放置在心脏底部下方,在那里它充当"吊带",将心尖向上引导到切口(图1A)。
- 如果在 15 秒内没有恢复或恢复非常缓慢,请立即将心脏送回心包腔,并在进一步脱位前采取必要措施改善血流动力学参数。
- 使用电生理标测导管创建左心室外膜表面的电解剖电压图(图1B)。通过标准电压截止来识别疤痕、边界和偏远区域。
注:疤痕和偏远区域分别用 <0.5 mV 或 >1.5 mV 的双极截止值和 <3 mV 或 >8.3 mV 的单极截止值11,12 定义。 - 将 27 G 治疗性注射器的针头弯曲到大约 80-90° 角。
- 将针头以较浅的角度推进到目标组织中,并对注射器柱塞施加压力,以排出总体积的 1/4 至 1/3。必须观察组织的变白(图1C)。使用电生理标测导管在生成的心外膜电压图上注释注射部位位置(图1D)。
注:在视频协议中,由细胞培养基(RPMI 1640)组成的载体注射用于演示目的。 - 部分拔出针头并将其重定向到心肌内。再排出注射器体积的 1/4 至 1/3。继续直到注射器为空。
- 重复步骤5.1.20-5.1.24,直到输送所需的剂量。
- 取下心脏上的棉签,轻轻取下心脏下方的"吊带",使其恢复到中立位置。在此步骤中,心律失常很常见,必须按照步骤 5.1.17 中的说明谨慎行事。
- 从心包取下 2-0 缝合线。松开牵开器并将其从胸部取出。
- 使用 1 号聚二恶烷酮缝合线 (PDS) 和钝头圆针穿过肋骨 3 和 4 以及肋骨 5 和 6 之间的空间来闭合胸部。
注意:窄的八字形缝合线为近似肋骨提供了滑轮效果。根据动物的大小,必须使用两到三个这样的缝合线。 - 在收紧和绑紧肋骨近似缝合线之前,将一小段硅胶管插入切口的腹侧边缘。
- 将管子的自由端放入一碗无菌盐水中,用于胸膜腔的水下密封引流。
- 用 2-0 可吸收缝合线以简单的连续模式闭合上覆的肌肉层。用 2-0 或 3-0 不可吸收缝合线以简单的连续或福特联锁模式13 闭合皮肤。
- 伤口闭合完成后,通过正压通气将游离空气从胸部排出。
- 将呼吸机调至"自由呼吸"设置。在再呼吸回路上使用储液袋,为气道提供一致的正压(保持在 20-30 cmH2O)。
- 继续施加这种压力,直到在盐水碗中不再观察到气泡,表明胸部内没有游离空气。
- 取下硅胶管。
- 在手术部位涂上粘性敷料,并放置分散的简单间断缝合线,以帮助将敷料固定到位。
- 恢复后,皮下注射美沙酮0.3mg/kg,静脉注射昂丹司琼0.2-0.5mg/kg(见 材料表)。
- 颈静脉渗透压微型泵植入术
- 按照步骤 3.1 中的说明放置动物。无菌准备并覆盖动物脖子的右侧。
- 使用 22 号手术刀刀片,从胸骨外侧 2-3 厘米的点向颅骨切开一个 8-10 厘米的切口。当该切口在颅骨上移动时,该切口必须略微偏侧。
- 使用 Metzenbaum 剪刀解剖皮肤肌、胸骨舌肌和胸头肌。使用钝性解剖技术加深切口,直到颈外静脉可见。
- 将自固定牵开器放入切口中并打开它们以提高能见度。
- 使用Adson棕色组织镊子(见 材料表)和Metzenbaum剪刀,去除颈静脉周围的软组织,包括上方和下方(图2A)。这是一个关键的步骤,因为在后期阶段,覆盖在血管上的软组织会阻碍微型泵管的通过。
- 使用5-0可吸收缝合线穿过静脉的尾部暴露端,距离血管最尾部可见边缘约1厘米的颅骨。按以下方式以 5 毫米的"咬合"方式通过缝合线:右侧为颅骨到尾部,从右到左侧,左侧为尾部到颅骨。生成的图案必须显示为"正方形的三个边"。确保两端的缝合尾部长度相等。
- 按照产品说明手册中的说明组装微型泵(参见 材料表)。
- 在颅端和尾端的血管周围系上环弹性血管系带。最初保持这些松散。让助手在血管结带上施加张力以闭塞血管。
- 使用 14 G 针头,在用缝合材料制成的"三边正方形"中心的静脉中穿刺(步骤 5.2.7; 图2B)。
- 将微型泵管穿入穿刺处。它必须很容易进入容器。如果遇到阻力,不要继续推;相反,请拉出管道并重试。
- 推进管道,直到容器外保留 1-2 厘米。拧紧导管周围的缝合材料,并将其打成一个简单的中断结。让助手松开并移除血管束缚。
- 将 2-0 不可吸收的缝合线缠绕在微型泵体上数次并系紧,使缝合线牢固地固定在泵上。然后,用一个简单的中断结将泵固定在附近的软组织上(图2C,D)。
- 从切口上取下牵开器。在标准的三层简单连续闭合中闭合切口。
- 在恢复期间皮下注射 0.2 mg/kg 美洛昔康。
- 经皮经心内膜注射
- 将动物置于背卧位,前肢和后肢伸展,并用系带固定。
- 无菌准备动物的尾腹和大腿内侧。用开窗股动脉造影悬垂悬垂(见 材料表)悬垂动物。
- 按照产品规格设置电解剖映射系统布线和贴片(参见 材料表)。
- 使用线性超声探头识别股动脉。在超声引导下,用煮针刺穿股动脉, 并通过 针将 0.035 英寸的导丝穿入血管。在电线上取下针头。
- 将 8 Fr 动脉鞘和导引器穿在动脉导线上并推入,直到只有轮毂暴露在皮肤上。确保电线始终可见,从护套的轮毂中露出。
注意:由于这是一个较大的护套,有时可能需要 11 号手术刀来创建一个小的皮肤切口以方便通过。 - 拆下护套导引器和电线。静脉注射肝素(100-200 U/kg)。
- 通过鞘引入经心内膜注射导管, 并通过 逆行主动脉入路进入左心室。
- 通过轻轻拖动导管穿过心内膜表面,创建左心室的电解剖图。进行轴向旋转和轻轻改变尖端屈曲,以实现良好的心内膜接触。通过标准电压截止来识别疤痕、边界和偏远区域。
- 在透视和电解剖引导下将导管引导至首选注射位置。通过远端尖端的偏转进行轻柔的轴向旋转,以接合并保持稳定的心内膜接触。
- 用至少两个透视图确认导管尖端的位置。轻轻推进核心导管,然后将针头延伸至受控的心肌内深度(心尖注射 3.5 mm,鼻中隔注射 5 mm)。
- 通过注射导管冲洗 4-6 mL 碘造影剂(参见 材料表),直到透视可见。观察接下来10-30秒的对比度,以确保它留在组织中(图3A)。
- 在延长针头和注射期间密切观察心电图,因为室性异位很常见。
注意:心室异位是指针尖与心肌接触。 - 如果造影剂注射成功,则随后注射目标药物。用造影剂冲洗,直到透视观察。
注意:感兴趣的药物特定于用户,具体取决于他们正在测试的疗法。 - 缩回针头。从动脉鞘中取出注射导管。
- 取出动脉鞘,对部位施加压力长达20分钟,直至止血。
6.全身麻醉恢复
- 关闭正在使用的吸入麻醉剂或静脉麻醉泵。将呼吸机的呼吸频率降低到 8-10 次/分钟。
- 2-5 分钟后,将呼吸机切换到"自由呼吸"模式,一次不超过 30 秒。观察动物和二氧化碳图的自主呼吸。
- 如果发生自主呼吸,请关闭呼吸机。如果动物呼吸暂停,请再打开呼吸机 1-2 分钟,然后重试,直到实现自主呼吸。
注意:恢复的时间范围因程序和动物特征而异,但可能从 15 分钟到 1 小时不等。 - 一旦动物呼吸舒适(呼吸频率为 15-30 次/分钟,呼气末二氧化碳低于 60,SpO2 高于 95%),断开氧气,让其他监测连接。
- 切除血管通路的临时部位并施加压力以防止血肿形成。如果动物保持稳定并在接下来的 5 分钟内继续充氧,则可以将其运送到其恢复区。
- 连续三次自发吞咽后,给气管插管的袖带放气,轻轻取出插管。
- 再观察动物至少 5 分钟,以确保它们继续适当地充氧并且不会遇到任何呼吸窘迫。如果动物在拔管后去饱和,应根据需要使用流氧。
结果
开胸手术和心外膜细胞注射
在接受开胸手术和心外膜注射的 29 只动物中,有 26 只幸存下来。组织学分析证实了通过这种方法在所有幸存动物中递送的人类细胞的植入(图1E)。一只动物在细胞注射过程中经历了致命的心律失常,无法复苏。另一名患者在闭合期间经历了无脉电活动,并长时间对气道施加正压,无法恢复。第三只动物在拔管时呕吐并呼吸停止。这只动物无法复苏。
两只动物经历了严重的并发症,但能够康复。一只动物在心肌注射过程中出现心室颤动,能够通过内部除颤拨片和心脏按摩进行复苏。第二只动物在拔管时呕吐,并有短暂的呼吸停止,但能够迅速重新插管并恢复良好。所有这些事件都发生在早期实验期间,随着团队使用方案经验的增加,不良事件减少(表1)。
颈静脉渗透压微型泵植入术
没有报告的死亡或主要并发症与颈静脉渗透压小泵植入术相关。7只动物中的大多数在前24小时内手术部位出现轻度肿胀,无需干预即可消退。在泵植入后第 3 天对血清进行的 ELISA 证明了泵的功效,与对照组相比,实现了血小板衍生生长因子-AB 人 (PDGF-AB) 的显着血药浓度7 (图 2E)。
经皮经心内膜注射
共有22只动物接受了心内膜注射。在这些注射中,有17次被认为是"成功的",这是通过死后在目标组织中观察到的荧光或墨水染色来确定的(图3B)。没有与该手术相关的死亡。一只动物因右心室穿孔而出现少量心包积液。这是自限性的,不会导致心血管损害。这只动物确实死了;然而,这是来自心肌内注射后不相关的附加程序。
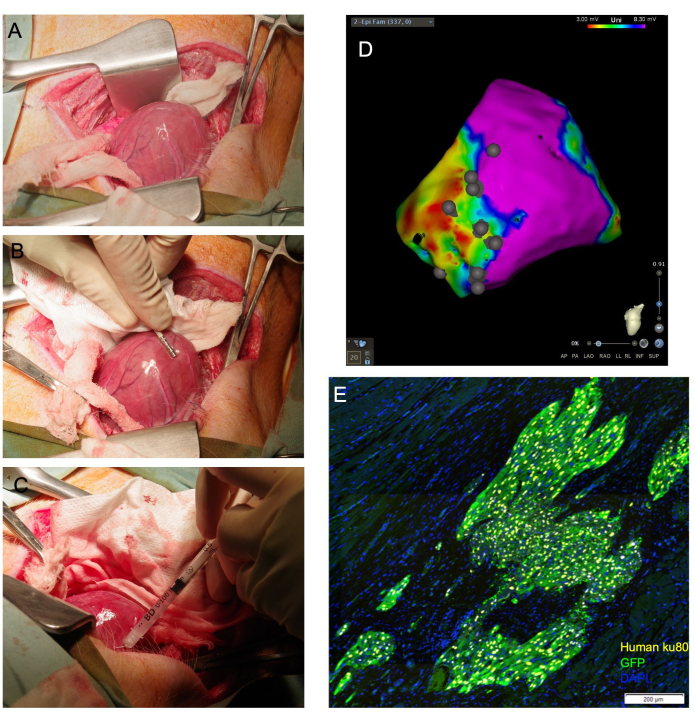
图 1:经心外膜心肌细胞注射可实现直接心脏可视化,并实现高比例的活细胞输送到心肌。 (A) 心脏顶点通过在心脏底部下方引导的湿纱布吊带暴露。(B) 心外膜标测导管划定疤痕和边界区域,并注释注射部位。(C) 使用 31 G 针头经心外膜将细胞注射到心肌中。(D) 带有注射部位注释的心外膜电压图。紫色:电压正常,心肌健康;红色:电压异常,心肌病变;灰点:注射部位。处死后,收集心脏并用福尔马林固定,用于下游组织学评估。在(E)中,通过对人抗核抗体Ku80和抗GFP抗体进行免疫染色来检测移植的人细胞。比例尺 = 200 μm. 请点击这里查看此图的较大版本.
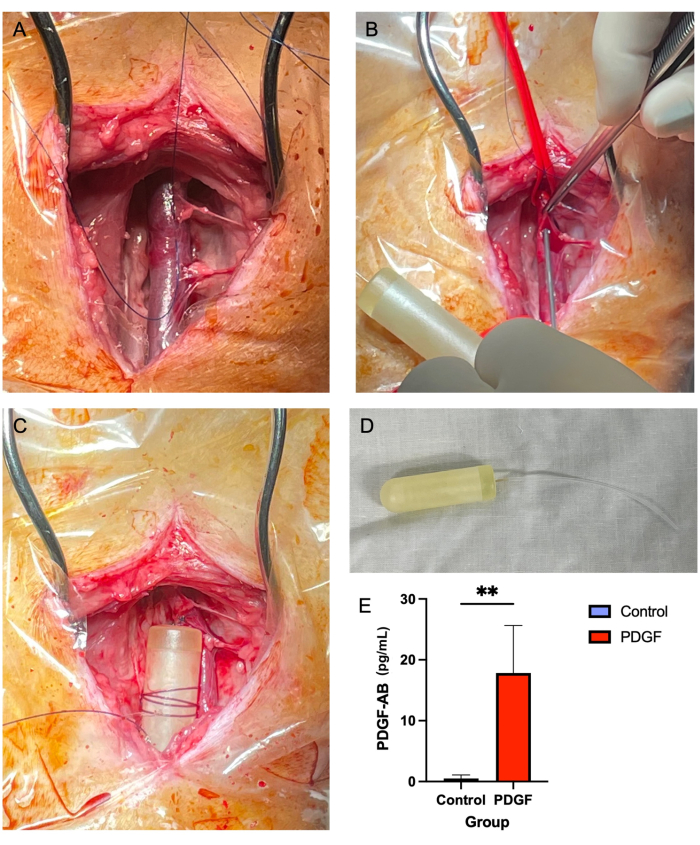
图 2:颈静脉微型泵置入提供了一种安全可靠的 PDGF 方法,可在 7 天内 输送。 (A) 暴露右颈静脉,软组织从血管中清除。(B) 血管系带闭塞血管,同时使用 14 G 针头进行穿刺,微型泵管穿过该穿刺。(C) 将微型泵管推进到静脉中,并将微型泵体固定在相邻的软组织上。(D) 植入前的微型泵体和管道。(E) 在植入后第 3 天使用 ELISA 测量每只动物通过微型泵和 PDGF-AB 递送 的重组蛋白的血清浓度。接受PDGF-AB的动物被证明具有明显高于对照动物的PDGF-AB血液浓度,证实了渗透性微型泵给药方法的有效性。**表示组间差异有统计学意义 (p = 0.005, Mann-Whitney U 检验) 请点击这里查看此图的较大版本.
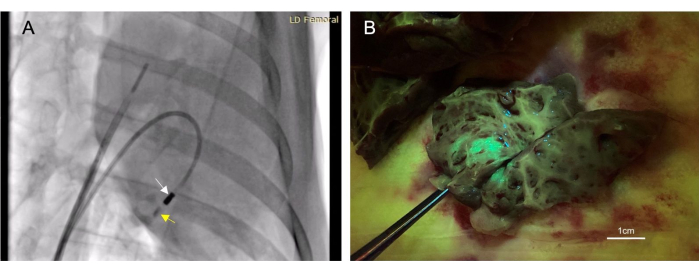
图 3:经心内膜心肌内注射允许采用微创治疗给药方法。 (A) 右前斜透视图像显示注射导管(白色箭头)将造影剂(黄色箭头)注入心肌。造影剂注射在治疗性注射之前和之后,因此可以确认针头在心肌内的位置。(B)注射的载体表达绿色荧光蛋白(GFP),使注射的材料在组织收集时发出荧光,从而确认注射成功。 请点击这里查看此图的较大版本.
| 经外膜注射 (n = 29) | 经心内膜注射 (n = 22) | 渗透压微型泵 (n = 7) | |
| 死亡率 | 3 | 0 | 0 |
| 术后呕吐和呼吸停止 | 1 | 0 | 0 |
| 注射期间的心室颤动 | 1 | 0 | 0 |
| 胸部闭合期间的无脉电活动 | 1 | 0 | 0 |
| 发病率 | 0 | 1 | 0 |
| 气胸 | 0 | 0 | 0 |
| 胸腔积液 | 0 | 0 | 0 |
| 心腔穿孔 | 0 | 1 | 0 |
| 出血 | 0 | 0 | 0 |
表 1:并发症列表。
讨论
经心外膜心内肌注射
该手术具有直接心脏可视化的优点,并且已被证明比全身给药方法提供更大的局部治疗保留 9,10,14。然而,开胸手术是侵入性的,需要相当多的技术技能,并且比所讨论的其他方法具有更大的发病率和死亡风险10,15。了解手术的关键和不稳定阶段有助于调解这种增加的风险。
由于心律失常和相关血流动力学损害的高风险,在操作心脏以暴露心尖时必须格外小心。持续有创血压监测和心电图可以快速识别低血压或不稳定的心律失常,便于及时干预和纠正。一过性低血压通常可以用间羟胺推注治疗。持续性低血压可以通过减少吸入麻醉剂(仔细监测麻醉深度)和开始输注血管加压药来暂时缓解,同时确定血流动力学改变的原因。不稳定型心律失常,如室性心动过速或心室颤动,可通过心脏电复律联合或不联合静脉抗心律失常药进行治疗。
对于动物的生存同样重要的是,在关闭胸部之前,成功地从胸膜腔中清除游离气体。如果不这样做,最终会导致气胸,一旦在恢复时与机械呼吸机断开连接,动物就会面临呼吸功能受损和死亡的巨大风险。气道正压通气必须保持至少 30 秒,直到不再观察到气泡。在冒泡停止后立即取出硅胶管,然后迅速关闭胸部。也可以在闭合时通过手术放置胸腔引流管,允许在接下来的 24-72 小时内手动清除空气和炎症性液体。然而,这很难保持清洁和完好无损,特别是如果动物被关在一起。导管损坏或污染可导致脓胸、气胸或脓毒症。根据我们的经验,如果在胸腔闭合前充分清除游离气体,则不需要插入临时胸腔引流管。
经皮经心内膜心内注射
与手术方法相比,这种治疗给药方法的优点是允许局部组织递送,风险较低,因为它的侵入性较小10,14。该技术已经用于大型动物研究,在没有直接可视化的情况下,透视和机电映射作为指导10,16,17。
鉴于心脏没有直接视野,手术医师在选择注射部位时应谨慎使用正交透视视图。此外,在治疗之前注射稀释的碘造影剂和递送治疗剂对于确认心肌接触极为有价值。适当的接触可以通过观察特征性的"心肌腮红"来确认,这可能是组织收获前注射成功的唯一标志之一。由于腔室穿孔的风险,所选注射部位的心肌壁厚度也建议大于 9 mm14,16。
颈静脉渗透压微型泵
渗透微型泵是小动物研究中常用的一种常用设备。人们对在大型动物模型中使用该装置的兴趣越来越大 7,18,19,因为它具有在设定时间段内以一致速率施用治疗剂的独特优势。这种方法的一个可能的局限性是无法在不更换或移除泵的情况下改变或停止药物的输注速率。在以这种方式尝试治疗之前,应考虑这一点。
本研究表明,该方法可以在猪中以高成功率进行,发病率和死亡率低。必须注意的是,许多重要结构都与手术部位相邻,包括淋巴结、胸腺和颈动脉。强烈建议遵守该方法并查阅解剖学文本20,以防止对任何这些结构的无意损坏。这种方法最令人担忧的并发症是由于颈静脉或周围结构的意外损伤而导致的失血性休克。因此,小心切除颈静脉周围的软组织至关重要。未能正确完成此步骤可能会导致难以放置微型泵管或控制意外出血。
本文介绍了三种提供心脏活性治疗的方法。尽管据报道每种技术都取得了成功,但仍有固有的局限性需要考虑。侵入性操作(经心外膜注射)可提高治疗递送的准确性;然而,它们带来了更大的潜在致命并发症的风险。此外,侵入性分娩对技术技能的要求更高,以最大限度地降低并发症的风险。同样,透视引导下经心内膜注射需要一定程度的导管插入术和硬件操作技术技能。如果这种方法执行不当,可能会导致注射失败和致命的并发症。
所描述的直接注射方法允许将治疗剂一次性施用到靶组织中。颈静脉渗透压微型泵允许在 7 天内全身给药治疗。相比之下,这种方法更简单,风险更小,但是,它依赖于全身治疗找到进入心肌的途径。此外,一旦泵就位,如果不重新麻醉动物并移除泵,就不可能停止给药或改变剂量率。
本文中描述的所有方法均在心肌梗死后一天或2周内在动物身上进行。因此,这项工作不能报告上述方法在健康动物或遭受替代心脏病理学的动物中的成功。最后,应仔细考虑任何预期药物的药理学和生物技术,因为这将与所选给药途径的疗效有内在的联系。对此的详细讨论超出了本手稿的范围。
对临床前方法的全面描述有利于动物福利和更广泛的科学界。由此增强的程序和结果的可重复性导致更少的动物健康并发症,减少产生显着结果所需的动物数量,并提高实验结果的信心21,22。本文描述了三种用于治疗猪模型心肌梗死的新疗法的给药方法。通过详细说明所使用的技术并阐明每种技术的益处和风险,预计研究人员将能够轻松创建适合其研究目标的一致且可靠的临床前模型。
披露声明
作者没有什么可透露的。
致谢
这项工作由国家健康与医学研究委员会APP1194139/APP1126276(JC),澳大利亚国家干细胞基金会和新南威尔士州政府健康与医学研究办公室(JC)资助。唐氏综合征得到了澳大利亚皇家内科医学院、临床病理学和医学研究所以及澳大利亚政府研究培训计划的支持。TD得到了临床病理学和医学研究所、奔富家庭奖学金、国家健康与医学研究委员会(APP2002783)和澳大利亚国家心脏基金会(104615)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
参考文献
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39(2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483(2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. Veterinary Sutures Handbook. , Editorial Servet. (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392(2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897(2016).
- Singh, B., Dyce, K. M. Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , Saunders. St. Louis, Missouri. (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411(2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。