Method Article
Verabreichung kardioaktiver Therapeutika in einem Schweine-Myokardinfarkt-Modell
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt drei Methoden zur Verabreichung kardioaktiver Therapeutika in einem Schweinemodell. Weibliche Landrassenschweine erhielten die Behandlung entweder: (1) Thorakotomie und transepikardiale Injektion, (2) kathetergestützte transendokardiale Injektion oder (3) intravenöse Infusion über die osmotische Minipumpe der Jugularvene.
Zusammenfassung
Myokardinfarkt ist weltweit eine der häufigsten Todes- und Invaliditätsursachen, und es besteht ein dringender Bedarf an neuartigen kardioprotektiven oder regenerativen Strategien. Ein wesentlicher Bestandteil der Arzneimittelentwicklung ist die Bestimmung, wie ein neuartiges Therapeutikum verabreicht werden soll. Physiologisch relevante Großtiermodelle sind von entscheidender Bedeutung für die Beurteilung der Durchführbarkeit und Wirksamkeit verschiedener therapeutischer Verabreichungsstrategien. Aufgrund ihrer Ähnlichkeiten mit dem Menschen in Bezug auf die kardiovaskuläre Physiologie, die koronare Gefäßanatomie und das Verhältnis von Herzgewicht zu Körpergewicht ist das Schwein eine der bevorzugten Spezies bei der präklinischen Bewertung neuer Therapien für Myokardinfarkt. Das vorliegende Protokoll beschreibt drei Methoden zur Verabreichung kardioaktiver Therapeutika in einem Schweinemodell. Nach einem perkutan induzierten Myokardinfarkt erhielten weibliche Landrassen eine Behandlung mit neuartigen Wirkstoffen durch (1) Thorakotomie und transepikardiale Injektion, (2) katheterbasierte transendokardiale Injektion oder (3) intravenöse Infusion über eine osmotische Minipumpe der Halsvene. Die für jede Technik verwendeten Verfahren sind reproduzierbar, was zu einer zuverlässigen kardioaktiven Wirkstoffabgabe führt. Diese Modelle können leicht an individuelle Studiendesigns angepasst werden, und jede dieser Verabreichungstechniken kann verwendet werden, um eine Vielzahl möglicher Interventionen zu untersuchen. Daher sind diese Methoden ein nützliches Werkzeug für translationale Wissenschaftler, die neue biologische Ansätze zur Herzreparatur nach Myokardinfarkt verfolgen.
Einleitung
Die koronare Herzkrankheit (KHK) und der damit verbundene ST-Hebungs-Myokardinfarkt (STEMI) sind weltweit die häufigsten Todesursachen. In den letzten zwei Jahrzehnten wurden große Fortschritte bei der Senkung der Krankenhaussterblichkeit von Patienten mit STEMI erzielt, und zwar durch das Aufkommen perkutaner Koronarinterventionen, fibrinolytischer Therapien und der Standardisierung von Behandlungsalgorithmen, um sicherzustellen, dass die Reperfusion rechtzeitig erreicht wird 1,2,3. Trotzdem stellt die mit STEMI verbundene Morbidität nach wie vor eine erhebliche Belastung dar, so dass ein großer Bedarf an der Entwicklung neuartiger kardioprotektiver und regenerativer Therapien besteht 2,3. Ein wesentlicher Bestandteil der Therapieentwicklung ist die Festlegung der Art und Weise, wie eine neuartige Therapie verabreicht werden soll4. Die Sicherheit, Wirksamkeit und Durchführbarkeit jeder Methode muss mit den Eigenschaften der Therapie selbst in Einklang gebracht werden.
Physiologisch relevante Großtiermodelle sind entscheidend für die Beurteilung dieser Eigenschaften verschiedener therapeutischer Verabreichungsstrategien5. Aufgrund ihrer Ähnlichkeiten mit dem Menschen in Bezug auf die kardiovaskuläre Physiologie, die koronare Gefäßanatomie und das Verhältnis von Herzgewicht zu Körpergewicht ist das Schwein eine der bevorzugten Spezies bei der präklinischen Bewertung neuer Therapien für Myokardinfarkt6. Wir haben zuvor ein porcines STEMI-Modell verwendet, um die reparative Kapazität einer rekombinanten Proteintherapie zu demonstrieren7, und untersuchen weiterhin neuartige pharmakologische, zelluläre und genetische Therapien mit diesem Modell. Hier werden drei Techniken der therapeutischen Verabreichung beschrieben, die in Schweinemodellen nach Infarktentstehung verwendet werden: Thorakotomie und transepikardiale Injektion, perkutane transendokardiale Injektion und jugularvenöse osmotische Minipumpenimplantation. Die ersten beiden Methoden ermöglichen eine lokale Gewebeabgabe, wodurch die erforderlichen Dosierungen, Off-Target-Effekte und der hepatische First-Pass-Metabolismus reduziertwerden 8,9,10. Die osmotische Minipumpe ermöglicht die kontinuierliche Verabreichung eines Medikaments mit einer kurzen Halbwertszeit, wodurch die Abhängigkeit von einer Infusionspumpe und einer patentierten intravenösen Kanüle entfällt, die beide in großen Tiermodellen schwierig zu implementieren sind.
Durch die Beschreibung dieser Techniken hofft man, dass dieser Artikel translationalen Wissenschaftlern helfen kann, neuartige kardioprotektive oder regenerative Wirkstoffe nach Myokardinfarkt in Großtiermodellen zu untersuchen.
Protokoll
Alle Versuche wurden nach dem "australischen Kodex für die Pflege und Verwendung von Tieren für wissenschaftliche Zwecke" durchgeführt und von der Tierethikkommission des Western Sydney Local Health District genehmigt. Für die vorliegende Studie wurden vorpubertäre große weiße Jungsauen mit einem Gewicht von 18-20 kg verwendet.
1. Tierhaltung
- Unterbringung der Tiere gemäß den Vorschriften der örtlichen Tierethikkommission.
HINWEIS: Die in diesem Protokoll enthaltenen Tiere werden einzeln untergebracht, um Kämpfe und Verletzungen zu vermeiden und sicherzustellen, dass es keine Konkurrenz um Futter gibt. Alle Tiere konnten jedoch Artgenossen sehen, hören und riechen. Ihre Ställe haben einen Betonboden, um die Reinigung zu erleichtern, und haben sowohl einen geschützten Innen- als auch einen Außenbereich. Die Schweine werden im Innenbereich mit Stroheinstreu und im Außenbereich mit "Spielzeug" zur Anreicherung versorgt.
2. Sedierung und Vollnarkose
- Beruhigung
- Stellen Sie sicher, dass das Tier mindestens 12 Stunden lang nüchtern war, bevor Sie mit einer starken Sedierung oder Vollnarkose beginnen.
- Wenn das Tier noch keinen Gefäßzugang in Form eines zentralen Zugangs hat, verwenden Sie ein intramuskuläres Beruhigungsprotokoll.
- Die intramuskuläre Sedierung besteht aus 8 mg/kg Ketamin, 0,3 mg/kg Midazolam, 0,2 mg/kg Methadon und 10 μg/kg Medetomidin (siehe Materialtabelle). Verabreichen Sie diese Mischung mit einer 21-G-Nadel in die epaxiale Muskulatur des Tieres. Im Durchschnitt brauchen die Tiere 5-10 Minuten, um stark sediert zu werden.
HINWEIS: Ein gestresstes Schwein ist resistenter gegen Sedierung; Stellen Sie sicher, dass ein ruhiger und sicherer Hundeführer das Tier sediert und dass das Tier nicht übermäßig gestresst wird. Wenn das Tier gestresst ist, lassen Sie es am besten 5-10 Minuten in Ruhe und versuchen es erneut. - Führen Sie eine intravenöse Sedierung durch, wenn ein zentraler Zugang vorhanden und offen ist. Die intravenöse Sedierung besteht aus 2 mg/kg Ketamin, 0,2 mg/kg Midazolam, 0,2 mg/kg Methadon und 2 μg/kg Medetomidin.
- Spülen Sie zuerst den intravenösen Zugang mit 0,9 % Natriumchlorid, um die Durchgängigkeit sicherzustellen. Schieben Sie dann langsam die Hälfte der gemischten Spritze durch die Leitung und spülen Sie mit 0,9 % Natriumchlorid.
- Beobachten Sie das Tier, das innerhalb von 20-30 s stark sediert werden muss. Wenn das Tier noch nicht sediert ist, spülen Sie die verbleibende Hälfte der Spritze wie in Schritt 2.1.5 beschrieben aus.
- Gefäßzugang
- Sobald das Schwein entsprechend sediert ist, wird es in den Operationssaal transportiert.
- Das Schwein wird mit einer Gesichtsmaske und einer Sauerstoffdurchflussrate von 5 l/min mit Sauerstoff angereichert. Schließen Sie ein Pulsoximeter an den Schwanz, die Ohren oder die Zunge des Schweins an, um das Tier durchgehend zu überwachen.
- Verschaffen Sie sich mit einer 22- oder 24-G-Kanüle Zugang zur linken und rechten Randvene des Ohrs und sichern Sie sie mit Klebeband.
- Allgemeinanästhesie
- Positionieren Sie das Schwein in Brustbeinlage.
- Verabreichen Sie 1-3 mg/kg Propofol (siehe Materialtabelle) intravenös als langsamen Schub, der bis zur Wirkung titriert wird. Lassen Sie einen Assistenten das Maul des Tieres offen halten (der Kiefer sollte in diesem Stadium schlaff sein) und strecken Sie den Hals aus.
- Verwenden Sie ein Laryngoskop (siehe Materialtabelle), um den Zungengrund zu drücken, und Epiglottis, um die Arytenoidknorpel des Kehlkopfes freizulegen.
- Führen Sie einen geschmierten Endotrachealtubus (Größe 5,5 oder 6,0; siehe Materialtabelle) mit einem Mandrin durch die Arytenoidknorpel in die Luftröhre. Gelegentlich kann ein Widerstand beim Passieren des Kehlkopfes zu spüren sein; Dem kann durch eine sanfte Rotation des Endotrachealtubus entgegengewirkt werden. Wenn sich das Tier der Intubation widersetzt, verabreichen Sie mehr Propofol intravenös.
- Entferne das Mandrin aus dem Endotrachealtubus. Blasen Sie die Manschette des Endotrachealtubus auf, bis Sie sicher sind, dass keine Luft um den Schlauch herum austritt. Im Allgemeinen werden 4-6 ml Luft benötigt, wobei das Volumen je nach Röhrchengröße und Tier variieren kann.
- Befestigen Sie den Endotrachealtubus hinter den Ohren des Tieres.
- Schließen Sie das Tier an einen Anästhesiekreislauf mit einer Beatmungsfunktion an. Wenn das Tier angeschlossen ist, schalten Sie das Beatmungsgerät aus.
HINWEIS: Stellen Sie sicher, dass das einstellbare Druckbegrenzungsventil (APL) oder "Pop-Off-Ventil" jederzeit geöffnet ist. Wenn das Ventil nicht geöffnet bleibt, kann dies zu einem tödlichen Barotrauma des Tieres führen. - Reduzieren Sie die Sauerstoffdurchflussrate des Anästhesiekreislaufs auf 2 l/min.
- Stellen Sie den Überdruckventilator in den Modus "Lautstärkeregelung". Stellen Sie das Atemzugvolumen auf 10 ml/kg und die Atemfrequenz auf 20 Atemzüge/min ein. Stellen Sie sicher, dass das Verhältnis von Inspiration zu Exspirator auf 1:2 eingestellt ist.
- Manipulieren Sie während des gesamten Eingriffs die Atemfrequenz, um sicherzustellen, dass das endtidale Kohlendioxid zwischen 35 und 50 mmHg liegt.
HINWEIS: Der inspiratorische Druck darf 20 cmH2O nicht überschreiten. Ein Anstieg des inspiratorischen Drucks veranlasst eine Untersuchung auf Knicke oder Verstopfungen der Schläuche. Um erhöhte Drücke zu lindern, die nicht mit Schläuchen verbunden sind, kann das Verhältnis von Inspiration zu Exspirator auf 1:1,5 reduziert und das Atemzugvolumen reduziert werden. - Wenn das Tier hämodynamisch stabil ist, halten Sie es mit einer Inhalationsnarkose aufrecht. Wenn das Tier nicht hämodynamisch stabil ist, halten Sie es unter intravenöser Vollnarkose, wie in Schritt 2.3.14 beschrieben.
- Wenn dem Tier eine Inhalationsanästhesie verabreicht werden soll, beginnen Sie mit 2,5 % Isofluran ab dem Zeitpunkt, an dem der Anästhesiekreislauf zum ersten Mal angeschlossen wird.
- Während der nächsten 30 Minuten wird das Tier schrittweise von 1,5 % inhaliertem Isofluran entwöhnt. Halten Sie das Tier bis zum Ende des Eingriffs bei 1,5% Isofluran.
- Beurteilen Sie die Narkosetiefe alle 10 Minuten, indem Sie die Lidreflexe überprüfen und den Kiefertonus testen. Passen Sie das Isofluran nach Bedarf an, um die Narkosetiefe aufrechtzuerhalten.
- Wenn das Tier hämodynamisch instabil ist, halten Sie es mit einer vollständigen intravenösen Anästhesie aufrecht, um eine größere Kontrolle der Narkosetiefe ohne die kardiovaskulären Komplikationen zu ermöglichen, die mit inhalativen Anästhetika verbunden sind.
- Bereiten Sie entweder Spritzenpumpen oder Standardflüssigkeitspumpen mit Propofol, Fentanyl und Midazolam vor. Verbinden Sie diese über eine gemeinsame Leitung mit dem Tier.
HINWEIS: Propofol kann mit 0,1-0,6 mg/kg/min, Fentanyl mit 1-5 μg/kg/h und Midazolam mit 0,05-0,2 mg/kg/h betrieben werden. - Wie bei der Inhalationsanästhesie titrieren Sie diese Medikamente, um während der gesamten Anästhesie zu wirken, um eine angemessene Anästhesietiefe aufrechtzuerhalten.
- Bereiten Sie entweder Spritzenpumpen oder Standardflüssigkeitspumpen mit Propofol, Fentanyl und Midazolam vor. Verbinden Sie diese über eine gemeinsame Leitung mit dem Tier.
- Intravenöse Flüssigkeitsunterstützung mit 0,9%iger Natriumchlorid- oder Hartmann-Lösung (siehe Materialtabelle) in einer Rate von 5 ml/kg/h.
- Überwachen Sie das Tier mit Blutdruckmessungen, Kapnographie, Narkosegasüberwachung, Temperatur, Pulsoximetrie und Elektrokardiographie.
- Verabreichen Sie während des gesamten Eingriffs eine zusätzliche Analgesie in Form von 0,2 mg/kg Methadon intravenös alle 4 Stunden nach der Prämedikation.
HINWEIS: Die Analgesie kann in kürzeren Abständen verabreicht werden, wenn das Tier während der Narkose Anzeichen von Schmerzen zeigt (Tachykardie, leichtere Narkosetiefe ohne Änderungen der Erhaltungsmedikamente).
3. Zentrale Linienplatzierung
- Positionieren Sie das Schwein in Rückenlage mit ausgestreckten Hintergliedmaßen, ausgestreckter linker Vordergliedmaße und gebeugter rechter Vordergliedmaße und gesichert mit einer Krawatte.
- Den Schweinehals aseptisch vorbereiten und mit einem Tuch abdecken.
- Verwenden Sie eine lineare Ultraschallsonde (siehe Materialtabelle) mit einer sterilen Abdeckung, um die rechte Halsvene zu lokalisieren. Dies gelingt am besten, wenn die Sonde senkrecht zur Luftröhre ausgerichtet ist und langsam seitlich vom Kehlkopf aus bewegt wird.
- Aktivieren Sie den Farbdoppler-Modus, um die Halsvene zu identifizieren. Die Vena jugularis kann von der Arteria carotis unterschieden werden, indem sie Kollapsibilität und einen kontinuierlichen, nicht pulsierenden Fluss zeigt.
- Verwenden Sie eine 18 g Kochnadel (siehe Materialtabelle), um die Vene unter Ultraschallkontrolle zu erreichen. Sobald der Zugang erreicht ist, führen Sie einen 0,035-Zoll-J-Tip-Draht (siehe Materialtabelle) durch die Nadel und fädeln Sie ihn in das Gefäß ein. Entfernen Sie die Nadel über den Draht.
- Fädeln Sie eine vorgespülte Mittellinie über den Draht und schieben Sie sie in die Vene durch. Stellen Sie sicher, dass der Draht immer sichtbar ist, der aus dem distalen Ende der Leitung heraustritt.
HINWEIS: Ein zentraler Venenkatheter mit 5 Fr und zwei Lumen (siehe Materialtabelle) wurde für Patienten verwendet, die über einen Zeitraum von 1-4 Wochen einen intravenösen Zugang benötigten. - Wenn es Schwierigkeiten gibt, die Linie durch die Haut zu führen, verwenden Sie ein Skalpell Nr. 11, um einen kleinen, 2-4 mm langen Schnitt zu machen, um den Durchgang der Linie über den Draht zu erleichtern. Wenden Sie Unterdruck an, gefolgt von einer Spülung auf jede externe Leitung, um die Durchgängigkeit zu gewährleisten. Klemmen Sie jede Zeile ab.
- Befestigen Sie die mitgelieferten Anker an den Außenleinen und fixieren Sie sie mit 2-0 oder 3-0 nicht auflösbaren Nähten (siehe Materialtabelle). Legen Sie zusätzliche Nähte an, um die äußeren Linien dorsal zu fixieren, um zu vermeiden, dass das Tier darauf kaut.
- Befestigen Sie die gespülten Verlängerungsschläuche an den externen Katheterleitungen und klemmen Sie sie ab.
- Statten Sie das Tier mit einem handelsüblichen Schweinemantel aus (siehe Materialtabelle) und befestigen Sie die Leinen darin. Wenn während der gleichen Narkose noch andere Eingriffe durchgeführt werden müssen, passen Sie die Jacke kurz vor der Genesung des Tieres an.
4. Myokardinfarkt
HINWEIS: Tiere, die in diesem Modell verwendet wurden, erlitten einen Myokardinfarkt nach einer zuvor veröffentlichten Methode7.
- Myokardinfarkt 2 Wochen vor transepikardialen und transendokardialen Injektionsverfahren durchführen 8,9,10. Die osmotische Minipumpenimplantation wurde unmittelbar nach der koronaren Reperfusion im Rahmen des gleichen Verfahrens durchgeführt.
5. Verabreichung von Medikamenten oder Zellen
- Thorakotomie und Epikardzellinjektion
- Verabreichen Sie intravenös prophylaktische Antibiotika in Form von 22 mg/kg Cefazolin (siehe Materialtabelle). Fahren Sie während des gesamten Verfahrens alle 90 Minuten fort.
- Positionieren Sie das Tier in der rechten seitlichen Liegeposition.
- Tragen Sie ein 100 μg/h Fentanyl-Pflaster (siehe Materialtabelle) auf die flache Ebene hinter den Schweineohren auf. Mit einem Klebeverband oder einer 2-0-Naht abdecken.
HINWEIS: Dieses Pflaster gilt 12 Stunden nach dem Einsetzen als "aktiv" und bietet 72 Stunden lang Analgesie. - Richten Sie die Verkabelung und die Patches des elektroanatomischen Mapping-Systems gemäß den Produktspezifikationen ein (siehe Materialtabelle).
- Markieren Sie eine 10 cm lange horizontale Linie zwischen den Rippen 4 und 5 mit einem Buntstift oder chirurgischen Marker auf dem Tier.
- Bereiten Sie eine Mischung aus Lidocain (2 mg/kg) und Bupivacain (1 mg/kg) in einer einzigen Spritze mit einer 25-G-Nadel zu.
- Bereiten Sie die Operationsstelle aseptisch vor und drapieren Sie das Tier. Führen Sie eine Hautlinienblockade an der markierten Inzisionsstelle durch, indem Sie die Nadel in einem flachen Winkel in die Haut einführen, den Kolben leicht zurückziehen, um sicherzustellen, dass kein Blut in die Spritze zurückfließt, und die Lösung langsam injizieren, wenn die Nadel aus der Haut gezogen wird. Wiederholen Sie diesen Vorgang, während Sie sich in der Linie nach unten bewegen.
HINWEIS: An jeder neuen Injektionsstelle muss Unterdruck auf die Spritze ausgeübt werden, um sicherzustellen, dass Bupivacain nicht intravaskulär verabreicht wird. Intravaskuläres Bupivacain kann schnell tödlich sein. - Machen Sie mit einem Skalpell Nr. 22 einen 10 cm langen Hautschnitt entlang der markierten Linie.
- Mit monopolarem Kauter (siehe Materialtabelle) wird der Schnitt durch die darunter liegenden Muskelschichten vertieft, bis die Zwischenrippenmuskulatur erreicht ist.
- Bereiten Sie eine sterile Spritze mit 0,5 mg/kg Bupivacain und 1 mg/kg Lignocain vor und bringen Sie eine 25-g-Nadel an.
- Stechen Sie die Nadel in einem flachen Winkel am kaudalen Rand der vierten Rippe ein. Üben Sie Unterdruck auf den Kolben aus, um sicherzustellen, dass die Nadel nicht durch die Interkostalvene oder -arterie geführt wurde. Injizieren Sie langsam ein Viertel des Spritzenvolumens, während Sie die Nadel stationär halten.
- Wiederholen Sie Schritt 5.1.12 an drei weiteren Stellen im Abstand von 3-5 cm entlang des kaudalen Randes der vierten Rippe.
- Verwenden Sie eine Metzenbaum-Schere (siehe Materialtabelle), um die Zwischenrippenmuskulatur vorsichtig zu schneiden, und schneiden Sie dann das Rippenfell nach Absprache mit dem Anästhesisten.
- Wenn das Rippenfell eingeschnitten ist, schalten Sie das Beatmungsgerät aus, damit die Lunge vom Rippenfell abfallen kann. Schalten Sie nach dem Einschnitt das Beatmungsgerät wieder ein und stellen Sie den positiven endexspiratorischen Druck auf 4 cmH2O ein.
- Platzieren Sie selbsthaltende Rippenaufroller zwischen den Rippen und öffnen Sie sie langsam, um das Herz freizulegen. Fassen Sie den Herzbeutel vorsichtig mit einer Gewebezange an und schneiden Sie ihn mit einer Metzenbaum-Schere ein, damit das Herz nach außen geführt werden kann.
HINWEIS: Während dieses Schritts und der nächsten Schritte treten häufig Herzrhythmusstörungen auf. Das EKG muss engmaschig überwacht werden, und jede Herzmanipulation muss vorübergehend gestoppt werden, wenn das Tier hämodynamisch instabil wird (mittlerer arterieller Druck unter 55 mmHg). Intravenöse Boli von Metaraminol (0,25 mg) sind nach Bedarf zu verabreichen, um den Blutdruck zu verbessern. - Platzieren Sie provisorische 2-0-Stay-Nähte an beiden Enden und Seiten des Perikardschnitts, um ihn an der Brustwand zu befestigen und eine Perikardmulde zu schaffen. Stellen Sie sicher, dass die Seiten des Perikards gestützt werden, um den Perikard so flach wie möglich zu machen.
- Verwenden Sie angefeuchtete Tupfer oder Laparotomieschwämme, um die Herzregion zu verpacken. Dies trägt dazu bei, das Herz stabil zu halten und das Austrocknen von freiliegendem Gewebe zu verhindern.
- Fördern Sie die Herzspitze aus der Perikardhöhle mit einem Zeigefinger hinter der linken Herzkammer. Achten Sie darauf, die linksventrikuläre Kompression zu minimieren.
HINWEIS: Ein gesundes Herz kann bequem schlagen, wenn die Spitze vertikal zeigt und mit sanfter Unterstützung, aber ohne Kompression auf der Basis sitzt. Im Zusammenhang mit der Manipulation kommt es zu einer anfänglichen Senkung des Blutdrucks, die sich jedoch ohne externe ventrikuläre Kompression auf ein akzeptables Niveau erholen muss.- Wenn innerhalb von 15 s keine oder nur eine sehr langsame Erholung eintritt, wird das Herz sofort in die Perikardhöhle zurückgeführt und die notwendigen Schritte zur Verbesserung der hämodynamischen Parameter vor einer weiteren Luxation unternommen.
HINWEIS: Wenn der Ventrikel ausgerenkt werden kann, kann die Position der Spitze außerhalb des Perikards beibehalten werden, indem Mullpackungen in geeigneter Größe in den Perikard gelegt werden, um den Ventrikel zu stützen. Ebenso kann ein länglicher, befeuchteter Tupfer unter der Herzbasis positioniert werden, wo er als "Schlinge" fungiert, die die Herzspitze nach oben in Richtung des Einschnitts führt (Abbildung 1A).
- Wenn innerhalb von 15 s keine oder nur eine sehr langsame Erholung eintritt, wird das Herz sofort in die Perikardhöhle zurückgeführt und die notwendigen Schritte zur Verbesserung der hämodynamischen Parameter vor einer weiteren Luxation unternommen.
- Erstellen Sie eine elektroanatomische Spannungskarte der linksventrikulären Epikardoberfläche mit einem elektrophysiologischen Mapping-Katheter (Abbildung 1B). Identifizieren Sie Narben-, Grenz- und abgelegene Zonen durch Standard-Spannungsabschaltungen.
ANMERKUNG: Die Narbe und die entfernte Zone wurden mit bipolaren Cut-Offs von <0,5 mV bzw. >1,5 mV und unipolaren Cut-Offs von <3 mV bzw. >8,3 mV definiert,11,12. - Biegen Sie die Nadel der 27-G-Spritze für die therapeutische Verabreichung in einem Winkel von etwa 80-90°.
- Schieben Sie die Nadel in einem flachen Winkel in das Zielgewebe und üben Sie Druck auf den Spritzenkolben aus, um 1/4 bis 1/3 des Gesamtvolumens abzugeben. Das Ausbleichen des Gewebes ist zu beobachten (Abbildung 1C). Verwenden Sie den elektrophysiologischen Mapping-Katheter, um die Position der Injektionsstelle auf der generierten epikardialen Spannungskarte zu markieren (Abbildung 1D).
HINWEIS: Fahrzeuginjektionen, die aus dem Zellkulturmedium (RPMI 1640) bestehen, wurden zu Demonstrationszwecken im Videoprotokoll verwendet. - Ziehen Sie die Nadel teilweise zurück und leiten Sie sie innerhalb des Myokards um. Entleeren Sie weitere 1/4 bis 1/3 des Volumens der Spritze. Fahren Sie fort, bis die Spritze leer ist.
- Wiederholen Sie die Schritte 5.1.20-5.1.24, bis die gewünschte Dosis verabreicht wurde.
- Entfernen Sie die Tupfer, die das Herz packen, und entfernen Sie vorsichtig die "Schlinge" unter dem Herzen, damit es in die neutrale Position zurückkehrt. Herzrhythmusstörungen treten bei diesem Schritt häufig auf, und es ist Vorsicht geboten, wie in Schritt 5.1.17 beschrieben.
- Entfernen Sie die 2-0-Stay-Nähte aus dem Herzbeutel. Lösen Sie den Retraktor und entfernen Sie ihn aus dem Thorax.
- Verwenden Sie Polydioxanon-Nahtmaterial (PDS) der Größe 1 mit einer stumpfen, runden Nadel, um den Thorax zu verschließen, indem Sie ihn durch die Zwischenräume zwischen den Rippen 3 und 4 sowie den Rippen 5 und 6 führen.
HINWEIS: Schmale Achternähte bieten einen Flaschenzugeffekt zur Annäherung an die Rippen. Je nach Tiergröße müssen zwei oder drei solcher Nähte verwendet werden. - Vor dem Anziehen und Abbinden der rippenapproximierenden Nähte führen Sie ein kurzes Stück Silikonschlauch in den ventralen Rand des Einschnitts ein.
- Legen Sie das freie Ende des Schlauchs in eine Schüssel mit steriler Kochsalzlösung, um die Pleurahöhle unter Wasser zu entleeren.
- Verschließen Sie die darüber liegenden Muskelschichten in einem einfachen kontinuierlichen Muster mit 2-0 resorbierbaren Nähten. Die Haut wird in einem einfachen durchgehenden oder furten, ineinandergreifenden Muster13 mit einer 2-0 oder 3-0 nicht resorbierbaren Naht verschlossen.
- Wenn der Wundverschluss abgeschlossen ist, wird die freie Luft durch die Überdruckbeatmung aus dem Thorax ausgestoßen.
- Schalten Sie das Beatmungsgerät auf die Einstellung "Freie Atmung". Verwenden Sie den Reservoirbeutel am Rückatmungskreislauf, um einen konstanten Überdruck auf die Atemwege zu übertragen (halten Sie ihn bei 20-30 cmH2O).
- Setzen Sie diesen Druck fort, bis in der Kochsalzschüssel keine Blasbildung mehr zu beobachten ist, was darauf hindeutet, dass keine freie Luft im Thorax vorhanden ist.
- Entferne den Silikonschlauch.
- Legen Sie einen selbstklebenden Verband auf die Operationsstelle und legen Sie verstreute, einfache, unterbrochene Nähte an, um den Verband an Ort und Stelle zu halten.
- Bei der Genesung sind 0,3 mg/kg Methadon subkutan und 0,2-0,5 mg/kg Ondansetron (siehe Materialtabelle) intravenös zu verabreichen.
- Implantation der osmotischen Minipumpe der Jugularvene
- Positionieren Sie das Tier wie in Schritt 3.1 beschrieben. Die rechte Seite des Halses des Tieres aseptisch vorbereiten und drapieren.
- Mit einer Skalpellklinge Nr. 22 einen 8-10 cm langen Schnitt machen, der sich kranial von einem Punkt 2-3 cm seitlich zum Manubrium sterni erstreckt. Dieser Schnitt muss etwas seitlicher werden, da er sich kranial bewegt.
- Verwenden Sie eine Metzenbaum-Schere, um die Muskeln cutaneus colli, sternohyoideus und sternocephalicus zu präparieren. Verwenden Sie stumpfe Dissektionstechniken, um den Schnitt zu vertiefen, bis die äußere Halsvene sichtbar ist.
- Platzieren Sie selbsthaltende Retraktoren in der Inzision und öffnen Sie sie, um die Sicht zu verbessern.
- Entfernen Sie mit einer Adson-Braungewebezange (siehe Materialtabelle) und einer Metzenbaum-Schere das Weichgewebe, das die Halsvene sowohl oben als auch unten umgibt (Abbildung 2A). Dies ist ein entscheidender Schritt, da in späteren Stadien Weichgewebe über dem Gefäß den Durchgang des Minipumpenschlauchs behindern kann.
- Verwenden Sie eine 5-0 resorbierbare Naht durch das kaudal freiliegende Ende der Vene, ca. 1 cm kranial vom kaudalsten sichtbaren Rand des Gefäßes entfernt. Führen Sie die Naht in 5-mm-"Bissen" auf folgende Weise durch: kranial-kaudal auf der rechten Seite, rechts nach links und kaudal-kranial auf der linken Seite. Das resultierende Muster muss als "drei Seiten eines Quadrats" erscheinen. Stellen Sie sicher, dass die Nahtenden von beiden Enden gleich lang sind.
- Montieren Sie die Minipumpe wie in der Bedienungsanleitung des Produkts beschrieben (siehe Materialtabelle).
- Binden Sie elastische Gefäßbänder um das Gefäß sowohl am kranialen als auch am kaudalen Ende. Halten Sie diese zunächst locker. Lassen Sie einen Assistenten die Gefäßbänder anspannen, um das Gefäß zu verschließen.
- Mit einer 14-G-Nadel einen Einstich in die Vene in der Mitte des "dreiseitigen Quadrats" vornehmen, das mit Nahtmaterial hergestellt wurde (Schritt 5.2.7; Abbildung 2B).
- Fädeln Sie den Minipumpenschlauch in die Einstichstelle. Es muss leicht in das Schiff gelangen können. Wenn Sie auf Widerstand stoßen, drücken Sie nicht weiter; Ziehen Sie stattdessen den Schlauch heraus und versuchen Sie es erneut.
- Schieben Sie den Schlauch vor, bis 1-2 cm außerhalb des Gefäßes verbleiben. Ziehen Sie das Nahtmaterial um den Katheterschlauch herum und binden Sie es in einem einfachen unterbrochenen Knoten ab. Lassen Sie den Assistenten die Gefäßbänder lösen und entfernen.
- Wickeln Sie eine 2-0 nicht resorbierbare Naht mehrmals um den Mini-Pumpenkörper und binden Sie sie ab, so dass die Naht sicher auf der Pumpe sitzt. Befestigen Sie dann die Pumpe mit einem einfachen unterbrochenen Knoten am nahe gelegenen Weichgewebe (Abbildung 2C,D).
- Entfernen Sie die Retraktoren aus dem Einschnitt. Schließen Sie den Einschnitt mit einem standardmäßigen dreilagigen, einfachen, kontinuierlichen Verschluss.
- Verabreichen Sie 0,2 mg/kg Meloxicam subkutan während der Genesung.
- Perkutane transendokardiale Injektion
- Positionieren Sie das Tier in Rückenlage mit ausgestreckten Vorder- und Hinterbeinen und sichern Sie es mit Fesseln.
- Bereiten Sie den kaudalen Bauch und die medialen Oberschenkel des Tieres aseptisch vor. Decken Sie das Tier mit einem gefensterten Femurangiographie-Tuch ab (siehe Materialtabelle).
- Richten Sie die Verkabelung und die Patches des elektroanatomischen Mapping-Systems gemäß den Produktspezifikationen ein (siehe Materialtabelle).
- Verwenden Sie eine lineare Ultraschallsonde, um die Oberschenkelarterie zu identifizieren. Unter Ultraschallkontrolle die Oberschenkelarterie mit einer Kochnadel punktieren und über die Nadel einen 0,035 Zoll langen Führungsdraht in das Gefäß einfädeln. Entfernen Sie die Nadel über den Draht.
- Fädeln Sie eine 8 Fr arterielle Hülle und einen Einführer über den arteriellen Draht und drücken Sie sie durch, bis nur noch der Hub mit der Haut bedeckt ist. Stellen Sie sicher, dass der Draht immer sichtbar ist und aus der Nabe des Mantels austritt.
HINWEIS: Da es sich um eine größere Hülle handelt, kann gelegentlich ein Skalpell Nr. 11 erforderlich sein, um einen kleinen Hautschnitt zu machen, um die Passage zu erleichtern. - Entfernen Sie die Manteleinleitung und das Kabel. Verabreichen Sie intravenöses Heparin (100-200 Einheiten/kg).
- Der transendokardiale Injektionskatheter wird durch die Schleuse eingeführt und über einen retrograden Aortenzugang in die linke Herzkammer vorgeschoben.
- Erstellen Sie eine elektroanatomische Karte der linken Herzkammer, indem Sie den Katheter vorsichtig über die endokardiale Oberfläche ziehen. Führen Sie eine axiale Rotation und sanfte Veränderungen der Spitzenbeugung durch, um einen guten endokardialen Kontakt zu erreichen. Identifizieren Sie Narben-, Grenz- und abgelegene Zonen durch Standard-Spannungsabschaltungen.
- Richten Sie den Katheter mit fluoroskopischer und elektroanatomischer Führung an die bevorzugte Injektionsstelle. Führen Sie eine sanfte axiale Drehung mit Auslenkung der distalen Spitze durch, um einen stabilen endokardialen Kontakt aufrechtzuerhalten.
- Bestätigen Sie die Platzierung der Katheterspitze mit mindestens zwei Durchleuchtungsansichten. Schieben Sie den Kernkatheter vorsichtig vor und verlängern Sie dann die Nadel auf eine kontrollierte intramyokardiale Tiefe (3,5 mm für apikale Injektion, 5 mm für Septuminjektion).
- Spülen Sie 4-6 ml jodhaltiges Kontrastmittel (siehe Materialtabelle) durch den Injektionskatheter, bis es fluoroskopisch sichtbar ist. Beobachten Sie den Kontrast für die nächsten 10-30 Sekunden, um sicherzustellen, dass er im Gewebe bleibt (Abbildung 3A).
- Beobachten Sie das EKG während des Ausfahrens der Nadel und der Injektion genau, da ventrikuläre Ektopieverläufe häufig sind.
HINWEIS: Von einer ventrikulären Ektopie spricht man, wenn die Nadelspitze in Myokardkontakt gekommen ist. - Wenn die Kontrastmittelinjektion erfolgreich ist, wird anschließend das gewünschte Mittel injiziert. Spülen Sie dies mit Kontrastmittel durch, bis es fluoroskopisch beobachtet wird.
HINWEIS: Der Wirkstoff von Interesse ist spezifisch für den Benutzer, je nachdem, welche Therapie er testet. - Ziehen Sie die Nadel zurück. Entfernen Sie den Injektionskatheter aus der arteriellen Schleuse.
- Entfernen Sie die arterielle Hülle und üben Sie bis zu 20 Minuten lang Druck auf die Stellen aus, bis die Hämostase erreicht ist.
6. Genesung nach Vollnarkose
- Schalten Sie die verwendeten Inhalationsanästhetika oder intravenösen Anästhesiepumpen aus. Reduzieren Sie die Atemfrequenz am Beatmungsgerät auf 8-10 Atemzüge/min.
- Schalten Sie das Beatmungsgerät nach 2-5 Minuten für maximal 30 Sekunden in den Modus "Freie Atmung". Beobachten Sie das Tier und den Kapnographen auf Spontanatmung.
- Wenn eine Spontanatmung aufgetreten ist, lassen Sie das Beatmungsgerät ausgeschaltet. Wenn das Tier apnoisch ist, schalten Sie das Beatmungsgerät für weitere 1-2 Minuten wieder ein und versuchen Sie es erneut, bis die Spontanatmung erreicht ist.
HINWEIS: Der Zeitrahmen für die Genesung ist je nach Verfahren und Tiermerkmalen variabel, kann aber zwischen 15 Minuten und 1 Stunde liegen. - Sobald das Tier gut atmet (Atemfrequenz von 15-30 Atemzügen/min, endtidales Kohlendioxid unter 60, SpO2 über 95%), trennen Sie den Sauerstoff und lassen Sie andere Überwachungsgeräte angeschlossen.
- Entfernen Sie temporäre Stellen des Gefäßzugangs und üben Sie Druck aus, um die Bildung von Hämatomen zu verhindern. Wenn das Tier stabil bleibt und in den folgenden 5 Minuten weiterhin gut mit Sauerstoff versorgt wird, kann es in seinen Auffangbereich transportiert werden.
- Nach drei aufeinanderfolgenden spontanen Schlucken die Manschette des Endotrachealtubus entleeren und den Tubus vorsichtig entfernen.
- Überwachen Sie das Tier für mindestens weitere 5 Minuten, um sicherzustellen, dass es weiterhin ausreichend mit Sauerstoff versorgt wird und keine Atemnot hat. Flow-by-Sauerstoff ist nach Bedarf zu verwenden, wenn ein Tier nach der Extubation entsättigt ist.
Ergebnisse
Thorakotomie und Epikardzellinjektion
Von den 29 Tieren, die sich einer Thorakotomie und einer epikardialen Injektion unterzogen, überlebten 26. Die histologische Analyse bestätigte die Transplantation menschlicher Zellen, die mit dieser Methode bei allen überlebenden Tieren verabreicht wurden (Abbildung 1E). Bei einem Tier kam es während der Zellinjektion zu tödlichen Herzrhythmusstörungen und konnte nicht wiederbelebt werden. Bei einem anderen trat während des Verschlusses und der anhaltenden Anwendung von Überdruck auf die Atemwege eine pulslose elektrische Aktivität auf und konnte nicht wiederhergestellt werden. Ein drittes Tier erbrach sich und erlitt bei der Extubation einen Atemstillstand. Dieses Tier konnte nicht wiederbelebt werden.
Bei zwei Tieren traten schwere Komplikationen auf, konnten aber geborgen werden. Ein Tier entwickelte während der intramyokardialen Injektion Kammerflimmern und konnte mit internen Defibrillationspaddeln und Herzmassage wiederbelebt werden. Das zweite Tier erbrach sich bei der Extubation und erlitt einen kurzen Atemstillstand, konnte aber schnell wieder intubiert werden und erholte sich gut. Alle diese Ereignisse traten während der frühen Experimente auf, wobei die unerwünschten Ereignisse mit zunehmender Erfahrung des Teams mit dem Protokoll zunahmen (Tabelle 1).
Implantation der osmotischen Minipumpe der Jugularvene
Es wurden keine Mortalität oder größere Komplikationen mit der Implantation einer jugularosmotischen Minipumpe in Verbindung gebracht. Bei den meisten der sieben Tiere kam es innerhalb der ersten 24 Stunden zu einer leichten Schwellung an der Operationsstelle, die sich ohne Intervention zurückbildete. Ein ELISA, der am Tag 3 nach der Implantation nach der Pumpe am Serum durchgeführt wurde, zeigte die Wirksamkeit der Pumpe und erreichte im Vergleich zu Kontrollen eine signifikante Blutkonzentration des Thrombozyten-abgeleiteten Wachstumsfaktors AB human (PDGF-AB) im Blut7 (Abbildung 2E).
Perkutane transendokardiale Injektion
Insgesamt erhielten 22 Tiere endokardiale Injektionen. Von diesen Injektionen wurden 17 als "erfolgreich" eingestuft, was durch Fluoreszenz- oder Tintenfärbung bestimmt wurde, die postmortal im Zielgewebe beobachtet wurde (Abbildung 3B). Es gab keine Todesfälle im Zusammenhang mit diesem Verfahren. Ein Tier entwickelte einen kleinvolumigen Perikarderguss durch rechtsventrikuläre Perforation. Dies war selbstlimitierend und führte nicht zu einer kardiovaskulären Beeinträchtigung. Dasselbe Tier starb; Dies war jedoch von einem nicht verwandten zusätzlichen Eingriff nach der intramyokardialen Injektion herrührend.
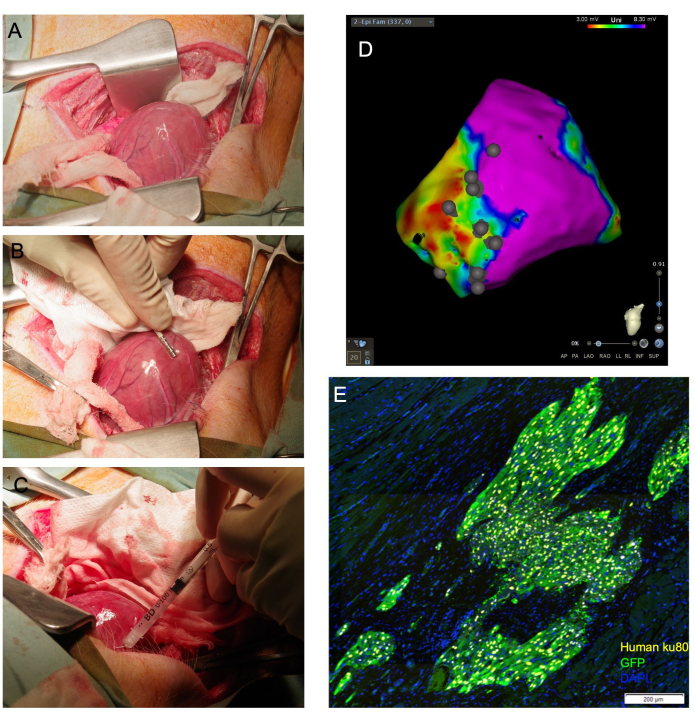
Abbildung 1: Die transepikardiale Kardiomyozyten-Injektion ermöglicht eine direkte kardiale Visualisierung und erreicht einen hohen Anteil an lebensfähigen Zellen, die dem Myokard zugeführt werden. (A) Die Herzspitze wird durch eine angefeuchtete Mullschlinge freigelegt, die unter der Basis des Herzens geführt wird. (B) Ein epikardialer Mapping-Katheter grenzt Narben- und Randzonen ab und markiert die Injektionsstellen. (C) Eine 31-G-Nadel wird verwendet, um Zellen transepikardial in das Myokard zu injizieren. (D) Epikardiale Spannungskarte mit Annotation der Injektionsstelle. Violett: normale Spannung, gesundes Myokard; Rot: abnorme Spannung, erkranktes Myokard; Graue Punkte: Injektionsstellen. Nach der Opferung wird das Herz entnommen und für die nachgelagerte histologische Beurteilung mit Formalin fixiert. In (E) werden transplantierte menschliche Zellen durch Immunfärbung für den humanen antinukleären Antikörper Ku80 und einen Anti-GFP-Antikörper nachgewiesen. Maßstabsleiste = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
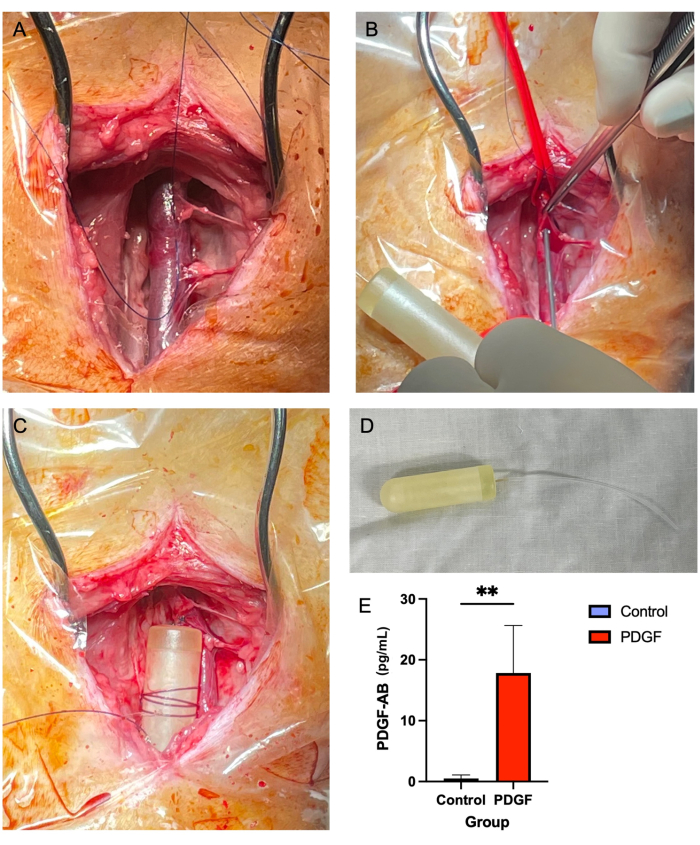
Abbildung 2: Das Einsetzen einer Jugularvenen-Minipumpe bietet eine sichere und zuverlässige Methode der PDGF-Verabreichung über einen Zeitraum von 7 Tagen . (A) Die rechte Halsvene wird freigelegt und das Weichgewebe wird aus dem Gefäß entfernt. (B) Gefäßbänder verschließen das Gefäß, während eine 14-G-Nadel verwendet wird, um eine Punktion vorzunehmen, durch die der Minipumpenschlauch gefädelt wird. (C) Der Minipumpenschlauch wird in die Vene vorgeschoben, und der Minipumpenkörper ist an angrenzendem Weichgewebe befestigt. (D) Der Minipumpenkörper und die Schläuche vor der Implantation. (E) Die Serumkonzentration des rekombinanten Proteins, das über die Minipumpe und den PDGF-AB abgegeben wurde, wurde bei jedem Tier am Tag 3 nach der Implantation mittels ELISA gemessen. Es wurde gezeigt, dass Tiere, die PDGF-AB erhielten, eine signifikant höhere Blutkonzentration von PDGF-AB aufwiesen als Kontrolltiere, was die Wirksamkeit der osmotischen Minipumpen-Verabreichungsmethode bestätigt. **bezeichnet einen statistisch signifikanten Unterschied zwischen den Gruppen (p = 0,005, Mann-Whitney-U-Test) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
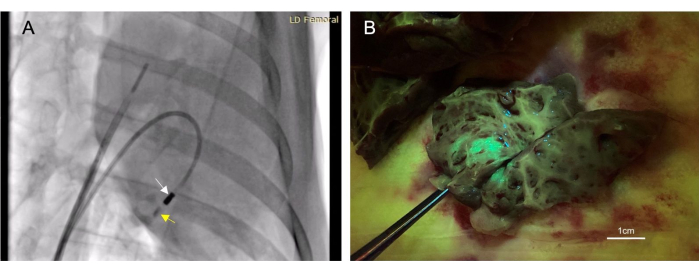
Abbildung 3: Die transendokardiale intramyokardiale Injektion ermöglicht eine minimal-invasive Methode zur Verabreichung von Therapeutika. (A) Ein rechtsvorderes schräges fluoroskopisches Bild, das den Injektionskatheter (weißer Pfeil) zeigt, der Kontrastmittel (gelber Pfeil) in das Myokard verabreicht. Die Kontrastmittelinjektion geht der therapeutischen Injektion voraus und folgt ihr, so dass die Nadelplatzierung im Myokard bestätigt werden kann. (B) Der injizierte Vektor exprimierte grün fluoreszierendes Protein (GFP), so dass injiziertes Material bei der Gewebeentnahme fluoreszieren würde, wodurch der Erfolg der Injektion bestätigt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Transepikardiale Injektion (n = 29) | Transendokardiale Injektion (n = 22) | Osmotische Minipumpe (n = 7) | |
| Sterblichkeit | 3 | 0 | 0 |
| Postoperatives Erbrechen und Atemstillstand | 1 | 0 | 0 |
| Kammerflimmern während der Injektion | 1 | 0 | 0 |
| Pulslose elektrische Aktivität während des Thoraxverschlusses | 1 | 0 | 0 |
| Morbidität | 0 | 1 | 0 |
| Pneumothorax | 0 | 0 | 0 |
| Pleuraerguss | 0 | 0 | 0 |
| Perforation der Herzkammer | 0 | 1 | 0 |
| Blutung | 0 | 0 | 0 |
Tabelle 1: Liste der Komplikationen.
Diskussion
Transepikardiale intramyokardiale Injektion
Dieses Verfahren hat den Vorteil der direkten kardialen Visualisierung und bietet nachweislich eine größere lokale Retention von Therapeutika als systemische Verabreichungsmethoden 9,10,14. Thorakotomien sind jedoch invasiv, erfordern erhebliche technische Fähigkeiten und stellen ein höheres Morbiditäts- und Mortalitätsrisiko dar als andere diskutierte Methoden10,15. Die Kenntnis der kritischen und prekären Phasen des Verfahrens kann bei der Vermittlung dieses erhöhten Risikos helfen.
Bei der Manipulation des Herzens zur Freilegung der Herzspitze ist aufgrund des hohen Risikos von Herzrhythmusstörungen und der damit verbundenen hämodynamischen Beeinträchtigung große Vorsicht geboten. Kontinuierliche invasive Blutdrucküberwachung und Elektrokardiographie ermöglichen eine schnelle Identifizierung von Hypotonie oder instabilen Arrhythmien und erleichtern ein sofortiges Eingreifen und Korrigieren. Die vorübergehende Hypotonie kann im Allgemeinen mit Metaraminol-Boli behandelt werden. Eine anhaltende Hypotonie kann durch eine Reduzierung der Inhalationsanästhesie (sorgfältige Überwachung der Narkosetiefe) und den Beginn einer Vasopressor-Infusion vorübergehend reduziert werden, während gleichzeitig die Ursache der veränderten Hämodynamik bestimmt wird. Instabile Herzrhythmusstörungen wie ventrikuläre Tachykardie oder Kammerflimmern können durch elektrische Kardioversion mit oder ohne intravenöse Antiarrhythmika behandelt werden.
Ebenso wichtig für das Überleben der Tiere ist die erfolgreiche Entfernung von freiem Gas aus der Pleurahöhle vor dem Verschluss des Brustkorbs. Geschieht dies nicht, kann dies zur Entwicklung eines Pneumothorax führen, wodurch das Tier einem großen Risiko ausgesetzt ist, die Atmung zu beeinträchtigen und zu sterben, sobald es nach der Genesung vom mechanischen Beatmungsgerät getrennt wird. Der positive Atemwegsdruck muss mindestens 30 s lang aufrechterhalten werden, bis keine Blasbildung mehr beobachtet wird. Der Silikonschlauch wird nach Beendigung der Blasbildung sofort entfernt und der Thorax wird dann schnell geschlossen. Es ist auch möglich, einen Thorakostomieschlauch chirurgisch am Verschluss zu legen, der eine manuelle Entfernung von Luft und Entzündungsflüssigkeit in den nächsten 24-72 Stunden ermöglicht. Dies ist jedoch schwer sauber und intakt zu halten, insbesondere wenn die Tiere zusammen untergebracht sind. Eine Beschädigung oder Kontamination des Eileiters kann zu Pyothorax, Pneumothorax oder Sepsis führen. Unserer Erfahrung nach ist das Einsetzen einer temporären Thoraxdrainage nicht erforderlich, wenn freies Gas vor dem Thoraxverschluss ausreichend entfernt wird.
Perkutane transendokardiale intramyokardiale Injektion
Diese Methode der therapeutischen Verabreichung hat den Vorteil, dass sie eine lokale Gewebeabgabe mit geringerem Risiko ermöglicht, da sie im Vergleich zu einem chirurgischen Ansatz weniger invasiv ist10,14. Diese Technik wird bereits in Großtierstudien eingesetzt, wobei sowohl die Durchleuchtung als auch die elektromechanische Kartierung als Leitfaden dienen, wenn keine direkte Visualisierung möglich ist10,16,17.
Da das Herz nicht direkt sichtbar ist, ist es für den Verfahrenstechniker ratsam, bei der Auswahl einer Injektionsstelle orthogonale Durchleuchtungsansichten zu verwenden. Darüber hinaus ist die Injektion von verdünntem Jodkontrastmittel vor und Verabreichung des Therapeutikums äußerst wertvoll für die Bestätigung des Myokardkontakts. Ein geeigneter Kontakt kann durch die Beobachtung eines charakteristischen "myokardialen Rouge" bestätigt werden, das einer der wenigen Marker für den Injektionserfolg vor der Gewebeentnahme sein kann. Aufgrund des Risikos einer Kammerperforation wird auch empfohlen, die myokardiale Wanddicke an der gewählten Injektionsstelle größer als 9 mm zu sein14,16.
Jugularvenöse osmotische Minipumpe
Die osmotische Minipumpe ist ein beliebtes Gerät, das häufig in Kleintierstudien eingesetzt wird. Es besteht ein zunehmendes Interesse an der Verwendung dieses Geräts in Großtiermodellen 7,18,19, da es den einzigartigen Vorteil hat, ein Therapeutikum über einen bestimmten Zeitraum mit einer konstanten Rate zu verabreichen. Eine mögliche Einschränkung dieser Methode ist die Unfähigkeit, die Infusionsraten des Arzneimittels zu ändern oder zu stoppen, ohne die Pumpe auszutauschen oder zu entfernen. Dies sollte berücksichtigt werden, bevor eine Therapie auf diese Weise ausprobiert wird.
Diese Studie zeigte, dass diese Methode mit einer hohen Erfolgsrate bei Schweinen mit geringer Morbidität und Mortalität durchgeführt werden kann. Es muss beachtet werden, dass viele lebenswichtige Strukturen an die Operationsstelle angrenzen, darunter Lymphknoten, der Thymus und die Halsschlagader. Es wird dringend empfohlen, sich an die Methode zu halten und anatomische Texte20 zu konsultieren, um eine unbeabsichtigte Beschädigung dieser Strukturen zu vermeiden. Die besorgniserregendste Komplikation dieser Methode ist der hämorrhagische Schock aufgrund einer unbeabsichtigten Verletzung der Halsvene oder einer umgebenden Struktur. Daher ist es wichtig, dass das Weichgewebe, das die Halsvene umgibt, vorsichtig entfernt wird. Wenn dieser Schritt nicht ordnungsgemäß ausgeführt wird, kann dies zu Schwierigkeiten beim Platzieren des Minipumpenschlauchs oder bei der Kontrolle unbeabsichtigter Blutungen führen.
In diesem Artikel wurden drei Methoden für die Verabreichung von kardioaktiven Therapeutika beschrieben. Trotz des berichteten Erfolgs jeder Technik gibt es inhärente Einschränkungen, die berücksichtigt werden müssen. Invasive Verfahren (transepikardiale Injektion) ermöglichen eine erhöhte Genauigkeit der therapeutischen Verabreichung; Sie bergen jedoch ein höheres Risiko für potenziell tödliche Komplikationen. Darüber hinaus erfordert die invasive Verabreichung mehr technische Fähigkeiten, um das Risiko von Komplikationen zu minimieren. In ähnlicher Weise erfordert die fluoroskopisch gesteuerte, transendokardiale Injektion ein gewisses Maß an technischem Geschick für die Katheterisierung und Manipulation der Hardware. Wenn diese Methode unsachgemäß durchgeführt wird, sind Injektionsfehler und tödliche Komplikationen möglich.
Die beschriebenen Direktinjektionsverfahren ermöglichen die einmalige Verabreichung eines Therapeutikums in das Zielgewebe. Die jugularvenöse osmotische Minipumpe ermöglicht die systemische Verabreichung eines Therapeutikums über einen Zeitraum von 7 Tagen. Diese Methode ist vergleichsweise einfacher und mit weniger Risiko verbunden, setzt jedoch voraus, dass ein systemisches Therapeutikum den Weg zum Herzmuskel findet. Darüber hinaus ist es nach dem Einsetzen der Pumpe unmöglich, die Verabreichung abzubrechen oder die Dosisleistung zu ändern, ohne das Tier erneut zu betäuben und die Pumpe zu entfernen.
Alle in diesem Artikel beschriebenen Methoden wurden an Tieren am Tag oder 2 Wochen nach dem Myokardinfarkt durchgeführt. Daher kann in dieser Arbeit nicht über den Erfolg der genannten Methoden bei gesunden Tieren oder Tieren, die einer alternativen Herzpathologie unterzogen wurden, berichtet werden. Schließlich müssen die Pharmakologie und Biotechnologie jedes beabsichtigten Wirkstoffs sorgfältig geprüft werden, da dies von Natur aus mit der Wirksamkeit des gewählten Verabreichungsweges verbunden ist. Eine detaillierte Erörterung dieses Manuskripts würde den Rahmen sprengen.
Umfassende Darstellungen präklinischer Methoden kommen dem Tierschutz und der breiteren wissenschaftlichen Gemeinschaft zugute. Die daraus resultierende verbesserte Reproduzierbarkeit von Verfahren und Ergebnissen führt zu weniger Komplikationen für die Tiergesundheit, einer geringeren Anzahl von Tieren, die erforderlich sind, um signifikante Ergebnisse zu erzielen, und einem größeren Vertrauen in die Versuchsergebnisse21,22. In diesem Artikel werden drei Methoden zur Verabreichung neuartiger Therapeutika zur Behandlung des Myokardinfarkts in einem Schweinemodell beschrieben. Durch die detaillierte Beschreibung der verwendeten Techniken und die Artikulation der Vorteile und Risiken jeder einzelnen wird erwartet, dass die Forscher in der Lage sein werden, konsistente und zuverlässige präklinische Modelle zu erstellen, die ihren Forschungszielen entsprechen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch Zuschüsse des National Health and Medical Research Council APP1194139/APP1126276 (JC), der National Stem Cell Foundation of Australia und des New South Wales Government Office of Health and Medical Research (JC) finanziert. DS wurde vom Royal Australasian College of Physicians, dem Institute of Clinical Pathology and Medical Research und dem Australian Government Research Training Program unterstützt. TD wurde vom Institute of Clinical Pathology and Medical Research, dem Penfolds Family Scholarship, dem National Health and Medical Research Council (APP2002783) und der National Heart Foundation of Australia (104615) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
Referenzen
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39 (2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483 (2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. . Veterinary Sutures Handbook. , (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392 (2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897 (2016).
- Singh, B., Dyce, K. M. . Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411 (2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten