Method Article
Aplicação da Terapêutica Cardioativa em Modelo de Infarto do Miocárdio Porcino
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo descreve três métodos de administração de agentes terapêuticos cardioativos em modelo suíno. Suínas crioulas receberam tratamento através de: (1) toracotomia e injeção transepicárdica, (2) injeção transendocárdica por cateter ou (3) infusão intravenosa via minibomba osmótica da veia jugular.
Resumo
O infarto do miocárdio é uma das principais causas de morte e incapacidade em todo o mundo, e há uma necessidade urgente de novas estratégias cardioprotetoras ou regenerativas. Um componente essencial do desenvolvimento de medicamentos é determinar como uma nova terapêutica deve ser administrada. Modelos animais de grande porte fisiologicamente relevantes são de importância crítica na avaliação da viabilidade e eficácia de várias estratégias de liberação terapêutica. Devido às suas semelhanças com os seres humanos na fisiologia cardiovascular, anatomia vascular coronariana e relação peso/peso corporal, os suínos são uma das espécies preferidas na avaliação pré-clínica de novas terapias para o infarto do miocárdio. O presente protocolo descreve três métodos de administração de agentes terapêuticos cardioativos em modelo suíno. Após infarto do miocárdio induzido por via percutânea, fêmeas de suínos crioulas receberam tratamento com novos agentes através de: (1) toracotomia e injeção transepicárdica, (2) injeção transendocárdica por cateter ou (3) infusão intravenosa via minibomba osmótica da veia jugular. Os procedimentos empregados para cada técnica são reprodutíveis, resultando em liberação confiável de drogas cardioativas. Esses modelos podem ser facilmente adaptados para se adequar a desenhos de estudo individuais, e cada uma dessas técnicas de entrega pode ser usada para investigar uma variedade de intervenções possíveis. Portanto, esses métodos são uma ferramenta útil para cientistas translacionais que buscam novas abordagens biológicas no reparo cardíaco após infarto do miocárdio.
Introdução
A doença arterial coronariana (DAC) e o infarto agudo do miocárdio com supradesnivelamento do segmento ST (IAMCSST) são as principais causas de morte em todo o mundo. Nas últimas duas décadas, grandes progressos foram feitos na redução da mortalidade hospitalar de pacientes com IAMCSST, por meio do advento da intervenção coronária percutânea, das terapias fibrinolíticas e da padronização dos algoritmos de tratamento para garantir que a reperfusão seja alcançada em tempo hábil 1,2,3. Apesar disso, a morbidade associada ao IAMCSST continua sendo uma carga significativa, criando uma grande necessidade para o desenvolvimento de novas terapias cardioprotetoras e regenerativas 2,3. Um componente essencial do desenvolvimento terapêutico é a determinação de como uma nova terapia deve ser administrada4. A segurança, eficácia e viabilidade de cada método precisam ser combinadas com as características da própria terapia.
Modelos animais de grande porte fisiologicamente relevantes são fundamentais na avaliação desses atributos de várias estratégias de liberação terapêutica5. Devido às suas semelhanças com os seres humanos na fisiologia cardiovascular, anatomia vascular coronariana e relação peso/peso corporal, os suínos são uma das espécies preferidas na avaliação pré-clínica de novas terapias para o infarto do miocárdio6. Usamos anteriormente um modelo de IAMCSST suíno para demonstrar a capacidade reparadora de uma terapia proteica recombinante7 e continuamos a investigar novas terapias farmacológicas, celulares e genéticas usando esse modelo. São descritas três técnicas de administração terapêutica utilizadas em modelos suínos após a criação do infarto: toracotomia e injeção transepicárdica, injeção transendocárdica percutânea e implante de minibomba osmótica venosa jugular. Os dois primeiros métodos permitem a liberação tecidual local, reduzindo as doses necessárias, os efeitos fora do alvo e o metabolismo hepático de primeira passagem 8,9,10. A minibomba osmótica permite a entrega contínua de um fármaco com meia-vida curta, negando a dependência de uma bomba de infusão e cânula intravenosa patente, ambas difíceis de instituir em modelos animais de grande porte.
Ao descrever essas técnicas, espera-se que este artigo possa ajudar cientistas translacionais na investigação de novos agentes cardioprotetores ou regenerativos após infarto do miocárdio em modelos animais de grande porte.
Protocolo
Todos os experimentos foram realizados seguindo o "código australiano para o cuidado e uso de animais para fins científicos" e foram aprovados pelo Comitê de Ética Animal do Distrito de Saúde Local de Western Sydney. Fêmeas pré-púberes grandes brancas x landraces, pesando 18-20 kg, foram utilizadas para o presente estudo.
1. Pecuária
- Aloja os animais de acordo com os regulamentos do comitê de ética animal local.
OBS: Os animais incluídos neste protocolo são alojados individualmente para evitar brigas e ferimentos e garantir que não haja competição por alimento. No entanto, todos os animais podiam ver, ouvir e cheirar conespecíficos. Suas canetas têm piso de concreto para facilitar a limpeza, e têm uma parte interna e externa abrigada. Os porcos são fornecidos com cama de palha na parte interna e 'brinquedos' de enriquecimento na parte externa.
2. Sedação e anestesia geral
- Sedação
- Certifique-se de que o animal tenha estado em jejum durante pelo menos 12 horas antes de iniciar qualquer sedação pesada ou anestesia geral.
- Caso o animal ainda não tenha acesso vascular na forma de uma linha central, utilize um protocolo de sedativo intramuscular.
- A sedação intramuscular consiste em 8 mg/kg de cetamina, 0,3 mg/kg de midazolam, 0,2 mg/kg de metadona e 10 μg/kg de medetomidina (ver Tabela de Materiais). Administrar esta mistura na musculatura epaxial do animal com uma agulha de 21 G. Em média, os animais levam de 5 a 10 minutos para ficarem fortemente sedados.
OBS: Um porco estressado é mais resistente à sedação; garantir um adestrador calmo e confiante seda o animal e que o animal não seja estressado indevidamente. Se o animal ficar estressado, é melhor deixá-los sozinhos por 5-10 minutos e tentar novamente. - Realizar sedação intravenosa se uma linha central estiver no lugar e patente. A sedação intravenosa consiste em 2 mg/kg de cetamina, 0,2 mg/kg de midazolam, 0,2 mg/kg de metadona e 2 μg/kg de medetomidina.
- Lave a linha intravenosa com cloreto de sódio a 0,9% primeiro para garantir a patência. Em seguida, empurre lentamente metade da seringa misturada através da linha e lave com cloreto de sódio a 0,9%.
- Observe o animal, que deve ser fortemente sedado dentro de 20-30 s. Se o animal ainda não estiver sediado, lave a metade restante da seringa, conforme descrito na etapa 2.1.5.
- Acesso vascular
- Uma vez devidamente sedado, transporte o porco para o centro cirúrgico.
- Pré-oxigenar o porco com uma máscara facial e uma taxa de fluxo de oxigênio de 5 L/min. Conecte um oxímetro de pulso à cauda, orelhas ou língua do porco para monitorar o animal por toda parte.
- Com o uso de uma cânula de 22 ou 24 G, obtenha acesso às veias marginais da orelha esquerda e direita e fixe com fita adesiva.
- Anestesia geral
- Posicionar o porco em decúbito esternal.
- Administrar 1-3 mg/kg de propofol (ver Tabela de Materiais) por via intravenosa como um impulso lento titulado para efeito. Peça a um assistente que segure a boca do animal aberta (a mandíbula deve estar frouxa nesta fase) e estenda o pescoço.
- Use um laringoscópio (ver Tabela de Materiais) para deprimir a base da língua e a epiglote para expor as cartilagens aritenoides da laringe.
- Passar um tubo endotraqueal lubrificado (tamanho 5,5 ou 6,0; ver Tabela de Materiais) com um estilete através das cartilagens aritenóideas e para dentro da traqueia. Ocasionalmente, a resistência pode ser sentida ao passar pela laringe; Isso pode ser combatido com rotação suave do tubo endotraqueal. Se o animal estiver resistindo à intubação, administrar mais propofol por via intravenosa.
- Retire o estilete do tubo endotraqueal. Inflar o balonete do tubo endotraqueal até que não haja vazamentos de ar ao redor do tubo. Geralmente, são necessários 4-6 mL de ar, embora o volume possa variar dependendo do tamanho do tubo e do animal.
- Fixe o tubo endotraqueal atrás das orelhas do animal.
- Conecte o animal a um circuito anestésico de reinalação com função de ventilador com controle de volume. Quando o animal estiver ligado, desligue o ventilador.
NOTA: Certifique-se de que, em todos os momentos, a válvula limitadora de pressão ajustável (APL) ou 'válvula pop-off' esteja aberta. A falha em deixar a válvula aberta pode resultar em barotrauma fatal para o animal. - Reduzir o fluxo de oxigênio do circuito anestésico para 2 L/min.
- Ajuste o ventilador de pressão positiva para o modo 'controle de volume'. Ajuste o volume corrente como 10 mL/kg e a frequência respiratória como 20 ciclos/min. Certifique-se de que a relação inspiratório:expiratório esteja definida em 1:2.
- Durante todo o procedimento, manipule a frequência respiratória para garantir que o dióxido de carbono expirado fique entre 35-50 mmHg.
NOTA: A pressão inspiratória não deve exceder 20 cmH2O. Aumentos na pressão inspiratória levam à investigação de torções ou bloqueios de tubos. Para aliviar o aumento das pressões que não estão associadas à tubulação, a relação inspiratório:expiratório pode ser reduzida para 1:1,5 e o volume corrente reduzido. - Se o animal estiver hemodinamicamente estável, mantê-los com anestesia inalatória. Se o animal não estiver hemodinamicamente estável, mantê-lo com anestesia venosa total, conforme descrito no passo 2.3.14.
- Se o animal for receber anestesia inalatória, iniciar com isoflurano a 2,5% a partir do momento em que o circuito anestésico for conectado pela primeira vez.
- Ao longo dos 30 min seguintes, o animal desmamou progressivamente até o isoflurano inalatório a 1,5%. Manter o animal em isoflurano a 1,5% até o final do procedimento.
- Avaliar a profundidade da anestesia a cada 10 min, verificando os reflexos palpebrais e testando o tônus da mandíbula. Ajustar o isoflurano conforme necessário para manter a profundidade anestésica.
- Se o animal estiver hemodinamicamente instável, mantê-lo com anestesia venosa total, permitindo maior controle da profundidade anestésica sem as complicações cardiovasculares associadas aos anestésicos inalatórios.
- Prepare bombas de seringa ou bombas de fluido padrão com propofol, fentanil e midazolam. Conecte-os ao animal através de uma linha comum.
NOTA: O propofol pode ser executado a 0,1-0,6 mg/kg/min, o fentanil pode ser executado a 1-5 μg/kg/h e o midazolam pode ser executado a 0,05-0,2 mg/kg/h. - Assim como na anestesia inalatória, titular esses fármacos para efeito em toda a anestesia para manter a profundidade adequada da anestesia.
- Prepare bombas de seringa ou bombas de fluido padrão com propofol, fentanil e midazolam. Conecte-os ao animal através de uma linha comum.
- Fornecer suporte de fluidos intravenosos com cloreto de sódio a 0,9% ou solução de Hartmann (ver Tabela de Materiais) a uma taxa de 5 mL/kg/h.
- Monitorar o animal com medidas de pressão arterial, capnografia, monitorização de gases anestésicos, temperatura, oximetria de pulso e eletrocardiografia.
- Durante qualquer procedimento, fornecer analgesia adicional na forma de 0,2 mg/kg de metadona por via intravenosa a cada 4 h após a pré-medicação.
NOTA: A analgesia pode ser administrada em intervalos mais curtos se o animal demonstrar sinais de dor durante a anestesia (taquicardia, profundidade anestésica iluminada sem alterações nos medicamentos de manutenção).
3. Colocação da linha central
- Posicione o porco em decúbito dorsal com os membros posteriores estendidos, o membro anterior esquerdo estendido e o membro anterior direito flexionado e preso com gravata.
- Prepare assepticamente o pescoço do porco e cubra com uma cortina.
- Use uma sonda de ultrassom linear (ver Tabela de Materiais) com uma cobertura estéril para localizar a veia jugular direita. Isso é melhor conseguido com a sonda orientada perpendicularmente à traqueia e movendo-a lentamente lateralmente da laringe.
- Habilite o modo doppler colorido para ajudar a identificar a veia jugular. A veia jugular pode ser distinguida da artéria carótida por demonstrar colapsabilidade e fluxo contínuo não pulsátil.
- Use uma agulha Cook 18 G (consulte a Tabela de Materiais) para acessar a veia sob orientação ultrassonográfica. Uma vez alcançado o acesso, passe um fio de ponta J de 0,035 polegadas (consulte Tabela de Materiais) através da agulha e enfie-o no vaso. Retire a agulha sobre o fio.
- Rosqueie uma linha central pré-lavada sobre o fio e empurre para dentro da veia. Certifique-se de que o fio esteja sempre visível emergindo da extremidade distal da linha.
NOTA: Um cateter venoso central de 5 Fr, dois lúmens (ver Tabela de Materiais) foi usado para indivíduos que necessitaram de acesso intravenoso durante um período de 1-4 semanas. - Se houver dificuldade em avançar a linha através da pele, use um bisturi nº 11 para criar uma pequena incisão de 2-4 mm para facilitar a passagem da linha sobre o fio. Aplique pressão negativa seguida de uma descarga em cada linha externa para garantir a permeabilidade. Aperte cada linha.
- Fixe as âncoras fornecidas às linhas externas e fixe-as no lugar com suturas não solúveis 2-0 ou 3-0 (ver Tabela de Materiais). Coloque suturas adicionais para fixar dorsalmente as linhas externas para evitar que o animal as mastigue.
- Conecte linhas de extensão niveladas às linhas de cateter externas e pinça.
- Encaixe o animal com uma jaqueta de porco comercial (consulte Tabela de Materiais) e prenda as linhas internas. Se outros procedimentos ainda não forem realizados durante o mesmo anestésico, encaixe a jaqueta imediatamente antes da recuperação do animal.
4. Infarto do miocárdio
NOTA: Os animais utilizados neste modelo receberam infarto do miocárdio seguindo um método previamentepublicado7.
- Realizar infarto do miocárdio 2 semanas antes dos procedimentos de injeção transepicárdica e transendocárdica 8,9,10. O implante de minibomba osmótica foi realizado imediatamente após a reperfusão coronariana dentro do mesmo procedimento.
5. Administração de medicamentos ou células
- Toracotomia e injeção de células epicárdicas
- Administrar antibióticos profiláticos intravenosos sob a forma de 22 mg/kg de cefazolina (ver Tabela de Materiais). Continue a cada 90 min durante todo o procedimento.
- Posicionar o animal na decúbito lateral direita.
- Aplicar um adesivo de fentanil de 100 μg/h (ver Tabela de Materiais) no plano plano atrás das orelhas do porco. Cobrir com curativo adesivo ou sutura 2-0.
NOTA: Este adesivo é considerado 'ativo' 12 h após a colocação, e fornece analgesia por 72 h. - Configure o cabeamento e os patches do sistema de mapeamento eletroanatômico seguindo as especificações do produto (consulte a Tabela de Materiais).
- Marque uma linha horizontal de 10 cm entre as costelas 4 e 5 no animal com um giz de cera ou marcador cirúrgico.
- Preparar uma mistura de lidocaína (2 mg/kg) e bupivacaína (1 mg/kg) em uma única seringa com agulha 25 G.
- Preparar assepticamente o sítio cirúrgico e esfregar o animal. Execute um bloqueio cutâneo da linha no local da incisão marcada, inserindo a agulha na pele em um ângulo raso, retirando o êmbolo ligeiramente para garantir que não haja refluxo de sangue para a seringa e injetando lentamente a solução à medida que a agulha é retirada da pele. Repita esse processo enquanto se move para baixo na linha.
NOTA: A pressão negativa deve ser aplicada à seringa em cada novo local de injeção para garantir que a bupivacaína não seja administrada por via intravascular. A bupivacaína intravascular pode ser rapidamente fatal. - Com bisturi nº 22, faça uma incisão de pele de 10 cm ao longo da linha marcada.
- Usando cautério monopolar (ver Tabela de Materiais), aprofunde a incisão através das camadas musculares subjacentes até que os músculos intercostais tenham sido alcançados.
- Preparar uma seringa estéril de 0,5 mg/kg de bupivacaína e 1 mg/kg de lignocaína e colocar uma agulha de 25 G.
- Insira a agulha em um ângulo raso na borda caudal da quarta costela. Aplique pressão negativa no êmbolo para garantir que a agulha não tenha passado pela veia ou artéria intercostal. Injete lentamente um quarto do volume da seringa, mantendo a agulha parada.
- Repetir o passo 5.1.12 em mais três locais, separados por 3-5 cm ao longo da borda caudal da quarta costela.
- Use a tesoura de Metzenbaum (ver Tabela de Materiais) para incisar os músculos intercostais cuidadosamente e, em seguida, incisar a pleura após a confirmação com o anestesista.
- À medida que a pleura é incisada, desligue o ventilador para permitir que os pulmões caiam para longe da pleura. Após a incisão, ligue novamente o ventilador e ajuste a pressão positiva expiratória final para 4 cmH2O.
- Coloque afastadores de costelas auto-retentores entre as costelas e abra lentamente para expor o coração. Usando pinças de tecido, segure suavemente o pericárdio e incite com tesoura de Metzenbaum para que o coração possa ser exteriorizado.
NOTA: Durante esta etapa e as próximas etapas, arritmias são comuns. O ECG precisa ser monitorado de perto, e qualquer manipulação cardíaca deve ser interrompida temporariamente se o animal se tornar hemodinamicamente instável (pressão arterial média abaixo de 55 mmHg). Em bolus intravenoso de metaraminol (0,25 mg) devem ser administrados conforme necessário para melhorar a pressão arterial. - Coloque suturas temporárias de permanência 2-0 em ambas as extremidades e lados da incisão pericárdica para fixá-la à parede torácica e criar um poço pericárdico. Certifique-se de que as laterais do pericárdio estejam apoiadas para tornar o pericárdio o mais raso possível.
- Use cotonetes umedecidos ou esponjas de laparotomia para embalar a região ao redor do coração. Isso ajudará a manter o coração estável e evitar o ressecamento dos tecidos expostos.
- Entregue o ápice do coração de dentro da cavidade pericárdica com um dedo indicador atrás do ventrículo esquerdo. Tome cuidado para minimizar a compressão ventricular esquerda.
NOTA: Um coração saudável pode bater confortavelmente com o ápice apontando verticalmente, sentado em sua base com apoio suave, mas sem compressão. Há uma diminuição inicial da pressão arterial associada à manipulação, mas esta deve se recuperar para um nível aceitável na ausência de compressão ventricular externa.- Se nenhuma ou muito lenta recuperação ocorrer em 15 s, retornar o coração imediatamente à cavidade pericárdica e tomar as medidas necessárias para melhorar os parâmetros hemodinâmicos antes de nova luxação.
NOTA: Se o ventrículo puder ser deslocado, a posição do ápice fora do pericárdio pode ser mantida colocando-se compressas de gaze de tamanho adequado dentro do pericárdio para apoiar o ventrículo. Da mesma forma, um swab alongado e umedecido pode ser posicionado sob a base do coração, onde atua como uma tipoia que guia o ápice cardíaco para cima em direção à incisão (Figura 1A).
- Se nenhuma ou muito lenta recuperação ocorrer em 15 s, retornar o coração imediatamente à cavidade pericárdica e tomar as medidas necessárias para melhorar os parâmetros hemodinâmicos antes de nova luxação.
- Criar um mapa eletroanatômico de voltagem da superfície epicárdica do ventrículo esquerdo utilizando um cateter de mapeamento eletrofisiológico (Figura 1B). Identifique cicatrizes, bordas e zonas remotas por meio de cortes de tensão padrão.
LEGENDA: Cicatriz e zona remota foram definidas com pontos de corte bipolares de <0,5 mV ou >1,5 mV e pontos de corte unipolares de <3 mV ou >8,3 mV, respectivamente11,12. - Dobre a agulha da seringa de administração terapêutica de 27 G para um ângulo de aproximadamente 80-90°.
- Avançar a agulha para o tecido alvo em um ângulo raso e aplicar pressão no êmbolo da seringa para descarregar 1/4 a 1/3 do volume total. Deve-se observar branqueamento do tecido (Figura 1C). Utilizar o cateter de mapeamento eletrofisiológico para anotar a localização do local de injeção no mapa de voltagem epicárdica gerado (Figura 1D).
NOTA: Injeções veiculares constituídas pelo meio de cultura celular (RPMI 1640) foram utilizadas para fins de demonstração no protocolo de vídeo. - Retirar parcialmente a agulha e redirecioná-la para dentro do miocárdio. Descarregar mais 1/4 a 1/3 do volume da seringa. Continue até que a seringa esteja vazia.
- Repita os passos 5.1.20-5.1.24 até que a dose desejada tenha sido administrada.
- Retire os cotonetes do coração e remova suavemente a "tipoia" sob o coração, para que ele retorne à posição neutra. Arritmias são comuns durante esta etapa, e deve-se ter cautela conforme descrito no passo 5.1.17.
- Remover as suturas de permanência 2-0 do pericárdio. Solte o afastador e retire-o do tórax.
- Use pontos de polidioxanona (PDS) tamanho 1 com uma agulha redonda com ponta romba para fechar o tórax, passando-o pelos espaços entre as costelas 3 e 4 e as costelas 5 e 6.
NOTA: As suturas estreitas da figura oito proporcionam um efeito de polia para a aproximação das costelas. Duas ou três suturas devem ser empregadas, dependendo do tamanho do animal. - Antes de apertar e amarrar as suturas que se aproximam das costelas, insira um tubo de silicone de comprimento curto na borda ventral da incisão.
- Coloque a extremidade livre da tubulação em uma bacia de soro fisiológico estéril para drenagem subaquática selada da cavidade pleural.
- Fechar as camadas musculares sobrejacentes em um padrão contínuo simples com pontos absorvíveis 2-0. Fechar a pele em um padrão simples contínuo ou intertravado13 com uma sutura inabsorvível 2-0 ou 3-0.
- À medida que o fechamento da ferida for concluído, expulse o ar livre do tórax pelo efeito da ventilação com pressão positiva.
- Ligue o ventilador na configuração "respiração livre". Use a bolsa reservatório no circuito de reinalação para fornecer pressão positiva consistente às vias aéreas (manter a 20-30 cmH2O).
- Continue essa pressão até que o borbulhamento não seja mais observado na bacia de soro fisiológico, indicando que não há ar livre dentro do tórax.
- Retire o tubo de silicone.
- Aplicar um curativo adesivo no local cirúrgico e colocar suturas simples interrompidas espalhadas para auxiliar na manutenção do curativo no lugar.
- Na recuperação, administrar 0,3 mg/kg de metadona por via subcutânea e 0,2-0,5 mg/kg de ondansetrona (ver Tabela de Materiais) por via intravenosa.
- Implante de minibomba osmótica de veia jugular
- Posicionar o animal como descrito no passo 3.1. Prepare e espalhe assepticamente o lado direito do pescoço do animal.
- Com uma lâmina de bisturi nº 22, faça uma incisão de 8-10 cm estendendo-se cranialmente de um ponto 2-3 cm lateral ao esterno do manúbrio. Esta incisão deve tornar-se ligeiramente mais lateral à medida que se move cranialmente.
- Use tesoura de Metzenbaum para dissecar através dos músculos colli, esterno-hioideo e esternocefálico cutâneo. Use técnicas de dissecção romba para aprofundar a incisão até que a veia jugular externa seja visível.
- Coloque afastadores auto-retentores na incisão e abra-os para melhorar a visibilidade.
- Usando pinças de tecido marrom Adson (ver Tabela de Materiais) e tesoura de Metzenbaum, remova o tecido mole ao redor da veia jugular, tanto acima quanto abaixo (Figura 2A). Esta é uma etapa crucial, pois em estágios posteriores, o tecido mole que recobre o vaso pode obstruir a passagem da tubulação da minibomba.
- Utilizar sutura absorvível 5-0 através da extremidade caudal exposta da veia, a aproximadamente 1 cm cranial da borda mais caudal visível do vaso. Passar a sutura em "mordidas" de 5 mm da seguinte forma: cranial-caudal do lado direito, da direita para a esquerda e caudal-cranial do lado esquerdo. O padrão resultante deve aparecer como "três lados de um quadrado". Certifique-se de que as caudas de sutura de ambas as extremidades tenham o mesmo comprimento.
- Monte a minibomba conforme descrito no manual de instruções do produto (consulte a Tabela de Materiais).
- Amarre laços vasculares elásticos ao redor do vaso nas extremidades cranial e caudal. Mantenha-os soltos inicialmente. Peça a um assistente que coloque tensão nos laços vasculares para ocluir o vaso.
- Com uma agulha de 14 G, criar uma punção na veia no centro do "quadrado de três lados" criado com material de sutura (passo 5.2.7; Figura 2B).
- Rosqueie a tubulação da minibomba na punção. Deve passar facilmente para dentro do navio. Se houver resistência, não continue pressionando; em vez disso, puxe a tubulação para fora e tente novamente.
- Avançar a tubulação até que 1-2 cm permaneça fora do vaso. Aperte o material de sutura ao redor da tubulação do cateter e amarre-o em um simples nó interrompido. Faça com que o assistente libere e remova as amarras vasculares.
- Enrole uma sutura inabsorvível 2-0 ao redor do corpo da mini bomba várias vezes e amarre para que a sutura fique segura na bomba. Em seguida, fixe a bomba no tecido mole próximo com um nó simples interrompido (Figura 2C,D).
- Retire os afastadores da incisão. Fechar a incisão em um fechamento contínuo simples padrão de três camadas.
- Administrar 0,2 mg/kg de meloxicam por via subcutânea durante a recuperação.
- Injeção transendocárdica percutânea
- Posicionar o animal em decúbito dorsal, com os membros anteriores e pélvicos estendidos, e seguro com gravatas.
- Preparar assepticamente o abdome caudal e a coxa medial do animal. Drape o animal com um pano de angiografia femoral fenestrada (ver Tabela de Materiais).
- Configure o cabeamento e os patches do sistema de mapeamento eletroanatômico seguindo as especificações do produto (consulte a Tabela de Materiais).
- Use uma sonda de ultrassom linear para identificar a artéria femoral. Sob orientação ultrassonográfica, puncione a artéria femoral com uma agulha de cozimento e enfie um fio-guia de 0,035 polegada no vaso através da agulha. Retire a agulha sobre o fio.
- Rosqueie uma bainha arterial de 8 Fr e introduztor sobre o fio arterial e empurre até que apenas o cubo seja exposto à pele. Certifique-se de que o fio esteja sempre visível, emergindo do cubo da bainha.
NOTA: Como esta é uma bainha maior, ocasionalmente, um bisturi nº 11 pode ser necessário para criar uma pequena incisão na pele para facilitar a passagem. - Retire a bainha, o introdutor e o fio. Administrar heparina intravenosa (100-200 unidades/kg).
- Introduzir o cateter de injeção transendocárdica através da bainha e avançar para o ventrículo esquerdo através de uma abordagem retrógrada da aorta.
- Crie um mapa eletroanatômico do ventrículo esquerdo arrastando suavemente o cateter pela superfície endocárdica. Realizar rotação axial e alterações suaves da flexão da ponta para obter um bom contato endocárdico. Identifique cicatrizes, bordas e zonas remotas por cortes de tensão padrão.
- Direcionar o cateter com orientação fluoroscópica e eletroanatômica para o local de injeção preferido. Realizar rotação axial suave com deflexão da ponta distal para engajar e manter estável o contato endocárdico.
- Confirme a colocação da ponta do cateter com pelo menos duas incidências fluoroscópicas. Avançar suavemente o cateter central e, em seguida, estender a agulha até uma profundidade intramiocárdica controlada (3,5 mm para injeção apical, 5 mm para injeção septal).
- Lave 4-6 mL de contraste iodado (ver Tabela de Materiais) através do cateter de injeção até ficar visível na fluoroscopia. Observe o contraste nos próximos 10-30 s para garantir sua permanência no tecido (Figura 3A).
- Observe atentamente o ECG durante a extensão da agulha e da injeção, pois são comuns ectopias ventriculares.
NOTA: Ectopia ventricular é quando a ponta da agulha entrou em contato miocárdico. - Se a injeção de contraste for bem-sucedida, siga com uma injeção do agente de interesse. Lave com contraste até observar fluoroscopicamente.
NOTA: O agente de interesse é específico para o usuário, dependendo da terapia que ele está testando. - Retraia a agulha. Remova o cateter de injeção da bainha arterial.
- Retirar o introdutor arterial e exercer pressão nos locais por até 20 min até que a hemostasia seja alcançada.
6. Recuperação da anestesia geral
- Desligue as bombas de anestésico inalatório ou de anestésico intravenoso que estão sendo usadas. Reduza a frequência respiratória no ventilador para 8-10 respirações/min.
- Após 2-5 min, mude o ventilador para o modo de "respiração livre" por não mais de 30 s de cada vez. Observe o animal e o capnógrafo para respiração espontânea.
- Se tiver ocorrido respiração espontânea, deixe o ventilador desligado. Se o animal estiver apneico, ligue novamente o ventilador por mais 1-2 minutos e tente novamente até que a respiração espontânea seja alcançada.
NOTA: O prazo para recuperação é variável dependendo do procedimento e das características do animal, mas pode variar de 15 min a 1 h. - Uma vez que o animal esteja respirando confortavelmente (frequência respiratória de 15-30 ciclos/min, dióxido de carbono expirado inferior a 60, SpO2 acima de 95%), desconecte o oxigênio, deixando outro monitoramento conectado.
- Remova os locais temporários de acesso vascular e aplique pressão para evitar a formação de hematomas. Se o animal permanecer estável e continuar a oxigenar bem nos 5 minutos seguintes, ele pode ser transportado para sua área de recuperação.
- Após três deglutições espontâneas consecutivas, esvaziar o balonete do tubo endotraqueal e retirá-lo suavemente.
- Monitore o animal por pelo menos mais 5 minutos para garantir que ele continue oxigenando adequadamente e não encontre nenhum desconforto respiratório. O oxigénio de fluxo deve ser utilizado conforme necessário se um animal dessaturar após a extubação.
Resultados
Toracotomia e injeção de células epicárdicas
Dos 29 animais submetidos à toracotomia e injeção epicárdica, 26 sobreviveram. A análise histológica confirmou o enxerto de células humanas liberadas por este método em todos os animais sobreviventes (Figura 1E). Um animal apresentou arritmias fatais durante a injeção de células e não pôde ser ressuscitado. Outro apresentou atividade elétrica sem pulso durante o fechamento e aplicação prolongada de pressão positiva nas vias aéreas e não conseguiu se recuperar. Um terceiro animal vomitou e entrou em parada respiratória após a extubação. Este animal não pôde ser reanimado.
Dois animais tiveram complicações maiores, mas conseguiram se recuperar. Um animal desenvolveu fibrilação ventricular durante a injeção intramiocárdica e pôde ser ressuscitado com pás de desfibrilação interna e massagem cardíaca. O segundo animal vomitou na extubação e teve uma breve parada respiratória, mas conseguiu ser rapidamente reintubado e se recuperou bem. Todos esses eventos ocorreram durante os primeiros experimentos, com redução dos eventos adversos à medida que a experiência da equipe com o protocolo aumentou (Tabela 1).
Implante de minibomba osmótica de veia jugular
Nenhuma mortalidade relatada ou complicações maiores foram associadas ao implante de minibomba jugular osmótica. A maioria dos sete animais apresentou discreto edema no sítio cirúrgico nas primeiras 24 h, que se resolveu sem intervenção. O ELISA realizado no soro no dia 3 pós-implante da bomba demonstrou a eficácia da bomba, alcançando uma concentração sanguínea significativa do fator de crescimento derivado de plaquetas-AB humano (PDGF-AB) em comparação com os controles7 (Figura 2E).
Injeção transendocárdica percutânea
Um total de 22 animais recebeu injeções endocárdicas. Dessas injeções, 17 foram consideradas "bem-sucedidas", determinadas por fluorescência ou coloração de tinta observada no tecido alvo post-mortem (Figura 3B). Não houve mortalidade associada a esse procedimento. Um animal desenvolveu derrame pericárdico de pequeno volume por perfuração do ventrículo direito. Isso foi autolimitado e não resultou em comprometimento cardiovascular. Esse mesmo animal morreu; no entanto, isso foi de um procedimento adicional não relacionado após a injeção intramiocárdica.
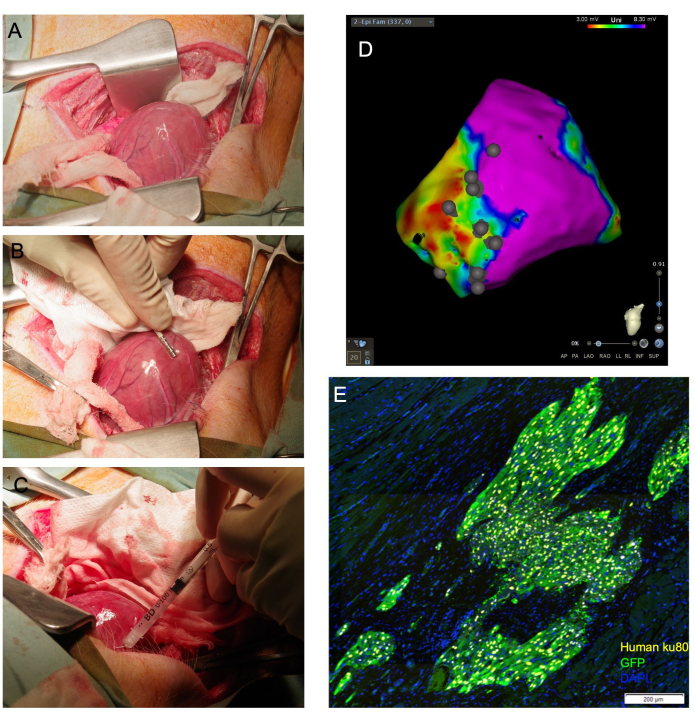
Figura 1: A injeção transepicárdica de cardiomiócitos permite a visualização cardíaca direta e alcança uma alta proporção de células viáveis liberadas ao miocárdio. (A) O ápice cardíaco é exposto através de uma tipoia de gaze umedecida guiada sob a base do coração. (B) Um cateter de mapeamento epicárdico delineia as zonas de cicatriz e borda e anota os locais de injeção. (C) Uma agulha 31 G é usada para injetar células transepicárdicas no miocárdio. (D) Mapa de voltagem epicárdica com anotação no local da injeção. Roxo: voltagem normal, miocárdio saudável; Vermelho: voltagem anormal, miocárdio doente; Pontos cinzentos: locais de injeção. Após o sacrifício, o coração é coletado e fixado em formalina para avaliação histológica a jusante. Em (E), células humanas enxertadas são detectadas por imunomarcação para o anticorpo antinuclear humano, Ku80, e um anticorpo anti-GFP. Barra de escala = 200 μm. Clique aqui para ver uma versão maior desta figura.
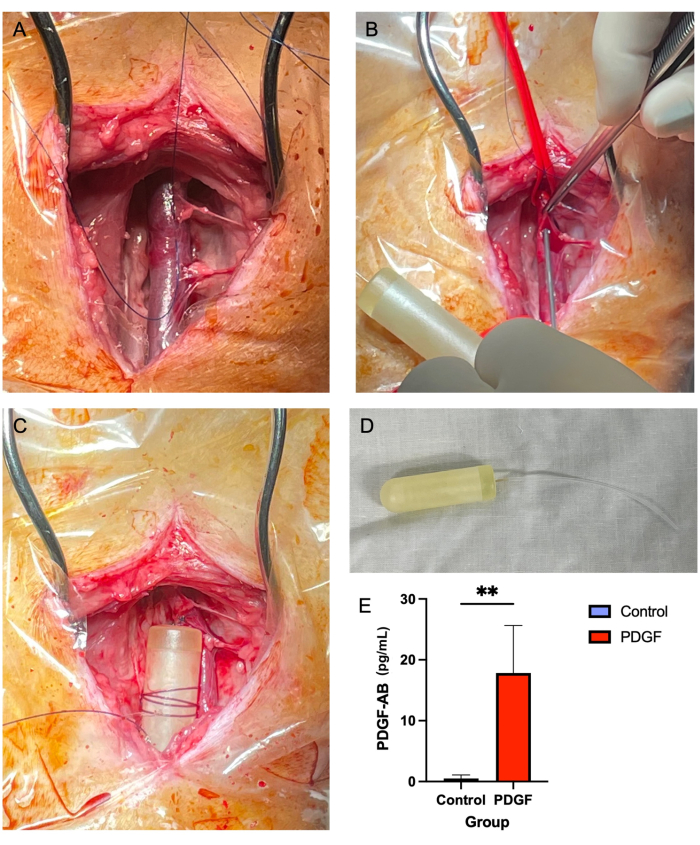
Figura 2: A inserção da minibomba da veia jugular fornece um método seguro e confiável de administração de PDGF durante um período de tempo de 7 dias . (A) A veia jugular direita é exposta, e os tecidos moles são removidos para longe do vaso. (B) Laços vasculares ocluem o vaso enquanto uma agulha 14 G é usada para fazer uma punção, através da qual a tubulação da minibomba é rosqueada. (C) A tubulação da minibomba é avançada na veia, e o corpo da minibomba é fixado ao tecido mole adjacente. (D) O corpo da minibomba e a tubulação antes da implantação. (E) A concentração sérica da proteína recombinante liberada via minibomba e do PDGF-AB foi medida por ELISA de cada animal no 3º dia pós-implante. Os animais que receberam PDGF-AB demonstraram ter uma concentração sanguínea significativamente maior de PDGF-AB do que os animais controle, confirmando a eficácia do método de administração de minibombas osmóticas. **denota diferença estatisticamente significante entre os grupos (p = 0,005, teste U de Mann-Whitney) Clique aqui para ver uma versão ampliada desta figura.
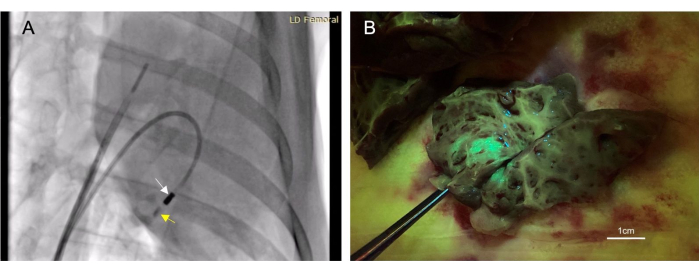
Figura 3: A injeção intramiocárdica transendocárdica permite um método terapêutico minimamente invasivo. (A) Imagem fluoroscópica oblíqua anterior direita demonstrando o cateter injetor (seta branca) administrando material de contraste (seta amarela) no miocárdio. A injeção de contraste precede e segue a injeção terapêutica para que a colocação da agulha dentro do miocárdio possa ser confirmada. (B) O vetor injetado expressou proteína fluorescente verde (GFP) de modo que o material injetado fluorescesse após a coleta do tecido, confirmando o sucesso da injeção. Clique aqui para ver uma versão maior desta figura.
| Injeção Transepicárdica (n = 29) | Injeção Transendocárdica (n = 22) | Minibomba osmótica (n = 7) | |
| Mortalidade | 3 | 0 | 0 |
| Vômitos e parada respiratória pós-operatória | 1 | 0 | 0 |
| Fibrilação ventricular durante a injeção | 1 | 0 | 0 |
| Atividade elétrica sem pulso durante o fechamento do tórax | 1 | 0 | 0 |
| Morbidade | 0 | 1 | 0 |
| Pneumotórax | 0 | 0 | 0 |
| Derrame pleural | 0 | 0 | 0 |
| Perfuração de câmaras cardíacas | 0 | 1 | 0 |
| Hemorragia | 0 | 0 | 0 |
Tabela 1: Lista de complicações.
Discussão
Injeção intramiocárdica transepicárdica
Esse procedimento tem o benefício da visualização cardíaca direta e tem demonstrado maior retenção local da terapêutica do que os métodos de administração sistêmica9,10,14. No entanto, as toracotomias são invasivas, requerem considerável habilidade técnica e apresentam maior risco de morbidade e mortalidade do que outros métodos discutidos10,15. O conhecimento das etapas críticas e precárias do procedimento pode auxiliar na mediação desse risco aumentado.
Muito cuidado deve ser tomado na manipulação do coração para expor o ápice cardíaco devido ao alto risco de arritmia e comprometimento hemodinâmico associado. A monitorização invasiva contínua da pressão arterial e o eletrocardiograma permitem a rápida identificação de hipotensão ou arritmias instáveis, facilitando a pronta intervenção e correção. A hipotensão transitória geralmente pode ser tratada com bolus de metaraminol. A hipotensão sustentada pode ser temporizada pela redução do anestésico inalatório (monitorização cuidadosa da profundidade do anestésico) e pelo início de uma infusão de vasopressores, ao mesmo tempo em que determina a causa da alteração hemodinâmica. Arritmias instáveis, como taquicardia ventricular ou fibrilação ventricular, podem ser tratadas por cardioversão elétrica com ou sem antiarrítmicos intravenosos.
Igualmente importante para a sobrevivência do animal é a remoção bem-sucedida de gás livre da cavidade pleural antes de fechar o tórax. A falha em fazê-lo pode culminar no desenvolvimento de um pneumotórax, deixando o animal com grande risco de comprometimento respiratório e morte uma vez desconectado do ventilador mecânico na recuperação. A pressão positiva nas vias aéreas deve ser mantida por pelo menos 30 s até que o borbulhamento não seja mais observado. A tubulação de silicone é prontamente removida após a cessação do borbulhamento, e o tórax é então rapidamente fechado. Também é possível colocar cirurgicamente um tubo de toracostomia no fechamento, permitindo a remoção manual de ar e líquido inflamatório nas próximas 24-72 h. Isso, no entanto, é difícil de manter limpo e intacto, especialmente se os animais estiverem alojados juntos. Danos ou contaminação do tubo podem levar a piotórax, pneumotórax ou sepse. Em nossa experiência, a inserção de um dreno torácico temporário não é necessária se o gás livre for adequadamente removido antes do fechamento do tórax.
Injeção intramiocárdica transendocárdica percutânea
Esse método de administração terapêutica tem o benefício de permitir a liberação tecidual local com menor risco devido à sua natureza menos invasiva quando comparada a uma abordagem cirúrgica10,14. Essa técnica já é utilizada em estudos com animais de grande porte, tendo como guia tanto a fluoroscopia quanto o mapeamento eletromecânico na ausência de visualização direta10,16,17.
Dado que o coração não está sob visão direta, é prudente que o processualista use vistas fluoroscópicas ortogonais ao selecionar um local de injeção. Além disso, a injeção de contraste iodado diluído antes e a liberação da terapêutica são de extrema valia na confirmação do contato miocárdico. O contato apropriado pode ser confirmado pela observação de um característico "blush miocárdico", que pode ser um dos únicos marcadores de sucesso da injeção antes da coleta de tecido. Devido ao risco de perfuração da câmara, recomenda-se também que a espessura da parede miocárdica no local de injeção selecionado seja maior que 9 mm14,16.
Minibomba osmótica venosa jugular
A minibomba osmótica é um dispositivo popular comumente empregado em estudos com pequenos animais. Tem havido crescente interesse no uso desse dispositivo em modelos animais de grande porte 7,18,19, dada a sua vantagem única de administrar um agente terapêutico em uma taxa consistente durante um período de tempo determinado. Uma possível limitação desse método é a incapacidade de alterar ou interromper as taxas de infusão do medicamento sem substituir ou remover a bomba. Isso deve ser considerado antes de testar a terapia dessa maneira.
Este estudo demonstrou que este método pode ser realizado com alta taxa de sucesso em suínos, com baixa morbidade e mortalidade. Deve-se notar que muitas estruturas vitais são adjacentes ao sítio cirúrgico, incluindo linfonodos, timo e artéria carótida. A adesão ao método e a consulta a textos anatômicos20 são fortemente recomendadas para evitar danos inadvertidos a qualquer uma dessas estruturas. A complicação mais preocupante deste método é o choque hemorrágico devido à lesão inadvertida da veia jugular ou de uma estrutura circundante. Portanto, é fundamental que o tecido mole ao redor da veia jugular seja cuidadosamente removido. A falha em completar adequadamente esta etapa pode levar à dificuldade na colocação da tubulação da minibomba ou no controle do sangramento inadvertido.
Este artigo descreveu três métodos para a realização de terapêutica cardioativa. Apesar do sucesso relatado de cada técnica, existem limitações inerentes a serem consideradas. Procedimentos invasivos (injeção transepicárdica) permitem maior acurácia da administração terapêutica; no entanto, trazem maior risco de complicações potencialmente fatais. Além disso, o parto invasivo tem maior exigência de habilidades técnicas para minimizar o risco de complicações. Da mesma forma, a injeção transendocárdica guiada por fluoroscopia requer um grau de habilidade técnica para cateterismo e manipulação de hardware. Se este método for realizado de forma inadequada, a falha da injeção e complicações fatais são possíveis.
Os métodos de injeção direta descritos permitem a administração única de uma terapêutica no tecido alvo. A minibomba osmótica venosa jugular permite a administração sistêmica de uma terapêutica durante um período de 7 dias. Comparativamente, esse método é mais simples e associado a menor risco, porém depende de um achado terapêutico sistêmico até o miocárdio. Além disso, uma vez instalada a bomba, é impossível interromper a administração ou alterar a taxa de dose sem voltar a anestesiar o animal e retirar a bomba.
Todos os métodos descritos neste artigo foram realizados em animais no dia ou 2 semanas após o infarto do miocárdio. Portanto, este trabalho não pode relatar o sucesso dos métodos mencionados em animais sadios ou submetidos a uma patologia cardíaca alternativa. Finalmente, a farmacologia e a biotecnologia de qualquer agente pretendido devem ser cuidadosamente consideradas, pois isso estará inerentemente ligado à eficácia da via de entrega escolhida. Uma discussão detalhada sobre isso está além do escopo deste manuscrito.
Representações abrangentes de métodos pré-clínicos beneficiam o bem-estar animal e a comunidade científica em geral. A consequente maior reprodutibilidade dos procedimentos e resultados leva a menos complicações de saúde animal, menor número de animais necessários para produzir resultados significativos e maior confiança nos resultados experimentais21,22. Três métodos de administração de novas terapêuticas são descritos neste artigo para o tratamento do infarto do miocárdio em modelo suíno. Ao detalhar as técnicas utilizadas e articular os benefícios e riscos de cada uma delas, espera-se que os pesquisadores sejam capazes de criar confortavelmente modelos pré-clínicos consistentes e confiáveis que atendam aos seus objetivos de pesquisa.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado por subsídios do National Health and Medical Research Council APP1194139/APP1126276 (JC), National Stem Cell Foundation of Australia e New South Wales Government Office of Health and Medical Research (JC). A DS foi apoiada pelo Royal Australasian College of Physicians, pelo Institute of Clinical Pathology and Medical Research e pelo Australian Government Research Training Program. A DT foi apoiada pelo Institute of Clinical Pathology and Medical Research, Penfolds Family Scholarship, National Health and Medical Research Council (APP2002783) e National Heart Foundation of Australia (104615).
Materiais
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
Referências
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39 (2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483 (2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. . Veterinary Sutures Handbook. , (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392 (2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897 (2016).
- Singh, B., Dyce, K. M. . Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411 (2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados