Method Article
ブタ心筋梗塞モデルにおける心役活性治療薬の送達
* これらの著者は同等に貢献しました
要約
本プロトコルは、ブタモデルにおいて心活性治療薬を投与する3つの方法を記述する。雌の在来種豚は、(1)開胸術と経心的心内膜注射、(2)カテーテルベースの経心内膜注射、または(3)頸静脈浸透圧ミニポンプ による 静脈内注入のいずれかで治療を受けました。
要約
心筋梗塞は、世界中の主要な死因の1つであり、新しい心臓保護または再生戦略が緊急に必要とされています。医薬品開発に不可欠な要素は、新規治療薬をどのように投与するかを決定することです。生理学的に関連性のある大型動物モデルは、さまざまな治療戦略の実現可能性と有効性を評価する上で非常に重要です。心血管生理学、冠動脈血管の解剖学、および心臓の重量と体重の比率がヒトと類似しているため、豚は心筋梗塞の新しい治療法の前臨床評価において好ましい種の1つです。本プロトコルは、ブタモデルにおいて心活性治療薬を投与する3つの方法を記述する。経皮的に誘発された心筋梗塞の後、雌の在来種豚は、(1)開胸術と経心外膜注射、(2)カテーテルベースの経心内膜注射、または(3)頸静脈浸透圧ミニポンプによる静脈内注入のいずれかによって新規薬剤 による 治療を受けました。各技術に採用されている手順は再現性があり、信頼性の高い心活性薬物送達を実現します。これらのモデルは、個々の研究デザインに合わせて簡単に適応させることができ、これらの提供技術のそれぞれを使用して、さまざまな可能な介入を調査することができます。したがって、これらの方法は、心筋梗塞後の心臓修復における新しい生物学的アプローチを追求するトランスレーショナルサイエンティストにとって有用なツールです。
概要
冠動脈疾患(CAD)および関連するST上昇型心筋梗塞(STEMI)は、世界中で主要な死因です。過去20年間で、経皮的冠動脈インターベンション、線溶療法、および再灌流がタイムリーに達成されるようにするための治療アルゴリズムの標準化の出現により、STEMIを呈する患者の院内死亡率の低下に大きな進歩が見られました1,2,3.それにもかかわらず、STEMIに関連する罹患率は依然として大きな負担であり、したがって、新しい心臓保護および再生療法の開発に大きなニーズが生じています2,3。治療法開発に不可欠な要素は、新規治療法をどのように投与するかを決定することです4。各方法の安全性、有効性、および実現可能性は、治療自体の特性と一致する必要があります。
生理学的に関連性のある大型動物モデルは、さまざまな治療送達戦略のこれらの属性を評価する上で重要です5。心血管生理学、冠動脈血管の解剖学、および心臓の重量と体重の比率がヒトと類似しているため、ブタは心筋梗塞の新しい治療法の前臨床評価において好ましい種の1つです6。我々は以前、ブタSTEMIモデルを用いて組換えタンパク質療法の修復能力を実証しており7、このモデルを用いた新規の薬理学的、細胞的、遺伝子的治療の研究を続けている。ここでは、梗塞作成後の豚モデルで使用される治療投与の3つの技術、すなわち開胸術および経心上膜注射、経皮的経心内膜注射、および頸静脈浸透圧ミニポンプ移植について説明する。最初の2つの方法は、局所組織送達を可能にし、必要な投与量、オフターゲット効果、および肝臓の初回通過代謝を低減します8,9,10。浸透圧ミニポンプは、半減期の短い薬剤の連続送達を可能にし、大型動物モデルでは導入が困難な輸液ポンプや特許の静脈内カニューレへの依存を排除します。
これらの技術を説明することにより、この記事は、トランスレーショナルサイエンティストが大型動物モデルで心筋梗塞後の新しい心臓保護剤または再生剤を研究するのに役立つことが期待されます。
プロトコル
すべての実験は、「科学的目的のための動物の世話と使用に関するオーストラリアのコード」に従って実施され、ウェスタンシドニー地方保健地区動物倫理委員会によって承認されました。本研究では、体重18〜20 kgの思春期前の大きな白いx在来種の雌豚を使用しました。
1.畜産
- 地元の動物倫理委員会の規則に従って動物を飼育します。
注:このプロトコルに含まれる動物は、喧嘩や怪我を避け、餌をめぐる競争がないように、個別に飼育されています。しかし、すべての動物は同種のものを見たり、聞いたり、匂いを嗅いだりすることができました。彼らのペンは、掃除がしやすいようにコンクリートの床があり、屋内と屋外の両方の保護された部分があります。豚には、屋内部分にわらの寝床が、屋外部分に濃縮の「おもちゃ」が提供されます。
2.鎮静と全身麻酔
- 鎮静
- 激しい鎮静または全身麻酔を開始する前に、動物が少なくとも12時間絶食していることを確認してください。
- 動物がまだ中心線の形で血管にアクセスできない場合は、筋肉内鎮静プロトコルを使用します。
- 筋肉内鎮静は、8 mg/kg のケタミン、0.3 mg/kg のミダゾラム、0.2 mg/kg のメタドン、および 10 μg/kg のメデトミジンで構成されます ( 資料表を参照)。この混合物を21Gの針で動物のエピキシャル筋肉組織に投与します。平均して、動物は重度の鎮静状態になるまでに5〜10分かかります。
注:ストレスを受けた豚は鎮静剤に対してより耐性があります。落ち着いて自信のあるハンドラーが動物を落ち着かせ、動物に過度のストレスを与えないようにします。動物がストレスを感じた場合は、5〜10分間放っておいて、もう一度やり直すのが最善です。 - 静脈内鎮静を行うのは、中心線が整い、特許を取得している場合です。静脈内鎮静は、2 mg/kg のケタミン、0.2 mg/kg のミダゾラム、0.2 mg/kg のメタドン、および 2 μg/kg のメデトミジンで構成されます。
- 開存性を確保するために、最初に静脈内ラインを0.9%塩化ナトリウムで洗い流します。.次に、混合シリンジの半分をゆっくりとラインに押し込み、0.9%塩化ナトリウムで洗い流します。
- 20〜30秒以内に重く鎮静する必要がある動物を観察します。動物がまだ鎮静されていない場合は、ステップ2.1.5の説明に従って、シリンジの残りの半分を洗い流します。.
- 血管アクセス
- 適切に鎮静されたら、豚を手術室に運びます。
- フェイスマスクと5 L / minの酸素流量で豚に事前に酸素化します。パルスオキシメータを豚の尻尾、耳、または舌に接続して、動物全体を監視します。
- 22Gまたは24Gのカニューレを使用して、左右の耳の辺縁静脈にアクセスし、テープで固定します。
- 全身麻酔
- 豚を胸骨横臥に置きます。
- 1〜3 mg / kgのプロポフォール( 材料表を参照)をゆっくりと滴定して静脈内投与します。.介助者に動物の口を開けてもらい(この段階では顎が緩んでいるはずです)、首を伸ばしてもらいます。
- 喉頭鏡( 資料表を参照)を使用して、舌と喉頭蓋の基部を押し下げ、喉頭の披裂軟骨を露出させます。
- 潤滑剤を塗布した気管内チューブ(サイズ5.5または6.0、 材料表を参照)をスタイレットで蓋骨軟骨に通し、気管に通します。時折、喉頭を通過するときに抵抗を感じることがあります。これは、気管内チューブを穏やかに回転させることで対抗できます。動物が挿管に抵抗している場合は、より多くのプロポフォールを静脈内投与します。
- 気管内チューブからスタイレットを取り外します。チューブの周囲に空気漏れがないことを確認するまで、気管内チューブカフを膨らませます。一般的に、4〜6 mLの空気が必要ですが、容量はチューブのサイズや動物によって異なります。
- 気管内チューブを動物の耳の後ろに固定します。
- 動物を容積制御人工呼吸器機能を備えた再呼吸麻酔回路に接続します。動物が接続されたら、人工呼吸器を「オフ」にします。
注意: 調整可能な圧力制限(APL)バルブ、または「ポップオフバルブ」が常に開いていることを確認してください。バルブを開いたままにしないと、動物に致命的な圧外傷を引き起こす可能性があります。 - 麻酔回路の酸素流量を2L/minに減らします。
- 陽圧換気装置を「ボリュームコントロール」モードに設定します。一回換気量を10mL / kg、呼吸数を20呼吸/ minに設定します。吸気と呼気の比率が1:2に設定されていることを確認します。
- 手順全体を通して、呼吸数を操作して、潮汐終末の二酸化炭素が35〜50 mmHgの間にあることを確認します。
注意: 吸気圧は20 cmH2Oを超えてはなりません。 吸気圧の上昇は、チューブのねじれや詰まりの調査を促します。チューブに関連しない圧力の上昇を緩和するために、吸気と呼気の比率を1:1.5に減らし、一回換気量を減らすことができます。 - 動物の血行動態が安定している場合は、吸入麻酔で維持します。動物の血行動態が安定していない場合は、ステップ2.3.14で説明したように、静脈内麻酔で維持します。.
- 動物に吸入麻酔を投与する場合は、麻酔回路が最初に接続された瞬間から2.5%イソフルランから始めます。.
- 次の30分間、動物を1.5%吸入イソフルランまで徐々に離乳させます。.処置が終了するまで、動物を1.5%イソフルランで維持します。
- 眼瞼反射をチェックし、顎の緊張をテストすることにより、10分ごとに麻酔の深さを評価します。麻酔の深さを維持するために、必要に応じてイソフルランを調整します。.
- 動物の血行動態が不安定な場合は、静脈内麻酔で維持し、吸入麻酔薬に関連する心血管合併症を起こさずに、麻酔の深さをより深く制御できるようにします。
- シリンジポンプまたはプロポフォール、フェンタニル、ミダゾラムを含む標準的な流体ポンプを準備します。これらを共通の回線 で 動物に接続します。
注:プロポフォールは0.1〜0.6 mg / kg / min、フェンタニルは1〜5 μg / kg / h、ミダゾラムは0.05〜0.2 mg / kg / hで実行できます。. - 吸入麻酔と同様に、これらの薬を滴定して麻酔全体に効果を発揮し、適切な麻酔深度を維持します。.
- シリンジポンプまたはプロポフォール、フェンタニル、ミダゾラムを含む標準的な流体ポンプを準備します。これらを共通の回線 で 動物に接続します。
- 0.9%塩化ナトリウムまたはハルトマン溶液( 材料表を参照)を5 mL / kg / hの速度で静脈内輸液サポートを提供します。.
- 血圧測定、カプノグラフィー、麻酔ガスモニタリング、体温、パルスオキシメトリー、心電図検査で動物を監視します。
- すべての手順を通じて、前投薬後4時間ごとに0.2 mg / kgのメタドンの形で追加の鎮痛剤を静脈内投与します。.
注:鎮痛は、動物が麻酔下で痛みの兆候を示す場合(頻脈、維持薬を変更せずに麻酔の深さを軽くした場合)より短い間隔で投与できます。
3. 中心線の配置
- 豚を後肢を伸ばし、左前肢を伸ばし、右前肢を曲げてネクタイで固定した背臥位に置きます。
- 豚の首を無菌的に準備し、ドレープで覆います。
- 滅菌カバー付きの線形超音波プローブ( 材料表を参照)を使用して、右頸静脈を見つけます。これは、プローブを気管に対して垂直に向け、喉頭から横方向にゆっくりと動かすことで最もよく達成されます。
- カラードップラーモードを有効にして、頸静脈の識別に役立てます。頸静脈は、虚脱性と連続的で非拍動性の流れを示すことにより、頸動脈と区別できます。
- 18 Gのクック針( 材料表を参照)を使用して、超音波ガイド下で静脈にアクセスします。アクセスができたら、0.035インチのJチップワイヤー( 材料表を参照)を針に通し、容器に通します。針をワイヤーから外します。
- 事前にフラッシュされた中心線をワイヤーに通し、静脈に押し込みます。ワイヤーがラインの遠位端から常に出ているのが見えることを確認してください。
注:5 Fr、2ルーメンの中心静脈カテーテル( 資料表を参照)は、1〜4週間にわたって静脈内アクセスを必要とする被験者に使用されました。 - ラインを皮膚を通して前進させるのが難しい場合は、No.11メスを使用して2〜4mmの小さな切開を行い、ワイヤー上のラインの通過を容易にします。陰圧をかけた後、各外部ラインにフラッシュを加えて開存性を確保します。各行をクランプします。
- 付属のアンカーを外部ラインに取り付け、2-0または3-0の非溶解性縫合糸で所定の位置に固定します( 材料表を参照)。動物が噛まないように、外側の線を背側に固定するために追加の縫合糸を配置します。
- フラッシュされた延長ラインを外部カテーテルラインに取り付け、クランプオフします。
- 動物に市販の豚用ジャケット( 材料表を参照)を取り付け、内側に線を固定します。同じ麻酔薬中に他の処置がまだ行われていない場合は、動物の回復の直前にジャケットを装着してください。
4.心筋梗塞
注:このモデルで使用された動物は、以前に発表された方法7に従って心筋梗塞を受けました。
- 経心外膜および経心内膜注射手順の2週間前に心筋梗塞を実行します8,9,10。浸透圧ミニポンプ移植は、同じ手順で冠状動脈再灌流の直後に行われました。
5.薬物または細胞投与
- 開胸術と心外膜細胞注射
- 22 mg / kgのセファゾリンの形で静脈内予防的抗生物質を投与します( 材料表を参照)。手順全体を通して90分ごとに続けます。
- 動物を右横臥位に置きます。
- 100 μg/hのフェンタニルパッチ( 材料表を参照)を豚の耳の後ろの平らな面に塗布します。接着性ドレッシングまたは2-0縫合糸で覆います。
注:このパッチは、配置後12時間で「アクティブ」と見なされ、72時間鎮痛を提供します。 - 電気解剖学的マッピングシステムのケーブルとパッチは、製品仕様に従ってセットアップします( 材料表を参照)。
- 動物の肋骨4と5の間に10cmの水平線をクレヨンまたは外科用マーカーでマークします。
- リドカイン(2 mg / kg)とブピバカイン(1 mg / kg)の混合物を25 G針で1本のシリンジに調製します。.
- 手術部位を無菌的に準備し、動物をドレープします。針を浅い角度で皮膚に挿入し、プランジャーを少し引いて注射器に血液が逆流しないようにし、針を皮膚から引き抜くときに溶液をゆっくりと注入することにより、マークされた切開部位に皮膚ラインブロックを行います。このプロセスを繰り返しながら、線を下に移動します。
注:ブピバカインが血管内に投与されないように、新しい注射部位のシリンジに陰圧をかける必要があります。.血管内ブピバカインは急速に致命的になる可能性があります。. - No.22メスを使用して、マークされた線に沿って10cmの皮膚切開を行います。
- 単極焼灼( 材料表を参照)を使用して、肋間筋に達するまで、下にある筋肉層を切開します。
- 0.5 mg / kgのブピバカインと1 mg / kgのリグノカインの滅菌シリンジを準備し、25 Gの針を取り付けます。.
- 第4肋骨の尾側縁に浅い角度で針を挿入します。プランジャーに陰圧を加えて、針が肋間静脈または動脈を通過していないことを確認します。針を静止させたまま、シリンジの容量の4分の1をゆっくりと注入します。
- 手順5.1.12を、4番目の肋骨の尾側縁に沿って3〜5 cm離して、さらに3か所で繰り返します。
- メッツェンバウムのハサミ( 資料表参照)を使用して肋間筋を慎重に切開し、麻酔科医に確認した後、胸膜を切開します。
- 胸膜を切開したら、人工呼吸器をオフにして、肺が胸膜から離れるようにします。切開後、人工呼吸器をオンに戻し、呼気終末陽圧を4cmH2Oに調整します。
- 自己保持型のリブリトラクターを肋骨の間に置き、ゆっくりと開いて心臓を露出させます。組織鉗子を使用して心膜を静かにつかみ、メッツェンバウムのハサミで切開して心臓を外在化させます。
注意: このステップと次のいくつかのステップでは、不整脈が一般的です。心電図を注意深く監視する必要があり、動物が血行動態が不安定になった場合(平均動脈圧が55 mmHg未満)の場合は、心臓操作を一時的に停止する必要があります。.メタラミノール(0.25 mg)の静脈内ボーラスは、血圧を改善するために必要に応じて投与されます。. - 心膜切開部の両端と側面に一時的な2-0ステイ縫合糸を配置して胸壁に固定し、心膜ウェルを作成します。心膜の側面が支えられ、心膜ができるだけ浅くなっていることを確認してください。
- 湿らせた綿棒または開腹スポンジを使用して、心臓の周囲の領域を詰めます。これは、心臓を安定させ、露出した組織の乾燥を防ぐのに役立ちます。
- 左心室の後ろの人差し指で心膜腔内から心臓の頂点を送達します。左心室の圧迫を最小限に抑えるように注意してください。.
注:健康な心臓は、頂点が垂直を向いていて快適に鼓動し、穏やかなサポートでベースに座っていますが、圧迫はありません。操作に関連する血圧の初期低下がありますが、これは外部心室圧迫がない場合に許容レベルまで回復する必要があります。- 15秒で回復が起こらないか、非常に遅い場合は、すぐに心臓を心膜腔に戻し、さらに脱臼する前に血行動態パラメーターを改善するために必要な措置を講じます。.
注意: 心室が脱臼する可能性がある場合は、心室を支えるために心膜内に適切なサイズのガーゼパックを配置することで、心膜の外側の頂点の位置を維持できます。.同様に、細長く湿らせた綿棒を心臓の基部の下に配置することができ、心臓の頂点を切開部に向かって上向きに導く「スリング」として機能します(図1A)。
- 15秒で回復が起こらないか、非常に遅い場合は、すぐに心臓を心膜腔に戻し、さらに脱臼する前に血行動態パラメーターを改善するために必要な措置を講じます。.
- 電気生理学的マッピングカテーテルを使用して、左心室心外膜表面の電気解剖学的電圧マップを作成します(図1B)。瘢痕、境界、およびリモートゾーンを標準電圧カットオフで識別します。
注:瘢痕とリモートゾーンは、それぞれ<0.5mVまたは>1.5mVのバイポーラカットオフ、および<3mVまたは>8.3mVのユニポーラカットオフで定義されました11,12。 - 27G治療用送達シリンジの針を約80〜90°の角度に曲げます。.
- 針を浅い角度で標的組織に進め、シリンジプランジャーに圧力をかけて、総量の1/4〜1/3を排出します。組織の白化を観察する必要があります(図1C)。電気生理学的マッピングカテーテルを使用して、生成された心外膜電圧マップ上の注射部位の位置に注釈を付けます(図1D)。
注:細胞培養培地(RPMI 1640)からなるビヒクル注入は、ビデオプロトコルのデモンストレーション目的で使用しました。 - 針を部分的に引き抜き、心筋内に方向転換します。シリンジの容積のさらに1/4〜1/3を排出します。シリンジが空になるまで続けます。.
- 目的の用量が送達されるまで、手順5.1.20〜5.1.24を繰り返します。.
- 心臓から詰まっている綿棒を取り除き、心臓の下の「スリング」をそっと取り外して、ニュートラルな位置に戻します。このステップでは不整脈が一般的であり、ステップ5.1.17で説明されているように注意が必要です。
- 心膜から2-0ステー縫合糸を取り除きます。リトラクターを緩め、胸部から取り外します。
- 先端が鈍い丸い針を備えたサイズ1のポリジオキサノン縫合糸(PDS)を使用して、胸部を肋骨3と4、および肋骨5と6の間のスペースに通して胸部を閉じます。
注:幅の狭い8の字縫合糸は、肋骨を近似するためのプーリー効果を提供します。動物の大きさに応じて、2つまたは3つのそのような縫合糸を使用する必要があります。 - 肋骨近似縫合糸を締めて縛る前に、短い長さのシリコンチューブを切開部の腹側端に挿入します。
- チューブの自由端を滅菌生理食塩水のボウルに入れて、胸膜腔の水中密閉ドレナージを行います。
- 上にある筋肉層を、2-0の吸収性縫合糸で単純な連続パターンで閉じます。2-0または3-0の非吸収性縫合糸で単純な連続またはフォードインターロッキングパターン13 で皮膚を閉じます。
- 創傷閉鎖が完了したら、陽圧換気の効果により胸部から自由空気を排出します。
- 人工呼吸器を「自由呼吸」設定にします。再呼吸回路のリザーバーバッグを使用して、気道に一貫した陽圧を供給します(20〜30 cmH2Oに維持します)。
- 生理食塩水ボウルに気泡が観察されなくなり、胸部内に自由空気がないことを示すまで、この圧力を続けます。
- シリコンチューブを取り外します。
- 手術部位に接着性ドレッシングを塗布し、ドレッシングを所定の位置に保つのを助けるために、散在する単純な中断縫合糸を配置します。
- 回復時に、0.3 mg / kgのメタドンを皮下投与し、0.2〜0.5 mg / kgのオンダンセトロンを静脈内投与します( 材料表を参照)。.
- 頸静脈浸透圧ミニポンプ移植術
- ステップ3.1の説明に従って動物を配置します。動物の首の右側を無菌的に準備し、ドレープします。
- No.22メスの刃を使用して、胸骨の横2〜10cmの点から頭側に8〜3cmの切開を行います。この切開は、頭蓋方向に動くにつれて、わずかに側方になる必要があります。
- メッツェンバウムはさみを使用して、皮膚結腸、sternohyoideus、およびsternocephalicusの筋肉を解剖します。鈍い解剖法を使用して、外頸静脈が見えるまで切開を深めます。
- 切開部に自己保持リトラクターを配置し、それらを開くと視認性が向上します。
- Adson褐色組織鉗子( 材料表を参照)とMetzenbaumハサミを使用して、頸静脈の周囲の軟部組織を上下に除去します(図2A)。後の段階では、血管を覆う軟部組織がミニポンプチューブの通過を妨げる可能性があるため、これは重要なステップです。
- 血管の最も尾側に見える端から約1cmの頭蓋静脈の尾側露出端に5-0の吸収性縫合糸を使用します。5mmの「噛み合わせ」で縫合糸を、頭蓋から尾側へ右側、右から左へ、尾側から頭蓋へ左側に通します。結果のパターンは「正方形の 3 辺」として表示される必要があります。両端からの縫合糸テールの長さが等しいことを確認します。
- ミニポンプは、製品の取扱説明書( 部品表を参照)の説明に従って組み立てます。
- 頭蓋端と尾端の両方で血管の周りに伸縮性のある血管を結びます。最初はこれらを緩めておきます。助手に血管の結びつきに張力をかけてもらい、血管を閉塞させます。
- 14Gの針を使用して、縫合糸で作成した「3面の正方形」の中央にある静脈に穿刺を作成します(ステップ5.2.7; 図2B)。
- ミニポンプチューブをパンクにねじ込みます。それは容器に容易に通らなければなりません。抵抗に遭遇した場合は、押し続けないでください。代わりに、チューブを抜いて再試行してください。
- 容器の外側に1〜2cm残るまでチューブを進めます。カテーテルチューブの周りの縫合糸を締め、簡単な断続結び目で結びます。助手に血管の結びつきを外してもらいます。
- 2-0の非吸収性縫合糸をミニポンプ本体に数回巻き付け、縫合糸がポンプに固定されるように結びます。次に、ポンプを近くの軟部組織に簡単な断続結び目で固定します(図2C、D)。
- 切開部からリトラクターを取り外します。標準的な3層のシンプルな連続閉鎖で切開部を閉じます。
- 回復中に0.2 mg / kgのメロキシカムを皮下投与します。.
- 経皮的経心内膜注射
- 前肢と後肢を伸ばした状態で動物を背臥位に置き、紐で固定します。
- 動物の尾腹部と内側大腿部を無菌的に準備します。有窓大腿骨血管造影ドレープで動物をドレープします( 材料表を参照)。
- 電気解剖学的マッピングシステムのケーブルとパッチは、製品仕様に従ってセットアップします( 材料表を参照)。
- リニア超音波プローブを使用して、大腿動脈を特定します。超音波ガイド下で、大腿動脈にクック針を刺し、針 を介して 0.035インチのガイドワイヤーを血管に通します。針をワイヤーから外します。
- 8 Frの動脈シースとイントロデューサーを動脈ワイヤーに通し、ハブのみが皮膚に露出するまで押し込みます。ワイヤーが常に見え、シースのハブから出ていることを確認してください。
注:これは大きな鞘であるため、通過を容易にするために小さな皮膚切開を作成するために11番メスが必要になる場合があります。 - シースイントロデューサーとワイヤーを取り外します。静脈内ヘパリン(100-200単位/ kg)を投与します。
- 経心内膜注射カテーテルをシースから導入し、逆行性大動脈アプローチ を介して 左心室に進みます。
- カテーテルを心内膜表面を横切って静かにドラッグすることにより、左心室の電気解剖学的マップを作成します。軸方向の回転と先端の屈曲の穏やかな変化を行い、良好な心内膜接触を実現します。瘢痕、境界、遠隔地を標準電圧カットオフで識別します。
- 透視および電気解剖学的ガイダンスを使用してカテーテルを希望の注入位置に向けます。遠位先端をたわませて穏やかな軸方向回転を行い、安定した心内膜接触を噛み合わせ、維持します。
- カテーテル先端の配置を少なくとも2つの透視図で確認します。コアカテーテルを静かに進めてから、針を制御された心筋内深さ(心尖注射の場合は3.5 mm、中隔注射の場合は5 mm)まで伸ばします。
- 4〜6 mLのヨウ素化造影剤( 材料表を参照)を注射カテーテルを通して、透視検査で見えるまで洗い流します。次の10〜30秒間コントラストを観察して、組織内に残っていることを確認します(図3A)。
- 心室異所性の実行が一般的であるため、針の延長と注射の間、心電図を注意深く観察します。
注:心室異所性は、針先が心筋に接触した場合です。 - 造影剤注入が成功した場合は、目的の薬剤の注入でフォローアップします。透視で観察されるまで、これを造影剤で洗い流します。
注:関心のある薬剤は、テストしている治療法に応じて、ユーザーに固有です。 - 針を引っ込めます。注射カテーテルを動脈シースから外します。
- 動脈鞘を取り外し、止血が達成されるまで最大20分間部位に圧力をかけます。
6.全身麻酔薬の回復。
- 使用されている吸入麻酔薬または静脈内麻酔ポンプの電源を切ります。.人工呼吸器の呼吸数を8〜10呼吸/分に減らします。.
- 2〜5分後、人工呼吸器を一度に30秒以内の「自由呼吸」モードに切り替えます。動物とカプノグラフの自発呼吸を観察します。
- 自発呼吸が発生した場合は、人工呼吸器の電源を切ったままにします。動物が無呼吸状態の場合は、人工呼吸器をさらに1〜2分間オンに戻し、自発呼吸が達成されるまで再試行してください。
注:回復の時間枠は、手順と動物の特性によって異なりますが、15分から1時間の範囲です。 - 動物が快適に呼吸できるようになったら(呼吸数15〜30回/分、潮汐終末二酸化炭素が60未満、SpO2が95%以上)、酸素を切断し、他のモニタリングを接続したままにします。
- 血管アクセスの一時的な部位を取り除き、血腫の形成を防ぐために圧力をかけます。動物が安定し、次の5分間にわたって酸素化が十分に続く場合は、回復エリアに輸送できます。
- 3回連続して自然飲み込んだ後、気管内チューブのカフを収縮させ、チューブを静かに取り外します。
- 動物が適切に酸素を供給し続け、呼吸困難が発生しないように、少なくともさらに5分間動物を監視します。フローバイ酸素は、抜管後に動物が不飽和度になった場合に必要に応じて使用します。
結果
開胸術と心外膜細胞注射
開胸術と心外膜注射を受けた29匹の動物のうち、26匹が生存した。組織学的分析により、生存しているすべての動物において、この方法によって送達されたヒト細胞の生着が確認されました(図1E)。1匹の動物は細胞注射中に致命的な不整脈を経験し、蘇生できませんでした。もう1人は、閉鎖中に脈拍のない電気的活動を経験し、気道に陽圧が長時間加えられ、回復することができませんでした。3匹目の動物は、抜管時に嘔吐し、呼吸停止に陥った。この動物は蘇生できませんでした。
2匹の動物が大きな合併症を経験しましたが、回復することができました。1匹の動物は心筋内注射中に心室細動を発症し、体内の除細動パドルと心臓マッサージで蘇生することができました。2匹目の動物は抜管時に嘔吐し、短時間の呼吸停止がありましたが、迅速に再挿管することができ、順調に回復しました。これらの事象はすべて初期の実験中に発生し、プロトコルに関するチームの経験が増加するにつれて有害事象は減少しました(表1)。
頸静脈浸透圧ミニポンプ移植術
頸動脈浸透圧ミニポンプの移植に関連する死亡率または重篤な合併症の報告はなかった。7匹の動物のほとんどが、最初の24時間以内に手術部位に軽度の腫脹を経験し、介入なしで治癒した。ポンプ移植後3日目に血清に対してELISAを実施したところ、ポンプの有効性が実証され、対照群と比較して 血小板由来成長因子-ABヒト(PDGF-AB)の血中濃度が有意に向上しました7(図2E)。
経皮的経心内膜注射
合計22匹の動物が心内膜注射を受けました。これらの注射のうち、17 回は「成功」と見なされ、死後検査で標的組織に観察された蛍光またはインク染色によって決定されました(図 3B)。この処置に関連する死亡例はなかった。1匹の動物は、右心室穿孔から少量の心嚢液貯留を発症しました。.これは自己限定的であり、心血管系の障害には至らなかった。この同じ動物は確かに死んだ。しかし、これは心筋内注射後の無関係な追加処置によるものでした。
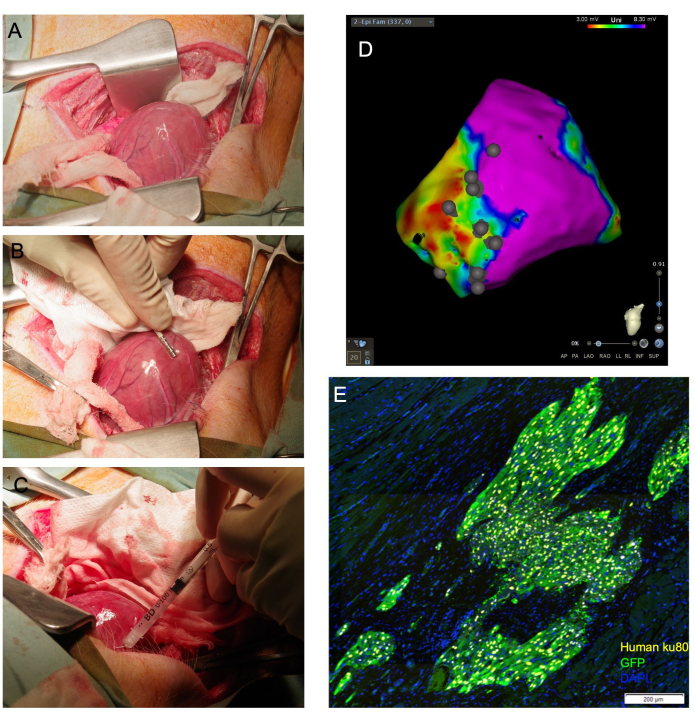
図1:経心外膜心筋細胞注射は、心臓を直接可視化し、心筋に送達される生細胞の割合を高くします。 (A)心臓の頂点は、心臓の基部の下に導かれた湿らせたガーゼスリングを通して露出します。(B)心外膜マッピングカテーテルは、瘢痕と境界ゾーンを描写し、注射部位に注釈を付けます。(C)31Gの針を使用して、細胞を心筋に経心的に注入します。(D)注射部位のアノテーションを含む心外膜電圧マップ。紫色:正常な電圧、健康な心筋。赤:異常な電圧、病気の心筋;灰色の点:注射部位。犠牲の後、心臓は収集され、下流の組織学的評価のためにホルマリン固定されます。(E)では、ヒト抗核抗体Ku80と抗GFP抗体を免疫染色することにより、生着したヒト細胞を検出します。スケールバー = 200 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
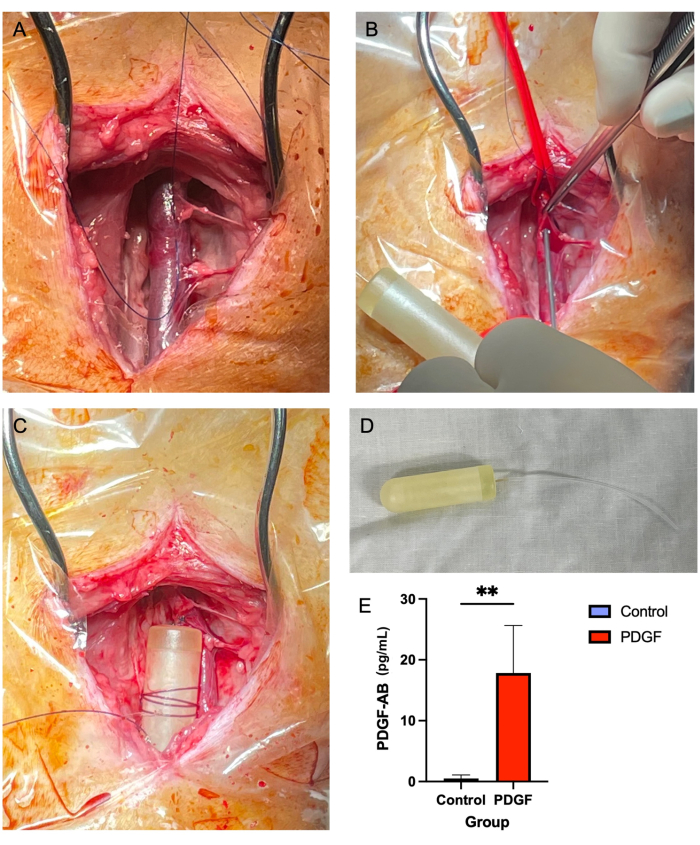
図2:頸静脈ミニポンプ挿入は、7日間にわたってPDGFを安全かつ確実に送達する方法を提供します 。 (A)右頸静脈が露出し、軟部組織が血管から取り除かれます。(B)14Gの針を使用して穿刺し、ミニポンプチューブに通す間、血管タイが血管を閉塞します。(C)ミニポンプチューブを静脈内に進め、ミニポンプ本体を隣接する軟部組織に固定する。(D)移植前のミニポンプ本体とチューブ。(E)ミニポンプとPDGF-AB を介して 送達された組換えタンパク質の血清濃度は、移植後3日目に各動物からELISAを使用して測定されました。PDGF-ABを投与された動物は、対照動物よりもPDGF-ABの血中濃度が有意に高いことが示され、浸透圧ミニポンプ投与法の有効性が確認されました。**はグループ間の統計的に有意な差を示します(p = 0.005、Mann-Whitney U検定) この図の拡大版をご覧になるには、ここをクリックしてください。
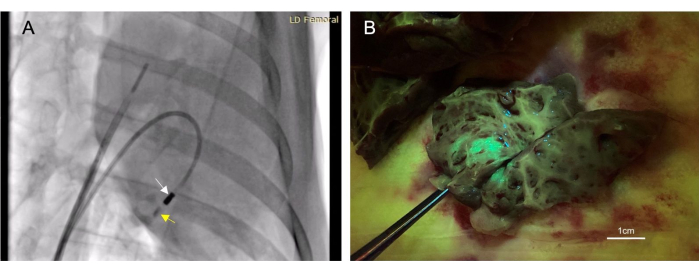
図3:経心内膜心筋内注射は、低侵襲治療薬の投与方法を可能にします。 (A)造影剤(黄色矢印)を心筋に注入する注射カテーテル(白矢印)を示す右前方斜め透視画像。造影剤の注射は、心筋内の針の配置を確認できるように、治療注射の前後に行われます。(B)注入したベクターは緑色蛍光タンパク質(GFP)を発現し、注入された物質が組織採取時に蛍光を発し、注入の成功が確認されました。 この図の拡大版をご覧になるには、ここをクリックしてください。
| 経心外膜注射(n = 29)。 | 経心内膜注射(n = 22) | 浸透圧ミニポンプ(n = 7) | |
| 死亡率 | 3 | 0 | 0 |
| 術後の嘔吐と呼吸停止 | 1 | 0 | 0 |
| 注射中の心室細動 | 1 | 0 | 0 |
| 胸部閉鎖時のパルスレス電気的活動 | 1 | 0 | 0 |
| 罹患 率 | 0 | 1 | 0 |
| 気胸 | 0 | 0 | 0 |
| 胸水 | 0 | 0 | 0 |
| 心室穿孔 | 0 | 1 | 0 |
| 出血 | 0 | 0 | 0 |
表1:合併症のリスト。
ディスカッション
経心外膜心筋内注射
この手順には、心臓を直接視覚化できるという利点があり、全身投与方法よりも治療薬の局所保持率が高いことが実証されています9,10,14。しかし、胸腔切開術は侵襲的であり、かなりの技術的スキルを必要とし、議論されている他の方法よりも罹患率と死亡率のリスクが高くなります10,15。手順の重要で不安定な段階に関する知識は、この増加したリスクの調停に役立ちます。
不整脈とそれに伴う血行動態の障害のリスクが高いため、心臓の頂点を露出させるために心臓を操作する際には細心の注意を払う必要があります。継続的な侵襲的血圧モニタリングと心電図検査により、低血圧や不安定な不整脈を迅速に特定し、迅速な介入と矯正を容易にします。一過性低血圧は、通常、メタラミノールボーラスで治療できます。.持続的な低血圧は、吸入麻酔薬を減らし(麻酔の深さを注意深く監視)、昇圧剤の注入を開始すると同時に、血行動態の変化の原因を特定することで一時的になる場合があります。.心室頻拍や心室細動などの不安定な不整脈は、静脈内抗不整脈薬の有無にかかわらず、電気除細動によって治療できます。.
動物の生存にとって同様に重要なことは、胸腔を閉じる前に胸膜腔から遊離ガスをうまく除去することです。これを怠ると、気胸を発症し、回復時に人工呼吸器から切り離されると、動物は呼吸障害や死亡の大きなリスクにさらされます。気道陽圧は、気泡が観察されなくなるまで少なくとも30秒間維持する必要があります。.シリコンチューブは、バブリングが止まると速やかに取り外され、胸部は急速に閉じられます。また、胸腔瘻造設チューブを閉鎖時に外科的に留置することも可能であり、次の24〜72時間にわたって手動で空気と炎症性液体を除去することができます。しかし、これは、特に動物が一緒に飼育されている場合、清潔で無傷に保つことは困難です。チューブの損傷や汚染は、膿胸、気胸、または敗血症につながる可能性があります。私たちの経験では、胸部閉鎖前に遊離ガスが適切に除去されていれば、一時的な胸腔ドレーンを挿入する必要はありません。
経皮的経心内膜心筋内注射
この治療的投与方法は、外科的アプローチと比較して侵襲性が低いため、リスクの低い局所組織送達を可能にするという利点があります10,14。この手法は、すでに大動物の研究で使用されており、直接可視化がない場合のガイドとして、透視法と電気機械マッピングの両方を使用しています10,16,17。
心臓が直視されていないことを考えると、処置者は注射部位を選択する際に直交透視図を使用するのが賢明です。さらに、治療薬の投与前および送達前の希釈ヨウ素造影剤の注射は、心筋接触を確認する上で非常に貴重である。適切な接触は、組織採取前の注射成功の唯一のマーカーの1つである可能性のある特徴的な「心筋赤面」を観察することによって確認できます。チャンバー穿孔のリスクがあるため、選択した注射部位の心筋壁の厚さも9mmより大きくすることをお勧めします14,16。
頸静脈浸透圧ミニポンプ
浸透圧ミニポンプは、小動物実験で一般的に使用される一般的な装置です。治療薬を一定期間一定の割合で投与するという独自の利点から、大型動物モデル7,18,19でこのデバイスを使用することへの関心が高まっています。この方法の考えられる制限は、ポンプを交換または取り外さずに薬物の注入速度を変更または停止できないことです。.この方法で治療を試す前に、これを考慮する必要があります。.
この研究は、この方法が豚で高い成功率で、罹患率と死亡率が低いことを実証しました。リンパ節、胸腺、頸動脈など、多くの重要な構造が手術部位に隣接していることに注意する必要があります。これらの構造のいずれかへの不注意な損傷を防ぐために、方法の遵守、および解剖学的テキスト20の相談を強くお勧めします。この方法の最も懸念される合併症は、頸静脈または周囲の構造への不注意な損傷による出血性ショックです。したがって、頸静脈を取り巻く軟部組織を慎重に除去することが重要です。このステップを適切に行わないと、ミニポンプチューブの配置や不注意による出血の制御が困難になる可能性があります。
この記事では、心役活性治療薬を送達するための3つの方法について説明しました。各手法の成功が報告されているにもかかわらず、考慮すべき固有の制限があります。侵襲的処置(経心外膜注射)により、治療送達の精度が向上します。しかし、それらは潜在的に致命的な合併症のリスクを高めます。さらに、侵襲的な分娩では、合併症のリスクを最小限に抑えるための技術的スキルがより必要になります。同様に、透視ガイド下経心内膜注射には、カテーテル挿入とハードウェアの操作にある程度の技術的スキルが必要です。この方法が不適切に行われると、注射の失敗や致命的な合併症を引き起こす可能性があります。
記載された直接注射法は、標的組織への治療薬の1回限りの投与を可能にする。頸静脈浸透圧ミニポンプは、7日間にわたる治療薬の全身投与を可能にします。比較的、この方法はより単純でリスクが少ないですが、心筋への道を見つける全身治療に依存しています。さらに、ポンプが設置されると、動物を再麻酔してポンプを取り外さずに投与を中止したり、線量率を変更したりすることは不可能です。
この記事に記載されているすべての方法は、心筋梗塞の日または2週間後に動物で行われました。したがって、この研究は、健康な動物または代替の心臓病理を受けた動物における上記の方法の成功を報告することはできません。最後に、意図する薬剤の薬理学とバイオテクノロジーは、選択した送達経路の有効性に本質的に関連しているため、慎重に検討する必要があります。これに関する詳細な議論は、この原稿の範囲を超えています。
前臨床法の包括的な描写は、動物福祉とより広い科学コミュニティに利益をもたらします。その結果、手順と結果の再現性が向上し、動物の健康上の合併症が減少し、有意な結果を出すために必要な動物の数が減り、実験結果の信頼性が高まります21,22。この記事では、ブタモデルにおける心筋梗塞の治療のために、新規治療薬の3つの投与方法について説明します。使用される技術を詳細に説明し、それぞれの利点とリスクを明確にすることで、研究者は研究目標に合った一貫性のある信頼性の高い前臨床モデルを快適に作成できるようになることが期待されます。
開示事項
著者は何も開示していません。
謝辞
この研究は、National Health and Medical Research Council APP1194139/APP1126276(JC)、National Stem Cell Foundation of Australia、New South Wales Government Office of Health and Medical Research(JC)からの助成金によって資金提供されました。DSは、Royal Australasian College of Physicians、Institute of Clinical Pathology and Medical Research、およびAustralian Government Research Training Programの支援を受けました。TDは、Institute of Clinical Pathology and Medical Research、Penfolds Family Scholarship、National Health and Medical Research Council(APP2002783)、National Heart Foundation of Australia(104615)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
参考文献
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39 (2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483 (2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. . Veterinary Sutures Handbook. , (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392 (2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897 (2016).
- Singh, B., Dyce, K. M. . Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411 (2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved