Method Article
Somministrazione di terapie cardioattive in un modello di infarto miocardico suino
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il presente protocollo descrive tre metodi di somministrazione di agenti terapeutici cardioattivi in un modello suino. Le femmine di suino autoctono hanno ricevuto un trattamento attraverso: (1) toracotomia e iniezione transepicardica, (2) iniezione transendocardica basata su catetere o (3) infusione endovenosa tramite minipompa osmotica della vena giugulare.
Abstract
L'infarto del miocardio è una delle principali cause di morte e disabilità in tutto il mondo e c'è un urgente bisogno di nuove strategie cardioprotettive o rigenerative. Una componente essenziale dello sviluppo di un farmaco è determinare come deve essere somministrata una nuova terapia. I modelli animali di grandi dimensioni fisiologicamente rilevanti sono di fondamentale importanza per valutare la fattibilità e l'efficacia di varie strategie terapeutiche di somministrazione. A causa delle loro somiglianze con gli esseri umani nella fisiologia cardiovascolare, nell'anatomia vascolare coronarica e nel rapporto peso/peso corporeo, i suini sono una delle specie preferite nella valutazione preclinica di nuove terapie per l'infarto miocardico. Il presente protocollo descrive tre metodi di somministrazione di agenti terapeutici cardioattivi in un modello suino. Dopo l'infarto miocardico indotto per via percutanea, le femmine di suino autoctono hanno ricevuto un trattamento con nuovi agenti attraverso: (1) toracotomia e iniezione transepicardica, (2) iniezione transendocardica basata su catetere o (3) infusione endovenosa tramite minipompa osmotica della vena giugulare. Le procedure impiegate per ciascuna tecnica sono riproducibili, con conseguente somministrazione affidabile di farmaci cardioattivi. Questi modelli possono essere facilmente adattati per adattarsi ai singoli disegni di studio e ciascuna di queste tecniche di somministrazione può essere utilizzata per studiare una varietà di possibili interventi. Pertanto, questi metodi sono uno strumento utile per gli scienziati traslazionali che perseguono nuovi approcci biologici nella riparazione cardiaca dopo l'infarto del miocardio.
Introduzione
La malattia coronarica (CAD) e l'infarto miocardico con sopraslivellamento del tratto ST (STEMI) sono le principali cause di morte in tutto il mondo. Negli ultimi due decenni, sono stati compiuti grandi progressi nella riduzione della mortalità ospedaliera dei pazienti che presentano STEMI, attraverso l'avvento dell'intervento coronarico percutaneo, delle terapie fibrinolitiche e della standardizzazione degli algoritmi di trattamento per garantire che la riperfusione sia raggiunta in modo tempestivo 1,2,3. Nonostante ciò, la morbilità associata allo STEMI rimane un onere significativo, creando così una grande necessità di sviluppare nuove terapie cardioprotettive e rigenerative 2,3. Una componente essenziale dello sviluppo terapeutico è la determinazione delle modalità di somministrazione di una nuova terapia4. La sicurezza, l'efficacia e la fattibilità di ciascun metodo devono essere abbinate alle caratteristiche della terapia stessa.
I modelli animali di grandi dimensioni fisiologicamente rilevanti sono fondamentali per valutare questi attributi di varie strategie terapeutichedi somministrazione 5. A causa delle loro somiglianze con gli esseri umani nella fisiologia cardiovascolare, nell'anatomia vascolare coronarica e nel rapporto peso/peso corporeo, i suini sono una delle specie preferite nella valutazione preclinica di nuove terapie per l'infarto del miocardio6. In precedenza abbiamo utilizzato un modello STEMI suino per dimostrare la capacità riparativa di una terapia proteica ricombinante7 e continuiamo a studiare nuove terapie farmacologiche, cellulari e genetiche utilizzando questo modello. Qui, vengono descritte tre tecniche di somministrazione terapeutica utilizzate nei modelli suini dopo la creazione dell'infarto: toracotomia e iniezione transepicardica, iniezione percutanea transendocardica e impianto di minipompa osmotica venosa giugulare. I primi due metodi consentono la somministrazione locale dei tessuti, riducendo i dosaggi richiesti, gli effetti fuori bersaglio e il metabolismo epatico di primo passaggio 8,9,10. La minipompa osmotica consente l'erogazione continua di un farmaco con una breve emivita, eliminando la dipendenza da una pompa per infusione e da una cannula endovenosa brevettata, entrambi difficili da istituire in modelli animali di grandi dimensioni.
Descrivendo queste tecniche, si spera che questo articolo possa aiutare gli scienziati traslazionali nello studio di nuovi agenti cardioprotettivi o rigenerativi a seguito di infarto del miocardio in modelli animali di grandi dimensioni.
Protocollo
Tutti gli esperimenti sono stati eseguiti seguendo il "Codice australiano per la cura e l'uso degli animali per scopi scientifici" e sono stati approvati dal Comitato Etico per gli Animali del Distretto Sanitario Locale di Western Sydney. Per il presente studio sono state utilizzate scrofette bianche x autoctone di grandi dimensioni in età prepuberale, del peso di 18-20 kg.
1. Zootecnia
- Alloggiare gli animali secondo i regolamenti del comitato etico animale locale.
NOTA: Gli animali inclusi in questo protocollo sono alloggiati individualmente per evitare combattimenti e lesioni e garantire che non ci sia competizione per il cibo. Tuttavia, tutti gli animali potevano vedere, sentire e annusare i conspecifici. I loro recinti hanno una pavimentazione in cemento per facilitare la pulizia e hanno una parte riparata sia interna che esterna. I suini sono dotati di lettiera di paglia nella parte interna e di "giocattoli" di arricchimento nella parte esterna.
2. Sedazione e anestesia generale
- Sedazione
- Assicurarsi che l'animale sia stato a digiuno per almeno 12 ore prima di iniziare qualsiasi sedazione pesante o anestesia generale.
- Se l'animale non ha ancora un accesso vascolare sotto forma di linea centrale, utilizzare un protocollo sedativo intramuscolare.
- La sedazione intramuscolare consiste in 8 mg/kg di ketamina, 0,3 mg/kg di midazolam, 0,2 mg/kg di metadone e 10 μg/kg di medetomidina (vedere la tabella dei materiali). Somministrare questa miscela nella muscolatura epassiale dell'animale con un ago da 21 G. In media, gli animali impiegano 5-10 minuti per essere pesantemente sedati.
NOTA: Un maiale stressato è più resistente alla sedazione; Assicurati che un conduttore calmo e fiducioso seda l'animale e che l'animale non sia eccessivamente stressato. Se l'animale è stressato, è meglio lasciarlo in pace per 5-10 minuti e riprovare. - Eseguire la sedazione endovenosa se è presente una linea centrale e perviene. La sedazione endovenosa consiste in 2 mg/kg di ketamina, 0,2 mg/kg di midazolam, 0,2 mg/kg di metadone e 2 μg/kg di medetomidina.
- Sciacquare prima la linea endovenosa con cloruro di sodio allo 0,9% per garantire la pervietà. Quindi, spingere lentamente metà della siringa miscelata attraverso la linea e sciacquare con cloruro di sodio allo 0,9%.
- Osservare l'animale, che deve essere sedato pesantemente entro 20-30 s. Se l'animale non è ancora sedato, sciacquare la restante metà della siringa, come descritto al punto 2.1.5.
- Accesso vascolare
- Una volta opportunamente sedato, trasportare il suino in sala operatoria.
- Pre-ossigenare il suino con una maschera facciale e una portata di ossigeno di 5 L/min. Collega un pulsossimetro alla coda, alle orecchie o alla lingua del maiale per monitorare l'animale per tutto il tempo.
- Utilizzando una cannula da 22 o 24 G, accedere alle vene marginali dell'orecchio sinistro e destro e fissarle con del nastro adesivo.
- Anestesia generale
- Posizionare il maiale in decubito sternale.
- Somministrare 1-3 mg/kg di propofol (vedere Tabella dei materiali) per via endovenosa con una lenta pressione titolata per ottenere l'effetto. Chiedi a un assistente di tenere aperta la bocca dell'animale (la mascella dovrebbe essere allentata in questa fase) ed estendere il collo.
- Utilizzare un laringoscopio (vedere la tabella dei materiali) per premere la base della lingua e l'epiglottide per esporre le cartilagini aritenoidi della laringe.
- Far passare un tubo endotracheale lubrificato (misura 5,5 o 6,0; vedi Tabella dei materiali) con uno stiletto attraverso le cartilagini aritenoidi e nella trachea. Occasionalmente, si può avvertire resistenza durante il passaggio attraverso la laringe; Questo può essere contrastato con una leggera rotazione del tubo endotracheale. Se l'animale resiste all'intubazione, somministrare più propofol per via endovenosa.
- Rimuovere lo stiletto dal tubo endotracheale. Gonfiare la cuffia del tubo endotracheale fino a quando non si è soddisfatti che non vi siano perdite d'aria intorno al tubo. Generalmente, sono necessari 4-6 mL di aria, anche se il volume può variare a seconda delle dimensioni della provetta e dell'animale.
- Fissare il tubo endotracheale dietro le orecchie dell'animale.
- Collegare l'animale a un circuito anestetico di nuova respirazione con una funzione di ventilazione a controllo del volume. Quando l'animale è collegato, spegnere il ventilatore.
NOTA: Assicurarsi che, in ogni momento, la valvola limitatrice di pressione regolabile (APL) o "valvola pop-off" sia aperta. La mancata apertura della valvola può provocare un barotrauma fatale per l'animale. - Ridurre la portata di ossigeno del circuito anestetico a 2 L/min.
- Impostare il ventilatore a pressione positiva in modalità "controllo del volume". Impostare il volume corrente a 10 ml/kg e la frequenza respiratoria a 20 respiri/min. Assicurarsi che il rapporto inspiratorio:espiratorio sia impostato su 1:2.
- Durante la procedura, manipolare la frequenza respiratoria per assicurarsi che l'anidride carbonica di fine espirazione sia compresa tra 35 e 50 mmHg.
NOTA: La pressione inspiratoria non deve superare i 20 cmH2O. Aumenti della pressione inspiratoria Indagine tempestiva per attorcigliamenti o ostruzioni dei tubi. Per alleviare l'aumento delle pressioni che non sono associate ai tubi, il rapporto inspiratorio:espiratorio può essere ridotto a 1:1,5 e il volume corrente ridotto. - Se l'animale è emodinamicamente stabile, mantenerlo con anestesia inalatoria. Se l'animale non è emodinamicamente stabile, mantenerlo con anestesia endovenosa totale, come descritto al punto 2.3.14.
- Se all'animale deve essere somministrata un'anestesia inalatoria, iniziare con isoflurano al 2,5% dal momento in cui il circuito anestetico viene collegato per la prima volta.
- Durante i successivi 30 minuti, svezzare progressivamente l'animale all'1,5% di isoflurano inalato. Mantenere l'animale con isoflurano all'1,5% fino alla fine della procedura.
- Valutare la profondità dell'anestetico ogni 10 minuti controllando i riflessi palpebrali e testando il tono della mandibola. Regolare l'isoflurano secondo necessità per mantenere la profondità dell'anestetico.
- Se l'animale è emodinamicamente instabile, mantenerlo con anestesia endovenosa totale, consentendo un maggiore controllo della profondità dell'anestesia senza le complicanze cardiovascolari associate agli agenti anestetici inalanti.
- Preparare pompe a siringa o pompe per fluidi standard con propofol, fentanil e midazolam. Collegali all'animale tramite una linea comune.
NOTA: Il propofol può essere somministrato alla dose di 0,1-0,6 mg/kg/min, il fentanil può essere somministrato alla dose di 1-5 μg/kg/h e il midazolam alla dose di 0,05-0,2 mg/kg/h. - Come per l'anestesia inalatoria, titolare questi farmaci in modo che abbiano effetto durante l'anestesia per mantenere un'adeguata profondità dell'anestesia.
- Preparare pompe a siringa o pompe per fluidi standard con propofol, fentanil e midazolam. Collegali all'animale tramite una linea comune.
- Fornire un supporto di liquidi per via endovenosa con cloruro di sodio allo 0,9% o soluzione di Hartmann (vedere Tabella dei materiali) alla velocità di 5 mL/kg/h.
- Monitorare l'animale con misurazioni della pressione sanguigna, capnografia, monitoraggio dei gas anestetici, temperatura, pulsossimetria ed elettrocardiografia.
- Durante qualsiasi procedura, fornire un'analgesia aggiuntiva sotto forma di 0,2 mg/kg di metadone per via endovenosa ogni 4 ore dopo la premedicazione.
NOTA: L'analgesia può essere somministrata a intervalli più brevi se l'animale mostra segni di dolore durante l'anestesia (tachicardia, profondità di anestetico alleggerita senza modifiche ai farmaci di mantenimento).
3. Posizionamento della linea centrale
- Posizionare il maiale in decubito dorsale con gli arti posteriori estesi, l'arto anteriore sinistro esteso e l'arto anteriore destro flesso e fissato con una fascia.
- Preparare asetticamente il collo del maiale e coprire con un drappeggio.
- Utilizzare una sonda ecografica lineare (vedi Tabella dei materiali) con un rivestimento sterile per localizzare la vena giugulare destra. Ciò si ottiene al meglio con la sonda orientata perpendicolarmente alla trachea e spostandola lentamente lateralmente dalla laringe.
- Abilita la modalità color doppler per aiutare a identificare la vena giugulare. La vena giugulare può essere distinta dall'arteria carotide dimostrando la collassabilità e il flusso continuo e non pulsatile.
- Utilizzare un ago Cook da 18 G (vedere la tabella dei materiali) per accedere alla vena sotto guida ecografica. Una volta ottenuto l'accesso, far passare un filo con punta a J da 0,035 pollici (vedere la tabella dei materiali) attraverso l'ago e infilarlo nel recipiente. Rimuovere l'ago sul filo.
- Infilare una linea centrale pre-lavata sul filo e spingere attraverso la vena. Assicurarsi che il filo sia sempre visibile emergendo dall'estremità distale della linea.
NOTA: Un catetere venoso centrale a due lumi da 5 Fr (vedere Tabella dei materiali) è stato utilizzato per i soggetti che necessitavano di accesso endovenoso per un periodo di 1-4 settimane. - Se c'è difficoltà a far avanzare la linea attraverso la pelle, utilizzare un bisturi n. 11 per creare una piccola incisione di 2-4 mm per facilitare il passaggio della linea sul filo. Applicare una pressione negativa seguita da un risciacquo su ciascuna linea esterna per garantire la pervietà. Bloccare ogni linea.
- Fissare gli ancoraggi forniti alle linee esterne e fissarli in posizione con suture non solubili 2-0 o 3-0 (vedi Tabella dei materiali). Posizionare punti di sutura aggiuntivi per fissare dorsalmente le linee esterne per evitare che l'animale le mastichi.
- Collegare le linee di estensione a filo alle linee esterne del catetere e bloccarle.
- Dotare l'animale di una giacca per maiali commerciale (vedi Tabella dei materiali) e fissare le linee all'interno. Se altre procedure devono ancora essere eseguite durante la stessa anestesia, indossare la giacca appena prima del recupero dell'animale.
4. Infarto del miocardio
NOTA: Gli animali utilizzati in questo modello hanno ricevuto un infarto del miocardio seguendo un metodo7 precedentemente pubblicato.
- Eseguire l'infarto del miocardio 2 settimane prima delle procedure di iniezione transepicardica e transendocardica 8,9,10. L'impianto della minipompa osmotica è stato eseguito immediatamente dopo la riperfusione coronarica nell'ambito della stessa procedura.
5. Somministrazione di farmaci o cellule
- Toracotomia e iniezione di cellule epicardiche
- Somministrare antibiotici profilattici per via endovenosa sotto forma di 22 mg/kg di cefazolina (vedere Tabella dei materiali). Continuare ogni 90 minuti per tutta la durata della procedura.
- Posizionare l'animale nella posizione di decubito laterale destro.
- Applicare un cerotto a base di fentanil da 100 μg/h (vedere Tabella dei materiali) sul piano piatto dietro le orecchie del suino. Coprire con una medicazione adesiva o una sutura 2-0.
NOTA: Questo cerotto è considerato "attivo" 12 ore dopo il posizionamento e fornisce analgesia per 72 ore. - Impostare il sistema di mappatura elettroanatomica, i cablaggi e le patch seguendo le specifiche del prodotto (vedi Tabella dei Materiali).
- Segna una linea orizzontale di 10 cm tra le costole 4 e 5 sull'animale con un pastello o un pennarello chirurgico.
- Preparare una miscela di lidocaina (2 mg/kg) e bupivacaina (1 mg/kg) in una singola siringa con un ago da 25 g.
- Preparare asetticamente il sito chirurgico e drappeggiare l'animale. Eseguire un blocco cutaneo della linea nel sito di incisione contrassegnato inserendo l'ago nella pelle con un'angolazione poco profonda, ritirando leggermente lo stantuffo per garantire che non vi sia alcun riflusso di sangue nella siringa e iniettando lentamente la soluzione man mano che l'ago viene estratto dalla pelle. Ripeti questo processo mentre ti muovi lungo la linea.
NOTA: La pressione negativa deve essere applicata alla siringa in ogni nuovo sito di iniezione per garantire che la bupivacaina non venga somministrata per via intravascolare. La bupivacaina intravascolare può essere rapidamente fatale. - Con un bisturi n. 22, praticare un'incisione cutanea di 10 cm lungo la linea segnata.
- Utilizzando la cauterizzazione monopolare (vedi Tabella dei materiali), approfondire l'incisione attraverso gli strati muscolari sottostanti fino a raggiungere i muscoli intercostali.
- Preparare una siringa sterile da 0,5 mg/kg di bupivacaina e 1 mg/kg di lignocaina e inserire un ago da 25 g.
- Inserire l'ago con un angolo poco profondo sul bordo caudale della quarta costola. Applicare una pressione negativa sullo stantuffo per assicurarsi che l'ago non sia passato attraverso la vena o l'arteria intercostale. Iniettare lentamente un quarto del volume della siringa mantenendo l'ago fermo.
- Ripetere il passaggio 5.1.12 in altre tre posizioni, a 3-5 cm di distanza lungo il bordo caudale della quarta costola.
- Utilizzare le forbici Metzenbaum (vedere la tabella dei materiali) per incidere con cura i muscoli intercostali, quindi incidere la pleura dopo la conferma con l'anestesista.
- Quando la pleura viene incisa, spegnere il ventilatore per consentire ai polmoni di staccarsi dalla pleura. Dopo aver praticato l'incisione, riaccendere il ventilatore e regolare la pressione positiva di fine espirazione a 4 cmH2O.
- Posizionare i divaricatori autobloccanti delle costole tra le costole e aprirli lentamente per esporre il cuore. Usando una pinza per tessuti, afferrare delicatamente il pericardio e incidere con le forbici Metzenbaum in modo che il cuore possa essere esteriorizzato.
NOTA: Durante questa fase e le successive, le aritmie sono comuni. L'ECG deve essere monitorato attentamente e qualsiasi manipolazione cardiaca deve essere interrotta temporaneamente se l'animale diventa emodinamicamente instabile (pressione arteriosa media inferiore a 55 mmHg). I boli endovenosi di metaraminolo (0,25 mg) devono essere somministrati secondo necessità per migliorare la pressione sanguigna. - Posizionare punti di sutura temporanei 2-0 su entrambe le estremità e sui lati dell'incisione pericardica per fissarla alla parete toracica e creare un pozzetto pericardico. Assicurarsi che i lati del pericardio siano supportati per rendere il pozzo pericardico il più superficiale possibile.
- Utilizzare tamponi inumiditi o spugne per laparotomia per impacchettare la regione che circonda il cuore. Ciò aiuterà a mantenere stabile il cuore e a prevenire l'essiccazione dei tessuti esposti.
- Consegnare l'apice del cuore dall'interno della cavità pericardica con un dito indice dietro il ventricolo sinistro. Fare attenzione a ridurre al minimo la compressione ventricolare sinistra.
NOTA: Un cuore sano può battere comodamente con l'apice rivolto verticalmente, seduto sulla sua base con un supporto delicato ma senza compressione. C'è una diminuzione iniziale della pressione sanguigna associata alla manipolazione, ma questa deve tornare a un livello accettabile in assenza di compressione ventricolare esterna.- Se il recupero non si verifica o si verifica un recupero molto lento entro 15 secondi, riportare immediatamente il cuore nella cavità pericardica e adottare le misure necessarie per migliorare i parametri emodinamici prima di un'ulteriore lussazione.
NOTA: Se il ventricolo può essere lussato, la posizione dell'apice all'esterno del pericardio può essere mantenuta posizionando pacchetti di garza di dimensioni adeguate all'interno del pericardio per sostenere il ventricolo. Allo stesso modo, un tampone allungato e inumidito può essere posizionato sotto la base del cuore, dove funge da "imbracatura" che guida l'apice cardiaco verso l'alto verso l'incisione (Figura 1A).
- Se il recupero non si verifica o si verifica un recupero molto lento entro 15 secondi, riportare immediatamente il cuore nella cavità pericardica e adottare le misure necessarie per migliorare i parametri emodinamici prima di un'ulteriore lussazione.
- Creare una mappa di tensione elettroanatomica della superficie epicardica ventricolare sinistra utilizzando un catetere di mappatura elettrofisiologica (Figura 1B). Identifica le cicatrici, i confini e le zone remote mediante interruzioni di tensione standard.
NOTA: La cicatrice e la zona remota sono state definite con cut-off bipolari di <0,5 mV o >1,5 mV e cut-off unipolari di <3 mV o >8,3 mV, rispettivamente11,12. - Piegare l'ago della siringa terapeutica da 27 G con un angolo di circa 80-90°.
- Far avanzare l'ago nel tessuto bersaglio con un angolo poco profondo e applicare una pressione sullo stantuffo della siringa per scaricare da 1/4 a 1/3 del volume totale. Deve essere osservato lo sbiancamento del tessuto (Figura 1C). Utilizzare il catetere per mappatura elettrofisiologica per annotare la posizione del sito di iniezione sulla mappa della tensione epicardica generata (Figura 1D).
NOTA: Le iniezioni del veicolo costituite dal terreno di coltura cellulare (RPMI 1640) sono state utilizzate a scopo dimostrativo nel protocollo video. - Estrarre parzialmente l'ago e reindirizzarlo all'interno del miocardio. Scaricare da 1/4 a 1/3 del volume della siringa. Continuare fino a svuotare la siringa.
- Ripetere i passaggi 5.1.20-5.1.24 fino a quando non è stata erogata la dose desiderata.
- Rimuovere i tamponi che si staccano dal cuore e rimuovere delicatamente la "fionda" sotto il cuore, in modo che ritorni in posizione neutra. Le aritmie sono comuni durante questa fase e occorre prestare attenzione come descritto al punto 5.1.17.
- Rimuovere i punti di sutura 2-0 dal pericardio. Allentare il divaricatore e rimuoverlo dal torace.
- Utilizzare suture in polidiossanone (PDS) di misura 1 con un ago rotondo a punta smussata per chiudere il torace facendolo passare attraverso gli spazi tra le costole 3 e 4 e le costole 5 e 6.
NOTA: Le suture strette a forma di otto forniscono un effetto puleggia per approssimare le costole. Devono essere impiegati due o tre punti di sutura di questo tipo, a seconda della taglia dell'animale. - Prima di stringere e legare le suture che si avvicinano alle costole, inserire un breve tratto di tubo in silicone nel bordo ventrale dell'incisione.
- Posizionare l'estremità libera del tubo in una ciotola di soluzione fisiologica sterile per il drenaggio sigillato subacqueo della cavità pleurica.
- Chiudere gli strati muscolari sovrastanti in un semplice schema continuo con punti di sutura riassorbibili 2-0. Chiudere la pelle in un semplice schema continuo o ad incastro guado13 con una sutura non assorbibile 2-0 o 3-0.
- Quando la chiusura della ferita è completata, espellere l'aria libera dal torace per effetto della ventilazione a pressione positiva.
- Ruotare il ventilatore sull'impostazione "respirazione libera". Utilizzare la sacca serbatoio sul circuito di respirazione per fornire una pressione positiva costante alle vie aeree (mantenere a 20-30 cmH2O).
- Continuare questa pressione fino a quando non si osservano più bolle nella ciotola della soluzione salina, indicando l'assenza di aria libera all'interno del torace.
- Rimuovere il tubo di silicone.
- Applicare una medicazione adesiva sul sito chirurgico e posizionare semplici suture interrotte sparse per aiutare a mantenere la medicazione in posizione.
- Al momento della convalescenza, somministrare 0,3 mg/kg di metadone per via sottocutanea e 0,2-0,5 mg/kg di ondansetron (vedere Tabella dei materiali) per via endovenosa.
- Impianto di minipompa osmotica della vena giugulare
- Posizionare l'animale come descritto al punto 3.1. Prepara e drappeggia asetticamente il lato destro del collo dell'animale.
- Con la lama del bisturi n. 22 praticare un'incisione di 8-10 cm estendendosi cranialmente da un punto di 2-3 cm lateralmente al manubrio sterno. Questa incisione deve diventare leggermente più laterale mentre si muove cranialmente.
- Usa le forbici Metzenbaum per sezionare i muscoli colli cutanei, sternoidioideo e sternocefalo. Utilizzare tecniche di dissezione smussata per approfondire l'incisione fino a quando la vena giugulare esterna non è visibile.
- Posizionare i divaricatori autobloccanti nell'incisione e aprirli per migliorare la visibilità.
- Utilizzando le pinze Adson per tessuti marroni (vedere la tabella dei materiali) e le forbici Metzenbaum, rimuovere i tessuti molli che circondano la vena giugulare, sia sopra che sotto (Figura 2A). Si tratta di un passaggio cruciale, poiché nelle fasi successive, i tessuti molli sovrastanti il vaso possono ostruire il passaggio del tubo della minipompa.
- Utilizzare una sutura riassorbibile 5-0 attraverso l'estremità caudale esposta della vena, a circa 1 cm craniale dal bordo visibile più caudale del vaso. Passare la sutura a "morsi" di 5 mm nel modo seguente: cranio-caudale sul lato destro, da destra a sinistra e caudale-craniale sul lato sinistro. Il modello risultante deve apparire come "tre lati di un quadrato". Assicurarsi che le code di sutura di entrambe le estremità siano della stessa lunghezza.
- Assemblare la minipompa come descritto nel manuale di istruzioni del prodotto (vedi Tabella dei materiali).
- Legami vascolari elastici ad anello intorno al vaso sia all'estremità cranica che caudale. Tienili sciolti inizialmente. Chiedi a un assistente di mettere in tensione i legami vascolari per occludere il vaso.
- Con l'ago da 14 G, praticare una puntura nella vena al centro del "quadrato a tre lati" creato con il materiale di sutura (punto 5.2.7; Figura 2B).
- Avvitare il tubo della minipompa nella foratura. Deve passare facilmente all'interno dell'imbarcazione. Se si incontra resistenza, non continuare a spingere; Invece, estrarre il tubo e riprovare.
- Far avanzare il tubo fino a quando rimangono 1-2 cm all'esterno del recipiente. Stringere il materiale di sutura attorno al tubo del catetere e legarlo con un semplice nodo interrotto. Chiedere all'assistente di rilasciare e rimuovere le fascette vascolari.
- Avvolgere più volte una sutura non assorbibile 2-0 attorno al corpo della mini pompa e legare in modo che la sutura sia fissata saldamente alla pompa. Quindi, fissare la pompa ai tessuti molli vicini con un semplice nodo interrotto (Figura 2C,D).
- Rimuovere i divaricatori dall'incisione. Chiudere l'incisione in una semplice chiusura continua standard a tre strati.
- Somministrare 0,2 mg/kg di meloxicam per via sottocutanea durante il recupero.
- Iniezione percutanea transendocardica
- Posizionare l'animale in decubito dorsale con gli arti anteriori e posteriori distesi e fissarlo con delle fascette.
- Preparare asetticamente l'addome caudale e le cosce mediali dell'animale. Coprire l'animale con un telo per angiografia femorale fenestrato (vedere Tabella dei materiali).
- Impostare il sistema di mappatura elettroanatomica, i cablaggi e le patch seguendo le specifiche del prodotto (vedi Tabella dei Materiali).
- Utilizzare una sonda ecografica lineare per identificare l'arteria femorale. Sotto guida ecografica, perforare l'arteria femorale con un ago da cucina e infilare un filo guida da 0,035 pollici nel vaso tramite l'ago. Rimuovere l'ago sul filo.
- Infilare una guaina arteriosa da 8 Fr e un introduttore sul filo arterioso e spingere fino a quando solo il mozzo è esposto alla pelle. Assicurarsi che il filo sia sempre visibile, emergendo dal mozzo della guaina.
NOTA: Poiché si tratta di una guaina più grande, occasionalmente potrebbe essere necessario un bisturi n. 11 per creare una piccola incisione cutanea per facilitare il passaggio. - Rimuovere la guaina, l'introduttore e il filo. Somministrare eparina per via endovenosa (100-200 unità/kg).
- Introdurre il catetere per iniezione transendocardica attraverso la guaina e avanzare verso il ventricolo sinistro tramite un approccio aortico retrogrado.
- Crea una mappa elettroanatomica del ventricolo sinistro trascinando delicatamente il catetere sulla superficie endocardica. Eseguire la rotazione assiale e alterare delicatamente la flessione della punta per ottenere un buon contatto endocardico. Identifica cicatrici, confini e zone remote mediante interruzioni di tensione standard.
- Dirigere il catetere con guida fluoroscopica ed elettroanatomica nella posizione di iniezione preferita. Eseguire una delicata rotazione assiale con deflessione della punta distale per impegnare e mantenere stabile il contatto endocardico.
- Confermare il posizionamento della punta del catetere con almeno due viste fluoroscopiche. Far avanzare delicatamente il catetere centrale, quindi estendere l'ago fino a una profondità intramiocardica controllata (3,5 mm per l'iniezione apicale, 5 mm per l'iniezione settale).
- Lavare 4-6 mL di mezzo di contrasto iodato (vedere la tabella dei materiali) attraverso il catetere per iniezione fino a quando non è visibile alla fluoroscopia. Osservare il contrasto per i successivi 10-30 secondi per assicurarsi che rimanga nel tessuto (Figura 3A).
- Osservare attentamente l'ECG durante l'estensione dell'ago e l'iniezione, poiché le cicli di ectopia ventricolare sono comuni.
NOTA: L'ectopia ventricolare si verifica quando la punta dell'ago è entrata in contatto con il miocardio. - Se l'iniezione di mezzo di contrasto ha successo, proseguire con un'iniezione dell'agente di interesse. Sciacquare con il mezzo di contrasto fino a quando non si osserva fluoroscopicamente.
NOTA: L'agente di interesse è specifico per l'utente, a seconda della terapia che sta testando. - Ritrarre l'ago. Rimuovere il catetere per iniezione dalla guaina arteriosa.
- Rimuovere la guaina arteriosa e applicare una pressione sui siti per un massimo di 20 minuti fino a raggiungere l'emostasi.
6. Recupero in anestesia generale
- Spegnere l'anestetico inalatorio o le pompe per anestesia endovenosa in uso. Ridurre la frequenza respiratoria sul ventilatore a 8-10 respiri/min.
- Dopo 2-5 minuti, portare il ventilatore in modalità "respirazione libera" per non più di 30 secondi alla volta. Osservare l'animale e il capnografo per la respirazione spontanea.
- Se si è verificata una respirazione spontanea, lasciare il ventilatore spento. Se l'animale è in fase di apnea, riaccendere il ventilatore per altri 1-2 minuti e riprovare fino a quando non si ottiene la respirazione spontanea.
NOTA: I tempi di recupero sono variabili a seconda delle caratteristiche procedurali e dell'animale, ma possono variare da 15 minuti a 1 ora. - Una volta che l'animale respira comodamente (frequenza respiratoria di 15-30 respiri/min, anidride carbonica di fine espirazione inferiore a 60, SpO2 superiore al 95%), scollegare l'ossigeno, lasciando collegato il monitoraggio.
- Rimuovere i siti temporanei di accesso vascolare e applicare pressione per prevenire la formazione di ematomi. Se l'animale rimane stabile e continua a ossigenarsi bene nei successivi 5 minuti, può essere trasportato nella sua area di recupero.
- Dopo tre deglutizioni spontanee consecutive, sgonfiare la cuffia del tubo endotracheale e rimuovere delicatamente il tubo.
- Monitora l'animale per almeno altri 5 minuti per assicurarti che continui a ossigenarsi in modo appropriato e non incontri difficoltà respiratorie. L'ossigeno a flusso deve essere utilizzato secondo necessità se un animale si desatura dopo l'estubazione.
Risultati
Toracotomia e iniezione di cellule epicardiche
Dei 29 animali sottoposti a toracotomia e iniezione epicardica, 26 sono sopravvissuti. L'analisi istologica ha confermato l'attecchimento delle cellule umane fornito con questo metodo in tutti gli animali sopravvissuti (Figura 1E). Un animale ha manifestato aritmie fatali durante l'iniezione cellulare e non è stato possibile rianimarlo. Un altro ha sperimentato un'attività elettrica senza polso durante la chiusura e l'applicazione prolungata di pressione positiva alle vie aeree e non è stato possibile recuperare. Un terzo animale ha vomitato ed è andato in arresto respiratorio dopo l'estubazione. Questo animale non è stato in grado di essere rianimato.
Due animali hanno avuto gravi complicazioni ma sono stati in grado di essere recuperati. Un animale ha sviluppato fibrillazione ventricolare durante l'iniezione intramiocardica ed è stato in grado di essere rianimato con pale di defibrillazione interna e massaggio cardiaco. Il secondo animale ha vomitato dopo l'estubazione e ha avuto un breve arresto respiratorio, ma è stato in grado di essere rapidamente reintubato e si è ripreso bene. Tutti questi eventi si sono verificati durante i primi esperimenti, con una riduzione degli eventi avversi con l'aumentare dell'esperienza del team con il protocollo (Tabella 1).
Impianto di minipompa osmotica della vena giugulare
Nessuna mortalità segnalata o complicanze maggiori è stata associata all'impianto di minipompa osmotica giugulare. La maggior parte dei sette animali ha manifestato un lieve gonfiore nel sito chirurgico entro le prime 24 ore, che si è risolto senza intervento. L'ELISA eseguito sul siero il giorno 3 dopo l'impianto post-pompa ha dimostrato l'efficacia del microinfusore, raggiungendo una concentrazione ematica significativa di fattore di crescita derivato dalle piastrine-AB umano (PDGF-AB) rispetto ai controlli7 (Figura 2E).
Iniezione percutanea transendocardica
Un totale di 22 animali hanno ricevuto iniezioni endocardiche. Di queste iniezioni, 17 sono state considerate "riuscite", determinate dalla fluorescenza o dalla colorazione dell'inchiostro osservata nel tessuto bersaglio post-mortem (Figura 3B). Non ci sono stati decessi associati a questa procedura. Un animale ha sviluppato un versamento pericardico di piccolo volume a causa della perforazione ventricolare destra. Questo era autolimitante e non ha provocato una compromissione cardiovascolare. Questo stesso animale morì; Tuttavia, questo proveniva da una procedura aggiuntiva non correlata dopo l'iniezione intramiocardica.
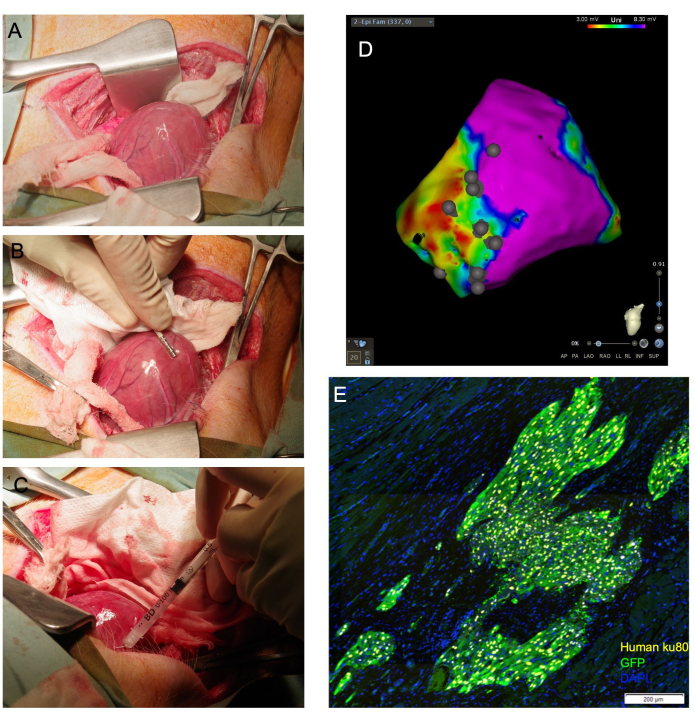
Figura 1: L'iniezione di cardiomiociti transepicardici consente la visualizzazione cardiaca diretta e consente di ottenere un'elevata percentuale di cellule vitali consegnate al miocardio. (A) L'apice cardiaco è esposto attraverso un'imbragatura di garza inumidita guidata sotto la base del cuore. (B) Un catetere per mappatura epicardica delinea le zone cicatriziali e di confine e annota i siti di iniezione. (C) Un ago da 31 G viene utilizzato per iniettare per via transepicardica le cellule nel miocardio. (D) Mappa del voltaggio epicardico con annotazione del sito di iniezione. Viola: voltaggio normale, miocardio sano; Rosso: voltaggio anomalo, miocardio malato; Punti grigi: siti di iniezione. Dopo il sacrificio, il cuore viene raccolto e fissato in formalina per la valutazione istologica a valle. In (E), le cellule umane trapiantate vengono rilevate mediante immunocolorazione per l'anticorpo anti-nucleo umano, Ku80, e un anticorpo anti-GFP. Barra della scala = 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
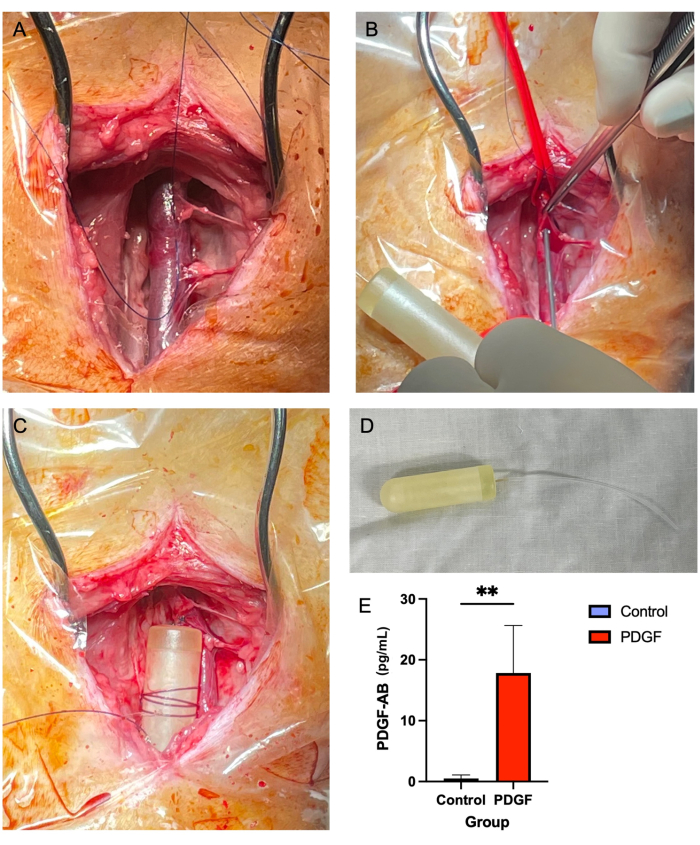
Figura 2: L'inserimento della minipompa della vena giugulare fornisce un metodo sicuro e affidabile per la somministrazione di PDGF in un periodo di 7 giorni . (A) La vena giugulare destra è esposta e i tessuti molli vengono eliminati dal vaso. (B) I legami vascolari occludono il vaso mentre un ago da 14 G viene utilizzato per eseguire una puntura, attraverso la quale viene infilato il tubo della minipompa. (C) Il tubo della minipompa viene fatto avanzare nella vena e il corpo della minipompa è fissato ai tessuti molli adiacenti. (D) Il corpo della minipompa e il tubo prima dell'impianto. (E) La concentrazione sierica della proteina ricombinante erogata tramite la minipompa e il PDGF-AB è stata misurata utilizzando l'ELISA di ciascun animale il giorno 3 dopo l'impianto. È stato dimostrato che gli animali trattati con PDGF-AB avevano una concentrazione ematica significativamente più elevata di PDGF-AB rispetto agli animali di controllo, confermando l'efficacia del metodo di somministrazione osmotica della minipompa. **indica una differenza statisticamente significativa tra i gruppi (p = 0,005, test U di Mann-Whitney) Fare clic qui per visualizzare una versione più grande di questa figura.
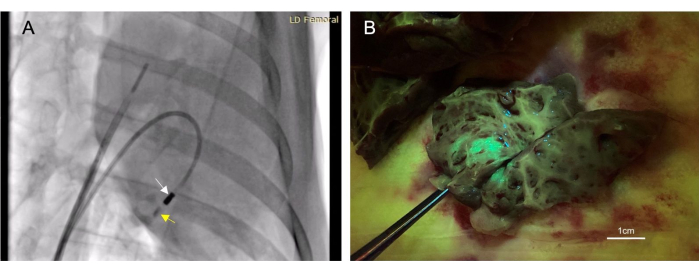
Figura 3: L'iniezione intramiocardica transendocardica consente un metodo di somministrazione terapeutica minimamente invasivo. (A) Un'immagine fluoroscopica obliqua anteriore destra che mostra il catetere per iniezione (freccia bianca) che somministra materiale di contrasto (freccia gialla) nel miocardio. L'iniezione di mezzo di contrasto precede e segue l'iniezione terapeutica, in modo da poter confermare il posizionamento dell'ago all'interno del miocardio. (B) Il vettore iniettato esprimeva la proteina fluorescente verde (GFP) in modo che il materiale iniettato diventasse fluorescente al momento della raccolta del tessuto, confermando così il successo dell'iniezione. Fare clic qui per visualizzare una versione più grande di questa figura.
| Iniezione transepicardica (n = 29) | Iniezione transendocardica (n = 22) | Minipompa osmotica (n = 7) | |
| Mortalità | 3 | 0 | 0 |
| Vomito post-operatorio e arresto respiratorio | 1 | 0 | 0 |
| Fibrillazione ventricolare durante l'iniezione | 1 | 0 | 0 |
| Attività elettrica senza polso durante la chiusura del torace | 1 | 0 | 0 |
| Morbilità | 0 | 1 | 0 |
| Pneumotorace | 0 | 0 | 0 |
| Versamento pleurico | 0 | 0 | 0 |
| Perforazione della camera cardiaca | 0 | 1 | 0 |
| Emorragia | 0 | 0 | 0 |
Tabella 1: Elenco delle complicanze.
Discussione
Iniezione intramiocardica transepicardica
Questa procedura ha il vantaggio della visualizzazione cardiaca diretta ed è stato dimostrato che fornisce una maggiore ritenzione locale delle terapie rispetto ai metodi di somministrazione sistemica 9,10,14. Tuttavia, le toracotomie sono invasive, richiedono una notevole abilità tecnica e presentano un rischio maggiore di morbilità e mortalità rispetto ad altri metodi discussi10,15. La conoscenza delle fasi critiche e precarie della procedura può aiutare nella mediazione di questo aumento del rischio.
È necessario prestare molta attenzione quando si manipola il cuore per esporre l'apice cardiaco a causa dell'alto rischio di aritmia e compromissione emodinamica associata. Il monitoraggio continuo invasivo della pressione arteriosa e l'elettrocardiogramma consentono una rapida identificazione di ipotensioni o aritmie instabili, facilitando l'intervento e la correzione tempestivi. L'ipotensione transitoria può essere generalmente trattata con boli di metaraminolo. L'ipotensione prolungata può essere temporizzata riducendo l'anestetico inalante (attento monitoraggio della profondità dell'anestetico) e iniziando un'infusione vasopressore, determinando contemporaneamente la causa dell'alterazione emodinamica. Le aritmie instabili, come la tachicardia ventricolare o la fibrillazione ventricolare, possono essere trattate con cardioversione elettrica con o senza antiaritmici per via endovenosa.
Altrettanto importante per la sopravvivenza dell'animale è la rimozione del gas libero dalla cavità pleurica prima di chiudere il torace. In caso contrario, l'animale può culminare nello sviluppo di uno pneumotorace, lasciando l'animale a grande rischio di compromissione respiratoria e morte una volta scollegato dal ventilatore meccanico al momento del recupero. La pressione positiva delle vie aeree deve essere mantenuta per almeno 30 secondi fino a quando non si osservano più bolle. Il tubo in silicone viene prontamente rimosso al cessare del gorgogliamento e il torace viene quindi rapidamente chiuso. È anche possibile posizionare chirurgicamente un tubo toracostomico alla chiusura, consentendo la rimozione manuale dell'aria e del liquido infiammatorio nelle successive 24-72 ore. Questo, però, è difficile da mantenere pulito e intatto, soprattutto se gli animali sono alloggiati insieme. Il danneggiamento o la contaminazione del tubo possono portare a piotorace, pneumotorace o sepsi. In base alla nostra esperienza, l'inserimento di un drenaggio toracico temporaneo non è necessario se il gas libero viene adeguatamente rimosso prima della chiusura del torace.
Iniezione intramiocardica transendocardica percutanea
Questo metodo di somministrazione terapeutica ha il vantaggio di consentire la somministrazione locale del tessuto con un rischio inferiore grazie alla sua natura meno invasiva rispetto ad un approccio chirurgico10,14. Questa tecnica è già utilizzata in studi su animali di grandi dimensioni, con la fluoroscopia e la mappatura elettromeccanica come guida in assenza di visualizzazione diretta10,16,17.
Dato che il cuore non è sotto visione diretta, è prudente per il proceduralista utilizzare viste fluoroscopiche ortogonali quando seleziona un sito di iniezione. Inoltre, l'iniezione di mezzo di contrasto di iodio diluito prima e la somministrazione del farmaco è estremamente preziosa per confermare il contatto miocardico. Il contatto appropriato può essere confermato osservando un caratteristico "rossore miocardico", che può essere uno dei pochi indicatori di successo dell'iniezione prima del prelievo di tessuto. A causa del rischio di perforazione della camera, si raccomanda che lo spessore della parete miocardica nel sito di iniezione selezionato sia superiore a 9 mm14,16.
Minipompa osmotica venosa giugulare
La minipompa osmotica è un dispositivo popolare comunemente impiegato negli studi sui piccoli animali. C'è stato un crescente interesse per l'utilizzo di questo dispositivo in modelli animali di grandi dimensioni 7,18,19, dato il suo vantaggio unico di somministrare un agente terapeutico a una velocità costante per un determinato periodo di tempo. Una possibile limitazione di questo metodo è l'impossibilità di modificare o interrompere la velocità di infusione del farmaco senza sostituire o rimuovere la pompa. Questo dovrebbe essere considerato prima di provare la terapia in questo modo.
Questo studio ha dimostrato che questo metodo potrebbe essere eseguito con un alto tasso di successo nei suini, con bassa morbilità e mortalità. Va notato che molte strutture vitali sono adiacenti al sito chirurgico, tra cui i linfonodi, il timo e l'arteria carotide. L'aderenza al metodo e la consultazione di testi anatomici20 sono fortemente raccomandati per prevenire danni involontari a una qualsiasi di queste strutture. La complicanza più preoccupante di questo metodo è lo shock emorragico dovuto a lesioni involontarie alla vena giugulare o a una struttura circostante. È quindi fondamentale che i tessuti molli che circondano la vena giugulare vengano accuratamente rimossi. Il mancato completamento di questo passaggio può causare difficoltà nel posizionamento del tubo della minipompa o nel controllo dello spurgo involontario.
Questo articolo ha descritto tre metodi per la somministrazione di terapie cardioattive. Nonostante il successo riportato di ciascuna tecnica, ci sono limitazioni intrinseche da considerare. Le procedure invasive (iniezione transepicardica) consentono una maggiore precisione della somministrazione terapeutica; tuttavia, comportano un rischio maggiore di complicazioni potenzialmente fatali. Inoltre, la somministrazione invasiva ha una maggiore richiesta di competenze tecniche per ridurre al minimo il rischio di complicanze. Allo stesso modo, l'iniezione transendocardica fluoroscopica richiede un certo grado di abilità tecnica per il cateterismo e la manipolazione dell'hardware. Se questo metodo viene eseguito in modo improprio, sono possibili errori di iniezione e complicazioni fatali.
I metodi di iniezione diretta descritti consentono la somministrazione una tantum di una terapia nel tessuto bersaglio. La minipompa osmotica venosa giugulare consente la somministrazione sistemica di una terapia per un periodo di 7 giorni. In confronto, questo metodo è più semplice e associato a meno rischi, tuttavia, si basa su una terapia sistemica che trova la sua strada verso il miocardio. Inoltre, una volta che la pompa è in posizione, è impossibile interrompere la somministrazione o modificare l'intensità della dose senza anestetizzare nuovamente l'animale e rimuovere la pompa.
Tutti i metodi descritti in questo articolo sono stati eseguiti su animali il giorno o 2 settimane dopo l'infarto del miocardio. Pertanto, questo lavoro non può riportare il successo dei metodi menzionati in animali sani o sottoposti a una patologia cardiaca alternativa. Infine, la farmacologia e la biotecnologia di qualsiasi agente previsto devono essere attentamente considerate, in quanto ciò sarà intrinsecamente legato all'efficacia della via di somministrazione scelta. Una discussione dettagliata di questo argomento esula dallo scopo di questo manoscritto.
Rappresentazioni complete dei metodi preclinici vanno a vantaggio del benessere degli animali e della comunità scientifica in generale. La conseguente maggiore riproducibilità delle procedure e dei risultati porta a un minor numero di complicanze per la salute degli animali, a un numero ridotto di animali necessari per produrre risultati significativi e a una maggiore fiducia nei risultati sperimentali21,22. In questo articolo vengono descritti tre metodi di somministrazione di nuove terapie per il trattamento dell'infarto miocardico in un modello suino. Dettagliando le tecniche utilizzate e articolando i benefici e i rischi di ciascuna, si prevede che i ricercatori saranno in grado di creare comodamente modelli preclinici coerenti e affidabili che si adattano ai loro obiettivi di ricerca.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato da sovvenzioni del National Health and Medical Research Council APP1194139/APP1126276 (JC), della National Stem Cell Foundation of Australia e dell'Ufficio governativo del New South Wales per la salute e la ricerca medica (JC). Il DS è stato supportato dal Royal Australasian College of Physicians, dall'Institute of Clinical Pathology and Medical Research e dall'Australian Government Research Training Program. TD è stato sostenuto dall'Istituto di Patologia Clinica e Ricerca Medica, dalla Penfolds Family Scholarship, dal National Health and Medical Research Council (APP2002783) e dalla National Heart Foundation of Australia (104615).
Materiali
| Name | Company | Catalog Number | Comments |
| Central line placement | |||
| 2-0 sutures | Ethicon | JJ9220 | |
| Arrow' Paediatric Two-Lumen Central Venous Catheterisation Set with Blue FlexTip Catheter (contains 18G cook needle and 0.035" J-tip wire) | Teleflex | CS-14502 | Central Line |
| Green Fluorsence Protein (GFP) | Abcam | ab13970 | 1:100 dilution ratio |
| Histology antibodies | |||
| Ku80 | Cell Signalling Technology | C48E7 | 1:500 dilution ratio |
| No. 11 scalpel | Swann-Morton | 203 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile ultrasound probe cover | Atris | 28041947 | |
| Swine Jacket with Pocket, size 'Medium' | Lomir Biomedical | SS J2YJJET | |
| Jugular vein osmotic minipump implantation | |||
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| Bellucci Self-Retaining Retractor | surgicalinstruments.net.au | group-24.26.02 | Self retaining tissue retractor |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel blade | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, 663G | |
| Osmotic Infusion Minipump | Alzet | 2ML1, 2ML2, 2ML4 | |
| Vascular Silicone Ties | Vecmedical | 95001 | |
| Vicryl suture (5-0) | Ethicon | W9982 | |
| Percutaneous transedocardial injection | |||
| Artis Zee' C-Arm Fluoroscopy | Siemens | IR-19-1994 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Myostar' Injection Catheter | Biosense Webster | 121117S, 121119S, 1211120S | Intramyocardial injection catheter |
| No.11 scalpel | Swann-Morton | 203 | |
| Omnipaque' Iohexol Contrast | GE Healthcare | AUST R 39861 | Iodinated contrast agent |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sedation & general anaesthesia | |||
| Compound Sodium Lactate Hartmann's Solution | Free flex | 894451 | |
| Fentanyl 50 mcg/mL | Pfizer | AUST R 107027. | Intravenous anaesthesia and analgesia |
| Forthane' Isoflurane | Abbott | AUST R 29656 | Inhalant anaesthetic |
| GE Aestiva 5 Anaesthesia Machine | Datex Ohmeda | 17002-9, 17002A9 Avante Health Solutions | Anaesthetic Machine |
| Hypnovel' Midazolam 5 mg/mL | Roche | AUST R 13726 | Sedative |
| Intravenous cannula | BD Angiocath | 381137 | 20 gauge cannula |
| Ketamil' Ketamine 10 mg/mL | Ilium | APVMA number: 51188c | Sedative |
| Laryngoscope | Miller | VDI-6205 | |
| Medetomidine 1 mg/mL | Ilium | APVMA number 64251; ACVM number A10488 | Sedative |
| Metaraminol 10 mg/mL | Phebra | AUST R 284784 | Short-acting vasopressor |
| Methadone 10 mg/mL | Ilium | APVMA number: 63712 | Sedative, Restricted drug |
| Onsetron' Ondansetron 2 mg/mL | Accord Healthcare | AUST R 205593 | Anti-emetic |
| Propofol-Lipuro' Propofol 10 mg/mL | Braun | AUST R 142906 | Intravenous anaesthetic |
| Pulse Oximeter | Meditech | GVPMT-M3S | Portable pulse oximeter |
| Shiley' Cuffed Basic Endotracheal Tube (Size 5.5 & 6.0) | Medtronic | 86108-, 86109- | |
| Shiley' Intubating Stylet, 10 Fr | Medtronic | 85864 | |
| Sodium Chloride 0.9% | Free flex | FAH1322 | |
| Thoracotomy and epicardial Cell Injection | |||
| 27 G Insulin needle | Terumo | 51907 | |
| Adson Brown Tissue Forceps | Icon Medical Supplies | KLINI316012 | |
| CARTO' 3 System | Biosense Webster | Electrophysiological Mapping Software & System | |
| Cefazolin 1 g Vial | AFT Pharmaceuticals | 9421900137367 CH2 | Antibiotic Prophylaxis |
| Chest drainage tube | SurgiVet | SKU-336 | |
| Cook Access Needle | Cook Medical | G07174 | Cannulation needle |
| Cooley Sternotomy Retractor Paediatric | Millennium Surgical | 9-61287 | |
| Durogesic' 100 mcg/h Fentanyl Patch | Janssen | AUST R 112371 | Postoperative analgesia |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Electrosurgical Pencils with 'Edge' Coated Electrodes | Covidien | E2450H | Cautery Pencil |
| Fast-Cath' Introducer (6 French, 8 French) | Abbott | 406204, 406142 | Vascular sheath with introducer and guidewire |
| Lignocaine 20 mg/mL | Pfizer | AUST R 49296, AUST R 49297, AUST R 49293 and AUST R 49295. | Local anaesthesia, anti-arrhythmic |
| Marcaine' Bupivacaine 0.5% | Pfizer | AUST R 48328 | Local anaesthesia. |
| Metzenbaum Scissors | Icon Medical Supplies | ARMO3250 | |
| No. 22 scalpel | Swann-Morton | 208 | |
| Nylon Suture (2-0, 3-0) | Ethicon | D9635, JJ76264 | |
| Size 1 PDS suture | Ethicon | JJ75414 | |
| Sparq' Ultrasound System | Philips | MP11742 Medpick | |
| Sterile gauze | Kerlix | KE5072 | |
| Sterile laparotomy sponges | Propax | 2907950 | |
| Thermocool Smartouch' Catheter | Biosense Webster | D133601, D133602, D133603 | Epicardial Mapping Catheter |
Riferimenti
- Vogel, B., et al. ST-segment elevation myocardial infarction. Nature Reviews Disease Primers. 5 (1), 39 (2019).
- Niccoli, G., et al. Optimized treatment of ST-elevation myocardial infarction. Circulation Research. 125 (2), 245-258 (2019).
- Ezekowitz, J. A., et al. Declining in-hospital mortality and increasing heart failure incidence in elderly patients with first myocardial infarction. Journal of the American College of Cardiology. 53 (1), 13-20 (2009).
- Hastings, C. L., et al. Drug and cell delivery for cardiac regeneration. Advanced Drug Delivery Reviews. 84, 85-106 (2015).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: a translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Suzuki, Y., Yeung, A. C., Ikeno, F. The representative porcine model for human cardiovascular disease. Journal of Biomedicine and Biotechnology. 2011, 195483 (2011).
- Thavapalachandran, S., et al. Platelet-derived growth factor-AB improves scar mechanics and vascularity after myocardial infarction. Science Translational Medicine. 12 (524), (2020).
- Hou, D., et al. Radiolabeled cell distribution after intramyocardial, intracoronary, and interstitial retrograde coronary venous delivery: implications for current clinical trials. Circulation. 112, 150-156 (2005).
- Tousoulis, D., Briasoulis, A., Antoniades, C., Stefanadi, E., Stefanadis, C. Heart regeneration: what cells to use and how. Current Opinion in Pharmacology. 8 (2), 211-218 (2008).
- Bonnet, G., Ishikawa, K., Hajjar, R. J., Kawase, Y. Direct myocardial injection of vectors. Methods in Molecular Biology. 1521, 237-248 (2017).
- Marchlinski, F. E., Callans, D. J., Gottlieb, C. D., Zado, E. Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation. 101 (11), 1288-1296 (2000).
- Polin, G. M., et al. Endocardial unipolar voltage mapping to identify epicardial substrate in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart Rhythm. 8 (1), 76-83 (2011).
- Tatay, J. . Veterinary Sutures Handbook. , (2018).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocol. 7 (8), 1479-1496 (2012).
- Sun, S., et al. Establishing a swine model of post-myocardial infarction heart failure for stem cell treatment. Journal of Visualized Experiments. (159), e60392 (2020).
- Gwon, H. C., et al. The feasibility and safety of fluoroscopy-guided percutaneous intramyocardial gene injection in porcine heart. International Journal of Cardiology. 79 (1), 77-88 (2001).
- Krause, K., et al. Percutaneous intramyocardial stem cell injection in patients with acute myocardial infarction: first-in-man study. Heart. 95 (14), 1145-1152 (2009).
- Wang, X., Shangguan, W., Li, G. Angiotensin-(1-7) prevents atrial tachycardia induced-heat shock protein 27 expression. Journal of Electrocardiology. 51 (1-7), 117-120 (2018).
- Klatt, N., et al. Development of nonfibrotic left ventricular hypertrophy in an ANG II-induced chronic ovine hypertension model. Physiological Reports. 4 (17), 12897 (2016).
- Singh, B., Dyce, K. M. . Dyce, Sack, and Wensing's Textbook of Veterinary Anatomy. , (2018).
- Percie du Sert, N., et al. Reporting animal research: Explanation and elaboration for the ARRIVE guidelines 2.0. PLOS Biology. 18 (7), 3000411 (2020).
- Schüttler, D., et al. A practical guide to setting up pig models for cardiovascular catheterization, electrophysiological assessment and heart disease research. Lab Animals. 51 (2), 46-67 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon