A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحديد الكمي لتخليق دي نوفو الأحماض الدهنية في الأنسجة الدهنية البنية باستخدام أكسيد الديوتيريوم
* These authors contributed equally
In This Article
Summary
هنا ، نقدم طريقة كمية غير مكلفة باستخدام أكسيد الديوتيريوم وقياس الطيف الكتلي اللوني للغاز (GCMS) لتحليل تكوين الدهون الكلي للأحماض الدهنية في الأنسجة الدهنية البنية في الجسم الحي.
Abstract
تخليق الأحماض الدهنية هو مسار أيضي معقد ويتطلب طاقة عالية مع أدوار وظيفية مهمة في السيطرة على التوازن الأيضي للجسم بالكامل والعمليات الفسيولوجية والمرضية الأخرى. على عكس المسارات الأيضية الرئيسية الأخرى ، مثل التخلص من الجلوكوز ، لا يتم تقييم تخليق الأحماض الدهنية وظيفيا بشكل روتيني ، مما يؤدي إلى تفسيرات غير كاملة لحالة التمثيل الغذائي. بالإضافة إلى ذلك ، هناك نقص في البروتوكولات التفصيلية المتاحة للجمهور والمناسبة للقادمين الجدد في هذا المجال. هنا ، نصف طريقة كمية غير مكلفة باستخدام أكسيد الديوتيريوم وقياس الطيف الكتلي اللوني للغاز (GCMS) لتحليل تخليق الأحماض الدهنية الكلية دي نوفو في الأنسجة الدهنية البنية في الجسم الحي. تقيس هذه الطريقة تخليق منتجات سينسيز الأحماض الدهنية بشكل مستقل عن مصدر الكربون ، ومن المحتمل أن تكون مفيدة لأي نسيج تقريبا ، في أي نموذج فأر ، وتحت أي اضطراب خارجي. وترد تفاصيل عن إعداد العينة لنظام GCMS والحسابات النهائية. نحن نركز على تحليل الدهون البنية بسبب مستوياتها العالية من تخليق الأحماض الدهنية دي نوفو والأدوار الحاسمة في الحفاظ على التوازن الأيضي.
Introduction
السمنة والأمراض الأيضية المرتبطة بها هي جائحة تعرض الأجيال الحالية والمستقبلية للخطر 1,2. عادة ما يتم تبسيطه كنتيجة لعدم التوازن بين استهلاك الطاقة والإنفاق ، يؤثر عدم التنظيم الأيضي المرتبط بالسمنة على عدد كبير من المسارات الأيضية التي تتحكم فيها العوامل البيئية والداخلية3. ومع ذلك ، يتم اختبار عدد قليل فقط من المسارات بشكل روتيني في النماذج الحيوانية من عدم التنظيم الأيضي.
على سبيل المثال ، يتم قياس التخلص من الجلوكوز بشكل روتيني عن طريق اختبارات تحمل الجلوكوز والأنسولين ، ربما بسبب بساطة استخدام أجهزة مراقبة الجلوكوز المحمولة4. كما يتم تقدير المعدلات النسبية لجلوكوز الجسم بالكامل وأكسدة الدهون بشكل روتيني بناء على نسبة التبادل التنفسي من مقايسات القياس الحراري غير المباشر 5,6. ومع ذلك ، فإن غالبية جميع الجوانب الأخرى لعملية التمثيل الغذائي لا يتم تقييمها وظيفيا بشكل روتيني. هذا يؤدي إلى تفسيرات غير مكتملة لحالة التمثيل الغذائي والخيارات العلاجية المفقودة. واحدة من هذه المسارات الرئيسية هي دي نوفو ليبوجينيسيس.
De novo lipogenesis (DNL) هي العملية التي يتم من خلالها توليد أحماض دهنية جديدة من السلائف. يعتبر الجلوكوز السلائف الرئيسية التي تساهم في DNL7 لكامل الجسم ، ولكن السلائف الأخرى ، مثل الأسيتات والفركتوز واللاكتات والأحماض الأمينية المتفرعة السلسلة ، قد ثبت أنها مصادر كربون ذات صلة بطريقة مكانية وتعتمد على الحالة8،9،10،11،12. DNL هو مساهم رئيسي في التوازن الأيضي وهو ضروري للتطور الطبيعي13. بالإضافة إلى ذلك ، ارتبطت التغيرات في DNL بالسرطان 14,15 والتمثيل الغذائي 16,17,18 وأمراض القلب والأوعية الدموية 19,20.
يتكون مسار DNL من المكونات الأنزيمية الأساسية ATP citrate lyase (ACLY) ، و acetyl-CoA carboxylase (ACC1 / 2) ، وسينسيز الأحماض الدهنية (FAS) التي تنتج بشكل أساسي بالميتات ، وهو حمض دهني مشبع ب 16 كربونا. ومع ذلك ، يمكن أيضا إنتاج الأحماض الدهنية ذات السلسلة الفردية والمتفرعة بمعدلات أقل9. تعمل Elongases و desaturases على تعديل هذه الأحماض الدهنية ، مما يخلق مجموعة متنوعة من أنواع الأحماض الدهنية المفيدة لمجموعة متنوعة من الوظائف (على سبيل المثال ، تخزين الطاقة على المدى الطويل والتلاعب بسيولة الغشاء).
يتم التحكم في التعبير عن الآلية الأنزيمية DNL من خلال عدد قصير من عوامل النسخ. الأكثر وصفا حتى الآن تشمل عائلة بروتين ربط العناصر التنظيمية للستيرول (SREBP) ، وبروتين ربط عنصر استجابة الكربوهيدرات (ChREBP) ، ومستقبلات الكبد X (LXR) 21،22،23،24،25،26. على الرغم من التداخل الواضح في وظائفها ، فقد تم الإبلاغ عن اللوائح الفردية القائمة على هيمنة نوع الخلية والظروف الفسيولوجية أو المرضية21،22،27،28.
ومن اللافت للنظر أن عددا من مثبطات خطوات مختارة من مسار DNL قد تمت الموافقة عليها للاستخدام السريري أو في المراحل قبل السريرية أو السريرية من التطور لعدد من الأمراض ، بما في ذلك السمنة ومرض الكبد الدهني غير الكحولي / التهاب الكبد الدهني غير الكحولي (NAFLD / NASH) وأمراض القلب والأوعية الدموية29. تسلط هذه الجهود الضوء على أهمية DNL في الصحة والمرض.
في السنوات الأخيرة ، زاد استخدام طرق التقييم الكمي لتخليق الأحماض الدهنية الجديدة 30. الطريقة الأكثر شيوعا لتقييم ذلك هي استخدام الماء الثقيل المسمى (D2O) ، حيث يتم دمج الهيدروجين الثقيل المسمى في سلاسل الأسيل أثناء التخليق بشكل مباشر وغير مباشر ، عن طريق تبادل الديوتيريوم مع الهيدروجين من ركائز DNL NAPDH و acetyl-CoA و malonyl-CoA. على الرغم من أن هذا النهج يكتسب شعبية ، إلا أن هناك نقصا في البروتوكولات التفصيلية المتاحة للجمهور والمناسبة للقادمين الجدد في هذا المجال. هنا ، نحدد طريقة للتقييم الكمي لتوليف دي نوفو لمنتجات FAS باستخدام D2O وقياس الطيف الكتلي اللوني للغاز (GCMS) ، مع الحسابات التي طورها Lee et al.31 سابقا. تقيس هذه الطريقة تخليق الأحماض الدهنية بشكل مستقل عن مصدر الكربون ، ومن المحتمل أن تكون مفيدة لأي نسيج تقريبا ، في أي نموذج فأر ، وتحت أي اضطراب خارجي. هنا ، نركز على تحليل الأنسجة الدهنية البنية (BAT) بسبب مستوياتها العالية من DNL والأدوار الحاسمة في الحفاظ على التوازن الأيضي.
Protocol
تمت الموافقة على جميع التجارب من قبل لجنة رعاية واستخدام الحيوانات المؤسسية في المركز الطبي لمستشفى سينسيناتي للأطفال.
1. إعداد D2O
ملاحظة: لتجنب التباين التجريبي ، قم بإعداد محلول / مياه شرب كافية لجميع الفئران طوال مدة التجربة.
- للحقن داخل الصفاق: قم بتوليد 0.9٪ وزن / فولت ملحي D 2 O عن طريق إذابة 9 جم من كلوريد الصوديوم لكل لتر من D 2 O. قم بالتصفية من خلال مرشح0.2ميكرومتر غير بيروجيني للتعقيم.
- لشرب الماء D 2 O: قم بتوليد 8٪ v / v D2 O من المياه المخصبة لاستخدامها كمياه شرب عن طريق خلط 80 مل من D2O لكل920 مل من مياه الشرب العادية. يمكن الحصول على مياه الشرب العادية من منشأة الماوس. قم بالتصفية من خلال مرشح 0.2 ميكرومتر غير بيروجيني للتعقيم.
2. تعديل نشاط BAT عن طريق التأقلم مع درجة الحرارة
- افصل الفئران بحيث يكون هناك فأران لكل قفص قبل 2 أسابيع من بدء التأقلم مع درجة الحرارة. قم بتغيير إمدادات المياه إلى زجاجات المياه للفئران للتكيف مع جميع الأقفاص والحفاظ عليها عند 22 درجة مئوية.
- قم بإعداد الغرف البيئية للفأر قبل أسبوع واحد من بدء التأقلم في درجة الحرارة عن طريق ضبط درجات الحرارة المناسبة: 30 درجة مئوية للحياد الحراري ، و 22 درجة مئوية لدرجة حرارة الغرفة ، و 18 درجة مئوية للتعرض للبرد.
- في بداية التأقلم مع درجة الحرارة ، استبدل الأقفاص بأخرى جديدة بدون إثراء بيئي (لتجنب الأعشاش). انقل الأقفاص إلى درجات حرارة كل منها.
ملاحظة: ستبقى الأقفاص المخصصة للحياد الحراري عند 30 درجة مئوية لمدة 4 أسابيع. ستبقى الأقفاص المخصصة لدرجة حرارة الغرفة عند 22 درجة مئوية لمدة 4 أسابيع. ستصبح الأقفاص المخصصة للتعرض للبرد أكثر برودة تدريجيا وفقا لجدول أسبوعي: 18 درجة مئوية للأسبوع الأول ، و 14 درجة مئوية للأسبوع الثاني ، و 10 درجات مئوية للأسبوع الثالث ، و 6 درجات مئوية للأسبوع الرابع. - تغيير الأقفاص المتسخة أسبوعيا لجميع الظروف. بالإضافة إلى ذلك ، استبدل زجاجات الطعام والماء بأخرى جديدة تم تكييفها مسبقا عند درجة حرارة مناسبة لمدة 24 ساعة على الأقل.
ملاحظة: ضع في اعتبارك كميات الطعام المضافة كل أسبوع ، خاصة بالنسبة للفئران في البرد ، لأنها ستستهلك كمية أكبر بكثير من الطعام مقارنة بالظروف العادية. توفير الغذاء الإعلاني.
3. إدارة D2O
- حقن كل بمحلول ملحي 0.9٪ وزن / وزن D2O عند 35 ميكرولتر / غرام من وزن الجسم ، قبل 12 ساعة - 3 أيام من جمع الأنسجة ، عن طريق الحقن داخل الصفاق باستخدام حقنة 1 مل وإبرة 26 جرام.
ملاحظة: يرجى الاطلاع على قسم المناقشة للحصول على مزيد من المعلومات حول اختيار وقت مناسب لوضع العلامات. - قم بتغيير زجاجات المياه إلى زجاجات تحتوي على 8٪ v / vD 2O- مياه شرب مخصبة.
4. جمع ومعالجة وتخزين البلازما والأنسجة
- في نهاية التجربة ، التضحية بالفئران باستخدام منهجيات معتمدة (على سبيل المثال ، جرعة زائدة من ثاني أكسيد الكربون تليها خلع عنق الرحم).
- استخدم ضمادات الحرارة / البرودة أو طرق أخرى لتجنب التغيرات المفاجئة في درجات الحرارة قبل القتل الرحيم التي قد تؤثر على النتائج. القتل الرحيم للفئران باتباع المنهجيات المعتمدة. انتقل فورا إلى جمع الدم والأنسجة.
- جمع الدم من خلال ثقب القلب باستخدام إبرة 26 غرام وتخزينها في أنبوب جمع الدم من حمض الإيثيلين ديامينيترايتيك. الحفاظ على الدم على الجليد حتى مزيد من المعالجة.
- قطع الجلد على طول الخط الأوسط من الجزء الخلفي من الماوس من المنطقة السفلية من التجويف الصدري حتى المنطقة العليا من الرقبة ، مع سحب الجلد لأعلى لتجنب التأثير على الأنسجة تحت الجلد. يقع BAT بين الكتفين بين لوحي الكتف تحت طبقة رقيقة من الأنسجة الدهنية البيضاء ، ويتكون من فصين هرميين الشكل.
- نظف الأنسجة عن طريق غسلها في محلول ملحي مخزن بالفوسفات البارد (PBS). ربت على منشفة ورقية للتخلص من السوائل الزائدة ، ووزنها على مقياس تحليلي ، وجمعها في أنبوب دقيق.
- فلاش على الفور تجميد الأنسجة باستخدام النيتروجين السائل. يمكن أيضا جمع مستودعات BAT الأخرى.
- أجهزة الطرد المركزي عينات الدم عند 10000 × جم لمدة 10 دقائق عند 4 درجات مئوية. بعد الطرد المركزي ، اجمع البلازما بعناية دون إزعاج حبيبات خلايا الدم الحمراء. قم بنقله إلى أنبوب دقيق جديد بارد وتجميد فلاش في النيتروجين السائل.
- قم بتخزين عينات الدهون البنية والبلازما في درجة حرارة -80 درجة مئوية حتى الاستخدام.
5. استخراج الدهون من الأنسجة الدهنية
- قبل البدء في الاستخراج
- تحضير محلول 1 mM من حمض hexadecenoic-d31 في الميثانول في قارورة زجاجية. سيكون هذا بمثابة معيار الأحماض الدهنية الداخلية.
- قم بتبريد الكمية المطلوبة من الكلوروفورم (CHCl 3) والميثانول (CH3OH) مسبقا في مجمد -80 درجة مئوية ، أو على الثلج الجاف.
ملاحظة: يمكن إضافة مضادات الأكسدة di-tert-butyl-4-methylphenol (BHT) إلىCHCl 3 بتركيز 0.01٪ وزن / فولت (2.5 مجم / 25 مل) لمنع أكسدة الروابط المزدوجة في الأحماض الدهنية غير المشبعة. - أنابيب طرد مركزي دقيقة قبل التسمية لكل عينة من الأنسجة وأنبوب إضافي لاستخدامه في استخراج فارغ.
تنبيه: CH 3 OH و CHCl3متقلبان للغاية وسامان إذا تم استنشاقهما. استخدم فقط في أغطية الدخان.
ملاحظة: العلامات التجارية المختلفة لأنابيب الطرد المركزي الدقيقة لها مستويات مختلفة من بالميتات الخلفية والقدرات من حيث منع تسرب المذيبات. نوصي باختبار مجموعة متنوعة من الأنابيب أولا ، لضمان منع تسرب المذيبات وأن الأنابيب تحتوي على مستويات دنيا من بالميتات الملوثة. يرجى الاطلاع على Yao et al.32 لمزيد من المناقشة.
- أخرج العينات من الفريزر وضعها على الثلج الجاف.
- ضع أنبوب الطرد المركزي الدقيق المسمى مسبقا على ميزان تحليلي وقم بتفريغ الميزان. ضع ملاقط ومشرط / شفرة حلاقة فولاذية على الثلج الجاف لمدة 10-20 ثانية لتبرد.
- استخدم الملقط لإخراج عينة الأنسجة المجمدة من الأنبوب ووضعها على قارب وزن بلاستيكي. يمكن وضع وعاء الوزن على كتلة مسطحة من الثلج الجاف أو سطح آخر مبرد مسبقا.
- باستخدام مشرط أو شفرة حلاقة فولاذية ، قم بتشريح جزء صغير من الأنسجة ، أي ما يعادل 5-15 ملغ في الوزن. ضع في أنبوب الطرد المركزي الدقيق وسجل الوزن الدقيق. كرر لكل عينة. يمكن تخزين العينات في الفريزر في هذه المرحلة أو يمكن تقديمها إلى الخطوات أدناه لاستخراج الدهون.
ملاحظة: تأكد من تنظيف المشرط بشكل صحيح باستخدام 70٪ من الإيثانول بين العينات واستخدام وعاء وزن جديد بين كل عينة.
- أضف 1 ميكرولتر / مجم من حمض 10 mM hexadecenoic-d 31 (C16: 0-d31) لكل عينة.
تنبيه: يجب تنفيذ الخطوات التالية (5.4 إلى 5.8) تحت غطاء دخان بسبب خطر استنشاق المذيبات. - أضف 250 ميكرولتر من CH 3 OH ، و 250 ميكرولتر من H2O ، و 500 ميكرولتر من CHCl3إلى كل عينة بثلاث حبات من الفولاذ المقاوم للصدأ 5 مم. ضع الأنابيب في كتلة مبردة مسبقا من مطحنة الطحن واخلط العينات بتردد اهتزازي 25 هرتز لمدة 5 دقائق ، أو استخدم الإرشادات الموصى بها من قبل الشركة المصنعة لعينات الأنسجة. قم بإزالة الخرزات باستخدام المغناطيس.
- أجهزة الطرد المركزي العينات عند 12000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
ملاحظة: بعد الطرد المركزي ، يجب ملاحظة فصل ثنائي الطور واضح مع المرحلة المائية العليا التي تحتوي على المستقلبات القطبية والمرحلة العضوية السفلية التي تحتوي على الدهون والأحماض الدهنية. إذا لم يلاحظ أي فصل ، أضف 250 ميكرولتر من H2O وكرر خطوات الدوامة والطرد المركزي. - باستخدام ماصة دقيقة ، خذ حجما ثابتا من المرحلة السفلية لكل عينة إلى أنابيب الطرد المركزي الدقيقة الموسومة المقابلة.
- أضف 500 ميكرولتر من CHCl3 إلى العينة المتبقية وكرر الخطوات 5.6-5.7.
- ضع العينات تحت غاز النيتروجين أو في فراغ طرد مركزي مبرد مقاوم ل CHCl3 عند 4 درجات مئوية حتى يجف تماما. يمكن تخزين العينات المجففة عند -20 درجة مئوية حتى تصبح جاهزة للاشتقاق.
ملاحظة: يمكن أيضا جمع الطبقة العليا من كل عينة في هذه المرحلة وتجفيفها كما في الخطوة 5.9 من أجل تحليل المستقلبات القطبية.
6. تحضير استرات ميثيل الأحماض الدهنية (FAMEs) وتحليل GCMS
- الأسترة المحفزة بالحمض والأسترة التبادلية لتحضير FAMEs
تنبيه: يجب تنفيذ الخطوات التالية تحت غطاء دخان بسبب خطر استنشاق المذيبات.- إذا تم تخزين العينات في الفريزر ، جففها تحت النيتروجين لمدة 5 دقائق لضمان عدم وجود ماء.
- باستخدام مذيبات من الدرجة MS ، ماصة 98 مل من CH3OH اللامائي في زجاجة وسائط زجاجية. أضف ببطء 2 مل من حمض الكبريتيك اللامائي في غطاء الدخان لتكوين 2٪ H2SO4 في CH3OH. تخلط عن طريق تحريك الزجاجة المغلقة.
- أضف 500 ميكرولتر من 2٪ H2SO4 في محلول CH3OH لكل عينة ودوامة لفترة وجيزة.
- احتضان العينات على كتلة حرارية عند 50 درجة مئوية لمدة 2 ساعة.
- أزل العينات من الكتلة الحرارية وأضف 100 ميكرولتر من محلول كلوريد الصوديوم المشبع و500 ميكرولتر من الهكسان إلى كل عينة.
- دوامة العينات بقوة في درجة حرارة الغرفة لمدة 1 دقيقة. اترك العينات للجلوس لمدة 1 دقيقة ؛ يجب أن تكون مرحلتان واضحتين بعد ذلك.
- جمع المرحلة العليا في أنبوب طرد مركزي دقيق جديد (انظر الملاحظة في القسم 5.1.3 للاختيار المناسب لأنبوب الطرد المركزي الدقيق).
- لزيادة العائد إلى أقصى حد ، كرر الخطوات 6.1.5-6.1.7 ، مع جمع العينة الثانية في نفس الأنابيب الموسومة.
- تجفيف العينات في درجة حرارة الغرفة تحت غاز النيتروجين.
- أعد تعليق العينات في 20 ميكرولتر / مجم من الهكسان ، بالنسبة لوزن الأنسجة الأصلي ، وانقلها على الفور إلى قارورة GC الزجاجية مع ملحق زجاجي.
ملاحظة: اعمل بسرعة أثناء نقل العينات لتقليل التبخر.
- تحليل GCMS
- لتحديد وفرة نظائر FAME ، قم بحقن العينات على مطياف كتلة كروماتوغرافيا غاز رباعي الأقطاب (GCMS).
ملاحظة: بينما يمكن استخدام العديد من أنواع الأعمدة للكشف عن البالميتات ، تم إنشاء برنامج درجة الحرارة التالي لعمود GCMS الذي تم تطويره لفصل الأحماض الدهنية cis/trans isomers، كما هو مفصل في جدول المواد. يبلغ طول هذا العمود 50 مترا وقطره الداخلي 0.25 مم. - حقن 1 ميكرولتر من العينة في مدخل منفصل / غير مقسم عند درجة حرارة مدخل 270 درجة مئوية ، باستخدام الهيليوم كغاز حامل ، يتدفق بسرعة 1 مل / دقيقة. استخدم حقنة غير مقسمة للأحماض الدهنية منخفضة الوفرة بتدفق إجمالي 19 مل / دقيقة ، وتطهير الحاجز 3 مل / دقيقة ، وتدفق تطهير لتقسيم فتحة التهوية 15 مل / دقيقة عند 0.75 دقيقة. استخدم نسبة تقسيم 10: 1-40: 1 للأحماض الدهنية الوفيرة مثل بالميتات وأوليات.
- استخدم معلمات الفرن التالية: درجة حرارة أولية 80 درجة مئوية ؛ زيادة بمقدار 20 درجة مئوية / دقيقة إلى 170 درجة مئوية ؛ زيادة بمقدار 1 درجة مئوية / دقيقة إلى 204 درجة مئوية ؛ زيادة بمقدار 20 درجة مئوية / دقيقة إلى 250 درجة مئوية ؛ ثم امسكها عند 250 درجة مئوية لمدة 10 دقائق.
- استخدم معلمات الكاشف الانتقائي للكتلة (MSD) التالية: وضع تأين تأثير الإلكترون 70 فولت والمسح على مدى 50-400 م / ض بسرعة مسح تبلغ 1562 (u / s) وتردد 4.1 مسح / ثانية. استخدم خط نقل عند 280 درجة مئوية ، ومصدر أيون عند 230 درجة مئوية ، ورباعي القطب عند 150 درجة مئوية.
ملاحظة: يمكن استخدام أعمدة أخرى، ولكن سيختلف برنامج درجة الحرارة. - تسلسل العينة: قم بترتيب عينة الحقن عشوائيا وحقن فراغين أو ثلاثة فراغات على الأقل من الهكسان في بداية التسلسل ، بعد كل عينة خامسة داخل التسلسل ، واثنين أو ثلاثة في نهاية التسلسل.
- استخدم برنامجا خاصا بالأداة ، أو برنامجا مجانيا مفتوح الوصول مثل Metabolite-Detector33 ، لدمج الأيونات في الجدول 1 لكل إستر ميثيل الأحماض الدهنية.
ملاحظة: لقد حددنا الأيونات التي تغطي نظائر M1-M5 في الجدول 1 التي وجدناها تغطي كمية دمج الديوتيريوم مع نافذة وضع العلامات هذه. ومع ذلك ، قد يلزم توسيع هذا إذا كان تدفق de novo أعلى بكثير و / أو تم استخدام وقت أطول لوضع العلامات. - استخدم وفرة كل أيون متكامل لتوليد توزيع نظائر الكتلة ، حيث يمكن تحويل شدة الأيونات إلى وفرة كسرية بحيث يساوي مجموع توزيع النظائر الكتلية واحدا. يرجى الاطلاع على مثال جدول البيانات في الملف التكميلي.
ملاحظة: من أجل تحديد اندماج الديوتيريوم بدقة، يجب استخدام تصحيح وفرة النظائر الطبيعية للسماح بوجود نظائر تحدث بشكل طبيعي مثل 13C و 15N و 2H. يتم تنفيذ ذلك عن طريق تطبيق مصفوفة تصحيح كما هو موضح من قبل Fernandez et al.34,35 ، ولا يمكن إجراؤها عن طريق طرح MID لمستقلب مقاس غير مسمى من مستقلب موسوم. في الممارسة العملية ، نوصي باستخدام البرامج المتاحة مجانا مثل fluxfix 36 أو polyMID37 أو IsoCor38 لتحويل البيانات الخام إلى MIDs كسرية ، وقد قدمنا صيغة تصحيح النظائر لمنتجات إستر الميثيل من FAS في الجدول 1. - لتحديد كمية البالميتات الموجودة ، استخدم الصيغة التالية:
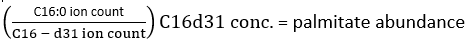
حيث يشير عدد الأيونات إلى مجموع جميع نظائر بالميتات المدمجة في الجدول 1 و C16: 0-d 31 يشير إلى المعيار الداخلي سداسي عشري-d31. يشكل المعيار الداخلي ذروة منفصلة عن تلك الموجودة في البالميتات الذاتية. يمكن أيضا تحديد الوفرة النسبية للأحماض الدهنية الأخرى ، ولكن قد يلزم استخدام المعايير الداخلية للنظائر الخاصة بالأحماض الدهنية (مع تحولات الكتلة أكبر من تلك التي لوحظت من دمج D2O) أو المنحنيات القياسية الخارجية للقياس الكمي الكامل. استخدم العينة المستخرجة الفارغة لتحديد مقدار بالميتات الخلفية واطرحها من قيمة الأنسجة النهائية. - احسب التخصيب المولي (ME) للبالميتات بالمعادلة الآتية:
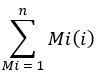
حيث Mi هي الوفرة الكسرية الطبيعية لنظائر بالميتات ، و n هو عدد نظائر بالميتات المحتملة. على سبيل المثال ، ME لجزيء بالميتات مع التوزيع الكسري التالي ، M1 = 0.25 ، M2 = 0.08 ، M3 = 0.02 ، هو: (0.025 * 1) + (0.08 * 2) + (0.02 * 3) = 0.245 (انظر الملف التكميلي).
- لتحديد وفرة نظائر FAME ، قم بحقن العينات على مطياف كتلة كروماتوغرافيا غاز رباعي الأقطاب (GCMS).
7. تبادل أسيتون الديوتيريوم لعينات البلازما لتحديد إثراء مياه الجسم
- رد فعل
- إعداد 10 معايير الديوتيريوم في الماء ، تتراوح بين 0-9 ٪ v / v.
- قم بإعداد محلول الأسيتون / الأسيتونيتريل 5٪ v / v مما يسمح ب 4 ميكرولتر لكل عينة ، بما في ذلك المعايير من الخطوة 5.1.1.
- في أنابيب الطرد المركزي الدقيقة ذات القفل الآمن ، اجمع بين 10 ميكرولتر من كل عينة بلازما أو معيار ، و 4 ميكرولتر من 10 M هيدروكسيد الصوديوم ، و 4 ميكرولتر من 5٪ أسيتون / أسيتونيتريل. نفذ ذلك في ثلاث نسخ لكل عينة.
- امزج العينات برفق عن طريق الماصة. اسمح للعينات بالاحتضان في درجة حرارة الغرفة طوال الليل.
- إستخلاص
- بعد الحضانة ، أضف 450-550 مجم من Na2SO4 إلى كل عينة.
- في غطاء الدخان ، أضف 600 ميكرولتر من CHCl3 إلى كل أنبوب ودوامة قوية لمدة 15 ثانية.
- أجهزة الطرد المركزي العينات في 300 × ز لمدة 2 دقيقة.
- تحت غطاء الدخان ، انقل ثلاث نسخ ، 80 ميكرولتر من المواد الطافية من كل عينة إلى قوارير GCMS الزجاجية الموسومة مع إدخالات زجاجية وغطاء بإحكام.
- تحليل GCMS
- عينات منفصلة على عمود (30 م ، 0.25 مم معرف ، Agilent DB-35MS) وتحليلها على مطياف الكتلة المرفق.
- حقن 1 ميكرولتر من العينة في مدخل منفصل / غير مقسم ، بنسبة انقسام 40: 1 ، وتدفق هيليوم 1 مل / دقيقة ، ودرجة حرارة مدخل 270 درجة مئوية.
- استخدم معلمات الفرن التالية: درجة حرارة أولية تبلغ 60 درجة مئوية ، وزيادة بمقدار 20 درجة مئوية / دقيقة إلى 100 درجة مئوية ، وزيادة بمقدار 50 درجة مئوية / دقيقة إلى 220 درجة مئوية ، ثم الاحتفاظ بها عند 220 درجة مئوية لمدة 1 دقيقة.
- استخدم معلمات الكاشف الانتقائي للكتلة (MSD) التالية: وضع تأين تأثير الإلكترون عند 70 فولت مع مراقبة أيونية مختارة تبلغ 58 و 59 م / ض. استخدم خط نقل عند 280 درجة مئوية ، ومصدر أيون عند 230 درجة مئوية ، ورباعي القطب عند 150 درجة مئوية.
ملاحظة: يمكن استخدام أعمدة أخرى منخفضة النزف ، مترابطة ، متشابكة ، متوسطة القطبية ، لكن برنامج درجة الحرارة سيختلف.
- اضبط طريقة أخذ العينات السائلة لتبدأ بغسل CHCl3 ثم تسلسل عشوائي للعينات ، بما في ذلك خطوات غسيل CHCl3 إضافية كل ست عينات.
ملاحظة: إذا تم استخدام الأسيتون كغسول بالإبرة لجهاز أخذ العينات الأوتوماتيكي ، فاستبدله بCHCl 3 أو الهكسان وقم بحقن عدة عينات فارغة من CHCl3 حتى تصبح أي قمة أسيتون ملوثة غير واضحة في الكروماتوجرام. - باستخدام هذه الطريقة ، تذوب قمة الأسيتون في حوالي 1.25 دقيقة. دمج البيانات وحساب الوفرة الكسرية لتخصيب الأسيتون باتباع الخطوات 6.2.6-6.2.7 ، مع تعديل لتحليل القمم التي تحتوي على نسبة m / z من 58-z كما هو موضح في الجدول 1.
- استخدم المعايير لإنشاء منحنى قياسي لتحديد النسبة المئوية لتخصيب مياه الجسم (p) لعينات الاختبار ، بناء على الإثراء الجزئي للأسيتون.
- عينات منفصلة على عمود (30 م ، 0.25 مم معرف ، Agilent DB-35MS) وتحليلها على مطياف الكتلة المرفق.
8. في الجسم الحي دي نوفو حسابات تكوين الدهون
- احسب جزء الأحماض الدهنية المركبة حديثا (FNS) التي هي منتجات مباشرة ل FAS (أي بالميتات والأحماض الدهنية ذات السلسلة الفردية و mmBCFAs) في كل عينة باستخدام المعادلة التالية:
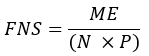
حيث ME هو متوسط التخصيب المولي لجزيء بالميتات (الخطوة 6.2.9) ، p هو تخصيب الديوتيريوم في الماء من عينة البلازما المقابلة (الخطوة 7.3.4) ، و N هو عدد ذرات الهيدروجين القابلة للتبادل على بالميتات حيث يمكن دمج الديوتيريوم. - حدد N باستخدام المعادلة أدناه التي أنشأها Lee et al.31:
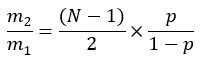
- حدد الكمية المولية للأحماض الدهنية المركبة حديثا (MNS) عن طريق:
MNS = FNS × إجمالي كمية الأحماض الدهنية (نانومول / ملغ).
ملاحظة: على سبيل المثال ، إذا تم الحصول على إثراء مولي بالميتات (ME) قدره 0.245 ، وإثراء الديوتيريوم في ماء الجسم (p) قدره 0.045 ، وعدد N محسوب من 22 ، فإن التوليف الكسري للبالميتات هو 0.247. إذا كانت كمية البالميتات الموجودة في الأنسجة 2 ملليمول / مجم ، فإن مليمول بالميتات المخلقة حديثا هو 0.494 مليمول / مجم (انظر الملف التكميلي).
النتائج
استنادا إلى جرعات D 2 O الموصوفة في الخطوة 1 ، نجد عادة أن مياه الجسم غنية في حدود2.5٪ إلى 6٪ ، وأن مستوى خط الأساس لتخصيب الديوتيريوم في مياه الجسم يتحقق بسرعة في ساعة واحدة ويتم الحفاظ عليه طوال مدة الدراسة عن طريق مياه الشرب المخصبة بنسبة 8٪ (الشكل 1). التخصيب المستم?...
Discussion
يعد فهم التوازن والتفاعل بين المسارات الأيضية المعقدة خطوة لا غنى عنها نحو فهم الأساس البيولوجي للأمراض المرتبطة بالتمثيل الغذائي. هنا ، نعرض منهجية غير جراحية وغير مكلفة لتحديد التغييرات في تخليق الأحماض الدهنية دي نوفو. هذه الطريقة مقتبسة من الطرق المنشورة سابقا والتي طورت حسابات...
Disclosures
ليس لدى المؤلفين ما يفصحون عنه.
Acknowledgements
نشكر أعضاء مختبر سانشيز جورماتشيس ووالاس على المناقشات القيمة. تم دعم هذا العمل بمنح من جمعية القلب الأمريكية (18CDA34080527 إلى JSG و 19POST34380545 إلى RM) ، والمعاهد الوطنية للصحة (R21OD031907 إلى JSG) ، وجائزة مجلس أمناء CCHMC ، وجائزة مركز CCHMC لعلم جينوم الأطفال ، وجائزة مركز CCHMC لعلم الجينوم والعلاجات المندلية. تم دعم هذا العمل جزئيا من قبل NIH P30 DK078392 من المركز الأساسي لأبحاث أمراض الجهاز الهضمي في سينسيناتي. المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة الآراء الرسمية للمعاهد الوطنية للصحة. تم دعم RT و MW من خلال زمالة UCD Ad Astra.
Materials
| Name | Company | Catalog Number | Comments |
| 4 mL Glass Vials | Fisher Scientific | 14-955-334 | |
| 0.2 µm filter | Olympus Plastic | 25-244 | |
| 26G needeled syringes | BD | 309597 | |
| Acetone | Merck | 34850 | |
| Acetonitrile | Merck | 900667 | |
| Blue GC screw cap with septa | Agilent | 5190-1599 | |
| Centrifuge | Eppendorf | 5424R | |
| Chloroform | Sigma | 366927 | |
| Deuterium oxide | Sigma | 151882 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Merck | B1378 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Agilent | CP7419 | |
| EDTA tube | Sarstedt | 411395105 | |
| Ethanol | Merck | 51976 | |
| Hexadecenoic-d31 Acid | Larodan | 71-1631 | |
| Hexane | Merck | 34859 | |
| Methanol | Merck | 34860 | |
| Microcentrifuge tube | Olympus Plastic | 24-282 | |
| Mouse environmental chamber | Caron | Caron 7001-33 | |
| Potasium Chloride | Fisher Bioreagents | BP366-500 | |
| Potasium Phosphate | MP Biomedicals | 194727 | |
| SafeLock microcentrifuge tubes | Eppendorf | 30120086 | |
| Screw top amber GC vial | Agilent | 5182-0716 | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Hydroxide | Merck | S5881 | |
| Sodium Phosphate, dibasic | Fisher Bioreagents | BP332-500 | |
| Sodium Sulfate | Merck | 239313 | |
| Sulfuric Acid | Merck | 258105 | |
| Vial insert | Agilent | 5183-2088 |
References
- . The Lancet, Diabetes Endocrinology. Childhood obesity: a growing pandemic. The Lancet. Diabetes & Endocrinology. 10 (1), 1 (2022).
- Gonzalez-Muniesa, P., et al. Obesity. Nature Reviews Disease Primers. 3, 17034 (2017).
- Müller, T. D., Blüher, M., Tschöp, M. H., DiMarchi, R. D. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21 (3), 201-223 (2021).
- Virtue, S., Vidal-Puig, A. GTTs and ITTs in mice: simple tests, complex answers. Nature Metabolism. 3 (7), 883-886 (2021).
- Müller, T. D., Klingenspor, M., Tschöp, M. H. Revisiting energy expenditure: how to correct mouse metabolic rate for body mass. Nature Metabolism. 3 (9), 1134-1136 (2021).
- Virtue, S., Lelliott, C. J., Vidal-Puig, A. What is the most appropriate covariate in ANCOVA when analysing metabolic rate. Nature Metabolism. 3 (12), 1585 (2021).
- Hellerstein, M. K. De novo lipogenesis in humans: metabolic and regulatory aspects. European Journal of Clinical Nutrition. 53 Suppl 1, S53-S65 (1999).
- Zhao, S., et al. Dietary fructose feeds hepatic lipogenesis via microbiota-derived acetate. Nature. 579 (7800), 586-591 (2020).
- Wallace, M., et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nature Chemical Biology. 14 (11), 1021-1031 (2018).
- Zhao, S., et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch. Cell Reports. 17 (4), 1037-1052 (2016).
- Green, C. R., et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. Nature Chemical Biology. 12 (1), 15-21 (2016).
- Zhang, Z., et al. Serine catabolism generates liver NADPH and supports hepatic lipogenesis. Nature Metabolism. 3 (12), 1608-1620 (2021).
- Chirala, S. S., et al. Fatty acid synthesis is essential in embryonic development: fatty acid synthase null mutants and most of the heterozygotes die in utero. Proceedings of the National Academy of Sciences. 100 (11), 6358-6363 (2003).
- Icard, P., et al. ATP citrate lyase: A central metabolic enzyme in cancer. Cancer Letters. 471, 125-134 (2020).
- Fhu, C. W., Ali, A. Fatty acid synthase: an emerging target in cancer. Molecules. 25 (17), 3935 (2020).
- Lawitz, E. J., et al. Acetyl-CoA carboxylase inhibitor GS-0976 for 12 weeks reduces hepatic de novo lipogenesis and steatosis in patients with nonalcoholic steatohepatitis. Clinical Gastroenterology and Hepatology. 16 (12), 1983e3-1991e3 (2018).
- Smith, G. I., et al. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. The Journal of Clinical Investigation. 130 (3), 1453-1460 (2020).
- Imamura, F., et al. Fatty acids in the de novo lipogenesis pathway and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Medicine. 17 (6), e1003102 (2020).
- Lai, H. T. M., et al. Serial plasma phospholipid fatty acids in the de novo lipogenesis pathway and total mortality, cause-specific mortality, and cardiovascular diseases in the cardiovascular health study. Journal of the American Heart Association. 8 (22), e012881 (2019).
- Ference, B. A., et al. Mendelian randomization study of ACLY and cardiovascular disease. The New England Journal of Medicine. 380 (11), 1033-1042 (2019).
- Herman, M. A., et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature. 484 (7394), 333-338 (2012).
- Sanchez-Gurmaches, J., et al. Brown fat AKT2 Is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis. Cell Metabolism. 27 (1), 195e6-209e6 (2018).
- Wang, X., et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. II. Purification and characterization. The Journal of Biological Chemistry. 268 (19), 14497-14504 (1993).
- Briggs, M. R., Yokoyama, C., Wang, X., Brown, M. S., Goldstein, J. L. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence. The Journal of Biological Chemistry. 268 (19), 14490-14496 (1993).
- Yokoyama, C., et al. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell. 75 (1), 187-197 (1993).
- Chen, G., Liang, G., Ou, J., Goldstein, J. L., Brown, M. S. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver. Proceedings of the National Academy of Sciences. 101 (31), 11245-11250 (2004).
- Denechaud, P. D., et al. ChREBP, but not LXRs, is required for the induction of glucose-regulated genes in mouse liver. The Journal of Clinical Investigation. 118 (3), 956-964 (2008).
- Crewe, C., et al. SREBP-regulated adipocyte lipogenesis is dependent on substrate availability and redox modulation of mTORC1. JCI Insight. 5 (15), e129397 (2019).
- Batchuluun, B., Pinkosky, S. L., Steinberg, G. R. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nature Reviews Drug Discovery. 21 (4), 283-305 (2022).
- Wallace, M., Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Seminars in Cell & Developmental Biology. 108, 65-71 (2020).
- Lee, W. N., et al. In vivo measurement of fatty acids and cholesterol synthesis using D2O and mass isotopomer analysis. The American Journal of Physiology. 266 (5 Pt 1), E699-E708 (1994).
- Yao, C. H., Liu, G. Y., Yang, K., Gross, R. W., Patti, G. J. Inaccurate quantitation of palmitate in metabolomics and isotope tracer studies due to plastics. Metabolomics. 12, 143 (2016).
- Hiller, K., et al. MetaboliteDetector: comprehensive analysis tool for targeted and nontargeted GC/MS based metabolome analysis. Analytical Chemistry. 81 (9), 3429-3439 (2009).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. Journal of Mass Spectrometry. 31 (3), 255-262 (1996).
- Midani, F. S., Wynn, M. L., Schnell, S. The importance of accurately correcting for the natural abundance of stable isotopes. Analytical Biochemistry. 520, 27-43 (2017).
- Trefely, S., Ashwell, P., Snyder, N. W. FluxFix: automatic isotopologue normalization for metabolic tracer analysis. BMC Bioinformatics. 17 (1), 485 (2016).
- Jeong, H., et al. Correcting for naturally occurring mass isotopologue abundances in stable-isotope tracing experiments with PolyMID. Metabolites. 11 (5), 310 (2021).
- Millard, P., et al. IsoCor: isotope correction for high-resolution MS labeling experiments. Bioinformatics. 35 (21), 4484-4487 (2019).
- Brunengraber, D. Z., et al. Influence of diet on the modeling of adipose tissue triglycerides during growth. American Journal of Physiology. Endocrinology and Metabolsim. 285 (4), E917-E925 (2003).
- Svensson, R. U., et al. Inhibition of acetyl-CoA carboxylase suppresses fatty acid synthesis and tumor growth of non-small-cell lung cancer in preclinical models. Nature Medicine. 22 (10), 1108-1119 (2016).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: a technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263 (5 Pt 1), E988-E1001 (1992).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Kelleher, J. K., Masterson, T. M. Model equations for condensation biosynthesis using stable isotopes and radioisotopes. The American Journal of Physiology. 262 (1 Pt 1), E118-E125 (1992).
- Kelleher, J. K., Nickol, G. B. Isotopomer spectral analysis: utilizing nonlinear models in isotopic flux studies. Methods in Enzymology. 561, 303-330 (2015).
- Argus, J. P., et al. Development and application of FASA, a model for quantifying fatty acid metabolism using stable isotope labeling. Cell Reports. 25 (10), 2919.e8-2934.e8 (2018).
- Guilherme, A., et al. Control of adipocyte thermogenesis and lipogenesis through β3-adrenergic and thyroid hormone signal integration. Cell Reports. 31 (5), 107598 (2020).
- Guilherme, A., et al. Neuronal modulation of brown adipose activity through perturbation of white adipocyte lipogenesis. Molecular Metabolism. 16, 116-125 (2018).
- Guilherme, A., et al. Adipocyte lipid synthesis coupled to neuronal control of thermogenic programming. Molecular Metabolism. 6 (8), 781-796 (2017).
- Lodhi, I. J., et al. Inhibiting adipose tissue lipogenesis reprograms thermogenesis and PPARgamma activation to decrease diet-induced obesity. Cell Metabolism. 16 (2), 189-201 (2012).
- McCormack, J. G., Denton, R. M. Evidence that fatty acid synthesis in the interscapular brown adipose tissue of cold-adapted rats is increased in vivo by insulin by mechanisms involving parallel activation of pyruvate dehydrogenase and acetyl-coenzyme A carboxylase. The Biochemistry Journal. 166 (3), 627-630 (1977).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Letters. 104 (1), 13-16 (1979).
- Negron, S. G., Ercan-Sencicek, A. G., Freed, J., Walters, M., Lin, Z. Both proliferation and lipogenesis of brown adipocytes contribute to postnatal brown adipose tissue growth in mice. Science Reports. 10 (1), 20335 (2020).
- Schlein, C., et al. Endogenous fatty acid synthesis drives brown adipose tissue involution. Cell Reports. 34 (2), 108624 (2021).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. Journal of Lipid Research. 55 (11), 2276-2286 (2014).
- Adlanmerini, M., et al. Circadian lipid synthesis in brown fat maintains murine body temperature during chronic cold. Proceedings of the National Academy of Sciences. 116 (37), 18691-18699 (2019).
- Yu, X. X., Lewin, D. A., Forrest, W., Adams, S. H. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB Journal. 16 (2), 155-168 (2002).
- Kushner, D. J., Baker, A., Dunstall, T. G. Pharmacological uses and perspectives of heavy water and deuterated compounds. Canadian Journal of Physiology and Pharmacology. 77 (2), 79-88 (1999).
- Diraison, F., Pachiaudi, C., Beylot, M. Measuring lipogenesis and cholesterol synthesis in humans with deuterated water: use of simple gas chromatographic/mass spectrometric techniques. Journal of Mass Spectrometry. 32 (1), 81-86 (1997).
- Yang, D., et al. Assay of low deuterium enrichment of water by isotopic exchange with [U-13C3]acetone and gas chromatography-mass spectrometry. Analytical Biochemistry. 258 (2), 315-321 (1998).
- Fu, X., et al. Measurement of lipogenic flux by deuterium resolved mass spectrometry. Nature Communications. 12 (1), 3756 (2021).
- Shah, V., Herath, K., Previs, S. F., Hubbard, B. K., Roddy, T. P. Headspace analyses of acetone: a rapid method for measuring the 2H-labeling of water. Analytical Biochemistry. 404 (2), 235-237 (2010).
- Argus, J. P., Yu, A. K., Wang, E. S., Williams, K. J., Bensinger, S. J. An optimized method for measuring fatty acids and cholesterol in stable isotope-labeled cells. Journal of Lipid Research. 58 (2), 460-468 (2017).
- Belew, G. D., Jones, J. G. De novo lipogenesis in non-alcoholic fatty liver disease: Quantification with stable isotope tracers. European Journal of Clinical Investigation. 52 (3), e13733 (2022).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Belew, G. D., et al. Transfer of glucose hydrogens via acetyl-CoA, malonyl-CoA, and NADPH to fatty acids during de novo lipogenesis. Journal of Lipid Research. 60 (12), 2050-2056 (2019).
- Diraison, F., Pachiaudi, C., Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water: determination of the average number of deuterium atoms incorporated. Metabolism. 45 (7), 817-821 (1996).
- Ajie, H. O., et al. In vivo study of the biosynthesis of long-chain fatty acids using deuterated water. The American Journal of Physiology. 269 (2 Pt 1), E247-E252 (1995).
- Schloerb, P. R., Friis-Hansen, B. J., Edelman, I. S., Solomon, A. K., Moore, F. D. The measurement of total body water in the human subject by deuterium oxide dilution; with a consideration of the dynamics of deuterium distribution. The Journal of Clinical Investigation. 29 (10), 1296-1310 (1950).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved