Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественное определение de novo синтеза жирных кислот в бурой жировой ткани с использованием оксида дейтерия
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем недорогой количественный метод с использованием масс-спектрометрии оксида дейтерия и газовой хроматографии (GCMS) для анализа общего липогенеза жирных кислот de novo в бурой жировой ткани in vivo.
Аннотация
Синтез жирных кислот является сложным и энергозатратным метаболическим путем, играющим важную функциональную роль в контроле метаболического гомеостаза всего организма и других физиологических и патологических процессов. В отличие от других ключевых метаболических путей, таких как утилизация глюкозы, синтез жирных кислот обычно функционально не оценивается, что приводит к неполной интерпретации метаболического статуса. Кроме того, в открытом доступе отсутствуют подробные протоколы, подходящие для новичков в этой области. В данной статье мы опишем недорогой количественный метод, использующий масс-спектрометрию оксида дейтерия и газовую хроматографию (GCMS) для анализа общего синтеза жирных кислот de novo в бурой жировой ткани in vivo. Этот метод измеряет синтез продуктов синтазы жирных кислот независимо от источника углерода, и он потенциально полезен практически для любой ткани, в любой мышиной модели и при любых внешних возмущениях. Приведена подробная информация о подготовке образцов для GCMS и последующих расчетах. Мы фокусируемся на анализе бурого жира из-за его высокого уровня синтеза жирных кислот de novo и критической роли в поддержании метаболического гомеостаза.
Введение
Ожирение и связанные с ним метаболические заболевания представляют собой пандемию, которая угрожает нынешнему и будущим поколениям 1,2. Метаболическая дисрегуляция, связанная с ожирением, обычно упрощается как следствие дисбаланса между потреблением и расходом энергии, затрагивает большое количество метаболических путей, контролируемых факторами окружающей среды и эндогеннымифакторами. Тем не менее, только несколько путей регулярно тестируются на животных моделях метаболической дисрегуляции.
Например, утилизация глюкозы обычно измеряется с помощью тестов на глюкозу и толерантность к инсулину, вероятно, из-за простоты использования портативных глюкометров4. Относительные скорости окисления глюкозы и липидов во всем организме также обычно оцениваются на основе коэффициента дыхательного обмена по данным непрямых калориметрических анализов 5,6. Тем не менее, большинство других аспектов метаболизма обычно не оцениваются функционально. Это приводит к неполной интерпретации метаболического статуса и упущенным терапевтическим возможностям. Одним из основных таких путей является липогенез de novo.
Липогенез de novo (DNL) — это процесс, с помощью которого из предшественников образуются новые жирные кислоты. Глюкоза считается основным прекурсором, способствующим ДНЛ7 всего тела, однако было показано, что другие предшественники, такие как ацетат, фруктоза, лактат и аминокислоты с разветвленной цепью, являются важными источниками углерода в зависимости от пространстве и состояния 8,9,10,11,12. ДНЛ является ключевым фактором, влияющим на метаболический гомеостаз, и имеет важное значение для нормального развития13. Кроме того, изменения в DNL были связаны с раком14,15 и метаболическими 16,17,18 и сердечно-сосудистыми заболеваниями 19,20.
Путь DNL состоит из основных ферментативных компонентов АТФ-цитратлиазы (ACLY), ацетил-КоА-карбоксилазы (ACC1/2) и синтазы жирных кислот (FAS), которые в основном продуцируют пальмитат, 16-углеродную насыщенную жирную кислоту. Тем не менее, жирные кислоты с нечетной и разветвленной цепью также могут производиться с более низкими показателями. Элонгазы и десатуразы дополнительно модифицируют эти жирные кислоты, создавая разнообразный спектр видов жирных кислот, полезных для различных функций (например, долгосрочное хранение энергии и манипулирование текучестью мембраны).
Экспрессия ферментативного аппарата DNL контролируется небольшим числом транскрипционных факторов. Наиболее хорошо описанными на сегодняшний день являются семейство белка, связывающего регуляторные элементы стерола (SREBP), белок, связывающий элемент углеводного ответа (ChREBP) и Х-рецептор печени (LXR)21,22,23,24,25,26. Несмотря на кажущееся совпадение их функций, сообщалось об индивидуальных регуляциях, основанных на доминировании типа клеток и физиологических или патологических состояниях21,22,27,28.
Примечательно, что ряд ингибиторов для отдельных этапов пути ДНЛ были одобрены для клинического использования или находятся на доклинической или клинической стадии разработки для ряда заболеваний, включая ожирение, неалкогольную жировую болезнь печени/неалкогольный стеатогепатит (НАЖБП/НАСГ) и сердечно-сосудистые заболевания29. Эти усилия подчеркивают актуальность DNL для здоровья и болезней.
В последние годы использование методов количественной оценки синтеза жирных кислот de novo возрослов 30 раз. Наиболее распространенным методом оценки этого является использование тяжелой меченой воды (D2O), где тяжелый меченый водород включается в ацильные цепи во время синтеза как прямо, так и косвенно, посредством обмена дейтерия с водородами субстратов DNL NAPDH, ацетил-КоА и малонил-КоА. Несмотря на то, что этот подход набирает популярность, в открытом доступе не хватает подробных протоколов, подходящих для новичков в этой области. В данной работе мы излагаем метод количественной оценки de novo синтеза продуктов ФАС с использованием D2O и газовой хроматографической масс-спектрометрии (GCMS) с расчетами, ранее разработанными Lee et al.31. Этот метод измеряет синтез жирных кислот de novo независимо от источника углерода, и он потенциально полезен практически для любой ткани, в любой модели мыши и при любых внешних возмущениях. Здесь мы сосредоточимся на анализе бурой жировой ткани (BAT) из-за ее высокого уровня DNL и критической роли в поддержании метаболического гомеостаза.
протокол
Все эксперименты были одобрены Комитетом по уходу за животными и их использованию в Медицинском центре детской больницы Цинциннати.
1. ПриготовлениеД2О
ПРИМЕЧАНИЕ: Чтобы избежать отклонений в эксперименте, приготовьте достаточное количество раствора/питьевой воды для всех мышей на время эксперимента.
- Для внутрибрюшинного введения: получить 0,9% физраствораD2O, растворив 9 г NaCl на литрD2O. Процедить через апирогенный фильтр 0,2 мкм для стерилизации.
- Для питьевой воды D2 O: получить 8% V/V D2O-обогащенной воды для использования в качестве питьевой воды путем смешивания 80 млD2Oна 920 мл обычной питьевой воды. Обычную питьевую воду можно получить в мышиной комнате. Процеживают через апирогенный фильтр 0,2 мкм для стерилизации.
2. Модуляция активности НДТ путем температурной акклиматизации
- Разделите мышей так, чтобы в клетке было по две мыши за 2 недели до начала температурной акклиматизации. Замените подачу воды на бутылки с водой, чтобы мыши могли адаптироваться и поддерживать температуру во всех клетках при температуре 22 °C.
- Подготовьте климатические камеры для мышей за 1 неделю до начала температурной акклиматизации, установив соответствующие температуры: 30 °C для термонейтральности, 22 °C для комнатной температуры и 18 °C для воздействия холода.
- В начале температурной акклиматизации замените клетки на новые, не обогащающие окружающую среду (во избежание гнезд). Переместите клетки на соответствующую температуру.
ПРИМЕЧАНИЕ: Клетки, предназначенные для термонейтральности, будут оставаться при температуре 30 °C в течение 4 недель. Клетки, предназначенные для комнатной температуры, будут храниться при температуре 22 °C в течение 4 недель. Клетки, предназначенные для воздействия холода, будут постепенно становиться холоднее по еженедельному графику: 18 °C в течение первой недели, 14 °C в течение второй недели, 10 °C в течение третьей недели и 6 °C в течение четвертой недели. - Меняйте загрязненные клетки еженедельно для любых условий. Кроме того, замените бутылки с едой и водой на новые, предварительно адаптированные при соответствующей температуре в течение не менее 24 часов.
ПРИМЕЧАНИЕ: Будьте внимательны к количеству пищи, добавляемой каждую неделю, особенно для мышей на холоде, так как они будут потреблять значительно большее количество пищи по сравнению с нормальными условиями. Обеспечьте питание вволю.
3. Введение D2O
- Вводят каждому животному 0,9% масс физиологического раствора D2Oв дозе 35 мкл/г массы тела за 12-3 дня до забора ткани путем внутрибрюшинной инъекции с помощью шприца объемом 1 мл и иглы 26 г.
ПРИМЕЧАНИЕ: Пожалуйста, обратитесь к разделу обсуждения для получения дополнительной информации о выборе подходящего времени маркировки. - Замените бутылки с водой на бутылки, содержащие питьевую воду, обогащенную 8% V/V D2O.
4. Сбор, обработка и хранение плазмы и тканей
- В конце эксперимента принесите мышей в жертву, используя утвержденные методики (например, передозировка углекислым газом с последующим вывихом шейки матки).
- Перед эвтаназией используйте тепловые/холодные прокладки или другие методы, чтобы избежать резких перепадов температуры, которые могут повлиять на результаты. Усыпляйте мышей в соответствии с утвержденными методиками. Немедленно приступайте к забору крови и тканей.
- Соберите кровь через пункцию сердца с помощью иглы 26 G и храните в пробирке для забора крови этилендиаминтетрауксусной кислотой. Держите кровь на льду до дальнейшей обработки.
- Разрежьте кожу вдоль средней линии спины мыши от нижней области грудной полости до верхней области шеи, одновременно натягивая кожу вверх, чтобы не задеть ткани под кожей. Межлопаточная БАТ расположена между лопатками под тонким слоем белой жировой ткани и состоит из двух долей пирамидальной формы.
- Очистите ткань, промыв ее в ледяной фосфатно-солевой буферной смеси (PBS). Промокните бумажным полотенцем, чтобы удалить лишнюю жидкость, взвесьте на аналитических весах и соберите в микропробирку.
- Сразу же мгновенно заморозьте ткань с помощью жидкого азота. Другие склады НДТ также могут быть собраны.
- Центрифугируют образцы крови при 10 000 x g в течение 10 мин при 4 °C. После центрифугирования аккуратно соберите плазму, не повредив гранулу эритроцита. Переложите его в новую ледяную микропробирку и мгновенно заморозьте в жидком азоте.
- Храните образцы бурого жира и плазмы при температуре -80 °C до использования.
5. Экстракция липидов из жировой ткани
- Перед началом экстракции
- Готовят раствор 1 мМ гексадеценовой кислоты d31 в метаноле в стеклянном флаконе. Это будет служить внутренним стандартом жирных кислот.
- Предварительно охладите необходимое количество хлороформа (CHCl 3) и метанола (CH3OH) в морозильной камере с температурой -80 °C или на сухом льду.
ПРИМЕЧАНИЕ: Антиоксидант ди-трет-бутил-4-метилфенол (BHT) может быть добавлен к CHCl3 в концентрации 0,01% по массе (2,5 мг/25 мл) для предотвращения окисления двойных связей в ненасыщенных жирных кислотах. - Предварительно пометьте пробирки для микроцентрифуг для каждого образца ткани и дополнительную пробирку, которая будет использоваться для извлечения заготовки.
ВНИМАНИЕ: CH 3 OHи CHCl3 очень летучи и токсичны при вдыхании. Использовать только в вытяжных шкафах.
ПРИМЕЧАНИЕ: Пробирки для микроцентрифуг разных марок имеют разные уровни фонового пальмитата и возможности с точки зрения предотвращения утечки растворителя. Мы рекомендуем сначала протестировать различные пробирки, чтобы гарантировать, что утечка растворителя предотвращена и что пробирки имеют минимальный уровень загрязнения пальмитата. Пожалуйста, обратитесь к Yao et al.32 для дальнейшего обсуждения.
- Достаньте образцы из морозильной камеры и положите на сухой лед.
- Поместите предварительно маркированную пробирку для микроцентрифуги на аналитические весы и тарируйте весы. Поместите пинцет и скальпель/стальное лезвие бритвы на сухой лед на 10-20 секунд, чтобы они остыли.
- С помощью пинцета выньте образец замороженной ткани из пробирки и поместите его на пластиковые весы. Весовая лодка может быть размещена на плоском блоке сухого льда или другой предварительно охлажденной поверхности.
- С помощью скальпеля или стального бритвенного лезвия рассеките небольшую часть ткани, эквивалентную 5-15 мг по весу. Поместите в пробирку с микроцентрифугой и запишите точный вес. Повторите эти действия для каждого образца. На этом этапе образцы можно хранить в морозильной камере или перейти к следующим шагам для извлечения липидов.
ПРИМЕЧАНИЕ: Убедитесь, что скальпель должным образом очищен 70% этанолом между образцами, а между образцами используется свежая лодочка для взвешивания.
- Добавьте 1 мкл/мг 10 мМ гексадеценовой кислоты 31 (C16:0-d31) в каждый образец.
ВНИМАНИЕ: Следующие шаги (5.4 - 5.8) следует выполнять под вытяжным шкафом из-за риска вдыхания растворителей. - Добавьте 250 мкл CH 3 OH, 250 мклH2Oи 500 мкл CHCl3в каждый образец с тремя 5-миллиметровыми шариками из нержавеющей стали. Поместите пробирки в предварительно охлажденный блок мельницы и перемешайте образцы с частотой колебаний 25 Гц в течение 5 мин или воспользуйтесь рекомендациями, рекомендованными производителем для образцов тканей. Извлеките бусины с помощью магнита.
- Центрифугируют образцы при 12 000 x g в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: После центрифугирования должно наблюдаться четкое двухфазное разделение с верхней водной фазой, содержащей полярные метаболиты, и нижней органической фазой, содержащей липиды и жирные кислоты. Если разделения не наблюдается, добавьте 250 мклH2Oи повторите этапы вихревого и центрифугирования. - С помощью микропипетки возьмите фиксированный объем из нижней фазы каждого образца в пробирки для микроцентрифуг с соответствующей маркировкой.
- Добавьте 500 мкл CHCl3 к оставшемуся образцу и повторите шаги 5.6-5.7.
- Поместите образцы под газообразный азот или в охлаждаемый центробежный вакуум, устойчивый к CHCl3, при температуре 4 °C до полного высыхания. Высушенные образцы можно хранить при температуре -20 °C до готовности к дериватизации.
ПРИМЕЧАНИЕ: Верхний слой каждого образца также может быть собран на этом этапе и высушен, как на шаге 5.9, для анализа полярных метаболитов.
6. Получение метиловых эфиров жирных кислот (FAMEs) и анализ GCMS
- Кислотно-катализируемая этерификация и переэтерификация для получения FAME
ВНИМАНИЕ: Следующие шаги следует выполнять под вытяжным шкафом из-за риска вдыхания растворителей.- Если образцы хранились в морозильной камере, высушите их под азотом в течение 5 минут, чтобы убедиться в отсутствии воды.
- Используя растворители MS-класса, пипеткой 98 мл безводного CH3OH в стеклянный флакон с питательной средой. Медленно добавьте 2 мл безводной серной кислоты в вытяжной шкаф, чтобы получить 2%H2SO4 в CH3OH. Перемешайте, взбалтывая закрытую бутылку.
- Добавьте 500 мкл 2%H2SO4 в раствор CH3OH к каждому образцу и кратковременно перемешайте.
- Образцы выдерживают на тепловом блоке при температуре 50 °C в течение 2 ч.
- Извлеките образцы из нагревательного блока и добавьте к каждому образцу 100 мкл насыщенного раствора NaCl и 500 мкл гексана.
- Энергично встряхните образцы при комнатной температуре в течение 1 мин. Оставьте образцы на 1 минуту; После этого должны быть очевидны две фазы.
- Соберите верхнюю фазу в новую пробирку для микроцентрифуги (см. примечание в разделе 5.1.3 для правильного выбора пробирки для микроцентрифуги).
- Чтобы максимизировать выход, повторите шаги 6.1.5-6.1.7, собирая вторую пробу в те же маркированные пробирки.
- Высушите образцы при комнатной температуре под газообразным азотом.
- Повторно суспендируйте образцы в 20 мкл/мг гексана относительно исходного веса ткани и немедленно переложите в стеклянный флакон GC со стеклянной вставкой.
ПРИМЕЧАНИЕ: Выполняйте быструю работу при переносе образцов, чтобы свести к минимуму испарение.
- Анализ GCMS
- Чтобы определить содержание изотопологов FAME, введите образцы на один квадрупольный газовый хроматографический масс-спектрометр (GCMS).
ПРИМЕЧАНИЕ: Несмотря на то, что для обнаружения пальмитата можно использовать различные типы колонок, для колонки GCMS, которая была разработана для разделения цис/транс-изомеров жирных кислот, была разработана следующая температурная программа, как подробно описано в таблице материалов. Эта колонна имеет длину 50 м с внутренним диаметром 0,25 мм. - Введите 1 мкл образца во входное отверстие с разделением/без расщепления при температуре на входе 270 °C, используя гелий в качестве газа-носителя со скоростью 1 мл/мин. Используйте бесщепленную инъекцию для низкого содержания жирных кислот с общим расходом 19 мл/мин, продувкой перегородки 3 мл/мин и продувочным потоком для расщепления 15 мл/мин через 0,75 мин. Используйте соотношение 10:1-40:1 для жирных кислот с высоким содержанием жира, таких как пальмитат и олеат.
- Используйте следующие параметры печи: начальная температура 80 °C; увеличение с шагом 20 °С/мин до 170 °С; увеличение с шагом 1 °С/мин до 204 °С; увеличение с шагом 20 °С/мин до 250 °С; а затем выдержать при температуре 250 °C в течение 10 мин.
- Используйте следующие параметры масс-селективного детектора (MSD): режим электронно-ударной ионизации 70 эВ и сканирование в диапазоне 50-400 м/з со скоростью сканирования 1,562 (ед/с) и частотой 4,1 сканирования/с. Используйте линию переноса при 280 °C, источник ионов при 230 °C и квадруполь при 150 °C.
ПРИМЕЧАНИЕ: Можно использовать другие колонки, но температурная программа будет отличаться. - Последовательность образцов: Рандомизируйте порядок ввода образцов и введите не менее двух или трех заготовок гексана в начале последовательности, после каждой пятой пробы в последовательности и двух или трех в конце последовательности.
- Используйте специальное программное обеспечение для прибора или бесплатное программное обеспечение с открытым доступом, такое как Metabolite-Detector33, для интегрирования ионов, указанных в таблице 1 , для каждого метилового эфира жирных кислот.
ПРИМЕЧАНИЕ: Мы описали ионы, которые покрывают изотопологи M1-M5 в таблице 1 , которые, как мы обнаружили, охватывают количество включения дейтерия в это окно маркировки. Тем не менее, этот показатель может потребоваться расширить, если поток de novo значительно выше и/или используется более длительное время маркировки. - Используйте распространенность каждого интегрированного иона для получения распределения массовых изотопомеров, где интенсивности ионов могут быть преобразованы в дробное распространение, чтобы сумма распределения массовых изотопомеров была равна единице. Пожалуйста, ознакомьтесь с примером таблицы в дополнительном файле.
ПРИМЕЧАНИЕ: Для того, чтобы точно определить содержание дейтерия, необходимо использовать коррекцию содержания природных изотопов, чтобы учесть присутствие встречающихся в природе изотопов, таких как 13C, 15N и 2H. Это достигается путем применения корректирующей матрицы, как описано в Fernandez et al.34,35, и не может быть выполнено путем вычитания MID немеченого измеренного метаболита из меченого метаболита. На практике мы рекомендуем использовать свободно доступное программное обеспечение, такое как fluxfix 36, polyMID37 или IsoCor38, для преобразования исходных данных во фракционные MID, и мы привели формулу для изотопной коррекции для продуктов метилового эфира FAS в таблице 1. - Чтобы определить количество пальмитата, используйте следующую формулу:
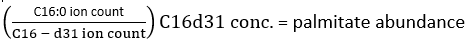
где число ионов относится к сумме всех изотопологов пальмитата, интегрированных в таблицу 1, а C16:0-d 31 относится к внутреннему стандарту hexadecenoic-d31. Внутренний стандарт образует отдельный пик по отношению к эндогенному пальмитату. Относительное содержание других жирных кислот также может быть определено, но для полного количественного определения может потребоваться использование внутренних изотопных стандартов жирных кислот (со сдвигами массы, превышающими те, которые наблюдаются при включенииD2O) или внешних стандартных кривых. Используйте пустой извлеченный образец, чтобы определить количество фонового пальмитата и вычесть его из окончательного значения ткани. - Рассчитайте молярное обогащение (МЭ) пальмитата по следующему уравнению:
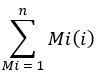
где Mi — нормированное дробное содержание пальмитатного изотополога, а n — число возможных пальмитатных изотопологов. Например, МЭ молекулы пальмитата со следующим дробным распределением, M1 = 0,25, M2 = 0,08, M3 = 0,02, составляет: (0,025*1) + (0,08*2) + (0,02*3) = 0,245 (см. Дополнительный файл).
- Чтобы определить содержание изотопологов FAME, введите образцы на один квадрупольный газовый хроматографический масс-спектрометр (GCMS).
7. Дейтерий-ацетоновый обмен образцов плазмы для определения обогащения организма водой
- Реакция
- Приготовьте 10 стандартов дейтерия в воде в диапазоне от 0 до 9% об.
- Приготовьте 5%-ный раствор ацетона/ацетонитрила, допускающий 4 мкл на образец, включая стандарты, указанные в шаге 5.1.1.
- В пробирках для микроцентрифуг с маркировкой и безопасным замком смешайте 10 мкл каждого образца плазмы или стандарта, 4 мкл 10 М NaOH и 4 мкл 5% ацетона/ацетонитрила. Выполните это в трех экземплярах для каждого образца.
- Осторожно перемешайте образцы с помощью пипетки. Дайте образцам инкубироваться при комнатной температуре в течение ночи.
- Извлечение
- После инкубации добавляют 450-550 мгNa2SO4 в каждый образец.
- В вытяжном шкафу добавьте 600 мкл CHCl3 в каждую пробирку и энергично встряхивайте в течение 15 с.
- Центрифугируют образцы при 300 x g в течение 2 мин.
- Под вытяжным шкафом перелейте тройное 80 мкл аликвот надосадочной жидкости из каждого образца в маркированные стеклянные флаконы GCMS со стеклянными вставками и плотно закрытой крышкой.
- Анализ GCMS
- Разделяют образцы на колонке (30 м, внутренний диаметр 0,25 мм, Agilent DB-35MS) и анализируют на прилагаемом масс-спектрометре.
- Введите 1 мкл образца в расщепленное/нерасщепленное входное отверстие с коэффициентом расщепления 40:1, потоком гелия 1 мл/мин и температурой на входе 270 °C.
- Используйте следующие параметры печи: начальная температура 60 °C, увеличение с шагом 20 °C/мин до 100 °C, увеличение с шагом 50 °C/мин до 220 °C, а затем выдерживание при 220 °C в течение 1 мин.
- Используйте следующие параметры масс-селективного детектора (MSD): режим электронно-ударной ионизации при 70 эВ с выборочным ионным контролем 58 и 59 м/з. Используйте линию переноса при 280 °C, источник ионов при 230 °C и квадруполь при 150 °C.
ПРИМЕЧАНИЕ: Можно использовать другие колонки с низкой прокачкой, сшитые, сшитые, средней полярности, но температурная программа будет отличаться.
- Установите метод пробоотборника жидкостей так, чтобы он начинался с промывки CHCl 3, а затем рандомизированной последовательности образцов, включая дополнительные этапы промывки CHCl3 каждые шесть образцов.
ПРИМЕЧАНИЕ: Если ацетон используется в качестве промывки иглы для автосамплера, замените его CHCl 3 или гексаном и введите несколько пустых образцов CHCl3 до тех пор, пока на хроматограмме не исчезнет загрязняющий пик ацетона. - При использовании этого метода пик ацетона достигается примерно через 1,25 мин. Интегрируйте данные и рассчитайте фракционное содержание обогащения ацетоном, выполнив шаги 6.2.6-6.2.7, с поправкой для анализа пиков, содержащих отношение m/z 58-60, как указано в таблице 1.
- Используйте эталоны для построения стандартной кривой для определения процента обогащения воды в организме (p) испытуемых образцов, исходя из фракционного обогащения ацетоном.
- Разделяют образцы на колонке (30 м, внутренний диаметр 0,25 мм, Agilent DB-35MS) и анализируют на прилагаемом масс-спектрометре.
8. Расчеты липогенеза in vivo de novo
- Рассчитайте долю вновь синтезированных жирных кислот (FNS), которые являются прямыми продуктами FAS (т. е. пальмитата, жирных кислот с нечетной цепью и mmBCFA) в каждом образце с помощью следующего уравнения:
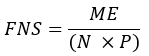
где ME — среднее молярное обогащение молекулы пальмитата (шаг 6.2.9), p — обогащение дейтерия водой из соответствующего образца плазмы (шаг 7.3.4), а N — число обменных атомов водорода на пальмитате, в которые может быть включен дейтерий. - Определите N, используя приведенное ниже уравнение, которое было установлено Lee et al.31:
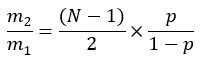
- Определите молярное количество вновь синтезированных жирных кислот (МНС) посредством:
МНС = FNS x общее количество жирных кислот (нмоль/мг ткани).
ПРИМЕЧАНИЕ: Например, при получении молярного обогащения пальмитата (ME) 0,245, обогащения дейтерия в воде организма (p) 0,045 и расчетного числа N, равного 22, фракционный синтез пальмитата равен 0,247. Если количество пальмитата, присутствующего в ткани, составляет 2 ммоль/мг, то ммоль вновь синтезированного пальмитата составляет 0,494 ммоль/мг (см. Дополнительный файл).
Результаты
Основываясь на дозировкеD2O, описанной на этапе 1, мы обычно обнаруживаем, что вода в организме обогащается в диапазоне от 2,5% до 6%, и что исходный уровень обогащения дейтерия в воде организма быстро достигается через 1 ч и поддерживается в течение всего исследования с помощью пи...
Обсуждение
Понимание баланса и взаимодействия между сложными метаболическими путями является необходимым шагом на пути к пониманию биологической основы заболеваний, связанных с обменом веществ. Здесь мы демонстрируем неинвазивную и недорогую методологию определения изменений в синтезе жирны?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим сотрудников лаборатории Санчес-Гурмачес и Уоллеса за ценные обсуждения. Эта работа была поддержана грантами Американской кардиологической ассоциации (18CDA34080527 для JSG и 19POST34380545 для RM), NIH (R21OD031907 для JSG), CCHMC Trustee Award, CCHMC Center for Pediatric Genomics Award и CCHMC Center for Mendelian Genomics & Therapeutics Award. Эта работа была частично поддержана NIH P30 DK078392 Центра исследований заболеваний пищеварительной системы в Цинциннати. Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения. RT и MW были поддержаны стипендиальной программой UCD Ad Astra Fellowship.
Материалы
| Name | Company | Catalog Number | Comments |
| 4 mL Glass Vials | Fisher Scientific | 14-955-334 | |
| 0.2 µm filter | Olympus Plastic | 25-244 | |
| 26G needeled syringes | BD | 309597 | |
| Acetone | Merck | 34850 | |
| Acetonitrile | Merck | 900667 | |
| Blue GC screw cap with septa | Agilent | 5190-1599 | |
| Centrifuge | Eppendorf | 5424R | |
| Chloroform | Sigma | 366927 | |
| Deuterium oxide | Sigma | 151882 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Merck | B1378 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Agilent | CP7419 | |
| EDTA tube | Sarstedt | 411395105 | |
| Ethanol | Merck | 51976 | |
| Hexadecenoic-d31 Acid | Larodan | 71-1631 | |
| Hexane | Merck | 34859 | |
| Methanol | Merck | 34860 | |
| Microcentrifuge tube | Olympus Plastic | 24-282 | |
| Mouse environmental chamber | Caron | Caron 7001-33 | |
| Potasium Chloride | Fisher Bioreagents | BP366-500 | |
| Potasium Phosphate | MP Biomedicals | 194727 | |
| SafeLock microcentrifuge tubes | Eppendorf | 30120086 | |
| Screw top amber GC vial | Agilent | 5182-0716 | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Hydroxide | Merck | S5881 | |
| Sodium Phosphate, dibasic | Fisher Bioreagents | BP332-500 | |
| Sodium Sulfate | Merck | 239313 | |
| Sulfuric Acid | Merck | 258105 | |
| Vial insert | Agilent | 5183-2088 |
Ссылки
- . The Lancet, Diabetes Endocrinology. Childhood obesity: a growing pandemic. The Lancet. Diabetes & Endocrinology. 10 (1), 1 (2022).
- Gonzalez-Muniesa, P., et al. Obesity. Nature Reviews Disease Primers. 3, 17034 (2017).
- Müller, T. D., Blüher, M., Tschöp, M. H., DiMarchi, R. D. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21 (3), 201-223 (2021).
- Virtue, S., Vidal-Puig, A. GTTs and ITTs in mice: simple tests, complex answers. Nature Metabolism. 3 (7), 883-886 (2021).
- Müller, T. D., Klingenspor, M., Tschöp, M. H. Revisiting energy expenditure: how to correct mouse metabolic rate for body mass. Nature Metabolism. 3 (9), 1134-1136 (2021).
- Virtue, S., Lelliott, C. J., Vidal-Puig, A. What is the most appropriate covariate in ANCOVA when analysing metabolic rate. Nature Metabolism. 3 (12), 1585 (2021).
- Hellerstein, M. K. De novo lipogenesis in humans: metabolic and regulatory aspects. European Journal of Clinical Nutrition. 53 Suppl 1, S53-S65 (1999).
- Zhao, S., et al. Dietary fructose feeds hepatic lipogenesis via microbiota-derived acetate. Nature. 579 (7800), 586-591 (2020).
- Wallace, M., et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nature Chemical Biology. 14 (11), 1021-1031 (2018).
- Zhao, S., et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch. Cell Reports. 17 (4), 1037-1052 (2016).
- Green, C. R., et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. Nature Chemical Biology. 12 (1), 15-21 (2016).
- Zhang, Z., et al. Serine catabolism generates liver NADPH and supports hepatic lipogenesis. Nature Metabolism. 3 (12), 1608-1620 (2021).
- Chirala, S. S., et al. Fatty acid synthesis is essential in embryonic development: fatty acid synthase null mutants and most of the heterozygotes die in utero. Proceedings of the National Academy of Sciences. 100 (11), 6358-6363 (2003).
- Icard, P., et al. ATP citrate lyase: A central metabolic enzyme in cancer. Cancer Letters. 471, 125-134 (2020).
- Fhu, C. W., Ali, A. Fatty acid synthase: an emerging target in cancer. Molecules. 25 (17), 3935 (2020).
- Lawitz, E. J., et al. Acetyl-CoA carboxylase inhibitor GS-0976 for 12 weeks reduces hepatic de novo lipogenesis and steatosis in patients with nonalcoholic steatohepatitis. Clinical Gastroenterology and Hepatology. 16 (12), 1983e3-1991e3 (2018).
- Smith, G. I., et al. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. The Journal of Clinical Investigation. 130 (3), 1453-1460 (2020).
- Imamura, F., et al. Fatty acids in the de novo lipogenesis pathway and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Medicine. 17 (6), e1003102 (2020).
- Lai, H. T. M., et al. Serial plasma phospholipid fatty acids in the de novo lipogenesis pathway and total mortality, cause-specific mortality, and cardiovascular diseases in the cardiovascular health study. Journal of the American Heart Association. 8 (22), e012881 (2019).
- Ference, B. A., et al. Mendelian randomization study of ACLY and cardiovascular disease. The New England Journal of Medicine. 380 (11), 1033-1042 (2019).
- Herman, M. A., et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature. 484 (7394), 333-338 (2012).
- Sanchez-Gurmaches, J., et al. Brown fat AKT2 Is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis. Cell Metabolism. 27 (1), 195e6-209e6 (2018).
- Wang, X., et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. II. Purification and characterization. The Journal of Biological Chemistry. 268 (19), 14497-14504 (1993).
- Briggs, M. R., Yokoyama, C., Wang, X., Brown, M. S., Goldstein, J. L. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence. The Journal of Biological Chemistry. 268 (19), 14490-14496 (1993).
- Yokoyama, C., et al. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell. 75 (1), 187-197 (1993).
- Chen, G., Liang, G., Ou, J., Goldstein, J. L., Brown, M. S. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver. Proceedings of the National Academy of Sciences. 101 (31), 11245-11250 (2004).
- Denechaud, P. D., et al. ChREBP, but not LXRs, is required for the induction of glucose-regulated genes in mouse liver. The Journal of Clinical Investigation. 118 (3), 956-964 (2008).
- Crewe, C., et al. SREBP-regulated adipocyte lipogenesis is dependent on substrate availability and redox modulation of mTORC1. JCI Insight. 5 (15), e129397 (2019).
- Batchuluun, B., Pinkosky, S. L., Steinberg, G. R. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nature Reviews Drug Discovery. 21 (4), 283-305 (2022).
- Wallace, M., Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Seminars in Cell & Developmental Biology. 108, 65-71 (2020).
- Lee, W. N., et al. In vivo measurement of fatty acids and cholesterol synthesis using D2O and mass isotopomer analysis. The American Journal of Physiology. 266 (5 Pt 1), E699-E708 (1994).
- Yao, C. H., Liu, G. Y., Yang, K., Gross, R. W., Patti, G. J. Inaccurate quantitation of palmitate in metabolomics and isotope tracer studies due to plastics. Metabolomics. 12, 143 (2016).
- Hiller, K., et al. MetaboliteDetector: comprehensive analysis tool for targeted and nontargeted GC/MS based metabolome analysis. Analytical Chemistry. 81 (9), 3429-3439 (2009).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. Journal of Mass Spectrometry. 31 (3), 255-262 (1996).
- Midani, F. S., Wynn, M. L., Schnell, S. The importance of accurately correcting for the natural abundance of stable isotopes. Analytical Biochemistry. 520, 27-43 (2017).
- Trefely, S., Ashwell, P., Snyder, N. W. FluxFix: automatic isotopologue normalization for metabolic tracer analysis. BMC Bioinformatics. 17 (1), 485 (2016).
- Jeong, H., et al. Correcting for naturally occurring mass isotopologue abundances in stable-isotope tracing experiments with PolyMID. Metabolites. 11 (5), 310 (2021).
- Millard, P., et al. IsoCor: isotope correction for high-resolution MS labeling experiments. Bioinformatics. 35 (21), 4484-4487 (2019).
- Brunengraber, D. Z., et al. Influence of diet on the modeling of adipose tissue triglycerides during growth. American Journal of Physiology. Endocrinology and Metabolsim. 285 (4), E917-E925 (2003).
- Svensson, R. U., et al. Inhibition of acetyl-CoA carboxylase suppresses fatty acid synthesis and tumor growth of non-small-cell lung cancer in preclinical models. Nature Medicine. 22 (10), 1108-1119 (2016).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: a technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263 (5 Pt 1), E988-E1001 (1992).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Kelleher, J. K., Masterson, T. M. Model equations for condensation biosynthesis using stable isotopes and radioisotopes. The American Journal of Physiology. 262 (1 Pt 1), E118-E125 (1992).
- Kelleher, J. K., Nickol, G. B. Isotopomer spectral analysis: utilizing nonlinear models in isotopic flux studies. Methods in Enzymology. 561, 303-330 (2015).
- Argus, J. P., et al. Development and application of FASA, a model for quantifying fatty acid metabolism using stable isotope labeling. Cell Reports. 25 (10), 2919.e8-2934.e8 (2018).
- Guilherme, A., et al. Control of adipocyte thermogenesis and lipogenesis through β3-adrenergic and thyroid hormone signal integration. Cell Reports. 31 (5), 107598 (2020).
- Guilherme, A., et al. Neuronal modulation of brown adipose activity through perturbation of white adipocyte lipogenesis. Molecular Metabolism. 16, 116-125 (2018).
- Guilherme, A., et al. Adipocyte lipid synthesis coupled to neuronal control of thermogenic programming. Molecular Metabolism. 6 (8), 781-796 (2017).
- Lodhi, I. J., et al. Inhibiting adipose tissue lipogenesis reprograms thermogenesis and PPARgamma activation to decrease diet-induced obesity. Cell Metabolism. 16 (2), 189-201 (2012).
- McCormack, J. G., Denton, R. M. Evidence that fatty acid synthesis in the interscapular brown adipose tissue of cold-adapted rats is increased in vivo by insulin by mechanisms involving parallel activation of pyruvate dehydrogenase and acetyl-coenzyme A carboxylase. The Biochemistry Journal. 166 (3), 627-630 (1977).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Letters. 104 (1), 13-16 (1979).
- Negron, S. G., Ercan-Sencicek, A. G., Freed, J., Walters, M., Lin, Z. Both proliferation and lipogenesis of brown adipocytes contribute to postnatal brown adipose tissue growth in mice. Science Reports. 10 (1), 20335 (2020).
- Schlein, C., et al. Endogenous fatty acid synthesis drives brown adipose tissue involution. Cell Reports. 34 (2), 108624 (2021).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. Journal of Lipid Research. 55 (11), 2276-2286 (2014).
- Adlanmerini, M., et al. Circadian lipid synthesis in brown fat maintains murine body temperature during chronic cold. Proceedings of the National Academy of Sciences. 116 (37), 18691-18699 (2019).
- Yu, X. X., Lewin, D. A., Forrest, W., Adams, S. H. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB Journal. 16 (2), 155-168 (2002).
- Kushner, D. J., Baker, A., Dunstall, T. G. Pharmacological uses and perspectives of heavy water and deuterated compounds. Canadian Journal of Physiology and Pharmacology. 77 (2), 79-88 (1999).
- Diraison, F., Pachiaudi, C., Beylot, M. Measuring lipogenesis and cholesterol synthesis in humans with deuterated water: use of simple gas chromatographic/mass spectrometric techniques. Journal of Mass Spectrometry. 32 (1), 81-86 (1997).
- Yang, D., et al. Assay of low deuterium enrichment of water by isotopic exchange with [U-13C3]acetone and gas chromatography-mass spectrometry. Analytical Biochemistry. 258 (2), 315-321 (1998).
- Fu, X., et al. Measurement of lipogenic flux by deuterium resolved mass spectrometry. Nature Communications. 12 (1), 3756 (2021).
- Shah, V., Herath, K., Previs, S. F., Hubbard, B. K., Roddy, T. P. Headspace analyses of acetone: a rapid method for measuring the 2H-labeling of water. Analytical Biochemistry. 404 (2), 235-237 (2010).
- Argus, J. P., Yu, A. K., Wang, E. S., Williams, K. J., Bensinger, S. J. An optimized method for measuring fatty acids and cholesterol in stable isotope-labeled cells. Journal of Lipid Research. 58 (2), 460-468 (2017).
- Belew, G. D., Jones, J. G. De novo lipogenesis in non-alcoholic fatty liver disease: Quantification with stable isotope tracers. European Journal of Clinical Investigation. 52 (3), e13733 (2022).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Belew, G. D., et al. Transfer of glucose hydrogens via acetyl-CoA, malonyl-CoA, and NADPH to fatty acids during de novo lipogenesis. Journal of Lipid Research. 60 (12), 2050-2056 (2019).
- Diraison, F., Pachiaudi, C., Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water: determination of the average number of deuterium atoms incorporated. Metabolism. 45 (7), 817-821 (1996).
- Ajie, H. O., et al. In vivo study of the biosynthesis of long-chain fatty acids using deuterated water. The American Journal of Physiology. 269 (2 Pt 1), E247-E252 (1995).
- Schloerb, P. R., Friis-Hansen, B. J., Edelman, I. S., Solomon, A. K., Moore, F. D. The measurement of total body water in the human subject by deuterium oxide dilution; with a consideration of the dynamics of deuterium distribution. The Journal of Clinical Investigation. 29 (10), 1296-1310 (1950).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены