Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantitative Bestimmung der de novo Fettsäuresynthese im braunen Fettgewebe mittels Deuteriumoxid
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir eine kostengünstige quantitative Methode vor, die Deuteriumoxid- und Gaschromatographie-Massenspektrometrie (GCMS) zur Analyse der Gesamtfettsäure-De-novo-Lipogenese in braunem Fettgewebe in vivo verwendet.
Zusammenfassung
Die Fettsäuresynthese ist ein komplexer und sehr energieintensiver Stoffwechselweg mit wichtigen funktionellen Rollen bei der Steuerung der metabolischen Homöostase des gesamten Körpers und anderer physiologischer und pathologischer Prozesse. Im Gegensatz zu anderen wichtigen Stoffwechselwegen, wie z. B. der Glukoseentsorgung, wird die Fettsäuresynthese nicht routinemäßig funktionell bewertet, was zu unvollständigen Interpretationen des Stoffwechselstatus führt. Darüber hinaus fehlt es an öffentlich zugänglichen detaillierten Protokollen, die für Neulinge auf diesem Gebiet geeignet sind. In dieser Arbeit beschreiben wir eine kostengünstige quantitative Methode, die Deuteriumoxid- und Gaschromatographie-Massenspektrometrie (GCMS) zur Analyse der Gesamtfettsäuresynthese in braunem Fettgewebe in vivo verwendet. Diese Methode misst die Synthese der Produkte der Fettsäuresynthase unabhängig von einer Kohlenstoffquelle und ist potenziell für praktisch jedes Gewebe, in jedem Mausmodell und unter jeder externen Störung nützlich. Details zur Probenvorbereitung für GCMS und nachgelagerte Berechnungen werden bereitgestellt. Wir konzentrieren uns auf die Analyse von braunem Fett aufgrund seiner hohen De-novo-Fettsäuresynthese und seiner kritischen Rolle bei der Aufrechterhaltung der metabolischen Homöostase.
Einleitung
Adipositas und damit verbundene Stoffwechselerkrankungen sind eine Pandemie, die gegenwärtige und zukünftige Generationen gefährdet 1,2. Die mit Fettleibigkeit verbundene metabolische Dysregulation, die gemeinhin als Folge des Ungleichgewichts zwischen Energieaufnahme und -verbrauch vereinfacht wird, betrifft eine große Anzahl von Stoffwechselwegen, die durch Umwelt- und endogene Faktoren gesteuert werden3. Allerdings werden nur wenige Signalwege routinemäßig in Tiermodellen der metabolischen Dysregulation getestet.
Beispielsweise wird die Glukoseentsorgung routinemäßig durch Glukose- und Insulintoleranztests gemessen, was wahrscheinlich auf die Einfachheit der Verwendung tragbarer Glukosemessgeräte zurückzuführenist 4. Die relativen Raten der Ganzkörperglukose und der Lipidoxidation werden ebenfalls routinemäßig auf der Grundlage des respiratorischen Austauschverhältnisses aus indirekten Kalorimetrie-Assays geschätzt 5,6. Die meisten anderen Aspekte des Stoffwechsels werden jedoch nicht routinemäßig funktionell erfasst. Dies führt zu unvollständigen Interpretationen des Stoffwechselstatus und verpassten Therapieoptionen. Einer der wichtigsten dieser Wege ist die de novo Lipogenese.
Die De-novo-Lipogenese (DNL) ist der Prozess, bei dem aus Vorläufern neue Fettsäuren gebildet werden. Glukose wird als der Hauptvorläufer angesehen, der zum Ganzkörper-DNL7 beiträgt, jedoch haben sich andere Vorläufer wie Acetat, Fruktose, Laktat und verzweigtkettige Aminosäuren als relevante Kohlenstoffquellen in räumlicher und zustandsabhängiger Weise erwiesen 8,9,10,11,12. DNL leistet einen wichtigen Beitrag zur metabolischen Homöostase und ist für die normale Entwicklung unerlässlich13. Darüber hinaus wurden Veränderungen des DNL mit Krebs 14,15 und metabolischen 16,17,18 und Herz-Kreislauf-Erkrankungen 19,20 in Verbindung gebracht.
Der DNL-Signalweg besteht aus den enzymatischen Kernkomponenten ATP-Citrat-Lyase (ACLY), Acetyl-CoA-Carboxylase (ACC1/2) und Fettsäuresynthase (FAS), die hauptsächlich Palmitat, eine gesättigte Fettsäure mit 16 Kohlenstoffatomen, produzieren. Ungerade und verzweigtkettige Fettsäuren können jedoch auch mit geringeren Raten produziert werden9. Elongasen und Desaturasen modifizieren diese Fettsäuren weiter, wodurch eine Vielzahl von Fettsäurespezies entsteht, die für eine Vielzahl von Funktionen nützlich sind (z. B. langfristige Energiespeicherung und Manipulation der Membranfluidität).
Die Expression der DNL-Enzymmaschinerie wird durch eine kurze Anzahl von Transkriptionsfaktoren gesteuert. Zu den bisher am besten beschriebenen gehören die Familie der sterolregulatorischen Elementbindungsproteine (SREBP), des Kohlenhydratreaktionselement-bindenden Proteins (ChREBP) und des Leber-X-Rezeptors (LXR)21,22,23,24,25,26. Trotz einer offensichtlichen Überlappung ihrer Funktionen wurden individuelle Regulationen beschrieben, die auf der Dominanz des Zelltyps und physiologischen oder pathologischen Bedingungen basieren21,22,27,28.
Bemerkenswert ist, dass eine Reihe von Inhibitoren für ausgewählte Schritte des DNL-Signalwegs für eine Reihe von Krankheiten, darunter Fettleibigkeit, nichtalkoholische Fettlebererkrankung/nichtalkoholische Steatohepatitis (NAFLD/NASH) und Herz-Kreislauf-Erkrankungen, für den klinischen Einsatz zugelassen wurden oder sich in der präklinischen oder klinischen Entwicklungsphase befinden29. Diese Bemühungen unterstreichen die Bedeutung von DNL für Gesundheit und Krankheit.
In den letzten Jahren hat der Einsatz von Methoden zur quantitativen Bewertung der De-novo-Fettsäuresynthese zugenommen30. Die gebräuchlichste Methode zur Beurteilung ist die Verwendung von schwer markiertem Wasser (D2O), bei dem der schwer markierte Wasserstoff während der Synthese sowohl direkt als auch indirekt über den Deuteriumaustausch mit den Wasserstoffen der DNL-Substrate NAPDH, Acetyl-CoA und Malonyl-CoA in Acylketten eingebaut wird. Obwohl dieser Ansatz immer beliebter wird, fehlt es an öffentlich zugänglichen detaillierten Protokollen, die für Neulinge auf diesem Gebiet geeignet sind. Hier skizzieren wir eine Methode zur quantitativen Bewertung der de novo Synthese von FAS-Produkten mittelsD2Ound Gaschromatographie-Massenspektrometrie (GCMS), mit Berechnungen, die zuvor von Lee et al.31 entwickelt wurden. Diese Methode misst die De-novo-Fettsäuresynthese unabhängig von einer Kohlenstoffquelle und ist potenziell für praktisch jedes Gewebe, in jedem Mausmodell und unter jeder externen Störung nützlich. Hier konzentrieren wir uns auf die Analyse von braunem Fettgewebe (BAT) aufgrund seines hohen DNL-Gehalts und seiner entscheidenden Rolle bei der Aufrechterhaltung der metabolischen Homöostase.
Protokoll
Alle Versuche wurden vom Institutional Animal Care and Use Committee des Cincinnati Children's Hospital Medical Center genehmigt.
1. Herstellung von D2O
HINWEIS: Um experimentelle Abweichungen zu vermeiden, bereiten Sie für die Dauer des Versuchs ausreichend Lösung/Trinkwasser für alle Mäuse vor.
- Für die intraperitoneale Injektion: Erzeugen Sie 0,9 Gew.-% KochsalzlösungD2Odurch Auflösen von 9 g NaCl pro LiterD2O. Filtrieren Sie durch einen pyrogenfreien 0,2-μm-Filter zum Sterilisieren.
- Zum Trinken von D2 O-Wasser: 8 % v/v D2O-angereichertes Wasser erzeugen, das als Trinkwasser verwendet werden kann, indem 80 mlD2O pro 920ml normales Trinkwasser gemischt werden. Reguläres Trinkwasser kann aus der Mäuseanlage bezogen werden. Zum Sterilisieren durch einen pyrogenfreien 0,2-μm-Filter filtern.
2. Modulation der BAT-Aktivität durch Temperaturakklimatisierung
- Trennen Sie die Mäuse so, dass sich 2 Wochen vor Beginn der Temperaturakklimatisierung zwei Mäuse pro Käfig befinden. Stellen Sie die Wasserversorgung auf Wasserflaschen um, damit sich die Mäuse an alle Käfige bei 22 °C gewöhnen und diese halten können.
- Bereiten Sie die Umweltkammern der Maus 1 Woche vor Beginn der Temperaturakklimatisierung vor, indem Sie die entsprechenden Temperaturen einstellen: 30 °C für Thermoneutralität, 22 °C für Raumtemperatur und 18 °C für Kälteexposition.
- Ersetzen Sie zu Beginn der Temperaturakklimatisierung die Käfige durch neue ohne Umweltanreicherung (um Nester zu vermeiden). Bringen Sie die Käfige auf ihre jeweilige Temperatur.
HINWEIS: Käfige, die der Thermoneutralität zugewiesen sind, bleiben 4 Wochen lang bei 30 °C. Käfige, die Raumtemperatur zugewiesen sind, bleiben 4 Wochen lang bei 22 °C. Käfige, die der Kälteexposition zugewiesen sind, werden wöchentlich kälter: 18 °C in der ersten Woche, 14 °C in der zweiten Woche, 10 °C in der dritten Woche und 6 °C in der vierten Woche. - Wechseln Sie die verschmutzten Käfige wöchentlich für alle Bedingungen. Ersetzen Sie außerdem Lebensmittel- und Wasserflaschen durch neue, die mindestens 24 Stunden lang auf die entsprechende Temperatur eingestellt sind.
HINWEIS: Achten Sie auf die Futtermengen, die jede Woche hinzugefügt werden, insbesondere bei Mäusen in der Kälte, da sie im Vergleich zu normalen Bedingungen eine deutlich größere Menge an Futter zu sich nehmen. Verpflegung ad libitum.
3. Verabreichung von D2O
- Jedem Tier werden 12 h-3 Tage vor der Gewebeentnahme 0,9 Gew.-% Kochsalzlösung-D2O bei 35 μl/g Körpergewicht mittels intraperitonealer Injektion mit einer 1-ml-Spritze und einer 26-g-Nadel injiziert.
HINWEIS: Weitere Informationen zur Auswahl eines geeigneten Beschriftungszeitpunkts finden Sie im Abschnitt Diskussion. - Tauschen Sie die Wasserflaschen gegen Flaschen aus, die 8 % v/v D2O-angereichertes Trinkwasser enthalten.
4. Plasma- und Gewebegewinnung, -verarbeitung und -lagerung
- Am Ende des Experiments werden die Mäuse mit zugelassenen Methoden getötet (z. B. Kohlendioxid-Überdosierung, gefolgt von einer Gebärmutterhalsverrenkung).
- Verwenden Sie Heiz-/Kühlpads oder andere Methoden, um plötzliche Temperaturschwankungen vor der Euthanasie zu vermeiden, die die Ergebnisse beeinflussen können. Euthanasieren Sie die Mäuse nach anerkannten Methoden. Fahren Sie sofort mit der Blut- und Gewebeentnahme fort.
- Blut durch Herzpunktion mit einer 26-G-Nadel entnehmen und in einem Ethylendiamintetraessigsäure-Blutentnahmeröhrchen aufbewahren. Bewahren Sie das Blut bis zur weiteren Verarbeitung auf Eis auf.
- Schneiden Sie die Haut entlang der Mittellinie des Rückens der Maus vom unteren Bereich der Brusthöhle bis zum oberen Bereich des Halses auf, während Sie die Haut nach oben ziehen, um Gewebe unter der Haut nicht zu beeinträchtigen. Der interscapuläre BAT befindet sich zwischen den Schulterblättern unter einer dünnen Schicht aus weißem Fettgewebe und besteht aus zwei pyramidenförmigen Lappen.
- Reinigen Sie das Gewebe, indem Sie es in eiskalter phosphatgepufferter Kochsalzlösung (PBS) waschen. Tupfen Sie es auf ein Papiertuch, um überschüssige Flüssigkeit zu entfernen, wiegen Sie es auf einer Analysewaage und sammeln Sie es in einem Mikroröhrchen.
- Das Gewebe sofort mit flüssigem Stickstoff schockgefrieren. Auch andere BVT-Depots können abgeholt werden.
- Die Blutproben werden bei 10.000 x g für 10 min bei 4 °C zentrifugiert. Nach der Zentrifugation wird das Plasma vorsichtig gesammelt, ohne das Pellet der roten Blutkörperchen zu stören. In ein neues eiskaltes Mikroröhrchen umfüllen und in flüssigem Stickstoff schockgefrieren.
- Lagern Sie braune Fett- und Plasmaproben bis zur Verwendung bei -80 °C.
5. Lipidextraktion aus Fettgewebe
- Vor Beginn der Extraktion
- Bereiten Sie eine 1 mM Lösung von Hexadecensäure-d31-Säure in Methanol in einer Durchstechflasche aus Glas vor. Dies dient als interner Fettsäurestandard.
- Die erforderliche Menge an Chloroform (CHCl 3) und Methanol (CH3OH) in einem Gefrierschrank bei -80 °C oder auf Trockeneis vorkühlen.
HINWEIS: Das Antioxidans Di-tert-Butyl-4-methylphenol (BHT) kann dem CHCl3 in einer Konzentration von 0,01 % w/v (2,5 mg/25 ml) zugesetzt werden, um die Oxidation der Doppelbindungen in ungesättigten Fettsäuren zu verhindern. - Beschriften Sie Mikrozentrifugenröhrchen für jede Gewebeprobe und ein zusätzliches Röhrchen, das für eine Blindextraktion verwendet wird.
ACHTUNG:CH3OH und CHCl3 sind leicht flüchtig und giftig, wenn sie eingeatmet werden. Nur in Abzügen verwenden.
HINWEIS: Verschiedene Marken von Mikrozentrifugenröhrchen haben unterschiedliche Mengen an Hintergrundpalmitat und Fähigkeiten in Bezug auf die Verhinderung des Auslaufens von Lösungsmitteln. Wir empfehlen, zuerst eine Vielzahl von Röhrchen zu testen, um sicherzustellen, dass ein Austreten von Lösungsmitteln verhindert wird und dass die Röhrchen nur minimale Mengen an kontaminierendem Palmitat aufweisen. Siehe Yao et al.32 für weitere Diskussionen.
- Nehmen Sie die Proben aus dem Gefrierschrank und legen Sie sie auf Trockeneis.
- Stellen Sie das voretikettierte Mikrozentrifugenröhrchen auf eine Analysenwaage und tarieren Sie die Waage. Eine Pinzette und ein Skalpell/eine Rasierklinge aus Stahl zum Abkühlen 10-20 s auf Trockeneis legen.
- Nehmen Sie die gefrorene Gewebeprobe mit der Pinzette aus dem Röhrchen und legen Sie sie auf eine Kunststoffwaage. Das Wägeschiffchen kann auf einen flachen Trockeneisblock oder eine andere vorgekühlte Oberfläche gestellt werden.
- Mit dem Skalpell oder der Rasierklinge aus Stahl wird ein kleiner Teil des Gewebes präpariert, was einem Gewicht von 5-15 mg entspricht. In das Mikrozentrifugenröhrchen geben und das genaue Gewicht notieren. Wiederholen Sie den Vorgang für jede Probe. Die Proben können zu diesem Zeitpunkt im Gefrierschrank aufbewahrt oder zur Lipidextraktion zu den folgenden Schritten weitergeleitet werden.
HINWEIS: Stellen Sie sicher, dass das Skalpell zwischen den Proben ordnungsgemäß mit 70 % Ethanol gereinigt wird und zwischen jeder Probe ein frisches Wägeschiffchen verwendet wird.
- Zu jeder Probe wird 10 μl/mg 10 mM Hexadecensäure-d 31(C16:0-d31) gegeben.
ACHTUNG: Die folgenden Schritte (5.4 bis 5.8) sollten aufgrund der Inhalationsgefahr der Lösungsmittel unter einem Abzug durchgeführt werden. - Zu jeder Probe mit drei 5 mm Edelstahlperlen werden 250 μlCH3OH, 250 μlH2Ound 500 μl CHCl3 gegeben. Legen Sie die Röhrchen in einen vorgekühlten Block einer Mahlmühle und mischen Sie die Proben bei einer Vibrationsfrequenz von 25 Hz für 5 Minuten oder verwenden Sie die vom Hersteller empfohlenen Richtlinien für Gewebeproben. Entfernen Sie die Perlen mit einem Magneten.
- Die Proben werden bei 12.000 x g für 10 min bei 4 °C zentrifugiert.
HINWEIS: Nach der Zentrifugation sollte eine klare zweiphasige Trennung beobachtet werden, wobei die obere wässrige Phase polare Metaboliten und die untere organische Phase Lipide und Fettsäuren enthält. Wenn keine Trennung zu sehen ist, fügen Sie 250 μlH2Ohinzu und wiederholen Sie die Wirbel- und Zentrifugationsschritte. - Entnehmen Sie mit einer Mikropipette ein festes Volumen aus der unteren Phase jeder Probe in entsprechend beschriftete Mikrozentrifugenröhrchen.
- Geben Sie 500 μl CHCl3 in die verbleibende Probe und wiederholen Sie die Schritte 5.6-5.7.
- Die Proben werden unter Stickstoffgas oder in einCHCl 3-beständiges gekühltes Zentrifugalvakuum bei 4 °C gegeben, bis sie vollständig getrocknet sind. Getrocknete Proben können bei -20 °C gelagert werden, bis sie für die Derivatisierung bereit sind.
HINWEIS: An dieser Stelle kann auch die oberste Schicht jeder Probe entnommen und wie in Schritt 5.9 getrocknet werden, um polare Metaboliten zu analysieren.
6. Herstellung von Fettsäuremethylestern (FAMEs) und GCMS-Analyse
- Säurekatalysierte Veresterung und Umesterung zur Herstellung von FAMEs
ACHTUNG: Die folgenden Schritte sollten aufgrund der Inhalationsgefahr der Lösungsmittel unter einem Abzug durchgeführt werden.- Wenn die Proben im Gefrierschrank gelagert wurden, trocknen Sie sie 5 Minuten lang unter Stickstoff, um sicherzustellen, dass kein Wasser vorhanden ist.
- Mit Lösungsmitteln in MS-Qualität 98 ml wasserfreiesCH3OH in eine Glasmedienflasche pipettieren. Langsam 2 ml wasserfreie Schwefelsäure in den Abzug geben, um 2 %H2SO4 inCH3OHzu erhalten. Mischen Sie, indem Sie die geschlossene Flasche schwenken.
- Zu jeder Probe werden 500 μl 2%igeH2SO4-Lösung inCH3OH-Lösunggegeben und kurz vorgewirbelt.
- Die Proben werden auf einem Wärmeblock bei 50 °C für 2 h inkubiert.
- Nehmen Sie die Proben aus dem Heizblock und geben Sie 100 μl gesättigte NaCl-Lösung und 500 μl Hexan zu jeder Probe.
- Die Proben werden bei Raumtemperatur 1 min lang kräftig vorgewirbelt. Lassen Sie die Proben 1 Minute lang einwirken; Danach sollten zwei Phasen erkennbar sein.
- Die obere Phase wird in ein frisches Mikrozentrifugenröhrchen aufgefangen (siehe Hinweis in Abschnitt 5.1.3 zur geeigneten Auswahl des Mikrozentrifugenröhrchens).
- Um die Ausbeute zu maximieren, wiederholen Sie die Schritte 6.1.5-6.1.7 und sammeln Sie die zweite Probe in denselben markierten Röhrchen.
- Trocknen Sie die Proben bei Raumtemperatur unter Stickstoffgas.
- Resuspendieren Sie die Proben in 20 μl/mg Hexan, bezogen auf das ursprüngliche Gewebegewicht, und geben Sie sie sofort in ein GC-Glasfläschchen mit einem Glaseinsatz um.
HINWEIS: Arbeiten Sie beim Übertragen von Proben schnell, um die Verdunstung zu minimieren.
- GCMS-Analyse
- Um die Häufigkeit von FAME-Isotopologen zu bestimmen, injizieren Sie die Proben auf einem einzelnen Quadrupol-Gaschromatographie-Massenspektrometer (GCMS).
HINWEIS: Während viele Säulentypen zum Nachweis von Palmitat verwendet werden können, wurde das folgende Temperaturprogramm für eine GCMS-Säule festgelegt, die für die Trennung von Fettsäure-cis/trans-Isomeren entwickelt wurde, wie in der Materialtabelle beschrieben. Diese Säule hat eine Länge von 50 m bei einem Innendurchmesser von 0,25 mm. - Injizieren Sie 1 μl der Probe in einen geteilten/splitlosen Einlass bei einer Eintrittstemperatur von 270 °C unter Verwendung von Helium als Trägergas, das mit 1 ml/min fließt. Verwenden Sie eine splitlose Injektion für wenig reichlich vorhandene Fettsäuren mit einem Gesamtfluss von 19 ml/min, einer Septumspülung von 3 ml/min und einem Spülfluss zur Trennung der Entlüftung von 15 ml/min bei 0,75 min. Verwenden Sie ein Aufteilungsverhältnis von 10:1-40:1 für reichlich vorhandene Fettsäuren wie Palmitat und Oleat.
- Verwenden Sie die folgenden Ofenparameter: eine Ausgangstemperatur von 80 °C; Erhöhung in Schritten von 20 °C/min auf 170 °C; in Schritten von 1 °C/min auf 204 °C erhöhen; Erhöhung um 20 °C/min auf 250 °C; und dann 10 min bei 250 °C halten.
- Verwenden Sie die folgenden Parameter des massenselektiven Detektors (MSD): einen Elektronenstoßionisationsmodus von 70 eV und einen Scan im Bereich von 50-400 m/z mit einer Scangeschwindigkeit von 1.562 (u/s) und einer Frequenz von 4,1 Scans/s. Verwenden Sie eine Transferleitung bei 280 °C, eine Ionenquelle bei 230 °C und einen Quadrupol bei 150 °C.
HINWEIS: Es können auch andere Säulen verwendet werden, aber das Temperaturprogramm kann variieren. - Probensequenz: Randomisieren Sie die Probenreihenfolge der Injektion und injizieren Sie mindestens zwei oder drei Hexan-Leerproben zu Beginn der Sequenz, nach jeder fünften Probe innerhalb der Sequenz und zwei oder drei am Ende der Sequenz.
- Verwenden Sie gerätespezifische Software oder kostenlose Open-Access-Software wie Metabolite-Detector33, um die Ionen in Tabelle 1 für jeden Fettsäuremethylester zu integrieren.
HINWEIS: Wir haben in Tabelle 1 Ionen beschrieben, die M1-M5-Isotopologe abdecken, von denen wir festgestellt haben, dass sie die Menge des Deuteriumeinbaus mit diesem Markierungsfenster abdecken. Dies muss jedoch möglicherweise erweitert werden, wenn das De-novo-Flussmittel deutlich höher ist und/oder eine längere Markierungszeit verwendet wird. - Verwenden Sie die Häufigkeit jedes integrierten Ions, um eine Massenisotopomerenverteilung zu erzeugen, bei der die Ionenintensitäten in eine fraktionelle Häufigkeit umgerechnet werden können, so dass die Summe der Massenisotopomerverteilung gleich eins ist. Bitte sehen Sie sich die Beispieltabelle in der Ergänzungsdatei an.
ANMERKUNG: Um den Deuteriumeinbau genau zu bestimmen, muss dann eine Korrektur der natürlichen Isotopenhäufigkeit vorgenommen werden, um das Vorhandensein von natürlich vorkommenden Isotopen wie 13C, 15N und 2H zu berücksichtigen. Dies wird durch die Anwendung einer Korrekturmatrix durchgeführt, wie sie von Fernandez et al.34,35 beschrieben wird, und kann nicht durchgeführt werden, indem die MID eines unmarkierten gemessenen Metaboliten von einem markierten Metaboliten subtrahiert wird. In der Praxis empfehlen wir die Verwendung frei verfügbarer Software wie fluxfix 36, polyMID37 oder IsoCor38, um Rohdaten in fraktionierte MIDs umzuwandeln, und wir haben die Formel für die Isotopenkorrektur für die Methylesterprodukte von FAS in Tabelle 1 bereitgestellt. - Um die Menge des vorhandenen Palmitats zu bestimmen, verwenden Sie die folgende Formel:
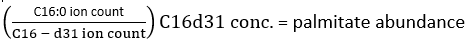
wobei sich die Ionenzahl auf die Summe aller in Tabelle 1 integrierten Palmitatisotopologen bezieht und C16:0-d 31 sich auf den internen Standard hexadecenoic-d31 bezieht. Der innere Standard bildet einen anderen Peak als der endogenen Palmitat. Die relative Häufigkeit anderer Fettsäuren kann ebenfalls bestimmt werden, aber für die vollständige Quantifizierung müssen möglicherweise fettsäurespezifische isotopeninterne Standards (mit Massenverschiebungen, die größer sind als die, die bei der Eingliederung vonD2Obeobachtet wurden) oder externe Standardkurven verwendet werden. Verwenden Sie die extrahierte Leerprobe, um die Menge an Hintergrundpalmitat zu bestimmen, und subtrahieren Sie diese vom endgültigen Gewebewert. - Berechnen Sie die molare Anreicherung (ME) von Palmitat mit der folgenden Gleichung:
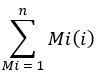
wobei Mi die normalisierte, fraktionierte Häufigkeit eines Palmitat-Isotopologen und n die Anzahl der möglichen Palmitat-Isotopologen ist. Zum Beispiel ist der ME eines Palmitatmoleküls mit der folgenden Bruchverteilung, M1 = 0,25, M2 = 0,08, M3 = 0,02, (0,025*1) + (0,08*2) + (0,02*3) = 0,245 (siehe ergänzende Datei).
- Um die Häufigkeit von FAME-Isotopologen zu bestimmen, injizieren Sie die Proben auf einem einzelnen Quadrupol-Gaschromatographie-Massenspektrometer (GCMS).
7. Deuteriumacetonaustausch von Plasmaproben zur Bestimmung der Körperwasseranreicherung
- Reaktion
- Bereiten Sie 10 Standards von Deuterium in Wasser im Bereich von 0-9% v/v vor.
- Es wird eine 5%ige Aceton/Acetonitril-Lösung mit 4 μl pro Probe hergestellt, einschließlich der Standards aus Schritt 5.1.1.
- In etikettierten, sicher verschlossenen Mikrozentrifugenröhrchen werden 10 μl jeder Plasmaprobe oder jedes Standards, 4 μl 10 M NaOH und 4 μl 5 % Aceton/Acetonitril gemischt. Führen Sie dies für jede Probe in dreifacher Ausführung durch.
- Mischen Sie die Proben vorsichtig durch Pipettieren. Lassen Sie die Proben über Nacht bei Raumtemperatur inkubieren.
- Extraktion
- Nach der Inkubation werden 450-550 mgNa2SO4 zu jeder Probe gegeben.
- Im Abzug 600 μl CHCl3 in jedes Röhrchen geben und 15 s kräftig wirbeln.
- Die Proben werden bei 300 x g für 2 min zentrifugiert.
- Unter einem Abzug dreifache 80-μl-Aliquots des Überstandes von jeder Probe in markierte GCMS-Glasfläschchen mit Glaseinsätzen und dichtem Deckel überführen.
- GCMS-Analyse
- Trennen Sie die Proben auf einer Säule (30 m, 0,25 mm Innendurchmesser, Agilent DB-35MS) und analysieren Sie sie auf dem angeschlossenen Massenspektrometer.
- Injizieren Sie 1 μl Probe in einen geteilten/spaltlosen Einlass mit einem Split-Verhältnis von 40:1, einem Heliumfluss von 1 ml/min und einer Eintrittstemperatur von 270 °C.
- Verwenden Sie die folgenden Ofenparameter: eine Anfangstemperatur von 60 °C, eine Erhöhung um 20 °C/min-Schritte auf 100 °C, eine Erhöhung um 50 °C/min-Schritte auf 220 °C und dann eine Pause von 220 °C für 1 Minute.
- Verwenden Sie die folgenden massenselektiven Detektorparameter (MSD): Elektronenstoß-Ionisationsmodus bei 70 eV mit ausgewählter Ionenüberwachung von 58 und 59 m/z. Verwenden Sie eine Transferleitung bei 280 °C, eine Ionenquelle bei 230 °C und einen Quadrupol bei 150 °C.
HINWEIS: Es können auch andere blutarme, gebundene, vernetzte Säulen mit mittlerer Polarität verwendet werden, aber das Temperaturprogramm kann variieren.
- Stellen Sie die Flüssigprobenahmemethode so ein, dass sie mit einer CHCl 3-Wäsche und dann einer zufälligen Sequenz der Proben beginnt, einschließlich zusätzlicherCHCl 3-Waschschritte alle sechs Proben.
HINWEIS: Wenn Aceton als Nadelwäsche für den Autosampler verwendet wird, ersetzen Sie es durch CHCl 3 oder Hexan und injizieren Sie mehrereCHCl 3-Leerproben, bis kein kontaminierender Acetonpeak mehr im Chromatogramm erkennbar ist. - Bei dieser Methode eluiert ein Aceton-Peak nach etwa 1,25 min. Integrieren Sie die Daten und berechnen Sie die fraktionelle Häufigkeit der Acetonanreicherung gemäß den Schritten 6.2.6-6.2.7, mit einer Anpassung, um Peaks mit einem m/z-Verhältnis von 58-60 zu analysieren, wie in Tabelle 1 angegeben.
- Verwenden Sie die Standards, um eine Standardkurve zu erstellen, um den Prozentsatz der Körperwasseranreicherung (p) der Testproben basierend auf der fraktionellen Anreicherung von Aceton zu bestimmen.
- Trennen Sie die Proben auf einer Säule (30 m, 0,25 mm Innendurchmesser, Agilent DB-35MS) und analysieren Sie sie auf dem angeschlossenen Massenspektrometer.
8. In-vivo-De-novo-Lipogenese-Berechnungen
- Berechnen Sie den Anteil der neu synthetisierten Fettsäuren (FNS), die direkte Produkte von FAS sind (d. h. Palmitat, ungera-kettige Fettsäuren und mmBCFAs) in jeder Probe mit der folgenden Gleichung:
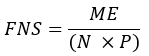
wobei ME die durchschnittliche molare Anreicherung eines Palmitatmoleküls (Schritt 6.2.9), p die Deuteriumanreicherung in Wasser aus der entsprechenden Plasmaprobe (Schritt 7.3.4) und N die Anzahl der austauschbaren Wasserstoffatome auf Palmitat ist, in die ein Deuterium eingebaut werden kann. - Bestimmen Sie N mit der folgenden Gleichung, die von Lee et al.31 aufgestellt wurde:
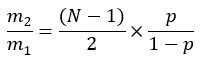
- Bestimmen Sie die molare Menge an neu synthetisierten Fettsäuren (MNS) durch:
MNS = FNS x Gesamtfettsäuremenge (nmol/mg Gewebe).
ANMERKUNG: Wenn beispielsweise eine Palmitat-Molarenanreicherung (ME) von 0,245, eine Deuteriumanreicherung in Körperwasser (p) von 0,045 und eine berechnete N-Zahl von 22 erhalten wird, beträgt die fraktionierte Synthese von Palmitat 0,247. Wenn die Menge des im Gewebe vorhandenen Palmitats 2 mmol/mg beträgt, beträgt das mmol des neu synthetisierten Palmitats 0,494 mmol/mg (siehe Zusatzdatei).
Ergebnisse
Basierend auf der in Schritt 1 beschriebenenD2O-Dosierungstellen wir typischerweise fest, dass das Körperwasser im Bereich von 2,5 % bis 6 % angereichert ist und dass ein Ausgangsniveau der Deuteriumanreicherung im Körperwasser schnell in 1 h erreicht und für die Dauer der Studie über 8 % angereichertes Trinkwasser aufrechterhalten wird (Abbildung 1). Die kontinuierliche stationäre Körperwasseranreicherung ist eine Annahme der in Schritt 6 verwendeten Berechnungen, ...
Diskussion
Das Verständnis des Gleichgewichts und der Wechselwirkung zwischen komplexen Stoffwechselwegen ist ein unverzichtbarer Schritt, um die biologischen Grundlagen von Stoffwechselerkrankungen zu verstehen. Hier zeigen wir eine nicht-invasive und kostengünstige Methodik, um Veränderungen in der de novo Fettsäuresynthese zu bestimmen. Diese Methode ist von früher veröffentlichten Methoden adaptiert, die Berechnungen zur Schätzung des De-novo-Syntheseflusses aus der Fettsäure-Deuterium-Anreicherung
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken den Sanchez-Gurmaches und den Mitgliedern des Wallace-Labors für wertvolle Gespräche. Diese Arbeit wurde durch Zuschüsse der American Heart Association (18CDA34080527 an JSG und 19POST34380545 an RM), der NIH (R21OD031907 an JSG), einen CCHMC Trustee Award, einen CCHMC Center for Pediatric Genomics Award und einen CCHMC Center for Mendelian Genomics & Therapeutics Award unterstützt. Diese Arbeit wurde teilweise von NIH P30 DK078392 des Digestive Diseases Research Core Center in Cincinnati unterstützt. Der Inhalt liegt in der alleinigen Verantwortung der Autoren und stellt nicht unbedingt die offizielle Meinung der National Institutes of Health dar. RT und MW wurden durch ein UCD Ad Astra Fellowship unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 4 mL Glass Vials | Fisher Scientific | 14-955-334 | |
| 0.2 µm filter | Olympus Plastic | 25-244 | |
| 26G needeled syringes | BD | 309597 | |
| Acetone | Merck | 34850 | |
| Acetonitrile | Merck | 900667 | |
| Blue GC screw cap with septa | Agilent | 5190-1599 | |
| Centrifuge | Eppendorf | 5424R | |
| Chloroform | Sigma | 366927 | |
| Deuterium oxide | Sigma | 151882 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Merck | B1378 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Agilent | CP7419 | |
| EDTA tube | Sarstedt | 411395105 | |
| Ethanol | Merck | 51976 | |
| Hexadecenoic-d31 Acid | Larodan | 71-1631 | |
| Hexane | Merck | 34859 | |
| Methanol | Merck | 34860 | |
| Microcentrifuge tube | Olympus Plastic | 24-282 | |
| Mouse environmental chamber | Caron | Caron 7001-33 | |
| Potasium Chloride | Fisher Bioreagents | BP366-500 | |
| Potasium Phosphate | MP Biomedicals | 194727 | |
| SafeLock microcentrifuge tubes | Eppendorf | 30120086 | |
| Screw top amber GC vial | Agilent | 5182-0716 | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Hydroxide | Merck | S5881 | |
| Sodium Phosphate, dibasic | Fisher Bioreagents | BP332-500 | |
| Sodium Sulfate | Merck | 239313 | |
| Sulfuric Acid | Merck | 258105 | |
| Vial insert | Agilent | 5183-2088 |
Referenzen
- . The Lancet, Diabetes Endocrinology. Childhood obesity: a growing pandemic. The Lancet. Diabetes & Endocrinology. 10 (1), 1 (2022).
- Gonzalez-Muniesa, P., et al. Obesity. Nature Reviews Disease Primers. 3, 17034 (2017).
- Müller, T. D., Blüher, M., Tschöp, M. H., DiMarchi, R. D. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21 (3), 201-223 (2021).
- Virtue, S., Vidal-Puig, A. GTTs and ITTs in mice: simple tests, complex answers. Nature Metabolism. 3 (7), 883-886 (2021).
- Müller, T. D., Klingenspor, M., Tschöp, M. H. Revisiting energy expenditure: how to correct mouse metabolic rate for body mass. Nature Metabolism. 3 (9), 1134-1136 (2021).
- Virtue, S., Lelliott, C. J., Vidal-Puig, A. What is the most appropriate covariate in ANCOVA when analysing metabolic rate. Nature Metabolism. 3 (12), 1585 (2021).
- Hellerstein, M. K. De novo lipogenesis in humans: metabolic and regulatory aspects. European Journal of Clinical Nutrition. 53 Suppl 1, S53-S65 (1999).
- Zhao, S., et al. Dietary fructose feeds hepatic lipogenesis via microbiota-derived acetate. Nature. 579 (7800), 586-591 (2020).
- Wallace, M., et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nature Chemical Biology. 14 (11), 1021-1031 (2018).
- Zhao, S., et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch. Cell Reports. 17 (4), 1037-1052 (2016).
- Green, C. R., et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. Nature Chemical Biology. 12 (1), 15-21 (2016).
- Zhang, Z., et al. Serine catabolism generates liver NADPH and supports hepatic lipogenesis. Nature Metabolism. 3 (12), 1608-1620 (2021).
- Chirala, S. S., et al. Fatty acid synthesis is essential in embryonic development: fatty acid synthase null mutants and most of the heterozygotes die in utero. Proceedings of the National Academy of Sciences. 100 (11), 6358-6363 (2003).
- Icard, P., et al. ATP citrate lyase: A central metabolic enzyme in cancer. Cancer Letters. 471, 125-134 (2020).
- Fhu, C. W., Ali, A. Fatty acid synthase: an emerging target in cancer. Molecules. 25 (17), 3935 (2020).
- Lawitz, E. J., et al. Acetyl-CoA carboxylase inhibitor GS-0976 for 12 weeks reduces hepatic de novo lipogenesis and steatosis in patients with nonalcoholic steatohepatitis. Clinical Gastroenterology and Hepatology. 16 (12), 1983e3-1991e3 (2018).
- Smith, G. I., et al. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. The Journal of Clinical Investigation. 130 (3), 1453-1460 (2020).
- Imamura, F., et al. Fatty acids in the de novo lipogenesis pathway and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Medicine. 17 (6), e1003102 (2020).
- Lai, H. T. M., et al. Serial plasma phospholipid fatty acids in the de novo lipogenesis pathway and total mortality, cause-specific mortality, and cardiovascular diseases in the cardiovascular health study. Journal of the American Heart Association. 8 (22), e012881 (2019).
- Ference, B. A., et al. Mendelian randomization study of ACLY and cardiovascular disease. The New England Journal of Medicine. 380 (11), 1033-1042 (2019).
- Herman, M. A., et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature. 484 (7394), 333-338 (2012).
- Sanchez-Gurmaches, J., et al. Brown fat AKT2 Is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis. Cell Metabolism. 27 (1), 195e6-209e6 (2018).
- Wang, X., et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. II. Purification and characterization. The Journal of Biological Chemistry. 268 (19), 14497-14504 (1993).
- Briggs, M. R., Yokoyama, C., Wang, X., Brown, M. S., Goldstein, J. L. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence. The Journal of Biological Chemistry. 268 (19), 14490-14496 (1993).
- Yokoyama, C., et al. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell. 75 (1), 187-197 (1993).
- Chen, G., Liang, G., Ou, J., Goldstein, J. L., Brown, M. S. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver. Proceedings of the National Academy of Sciences. 101 (31), 11245-11250 (2004).
- Denechaud, P. D., et al. ChREBP, but not LXRs, is required for the induction of glucose-regulated genes in mouse liver. The Journal of Clinical Investigation. 118 (3), 956-964 (2008).
- Crewe, C., et al. SREBP-regulated adipocyte lipogenesis is dependent on substrate availability and redox modulation of mTORC1. JCI Insight. 5 (15), e129397 (2019).
- Batchuluun, B., Pinkosky, S. L., Steinberg, G. R. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nature Reviews Drug Discovery. 21 (4), 283-305 (2022).
- Wallace, M., Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Seminars in Cell & Developmental Biology. 108, 65-71 (2020).
- Lee, W. N., et al. In vivo measurement of fatty acids and cholesterol synthesis using D2O and mass isotopomer analysis. The American Journal of Physiology. 266 (5 Pt 1), E699-E708 (1994).
- Yao, C. H., Liu, G. Y., Yang, K., Gross, R. W., Patti, G. J. Inaccurate quantitation of palmitate in metabolomics and isotope tracer studies due to plastics. Metabolomics. 12, 143 (2016).
- Hiller, K., et al. MetaboliteDetector: comprehensive analysis tool for targeted and nontargeted GC/MS based metabolome analysis. Analytical Chemistry. 81 (9), 3429-3439 (2009).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. Journal of Mass Spectrometry. 31 (3), 255-262 (1996).
- Midani, F. S., Wynn, M. L., Schnell, S. The importance of accurately correcting for the natural abundance of stable isotopes. Analytical Biochemistry. 520, 27-43 (2017).
- Trefely, S., Ashwell, P., Snyder, N. W. FluxFix: automatic isotopologue normalization for metabolic tracer analysis. BMC Bioinformatics. 17 (1), 485 (2016).
- Jeong, H., et al. Correcting for naturally occurring mass isotopologue abundances in stable-isotope tracing experiments with PolyMID. Metabolites. 11 (5), 310 (2021).
- Millard, P., et al. IsoCor: isotope correction for high-resolution MS labeling experiments. Bioinformatics. 35 (21), 4484-4487 (2019).
- Brunengraber, D. Z., et al. Influence of diet on the modeling of adipose tissue triglycerides during growth. American Journal of Physiology. Endocrinology and Metabolsim. 285 (4), E917-E925 (2003).
- Svensson, R. U., et al. Inhibition of acetyl-CoA carboxylase suppresses fatty acid synthesis and tumor growth of non-small-cell lung cancer in preclinical models. Nature Medicine. 22 (10), 1108-1119 (2016).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: a technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263 (5 Pt 1), E988-E1001 (1992).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Kelleher, J. K., Masterson, T. M. Model equations for condensation biosynthesis using stable isotopes and radioisotopes. The American Journal of Physiology. 262 (1 Pt 1), E118-E125 (1992).
- Kelleher, J. K., Nickol, G. B. Isotopomer spectral analysis: utilizing nonlinear models in isotopic flux studies. Methods in Enzymology. 561, 303-330 (2015).
- Argus, J. P., et al. Development and application of FASA, a model for quantifying fatty acid metabolism using stable isotope labeling. Cell Reports. 25 (10), 2919.e8-2934.e8 (2018).
- Guilherme, A., et al. Control of adipocyte thermogenesis and lipogenesis through β3-adrenergic and thyroid hormone signal integration. Cell Reports. 31 (5), 107598 (2020).
- Guilherme, A., et al. Neuronal modulation of brown adipose activity through perturbation of white adipocyte lipogenesis. Molecular Metabolism. 16, 116-125 (2018).
- Guilherme, A., et al. Adipocyte lipid synthesis coupled to neuronal control of thermogenic programming. Molecular Metabolism. 6 (8), 781-796 (2017).
- Lodhi, I. J., et al. Inhibiting adipose tissue lipogenesis reprograms thermogenesis and PPARgamma activation to decrease diet-induced obesity. Cell Metabolism. 16 (2), 189-201 (2012).
- McCormack, J. G., Denton, R. M. Evidence that fatty acid synthesis in the interscapular brown adipose tissue of cold-adapted rats is increased in vivo by insulin by mechanisms involving parallel activation of pyruvate dehydrogenase and acetyl-coenzyme A carboxylase. The Biochemistry Journal. 166 (3), 627-630 (1977).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Letters. 104 (1), 13-16 (1979).
- Negron, S. G., Ercan-Sencicek, A. G., Freed, J., Walters, M., Lin, Z. Both proliferation and lipogenesis of brown adipocytes contribute to postnatal brown adipose tissue growth in mice. Science Reports. 10 (1), 20335 (2020).
- Schlein, C., et al. Endogenous fatty acid synthesis drives brown adipose tissue involution. Cell Reports. 34 (2), 108624 (2021).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. Journal of Lipid Research. 55 (11), 2276-2286 (2014).
- Adlanmerini, M., et al. Circadian lipid synthesis in brown fat maintains murine body temperature during chronic cold. Proceedings of the National Academy of Sciences. 116 (37), 18691-18699 (2019).
- Yu, X. X., Lewin, D. A., Forrest, W., Adams, S. H. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB Journal. 16 (2), 155-168 (2002).
- Kushner, D. J., Baker, A., Dunstall, T. G. Pharmacological uses and perspectives of heavy water and deuterated compounds. Canadian Journal of Physiology and Pharmacology. 77 (2), 79-88 (1999).
- Diraison, F., Pachiaudi, C., Beylot, M. Measuring lipogenesis and cholesterol synthesis in humans with deuterated water: use of simple gas chromatographic/mass spectrometric techniques. Journal of Mass Spectrometry. 32 (1), 81-86 (1997).
- Yang, D., et al. Assay of low deuterium enrichment of water by isotopic exchange with [U-13C3]acetone and gas chromatography-mass spectrometry. Analytical Biochemistry. 258 (2), 315-321 (1998).
- Fu, X., et al. Measurement of lipogenic flux by deuterium resolved mass spectrometry. Nature Communications. 12 (1), 3756 (2021).
- Shah, V., Herath, K., Previs, S. F., Hubbard, B. K., Roddy, T. P. Headspace analyses of acetone: a rapid method for measuring the 2H-labeling of water. Analytical Biochemistry. 404 (2), 235-237 (2010).
- Argus, J. P., Yu, A. K., Wang, E. S., Williams, K. J., Bensinger, S. J. An optimized method for measuring fatty acids and cholesterol in stable isotope-labeled cells. Journal of Lipid Research. 58 (2), 460-468 (2017).
- Belew, G. D., Jones, J. G. De novo lipogenesis in non-alcoholic fatty liver disease: Quantification with stable isotope tracers. European Journal of Clinical Investigation. 52 (3), e13733 (2022).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Belew, G. D., et al. Transfer of glucose hydrogens via acetyl-CoA, malonyl-CoA, and NADPH to fatty acids during de novo lipogenesis. Journal of Lipid Research. 60 (12), 2050-2056 (2019).
- Diraison, F., Pachiaudi, C., Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water: determination of the average number of deuterium atoms incorporated. Metabolism. 45 (7), 817-821 (1996).
- Ajie, H. O., et al. In vivo study of the biosynthesis of long-chain fatty acids using deuterated water. The American Journal of Physiology. 269 (2 Pt 1), E247-E252 (1995).
- Schloerb, P. R., Friis-Hansen, B. J., Edelman, I. S., Solomon, A. K., Moore, F. D. The measurement of total body water in the human subject by deuterium oxide dilution; with a consideration of the dynamics of deuterium distribution. The Journal of Clinical Investigation. 29 (10), 1296-1310 (1950).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten