Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Détermination quantitative de la synthèse d’acides gras de novo dans le tissu adipeux brun à l’aide d’oxyde de deutérium
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici une méthode quantitative peu coûteuse utilisant l’oxyde de deutérium et la chromatographie en phase gazeuse par spectrométrie de masse (GCMS) pour l’analyse de la lipogenèse de novo des acides gras totaux dans le tissu adipeux brun in vivo.
Résumé
La synthèse des acides gras est une voie métabolique complexe et très énergivore qui joue un rôle fonctionnel important dans le contrôle de l’homéostasie métabolique du corps entier et d’autres processus physiologiques et pathologiques. Contrairement à d’autres voies métaboliques clés, telles que l’élimination du glucose, la synthèse des acides gras n’est pas systématiquement évaluée fonctionnellement, ce qui conduit à des interprétations incomplètes de l’état métabolique. De plus, il n’existe pas de protocoles détaillés accessibles au public et adaptés aux nouveaux arrivants dans le domaine. Nous décrivons ici une méthode quantitative peu coûteuse utilisant l’oxyde de deutérium et la chromatographie en phase gazeuse par spectrométrie de masse (GCMS) pour l’analyse de la synthèse de novo d’acides gras totaux dans le tissu adipeux brun in vivo. Cette méthode mesure la synthèse des produits de la synthase d’acide gras indépendamment d’une source de carbone, et elle est potentiellement utile pour pratiquement tous les tissus, dans n’importe quel modèle de souris, et sous n’importe quelle perturbation externe. Des détails sur la préparation de l’échantillon pour le SMGC et les calculs en aval sont fournis. Nous nous concentrons sur l’analyse de la graisse brune en raison de ses niveaux élevés de synthèse d’acides gras de novo et de son rôle essentiel dans le maintien de l’homéostasie métabolique.
Introduction
L’obésité et les maladies métaboliques associées sont une pandémie qui met en danger les générations actuelles et futures 1,2. Communément simplifié comme la conséquence du déséquilibre entre l’apport et la dépense énergétique, le dérèglement métabolique associé à l’obésité affecte un grand nombre de voies métaboliques contrôlées par des facteurs environnementaux etendogènes3. Cependant, seules quelques voies sont systématiquement testées dans des modèles animaux de dérégulation métabolique.
À titre d’exemple, l’élimination du glucose est régulièrement mesurée par des tests de tolérance au glucose et à l’insuline, probablement en raison de la simplicité d’utilisation des glucomètres portables4. Les taux relatifs d’oxydation du glucose et des lipides dans l’ensemble du corps sont également estimés de manière routinière sur la base du rapport d’échange respiratoire à partir d’essais calorimétriques indirects 5,6. Cependant, la majorité de tous les autres aspects du métabolisme ne sont pas systématiquement évalués fonctionnellement. Cela conduit à des interprétations incomplètes de l’état métabolique et à des options thérapeutiques manquées. L’une de ces principales voies est la lipogenèse de novo.
La lipogenèse de novo (DNL) est le processus par lequel de nouveaux acides gras sont générés à partir de précurseurs. Le glucose est considéré comme le principal précurseur contribuant à la DNL7 du corps entier, mais d’autres précurseurs, tels que l’acétate, le fructose, le lactate et les acides aminés à chaîne ramifiée, se sont avérés être des sources de carbone pertinentes d’une manière dépendante de l’espace et de l’état 8,9,10,11,12. Le DNL est un contributeur clé à l’homéostasie métabolique et est essentiel au développement normal13. De plus, des altérations de la DNL ont été associées au cancer 14,15 et métabolique 16,17,18 et aux maladies cardiovasculaires 19,20.
La voie DNL est composée des composants enzymatiques de base ATP citrate lyase (ACLY), acétyl-CoA carboxylase (ACC1/2) et acide gras synthase (FAS) qui produisent principalement du palmitate, un acide gras saturé à 16 carbones. Cependant, les acides gras à chaîne impaire et à chaîne ramifiée peuvent également être produits à des taux plus faibles9. Les élongases et les désaturases modifient davantage ces acides gras, créant une gamme diversifiée d’espèces d’acides gras utiles à diverses fonctions (par exemple, le stockage d’énergie à long terme et la manipulation de la fluidité membranaire).
L’expression de la machinerie enzymatique DNL est contrôlée par un petit nombre de facteurs de transcription. Les plus bien décrites à ce jour comprennent la famille des protéines de liaison aux éléments régulateurs des stérols (SREBP), la protéine de liaison aux éléments de réponse glucidique (ChREBP) et le récepteur X du foie (LXR)21,22,23,24,25,26. Malgré un chevauchement apparent de leurs fonctions, des régulations individuelles basées sur la dominance du type cellulaire et les conditions physiologiques ou pathologiques ont été rapportées21,22,27,28.
Fait remarquable, un certain nombre d’inhibiteurs de certaines étapes de la voie DNL ont été approuvés pour une utilisation clinique ou sont à des stades précliniques ou cliniques de développement pour un certain nombre de maladies, notamment l’obésité, la stéatose hépatique non alcoolique/stéatohépatite non alcoolique (NAFLD/NASH) et les maladies cardiovasculaires29. Ces efforts mettent en évidence la pertinence de la DNL dans le domaine de la santé et de la maladie.
Au cours des dernières années, l’utilisation de méthodes d’évaluation quantitative de la synthèse des acides gras de novo a augmenté30. La méthode la plus courante pour évaluer cela est l’utilisation d’eau lourde marquée (D2O), où l’hydrogène lourd marqué est incorporé dans des chaînes acyle lors de la synthèse à la fois directement et indirectement, via l’échange de deutérium avec les hydrogènes des substrats DNL NAPDH, acétyl-CoA et malonyl-CoA. Bien que cette approche gagne en popularité, il y a un manque de protocoles détaillés accessibles au public et adaptés aux nouveaux arrivants dans le domaine. Nous décrivons ici une méthode d’évaluation quantitative de la synthèse de novo des produits du SAF à l’aide du D2O et de la chromatographie en phase gazeuse par spectrométrie de masse (GCMS), avec des calculs précédemment développés par Lee et al.31. Cette méthode mesure la synthèse d’acides gras de novo indépendamment d’une source de carbone, et elle est potentiellement utile pour pratiquement tous les tissus, dans n’importe quel modèle murin et sous n’importe quelle perturbation externe. Ici, nous nous concentrons sur l’analyse du tissu adipeux brun (BAT) en raison de ses niveaux élevés de DNL et de son rôle essentiel dans le maintien de l’homéostasie métabolique.
Protocole
Toutes les expériences ont été approuvées par le comité institutionnel de soins et d’utilisation des animaux du centre médical de l’hôpital pour enfants de Cincinnati.
1. Préparation du D2O
REMARQUE : Pour éviter les variations expérimentales, préparez suffisamment de solution / d’eau potable pour toutes les souris pendant toute la durée de l’expérience.
- Pour l’injection intrapéritonéale : générer 0,9 % p/v de solution saline D 2 O en dissolvant 9 g de NaCl par litre deD 2 O. Filtrer à travers un filtre apyrogène de0,2μm pour stériliser.
- Pour boire de l’eau D 2 O : produire 8 % v/v d 2 d’eau enrichie en O à utiliser comme eau potable en mélangeant 80 mL deD2O par 920 mL d’eau potable ordinaire. De l’eau potable ordinaire peut être obtenue auprès de l’installation de souris. Filtrer à travers un filtre apyrogène de 0,2 μm pour stériliser.
2. Modulation de l’activité des MTD par acclimatation à la température
- Séparez les souris de manière à ce qu’il y ait deux souris par cage 2 semaines avant le début de l’acclimatation à la température. Changez l’alimentation en eau pour que les souris s’adaptent et maintiennent toutes les cages à 22 °C.
- Préparez les chambres environnementales de la souris 1 semaine avant le début de l’acclimatation à la température en réglant les températures appropriées : 30 °C pour la thermoneutralité, 22 °C pour la température ambiante et 18 °C pour l’exposition au froid.
- Au début de l’acclimatation à la température, remplacez les cages par des cages neuves sans enrichissement de l’environnement (pour éviter les nids). Déplacez les cages à leurs températures respectives.
REMARQUE : Les cages affectées à la thermoneutralité resteront à 30 °C pendant 4 semaines. Les cages assignées à la température ambiante resteront à 22 °C pendant 4 semaines. Les cages affectées à l’exposition au froid deviendront progressivement plus froides selon un horaire hebdomadaire : 18 °C pour la première semaine, 14 °C pour la deuxième semaine, 10 °C pour la troisième semaine et 6 °C pour la quatrième semaine. - Changez les cages souillées chaque semaine pour toutes les conditions. De plus, remplacez les bouteilles de nourriture et d’eau par des bouteilles neuves préadaptées à la température appropriée pendant au moins 24 h.
REMARQUE : Faites attention aux quantités de nourriture ajoutées chaque semaine, en particulier pour les souris froides, car elles consommeront une quantité de nourriture nettement plus importante par rapport aux conditions normales. Fournir de la nourriture ad libitum.
3. Administration du D2O
- Injecter à chaque animal une solution saline à 0,9 % p/v-D2O à 35 μL/g de poids corporel, 12 h à 3 jours avant le prélèvement tissulaire, par injection intrapéritonéale à l’aide d’une seringue de 1 mL et d’une aiguille de 26 G.
REMARQUE : Veuillez consulter la section de discussion pour plus d’informations sur le choix d’un moment d’étiquetage approprié. - Remplacez les bouteilles d’eau par des bouteilles contenant 8 % v/v d’eaupotable enrichie en O D2.
4. Prélèvement, traitement et stockage du plasma et des tissus
- À la fin de l’expérience, sacrifiez les souris en utilisant des méthodologies approuvées (par exemple, surdosage de dioxyde de carbone suivi d’une luxation cervicale).
- Utilisez des coussinets chauffants ou froids ou d’autres méthodes pour éviter les changements brusques de température avant l’euthanasie qui pourraient affecter les résultats. Euthanasier les souris selon les méthodologies approuvées. Procéder immédiatement au prélèvement de sang et de tissus.
- Prélever du sang par ponction cardiaque à l’aide d’une aiguille de 26 G et le conserver dans un tube de prélèvement sanguin à base d’acide éthylènediaminetétraacétique. Gardez le sang sur la glace jusqu’à ce que le traitement soit terminé.
- Coupez la peau le long de la ligne médiane du dos de la souris, de la zone inférieure de la cavité thoracique jusqu’à la zone supérieure du cou, tout en tirant la peau vers le haut pour éviter d’affecter les tissus sous la peau. La MTD interscapulaire est située entre les omoplates sous une fine couche de tissu adipeux blanc, et elle est composée de deux lobes de forme pyramidale.
- Nettoyez le tissu en le lavant dans une solution saline tamponnée au phosphate (PBS) glacée. Tamponnez sur une serviette en papier pour éliminer l’excès de liquide, pesez sur une balance analytique et collectez dans un microtube.
- Congeler immédiatement les tissus à l’aide d’azote liquide. D’autres dépôts BAT peuvent également être collectés.
- Centrifuger les échantillons de sang à 10 000 x g pendant 10 min à 4 °C. Après la centrifugation, prélevez soigneusement le plasma sans perturber la pastille de globules rouges. Transférez-le dans un nouveau microtube glacé et congelez-le rapidement dans de l’azote liquide.
- Conservez les échantillons de graisse brune et de plasma à -80 °C jusqu’à utilisation.
5. Extraction des lipides du tissu adipeux
- Avant de commencer l’extraction
- Préparer une solution de 1 mM d’acide hexadénoïque-d31 dans du méthanol dans un flacon en verre. Cela servira d’étalon interne d’acides gras.
- Pré-refroidir la quantité requise de chloroforme (CHCl 3) et de méthanol (CH3OH) dans un congélateur à -80 °C ou sur de la glace carbonique.
REMARQUE : Le di-tert-butyl-4-méthylphénol (BHT) antioxydant peut être ajouté auCHCl 3 à une concentration de 0,01 % p/v (2,5 mg/25 mL) pour prévenir l’oxydation des doubles liaisons dans les acides gras insaturés. - Pré-étiqueter les tubes de microcentrifugation pour chaque échantillon de tissu et un tube supplémentaire à utiliser pour une extraction à blanc.
ATTENTION : Le CH 3OH et le CHCl3 sont très volatils et toxiques s’ils sont inhalés. Utiliser uniquement dans les hottes.
REMARQUE : Différentes marques de tubes de microcentrifugation ont des niveaux différents de palmitate de fond et des capacités en termes de prévention des fuites de solvant. Nous recommandons qu’une variété de tubes soient d’abord testés, afin de s’assurer que les fuites de solvant sont évitées et que les tubes ont des niveaux minimaux de palmitate contaminant. Voir Yao et al.32 pour plus de détails.
- Sortez les échantillons du congélateur et placez-les sur de la glace sèche.
- Placez le tube de microcentrifugation pré-étiqueté sur une balance d’analyse et tarez la balance. Placez une pince à épiler et un scalpel/lame de rasoir en acier sur de la glace carbonique pendant 10 à 20 s pour refroidir.
- Utilisez la pince à épiler pour retirer l’échantillon de tissu congelé du tube et placez-le sur un bateau de pesée en plastique. Le bateau de pesée peut être placé sur un bloc plat de glace carbonique ou sur une autre surface pré-refroidie.
- À l’aide du scalpel ou de la lame de rasoir en acier, disséquez une petite partie du tissu, équivalant à 5 à 15 mg de poids. Placez-le dans le tube de la microcentrifugeuse et notez le poids exact. Répétez l’opération pour chaque échantillon. Les échantillons peuvent être conservés au congélateur à ce stade ou peuvent être avancés aux étapes ci-dessous pour l’extraction des lipides.
REMARQUE : Assurez-vous que le scalpel est correctement nettoyé avec de l’éthanol à 70% entre les échantillons et qu’un nouveau bateau de pesée est utilisé entre chaque échantillon.
- Ajouter 1 μL/mg d’acide hexadécénoïque-d 31(C16 :0-j31) de 10 mM à chaque échantillon.
ATTENTION : Les étapes suivantes (5.4 à 5.8) doivent être effectuées sous une hotte en raison du risque d’inhalation des solvants. - Ajouter 250 μL deCH3OH, 250 μL de H2O et 500 μL de CHCl3 à chaque échantillon à l’aide de trois billes d’acier inoxydable de 5 mm. Placez les tubes dans un bloc pré-refroidi d’un broyeur et mélangez les échantillons à une fréquence de vibration de 25 Hz pendant 5 min, ou utilisez les directives recommandées par le fabricant pour les échantillons de tissus. Retirez les perles à l’aide d’un aimant.
- Centrifuger les échantillons à 12 000 x g pendant 10 min à 4 °C.
REMARQUE : Après centrifugation, une séparation biphasique claire doit être observée avec la phase aqueuse supérieure contenant des métabolites polaires et la phase organique inférieure contenant des lipides et des acides gras. Si aucune séparation n’est observée, ajouter 250 μL de H2O et répéter les étapes de vortex et de centrifugation. - À l’aide d’une micropipette, prélevez un volume fixe de la phase inférieure de chaque échantillon dans des tubes de microcentrifugation étiquetés en conséquence.
- Ajouter 500 μL de CHCl3 au reste de l’échantillon et répéter les étapes 5.6 à 5.7.
- Placez les échantillons sous azote gazeux ou dans un vide centrifuge réfrigéré résistant au CHCl3 à 4 °C jusqu’à ce qu’ils soient complètement secs. Les échantillons séchés peuvent être conservés à -20 °C jusqu’à ce qu’ils soient prêts à être dérivés.
REMARQUE : La couche supérieure de chaque échantillon peut également être prélevée à ce stade et séchée comme à l’étape 5.9 afin d’analyser les métabolites polaires.
6. Préparation des esters méthyliques d’acides gras (EMAG) et analyse du SMGC
- Estérification et transestérification catalysées par l’acide pour préparer les EMAG
ATTENTION : Les étapes suivantes doivent être effectuées sous une hotte en raison du risque d’inhalation des solvants.- Si les échantillons ont été conservés au congélateur, séchez-les sous azote pendant 5 minutes pour vous assurer qu’il n’y a pas d’eau.
- À l’aide de solvants de qualité MS, pipeter 98 mL de CH3OH anhydre dans un flacon en verre. Ajouter lentement 2 mL d’acide sulfurique anhydre dans la hotte pour obtenir 2 % H2SO4 dans CH3OH. Mélangez en faisant tourner la bouteille fermée.
- Ajouter 500 μL de solution 2% H2SO4 dans CH3OH à chaque échantillon et tourbillonner brièvement.
- Incuber les échantillons sur un bloc chauffant à 50 °C pendant 2 h.
- Retirez les échantillons du bloc chauffant et ajoutez 100 μL de solution saturée de NaCl et 500 μL d’hexane à chaque échantillon.
- Faire tourner les échantillons vigoureusement à température ambiante pendant 1 min. Laisser reposer les échantillons pendant 1 min ; Deux phases devraient être apparentes après cela.
- Recueillir la phase supérieure dans un nouveau tube de microcentrifugation (voir la note de la section 5.1.3 pour le choix approprié du tube de microcentrifugation).
- Pour maximiser le rendement, répétez les étapes 6.1.5 à 6.1.7, en prélevant le deuxième échantillon dans les mêmes tubes étiquetés.
- Séchez les échantillons à température ambiante sous azote gazeux.
- Remettre les échantillons en suspension dans 20 μL/mg d’hexane, par rapport au poids du tissu d’origine, et transférer immédiatement dans un flacon de GC en verre avec un insert en verre.
REMARQUE : Travaillez rapidement lors du transfert des échantillons pour minimiser l’évaporation.
- Analyse du SMGC
- Pour déterminer l’abondance des isotopologues de l’EMAG, injecter les échantillons sur un seul spectromètre de masse quadripolaire de chromatographie en phase gazeuse (GCMS).
NOTA : Bien que de nombreux types de colonnes puissent être utilisés pour détecter le palmitate, le programme de température suivant a été établi pour une colonne GCMS qui a été développée pour la séparation des isomères cis/trans d’acides gras, comme indiqué dans le tableau des matériaux. Cette colonne a une longueur de 50 m avec un diamètre intérieur de 0,25 mm. - Injecter 1 μL d’échantillon dans une entrée fendue/non fendue à une température d’entrée de 270 °C, en utilisant de l’hélium comme gaz porteur, s’écoulant à 1 mL/min. Utiliser une injection sans fente pour les acides gras peu abondants avec un débit total de 19 mL/min, une purge du septum de 3 mL/min et un débit de purge vers l’évent fendu de 15 mL/min à 0,75 min. Utilisez un rapport de répartition de 10 :1-40 :1 pour les acides gras très abondants tels que le palmitate et l’oléate.
- Utiliser les paramètres suivants du four : une température initiale de 80 °C ; augmenter par incréments de 20 °C/min jusqu’à 170 °C ; augmenter par incréments de 1 °C/min jusqu’à 204 °C ; augmenter par incréments de 20 °C/min jusqu’à 250 °C ; puis maintenir à 250 °C pendant 10 min.
- Utilisez les paramètres de détecteur sélectif de masse (MSD) suivants : un mode d’ionisation par impact d’électrons de 70 eV et balayez sur une plage de 50 à 400 m/z avec une vitesse de balayage de 1 562 (u/s) et une fréquence de 4,1 balayages/s. Utilisez une ligne de transfert à 280 °C, une source d’ions à 230 °C et un quadripôle à 150 °C.
REMARQUE : D’autres colonnes peuvent être utilisées, mais le programme de température variera. - Séquence d’échantillonnage : Randomiser l’ordre d’injection de l’échantillon et injecter au moins deux ou trois blancs d’hexane au début de la séquence, après chaque cinquième échantillon dans la séquence, et deux ou trois à la fin de la séquence.
- Utilisez un logiciel spécifique à l’instrument, ou un logiciel gratuit en libre accès tel que Metabolite-Detector33, pour intégrer les ions du tableau 1 pour chaque ester méthylique d’acide gras.
REMARQUE : Nous avons décrit les ions qui couvrent les isotopologues M1-M5 dans le tableau 1 qui, selon nous, couvre la quantité d’incorporation de deutérium avec cette fenêtre d’étiquetage. Cependant, il peut être nécessaire de l’étendre si le flux de novo est significativement plus élevé et/ou si un temps d’étiquetage plus long est utilisé. - Utilisez l’abondance de chaque ion intégré pour générer une distribution isotopomère de masse, où les intensités ioniques peuvent être converties en abondance fractionnaire de sorte que la somme de la distribution isotopomère de masse soit égale à un. Veuillez consulter l’exemple de feuille de calcul dans le fichier supplémentaire.
NOTA : Afin de déterminer avec précision l’incorporation du deutérium, il faut ensuite corriger l’abondance des isotopes naturels pour tenir compte de la présence d’isotopes naturels tels que 13C, 15N et 2H. Ceci est réalisé en appliquant une matrice de correction comme indiqué par Fernandez et al.34,35, et ne peut pas être effectué en soustrayant le MID d’un métabolite mesuré non marqué d’un métabolite marqué. En pratique, nous recommandons l’utilisation de logiciels disponibles gratuitement tels que fluxfix 36, polyMID37 ou IsoCor38 pour transformer les données brutes en MID fractionnaires, et nous avons fourni la formule de correction isotopique pour les produits à base d’ester méthylique du SAF dans le tableau 1. - Pour déterminer la quantité de palmitate présente, utilisez la formule suivante :
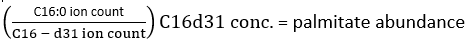
où le nombre d’ions fait référence à la somme de tous les isotopologues du palmitate intégrés dans le tableau 1 et C16 :0-d 31 fait référence à l’étalon interne hexadénoïque-d31. L’étalon interne forme un pic distinct de celui du palmitate endogène. L’abondance relative d’autres acides gras peut également être déterminée, mais il peut être nécessaire d’utiliser des étalons internes d’isotopes spécifiques aux acides gras (avec des décalages de masse supérieurs à ceux observés lors de l’incorporation de D2O) ou des courbes d’étalons externes pour une quantification complète. Utilisez l’échantillon vierge extrait pour déterminer la quantité de palmitate de fond et soustrayez-la de la valeur tissulaire finale. - Calculer l’enrichissement molaire (EM) du palmitate par l’équation suivante :
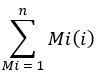
où Mi est l’abondance fractionnaire normalisée d’un isotopologue palmité, et n est le nombre d’isotopologues palmités possibles. Par exemple, l’EM d’une molécule de palmitate avec la distribution fractionnaire suivante, M1 = 0,25, M2 = 0,08, M3 = 0,02, est : (0,025*1) + (0,08*2) + (0,02*3) = 0,245 (voir le fichier supplémentaire).
- Pour déterminer l’abondance des isotopologues de l’EMAG, injecter les échantillons sur un seul spectromètre de masse quadripolaire de chromatographie en phase gazeuse (GCMS).
7. Échange d’acétone de deutérium d’échantillons de plasma pour déterminer l’enrichissement en eau corporelle
- Réaction
- Préparer 10 étalons de deutérium dans l’eau, allant de 0 à 9 % v/v.
- Préparer une solution d’acétone/acétonitrile à 5 % v/v en tenant compte de 4 μL par échantillon, y compris les étalons de l’étape 5.1.1.
- Dans des tubes de microcentrifugation étiquetés et sécurisés, mélanger 10 μL de chaque échantillon de plasma ou étalon, 4 μL de NaOH 10 M et 4 μL d’acétone/acétonitrile à 5 %. Effectuez cette opération en trois exemplaires pour chaque échantillon.
- Mélangez délicatement les échantillons par pipetage. Laissez les échantillons incuber à température ambiante pendant la nuit.
- Extraction
- Après incubation, ajouter 450 à 550 mg de Na2SO4 à chaque échantillon.
- Dans la hotte, ajouter 600 μL de CHCl3 dans chaque tube et faire tourbillonner vigoureusement pendant 15 s.
- Centrifuger les échantillons à 300 x g pendant 2 min.
- Sous une hotte, transférer en trois exemplaires des aliquotes de 80 μL du surnageant de chaque échantillon dans des flacons GCMS en verre étiquetés avec des inserts en verre et un bouchon hermétique.
- Analyse du SMGC
- Séparez les échantillons sur une colonne (30 m, 0,25 mm de diamètre intérieur, Agilent DB-35MS) et analysez-les sur le spectromètre de masse attaché.
- Injecter 1 μL d’échantillon dans une entrée divisée/non divisée, avec un rapport de division de 40 :1, un débit d’hélium de 1 mL/min et une température d’entrée de 270 °C.
- Utilisez les paramètres suivants du four : une température initiale de 60 °C, augmenter par incréments de 20 °C/min jusqu’à 100 °C, augmenter de 50 °C/min jusqu’à 220 °C, puis maintenir à 220 °C pendant 1 min.
- Utilisez les paramètres de détecteur sélectif de masse (MSD) suivants : mode d’ionisation par impact d’électrons à 70 eV avec surveillance ionique sélective de 58 et 59 m/z. Utilisez une ligne de transfert à 280 °C, une source d’ions à 230 °C et un quadripôle à 150 °C.
REMARQUE : D’autres colonnes à faible purge, collées, réticulées et à polarité moyenne peuvent être utilisées, mais le programme de température variera.
- Réglez la méthode de l’échantillonneur liquide pour commencer par un lavage CHCl 3, puis une séquence aléatoire des échantillons, y compris des étapes de lavageCHCl 3 supplémentaires tous les six échantillons.
REMARQUE : Si l’acétone est utilisée comme lavage à l’aiguille pour l’échantillonneur automatique, remplacez-la par du CHCl 3 ou de l’hexane et injectez plusieurs échantillons blancs deCHCl 3 jusqu’à ce que tout pic d’acétone contaminant ne soit plus évident dans le chromatogramme. - En utilisant cette méthode, un pic d’acétone élue à environ 1,25 min. Intégrer les données et calculer l’abondance fractionnaire de l’enrichissement en acétone en suivant les étapes 6.2.6 à 6.2.7, avec un ajustement pour analyser les pics contenant un rapport m/z de 58-60 comme indiqué dans le tableau 1.
- Utilisez les étalons pour générer une courbe standard afin de déterminer le pourcentage d’enrichissement en eau corporelle (p) des échantillons d’essai, en fonction de l’enrichissement fractionné de l’acétone.
- Séparez les échantillons sur une colonne (30 m, 0,25 mm de diamètre intérieur, Agilent DB-35MS) et analysez-les sur le spectromètre de masse attaché.
8. Calculs de lipogenèse in vivo de novo
- Calculer la fraction d’acides gras nouvellement synthétisés (FNS) qui sont des produits directs du SAF (c.-à-d. palmitate, acides gras à chaîne impaire et mmBCFA) dans chaque échantillon à l’aide de l’équation suivante :
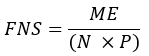
où ME est l’enrichissement molaire moyen d’une molécule de palmitate (étape 6.2.9), p est l’enrichissement en deutérium dans l’eau à partir de l’échantillon de plasma correspondant (étape 7.3.4) et N est le nombre d’atomes d’hydrogène échangeables sur le palmitate où un deutérium peut être incorporé. - Déterminer N à l’aide de l’équation ci-dessous qui a été établie par Lee et al.31 :
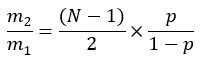
- Déterminer la quantité molaire d’acides gras nouvellement synthétisés (MNS) en :
MNS = FNS x quantité totale d’acides gras (nmol/mg de tissu).
REMARQUE : Par exemple, si l’on obtient un enrichissement molaire en palmitate (EM) de 0,245, un enrichissement en deutérium dans l’eau corporelle (p) de 0,045 et un nombre N calculé de 22, la synthèse fractionnée du palmitate est de 0,247. Si la quantité de palmitate présente dans le tissu est de 2 mmol/mg, alors la mmol du palmitate nouvellement synthétisé est de 0,494 mmol/mg (voir Fichier supplémentaire).
Résultats
Sur la base de la dose de D 2 O décrite à l’étape 1, nous constatons généralement que l’eau corporelle est enrichie de l’ordre de2,5% à 6 % et qu’un niveau de base d’enrichissement en deutérium dans l’eau corporelle est rapidement atteint en 1 h et maintenu pendant toute la durée de l’étude via de l’eau potable enrichie à 8 % (Figure 1). L’enrichissement continu en eau corporelle à l’état d’équilibre est une hypothèse des calculs utilis...
Discussion
Comprendre l’équilibre et l’interaction entre des voies métaboliques complexes est une étape indispensable pour comprendre les bases biologiques des maladies métaboliques. Ici, nous montrons une méthodologie non invasive et peu coûteuse pour déterminer les changements dans la synthèse des acides gras de novo. Cette méthode est adaptée de méthodes publiées antérieurement qui ont mis au point des calculs pour estimer le flux de synthèse de novo à partir de l’enrichissement en deutéri...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions les membres du laboratoire Sanchez-Gurmaches et Wallace pour leurs précieuses discussions. Ce travail a été soutenu par des subventions de l’American Heart Association (18CDA34080527 à JSG et 19POST34380545 à RM), du NIH (R21OD031907 à JSG), d’un prix du CCHMC Trustee, d’un prix du Centre de génomique pédiatrique du CCHMC et d’un prix du Centre de génomique et de thérapeutique mendélienne du CCHMC. Ce travail a été soutenu en partie par le NIH P30 DK078392 du Centre central de recherche sur les maladies digestives à Cincinnati. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles des National Institutes of Health. RT et MW ont été soutenus par une bourse Ad Astra de l’UCD.
matériels
| Name | Company | Catalog Number | Comments |
| 4 mL Glass Vials | Fisher Scientific | 14-955-334 | |
| 0.2 µm filter | Olympus Plastic | 25-244 | |
| 26G needeled syringes | BD | 309597 | |
| Acetone | Merck | 34850 | |
| Acetonitrile | Merck | 900667 | |
| Blue GC screw cap with septa | Agilent | 5190-1599 | |
| Centrifuge | Eppendorf | 5424R | |
| Chloroform | Sigma | 366927 | |
| Deuterium oxide | Sigma | 151882 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Merck | B1378 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Agilent | CP7419 | |
| EDTA tube | Sarstedt | 411395105 | |
| Ethanol | Merck | 51976 | |
| Hexadecenoic-d31 Acid | Larodan | 71-1631 | |
| Hexane | Merck | 34859 | |
| Methanol | Merck | 34860 | |
| Microcentrifuge tube | Olympus Plastic | 24-282 | |
| Mouse environmental chamber | Caron | Caron 7001-33 | |
| Potasium Chloride | Fisher Bioreagents | BP366-500 | |
| Potasium Phosphate | MP Biomedicals | 194727 | |
| SafeLock microcentrifuge tubes | Eppendorf | 30120086 | |
| Screw top amber GC vial | Agilent | 5182-0716 | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Hydroxide | Merck | S5881 | |
| Sodium Phosphate, dibasic | Fisher Bioreagents | BP332-500 | |
| Sodium Sulfate | Merck | 239313 | |
| Sulfuric Acid | Merck | 258105 | |
| Vial insert | Agilent | 5183-2088 |
Références
- . The Lancet, Diabetes Endocrinology. Childhood obesity: a growing pandemic. The Lancet. Diabetes & Endocrinology. 10 (1), 1 (2022).
- Gonzalez-Muniesa, P., et al. Obesity. Nature Reviews Disease Primers. 3, 17034 (2017).
- Müller, T. D., Blüher, M., Tschöp, M. H., DiMarchi, R. D. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21 (3), 201-223 (2021).
- Virtue, S., Vidal-Puig, A. GTTs and ITTs in mice: simple tests, complex answers. Nature Metabolism. 3 (7), 883-886 (2021).
- Müller, T. D., Klingenspor, M., Tschöp, M. H. Revisiting energy expenditure: how to correct mouse metabolic rate for body mass. Nature Metabolism. 3 (9), 1134-1136 (2021).
- Virtue, S., Lelliott, C. J., Vidal-Puig, A. What is the most appropriate covariate in ANCOVA when analysing metabolic rate. Nature Metabolism. 3 (12), 1585 (2021).
- Hellerstein, M. K. De novo lipogenesis in humans: metabolic and regulatory aspects. European Journal of Clinical Nutrition. 53 Suppl 1, S53-S65 (1999).
- Zhao, S., et al. Dietary fructose feeds hepatic lipogenesis via microbiota-derived acetate. Nature. 579 (7800), 586-591 (2020).
- Wallace, M., et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nature Chemical Biology. 14 (11), 1021-1031 (2018).
- Zhao, S., et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch. Cell Reports. 17 (4), 1037-1052 (2016).
- Green, C. R., et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. Nature Chemical Biology. 12 (1), 15-21 (2016).
- Zhang, Z., et al. Serine catabolism generates liver NADPH and supports hepatic lipogenesis. Nature Metabolism. 3 (12), 1608-1620 (2021).
- Chirala, S. S., et al. Fatty acid synthesis is essential in embryonic development: fatty acid synthase null mutants and most of the heterozygotes die in utero. Proceedings of the National Academy of Sciences. 100 (11), 6358-6363 (2003).
- Icard, P., et al. ATP citrate lyase: A central metabolic enzyme in cancer. Cancer Letters. 471, 125-134 (2020).
- Fhu, C. W., Ali, A. Fatty acid synthase: an emerging target in cancer. Molecules. 25 (17), 3935 (2020).
- Lawitz, E. J., et al. Acetyl-CoA carboxylase inhibitor GS-0976 for 12 weeks reduces hepatic de novo lipogenesis and steatosis in patients with nonalcoholic steatohepatitis. Clinical Gastroenterology and Hepatology. 16 (12), 1983e3-1991e3 (2018).
- Smith, G. I., et al. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. The Journal of Clinical Investigation. 130 (3), 1453-1460 (2020).
- Imamura, F., et al. Fatty acids in the de novo lipogenesis pathway and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Medicine. 17 (6), e1003102 (2020).
- Lai, H. T. M., et al. Serial plasma phospholipid fatty acids in the de novo lipogenesis pathway and total mortality, cause-specific mortality, and cardiovascular diseases in the cardiovascular health study. Journal of the American Heart Association. 8 (22), e012881 (2019).
- Ference, B. A., et al. Mendelian randomization study of ACLY and cardiovascular disease. The New England Journal of Medicine. 380 (11), 1033-1042 (2019).
- Herman, M. A., et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature. 484 (7394), 333-338 (2012).
- Sanchez-Gurmaches, J., et al. Brown fat AKT2 Is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis. Cell Metabolism. 27 (1), 195e6-209e6 (2018).
- Wang, X., et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. II. Purification and characterization. The Journal of Biological Chemistry. 268 (19), 14497-14504 (1993).
- Briggs, M. R., Yokoyama, C., Wang, X., Brown, M. S., Goldstein, J. L. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence. The Journal of Biological Chemistry. 268 (19), 14490-14496 (1993).
- Yokoyama, C., et al. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell. 75 (1), 187-197 (1993).
- Chen, G., Liang, G., Ou, J., Goldstein, J. L., Brown, M. S. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver. Proceedings of the National Academy of Sciences. 101 (31), 11245-11250 (2004).
- Denechaud, P. D., et al. ChREBP, but not LXRs, is required for the induction of glucose-regulated genes in mouse liver. The Journal of Clinical Investigation. 118 (3), 956-964 (2008).
- Crewe, C., et al. SREBP-regulated adipocyte lipogenesis is dependent on substrate availability and redox modulation of mTORC1. JCI Insight. 5 (15), e129397 (2019).
- Batchuluun, B., Pinkosky, S. L., Steinberg, G. R. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nature Reviews Drug Discovery. 21 (4), 283-305 (2022).
- Wallace, M., Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Seminars in Cell & Developmental Biology. 108, 65-71 (2020).
- Lee, W. N., et al. In vivo measurement of fatty acids and cholesterol synthesis using D2O and mass isotopomer analysis. The American Journal of Physiology. 266 (5 Pt 1), E699-E708 (1994).
- Yao, C. H., Liu, G. Y., Yang, K., Gross, R. W., Patti, G. J. Inaccurate quantitation of palmitate in metabolomics and isotope tracer studies due to plastics. Metabolomics. 12, 143 (2016).
- Hiller, K., et al. MetaboliteDetector: comprehensive analysis tool for targeted and nontargeted GC/MS based metabolome analysis. Analytical Chemistry. 81 (9), 3429-3439 (2009).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. Journal of Mass Spectrometry. 31 (3), 255-262 (1996).
- Midani, F. S., Wynn, M. L., Schnell, S. The importance of accurately correcting for the natural abundance of stable isotopes. Analytical Biochemistry. 520, 27-43 (2017).
- Trefely, S., Ashwell, P., Snyder, N. W. FluxFix: automatic isotopologue normalization for metabolic tracer analysis. BMC Bioinformatics. 17 (1), 485 (2016).
- Jeong, H., et al. Correcting for naturally occurring mass isotopologue abundances in stable-isotope tracing experiments with PolyMID. Metabolites. 11 (5), 310 (2021).
- Millard, P., et al. IsoCor: isotope correction for high-resolution MS labeling experiments. Bioinformatics. 35 (21), 4484-4487 (2019).
- Brunengraber, D. Z., et al. Influence of diet on the modeling of adipose tissue triglycerides during growth. American Journal of Physiology. Endocrinology and Metabolsim. 285 (4), E917-E925 (2003).
- Svensson, R. U., et al. Inhibition of acetyl-CoA carboxylase suppresses fatty acid synthesis and tumor growth of non-small-cell lung cancer in preclinical models. Nature Medicine. 22 (10), 1108-1119 (2016).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: a technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263 (5 Pt 1), E988-E1001 (1992).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Kelleher, J. K., Masterson, T. M. Model equations for condensation biosynthesis using stable isotopes and radioisotopes. The American Journal of Physiology. 262 (1 Pt 1), E118-E125 (1992).
- Kelleher, J. K., Nickol, G. B. Isotopomer spectral analysis: utilizing nonlinear models in isotopic flux studies. Methods in Enzymology. 561, 303-330 (2015).
- Argus, J. P., et al. Development and application of FASA, a model for quantifying fatty acid metabolism using stable isotope labeling. Cell Reports. 25 (10), 2919.e8-2934.e8 (2018).
- Guilherme, A., et al. Control of adipocyte thermogenesis and lipogenesis through β3-adrenergic and thyroid hormone signal integration. Cell Reports. 31 (5), 107598 (2020).
- Guilherme, A., et al. Neuronal modulation of brown adipose activity through perturbation of white adipocyte lipogenesis. Molecular Metabolism. 16, 116-125 (2018).
- Guilherme, A., et al. Adipocyte lipid synthesis coupled to neuronal control of thermogenic programming. Molecular Metabolism. 6 (8), 781-796 (2017).
- Lodhi, I. J., et al. Inhibiting adipose tissue lipogenesis reprograms thermogenesis and PPARgamma activation to decrease diet-induced obesity. Cell Metabolism. 16 (2), 189-201 (2012).
- McCormack, J. G., Denton, R. M. Evidence that fatty acid synthesis in the interscapular brown adipose tissue of cold-adapted rats is increased in vivo by insulin by mechanisms involving parallel activation of pyruvate dehydrogenase and acetyl-coenzyme A carboxylase. The Biochemistry Journal. 166 (3), 627-630 (1977).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Letters. 104 (1), 13-16 (1979).
- Negron, S. G., Ercan-Sencicek, A. G., Freed, J., Walters, M., Lin, Z. Both proliferation and lipogenesis of brown adipocytes contribute to postnatal brown adipose tissue growth in mice. Science Reports. 10 (1), 20335 (2020).
- Schlein, C., et al. Endogenous fatty acid synthesis drives brown adipose tissue involution. Cell Reports. 34 (2), 108624 (2021).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. Journal of Lipid Research. 55 (11), 2276-2286 (2014).
- Adlanmerini, M., et al. Circadian lipid synthesis in brown fat maintains murine body temperature during chronic cold. Proceedings of the National Academy of Sciences. 116 (37), 18691-18699 (2019).
- Yu, X. X., Lewin, D. A., Forrest, W., Adams, S. H. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB Journal. 16 (2), 155-168 (2002).
- Kushner, D. J., Baker, A., Dunstall, T. G. Pharmacological uses and perspectives of heavy water and deuterated compounds. Canadian Journal of Physiology and Pharmacology. 77 (2), 79-88 (1999).
- Diraison, F., Pachiaudi, C., Beylot, M. Measuring lipogenesis and cholesterol synthesis in humans with deuterated water: use of simple gas chromatographic/mass spectrometric techniques. Journal of Mass Spectrometry. 32 (1), 81-86 (1997).
- Yang, D., et al. Assay of low deuterium enrichment of water by isotopic exchange with [U-13C3]acetone and gas chromatography-mass spectrometry. Analytical Biochemistry. 258 (2), 315-321 (1998).
- Fu, X., et al. Measurement of lipogenic flux by deuterium resolved mass spectrometry. Nature Communications. 12 (1), 3756 (2021).
- Shah, V., Herath, K., Previs, S. F., Hubbard, B. K., Roddy, T. P. Headspace analyses of acetone: a rapid method for measuring the 2H-labeling of water. Analytical Biochemistry. 404 (2), 235-237 (2010).
- Argus, J. P., Yu, A. K., Wang, E. S., Williams, K. J., Bensinger, S. J. An optimized method for measuring fatty acids and cholesterol in stable isotope-labeled cells. Journal of Lipid Research. 58 (2), 460-468 (2017).
- Belew, G. D., Jones, J. G. De novo lipogenesis in non-alcoholic fatty liver disease: Quantification with stable isotope tracers. European Journal of Clinical Investigation. 52 (3), e13733 (2022).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Belew, G. D., et al. Transfer of glucose hydrogens via acetyl-CoA, malonyl-CoA, and NADPH to fatty acids during de novo lipogenesis. Journal of Lipid Research. 60 (12), 2050-2056 (2019).
- Diraison, F., Pachiaudi, C., Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water: determination of the average number of deuterium atoms incorporated. Metabolism. 45 (7), 817-821 (1996).
- Ajie, H. O., et al. In vivo study of the biosynthesis of long-chain fatty acids using deuterated water. The American Journal of Physiology. 269 (2 Pt 1), E247-E252 (1995).
- Schloerb, P. R., Friis-Hansen, B. J., Edelman, I. S., Solomon, A. K., Moore, F. D. The measurement of total body water in the human subject by deuterium oxide dilution; with a consideration of the dynamics of deuterium distribution. The Journal of Clinical Investigation. 29 (10), 1296-1310 (1950).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon