A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קביעה כמותית של סינתזת חומצות שומן דה נובו ברקמת שומן חומה באמצעות תחמוצת דאוטריום
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים שיטה כמותית זולה המשתמשת תחמוצת דאוטריום וספקטרומטריית מסה כרומטוגרפית גז (GCMS) לניתוח של חומצת שומן כוללת דה נובו ליפוגנזה ברקמת שומן חום in vivo.
Abstract
סינתזת חומצות שומן היא מסלול מטבולי מורכב ועתיר אנרגיה עם תפקידים תפקודיים חשובים בשליטה על הומאוסטזיס מטבולי של כל הגוף ותהליכים פיזיולוגיים ופתולוגיים אחרים. בניגוד למסלולים מטבוליים מרכזיים אחרים, כגון סילוק גלוקוז, סינתזת חומצות שומן אינה מוערכת באופן פונקציונלי באופן שגרתי, מה שמוביל לפרשנויות חלקיות של המצב המטבולי. בנוסף, קיים מחסור בפרוטוקולים מפורטים הזמינים לציבור המתאימים למצטרפים חדשים בתחום. במאמר זה אנו מתארים שיטה כמותית זולה המשתמשת בתחמוצת דאוטריום ובספקטרומטריית מסה של כרומטוגרפיית גז (GCMS) לניתוח סינתזת חומצת השומן הכוללת דה נובו ברקמת שומן חומה in vivo. שיטה זו מודדת את הסינתזה של תוצרי חומצת השומן סינתאז ללא תלות במקור פחמן, והיא עשויה להיות שימושית כמעט לכל רקמה, בכל מודל עכברי, ותחת כל הפרעה חיצונית. פרטים על הכנת המדגם עבור GCMS וחישובים במורד הזרם מסופקים. אנו מתמקדים בניתוח של שומן חום בשל רמות גבוהות של סינתזת חומצות שומן דה נובו ותפקידים קריטיים בשמירה על הומאוסטזיס מטבולי.
Introduction
השמנת יתר ומחלות מטבוליות נלוות הן מגיפה המסכנת את הדורות הנוכחיים והעתידיים 1,2. בדרך כלל מפושט כתוצאה של חוסר איזון בין צריכת אנרגיה והוצאה, חוסר הוויסות המטבולי הקשור להשמנת יתר משפיע על מספר רב של מסלולים מטבוליים הנשלטים על ידי גורמים סביבתיים אנדוגניים3. עם זאת, רק מסלולים מעטים נבדקים באופן שגרתי במודלים של בעלי חיים של חוסר ויסות מטבולי.
לדוגמה, סילוק גלוקוז נמדד באופן שגרתי על ידי בדיקות גלוקוז וסבילות לאינסולין, כנראה בשל פשטות השימוש במוניטורים ניידיםלגלוקוז 4. שיעורים יחסיים של גלוקוז וחמצון שומנים בכל הגוף נאמדים גם הם באופן שגרתי בהתבסס על יחס חילופי הנשימה ממבחני קלוריות עקיפים 5,6. עם זאת, רוב ההיבטים האחרים של חילוף החומרים אינם מוערכים באופן שגרתי. זה מוביל לפרשנויות חלקיות של המצב המטבולי ואפשרויות טיפוליות שהוחמצו. אחד המסלולים העיקריים מסוג זה הוא דה נובו ליפוגנזיס.
De novo lipogenesis (DNL) הוא התהליך שבו חומצות שומן חדשות נוצרות ממבשרים. גלוקוז נחשב לקודמן העיקרי התורם ל- DNL7 של כל הגוף, אולם מבשרים אחרים, כגון אצטט, פרוקטוז, לקטט וחומצות אמינו מסועפות שרשרת, הוכחו כמקורות פחמן רלוונטיים באופן מרחבי ותלוי מצב 8,9,10,11,12. DNL הוא תורם מרכזי להומאוסטזיס מטבולי והוא חיוני להתפתחות תקינה13. בנוסף, שינויים ב- DNL נקשרו לסרטן 14,15 ומטבולית 16,17,18 ומחלות לב וכלי דם 19,20.
מסלול DNL מורכב מרכיבי הליבה האנזימטיים ATP ציטראט ליאז (ACLY), אצטיל-CoA קרבוקסילאז (ACC1/2) וחומצת שומן סינתאז (FAS) המייצרים בעיקר פלמיטט, חומצת שומן רוויה בת 16 פחמן. עם זאת, ניתן לייצר גם חומצות שומן מוזרות ומסועפות שרשרת בשיעורים נמוכים יותר9. Elongases ו desaturases לשנות עוד יותר חומצות שומן אלה, יצירת מגוון רחב של מיני חומצות שומן שימושי עבור מגוון רחב של פונקציות (למשל, אחסון אנרגיה לטווח ארוך מניפולציה של נזילות הממברנה).
הביטוי של המנגנון האנזימטי DNL נשלט על ידי מספר קצר של גורמי שעתוק. המתוארים ביותר עד כה כוללים את משפחת החלבון קושר אלמנט רגולטורי סטרול (SREBP), חלבון קושר אלמנט תגובת פחמימות (ChREBP), וקולטן X בכבד (LXR) 21,22,23,24,25,26. למרות חפיפה לכאורה בתפקודם, דווח על תקנות אינדיבידואליות המבוססות על דומיננטיות סוג התא ומצבים פיזיולוגיים או פתולוגיים 21,22,27,28.
למרבה הפלא, מספר מעכבים לשלבים נבחרים של מסלול DNL אושרו לשימוש קליני או נמצאים בשלבי פיתוח פרה-קליניים או קליניים עבור מספר מחלות, כולל השמנת יתר, מחלת כבד שומני לא אלכוהולי/סטאטוהפטיטיס לא אלכוהולית (NAFLD/NASH), ומחלות לב וכלי דם29. מאמצים אלה מדגישים את הרלוונטיות של DNL בבריאות ובמחלות.
בשנים האחרונות, השימוש בשיטות להערכה כמותית של סינתזת חומצות שומן דה נובו גדל30. השיטה הנפוצה ביותר להערכה זו היא שימוש במים מסומנים כבדים (D2O), כאשר המימן המסומן הכבד משולב בשרשראות אציל במהלך הסינתזה הן באופן ישיר והן בעקיפין, באמצעות חילופי דאוטריום עם המימן של מצעי DNL NAPDH, אצטיל-CoA ומלוניל-CoA. למרות שגישה זו צוברת פופולריות, חסרים פרוטוקולים מפורטים הזמינים לציבור המתאימים למצטרפים חדשים בתחום. כאן, אנו מתארים שיטה להערכה כמותית של סינתזת דה נובו של מוצרים של FAS באמצעות D2O וספקטרומטריית מסה של כרומטוגרפיית גז (GCMS), עם חישובים שפותחו בעבר על ידי Lee et al.31. שיטה זו מודדת סינתזת חומצות שומן דה נובו ללא תלות במקור פחמן, והיא עשויה להיות שימושית כמעט לכל רקמה, בכל מודל עכבר, ותחת כל הפרעה חיצונית. כאן, אנו מתמקדים בניתוח של רקמת שומן חום (BAT) בשל רמות גבוהות של DNL ותפקידים קריטיים בשמירה על הומאוסטזיס מטבולי.
Protocol
כל הניסויים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים במרכז הרפואי של בית החולים לילדים בסינסינטי.
1. הכנת D2O
הערה: כדי להימנע משינויים ניסיוניים, הכינו תמיסה/מי שתייה מספיקים לכל העכברים למשך הניסוי.
- להזרקה תוך צפקית: יש לייצר 0.9% עם מי מלח D 2 O על ידי המסת 9 גרם NaCl לליטר D 2 O. לסנן דרךמסנן לא פירוגני של0.2מיקרומטר כדי לעקר.
- לשתיית D 2 O-water: לייצר 8% v/v D2 מים מועשרים O שישמשו כמי שתייה על ידי ערבוב 80 מ"ל של D2O לכל920 מ"ל של מי שתייה רגילים. ניתן לקבל מי שתייה רגילים ממתקן העכבר. יש לסנן דרך מסנן לא פירוגני של 0.2 מיקרומטר לצורך עיקור.
2. אפנון פעילות BAT על ידי אקלום טמפרטורה
- הפרידו בין העכברים כך שיהיו שני עכברים בכל כלוב שבועיים לפני תחילת ההסתגלות לטמפרטורה. שנה את אספקת המים לבקבוקי מים כדי שהעכברים יסתגלו וישמרו על כל הכלובים ב -22 מעלות צלזיוס.
- הכן את תאי הסביבה של העכבר שבוע לפני תחילת אקלום הטמפרטורה על ידי הגדרת הטמפרטורות המתאימות: 30 ° C עבור thermoneutrality, 22 ° C עבור טמפרטורת החדר, ו 18 ° C עבור חשיפה לקור.
- בתחילת אקלום הטמפרטורה יש להחליף את הכלובים בכלובים חדשים ללא העשרה סביבתית (כדי למנוע קינים). העבירו את הכלובים לטמפרטורה המתאימה להם.
הערה: כלובים שהוקצו לניטרליות תרמית יישארו בטמפרטורה של 30 מעלות צלזיוס למשך 4 שבועות. כלובים שהוקצו לטמפרטורת החדר יישארו ב 22 °C (75 °F) במשך 4 שבועות. כלובים שהוקצו לחשיפה לקור יהפכו קרים יותר ויותר בלוח זמנים שבועי: 18 °C (75 °F) בשבוע הראשון, 14 °C (75 °F) בשבוע השני, 10 °C (75 °F) בשבוע השלישי ו 6 °C (66 °F) בשבוע הרביעי. - החליפו כלובים מלוכלכים מדי שבוע לכל התנאים. בנוסף, החליפו את בקבוקי המזון והמים בחדשים שהותאמו מראש בטמפרטורה המתאימה למשך 24 שעות לפחות.
הערה: שימו לב לכמויות המזון המתווספות מדי שבוע, במיוחד עבור עכברים בקור, שכן הם יצרכו כמות גדולה משמעותית של מזון בהשוואה לתנאים רגילים. לספק ליביטום.
3. ניהול D2O
- הזריקו לכל בעל חיים 0.9% w/v מלוחים-D2O במשקל גוף של 35 μL/g, 12 שעות-3 ימים לפני איסוף הרקמות, באמצעות הזרקה תוך צפקית באמצעות מזרק 1 מ"ל ומחט 26 גרם.
הערה: עיין בסעיף הדיון לקבלת מידע נוסף על בחירת זמן תיוג מתאים. - החליפו את בקבוקי המים לבקבוקים המכילים 8% מי שתייה מועשרים ב-O V/VD 2.
4. איסוף, עיבוד ואחסון פלזמה ורקמות
- בסוף הניסוי, הקריבו את העכברים באמצעות מתודולוגיות מאושרות (למשל, מנת יתר של פחמן דו חמצני ואחריה פריקת צוואר הרחם).
- השתמש רפידות חום/קירור או שיטות אחרות כדי למנוע שינויי טמפרטורה פתאומיים לפני המתת חסד שעלולים להשפיע על התוצאות. הרדימו את העכברים בהתאם למתודולוגיות מאושרות. המשך מיד לאיסוף דם ורקמות.
- לאסוף דם באמצעות ניקוב לב באמצעות מחט 26 G ולאחסן בצינור איסוף דם חומצה ethylenediaminetetraacetic. שמור את הדם על קרח עד עיבוד נוסף.
- פתח את העור לאורך הקו האמצעי של גב העכבר מהאזור התחתון של חלל בית החזה עד לאזור העליון של הצוואר, תוך משיכת העור למעלה כדי למנוע השפעה על רקמות מתחת לעור. ה- BAT interscapular ממוקם בין השכמות מתחת לשכבה דקה של רקמת שומן לבנה, והוא מורכב משתי אונות בצורת פירמידה.
- נקו את הרקמה על ידי שטיפה במי מלח חוצצים פוספט קר כקרח (PBS). טפחו על מגבת נייר כדי לסלק נוזלים עודפים, שקלו בקנה מידה אנליטי ואספו במיקרו-צינור.
- מיד הבזק להקפיא את הרקמה באמצעות חנקן נוזלי. ניתן לאסוף גם מחסני BAT אחרים.
- צנטריפוגה את דגימות הדם ב 10,000 x גרם במשך 10 דקות ב 4 ° C. לאחר צנטריפוגה, בזהירות לאסוף את הפלזמה מבלי להפריע גלולת תאי הדם האדומים. העבירו אותו למיקרו-צינור חדש וקר כקרח והקפיאו בחנקן נוזלי.
- יש לאחסן דגימות שומן חום ופלזמה בטמפרטורה של -80°C עד לשימוש.
5. מיצוי שומנים מרקמת השומן
- לפני תחילת החילוץ
- הכינו תמיסה של 1 מ"מ של חומצה הקסדצנואית31 במתנול בבקבוקון זכוכית. זה ישמש תקן חומצות שומן פנימי.
- קררו מראש את הכמות הנדרשת של כלורופורם (CHCl 3) ומתנול (CH3OH) במקפיא של -80°C, או על קרח יבש.
הערה: ניתן להוסיף את נוגד החמצון di-tert-butyl-4-methylphenol (BHT) ל-CHCl3 בריכוז של 0.01% w/v (2.5 מ"ג/25 מ"ל) כדי למנוע חמצון של הקשרים הכפולים בחומצות שומן בלתי רוויות. - תיוג מראש של צינורות מיקרוצנטריפוגות עבור כל דגימת רקמה וצינורית נוספת שתשמש לחילוץ ריק.
אזהרה: CH 3 OH ו-CHCl3הם נדיפים מאוד ורעילים בשאיפה. יש להשתמש רק במנדפים מנדפים.
הערה: למותגים שונים של צינורות מיקרוצנטריפוגות יש רמות שונות של פלמיטט רקע ויכולות שונות מבחינת מניעת דליפת ממס. אנו ממליצים לבדוק תחילה מגוון צינורות, כדי לוודא שנמנעת דליפת ממס ושיש בצינורות רמות מינימליות של פלמיטט מזהם. ראה Yao et al.32 לדיון נוסף.
- מוציאים את הדגימות מהמקפיא ומניחים על קרח יבש.
- הניחו את צינור המיקרו-צנטריפוגה המסומן מראש על איזון אנליטי וטשטשו את האיזון. מניחים פינצטה וסכין גילוח אזמל/פלדה על קרח יבש לקירור של 10-20 שניות.
- השתמשו בפינצטה כדי להוציא את דגימת הרקמה הקפואה מהצינור והניחו אותה על סירת שקילה מפלסטיק. ניתן להניח את סירת השקילה על גוש שטוח של קרח יבש או על משטח אחר מקורר מראש.
- באמצעות אזמל או סכין גילוח פלדה, לנתח חלק קטן של הרקמה, שווה ערך 5-15 מ"ג במשקל. מניחים בצינור המיקרוצנטריפוגה ורושמים את המשקל המדויק. חזור על הפעולה עבור כל דגימה. דגימות ניתן לאחסן במקפיא בשלב זה או ניתן להתקדם לשלבים הבאים עבור מיצוי שומנים.
הערה: יש לוודא שהאזמל מנוקה כראוי עם 70% אתנול בין הדגימות ונעשה שימוש בסירת שקילה טרייה בין כל דגימה.
- הוסף 1 μL/mg של 10 mM hexadecenoic-d 31 (C16: 0-d31) חומצה לכל דגימה.
זהירות: יש לבצע את השלבים הבאים (5.4 עד 5.8) תחת מכסה אדים בשל סיכון השאיפה של הממסים. - הוסף 250 μL של CH 3 OH, 250 μL של H2O ו- 500 μL של CHCl3לכל דגימה עם שלושה חרוזי נירוסטה 5 מ"מ. הניחו את הצינורות בבלוק מקורר מראש של טחנת טחינה וערבבו את הדגימות בתדר רטט של 25 הרץ למשך 5 דקות, או השתמשו בהנחיות המומלצות על ידי היצרן לדגימות רקמות. מוציאים את החרוזים בעזרת מגנט.
- צנטריפוגה הדגימות ב 12,000 x גרם במשך 10 דקות ב 4 ° C.
הערה: לאחר הצנטריפוגה יש לראות הפרדה דו-פאזית ברורה כאשר השלב המימי העליון מכיל מטבוליטים קוטביים והשלב האורגני התחתון מכיל שומנים וחומצות שומן. אם לא נראית הפרדה, הוסף 250 μL של H2O וחזור על שלבי המערבולת והצנטריפוגה. - באמצעות מיקרופיפטה, לקחת נפח קבוע מהשלב התחתון של כל דגימה לתוך צינורות microcentrifuge מסומן בהתאם.
- הוסף 500 μL של CHCl3 למדגם הנותר וחזור על שלבים 5.6-5.7.
- הניחו את הדגימות תחת גז חנקן או בוואקום צנטריפוגלי מקוררCHCl עמיד 3 בטמפרטורה של 4°C עד לייבוש מלא. דגימות מיובשות ניתן לאחסן ב -20 ° C עד מוכן derivatization.
הערה: ניתן גם לאסוף את השכבה העליונה של כל דגימה בשלב זה ולייבש אותה כמו בשלב 5.9 על מנת לנתח מטבוליטים קוטביים.
6. הכנת אסטרי מתיל חומצות שומן (FAMEs) וניתוח GCMS
- אסטריפיקציה וטרנסאסטריפיקציה המזורזת על ידי חומצה להכנת FAMEs
זהירות: יש לבצע את השלבים הבאים מתחת למכסה אדים בשל סכנת השאיפה של הממסים.- אם הדגימות אוחסנו במקפיא, יבשו תחת חנקן במשך 5 דקות כדי לוודא שאין מים.
- באמצעות ממיסים כיתה MS, פיפטה 98 מ"ל של נטול מים CH3OH לתוך בקבוק מדיה זכוכית. הוסיפו באיטיות 2 מ"ל של חומצה גופרתית נטולת מים למכסה האדים כדי ליצור 2% H2SO4 ב- CH3OH. מערבבים על ידי ערבול הבקבוק הסגור.
- הוסף 500 μL של 2% H2SO4 בתמיסת CH3OH לכל דגימה ומערבולת לזמן קצר.
- לדגור את הדגימות על בלוק חום ב 50 ° C במשך 2 שעות.
- הסר את הדגימות מבלוק החום והוסף 100 μL של תמיסת NaCl רוויה ו- 500 μL של הקסאן לכל דגימה.
- מערבבים את הדגימות במרץ בטמפרטורת החדר למשך דקה. השאירו את הדגימות לשבת במשך דקה; שני שלבים צריכים להיות ברורים לאחר מכן.
- אספו את השלב העליון לתוך צינור מיקרוצנטריפוגה טרי (ראו הערה בסעיף 5.1.3 לבחירה מתאימה של צינור המיקרוצנטריפוגה).
- כדי למקסם את התפוקה, חזור על שלבים 6.1.5-6.1.7, איסוף הדגימה השנייה לאותן שפופרות מסומנות.
- יבשו את הדגימות בטמפרטורת החדר תחת גז חנקן.
- יש להשהות מחדש את הדגימות ב-20 μL/mg של הקסאן, ביחס למשקל הרקמה המקורי, ולהעביר מיד לבקבוקון זכוכית GC עם תוספת זכוכית.
הערה: עבוד במהירות בעת העברת דגימות כדי למזער אידוי.
- ניתוח GCMS
- כדי לקבוע את שפע האיזוטופולוגים של FAME, הזריקו את הדגימות על ספקטרומטר מסה כרומטוגרפי גז מרובע יחיד (GCMS).
הערה: בעוד שניתן להשתמש בסוגי עמודות רבים כדי לזהות פלמיטט, תוכנית הטמפרטורה הבאה נקבעה עבור עמודת GCMS שפותחה להפרדת חומצות שומן cis/isomers trans, כמפורט בטבלת החומרים. עמוד זה הוא באורך של 50 מ 'עם קוטר פנימי של 0.25 מ"מ. - יש להזריק 1 μL של דגימה בכניסה מפוצלת/מפוצלת בטמפרטורת כניסה של 270°C, תוך שימוש בהליום כגז המוביל, הזורם ב-1 מ"ל/דקה. יש להשתמש בהזרקה ללא פיצול עבור חומצות שומן נמוכות בשפע עם זרימה כוללת של 19 מ"ל/דקה, טיהור מחיצה של 3 מ"ל/דקה, וזרימת טיהור לנביעה מפוצלת של 15 מ"ל/דקה ב-0.75 דקות. השתמש ביחס פיצול של 10:1-40:1 עבור חומצות שומן בשפע גבוה כגון palmitate ו oleate.
- השתמש בפרמטרים הבאים של התנור: טמפרטורה התחלתית של 80 מעלות צלזיוס; להגדיל ב 20 ° C / דקות מרווחים ל 170 ° C; להגדיל ב 1 ° C / דקות מרווחים ל 204 ° C; להגדיל ב 20 ° C / דקות מרווחים ל 250 ° C; ולאחר מכן להחזיק ב 250 ° C במשך 10 דקות.
- השתמש בפרמטרים הבאים של גלאי מסה סלקטיבי (MSD): מצב יינון פגיעת אלקטרונים של 70 eV וסרוק בטווח של 50-400 m/z במהירות סריקה של 1,562 (u/s) ותדירות של 4.1 סריקות לשנייה. השתמש בקו העברה ב 280 ° C, מקור יונים ב 230 ° C, ו quadrupole ב 150 ° C.
הערה: ניתן להשתמש בעמודות אחרות, אך תוכנית הטמפרטורה תשתנה. - רצף דגימות: סדר הדגימה של ההזרקה באופן אקראי והזריקו לפחות שניים או שלושה ריקים של הקסאן בתחילת הרצף, אחרי כל דגימה חמישית בתוך הרצף, ושתיים או שלוש בסוף הרצף.
- השתמש בתוכנה ספציפית למכשיר, או בתוכנה חופשית בגישה פתוחה כגון Metabolite-Detector33, כדי לשלב את היונים בטבלה 1 עבור כל חומצת שומן מתיל אסטר.
הערה: תיארנו יונים המכסים איזוטופולוגים M1-M5 בטבלה 1 שמצאנו שמכסים את כמות שילוב הדאוטריום בחלון תיוג זה. עם זאת, ייתכן שיהיה צורך להרחיב זאת אם שטף דה נובו גבוה משמעותית ו / או זמן תיוג ארוך יותר משמש. - השתמש בשפע של כל יון משולב כדי ליצור התפלגות איזוטופומר מסה, שבה ניתן להמיר את עוצמות היונים לשפע חלקי כך שסכום התפלגות איזוטופומר המסה שווה לאחד. עיין בגיליון האלקטרוני לדוגמה בקובץ המשלים.
הערה: על מנת לקבוע במדויק את שילוב הדאוטריום, יש להשתמש בתיקון של שפע האיזוטופים הטבעיים כדי לאפשר נוכחות של איזוטופים טבעיים כגון 13C, 15N ו- 2H. זה מבוצע על ידי יישום מטריצת תיקון כפי שתואר על ידי פרננדז ואחרים.34,35, ולא ניתן לבצע על ידי חיסור MID של מטבוליט נמדד ללא תווית ממטבוליט מסומן. בפועל, אנו ממליצים להשתמש בתוכנות זמינות באופן חופשי כגון fluxfix 36, polyMID37 או IsoCor38 כדי להפוך נתונים גולמיים ל-MID חלקי, וסיפקנו את הנוסחה לתיקון איזוטופים עבור תוצרי מתיל אסטר של FAS בטבלה 1. - כדי לקבוע את כמות הפלמיטט הקיימת, השתמש בנוסחה הבאה:
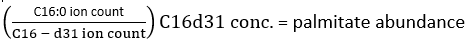
כאשר ספירת היונים מתייחסת לסכום כל איזוטולוגי הפלמיטטים המשולבים בטבלה 1 ו-C16:0-d 31 מתייחסת לתקן הפנימי הקסדצנואי-d31. התקן הפנימי מהווה שיא נפרד מזה של הפלמיטט האנדוגני. ניתן לקבוע גם את השפע היחסי של חומצות שומן אחרות, אך ייתכן שיהיה צורך להשתמש בתקנים פנימיים של איזוטופים ספציפיים לחומצות שומן (עם שינויי מסה גדולים יותר מאלה שנצפו משילוב D2O) או בעקומות תקן חיצוניות לצורך כימות מלא. השתמש בדגימה הריקה שחולצה כדי לקבוע את כמות palmitate הרקע וחסר אותה מערך הרקמה הסופי. - חשב את ההעשרה המולרית (ME) של פלמיטט לפי המשוואה הבאה:
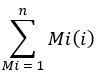
כאשר Mi הוא השפע החלקי המנורמל של איזוטופולוג פלמיטט, ו- n הוא מספר איזוטופולוגים פלמיטטים אפשריים. לדוגמה, ME של מולקולת פלמיטט עם התפלגות השברים הבאה, M1 = 0.25, M2 = 0.08, M3 = 0.02, הוא: (0.025*1) + (0.08*2) + (0.02*3) = 0.245 (ראה קובץ משלים).
- כדי לקבוע את שפע האיזוטופולוגים של FAME, הזריקו את הדגימות על ספקטרומטר מסה כרומטוגרפי גז מרובע יחיד (GCMS).
7. החלפת דאוטריום אצטון של דגימות פלזמה לקביעת העשרת מי הגוף
- התגובה
- הכינו 10 תקנים של דאוטריום במים, הנעים בין 0-9% v/v.
- הכינו תמיסת 5% v/v אצטון/אצטוניטריל המאפשרת 4 μL לדגימה, כולל התקנים משלב 5.1.1.
- בצינורות מיקרוצנטריפוגות מסומנים עם נעילה בטוחה, יש לשלב 10 μL של כל דגימת פלזמה או תקן, 4 μL של 10 M NaOH ו-4 μL של 5% אצטון/אצטוניטריל. בצע זאת בשלשה עבור כל דגימה.
- מערבבים את הדגימות בעדינות על ידי פיפט. תנו לדגימות לדגור בטמפרטורת החדר למשך הלילה.
- חילוץ
- לאחר הדגירה, להוסיף 450-550 מ"ג של Na2SO4 לכל דגימה.
- במכסה האדים מוסיפים 600 μL שלCHCl 3 לכל צינור ומערבלים במרץ במשך 15 שניות.
- צנטריפוגה את הדגימות ב 300 x גרם במשך 2 דקות.
- מתחת למכסה המנוע, מעבירים משולש, 80 μL aliquots של supernatant מכל דגימה לתוך בקבוקוני GCMS זכוכית מסומנים עם תוספות זכוכית ומכסה בחוזקה.
- ניתוח GCMS
- יש להפריד דגימות על עמודה (30 מטר, 0.25 מ"מ i.d, Agilent DB-35MS) ולנתח על ספקטרומטר המסות המצורף.
- יש להזריק 1 μL של דגימה בכניסה מפוצלת/מפוצלת, עם יחס פיצול של 40:1, זרימת הליום של 1 מ"ל/דקה וטמפרטורת כניסה של 270°C.
- השתמשו בפרמטרים הבאים של התנור: טמפרטורה התחלתית של 60°C, הגדילו במרווחים של 20°C/min ל-100°C, הגדילו במרווחים של 50°C/min ל-220°C ולאחר מכן החזיקו ב-220°C למשך דקה אחת.
- השתמש בפרמטרים הבאים של גלאי מסה סלקטיבי (MSD): מצב יינון פגיעת אלקטרונים ב- 70 eV עם ניטור יונים נבחרים של 58 ו- 59 m/z. השתמש בקו העברה ב 280 ° C, מקור יונים ב 230 ° C, ו quadrupole ב 150 ° C.
הערה: ניתן להשתמש בעמודות אחרות בעלות דממות נמוכות, מלוכדות, מקושרות וקוטביות בינונית, אך תוכנית הטמפרטורה תשתנה.
- הגדר את שיטת הדוגם הנוזלי כך שתתחיל בשטיפתCHCl 3 ולאחר מכן רצף אקראי של הדגימות, כולל שלבי שטיפה נוספים של CHCl3 כל שש דגימות.
הערה: אם אצטון משמש לשטיפת מחטים עבור הדוגם האוטומטי, החלף ב-CHCl 3 או הקסאן והזריק דגימות CHCl3 ריקות מרובות עד ששיא אצטון מזהם כלשהו אינו ניכר עוד בכרומטוגרמה. - בשיטה זו, שיא אצטון מגיע למהירות של כ-1.25 דקות. לשלב את הנתונים ולחשב את שפע השברים של העשרת אצטון לפי שלבים 6.2.6-6.2.7, עם התאמה לניתוח פסגות המכילות יחס m/z של 58-60 כמצוין בטבלה 1.
- השתמש בתקנים כדי ליצור עקומה סטנדרטית כדי לקבוע את אחוז העשרת המים בגוף (p) של דגימות הבדיקה, בהתבסס על העשרה חלקית של אצטון.
- יש להפריד דגימות על עמודה (30 מטר, 0.25 מ"מ i.d, Agilent DB-35MS) ולנתח על ספקטרומטר המסות המצורף.
8. חישובי In vivo de novo lipogenesis
- חשב את החלק של חומצות שומן מסונתזות חדשות (FNS) שהן תוצרים ישירים של FAS (כלומר, פלמיטט, חומצות שומן אי-זוגיות שרשרת ו-mmBCFAs) בכל דגימה באמצעות המשוואה הבאה:
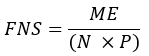
כאשר ME הוא ההעשרה המולרית הממוצעת של מולקולת פלמיטט (שלב 6.2.9), p הוא העשרת הדאוטריום במים מדגימת הפלזמה המתאימה (שלב 7.3.4), ו-N הוא מספר אטומי המימן הניתנים להחלפה על פלמיטט שבהם ניתן לשלב דאוטריום. - קבע N באמצעות המשוואה שמתחתיה נקבעה על ידי Lee et al.31:
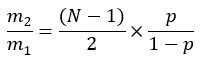
- קבע את הכמות המולרית של חומצות שומן מסונתזות חדשות (MNS) על ידי:
MNS = FNS x כמות חומצת השומן הכוללת (רקמת nmol/mg).
הערה: לדוגמה, אם משיגים העשרה מולרית פלמיטטית (ME) של 0.245, העשרת דאוטריום במי גוף (p) של 0.045, ומספר N מחושב של 22, הסינתזה החלקית של פלמיטט היא 0.247. אם כמות הפלמיטט הקיימת ברקמה היא 2 mmol / mg, אז mmol של palmitate מסונתז חדש הוא 0.494 mmol / mg (ראה קובץ משלים).
תוצאות
בהתבסס על מינון D 2 O המתואר בשלב 1, אנו מוצאים בדרך כלל שמי הגוף מועשרים בטווח של2.5% עד 6%, וכי רמה בסיסית של העשרת דאוטריום במי הגוף מושגת במהירות תוך שעה אחת ונשמרת למשך המחקר באמצעות מי שתייה מועשרים של 8% (איור 1). העשרת מי גוף במצב יציב רציף היא הנחה של החישובים המשמ...
Discussion
הבנת האיזון והאינטראקציה בין מסלולים מטבוליים מורכבים היא צעד הכרחי לקראת הבנת הבסיס הביולוגי של מחלות הקשורות לחילוף חומרים. כאן, אנו מראים מתודולוגיה לא פולשנית וזולה כדי לקבוע שינויים בסינתזת חומצות שומן דה נובו. שיטה זו מבוססת על שיטות שפורסמו בעבר אשר פיתחו חישובים להערכת שטף ס...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לחברי המעבדה של סאנצ'ז-גורמצ'י וואלאס על דיונים חשובים. עבודה זו נתמכה על ידי מענקים מאיגוד הלב האמריקאי (18CDA34080527 ל- JSG ו- 19POST34380545 ל- RM), NIH (R21OD031907 ל- JSG), פרס נאמן CCHMC, פרס מרכז CCHMC לגנומיקה של ילדים, ופרס מרכז CCHMC לגנומיקה מנדליאנית וטיפול. עבודה זו נתמכה בחלקה על ידי NIH P30 DK078392 של מרכז הליבה לחקר מחלות עיכול בסינסינטי. התוכן הוא באחריותם הבלעדית של המחברים ואינו מייצג בהכרח את הדעות הרשמיות של המכונים הלאומיים לבריאות. RT ו- MW נתמכו על ידי מלגת UCD Ad Astra.
Materials
| Name | Company | Catalog Number | Comments |
| 4 mL Glass Vials | Fisher Scientific | 14-955-334 | |
| 0.2 µm filter | Olympus Plastic | 25-244 | |
| 26G needeled syringes | BD | 309597 | |
| Acetone | Merck | 34850 | |
| Acetonitrile | Merck | 900667 | |
| Blue GC screw cap with septa | Agilent | 5190-1599 | |
| Centrifuge | Eppendorf | 5424R | |
| Chloroform | Sigma | 366927 | |
| Deuterium oxide | Sigma | 151882 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Merck | B1378 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Agilent | CP7419 | |
| EDTA tube | Sarstedt | 411395105 | |
| Ethanol | Merck | 51976 | |
| Hexadecenoic-d31 Acid | Larodan | 71-1631 | |
| Hexane | Merck | 34859 | |
| Methanol | Merck | 34860 | |
| Microcentrifuge tube | Olympus Plastic | 24-282 | |
| Mouse environmental chamber | Caron | Caron 7001-33 | |
| Potasium Chloride | Fisher Bioreagents | BP366-500 | |
| Potasium Phosphate | MP Biomedicals | 194727 | |
| SafeLock microcentrifuge tubes | Eppendorf | 30120086 | |
| Screw top amber GC vial | Agilent | 5182-0716 | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Hydroxide | Merck | S5881 | |
| Sodium Phosphate, dibasic | Fisher Bioreagents | BP332-500 | |
| Sodium Sulfate | Merck | 239313 | |
| Sulfuric Acid | Merck | 258105 | |
| Vial insert | Agilent | 5183-2088 |
References
- . The Lancet, Diabetes Endocrinology. Childhood obesity: a growing pandemic. The Lancet. Diabetes & Endocrinology. 10 (1), 1 (2022).
- Gonzalez-Muniesa, P., et al. Obesity. Nature Reviews Disease Primers. 3, 17034 (2017).
- Müller, T. D., Blüher, M., Tschöp, M. H., DiMarchi, R. D. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21 (3), 201-223 (2021).
- Virtue, S., Vidal-Puig, A. GTTs and ITTs in mice: simple tests, complex answers. Nature Metabolism. 3 (7), 883-886 (2021).
- Müller, T. D., Klingenspor, M., Tschöp, M. H. Revisiting energy expenditure: how to correct mouse metabolic rate for body mass. Nature Metabolism. 3 (9), 1134-1136 (2021).
- Virtue, S., Lelliott, C. J., Vidal-Puig, A. What is the most appropriate covariate in ANCOVA when analysing metabolic rate. Nature Metabolism. 3 (12), 1585 (2021).
- Hellerstein, M. K. De novo lipogenesis in humans: metabolic and regulatory aspects. European Journal of Clinical Nutrition. 53 Suppl 1, S53-S65 (1999).
- Zhao, S., et al. Dietary fructose feeds hepatic lipogenesis via microbiota-derived acetate. Nature. 579 (7800), 586-591 (2020).
- Wallace, M., et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nature Chemical Biology. 14 (11), 1021-1031 (2018).
- Zhao, S., et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch. Cell Reports. 17 (4), 1037-1052 (2016).
- Green, C. R., et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. Nature Chemical Biology. 12 (1), 15-21 (2016).
- Zhang, Z., et al. Serine catabolism generates liver NADPH and supports hepatic lipogenesis. Nature Metabolism. 3 (12), 1608-1620 (2021).
- Chirala, S. S., et al. Fatty acid synthesis is essential in embryonic development: fatty acid synthase null mutants and most of the heterozygotes die in utero. Proceedings of the National Academy of Sciences. 100 (11), 6358-6363 (2003).
- Icard, P., et al. ATP citrate lyase: A central metabolic enzyme in cancer. Cancer Letters. 471, 125-134 (2020).
- Fhu, C. W., Ali, A. Fatty acid synthase: an emerging target in cancer. Molecules. 25 (17), 3935 (2020).
- Lawitz, E. J., et al. Acetyl-CoA carboxylase inhibitor GS-0976 for 12 weeks reduces hepatic de novo lipogenesis and steatosis in patients with nonalcoholic steatohepatitis. Clinical Gastroenterology and Hepatology. 16 (12), 1983e3-1991e3 (2018).
- Smith, G. I., et al. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. The Journal of Clinical Investigation. 130 (3), 1453-1460 (2020).
- Imamura, F., et al. Fatty acids in the de novo lipogenesis pathway and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Medicine. 17 (6), e1003102 (2020).
- Lai, H. T. M., et al. Serial plasma phospholipid fatty acids in the de novo lipogenesis pathway and total mortality, cause-specific mortality, and cardiovascular diseases in the cardiovascular health study. Journal of the American Heart Association. 8 (22), e012881 (2019).
- Ference, B. A., et al. Mendelian randomization study of ACLY and cardiovascular disease. The New England Journal of Medicine. 380 (11), 1033-1042 (2019).
- Herman, M. A., et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature. 484 (7394), 333-338 (2012).
- Sanchez-Gurmaches, J., et al. Brown fat AKT2 Is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis. Cell Metabolism. 27 (1), 195e6-209e6 (2018).
- Wang, X., et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. II. Purification and characterization. The Journal of Biological Chemistry. 268 (19), 14497-14504 (1993).
- Briggs, M. R., Yokoyama, C., Wang, X., Brown, M. S., Goldstein, J. L. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence. The Journal of Biological Chemistry. 268 (19), 14490-14496 (1993).
- Yokoyama, C., et al. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell. 75 (1), 187-197 (1993).
- Chen, G., Liang, G., Ou, J., Goldstein, J. L., Brown, M. S. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver. Proceedings of the National Academy of Sciences. 101 (31), 11245-11250 (2004).
- Denechaud, P. D., et al. ChREBP, but not LXRs, is required for the induction of glucose-regulated genes in mouse liver. The Journal of Clinical Investigation. 118 (3), 956-964 (2008).
- Crewe, C., et al. SREBP-regulated adipocyte lipogenesis is dependent on substrate availability and redox modulation of mTORC1. JCI Insight. 5 (15), e129397 (2019).
- Batchuluun, B., Pinkosky, S. L., Steinberg, G. R. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nature Reviews Drug Discovery. 21 (4), 283-305 (2022).
- Wallace, M., Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Seminars in Cell & Developmental Biology. 108, 65-71 (2020).
- Lee, W. N., et al. In vivo measurement of fatty acids and cholesterol synthesis using D2O and mass isotopomer analysis. The American Journal of Physiology. 266 (5 Pt 1), E699-E708 (1994).
- Yao, C. H., Liu, G. Y., Yang, K., Gross, R. W., Patti, G. J. Inaccurate quantitation of palmitate in metabolomics and isotope tracer studies due to plastics. Metabolomics. 12, 143 (2016).
- Hiller, K., et al. MetaboliteDetector: comprehensive analysis tool for targeted and nontargeted GC/MS based metabolome analysis. Analytical Chemistry. 81 (9), 3429-3439 (2009).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. Journal of Mass Spectrometry. 31 (3), 255-262 (1996).
- Midani, F. S., Wynn, M. L., Schnell, S. The importance of accurately correcting for the natural abundance of stable isotopes. Analytical Biochemistry. 520, 27-43 (2017).
- Trefely, S., Ashwell, P., Snyder, N. W. FluxFix: automatic isotopologue normalization for metabolic tracer analysis. BMC Bioinformatics. 17 (1), 485 (2016).
- Jeong, H., et al. Correcting for naturally occurring mass isotopologue abundances in stable-isotope tracing experiments with PolyMID. Metabolites. 11 (5), 310 (2021).
- Millard, P., et al. IsoCor: isotope correction for high-resolution MS labeling experiments. Bioinformatics. 35 (21), 4484-4487 (2019).
- Brunengraber, D. Z., et al. Influence of diet on the modeling of adipose tissue triglycerides during growth. American Journal of Physiology. Endocrinology and Metabolsim. 285 (4), E917-E925 (2003).
- Svensson, R. U., et al. Inhibition of acetyl-CoA carboxylase suppresses fatty acid synthesis and tumor growth of non-small-cell lung cancer in preclinical models. Nature Medicine. 22 (10), 1108-1119 (2016).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: a technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263 (5 Pt 1), E988-E1001 (1992).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Kelleher, J. K., Masterson, T. M. Model equations for condensation biosynthesis using stable isotopes and radioisotopes. The American Journal of Physiology. 262 (1 Pt 1), E118-E125 (1992).
- Kelleher, J. K., Nickol, G. B. Isotopomer spectral analysis: utilizing nonlinear models in isotopic flux studies. Methods in Enzymology. 561, 303-330 (2015).
- Argus, J. P., et al. Development and application of FASA, a model for quantifying fatty acid metabolism using stable isotope labeling. Cell Reports. 25 (10), 2919.e8-2934.e8 (2018).
- Guilherme, A., et al. Control of adipocyte thermogenesis and lipogenesis through β3-adrenergic and thyroid hormone signal integration. Cell Reports. 31 (5), 107598 (2020).
- Guilherme, A., et al. Neuronal modulation of brown adipose activity through perturbation of white adipocyte lipogenesis. Molecular Metabolism. 16, 116-125 (2018).
- Guilherme, A., et al. Adipocyte lipid synthesis coupled to neuronal control of thermogenic programming. Molecular Metabolism. 6 (8), 781-796 (2017).
- Lodhi, I. J., et al. Inhibiting adipose tissue lipogenesis reprograms thermogenesis and PPARgamma activation to decrease diet-induced obesity. Cell Metabolism. 16 (2), 189-201 (2012).
- McCormack, J. G., Denton, R. M. Evidence that fatty acid synthesis in the interscapular brown adipose tissue of cold-adapted rats is increased in vivo by insulin by mechanisms involving parallel activation of pyruvate dehydrogenase and acetyl-coenzyme A carboxylase. The Biochemistry Journal. 166 (3), 627-630 (1977).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Letters. 104 (1), 13-16 (1979).
- Negron, S. G., Ercan-Sencicek, A. G., Freed, J., Walters, M., Lin, Z. Both proliferation and lipogenesis of brown adipocytes contribute to postnatal brown adipose tissue growth in mice. Science Reports. 10 (1), 20335 (2020).
- Schlein, C., et al. Endogenous fatty acid synthesis drives brown adipose tissue involution. Cell Reports. 34 (2), 108624 (2021).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. Journal of Lipid Research. 55 (11), 2276-2286 (2014).
- Adlanmerini, M., et al. Circadian lipid synthesis in brown fat maintains murine body temperature during chronic cold. Proceedings of the National Academy of Sciences. 116 (37), 18691-18699 (2019).
- Yu, X. X., Lewin, D. A., Forrest, W., Adams, S. H. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB Journal. 16 (2), 155-168 (2002).
- Kushner, D. J., Baker, A., Dunstall, T. G. Pharmacological uses and perspectives of heavy water and deuterated compounds. Canadian Journal of Physiology and Pharmacology. 77 (2), 79-88 (1999).
- Diraison, F., Pachiaudi, C., Beylot, M. Measuring lipogenesis and cholesterol synthesis in humans with deuterated water: use of simple gas chromatographic/mass spectrometric techniques. Journal of Mass Spectrometry. 32 (1), 81-86 (1997).
- Yang, D., et al. Assay of low deuterium enrichment of water by isotopic exchange with [U-13C3]acetone and gas chromatography-mass spectrometry. Analytical Biochemistry. 258 (2), 315-321 (1998).
- Fu, X., et al. Measurement of lipogenic flux by deuterium resolved mass spectrometry. Nature Communications. 12 (1), 3756 (2021).
- Shah, V., Herath, K., Previs, S. F., Hubbard, B. K., Roddy, T. P. Headspace analyses of acetone: a rapid method for measuring the 2H-labeling of water. Analytical Biochemistry. 404 (2), 235-237 (2010).
- Argus, J. P., Yu, A. K., Wang, E. S., Williams, K. J., Bensinger, S. J. An optimized method for measuring fatty acids and cholesterol in stable isotope-labeled cells. Journal of Lipid Research. 58 (2), 460-468 (2017).
- Belew, G. D., Jones, J. G. De novo lipogenesis in non-alcoholic fatty liver disease: Quantification with stable isotope tracers. European Journal of Clinical Investigation. 52 (3), e13733 (2022).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Belew, G. D., et al. Transfer of glucose hydrogens via acetyl-CoA, malonyl-CoA, and NADPH to fatty acids during de novo lipogenesis. Journal of Lipid Research. 60 (12), 2050-2056 (2019).
- Diraison, F., Pachiaudi, C., Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water: determination of the average number of deuterium atoms incorporated. Metabolism. 45 (7), 817-821 (1996).
- Ajie, H. O., et al. In vivo study of the biosynthesis of long-chain fatty acids using deuterated water. The American Journal of Physiology. 269 (2 Pt 1), E247-E252 (1995).
- Schloerb, P. R., Friis-Hansen, B. J., Edelman, I. S., Solomon, A. K., Moore, F. D. The measurement of total body water in the human subject by deuterium oxide dilution; with a consideration of the dynamics of deuterium distribution. The Journal of Clinical Investigation. 29 (10), 1296-1310 (1950).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved