Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kahverengi Yağ Dokusunda De Novo Yağ Asidi Sentezinin Döteryum Oksit Kullanılarak Kantitatif Tayini
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, in vivo kahverengi yağ dokusunda toplam yağ asidi de novo lipogenezinin analizi için döteryum oksit ve gaz kromatografisi kütle spektrometrisi (GCMS) kullanan ucuz bir kantitatif yöntem sunuyoruz.
Özet
Yağ asidi sentezi, tüm vücut metabolik homeostazının ve diğer fizyolojik ve patolojik süreçlerin kontrolünde önemli fonksiyonel rollere sahip karmaşık ve yüksek enerji gerektiren bir metabolik yoldur. Glikoz imhası gibi diğer önemli metabolik yolların aksine, yağ asidi sentezi rutin olarak işlevsel olarak değerlendirilmez ve bu da metabolik durumun eksik yorumlanmasına yol açar. Buna ek olarak, bu alanda yeni gelenler için uygun, kamuya açık ayrıntılı protokollerin eksikliği vardır. Burada, in vivo kahverengi yağ dokusunda toplam yağ asidi de novo sentezinin analizi için döteryum oksit ve gaz kromatografisi kütle spektrometrisi (GCMS) kullanan ucuz bir kantitatif yöntemi açıklıyoruz. Bu yöntem, bir karbon kaynağından bağımsız olarak yağ asidi sentaz ürünlerinin sentezini ölçer ve herhangi bir fare modelinde ve herhangi bir dış bozulma altında hemen hemen her doku için potansiyel olarak yararlıdır. GCMS için numune hazırlama ve sonraki hesaplamalar ile ilgili ayrıntılar verilmiştir. Yüksek seviyelerde de novo yağ asidi sentezi ve metabolik homeostazın korunmasındaki kritik rolleri nedeniyle kahverengi yağın analizine odaklanıyoruz.
Giriş
Obezite ve buna bağlı metabolik hastalıklar, şimdiki ve gelecek nesilleri tehlikeye atan bir salgındır 1,2. Enerji alımı ve harcaması arasındaki dengesizliğin bir sonucu olarak yaygın olarak basitleştirilen obezite ile ilişkili metabolik düzensizlik, çevresel ve endojen faktörler tarafından kontrol edilen çok sayıda metabolik yolu etkiler3. Bununla birlikte, metabolik düzensizliğin hayvan modellerinde sadece birkaç yol rutin olarak test edilir.
Örnek olarak, glikoz imhası, muhtemelen taşınabilir glikoz monitörlerinin kullanımının basitliği nedeniyle, rutin olarak glikoz ve insülin tolerans testleri ile ölçülür4. Tüm vücut glukoz ve lipid oksidasyon nispi oranları da dolaylı kalorimetri testlerinden 5,6 elde edilen solunum değişim oranına dayalı olarak rutin olarak tahmin edilmektedir. Bununla birlikte, metabolizmanın diğer tüm yönlerinin çoğunluğu rutin olarak işlevsel olarak değerlendirilmez. Bu, metabolik durumun eksik yorumlanmasına ve terapötik seçeneklerin kaçırılmasına yol açar. Bu tür ana yollardan biri de novo lipogenezdir.
De novo lipogenez (DNL), öncüllerden yeni yağ asitlerinin üretildiği süreçtir. Glikoz, tüm vücut DNL7'ye katkıda bulunan ana öncü olarak kabul edilir, ancak asetat, fruktoz, laktat ve dallı zincirli amino asitler gibi diğer öncülerin, mekansal ve duruma bağlı bir şekilde ilgili karbon kaynakları olduğu gösterilmiştir 8,9,10,11,12. DNL, metabolik homeostaza önemli bir katkıda bulunur ve normal gelişim için gereklidir13. Ek olarak, DNL'deki değişiklikler kanser 14,15 ve metabolik 16,17,18 ve kardiyovasküler hastalıklar 19,20 ile ilişkilendirilmiştir.
DNL yolu, esas olarak 16 karbonlu doymuş bir yağ asidi olan palmitat üreten çekirdek enzimatik bileşenler ATP sitrat liyaz (ACLY), asetil-CoA karboksilaz (ACC1/2) ve yağ asidi sentazdan (FAS) oluşur. Bununla birlikte, tek zincirli ve dallı zincirli yağ asitleri de daha düşük oranlarda üretilebilir9. Uzamalar ve desatürazlar, bu yağ asitlerini daha da değiştirerek, çeşitli işlevler için yararlı olan çok çeşitli yağ asitleri türleri yaratır (örneğin, uzun süreli enerji depolama ve membran akışkanlığının manipülasyonu).
DNL enzimatik mekanizmasının ekspresyonu, kısa sayıda transkripsiyon faktörü tarafından kontrol edilir. Bugüne kadar en iyi tanımlananlar arasında sterol düzenleyici element bağlayıcı protein (SREBP) ailesi, karbonhidrat yanıt elemanı bağlayıcı protein (ChREBP) ve karaciğer X reseptörü (LXR)21,22,23,24,25,26 bulunur. İşlevlerinde belirgin bir örtüşmeye rağmen, hücre tipi baskınlığına ve fizyolojik veya patolojik koşullara dayalı bireysel düzenlemeler bildirilmiştir21,22,27,28.
Dikkat çekici bir şekilde, DNL yolunun seçilen adımları için bir dizi inhibitör klinik kullanım için onaylanmıştır veya obezite, alkolsüz yağlı karaciğer hastalığı / alkolsüz steatohepatit (NAFLD / NASH) ve kardiyovasküler hastalık dahil olmak üzere bir dizi hastalık için klinik öncesi veya klinik gelişim aşamalarındadır29. Bu çabalar, DNL'nin sağlık ve hastalıkla olan ilişkisini vurgulamaktadır.
Son yıllarda, de novo yağ asidi sentezini kantitatif olarak değerlendirmek için yöntemlerin kullanımı artmıştır30. Bunu değerlendirmek için en yaygın yöntem, ağır etiketli hidrojenin sentez sırasında hem doğrudan hem de dolaylı olarak, DNL substratları NAPDH, asetil-CoA ve malonil-CoA'nın hidrojenleri ile döteryum değişimi yoluyla asil zincirlerine dahil edildiği ağır etiketli suyun (D2O) kullanılmasıdır. Bu yaklaşım popülerlik kazanmasına rağmen, bu alanda yeni gelenler için uygun, kamuya açık ayrıntılı protokollerin eksikliği vardır. Burada, daha önce Lee ve ark.31 tarafından geliştirilen hesaplamalarla, D2Ove gaz kromatografisi kütle spektrometrisi (GCMS) kullanarak FAS ürünlerinin de novo sentezini nicel olarak değerlendirmek için bir yöntemin ana hatlarını çiziyoruz. Bu yöntem, bir karbon kaynağından bağımsız olarak de novo yağ asidi sentezini ölçer ve herhangi bir fare modelinde ve herhangi bir dış bozulma altında hemen hemen her doku için potansiyel olarak yararlıdır. Burada, yüksek DNL seviyeleri ve metabolik homeostazın korunmasındaki kritik rolleri nedeniyle kahverengi yağ dokusunun (BAT) analizine odaklanıyoruz.
Protokol
Tüm deneyler, Cincinnati Çocuk Hastanesi Tıp Merkezi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı.
1. D2O'nun Hazırlanması
NOT: Deneysel varyasyonu önlemek için, deney süresince tüm fareler için yeterli çözelti/içme suyu hazırlayın.
- İntraperitoneal enjeksiyon için: D2O litresi başına 9 g NaCl çözerek% 0.9 w / v salin D 2 O üretin Sterilize etmek için pirojenik olmayan0.2μm filtreden süzün.
- D 2 O-su içmek için: 920 mL normal içme suyuna 80 mL D2O karıştırarak içme suyu olarak kullanılmak üzere %8 v / v D2O ile zenginleştirilmiş su üretir. Fare tesisinden düzenli içme suyu elde edilebilir. Sterilize etmek için pirojenik olmayan 0,2 μm filtreden süzün.
2. BAT aktivitesinin sıcaklık iklimlendirmesi ile modülasyonu
- Fareleri, sıcaklık alıştırmasının başlamasından 2 hafta önce kafes başına iki fare olacak şekilde ayırın. Farelerin uyum sağlaması ve tüm kafesleri 22 °C'de tutması için su beslemesini su şişeleriyle değiştirin.
- Uygun sıcaklıkları ayarlayarak sıcaklığa alışmaya başlamadan 1 hafta önce fare çevre odalarını hazırlayın: termonötralite için 30 °C, oda sıcaklığı için 22 °C ve soğuğa maruz kalma için 18 °C.
- Sıcaklık iklimlendirmesinin başlangıcında, kafesleri çevresel zenginleştirme olmadan yenileriyle değiştirin (yuvaları önlemek için). Kafesleri ilgili sıcaklıklara getirin.
NOT: Termonötraliteye atanan kafesler 4 hafta boyunca 30 °C'de kalacaktır. Oda sıcaklığına atanan kafesler 4 hafta boyunca 22 °C'de kalacaktır. Soğuğa maruz kalmaya atanan kafesler haftalık bir programda giderek daha soğuk hale gelecektir: ilk hafta 18 °C, ikinci hafta 14 °C, üçüncü hafta 10 °C ve dördüncü hafta 6 °C. - Tüm koşullar için kirli kafesleri haftalık olarak değiştirin. Ek olarak, yiyecek ve su şişelerini en az 24 saat boyunca uygun sıcaklıkta önceden uyarlanmış yenileriyle değiştirin.
NOT: Normal koşullara kıyasla önemli ölçüde daha fazla miktarda yiyecek tüketeceklerinden, özellikle soğuktaki fareler için her hafta eklenen yiyecek miktarlarına dikkat edin. Yiyecek ad libitum sağlayın.
3. D2O'nun Yönetimi
- Her hayvana, 1 mL şırınga ve 26 G iğne kullanarak intraperitoneal enjeksiyon yoluyla, doku toplamadan 12 saat-3 gün önce, 35 μL / g vücut ağırlığında% 0.9 w / v salin-D2O enjekte edin.
NOT: Uygun bir etiketleme süresinin seçilmesi hakkında daha fazla bilgi için lütfen tartışma bölümüne bakın. - Su şişelerini %8 v/v D2O ile zenginleştirilmiş içme suyu içeren şişelerle değiştirin.
4. Plazma ve doku toplama, işleme ve depolama
- Deneyin sonunda, onaylanmış metodolojileri kullanarak fareleri feda edin (örneğin, aşırı dozda karbondioksit ve ardından servikal çıkık).
- Ötenaziden önce sonuçları etkileyebilecek ani sıcaklık değişikliklerini önlemek için ısıtma/soğutma pedleri veya başka yöntemler kullanın. Onaylanmış metodolojileri izleyerek farelere ötenazi yapın. Hemen kan ve doku alımına geçin.
- 26 G'lik bir iğne kullanarak kardiyak ponksiyon yoluyla kan toplayın ve bir etilendiamintetraasetik asit kan alma tüpünde saklayın. Daha fazla işlenene kadar kanı buz üzerinde tutun.
- Derinin altındaki dokuları etkilememek için cildi yukarı çekerken, farenin sırtının orta çizgisi boyunca cildi göğüs boşluğunun alt bölgesinden boynun üst bölgesine kadar kesin. İnterskapular BAT, ince bir beyaz yağ dokusu tabakası altında omuz bıçakları arasında bulunur ve iki piramidal şekilli lobdan oluşur.
- Buz gibi soğuk fosfat tamponlu salin (PBS) içinde yıkayarak dokuyu temizleyin. Fazla sıvıyı gidermek için bir kağıt havluya sürün, analitik bir ölçekte tartın ve bir mikrotüpte toplayın.
- Sıvı nitrojen kullanarak dokuyu hemen dondurun. Diğer BAT depoları da toplanabilir.
- Kan örneklerini 10.000 x g'da 4 °C'de 10 dakika santrifüjleyin. Santrifüjlemeden sonra, kırmızı kan hücresi peletini bozmadan plazmayı dikkatlice toplayın. Yeni bir buz gibi soğuk mikrotüpe aktarın ve sıvı nitrojen içinde hızlı dondurun.
- Kahverengi yağ ve plazma örneklerini kullanana kadar -80 °C'de saklayın.
5. Yağ dokusundan lipit ekstraksiyonu
- Ekstraksiyona başlamadan önce
- Bir cam şişede metanol içinde 1 mM'lik bir hekzadekenoik-d31 asit çözeltisi hazırlayın. Bu, iç yağ asidi standardı olarak hizmet edecektir.
- Gerekli miktarda kloroform (CHCl3) ve metanolü (CH3OH) -80 °C'lik bir dondurucuda veya kuru buzda önceden soğutun.
NOT: Antioksidan di-tert-butil-4-metilfenol (BHT), doymamış yağ asitlerinde çift bağların oksidasyonunu önlemek için %0.01 w/v (2.5 mg/25 mL)konsantrasyonda CHCl3'e eklenebilir. - Her doku örneği için önceden etiketlenmiş mikrosantrifüj tüpleri ve boş ekstraksiyon için kullanılacak ekstra bir tüp.
DİKKAT:CH3OHveCHCl3 solunduğunda oldukça uçucu ve toksiktir. Sadece çeker ocaklarda kullanın.
NOT: Farklı marka mikrosantrifüj tüpleri, solvent sızıntısını önleme açısından farklı seviyelerde arka plan palmitat ve yeteneklere sahiptir. Solvent sızıntısının önlendiğinden ve tüplerin minimum düzeyde kirletici palmitat içerdiğinden emin olmak için önce çeşitli tüplerin test edilmesini öneririz. Daha fazla tartışma için lütfen Yao ve ark.32'ye bakın.
- Numuneleri dondurucudan çıkarın ve kuru buz üzerine koyun.
- Önceden etiketlenmiş mikrosantrifüj tüpünü bir analitik teraziye yerleştirin ve terazinin darasını alın. Cımbız ve neşter/çelik tıraş bıçağını soğuması için 10-20 saniye kuru buz üzerine yerleştirin.
- Dondurulmuş doku örneğini tüpten çıkarmak için cımbız kullanın ve plastik bir tartım teknesine yerleştirin. Kantar, düz bir kuru buz bloğuna veya önceden soğutulmuş başka bir yüzeye yerleştirilebilir.
- Neşter veya çelik tıraş bıçağı kullanarak, dokunun 5-15 mg ağırlığa eşdeğer küçük bir kısmını inceleyin. Mikrosantrifüj tüpüne yerleştirin ve tam ağırlığı kaydedin. Her örnek için tekrarlayın. Numuneler bu noktada dondurucuda saklanabilir veya lipid ekstraksiyonu için aşağıdaki adımlara ilerletilebilir.
NOT: Numuneler arasında neşterin %70 etanol ile uygun şekilde temizlendiğinden ve her numune arasında yeni bir tartım teknesi kullanıldığından emin olun.
- Her numuneye 1 μL/mg 10 mM heksadekenoik-d 31(C16:0-d31) asit ekleyin.
DİKKAT: Çözücülerin solunması riski nedeniyle aşağıdaki adımlar (5.4 ila 5.8) çeker ocak altında gerçekleştirilmelidir. - Üç adet 5 mm paslanmaz çelik boncuk ile her numuneye 250 μLCH3OH, 250 μLH2Ove 500 μLCHCl3 ekleyin. Tüpleri bir öğütme değirmeninin önceden soğutulmuş bir bloğuna yerleştirin ve numuneleri 5 dakika boyunca 25 Hz'lik bir titreşim frekansında karıştırın veya doku numuneleri için üretici tarafından önerilen yönergeleri kullanın. Bir mıknatıs kullanarak boncukları çıkarın.
- Numuneleri 12.000 x g'da 4 °C'de 10 dakika santrifüjleyin.
NOT: Santrifüjlemeden sonra, polar metabolitleri içeren üst sulu faz ve lipitleri ve yağ asitleri içeren alt organik faz ile net bir bifazik ayrım gözlenmelidir. Herhangi bir ayrılma görülmezse, 250 μLH2Oekleyin ve vorteks ve santrifüjleme adımlarını tekrarlayın. - Bir mikropipet kullanarak, her numunenin alt fazından uygun şekilde etiketlenmiş mikrosantrifüj tüplerine sabit bir hacim alın.
- Kalan örneğe 500 μL CHCl3 ekleyin ve 5.6-5.7 adımlarını tekrarlayın.
- Numuneleri nitrojen gazı altına veya tamamen kuruyana kadar 4 °C'de CHCl3'e dayanıklı soğutmalı santrifüj vakuma yerleştirin. Kurutulmuş numuneler, türevlendirmeye hazır olana kadar -20 °C'de saklanabilir.
NOT: Polar metabolitleri analiz etmek için her numunenin üst tabakası da bu noktada toplanabilir ve adım 5.9'daki gibi kurutulabilir.
6. Yağ asidi metil esterlerinin (FAME'ler) hazırlanması ve GCMS analizi
- FAME'leri hazırlamak için asit katalizli esterleştirme ve transesterifikasyon
DİKKAT: Solventlerin solunma riski nedeniyle aşağıdaki adımlar çeker ocak altında gerçekleştirilmelidir.- Numuneler dondurucuda saklanmışsa, su bulunmadığından emin olmak için nitrojen altında 5 dakika kurutun.
- MS sınıfı çözücüler kullanarak, 98 mL susuzCH3OH'yi bir cam ortam şişesine pipetleyin. CH3 OH'de%2 H 2S04yapmak için çeker ocakta yavaşça 2 mL susuz sülfürik asit ekleyin. Kapalı şişeyi döndürerek karıştırın.
- Her numuneye 500 μL %2H2S04CH3OHçözeltisi ekleyin ve kısaca vorteksleyin.
- Numuneleri bir ısı bloğunda 50 °C'de 2 saat inkübe edin.
- Numuneleri ısı bloğundan çıkarın ve her numuneye 100 μL doymuş NaCl çözeltisi ve 500 μL heksan ekleyin.
- Numuneleri oda sıcaklığında 1 dakika kuvvetlice vorteksleyin. Numuneleri 1 dakika bekletin; Bundan sonra iki aşama belirgin olmalıdır.
- Üst fazı yeni bir mikrosantrifüj tüpünde toplayın (mikrosantrifüj tüpünün uygun seçimi için bölüm 5.1.3'teki nota bakın).
- Verimi en üst düzeye çıkarmak için, ikinci numuneyi aynı etiketli tüplere toplayarak 6.1.5-6.1.7 adımlarını tekrarlayın.
- Numuneleri oda sıcaklığında nitrojen gazı altında kurutun.
- Numuneleri orijinal doku ağırlığına göre 20 μL/mg hekzan içinde yeniden süspanse edin ve hemen bir cam insert ile cam GC şişesine aktarın.
NOT: Buharlaşmayı en aza indirmek için numuneleri aktarırken hızlı çalışın.
- GCMS analizi
- FAME izotopologlarının bolluğunu belirlemek için, numuneleri tek bir dört kutuplu gaz kromatografisi kütle spektrometresine (GCMS) enjekte edin.
NOT: Palmitatı tespit etmek için birçok kolon tipi kullanılabilirken, Malzeme Tablosunda ayrıntılı olarak açıklandığı gibi, yağ asidi cis/trans izomerlerinin ayrılması için geliştirilmiş bir GCMS kolonu için aşağıdaki sıcaklık programı oluşturulmuştur. Bu kolon 50 m uzunluğa ve 0,25 mm iç çapa sahiptir. - Taşıyıcı gaz olarak helyum kullanarak, 1 mL/dk'da akan 270 °C'lik bir giriş sıcaklığında bölünmüş/ayrılmamış bir girişe 1 μL numune enjekte edin. Toplam akışı 19 mL/dk, septum tahliyesi 3 mL/dk ve 0,75 dk'da 15 mL/dk'lık ayrık havalandırmaya temizleme akışı ile düşük bol miktarda yağ asitleri için bölünmemiş bir enjeksiyon kullanın. Palmitat ve oleat gibi yüksek miktarda yağ asitleri için 10: 1-40: 1'lik bir bölme oranı kullanın.
- Aşağıdaki fırın parametrelerini kullanın: 80 °C'lik bir başlangıç sıcaklığı; 20 °C/dk'lık artışlarla 170 °C'ye çıkarmak; 1 °C/dk'lık artışlarla 204 °C'ye çıkarmak; 20 °C/dk'lık artışlarla 250 °C'ye çıkarmak; ve ardından 250 °C'de 10 dakika tutun.
- Aşağıdaki kütle seçici dedektör (MSD) parametrelerini kullanın: 70 eV'lik bir elektron darbeli iyonizasyon modu ve 1.562 (u/s) tarama hızı ve 4,1 tarama/s frekansı ile 50-400 m/z aralığında tarama. 280 °C'de bir transfer hattı, 230 °C'de bir iyon kaynağı ve 150 °C'de bir dört kutuplu kullanın.
NOT: Diğer sütunlar kullanılabilir, ancak sıcaklık programı değişiklik gösterecektir. - Numune dizisi: Enjeksiyon numune sırasını rastgele hale getirin ve dizinin başında, dizi içindeki her beşinci numuneden sonra ve dizinin sonunda iki veya üç heksan boşluğu enjekte edin.
- Her bir yağ asidi metil esteri için Tablo 1'deki iyonları entegre etmek için cihaza özel yazılım veya Metabolit-Dedektör33 gibi ücretsiz açık erişimli yazılım kullanın.
NOT: Tablo 1'de M1-M5 izotopologlarını kapsayan iyonları özetledik ve bu etiketleme penceresi ile döteryum dahil etme miktarını kapsadığını bulduk. Bununla birlikte, de novo akı önemli ölçüde daha yüksekse ve/veya daha uzun bir etiketleme süresi kullanılıyorsa, bunun genişletilmesi gerekebilir. - İyon yoğunluklarının kesirli bolluğa dönüştürülebildiği bir kütle izotopomer dağılımı oluşturmak için her entegre iyonun bolluğunu kullanın, böylece kütle izotopomer dağılımının toplamı bire eşittir. Lütfen Ek Dosya'daki örnek elektronik tabloya bakın.
NOT: Döteryum katılımını doğru bir şekilde belirlemek için, 13C, 15N ve 2H gibi doğal olarak oluşan izotopların varlığına izin vermek için doğal izotop bolluğunun düzeltilmesi kullanılmalıdır. Bu, Fernandez ve ark.34,35 tarafından belirtildiği gibi bir düzeltme matrisi uygulanarak gerçekleştirilir ve etiketli bir metabolitten etiketlenmemiş ölçülen bir metabolitin MID'sinin çıkarılmasıyla gerçekleştirilemez. Uygulamada, ham verileri fraksiyonel MID'lere dönüştürmek için fluxfix36, polyMID 37 veya IsoCor38 gibi ücretsiz olarak temin edilebilen yazılımların kullanılmasını öneriyoruz ve Tablo 1'de FAS'ın metil ester ürünleri için izotop düzeltmesi formülünü sağladık. - Mevcut palmitat miktarını belirlemek için aşağıdaki formülü kullanın:
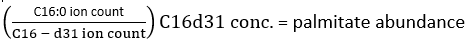
iyon sayısı, Tablo 1 ve C16: 0-d 31'e entegre edilmiş tüm palmitat izotopologlarının toplamını ifade ederken, dahili standart hekzadekenoik-d31'i ifade eder. İç standart, endojen palmitatınkinden ayrı bir tepe oluşturur. Diğer yağ asitlerinin nispi bolluğu da belirlenebilir, ancak tam kantitasyon için yağ asidine özgü izotop iç standartlarının (D2Odahil edilmesinden gözlemlenenden daha büyük kütle kaymaları ile) veya harici standart eğrilerin kullanılması gerekebilir. Arka plan palmitat miktarını belirlemek için boş ekstrakte edilmiş numuneyi kullanın ve bunu nihai doku değerinden çıkarın. - Palmitatın molar zenginleşmesini (ME) aşağıdaki denklemle hesaplayın:
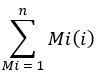
buradaM, bir palmitat izotopologunun normalleştirilmiş, kesirli bolluğudur ve n, olası palmitat izotopologlarının sayısıdır. Örneğin, aşağıdaki fraksiyonel dağılıma sahip bir palmitat molekülünün ME'si, M1 = 0.25, M2 = 0.08, M3 = 0.02, şöyledir: (0.025 * 1) + (0.08 * 2) + (0.02 * 3) = 0.245 ( Ek Dosyaya Bakınız).
- FAME izotopologlarının bolluğunu belirlemek için, numuneleri tek bir dört kutuplu gaz kromatografisi kütle spektrometresine (GCMS) enjekte edin.
7. Vücut suyu zenginleştirmesini belirlemek için plazma örneklerinin döteryum aseton değişimi
- Tepkime
- Suda% 0-9 v / v arasında değişen 10 döteryum standardı hazırlayın.
- Adım 5.1.1'deki standartlar da dahil olmak üzere, numune başına 4 μL'ye izin veren %5 v/v aseton/asetonitril çözeltisi hazırlayın.
- Etiketli, güvenli kilitli mikrosantrifüj tüplerinde, her plazma örneğinden veya standarttan 10 μL, 4 μL 10 M NaOH ve 4 μL %5 aseton/asetonitril'i birleştirin. Bunu her örnek için üç kopya halinde gerçekleştirin.
- Numuneleri pipetleme ile nazikçe karıştırın. Numunelerin gece boyunca oda sıcaklığında inkübe edilmesine izin verin.
- Çıkarma
- İnkübasyondan sonra, her numuneye 450-550 mgNa2S04ekleyin.
- Çeker ocakta, her tüpe 600 μL CHCl3 ekleyin ve 15 saniye boyunca kuvvetlice girdap yapın.
- Numuneleri 300 x g'da 2 dakika santrifüjleyin.
- Bir çeker ocak altında, her numuneden süpernatantın üç kopyalı, 80 μL'lik alikotlarını cam ekleri ve kapağı olan etiketli, cam GCMS şişelerine aktarın.
- GCMS analizi
- Numuneleri bir kolon üzerinde (30 m, 0,25 mm i.d, Agilent DB-35MS) ayırın ve ekli kütle spektrometresinde analiz edin.
- 40:1 bölme oranı, 1 mL/dak helyum akışı ve 270 °C giriş sıcaklığı ile bölünmüş/bölmesiz bir girişe 1 μL numune enjekte edin.
- Aşağıdaki fırın parametrelerini kullanın: 60 °C'lik bir başlangıç sıcaklığı, 20 °C/dk'lık artışlarla 100 °C'ye, 50 °C/dk'lık artışlarla 220 °C'ye yükseltin ve ardından 220 °C'de 1 dakika tutun.
- Aşağıdaki kütle seçici dedektör (MSD) parametrelerini kullanın: 58 ve 59 m/z seçili iyon izleme ile 70 eV'de elektron darbeli iyonizasyon modu. 280 °C'de bir transfer hattı, 230 °C'de bir iyon kaynağı ve 150 °C'de bir dört kutuplu kullanın.
NOT: Diğer düşük boşaltmalı, yapıştırılmış, çapraz bağlı, orta polariteli sütunlar kullanılabilir, ancak sıcaklık programı değişecektir.
- Sıvı örnekleyici yöntemini, birCHCl 3 yıkaması ve ardından her altı örnekte bir ek CHCl3 yıkama adımları da dahil olmak üzere rastgele bir numune dizisi ile başlayacak şekilde ayarlayın.
NOT: Otomatik numune alma cihazı için iğne yıkama olarak aseton kullanılıyorsa, CHCl 3 veya hekzan ile değiştirin ve kromatogramda herhangi bir kirletici aseton zirvesi artık belirgin olmayana kadar birden fazla boşCHCl 3 numunesi enjekte edin. - Bu yöntemi kullanarak, bir aseton zirvesi yaklaşık 1.25 dakikada yükselir. Tablo 1'de gösterildiği gibi 58-60'lık bir m/z oranı içeren tepe noktalarını analiz etmek için bir ayarlama ile 6.2.6-6.2.7 adımlarını izleyerek verileri entegre edin ve aseton zenginleştirmesinin kesirli bolluğunu hesaplayın.
- Asetonun fraksiyonel zenginleşmesine dayalı olarak, test numunelerinin vücut suyu zenginleştirme (p) yüzdesini belirlemek için standart bir eğri oluşturmak için standartları kullanın.
- Numuneleri bir kolon üzerinde (30 m, 0,25 mm i.d, Agilent DB-35MS) ayırın ve ekli kütle spektrometresinde analiz edin.
8. İn vivo de novo lipogenez hesaplamaları
- Her numunede FAS'ın doğrudan ürünleri olan yeni sentezlenmiş yağ asitlerinin (FNS) fraksiyonunu (yani, palmitat, tek zincirli yağ asitleri ve mmBCFA'lar) aşağıdaki denklemle hesaplayın:
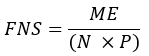
burada ME, bir palmitat molekülünün ortalama molar zenginleşmesidir (adım 6.2.9), p, karşılık gelen plazma örneğinden sudaki döteryum zenginleştirmesidir (adım 7.3.4) ve N, bir döteryumun dahil edilebileceği palmitat üzerindeki değiştirilebilir hidrojen atomlarının sayısıdır. - Lee ve ark.31 tarafından kurulan aşağıdaki denklemi kullanarak N'yi belirleyin:
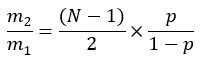
- Yeni sentezlenen yağ asitlerinin (MNS) molar miktarını şu şekilde belirleyin:
MNS = FNS x toplam yağ asidi miktarı (nmol/mg doku).
NOT: Örneğin, 0.245'lik bir palmitat molar zenginleştirme (ME), 0.045'lik bir vücut suyunda (p) bir döteryum zenginleştirmesi ve hesaplanan bir N sayısı 22 elde edilirse, palmitatın fraksiyonel sentezi 0.247'dir. Dokuda bulunan palmitat miktarı 2 mmol / mg ise, yeni sentezlenen palmitatın mmol 0.494 mmol / mg'dır (Ek Dosyaya bakınız).
Sonuçlar
Adım 1'de açıklananD2Odozuna dayanarak, tipik olarak vücut suyunun %2,5 ila %6 aralığında zenginleştirildiğini ve vücut suyunda temel bir döteryum zenginleştirme seviyesinin 1 saat içinde hızla elde edildiğini ve çalışma süresince %8 zenginleştirilmiş içme suyu ile korunduğunu bulduk (Şekil 1). Sürekli kararlı durum vücut suyu zenginleştirme, 6. adımda kullanılan hesaplamaların bir varsayımıdır ve bu nedenle yeni deneysel modellerde vücu...
Tartışmalar
Karmaşık metabolik yolaklar arasındaki dengeyi ve etkileşimi anlamak, metabolik ilişkili hastalıkların biyolojik temelini anlamak için vazgeçilmez bir adımdır. Burada, de novo yağ asidi sentezindeki değişiklikleri belirlemek için invaziv olmayan ve ucuz bir metodoloji gösteriyoruz. Bu yöntem, yağ asidi döteryum zenginleştirmesinden31 de novo sentez akısını tahmin etmek ve vücut suyundakiD2O'nunnispi yüzdesini belirlemek için döteryum-aseton d...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yoktur.
Teşekkürler
Değerli tartışmalar için Sanchez-Gurmaches ve Wallace laboratuvar üyelerine teşekkür ederiz. Bu çalışma, Amerikan Kalp Derneği (18CDA34080527'den JSG'ye ve 19POST34380545'ten RM'ye), NIH (JSG'ye R21OD031907), CCHMC Mütevelli Ödülü, CCHMC Pediatrik Genomik Merkezi Ödülü ve CCHMC Mendel Genomik ve Terapötik Merkezi Ödülü'nden alınan hibelerle desteklenmiştir. Bu çalışma kısmen Cincinnati'deki Sindirim Hastalıkları Araştırma Çekirdek Merkezi'nin NIH P30 DK078392 tarafından desteklenmiştir. İçerik yalnızca yazarların sorumluluğundadır ve Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmeyebilir. RT ve MW, UCD Ad Astra Bursu tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4 mL Glass Vials | Fisher Scientific | 14-955-334 | |
| 0.2 µm filter | Olympus Plastic | 25-244 | |
| 26G needeled syringes | BD | 309597 | |
| Acetone | Merck | 34850 | |
| Acetonitrile | Merck | 900667 | |
| Blue GC screw cap with septa | Agilent | 5190-1599 | |
| Centrifuge | Eppendorf | 5424R | |
| Chloroform | Sigma | 366927 | |
| Deuterium oxide | Sigma | 151882 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Merck | B1378 | |
| Di-tert-butyl-4-methylphenol (BHT) Select FAME Column | Agilent | CP7419 | |
| EDTA tube | Sarstedt | 411395105 | |
| Ethanol | Merck | 51976 | |
| Hexadecenoic-d31 Acid | Larodan | 71-1631 | |
| Hexane | Merck | 34859 | |
| Methanol | Merck | 34860 | |
| Microcentrifuge tube | Olympus Plastic | 24-282 | |
| Mouse environmental chamber | Caron | Caron 7001-33 | |
| Potasium Chloride | Fisher Bioreagents | BP366-500 | |
| Potasium Phosphate | MP Biomedicals | 194727 | |
| SafeLock microcentrifuge tubes | Eppendorf | 30120086 | |
| Screw top amber GC vial | Agilent | 5182-0716 | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Hydroxide | Merck | S5881 | |
| Sodium Phosphate, dibasic | Fisher Bioreagents | BP332-500 | |
| Sodium Sulfate | Merck | 239313 | |
| Sulfuric Acid | Merck | 258105 | |
| Vial insert | Agilent | 5183-2088 |
Referanslar
- . The Lancet, Diabetes Endocrinology. Childhood obesity: a growing pandemic. The Lancet. Diabetes & Endocrinology. 10 (1), 1 (2022).
- Gonzalez-Muniesa, P., et al. Obesity. Nature Reviews Disease Primers. 3, 17034 (2017).
- Müller, T. D., Blüher, M., Tschöp, M. H., DiMarchi, R. D. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21 (3), 201-223 (2021).
- Virtue, S., Vidal-Puig, A. GTTs and ITTs in mice: simple tests, complex answers. Nature Metabolism. 3 (7), 883-886 (2021).
- Müller, T. D., Klingenspor, M., Tschöp, M. H. Revisiting energy expenditure: how to correct mouse metabolic rate for body mass. Nature Metabolism. 3 (9), 1134-1136 (2021).
- Virtue, S., Lelliott, C. J., Vidal-Puig, A. What is the most appropriate covariate in ANCOVA when analysing metabolic rate. Nature Metabolism. 3 (12), 1585 (2021).
- Hellerstein, M. K. De novo lipogenesis in humans: metabolic and regulatory aspects. European Journal of Clinical Nutrition. 53 Suppl 1, S53-S65 (1999).
- Zhao, S., et al. Dietary fructose feeds hepatic lipogenesis via microbiota-derived acetate. Nature. 579 (7800), 586-591 (2020).
- Wallace, M., et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nature Chemical Biology. 14 (11), 1021-1031 (2018).
- Zhao, S., et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch. Cell Reports. 17 (4), 1037-1052 (2016).
- Green, C. R., et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. Nature Chemical Biology. 12 (1), 15-21 (2016).
- Zhang, Z., et al. Serine catabolism generates liver NADPH and supports hepatic lipogenesis. Nature Metabolism. 3 (12), 1608-1620 (2021).
- Chirala, S. S., et al. Fatty acid synthesis is essential in embryonic development: fatty acid synthase null mutants and most of the heterozygotes die in utero. Proceedings of the National Academy of Sciences. 100 (11), 6358-6363 (2003).
- Icard, P., et al. ATP citrate lyase: A central metabolic enzyme in cancer. Cancer Letters. 471, 125-134 (2020).
- Fhu, C. W., Ali, A. Fatty acid synthase: an emerging target in cancer. Molecules. 25 (17), 3935 (2020).
- Lawitz, E. J., et al. Acetyl-CoA carboxylase inhibitor GS-0976 for 12 weeks reduces hepatic de novo lipogenesis and steatosis in patients with nonalcoholic steatohepatitis. Clinical Gastroenterology and Hepatology. 16 (12), 1983e3-1991e3 (2018).
- Smith, G. I., et al. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. The Journal of Clinical Investigation. 130 (3), 1453-1460 (2020).
- Imamura, F., et al. Fatty acids in the de novo lipogenesis pathway and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Medicine. 17 (6), e1003102 (2020).
- Lai, H. T. M., et al. Serial plasma phospholipid fatty acids in the de novo lipogenesis pathway and total mortality, cause-specific mortality, and cardiovascular diseases in the cardiovascular health study. Journal of the American Heart Association. 8 (22), e012881 (2019).
- Ference, B. A., et al. Mendelian randomization study of ACLY and cardiovascular disease. The New England Journal of Medicine. 380 (11), 1033-1042 (2019).
- Herman, M. A., et al. A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism. Nature. 484 (7394), 333-338 (2012).
- Sanchez-Gurmaches, J., et al. Brown fat AKT2 Is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis. Cell Metabolism. 27 (1), 195e6-209e6 (2018).
- Wang, X., et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. II. Purification and characterization. The Journal of Biological Chemistry. 268 (19), 14497-14504 (1993).
- Briggs, M. R., Yokoyama, C., Wang, X., Brown, M. S., Goldstein, J. L. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence. The Journal of Biological Chemistry. 268 (19), 14490-14496 (1993).
- Yokoyama, C., et al. SREBP-1, a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell. 75 (1), 187-197 (1993).
- Chen, G., Liang, G., Ou, J., Goldstein, J. L., Brown, M. S. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver. Proceedings of the National Academy of Sciences. 101 (31), 11245-11250 (2004).
- Denechaud, P. D., et al. ChREBP, but not LXRs, is required for the induction of glucose-regulated genes in mouse liver. The Journal of Clinical Investigation. 118 (3), 956-964 (2008).
- Crewe, C., et al. SREBP-regulated adipocyte lipogenesis is dependent on substrate availability and redox modulation of mTORC1. JCI Insight. 5 (15), e129397 (2019).
- Batchuluun, B., Pinkosky, S. L., Steinberg, G. R. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nature Reviews Drug Discovery. 21 (4), 283-305 (2022).
- Wallace, M., Metallo, C. M. Tracing insights into de novo lipogenesis in liver and adipose tissues. Seminars in Cell & Developmental Biology. 108, 65-71 (2020).
- Lee, W. N., et al. In vivo measurement of fatty acids and cholesterol synthesis using D2O and mass isotopomer analysis. The American Journal of Physiology. 266 (5 Pt 1), E699-E708 (1994).
- Yao, C. H., Liu, G. Y., Yang, K., Gross, R. W., Patti, G. J. Inaccurate quantitation of palmitate in metabolomics and isotope tracer studies due to plastics. Metabolomics. 12, 143 (2016).
- Hiller, K., et al. MetaboliteDetector: comprehensive analysis tool for targeted and nontargeted GC/MS based metabolome analysis. Analytical Chemistry. 81 (9), 3429-3439 (2009).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. Journal of Mass Spectrometry. 31 (3), 255-262 (1996).
- Midani, F. S., Wynn, M. L., Schnell, S. The importance of accurately correcting for the natural abundance of stable isotopes. Analytical Biochemistry. 520, 27-43 (2017).
- Trefely, S., Ashwell, P., Snyder, N. W. FluxFix: automatic isotopologue normalization for metabolic tracer analysis. BMC Bioinformatics. 17 (1), 485 (2016).
- Jeong, H., et al. Correcting for naturally occurring mass isotopologue abundances in stable-isotope tracing experiments with PolyMID. Metabolites. 11 (5), 310 (2021).
- Millard, P., et al. IsoCor: isotope correction for high-resolution MS labeling experiments. Bioinformatics. 35 (21), 4484-4487 (2019).
- Brunengraber, D. Z., et al. Influence of diet on the modeling of adipose tissue triglycerides during growth. American Journal of Physiology. Endocrinology and Metabolsim. 285 (4), E917-E925 (2003).
- Svensson, R. U., et al. Inhibition of acetyl-CoA carboxylase suppresses fatty acid synthesis and tumor growth of non-small-cell lung cancer in preclinical models. Nature Medicine. 22 (10), 1108-1119 (2016).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: a technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263 (5 Pt 1), E988-E1001 (1992).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Kelleher, J. K., Masterson, T. M. Model equations for condensation biosynthesis using stable isotopes and radioisotopes. The American Journal of Physiology. 262 (1 Pt 1), E118-E125 (1992).
- Kelleher, J. K., Nickol, G. B. Isotopomer spectral analysis: utilizing nonlinear models in isotopic flux studies. Methods in Enzymology. 561, 303-330 (2015).
- Argus, J. P., et al. Development and application of FASA, a model for quantifying fatty acid metabolism using stable isotope labeling. Cell Reports. 25 (10), 2919.e8-2934.e8 (2018).
- Guilherme, A., et al. Control of adipocyte thermogenesis and lipogenesis through β3-adrenergic and thyroid hormone signal integration. Cell Reports. 31 (5), 107598 (2020).
- Guilherme, A., et al. Neuronal modulation of brown adipose activity through perturbation of white adipocyte lipogenesis. Molecular Metabolism. 16, 116-125 (2018).
- Guilherme, A., et al. Adipocyte lipid synthesis coupled to neuronal control of thermogenic programming. Molecular Metabolism. 6 (8), 781-796 (2017).
- Lodhi, I. J., et al. Inhibiting adipose tissue lipogenesis reprograms thermogenesis and PPARgamma activation to decrease diet-induced obesity. Cell Metabolism. 16 (2), 189-201 (2012).
- McCormack, J. G., Denton, R. M. Evidence that fatty acid synthesis in the interscapular brown adipose tissue of cold-adapted rats is increased in vivo by insulin by mechanisms involving parallel activation of pyruvate dehydrogenase and acetyl-coenzyme A carboxylase. The Biochemistry Journal. 166 (3), 627-630 (1977).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Letters. 104 (1), 13-16 (1979).
- Negron, S. G., Ercan-Sencicek, A. G., Freed, J., Walters, M., Lin, Z. Both proliferation and lipogenesis of brown adipocytes contribute to postnatal brown adipose tissue growth in mice. Science Reports. 10 (1), 20335 (2020).
- Schlein, C., et al. Endogenous fatty acid synthesis drives brown adipose tissue involution. Cell Reports. 34 (2), 108624 (2021).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. Journal of Lipid Research. 55 (11), 2276-2286 (2014).
- Adlanmerini, M., et al. Circadian lipid synthesis in brown fat maintains murine body temperature during chronic cold. Proceedings of the National Academy of Sciences. 116 (37), 18691-18699 (2019).
- Yu, X. X., Lewin, D. A., Forrest, W., Adams, S. H. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB Journal. 16 (2), 155-168 (2002).
- Kushner, D. J., Baker, A., Dunstall, T. G. Pharmacological uses and perspectives of heavy water and deuterated compounds. Canadian Journal of Physiology and Pharmacology. 77 (2), 79-88 (1999).
- Diraison, F., Pachiaudi, C., Beylot, M. Measuring lipogenesis and cholesterol synthesis in humans with deuterated water: use of simple gas chromatographic/mass spectrometric techniques. Journal of Mass Spectrometry. 32 (1), 81-86 (1997).
- Yang, D., et al. Assay of low deuterium enrichment of water by isotopic exchange with [U-13C3]acetone and gas chromatography-mass spectrometry. Analytical Biochemistry. 258 (2), 315-321 (1998).
- Fu, X., et al. Measurement of lipogenic flux by deuterium resolved mass spectrometry. Nature Communications. 12 (1), 3756 (2021).
- Shah, V., Herath, K., Previs, S. F., Hubbard, B. K., Roddy, T. P. Headspace analyses of acetone: a rapid method for measuring the 2H-labeling of water. Analytical Biochemistry. 404 (2), 235-237 (2010).
- Argus, J. P., Yu, A. K., Wang, E. S., Williams, K. J., Bensinger, S. J. An optimized method for measuring fatty acids and cholesterol in stable isotope-labeled cells. Journal of Lipid Research. 58 (2), 460-468 (2017).
- Belew, G. D., Jones, J. G. De novo lipogenesis in non-alcoholic fatty liver disease: Quantification with stable isotope tracers. European Journal of Clinical Investigation. 52 (3), e13733 (2022).
- Zhang, Z., Chen, L., Liu, L., Su, X., Rabinowitz, J. D. Chemical basis for deuterium labeling of fat and NADPH. Journal of the American Chemical Society. 139 (41), 14368-14371 (2017).
- Belew, G. D., et al. Transfer of glucose hydrogens via acetyl-CoA, malonyl-CoA, and NADPH to fatty acids during de novo lipogenesis. Journal of Lipid Research. 60 (12), 2050-2056 (2019).
- Diraison, F., Pachiaudi, C., Beylot, M. In vivo measurement of plasma cholesterol and fatty acid synthesis with deuterated water: determination of the average number of deuterium atoms incorporated. Metabolism. 45 (7), 817-821 (1996).
- Ajie, H. O., et al. In vivo study of the biosynthesis of long-chain fatty acids using deuterated water. The American Journal of Physiology. 269 (2 Pt 1), E247-E252 (1995).
- Schloerb, P. R., Friis-Hansen, B. J., Edelman, I. S., Solomon, A. K., Moore, F. D. The measurement of total body water in the human subject by deuterium oxide dilution; with a consideration of the dynamics of deuterium distribution. The Journal of Clinical Investigation. 29 (10), 1296-1310 (1950).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır