Method Article
الزراعة المشتركة ونقل الخلايا الصعترية للفئران على الخلايا اللحمية الشبيهة بدلتا 4 لدراسة الجينات المسرطنة في سرطان الدم في الخلايا التائية
In This Article
Summary
يصف هذا البروتوكول عزل الخلايا الصعترية السلبية المزدوجة من الغدة الصعترية للفأر متبوعة بنقل الفيروسات القهقرية والمزرعة المشتركة على نظام الاستزراع المشترك لخط لحمية نخاع العظم الشبيه بدلتا (OP9-DL4) لمزيد من التحليل الوظيفي.
Abstract
يمكن تمييز الخلايا الصعترية غير الناضجة للفأر المحول إلى خلايا تائية في المختبر باستخدام نظام الاستزراع المشترك لخط الخلايا اللحمية لنخاع العظم الذي يشبه دلتا (OP9-DL4). نظرا لأن نقل الفيروسات القهقرية يتطلب انقسام الخلايا لتكامل الجينات المحورة ، فإن OP9-DL4 يوفر بيئة مناسبة في المختبر لزراعة الخلايا السلفية المكونة للدم. هذا مفيد بشكل خاص عند دراسة آثار التعبير عن جين معين أثناء نمو الخلايا التائية الطبيعية وتكوين الكريات البيض ، لأنه يسمح للباحثين بالتحايل على العملية التي تستغرق وقتا طويلا لتوليد الفئران المعدلة وراثيا. لتحقيق نتائج ناجحة ، يجب إجراء سلسلة من الخطوات المنسقة التي تنطوي على معالجة متزامنة لأنواع مختلفة من الخلايا بعناية. على الرغم من أن هذه إجراءات راسخة للغاية ، إلا أن عدم وجود مصدر مشترك في الأدبيات غالبا ما يعني أن هناك حاجة إلى سلسلة من التحسينات ، والتي يمكن أن تستغرق وقتا طويلا. وقد ثبت أن هذا البروتوكول فعال في تحويل الخلايا الصعترية الأولية متبوعا بالتمايز على خلايا OP9-DL4. مفصل هنا هو بروتوكول يمكن أن يكون بمثابة دليل سريع ومحسن للثقافة المشتركة للخلايا الصعترية المحولة بالفيروسات القهقرية على الخلايا اللحمية OP9-DL4.
Introduction
يوفر خط الخلايا اللحمية لنخاع العظم OP9 نظاما مفيدا في المختبر لتحريض تكون اللمفاويات من عدة مصادر للأسلاف1. أظهرت الدراسات الأولى التي استخدمت خلايا OP9 أن عدم وجود تعبير عامل تحفيز مستعمرة البلاعم (MCSF) ساهم في قدرة خط خلايا OP9 على دعم تكون الدم وتمايز الخلايا البائية عن الخلايا الجذعية المكونة للدم المشتقة من نخاع العظم (HSCs) ، كما هو موضح لاحقا أيضا للخلايا الجذعية الجنينية (ESCs)2،3،4،5 . في الدراسات السابقة ، مكن توليد خلايا OP9 التي تشبه دلتا (OP9-DL1 / OP9-DL4) من تحريض التزام سلالة الخلايا التائية6 وأظهر القدرة على تلخيص نضج الغدة الصعترية بنجاح 7,8. باختصار ، تم وصف تطور الخلايا التائية من خلال التعبير المتسلسل لجزيئات CD4 و CD8. الخلايا الصعترية غير الناضجة "سلبية مزدوجة" (DN ، CD4− CD8−) ويمكن تقسيمها بشكل أكبر وفقا للتعبير السطحي ل CD44 و CD25. تتمايز الخلايا الصعترية DN من خلال مرحلة الإيجابية المفردة غير الناضجة (ISP) ، والتي تتميز بتعبير CD8 في الفئران و CD4 في البشر ، تليها المرحلة الإيجابية المزدوجة (DP) ، التي تتميز بالتعبير المشترك ل CD4 و CD8 ، وأخيرا ، المرحلة الإيجابية الفردية الناضجة ، التي تتميز بالتعبير عن CD4 أو CD89. تعبر HSCs عن مستقبل Notch1 ، والذي يتفاعل عادة مع 4 (DL4) الشبيه بالدلتا المعبر عنه على الخلايا الظهارية الصعترية للحث على تمايز سلالة T10. ومن ثم ، زاد الاهتمام بنموذج OP9-DL1 / 4 تدريجيا ، مما أدى إلى الاستخدام المكثف لهذا النهج في مجموعة واسعة من التطبيقات في العقدين الماضيين8،11،12،13. على الرغم من أن DL1 و DL4 قادران على دعم تمايز الخلايا التائية في المختبر ، إلا أنهما يظهران متطلبات تفاضلية في الجسم الحي ، وقد اقترحت بعض الدراسات أن OP9_DL4 أكثر كفاءة من OP9_DL1 في تلخيص بيئة الغدة الصعترية للفأر 7,14.
من بين التطبيقات المحتملة لنظام OP9-DL1/4 ، هناك اهتمام خاص بالجمع بين هذا النظام ونقل خلايا DN أو HSCs مع ناقلات الفيروسات القهقرية. هذا المزيج هو وسيلة فعالة لمعالجة التعبير الجيني أثناء نمو الخلايا التائية الطبيعية وتكوين الكريات البيض وقد ثبت أنه طريقة فعالة للحث أو تثبيط وظيفة الجين محلالاهتمام 15،16،17. تم استخدام هذا النموذج بنجاح خاص لدراسة التعاون بين الجينات المسرطنة التي تقود سرطان الدم15 لأنه مرن ويتيح فحص آثار مجموعات جينية متعددة في وقت معقول ، على عكس توليد الفئران المعدلة وراثيا. علاوة على ذلك ، تم استخدام نماذج مماثلة سابقا لتقييم آثار إدخال الجينات المسرطنة في الخلايا الطبيعية15،16،17. بالإضافة إلى ذلك ، يتطلب نقل الفيروسات القهقرية تقسيم الخلايا لتكامل الجينات المحورة18 ، وبينما سيتغلب نقل الفيروسات العدسية على هذا القيد من خلال القضاء على الحاجة إلى تقسيم الخلايا لتكامل الجينات المحورة ، لم نتمكن من تحقيق النقل الناجح لخلايا الغدة الصعترية DN باستخدام ناقلات الفيروسات العدسية. وبالتالي ، فإن OP9-DL1 / DL4 هو أداة مناسبة لزراعة الخلايا السلفية المكونة للدم.
يتضمن البروتوكول القياسي لتكوين اللمفاويات للخلايا الصعترية المحولة على OP9-DL4 سلسلة من الخطوات المنسقة التي يجب تنفيذها بعناية لتحقيق نتيجة ناجحة. على الرغم من أن هذه التقنيات كانت تخدم المجتمع بشكل جيد لسنوات عديدة ، إلا أن البروتوكولات المتاحة في الأدبيات غالبا ما تكون مجزأة. ونتيجة لذلك، يضطر كل مختبر إلى تكييف المراحل المختلفة من الإجراء وتحسينها، الأمر الذي قد يستغرق وقتا طويلا. هنا ، يصف هذا البروتوكول عزل الخلايا الصعترية DN من الغدة الصعترية للفأر ، يليها نقل الفيروسات القهقرية والاستزراع المشترك على الخلايا اللحمية OP9-DL4 لمزيد من التحليل الوظيفي. وقد ثبت أن هذا البروتوكول المعمول به فعال وقابل للتكرار في تحويل الخلايا الصعترية الأولية ، يليه التمايز على خلايا OP9-DL4 أو تحريض سرطان الدم الليمفاوي الحاد للخلايا التائية15.
Protocol
تمت الموافقة على جميع التجارب على الحيوانات الموصوفة من قبل لجنة السلامة الأحيائية المؤسسية التابعة للمعاهد الوطنية للصحة (IBC) ولجنة رعاية واستخدام الحيوان (ACUC). انظر جدول المواد للحصول على التفاصيل المتعلقة بجميع الكواشف والمواد المستخدمة في هذا البروتوكول. راجع الإرشاداتالمنشورة رقم 19 للحصول على مزيد من التفاصيل حول زراعة الخلايا المنتجة للفيروسات القهقرية وإجراءات الصيانة. انظر الشكل 1 للحصول على نظرة عامة على البروتوكول.
1. بدء زراعة خلايا OP9-DL4 (اليوم الأول)
- قم بإذابة خلايا OP9-DL4 بسرعة عن طريق إمساك القارورة ورجها برفق في حمام مائي عند 37 درجة مئوية. نقل الخلايا على الفور إلى أنبوب طرد مركزي يحتوي على 5 مل من وسط OP9 (وسط MEM-alpha ، 10٪ FBS ، 50 وحدة / مل بنسلين / ستربتومايسين ، 55 ميكرومتر 2-ميركابتوإيثانول ، 2 مللي متر L-glutamine) لإزالة عوامل الحماية بالتبريد.
- أجهزة الطرد المركزي في 300 × غرام لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية ، وأعد تعليق الخلايا في 1 مل من وسط OP9.
- ضع 5 مل من وسط OP9 في دورق T25 ، وأضف الخلايا المعاد تعليقها إلى هذه القارورة. الثقافة عند 37 درجة مئوية و 5٪ CO2.
- بعد 2-3 أيام ، قم بزراعة الخلايا باستخدام تقسيم 1: 3 (مرور الخلايا كل يوم اثنين وأربعاء وجمعة).
ملاحظة: تقسيم خلايا OP9-DL4 قبل أن تصل إلى نقطة التقارب. يجب أن تكون قارورة OP9-DL4 متقاربة بنسبة 80٪ -90٪ في الأيام 6-7 وفي الأيام 8-9+ للزراعة المشتركة مع الخلايا الصعترية. وبالتالي ، من المهم التخطيط لعدد خلايا OP9-DL4 المطلوبة في تلك الأيام أثناء تقسيم خلايا OP9-DL4.- تخلص من الوسط من القارورة ، واغسل الطبقة الأحادية باستخدام 1x PBS. تخلص من برنامج تلفزيوني ، أضف 1 مل من 0.25٪ تربسين ، واحتضن لمدة 1-5 دقائق عند 37 درجة مئوية ، أو حتى تزيح الخلايا من القارورة. ضرب القارورة لإزاحة الخلايا.
ملاحظة: (اختياري) يمكن التحقق من تقدم تفكك الخلايا عن طريق الفحص المجهري. - أضف 5 مل من وسط OP9 لتعطيل التربسين ، وأعد تعليق الخلايا عن طريق شطف السطح المغطى بالخلية للقارورة أثناء التعليق.
- جهاز طرد مركزي تعليق الخلية عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة وإعادة تعليقه في 3 مل من وسط OP9 (لتقسيم 1: 3).
- ضع 1 مل من معلق الخلية في دورق T25 يحتوي بالفعل على 5 مل من وسط OP9 الطازج. تجميد / تجاهل الخلايا المتبقية.
- لتجميد خلايا OP9-DL4 ، أعد تعليق الخلايا في 90٪ FBS / 10٪ DMSO بنسبة 1 مل من وسط التجميد إلى قارورة واحدة من الخلايا.
- تجمد في 1 مل كريوفيال عند -80 درجة مئوية أو في النيتروجين السائل ، اعتمادا على المتطلبات المستقبلية. تخزينها في النيتروجين السائل للتخزين لفترات طويلة.
- تخلص من الوسط من القارورة ، واغسل الطبقة الأحادية باستخدام 1x PBS. تخلص من برنامج تلفزيوني ، أضف 1 مل من 0.25٪ تربسين ، واحتضن لمدة 1-5 دقائق عند 37 درجة مئوية ، أو حتى تزيح الخلايا من القارورة. ضرب القارورة لإزاحة الخلايا.
2. بدء زراعة خط الخلايا المنتجة للفيروسات القهقرية (اليوم 1)
- قم بإذابة خط الخلايا المنتجة للفيروسات القهقرية بسرعة عن طريق إمساك القارورة ورجها برفق في حمام مائي عند 37 درجة مئوية. انقل الخلايا على الفور إلى أنبوب طرد مركزي يحتوي على 5 مل من وسط الخلية المنتج للفيروسات القهقرية (RPC: DMEM ، 10٪ FBS) لإزالة عامل الحماية من التبريد.
- أجهزة الطرد المركزي في 300 × غرام لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية ، وأعد تعليق الخلايا في 1 مل من وسط RPC.
- ضع 5 مل من وسط RPC في دورق T25 ، وأضف الخلايا المعاد تعليقها إلى هذه الدورق. الثقافة عند 37 درجة مئوية و 5٪ CO2.
- قم بتمرير الخلايا كل 2-3 أيام عند تقسيم 1: 5 إلى 1: 8.
- اضرب القارورة لإزاحة الخلايا ، وأعد تعليق الخلايا عن طريق السحب بقوة.
ملاحظة: يمكن إزالة هذه الخلايا من سطح القارورة عن طريق سحب ماصة عدوانية دون التربسين. بدلا من ذلك ، التربسين (0.05٪ تربسين / 0.53 مللي مول EDTA) حتى تنفصل الخلايا بسهولة ويمكن سحبها بسهولة إلى معلق أحادي الخلية.
- اضرب القارورة لإزاحة الخلايا ، وأعد تعليق الخلايا عن طريق السحب بقوة.
- جهاز طرد مركزي تعليق الخلية عند 300 × جم لمدة 5 دقائق ، وإعادة التعليق في 5 مل من وسط RPC (لتقسيم 1: 5).
- ضع 1 مل من معلق الخلية في دورق T25 يحتوي بالفعل على 5 مل من وسط RPC الجديد. تجميد / تجاهل الخلايا المتبقية. قم بتجميد الخلايا المنتجة للفيروسات القهقرية بنفس الطريقة الموصوفة لخلايا OP9-DL4 (الخطوات 1.4.4.1-1.4.4.2).
3. بدء زراعة الخلايا المنتجة للفيروس القهقري في 6 ألواح (الأيام 4-5)
- قم بزرع الخلايا المنتجة للفيروس القهقري قبل 18-24 ساعة من الانتقال عند التقاء 70٪ -90٪ في كل بئر من صفيحة زراعة الأنسجة المكونة من 6 آبار في 2 مل من وسط RPC ، واحتضانها عند 37 درجة مئوية و 5٪ CO2.
ملاحظة: نقل بئرين من الخلايا المنتجة للفيروس القهقري لكل 2-5 × 105 إلى 1 × 106 خلايا الغدة الصعترية التي سيتم تحويلها.
4. نقل الخلايا المنتجة للفيروس القهقري لتوليد الفيروس القهقري الذي يحتوي على الجينات ذات الأهمية (الأيام 5-6)
- استبدل الوسط بوسيط RPC جديد قبل 1 ساعة من النقل.
- تحضير مخاليط الليبوفيكشن (لكل بئر من صفيحة ذات 6 آبار - قم بتوسيع نطاقها حسب الحاجة): قم بتخفيف 4 ميكروغرام من الحمض النووي (2 ميكروغرام من البلازميد المساعد (pCL-Eco) و 2 ميكروغرام من بلازميد النقل (pMIG) في 250 ميكرولتر من وسط المصل المنخفض. تخلط بلطف.
- امزج 10 ميكرولتر من كاشف النقل مع 250 ميكرولتر من وسط المصل المختزل من الخطوة 4.2. احتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- بعد 5 دقائق من الحضانة ، ادمج الحمض النووي المخفف مع كاشف النقل المخفف (الحجم الكلي = 500 ميكرولتر). تخلط بلطف ، واحتضان لمدة 20-25 دقيقة في درجة حرارة الغرفة.
- أضف 500 ميكرولتر من مخاليط كاشف الحمض النووي / النقل برفق إلى البئر الذي يحتوي على الخلايا المنتجة للفيروسات القهقرية عن طريق إسقاطها على الخلايا بحركة دائرية. امزج برفق عن طريق هز الطبق ذهابا وإيابا ، واحتضن الطبق في حاضنة 37 درجة مئوية لمدة 16-24 ساعة.
ملاحظة: الخلايا تحت المتقاربة (80٪ -90٪) هي الأنسب للانتقال ويحتمل أن تولد أعلى عيار فيروسي. نظرا لأن الخلايا المنتجة للفيروسات القهقرية تزيح بسهولة شديدة من القارورة ، تجنب الحركات المفاجئة عند التعامل مع هذه الخلايا.
5. تغيير وسط الخلية المنتجة للفيروسات القهقرية (الأيام 6-7)
- استبدل الوسط القديم بعد حوالي 16 ساعة من النقل ب 2 مل من وسط RPC الطازج. استمر في احتضان الخلايا عند 37 درجة مئوية لمدة 20-24 ساعة.
- تقييم كفاءة النقل تحت المجهر الفلوري (اختياري).
ملاحظة: في هذا البروتوكول ، الخلايا الإيجابية ل GFP هي الخلايا ذات الاهتمام (انظر الشكل 2). تعتمد هذه الخطوة على ناقل الفيروس القهقري المحدد للاستخدام في هذا البروتوكول (ما إذا كان جين المراسل موجودا في العمود الفقري).
6. تحضير الخلايا الصعترية واستنفاد خلايا CD4+ و CD8+ (الأيام 6-7)
- احصد الغدة الصعترية من فأر C57BL / 6 عمره 4-6 أسابيع. لمزيد من التفاصيل حول حصاد الغدة الصعترية ، راجع Xing و Hogquist20.
ملاحظة: تم القتل الرحيم للفئران عن طريق استنشاق CO2 متبوعا بخلع عنق الرحم. - تحضير تعليق خلية واحدة الغدة الصعترية عن طريق وضع الغدة الصعترية في 5 مل من برنامج تلفزيوني في طبق بتري. باستخدام شرائح زجاجية معقمة ، ضع الغدة الصعترية بين الأسطح المتجمدة للشرائح ، وافرك الشرائح معا برفق ، مع لف الغدة الصعترية بين الشريحتين. شطف الشرائح الزجاجية لجمع الخلايا ، وتجاهل الأنسجة اللحمية الغدة الصعترية المتبقية.
ملاحظة: العائد المقدر من الغدة الصعترية هو 90 × 10 6-100 × 106 خلايا ، وسيبقى حوالي 1٪ من الخلايا بعد استنفاد CD4 و CD8. استخدم أنسجة الغدة الصعترية من الفئران الأصغر سنا للحصول على إنتاجية أفضل من الخلايا ، حيث أن خلوية الغدة الصعترية للفأر في الأسابيع الأولى بعد الولادة تزداد بسرعة ، وتصل إلى هضبة في عمر 4-6 أسابيع ، وتلتف تدريجيا بعدذلك 21. عد الخلايا باستخدام عداد خلايا الدم التلقائي أو أي طريقة بديلة. - قم بتصفية تعليق الغدة الصعترية من خلال مرشح 30 ميكرومتر أو 40 ميكرومتر عن طريق سحب 5 مل من تعليق الغدة الصعترية من خلال مصفاة خلوية. أجهزة الطرد المركزي الخلايا في 300 × غرام لمدة 10 دقائق.
- قم بإزالة المادة الطافية ، وقم بتحليل خلايا الدم الحمراء باستخدام محلول تحلل ACK عن طريق إضافة (حسب حجم العينة) 1 مل من المخزن المؤقت لكل أنبوب لمدة دقيقة واحدة. أضف 5 مل من المخزن المؤقت لاستنفاد الخلايا (500 مل من PBS [pH 7.2] ، 0.5٪ BSA ، 2 mM 0.5M EDTA ، pH 8.0) لإلغاء تنشيط المخزن المؤقت لتحلل ACK ، وأجهزة الطرد المركزي عند 300 × جم لمدة 10 دقائق ، وإعادة التعليق في 1-5 مل من المخزن المؤقت لاستنفاد الخلايا للعد.
ملاحظة: ضع جانبا ما يلي على الجليد قبل النضوب (قبل النضوب): 70 ميكرولتر من معلق الخلية للعد (قم بتغيير هذا اعتمادا على طريقة عد الخلايا المختارة) و 200 ميكرولتر من تعليق الخلية لتحديد كفاءة النضوب عن طريق تلطيخ CD4 و CD8 والتحليل بواسطة قياس التدفق الخلوي22,23. - عد الخلايا وأجهزة الطرد المركزي عند 300 × جم لمدة 10 دقائق. أعد تعليق الخلايا عند 1 × 107/80 ميكرولتر من المخزن المؤقت لاستنفاد الخلايا. أضف 10 ميكرولتر لكل من ميكروبيدات CD4 و CD8 لكل 1 × 107 خلايا. تخلط جيدا ، وتحتضن لمدة 15 دقيقة في الظلام في الثلاجة (2-8 درجة مئوية).
- قم بإعداد عمود النضوب عن طريق شطفه ب 2 مل من المخزن المؤقت للنضوب والتخلص من التدفق.
- اغسل الخلايا من الخطوة 6.6 بإضافة 1-2 مل من محلول النضوب لكل 1 × 107 خلايا ، وأجهزة الطرد المركزي عند 300 × جم لمدة 10 دقائق. قم بإزالة وتجاهل المادة الطافية.
- إعادة تعليق ما يصل إلى 1.25 × 108 خلايا في 500 ميكرولتر من المخزن المؤقت للنضوب. قم بتطبيق تعليق الخلية على العمود ، واجمع التدفق (الخلايا غير المصنفة). اغسل العمود 2x ب 1 مل من المخزن المؤقت ، واجمع التدفق.
ملاحظة: أضف مخزن مؤقت جديد فقط عندما يكون خزان العمود فارغا. ضع جانبا ما يلي على الجليد بعد النضوب (التحكم بعد النضوب): 70 ميكرولتر من تعليق الخلية للعد (يختلف هذا اعتمادا على طريقة عد الخلايا المختارة) و 1000 ميكرولتر من تعليق الخلية لتحديد كفاءة النضوب عن طريق تلطيخ CD4 و CD8 والتحليل بواسطة قياس التدفق الخلوي22,23. - تلطيخ ضوابط كفاءة النضوب عن طريق تقسيم 200 ميكرولتر من الخلايا التي تم جمعها قبل النضوب إلى أربعة أنابيب FACS: غير ملطخة ، CD4 أحادية اللون ، CD8 أحادية اللون ، و CD4 / CD8 مزدوجة اللون (استخدم العينات غير الملوثة والمفردة الملطخة لإعداد معلمات قياس التدفق الخلوي). استخدم 1000 ميكرولتر من الخلايا التي تم جمعها بعد النضوب لتلطيخ CD4 و CD8 وقارنها بالعينة المزدوجة الملطخة التي تم جمعها قبل النضوب (انظر نتائج الاستنفاد النموذجية في الشكل 3).
ملاحظة: اضبط أحجام تلطيخ قياس التدفق الخلوي وفقا لتوصية الشركة المصنعة للأجسام المضادة (على سبيل المثال ، 1 ميكرولتر من anti-CD4-FITC + 0.5 ميكرولتر من anti-CD8-PE لكل 1 × 106 خلايا في 50 ميكرولتر من المخزن المؤقت).
7. زراعة الخلايا الصعترية على خلايا OP9-DL4 (الأيام 6-7)
- ضع 2-5 × 105 إلى 1 × 106 خلايا الغدة الصعترية بعد النضوب في دورق T25 من 80٪ - 90٪ خلايا OP9-DL4 المتقاربة في وسط OP9 الذي يحتوي على السيتوكينات (10 نانوغرام / مل IL-7 المؤتلف و hFLT-3 المؤتلف). الثقافة عند 37 درجة مئوية و 5٪ CO2. تنمو لمدة 24 ساعة تقريبا على خلايا OP9-DL4.
ملاحظة: هذه المدة مطلوبة لجعل الخلايا التائية قابلة للتحويل (انظر النتيجة النموذجية في الشكل 4). احتفظ بقارورة T25 واحدة من الثقافة المشتركة للخلايا الصعترية وخلايا OP9-DL4 لاستخدامها كعنصر تحكم (غير محول). سيتم تلطيخ الخلايا الصعترية غير المنقولة مع الخلايا الصعترية المحولة (الخطوة 9.1) كعنصر تحكم سلبي لتقييم كفاءة النقل. يمكن أيضا استخدام الخلايا الصعترية غير المنقولة لقياس تأثير التعبير الجيني التحوير على تمايز الخلايا. تجاهل الوسط المحتوي على السيتوكين بعد 1 شهر.
8. حصاد الفيروس القهقري من المادة الطافية واستخدامه لتحويل الخلايا الصعترية (الأيام 8-9)
- اجمع المادة الطافية التي تحتوي على الفيروسات القهقرية من الخلايا المنقولة عن طريق إمالة اللوحة المكونة من 6 آبار ووضع حقنة 3-5 مل في أسفل اللوحة أثناء سحب المكبس لشفط المادة الطافية. استبدل الوسط ب 2 مل من وسط RPC الطازج. استمر في احتضان الخلايا عند 37 درجة مئوية لمدة 20-24 ساعة للتحويل الثاني في الخطوة 8.9.
- قم بتصفية طاف الفيروس القهقري من خلال مرشح حقنة 0.45 ميكرومتر ، واجمع المرشح في أنبوب سعة 50 مل.
ملاحظة: لا تجمد المادة الطافية للفيروسات القهقرية. استخدم مستحضرا حديثا للفيروس للنقل. - جمع الخلايا الصعترية من ثقافة OP9-DL4 عن طريق ماصة العدوانية لإزالة الخلايا الصعترية وخلايا OP9-DL4 من سطح القارورة. قم بتصفية تعليق الخلية من خلال مصفاة خلية 40 ميكرومتر لإزالة معظم خلايا OP9-DL4 ، وجمع المرشح في أنبوب سعة 50 مل.
ملاحظة: خلايا OP9 ملتصقة جدا. على الرغم من أن السحب العدواني قد يزيل بعض خلايا OP9-DL4 من القارورة ، إلا أن تعطيل الطبقة الأحادية OP9-DL4 خلال هذه العملية يكون ضئيلا ، وسيتم تصفية خلايا OP9-DL4 التي تخرج باستخدام مصفاة الخلايا 40 ميكرومتر ، نظرا لأن خلايا OP9-DL4 أكبر بكثير من الخلايا الصعترية الأولية. إذا كانت خلايا OP9-DL4 لا تزال متقاربة بنسبة 80٪ إلى 90٪ ، فقم بإزالة الخلايا الصعترية وإعادة صفيحها في نفس دورق OP9-DL4. بدلا من ذلك ، يجب إعداد قارورة OP9-DL4 جديدة. - الطرد المركزي الخلايا الصعترية في المرشح من الخطوة 8.3 في 300 × غرام لمدة 5 دقائق. تخلص من المادة الطافية.
- في أنبوب 50 مل ، أعد تعليق الخلايا الصعترية في 0.5-1 مل من وسط OP9 + السيتوكينات (انظر الخطوة 7.1). أضف 1-2 مل من وسط RPC الذي يحتوي على الفيروس (ضعف وسط RPC مثل وسط الخلايا الصعترية). يضاف بروميد سداسي ميثرين (تركيز مخزون 10 ميكروغرام/ميكرولتر) لإنتاج 8 ميكروغرام من بروميد سداسي ميثرين/مل من معلق الخلية الكلي.
- قم بالتلقيح عن طريق الطرد المركزي للخلايا عند 850 × جم لمدة 1 ساعة في درجة حرارة الغرفة.
- أعد تعليق الخلايا في 6 مل من وسط OP9 + السيتوكينات لكل قارورة (انظر الخطوة 7.1) ، وأضف التعليق مرة أخرى إلى الطبقة الأحادية للخلية OP9-DL4.
ملاحظة: بدلا من ذلك ، لديك قوارير OP9-DL4 جديدة جاهزة لاستقبال الخلايا الصعترية المحولة. إذا كان سيتم إعادة الخلايا الصعترية إلى قارورة OP9-DL4 المستخدمة ، فتأكد من إضافة وسيط OP9 جديد إلى خلايا OP9-DL4 خلال 1 ساعة من شبقية الخلايا الصعترية للحفاظ على صحة الخلايا وضمان التقاء 80٪ -90٪. - احتضان في 37 درجة مئوية بين عشية وضحاها.
- كرر الخطوات من 8.2 إلى 8.7 باستخدام بئر جديد من طاف الخلية المحتوي على الفيروس القهقري.
9. الحفاظ على الخلايا الصعترية المتحولة على مزرعة OP9-DL4 لمدة 2-5 أيام أو تجميدها حسب الحاجة (اليوم 9+)
- تقييم تمايز الخلايا الصعترية عن طريق قياس التدفق الخلوي عن طريق تلطيخ الخلايا الصعترية لعلامات تطور الخلايا التائية مثل CD4 و CD8 و CD25 و CD4423. انظر نتائج تمايز الخلايا التوتية النموذجية في الشكل 5.
النتائج
يمكن تقييم كفاءة الاستنفاد للتدفق الخلوي عن طريق تسمية جزء الخلية غير المسمى مغناطيسيا ل CD4 و CD8 بعد فصل الخلايا المغناطيسية المناعية (MACS) وتحليل ذلك على مخطط نقطي ثنائي المتغير ثنائي الأبعاد (الشكل 3). العائد الجيد للخلايا السالبة المزدوجة (CD4− ، CD8−) هو 95٪ أو أعلى ، كما هو موضح في الشكل 3. اثنان من أكثر الأسباب شيوعا لانخفاض الغلة هما سوء تقدير الميكروبيدات بناء على عدد الخلايا وعدد الخلايا المصنفة التي تتجاوز سعة العمود. يوصى باختيار العدد الصحيح لأعمدة MACS وفقا لعدد الخلايا المصنفة. عند العمل مع الخلايا الصعترية ، فإن عدد الخلايا المصنفة (خلايا DP و SP) يساوي تقريبا عدد الخلايا الكلية (أكثر من 96٪). يمكن إجراء عد الخلايا في عداد الخلايا التلقائي أو غرفة نيوباور أو بأي طريقة بديلة. نتيجة لذلك ، قد تحتاج الأحجام المخصصة لعد الخلايا إلى التعديل اعتمادا على الجهاز المحدد وطريقة العد المختارة.
من المهم تحديد عدد الخلايا الموجودة قبل وبعد النضوب. هناك حاجة إلى عدد الخلايا هذه لحساب عدد أعمدة استنفاد LD اللازمة ولتوزيع خلايا الغدة الصعترية DN بالتساوي في العدد المناسب من قوارير OP9-DL4. يمكن إجراء عناصر التحكم في قياس التدفق الخلوي (الخلايا غير المسماة ، والخلايا الموسومة ل CD4 ، والخلايا الموسومة ل CD8) باستخدام عينة ما قبل الاستنفاد المحجوزة ، حيث تحتوي على المزيد من الخلايا. ومع ذلك ، نظرا لأنه من المتوقع الاحتفاظ بمعظم الخلايا داخل العمود ، فإن عينة ما بعد الاستنفاد التي سيتم تسميتها ستتطلب حجما أكبر. وبالتالي ، قد يلزم إجراء تعديلات وفقا لبروتوكول وضع العلامات المحدد.
عند استخدام النواقل التي تعبر عن علامات قابلة للفحص ، مثل جين مضان ، يمكن تقييم النقل والنقل بشكل تقريبي وتجريبي بواسطة الفحص المجهري الفلوري (الشكل 2). يمكن تحليل كفاءة النقل عن طريق حصاد الغدة الصعترية من الطبقة الأحادية OP9-DL4 ، كما هو موضح في الخطوة 8.3 ، والنظر في التعبير عن جين مضان عن طريق قياس التدفق الخلوي. كانت كفاءة النقل باستخدام ناقل فيروسات قهقرية فارغ مع GFP كجين مراسل 84.2٪ (الشكل 4).
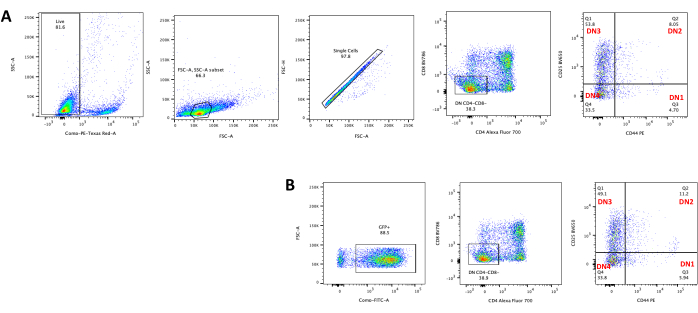
يمكن ملاحظة تمايز الخلايا التائية على خلايا OP9-DL4 بعد 4 أيام من النقل. عادة ما يتم إجراء قياس التدفق الخلوي لتقييم تمايز الخلايا الناجم عن الثقافة المشتركة على خلايا OP9-DL4 و / أو التعبير الجيني ، كما هو موضح في الشكل 5 ، حيث تم تسمية الخلايا ل CD4 و CD8 و CD44 و CD25. هناك العديد من المجموعات الممكنة من وسم جزيئات سطح الخلية التي ثبت أنها مفيدة للتحقيق في الآليات الجزيئية والخلوية لتطور الخلايا التائية في الفئران24،25،26،27. لذلك ، قد تختلف لوحات الأجسام المضادة الفلورية وفقا لمسألة الاهتمام التي يتم تناولها. قدم نقل الخلايا الصعترية DN مع ناقل الفيروس القهقري الفارغ pMIG ، الموضح في اللوحة B ، نفس النسب تقريبا من الإيجابيات الفردية (CD4 + أو CD8 +) ، والإيجابيات المزدوجة (CD4 + / CD8 +) ، والسلبيات المزدوجة (CD4− / CD8−) ، ومراحلها الفرعية مزدوجة سلبية 1-4 (DN1-DN4) مثل الخلايا الصعترية غير المنقولة ، الموضحة في اللوحة A ، مما يشير إلى أن نمو الخلايا التائية لم يتأثر بعملية التنبيث.
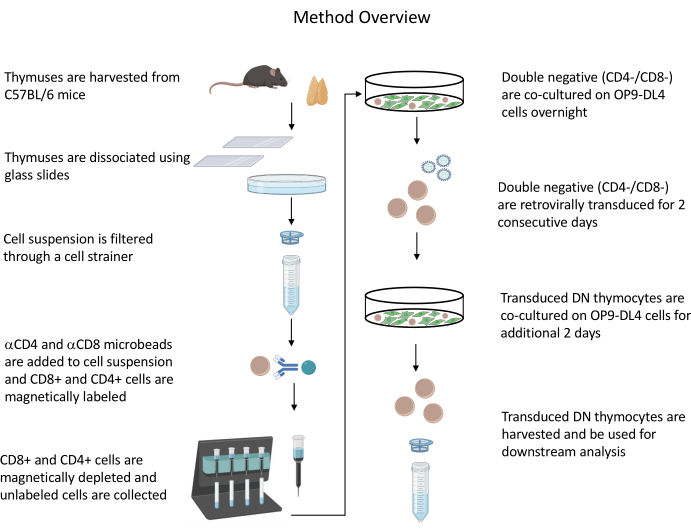
الشكل 1: شكل يوضح خطوات عزل الخلايا التوتية، ونقلها، وزراعتها المشتركة. الاختصار: DN = سلبي مزدوج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
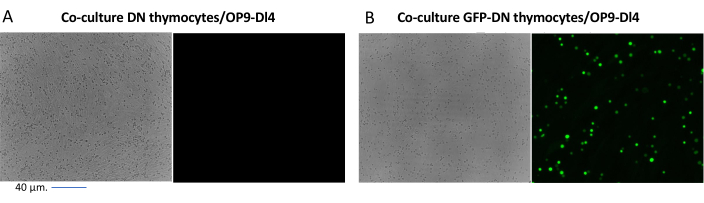
الشكل 2: الفحص المجهري الفلوري للثقافة المشتركة للخلايا الصعترية المحولة بواسطة GFP أو الخلايا الصعترية غير المنقولة وخلايا OP9-DL4. (أ) الخلايا الصعترية غير المنقولة و (ب) الخلايا الصعترية المستقرة المعبرة عن GFP على OP9-DL4 في اليوم الثالث بعد التنبيغ الثاني. تم استخدام مجهر مضان أوليمبوس-IX71 مع عدسة 40x ومرشح 480/30 مناسب للكشف عن GFP. شريط المقياس = 40 ميكرومتر. الاختصارات: GFP = بروتين الفلورسنت الأخضر. DN = مزدوج سلبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
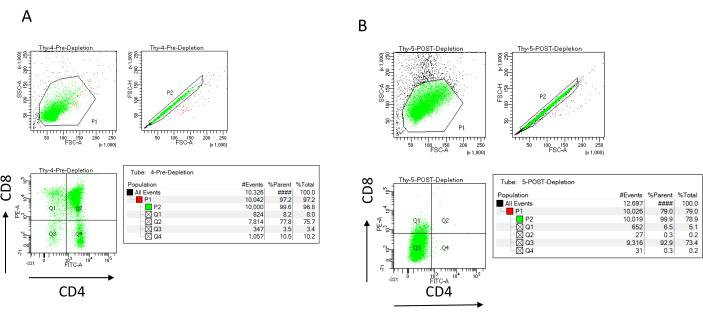
الشكل 3: قياس التدفق الخلوي لنضوب الخلايا التوتية. مخططات قياس التدفق الخلوي التمثيلية التي تحلل التعبير عن CD4 و CD8 على الخلايا الصعترية التي تم الحصول عليها من إناث الفئران C57BL / 6J البالغة من العمر 7-8 أسابيع (A) قبل النضوب و (B) بعد استنفاد CD4 + و CD8 + باستخدام الميكروبيدات وأعمدة LD وفقا لتعليمات الشركة المصنعة. تظهر المخططات النقطية على اليسار بوابات بناء على حجم الحدث وتعقيده (FCS-A و SSC-A ، على التوالي). تعرض اللوحة الوسطى FSC-H مقابل FSC-A لبوابة الخلايا المفردة واستبعاد الثنائيات. في المؤامرات الموجودة على اليمين ، تم تعريف الخلايا على أنها CD4 و CD8 من بوابة الخلية الواحدة. الاختصارات: FSC-A = منطقة ذروة التشتت الأمامية ؛ SSC-A = منطقة ذروة التشتت الجانبية ؛ FSC-H = ارتفاع ذروة التشتت الأمامي ؛ FITC = فلوريسئين إيزوثيوسيانات ؛ PE = فيكوريثرين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 4: قياس التدفق الخلوي لكفاءة نقل الخلايا الصعترية للفيروسات القهقرية. (أ) الخلايا التوتية غير المنقولة المستزرعة في OP9-DL4؛ (ب) الخلايا الصعترية المنقولة بالفيروسات القهقرية على OP9-DL4 في اليوم الثالث بعد النقل. الاختصارات: FSC-A = منطقة ذروة التشتت الأمامية ؛ SSC-A = منطقة ذروة التشتت الجانبية ؛ FSC-H = ارتفاع ذروة التشتت الأمامي ؛ FITC = فلوريسئين إيزوثيوسيانات ؛ PE = فيكوريثرين. DN = مزدوج سلبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
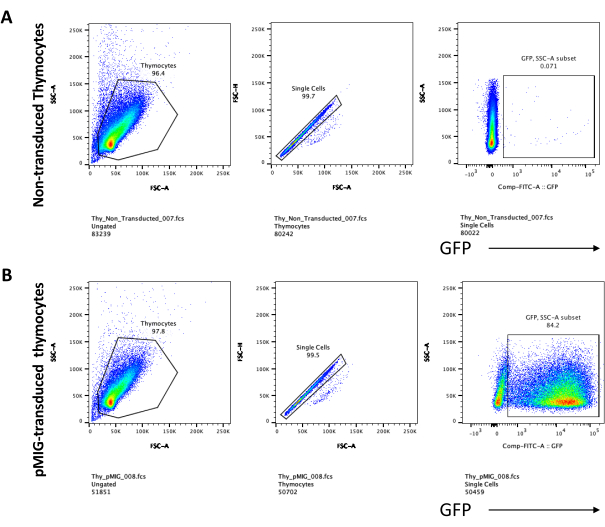
الشكل 5: قياس التدفق الخلوي للخلايا الصعترية المستحثة بعد 4 أيام من الزراعة المشتركة OP9-DL4. (أ) غير محولة و (ب) محولة بالفيروس القهقري pMIG. تم أولا إغلاق الخلايا على خلايا حية ثم بوابات بناء على الحجم والتعقيد (FCS-A و SSC-A ، على التوالي) ، متبوعا برسم FSC-H مقابل FSC-A للبوابة على الخلايا المفردة واستبعاد المزدوجات. بالنسبة للخلايا غير المنقولة ، استخدمنا استراتيجية البوابة التالية. من بوابة الخلية الواحدة ، تم تعريف الخلايا على أنها إيجابيات مفردة (CD4 + أو CD8 +) ، وإيجابيات مزدوجة (CD4 + / CD8 +) ، وسلبيات مزدوجة (CD4− / CD8−). بعد ذلك ، من بوابة السالبات المزدوجة (CD4− / CD8−) ، تم تعريف الخلايا على أنها CD44 + و CD25 + و CD44 + / CD25 + و CD44− / CD25− ، كما هو موضح في اللوحة A. بالنسبة للخلايا المحولة pMIG ، الموضحة في اللوحة B ، من البوابة أحادية الخلية ، تم تعريف الخلايا أولا على أنها GFP + / GFP− ، ثم من خلايا GFP + ، تم تحديد توزيع عدد الخلايا في مراحل تطور الخلايا التائية الرئيسية ، كما هو محدد بواسطة تعبير CD4 و CD8 و CD44 و CD25 ، باستخدام نفس استراتيجية البوابة كما هو الحال بالنسبة للخلايا غير المجلدة. الاختصارات: FSC-A = منطقة ذروة التشتت الأمامية ؛ SSC-A = منطقة ذروة التشتت الجانبية ؛ FSC-H = ارتفاع ذروة التشتت الأمامي ؛ FITC = فلوريسئين إيزوثيوسيانات ؛ GFP = بروتين الفلورسنت الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم تطوير البروتوكول الموصوف هنا خصيصا لدراسات الخلايا التائية DN المشتقة من الغدة الصعترية (CD4− / CD8−) مع نقل الفيروسات القهقرية متبوعا بنموذج تمايز OP9-DL4. ومع ذلك ، فمن المحتمل أن الخلايا المستهدفة التي ستخضع لبروتوكول التنبيغ هذا متبوعا بتمايز الخلايا سيكون لها فائدة متعددة التخصصات أوسع. وبالتالي ، بالإضافة إلى الخلايا الصعترية غير الناضجة ، يمكن استخدام الخلايا الجذعية المكونة للدم ، مثل الخلايا المشتقة من كبد الجنين أو نخاع العظام ، في هذا البروتوكول.
أثبت نظام OP9-DL4 أنه نموذج فعال لدراسة وظيفة الجينات في مجموعة متنوعة من الجوانب ، بما في ذلك تمايز الخلايا17 وتكوين الأورام15. في حين أن التعديل العكسي للفيروسات الرجعية للأسلاف المكونة للدم هو تقنية راسخة تمكن من التعديل الوراثي المستقر ، فإن الجمع بين تحريض تمايز الخلايا على نظام OP9-DL4 ونقل الفيروسات القهقرية يتطلب العناية والمهارة. الجانب الحاسم لتحقيق النجاح مع هذا البروتوكول هو ضمان تنسيق جميع الخطوات بشكل جيد ، حيث يتضمن البروتوكول استخدام ثلاثة أنواع مختلفة من الخلايا التي يجب الحفاظ عليها صحية وفي التقاء مثالي مطلوب لكل مرحلة محددة. مع وضع ذلك في الاعتبار ، من المهم إجراء جميع تحليلات نقاط تفتيش مراقبة الجودة بعد تنفيذ كل خطوة قبل الانتقال إلى الخطوة التالية. سيضمن ذلك أن جميع الخطوات تعمل. لذلك ، يعد التحقق من كفاءة الاستنفاد والنقل والنقل أمرا مهما للتنفيذ الناجح لهذا البروتوكول (انظر النتيجة النموذجية لكفاءة النقل في الشكل 4). ترتبط كفاءة نقل الخلايا الأولية الجيدة بعيار فيروسي عالي. عادة ، تؤدي الحشوات الأكبر إلى انخفاض عيار الفيروس18. لأغراض التدريب ، نستخدم متجه فارغ لتمثيل النتائج التي يمكن الحصول عليها باستخدام هذا البروتوكول. في تجربتنا ، تختلف كفاءات النقل والنقل وفقا لحجم الإدراج ، لا سيما بالنظر إلى جينات مراسل العمود الفقري الفيروسي ، مثل GFP. تتمثل إحدى الاستراتيجيات التي يمكن استخدامها عند دراسة تفاعل أكثر من جين واحد في استنساخ كل جين في ناقل نقل مختلف ، يليه إنتاج الفيروس الفردي ، وأخيرا النقل المشترك للخلية المستهدفة. في هذه الحالة ، يمكن تطبيق خطوة اختيار لإزالة الخلايا المنقولة بشكل فردي والاحتفاظ فقط بالخلايا المتحولة بشكل مشترك.
تجدر الإشارة إلى أن غالبية خطوط خلايا طبقة التغذية اللحمية OP9-DL1 / DL4 قد تمت هندستها وراثيا للتعبير عن GFP كجزء من تركيبات DL1 أو DL47. في هذا البروتوكول ، استخدمنا ناقلا للفيروسات القهقرية يعبر أيضا عن GFP. ومع ذلك ، فهو أكثر إشراقا من بروتين GFP الذي تعبر عنه خلايا OP9-DL4 ولا يتداخل مع فحص النقل عند تصور الثقافة المشتركة تحت المجهر الفلوري.
تتمايز خلايا OP9 إلى خلايا دهنية بعد العديد من الممرات ، أو فترات طويلة في الثقافة ، أو في ظل ظروف الالتقاء المفرط19. يتضح هذا من خلال تطور فجوات كبيرة. وبالتالي ، لا ينبغي استخدام خلايا OP9 التي تقدم هذه الخصائص في هذا البروتوكول. سيؤدي نقل الخلايا المنتجة للفيروسات القهقرية شديدة التلاشي إلى انخفاض عيار الفيروس. في الواقع ، المرحلة الفرعية هي عندما تكون الخلايا أكثر قابلية للنقل. علاوة على ذلك ، فإن نقل الخلايا المنتجة للفيروسات القهقرية منخفضة الالتقاء سيقلل من إجهاد الخلية في عملية النقل ويعطي أعلى عيار للفيروس.
بينما ، في هذا البروتوكول ، لا نقوم بمعايرة طاف الفيروس ، يجب مراعاة معايرة طاف الفيروس في بعض الحالات ، مثل عدم وجود جين مراسل في ناقل الفيروسات القهقرية ، مما يمنع التحديد غير المباشر للإنتاج الفيروسي ، أو في الحالات التي يتطلب فيها التصميم التجريبي عددا أكثر دقة من نسخ الجينات المحورة ليتم دمجها في جينوم الخلية المستهدفة. ومع ذلك ، من المهم ملاحظة أن عيار طافية ناقل الفيروسات القهقرية ينخفض بشكل كبير عند تخزينه عند -80 درجة مئوية أو 4 درجات مئوية حتى يتم الحصول على نتائج المعايرة. لذلك ، فإن استخدام طاف الفيروس الطازج للتنبيغ سيؤدي إلى كفاءة نقل أفضل.
تحتوي الغدة الصعترية على عدد كبير من الخلايا الصعترية المزدوجة الإيجابية (DP) (أكثر من 85٪) وحوالي 10٪ من الخلايا الأحادية الإيجابية15 (CD4 أو CD8) ، وهي خلايا الغدة الصعترية في مرحلة ما بعد DN. لا يمكن لخلايا DP البقاء على قيد الحياة في المختبر للتلاعب بالفيروسات القهقرية ، في حين أن خلايا SP غير قابلة للتحويل. لذلك ، يمكن تطبيق هذا البروتوكول لتوليد خلايا الغدة الصعترية DN القابلة للنقل من ناقلات الفيروسات القهقرية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه
Acknowledgements
تم دعم هذا العمل من قبل البرنامج الداخلي للمعهد الوطني للسرطان ، مشروع ZIABC009287. تم الحصول على OP9-DL4 من الدكتور خوان كارلوس زونيغا بفلوكر (مركز سانيبروك للعلوم الصحية ، تورنتو ، أونتاريو ، كندا). يشكر المؤلفون برنامج علوم مختبر NCI-Frederick على مساعدتهم الفنية المستمرة ونصائحهم ومدخلاتهم التجريبية ، وكذلك جيف كاريل وميغان كاروان وكيمبرلي كلارمان للمساعدة في قياس التدفق الخلوي. نحن ممتنون لهوارد يونغ على المشورة والمدخلات الهامة.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma | M3148 | |
| ACK Lysis buffer | Lonza | 10-548E | |
| BSA | Cell Signaling Technology | 9998S | |
| CD4 Microbeads | Miltenyi | 130-049-201 | |
| CD8 Microbeads | Miltenyi | 130-049-401 | |
| Centrifuge 5910R | eppendorf | 5942IP802353 | |
| DMEM | Corning | 10-013-CV | |
| EDTA | Invitrogen | 15575-038 | |
| Fetal calf serum HyClone FBS | ThermoScientific | SH30910.03 | |
| LD columns | Miltenyi | 130-042-901 | |
| L-glutamine | Sigma | G7513 | Freeze glutamine in aliquots and use freshly-thawed glutamine |
| Lipofectamine 2000 | Invitrogen | P/N 52887 | |
| MEM-alpha Medium | Gibco | 12561-072 | |
| OPTI-MEM I Reducing Serum Medium | Invitrogen | 31985-062 | |
| PBS pH 7.2 | Corning | 21-040-CV | |
| pcL-Eco Plasmid | Addgene | 12371 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| pMIG Plasmid | Addgene | 6492 | |
| Polybrene | Chemicon | TR-1003-G | |
| Pre-Separation Filters | Miltenyi | 130-041-407 | |
| recombinant hFLT-3L | PeproTech | 300-19 | |
| recombinant IL-7 | Peprotech | 217-17 | |
| Retrovial packaging cell line Phoenix-Eco | Orbigen | RVC-10002 | |
| Syringe filter (0.45 µm) | Millipore | SLHV033RS |
References
- Zuniga-Pflucker, J. C. T-cell development made simple. Nature Reviews Immunology. 4 (1), 67 (2004).
- Kodama, H., Nose, M., Niida, S., Nishikawa, S., Nishikawa, S. Involvement of the c-kit receptor in the adhesion of hematopoietic stem cells to stromal cells. Experimental Hematology. 22 (10), 979-984 (1994).
- Nakano, T., Kodama, H., Honjo, T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science. 265 (5175), 1098-1101 (1994).
- Nakano, T., Kodama, H., Honjo, T. In vitro development of primitive and definitive erythrocytes from different precursors. Science. 272 (5262), 722-724 (1996).
- Ueno, H., et al. A stromal cell-derived membrane protein that supports hematopoietic stem cells. Nature Immunology. 4 (5), 457-463 (2003).
- Jaleco, A. C., et al. Differential effects of Notch ligands Delta-1 and Jagged-1 in human lymphoid differentiation. Journal of Experimental Medicine. 194 (7), 991-1002 (2001).
- Mohtashami, M., et al. Direct comparison of Dll1- and Dll4-mediated Notch activation levels shows differential lymphomyeloid lineage commitment outcomes. Journal of Immunology. 185 (2), 867-876 (2010).
- Schmitt, T. M., Zuniga-Pflucker, J. C. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity. 17 (6), 749-756 (2002).
- Mazzucchelli, R., Durum, S. K. Interleukin-7 receptor expression: Intelligent design. Nature Reviews Immunology. 7 (2), 144-154 (2007).
- Robey, E. A., Bluestone, J. A. Notch signaling in lymphocyte development and function. Current Opinion in Immunology. 16 (3), 360-366 (2004).
- Lavaert, M., et al. Integrated scRNA-Seq identifies human postnatal thymus seeding progenitors and regulatory dynamics of differentiating immature thymocytes. Immunity. 52 (6), 1088-1104 (2020).
- Roh, K. H., Roy, K. Engineering approaches for regeneration of T lymphopoiesis. Biomaterials Research. 20 (20), (2016).
- Zlotoff, D. A., et al. CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus. Blood. 115 (10), 1897-1905 (2010).
- Holmes, R., Zuniga-Pflucker, J. C. The OP9-DL1 system: Generation of T-lymphocytes from embryonic or hematopoietic stem cells in vitro. Cold Spring Harbor Protocols. 2009 (2), (2009).
- Cramer, S. D., et al. Mutant IL-7Ralpha and mutant NRas are sufficient to induce murine T cell acute lymphoblastic leukemia. Leukemia. 32 (8), 1795-1882 (2018).
- Treanor, L. M., et al. Interleukin-7 receptor mutants initiate early T cell precursor leukemia in murine thymocyte progenitors with multipotent potential. Journal of Experimental Medicine. 211 (4), 701-713 (2014).
- Yokoyama, K., et al. In vivo leukemogenic potential of an interleukin 7 receptor alpha chain mutant in hematopoietic stem and progenitor cells. Blood. 122 (26), 4259-4263 (2013).
- Simmons, A., Alberola-Ila, J. Retroviral transduction of T cells and T cell precursors. Methods in Molecular Biology. 1323, 99-108 (2016).
- . Retroviral systems Available from: https://web.stanford.edu/group/nolan/_OldWebsite/retroviral_systems/retsys.html (2022)
- Xing, Y., Hogquist, K. A. Isolation, identification, and purification of murine thymic epithelial cells. Journal of Visualized Experiments. (90), e51780 (2014).
- Gray, D. H., et al. Developmental kinetics, turnover, and stimulatory capacity of thymic epithelial cells. Blood. 108 (12), 3777-3785 (2006).
- Godfrey, D. I., Kennedy, J., Suda, T., Zlotnik, A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3-CD4-CD8- triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. Journal of Immunology. 150 (10), 4244-4252 (1993).
- Wang, Y. B., Edinger, M., Mittar, D., McIntyre, C. Studying mouse thymocyte development using multiparametric flow cytometry: An efficient method to improve an 8-color panel on the BD FACSVerse™ system. BD Biosciences–Application Note. , (2012).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- He, X., Park, K., Kappes, D. J. The role of ThPOK in control of CD4/CD8 lineage commitment. Annual Review of Immunology. 28, 295-320 (2010).
- Wang, Y., et al. A conserved CXXC motif in CD3epsilon is critical for T cell development and TCR signaling. PLoS Biology. 7 (12), e1000253 (2009).
- Aliahmad, P., Kadavallore, A., de la Torre, B., Kappes, D., Kaye, J. TOX is required for development of the CD4 T cell lineage gene program. Journal of Immunology. 187 (11), 5931-5940 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved