Method Article
T Hücreli Lösemide Onkogenleri İncelemek için Delta Benzeri 4 Eksprese Eden Stromal Hücreler Üzerinde Murin Timositlerinin Ko-Kültürü ve Transdüksiyonu
Bu Makalede
Özet
Bu protokol, çift negatif timositlerin fare timumundan izolasyonunu, ardından daha fazla fonksiyonel analiz için delta benzeri 4 eksprese eden kemik iliği stromal hücre hattı ko-kültür sisteminde (OP9-DL4) retroviral transdüksiyon ve ko-kültürü tanımlar.
Özet
Transdüe fare olgunlaşmamış timositleri, delta benzeri 4 eksprese eden kemik iliği stromal hücre hattı ko-kültür sistemi (OP9-DL4) kullanılarak in vitro olarak T hücrelerine ayrılabilir. Retroviral transdüksiyon, transgen entegrasyonu için hücrelerin bölünmesini gerektirdiğinden, OP9-DL4, hematopoetik progenitör hücrelerin yetiştirilmesi için uygun bir in vitro ortam sağlar. Bu, normal T hücresi gelişimi ve lösemiogenez sırasında belirli bir genin ekspresyonunun etkilerini incelerken özellikle avantajlıdır, çünkü araştırmacıların transgenik fareler üretmenin zaman alıcı sürecini atlatmalarına izin verir. Başarılı sonuçlar elde etmek için, farklı hücre tiplerinin eşzamanlı manipülasyonunu içeren bir dizi koordineli adım dikkatlice gerçekleştirilmelidir. Bunlar çok iyi kurulmuş prosedürler olmasına rağmen, literatürde ortak bir kaynağın bulunmaması genellikle zaman alıcı olabilecek bir dizi optimizasyonun gerekli olduğu anlamına gelir. Bu protokolün primer timositlerin transdüksiyonunda etkili olduğu ve ardından OP9-DL4 hücrelerinde farklılaşmada etkili olduğu gösterilmiştir. Burada ayrıntılı olarak, OP9-DL4 stromal hücreleri üzerinde retroviral olarak dönüştürülmüş timositlerin ko-kültürü için hızlı ve optimize edilmiş bir rehber olarak hizmet edebilecek bir protokol bulunmaktadır.
Giriş
OP9 kemik iliği stromal hücre hattı, çeşitli progenitör kaynaklarından lenfopoez indüksiyonu için yararlı bir in vitro sistem sağlar1. OP9 hücrelerini kullanan ilk çalışmalar, makrofaj koloni uyarıcı faktör (MCSF) ekspresyonunun eksikliğinin, OP9 hücre hattının, daha sonra embriyonik kök hücreler (ESC'ler) için de gösterildiği gibi, kemik iliği kaynaklı hematopoetik kök hücrelerden (HSC'ler) hematopoez ve B hücresi farklılaşmasını destekleme yeteneğine katkıda bulunduğunu göstermiştir2,3,4,5 . Önceki çalışmalarda, delta benzeri 1/4 eksprese eden OP9 hücrelerinin (OP9-DL1 / OP9-DL4) üretilmesi, T hücre soy bağlılığı6'nın indüksiyonunu sağladı ve timik olgunlaşma 7,8'i başarılı bir şekilde özetleme yeteneğini gösterdi. Kısaca, T hücre gelişimi, CD4 ve CD8 moleküllerinin sıralı ekspresyonu ile tanımlanmıştır. Olgunlaşmamış timositler "çift negatif" tir (DN, CD4-CD8-) ve CD44 ve CD25'in yüzey ekspresyonuna göre daha da alt bölümlere ayrılabilir. DN timositleri, farelerde CD8 ekspresyonu ve insanlarda CD4 ekspresyonu ile karakterize edilen olgunlaşmamış tek pozitif (ISP) aşama ile farklılaşır, bunu CD4 ve CD8'in birlikte ekspresyonu ile karakterize edilen çift pozitif (DP) aşama ve son olarak, CD4 veya CD89'un ekspresyonu ile karakterize edilen olgun tek pozitif aşama izler. HSC'ler, normalde T soyu farklılaşmasını indüklemek için timik epitel hücrelerinde eksprese edilen delta benzeri 4 (DL4) ile etkileşime giren Notch1 reseptörünü eksprese eder10. Bu nedenle, OP9-DL1/4 modeline olan ilgi giderek artmış ve bu yaklaşımın son yirmi yılda çok çeşitli uygulamalarda yaygın olarak kullanılmasına yol açmıştır 8,11,12,13. DL1 ve DL4'ün her ikisi de in vitro T hücre farklılaşmasını destekleyebilse de, in vivo olarak diferansiyel gereksinimler gösterirler ve birkaç çalışma, fare timik ortamının özetlenmesinde OP9_DL4 OP9_DL1'den daha verimli olduğunu göstermiştir 7,14.
OP9-DL1/4 sisteminin potansiyel uygulamaları arasında, bu sistemin DN hücrelerinin veya HSC'lerin retroviral vektörlerle transdüksiyonu ile kombinasyonuna özellikle ilgi vardır. Bu kombinasyon, normal T hücresi gelişimi ve lösemiogenez sırasında gen ekspresyonunu manipüle etmenin etkili bir yoludur ve ilgilenilen bir genin işlevini indüklemek veya inhibe etmek için etkili bir yöntem olduğu gösterilmiştir15,16,17. Bu model, lösemi15'i yönlendiren onkogenler arasındaki işbirliğini incelemek için özellikle başarılı bir şekilde kullanılmıştır, çünkü esnektir ve transgenik farelerin üretilmesinin aksine, çoklu gen kombinasyonlarının etkilerinin makul bir sürede incelenmesini sağlar. Dahası, onkogenlerin normal hücrelere sokulmasının etkilerini değerlendirmek için daha önce benzer modeller kullanılmıştır15,16,17. Ek olarak, retroviral transdüksiyon, transgen entegrasyonu için hücrelerin bölünmesini gerektirir18 ve lentiviral transdüksiyon, transgen entegrasyonu için hücrelerin bölünmesi ihtiyacını ortadan kaldırarak bu sınırlamanın üstesinden gelirken, lentiviral vektörleri kullanarak DN timositlerinin başarılı bir şekilde transdüksiyonunu başaramadık. Bu nedenle, OP9-DL1 / DL4, hematopoetik progenitör hücrelerin büyümesi için uygun bir araçtır.
OP9-DL4 üzerindeki transdüse timositlerin lenfopoezi için standart protokol, başarılı bir sonuç elde etmek için dikkatlice gerçekleştirilmesi gereken bir dizi koordineli adımı içerir. Bunlar uzun yıllardır topluma iyi hizmet eden teknikler olmasına rağmen, literatürde mevcut olan protokoller genellikle parçalanmıştır. Sonuç olarak, her laboratuvar prosedürün farklı aşamalarını uyarlamak ve optimize etmek zorunda kalır ve bu da zaman alıcı olabilir. Burada, bu protokol DN timositlerinin fare timumundan izolasyonunu, ardından daha fazla fonksiyonel analiz için OP9-DL4 stromal hücrelerinde retroviral transdüksiyon ve ko-kültürü tanımlamaktadır. Bu yerleşik protokolün primer timositlerin transdüksiyonunda etkili ve tekrarlanabilir olduğu, ardından OP9-DL4 hücrelerinde farklılaşma veya T hücreli akut lenfoblastik lösemiindüksiyonu 15 olduğu gösterilmiştir.
Protokol
Açıklanan tüm hayvan deneyleri, NIH Kurumsal Biyogüvenlik Komitesi (IBC) ve Hayvan Bakımı ve Kullanımı Komitesi (ACUC) tarafından onaylanmıştır. Bu protokolde kullanılan tüm reaktifler ve malzemelerle ilgili ayrıntılar için Malzeme Tablosuna bakınız. Retrovirüs üreticisi hücre kültürü ve bakım prosedürleri hakkında daha fazla ayrıntı için yayınlanmış kılavuz19'a bakın. Protokole genel bir bakış için Şekil 1'e bakın.
1. OP9-DL4 hücrelerinin kültürünün başlatılması (Gün 1)
- OP9-DL4 hücrelerini şişeyi tutarak ve 37 ° C'de bir su banyosunda hafifçe sallayarak hızla çözün. Kriyoprotektan ajanları uzaklaştırmak için hücreleri derhal 5 mL OP9 ortamı (MEM-alfa ortamı,% 10 FBS, 50 U / mL penisilin / streptomisin, 55 μM 2-merkaptoetanol, 2 mM L-glutamin) içeren bir santrifüj tüpüne aktarın.
- Oda sıcaklığında 5 dakika boyunca 300 × g'da santrifüj. Süpernatanı atın ve hücreleri 1 mL OP9 ortamında yeniden askıya alın.
- Bir T25 şişesine 5 mL OP9 ortamı yerleştirin ve yeniden askıya alınmış hücreleri bu şişeye ekleyin. 37 °C'de kültür ve% 5 CO2.
- 2-3 gün sonra, 1: 3'lük bir bölünme kullanarak hücreleri alt kültüre alın (hücreleri her pazartesi, çarşamba ve cuma günleri geçirin).
NOT: OP9-DL4 hücrelerini birleşime ulaşmadan önce bölün. OP9-DL4 şişesi, timositlerle birlikte kültür için 6-7. günlerde ve 8-9+ günlerde% 80-90 oranında birleşmelidir. Bu nedenle, OP9-DL4 hücrelerini bölerken o günlerde kaç tane OP9-DL4 hücresine ihtiyaç duyulacağını planlamak önemlidir.- Ortamı şişeden atın ve tek katmanı 1x PBS ile yıkayın. PBS'yi atın, 1 mL% 0.25 tripsin ekleyin ve 37 ° C'de 1-5 dakika veya hücreler şişeden çıkana kadar inkübe edin. Hücreleri yerinden çıkarmak için şişeyi yumruklayın.
NOT: (İsteğe bağlı) Hücre ayrışmasının ilerlemesi mikroskopi ile kontrol edilebilir. - Tripsini inaktive etmek için 5 mL OP9 ortamı ekleyin ve yeniden süspansiyon sırasında şişenin hücre kaplı yüzeyini durulayarak hücreleri yeniden askıya alın.
- Hücre süspansiyonunu oda sıcaklığında 5 dakika boyunca 300 × g'da santrifüj edin ve 3 mL OP9 ortamında (1:3 bölünme için) tekrar askıya alın.
- Hücre süspansiyonunun 1 mL'sini, zaten 5 mL taze OP9 ortamı içeren bir T25 şişesine yerleştirin. Kalan hücreleri dondurun/atın.
- OP9-DL4 hücrelerini dondurmak için, hücreleri% 90 FBS /% 10 DMSO'da, 1 mL dondurma ortamı ile bir şişe hücre oranında yeniden askıya alın.
- Gelecekteki gereksinimlere bağlı olarak 1 mL kriyovyallerde −80 °C'de veya sıvı azotta dondurun. Uzun süreli depolama için sıvı azotta saklayın.
- Ortamı şişeden atın ve tek katmanı 1x PBS ile yıkayın. PBS'yi atın, 1 mL% 0.25 tripsin ekleyin ve 37 ° C'de 1-5 dakika veya hücreler şişeden çıkana kadar inkübe edin. Hücreleri yerinden çıkarmak için şişeyi yumruklayın.
2. Retrovirüs üreticisi hücre hattının kültürünün başlatılması (Gün 1)
- Retrovirüs üreticisi hücre hattını, şişeyi tutarak ve 37 ° C'de bir su banyosunda hafifçe sallayarak hızla çözün. Kriyoprotektan ajanı çıkarmak için hücreleri derhal 5 mL retrovirüs üreticisi hücre ortamı (RPC: DMEM,% 10 FBS) içeren bir santrifüj tüpüne aktarın.
- Oda sıcaklığında 5 dakika boyunca 300 × g'da santrifüj. Süpernatanı atın ve hücreleri 1 mL RPC ortamında yeniden askıya alın.
- Bir T25 şişesine 5 mL RPC ortamı yerleştirin ve askıya alınmış hücreleri bu şişeye ekleyin. 37 °C'de kültür ve% 5 CO2.
- Hücreleri her 2-3 günde bir 1:5 ila 1:8 arasında bir bölünmeyle geçirin.
- Hücreleri yerinden çıkarmak için şişeyi yumruklayın ve agresif bir şekilde pipetleyerek hücreleri yeniden askıya alın.
NOT: Bu hücreler, tripsin olmadan agresif pipetleme ile şişe yüzeyinden çıkarılabilir. Alternatif olarak, hücreler kolayca ayrılana ve tek hücreli bir süspansiyona kolayca pipetlenene kadar tripsin (% 0.05 tripsin / 0.53 mM EDTA) deneyin.
- Hücreleri yerinden çıkarmak için şişeyi yumruklayın ve agresif bir şekilde pipetleyerek hücreleri yeniden askıya alın.
- Hücre süspansiyonunu 5 dakika boyunca 300 × g'da santrifüj edin ve 5 mL RPC ortamında (1:5 bölünme için) yeniden askıya alın.
- Hücre süspansiyonunun 1 mL'sini, zaten 5 mL taze RPC ortamı içeren bir T25 şişesine yerleştirin. Kalan hücreleri dondurun/atın. Retrovirüs üreticisi hücreleri OP9-DL4 hücreleri için tarif edildiği şekilde dondurun (adım 1.4.4.1–1.4.4.2).
3. Retrovirüs üreticisi hücrelerin kültürüne 6 kuyucuklu plakalarda başlanması (Gün 4-5)
- Transfeksiyondan 18-24 saat önce retrovirüs üreticisi hücreleri, 2 mL RPC ortamında 6 kuyucuklu bir doku kültürü plakasının her bir kuyucuğunda% 70-90 akıcılıkta tohumlayın ve 37 ° C'de ve% 5 CO2'de inkübe edin.
NOT: Dönüştürülecek her 2-5 × 105 ila 1 × 106 timosit için retrovirüs üreticisi hücrelerin iki kuyucuğunu transfekte edin.
4. İlgili genleri içeren retrovirüsü üretmek için retrovirüs üreten hücrelerin transfekte edilmesi (Gün 5-6)
- Transfeksiyondan 1 saat önce ortamı taze RPC ortamı ile değiştirin.
- Dupopeksiyon karışımları hazırlayın (6 delikli bir plakanın her bir kuyucuğu için - gerektiğinde ölçeklendirin): 4 μg DNA'yı (2 μg yardımcı plazmid (pCL-Eco) ve 2 μg transfer plazmidini (pMIG) 250 μL indirgenmiş serum ortamında seyreltin. Yavaşça karıştırın.
- 10 μL transfeksiyon reaktifini, adım 4.2'den itibaren indirgenmiş serum ortamının 250 uL'si ile karıştırın. Oda sıcaklığında 5 dakika inkübe edin.
- 5 dakikalık inkübasyondan sonra, seyreltilmiş DNA'yı seyreltilmiş transfeksiyon reaktifi ile birleştirin (toplam hacim = 500 μL). Yavaşça karıştırın ve oda sıcaklığında 20-25 dakika inkübe edin.
- 500 μL DNA/transfeksiyon reaktifi karışımlarını, retrovirüs üreticisi hücreleri içeren kuyucuğa, dairesel bir hareketle hücrelerin üzerine bırakarak yavaşça ekleyin. Plakayı ileri geri sallayarak hafifçe karıştırın ve plakayı 37 ° C'lik bir inkübatörde 16-24 saat boyunca inkübe edin.
NOT: Subkonfluent hücreler (%80-%90) transfeksiyon için en uygun olanıdır ve potansiyel olarak en yüksek viral titreyi üretirler. Retrovirüs üreticisi hücreler şişeden çok kolay bir şekilde yerinden çıktığından, bu hücreleri tutarken ani hareketlerden kaçının.
5. Retrovirüs üreticisi hücre ortamını değiştirme (Gün 6-7)
- Transfeksiyondan yaklaşık 16 saat sonra eski ortamı 2 mL taze RPC ortamı ile değiştirin. Hücreleri 20-24 saat boyunca 37 ° C'de inkübe etmeye devam edin.
- Transfeksiyon verimliliğini floresan mikroskobu altında değerlendirin (isteğe bağlı).
NOT: Bu protokolde, GFP-pozitif hücreler ilgilenilen hücrelerdir (bkz. Şekil 2). Bu adım, bu protokolde kullanılmak üzere seçilen retrovirüs vektörüne (omurgada bir muhabir geninin bulunup bulunmadığı) bağlıdır.
6. CD4 + ve CD8 + hücrelerinin timosit hazırlanması ve tükenmesi (Gün 6-7)
- Timüsü 4-6 haftalık bir C57BL/6 fareden toplayın. Timus hasadı hakkında daha fazla bilgi için, Xing ve Hogquist20'ye bakın.
NOT: Fareler CO2 inhalasyonu ve ardından servikal çıkık ile ötenazi yapıldı. - Timüsü bir Petri kabında 5 mL PBS'ye yerleştirerek bir timosit tek hücreli süspansiyon hazırlayın. Steril cam slaytlar kullanarak, timusu slaytların buzlu yüzeyleri arasına yerleştirin ve timusu iki slayt arasında yuvarlayarak slaytları hafifçe ovalayın. Hücreleri toplamak için cam slaytları durulayın ve kalan timik stromal dokuyu atın.
NOT: Bir timustan elde edilen tahmini verim 90 × 10 6-100 × 106 hücredir ve CD4 ve CD8 tükenmesinden sonra hücrelerin yaklaşık% 1'i kalacaktır. Daha iyi bir hücre verimi için genç farelerden timus dokusu kullanın, çünkü doğumdan sonraki ilk haftalarda fare timusunun hücreselliği hızla artar, 4-6 haftalıkken bir platoya ulaşır ve daha sonra21'i aşamalı olarak içerir. Otomatik bir kan hücresi sayacı veya herhangi bir alternatif yöntem kullanarak hücreleri sayın. - Timik süspansiyonun 5 mL'sini bir hücre süzgecinden pipetleyerek timik süspansiyonu 30 μm veya 40 μm'lik bir filtreden geçirin. Hücreleri 10 dakika boyunca 300 × g'da santrifüj edin.
- Süpernatanı çıkarın ve kırmızı kan hücrelerini ACK lizis tamponu ile lize edin (numune boyutuna bağlı olarak) 1 dakika boyunca tüp başına 1 mL tampon ekleyin. ACK lizis tamponunu devre dışı bırakmak için 5 mL hücre tükenme tamponu (500 mL PBS [pH 7.2], %0.5 BSA, 2 mM 0.5M EDTA, pH 8.0) ekleyin, 10 dakika boyunca 300 × g'da santrifüj yapın ve sayım için 1-5 mL hücre tükenme tamponunda yeniden askıya alın.
NOT: Tükenmeden önce buz üzerinde aşağıdakileri bir kenara koyun (tükenme öncesi): CD4 ve CD8 için boyama ve akış sitometrisi 22,23 ile analiz ederek tükenmenin verimliliğini belirlemek için saymak için 70 μL hücre süspansiyonu (seçilen sayma hücresi yöntemine bağlı olarak değişir) ve200 μL hücre süspansiyonu. - Hücreleri sayın ve 10 dakika boyunca 300 × g'da santrifüj yapın. Hücreleri 1 × 107/80 μL hücre tükenme tamponunda yeniden askıya alın. 1 × 107 hücre başına CD4 ve CD8 mikroboncuklarının her birine 10 μL ekleyin. İyice karıştırın ve karanlıkta buzdolabında (2-8 ° C) 15 dakika inkübe edin.
- 2 mL tükenme tamponu ile durulayarak ve akışı atarak bir tükenme sütunu hazırlayın.
- 1 ×10 7 hücre başına 1-2 mL tükenme tamponu ekleyerek hücreleri adım 6.6'dan yıkayın ve 10 dakika boyunca 300 × g'da santrifüj yapın. Supernatan'ı çıkarın ve atın.
- 500 μL tükenme tamponunda 1,25 ×10 8 hücreye kadar yeniden askıya alın. Hücre süspansiyonunu sütuna uygulayın ve akışı (etiketlenmemiş hücreler) toplayın. Kolonu 2x 1 mL tamponla yıkayın ve akışı toplayın.
NOT: Yalnızca sütun rezervuarı boş olduğunda yeni arabellek ekleyin. Tükenmeden sonra buz üzerinde aşağıdakileri bir kenara koyun (tükenme sonrası kontrol): CD4 ve CD8 için boyayarak ve akış sitometrisi22,23 ile analiz ederek tükenmenin verimliliğini belirlemek için saymak için 70 μL hücre süspansiyonu (seçilen sayma hücresi yöntemine bağlı olarak değişir) ve 1.000 μL hücre süspansiyonu. - Tükenmeden önce toplanan 200 μL hücreyi dört FACS tüpüne bölerek tükenme verimliliği kontrollerini lekeleyin: lekesiz, CD4 tek boyalı, CD8 tek boyalı ve CD4 / CD8 çift boyalı (akış sitometri parametrelerini ayarlamak için lekesiz ve tek boyalı numuneleri kullanın). CD4 ve CD8 için boyamak için tükenmeden sonra toplanan 1.000 μL hücreyi kullanın ve tükenmeden önce toplanan çift boyalı numune ile karşılaştırın ( Şekil 3'teki tipik tükenme sonuçlarına bakınız).
NOT: Akış sitometri boyama hacimlerini antikor üreticisinin önerisine göre ayarlayın (örneğin, 50 μL tamponda 1 x 106 hücre başına 1 μL anti-CD4-FITC + 0,5 μL anti-CD8-PE).
7. OP9-DL4 hücrelerinde timositlerin kültürlenmesi (Gün 6-7)
- 2-5 × 105 ila 1 × 106 tükenme sonrası timositleri, sitokinler içeren OP9 ortamında% 80-90 oranında birleşik OP9-DL4 hücrelerinden oluşan bir T25 şişesine yerleştirin (10 ng / mL rekombinant IL-7 ve rekombinant hFLT-3). 37 °C'de kültür ve% 5 CO2. OP9-DL4 hücrelerinde yaklaşık 24 saat büyür.
NOT: Bu süre, T hücrelerini dönüştürülebilir hale getirmek için gereklidir ( Şekil 4'teki tipik sonuca bakın). Timositlerin ve OP9-DL4 hücrelerinin birlikte kültürlenmesinin bir T25 şişesini kontrol olarak kullanılmak üzere ayırın (dönüştürülmemiş). Transdüksiyon verimliliğini değerlendirmek için transdübe edilmemiş timositler (adım 9.1) negatif bir kontrol olarak transdübe edilmemiş timositlerle birlikte boyanacaktır. Transdüse edilmemiş timositler, transgen ekspresyonunun hücre farklılaşması üzerindeki etkisini ölçmek için de kullanılabilir. Sitokin içeren ortamı 1 ay sonra atın.
8. Retrovirüsün süpernatanttan toplanması ve timositleri dönüştürmek için kullanılması (Gün 8-9)
- 6 delikli plakayı eğerek ve süpernatanı aspire etmek için pistonu çekerken plakanın altına 3-5 mL'lik bir şırınga yerleştirerek transfekte hücrelerden retrovirüsleri içeren süpernatantı toplayın. Ortamı 2 mL taze RPC ortamı ile değiştirin. Adım 8.9'daki ikinci transdüksiyon için hücreleri 20-24 saat boyunca 37 ° C'de inkübe etmeye devam edin.
- Retrovirüs süpernatantını 0,45 μm'lik bir şırınga filtresinden geçirin ve filtratı 50 mL'lik bir tüpte toplayın.
NOT: Retroviral süpernatanı dondurmayın. Transdüksiyon için taze yapılmış bir virüs preparatı kullanın. - Timositleri ve OP9-DL4 hücrelerini şişe yüzeyinden çıkarmak için agresif pipetleme ile OP9-DL4 kültüründen timositleri toplayın. OP9-DL4 hücrelerinin çoğunu çıkarmak için hücre süspansiyonunu 40 μm'lik bir hücre süzgecinden geçirin ve filtratı 50 mL'lik bir tüpte toplayın.
NOT: OP9 hücreleri çok yapışkandır. Agresif pipetleme, OP9-DL4 hücrelerinin bir kısmını şişeden çıkarabilse de, bu işlem sırasında OP9-DL4 tek katmanının bozulması minimumdur ve OP9-DL4 hücreleri birincil timositlerden çok daha büyük olduğundan, çıkan OP9-DL4 hücreleri 40 μm hücre süzgeci ile filtrelenecektir. OP9-DL4 hücreleri hala% 80-90 oranında birleşikse, timositleri çıkarın ve aynı OP9-DL4 şişesinde yeniden plakalayın. Alternatif olarak, yeni bir OP9-DL4 şişesi hazırlanmalıdır. - Filtrattaki timositleri 8.3. adımdan itibaren 300 × g'da 5 dakika boyunca santrifüj edin. Supernatan'ı atın.
- 50 mL'lik tüpte, timositleri 0.5-1 mL OP9 ortamı + sitokinlerde yeniden askıya alın (bkz. adım 7.1). Virüsü içeren 1-2 mL RPC ortamı ekleyin (timosit ortamının iki katı kadar RPC ortamı). 8 μg heksametrin bromür / mL toplam hücre süspansiyonu elde etmek için heksametrin bromür (10 μg / μL stok konsantrasyonu) ekleyin.
- Hücreleri oda sıcaklığında 1 saat boyunca 850 × g'da santrifüj ederek spinülatın.
- Hücreleri şişe başına 6 mL OP9 ortamı + sitokinlerde yeniden askıya alın (bkz. adım 7.1) ve süspansiyonu OP9-DL4 hücre tek katmanına geri ekleyin.
NOT: Alternatif olarak, dönüştürülmüş timositleri almaya hazır yeni OP9-DL4 şişeleri bulundurun. Timositler kullanılmış bir OP9-DL4 şişesine geri yerleştirilecekse, hücreleri sağlıklı tutmak ve% 80-90 akıcılık sağlamak için 1 saatlik timosit spinokülasyonu sırasında OP9-DL4 hücrelerine taze OP9 ortamı eklediğinizden emin olun. - Gece boyunca 37 ° C'de inkübe edin.
- Retrovirüs içeren hücre süpernatanının yeni bir kuyusunu kullanarak 8.2-8.7 arasındaki adımları tekrarlayın.
9. OP9-DL4 kültüründe transdüne timositlerin 2-5 gün boyunca muhafaza edilmesi veya gerektiğinde dondurulması (Gün 9+)
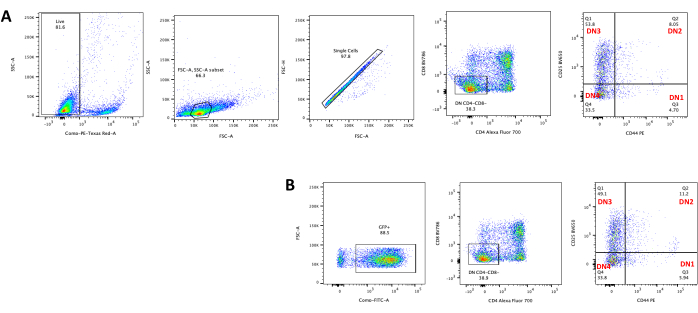
- CD4, CD8, CD25 ve CD4423 gibi T hücre gelişim belirteçleri için timositleri boyayarak akış sitometrisi ile timosit farklılaşmasını değerlendirin. Tipik timosit farklılaşma sonuçlarına Şekil 5'te bakınız.
Sonuçlar
Tükenme verimliliği, immünomanyetik hücre ayrımından (MACS) sonra CD4 ve CD8 için manyetik olarak etiketlenmemiş hücre fraksiyonunu etiketleyerek ve bunu iki boyutlu iki değişkenli bir nokta grafiği üzerinde analiz ederek akış sitometrik olarak değerlendirilebilir (Şekil 3). Çift negatif (CD4-, CD8-) hücrelerin iyi bir verimi, Şekil 3'te gösterildiği gibi% 95 veya üstüdür. Düşük verimin en yaygın nedenlerinden ikisi, hücre sayısına ve kolon kapasitesini aşan etiketli hücrelerin sayısına bağlı olarak mikroboncukların yanlış hesaplanmasıdır. Etiketli hücre sayısına göre doğru sayıda MACS sütununun seçilmesi önerilir. Timositlerle çalışırken, etiketli hücrelerin sayısı (DP ve SP hücreleri) neredeyse toplam hücre sayısına eşittir (% 96'dan fazla). Hücre sayımı otomatik bir hücre sayacında, bir Neubauer odasında veya herhangi bir alternatif yöntemle yapılabilir. Sonuç olarak, hücre sayımı için ayrılan hacimlerin, belirli makineye ve seçilen sayım yöntemine bağlı olarak ayarlanması gerekebilir.
Tükenmeden önce ve sonra mevcut olan hücrelerin sayısını belirlemek önemlidir. Bu hücre sayımları, gerekli LD tükenme kolonlarının sayısını hesaplamak ve DN timositlerini uygun sayıda OP9-DL4 şişesine eşit olarak dağıtmak için gereklidir. Akış sitometrisi kontrolleri (etiketlenmemiş hücreler, CD4 için etiketlenmiş hücreler ve CD8 için etiketlenmiş hücreler), daha fazla hücre içerdiğinden, ayrılmış tükenme öncesi numune ile gerçekleştirilebilir. Bununla birlikte, hücrelerin çoğunun sütun içinde tutulması beklendiğinden, etiketlenecek tükenme sonrası örnek daha yüksek bir hacim gerektirecektir. Sonuç olarak, seçilen etiketleme protokolüne göre ayarlamalar yapılması gerekebilir.
Bir floresan geni gibi taranabilir belirteçleri ifade eden vektörler kullanıldığında, transfeksiyon ve transdüksiyon floresan mikroskobu ile kabaca ve ampirik olarak değerlendirilebilir (Şekil 2). Transdüksiyon verimliliği, adım 8.3'te açıklandığı gibi OP9-DL4 tek katmanından timosit toplayarak ve akış sitometrisi ile bir floresan geninin ekspresyonuna bakarak analiz edilebilir. Muhabir gen olarak GFP ile boş bir retroviral vektör kullanılarak transdüksiyonun etkinliği %84.2 idi (Şekil 4).
OP9-DL4 hücrelerinde T hücre farklılaşması transdüksiyondan 4 gün sonra gözlenebilir. Akış sitometrisi genellikle, OP9-DL4 hücreleri üzerindeki ko-kültür tarafından indüklenen hücre farklılaşmasını ve / veya hücrelerin CD4, CD8, CD44 ve CD25 için etiketlendiği Şekil 5'te gösterildiği gibi transgen ekspresyonunu değerlendirmek için yapılır. Farelerde T hücresi gelişiminin moleküler ve hücresel mekanizmalarını araştırmak için yararlı olduğu gösterilen hücre yüzey molekülü etiketlemesinin birkaç olası kombinasyonu vardır24,25,26,27. Bu nedenle, floresan antikorların panelleri, ele alınan ilgi sorusuna göre değişebilir. DN timositlerinin panel B'de gösterilen boş retroviral vektör pMIG ile transdüksiyonu, panel A'da gösterilen transdüksiyon işleminde gösterilen tek pozitiflerin (CD4 + veya CD8 +), çift pozitiflerin (CD4 + / CD8 +), çift negatiflerin (CD4 − / CD8 −) ve alt aşamalarının çift negatif 1-4 (DN1-DN4) ile yaklaşık olarak aynı oranlarını sundu.
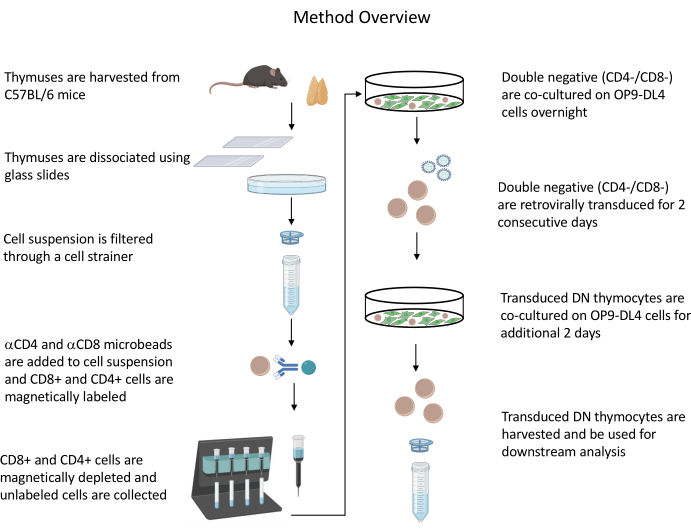
Şekil 1: Timosit izolasyonu, transdüksiyon ve ko-kültür adımlarının diyagramı. Kısaltma: DN = çift negatif. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
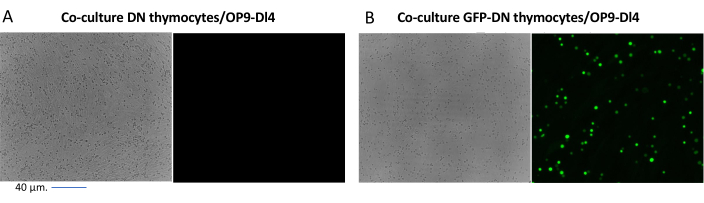
Resim 2: GFP-transdüne timositlerin veya transdüne edilmemiş timositlerin ve OP9-DL4 hücrelerinin ko-kültür floresan mikroskopisi . (A) Transdübe edilmemiş timositler ve (B) ikinci transdüksiyondan sonraki 3. günde OP9-DL4 üzerinde stabil GFP eksprese eden murin timositleri. GFP algılama için uygun 40x lensli ve 480/30 filtreli bir Olympus-IX71 floresan mikroskobu kullanıldı. Ölçek çubuğu = 40 μm. Kısaltmalar: GFP = yeşil floresan proteini; DN = çift negatif. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
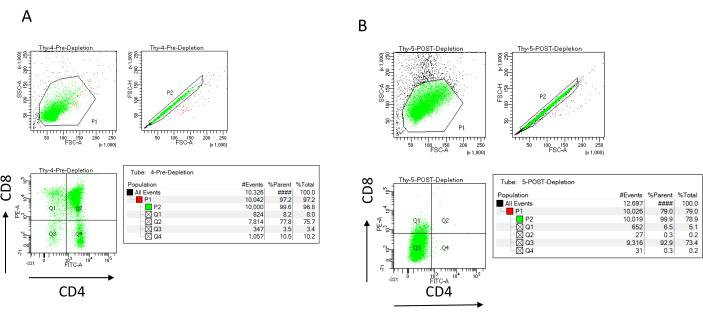
Şekil 3: Timosit tükenmesinin akım sitometrisi. 7-8 haftalık C57BL / 6J dişi farelerden elde edilen timositler üzerindeki CD4 ve CD8 ekspresyonunu analiz eden temsili akış sitometrisi grafikleri (A) ön tükenme ve (B) CD4 + ve CD8 + 'nın tükenme sonrası mikroboncuklar ve LD sütunları kullanılarak üreticinin talimatlarına göre. Soldaki nokta grafikleri, olayın boyutuna ve karmaşıklığına göre kapıları gösterir (sırasıyla FCS-A ve SSC-A). Orta panel, tek hücreleri geçitlemek ve çiftleri hariç tutmak için FSC-H ile FSC-A'yı gösterir. Sağdaki grafiklerde hücreler tek hücreli kapıdan CD4 ve CD8 olarak tanımlanmıştır. Kısaltmalar: FSC-A = ileri saçılma-tepe alanı; SSC-A = yan saçılma-tepe alanı; FSC-H = ileri saçılma-tepe yüksekliği; FITC = floresein izotiyosiyanat; PE = fikoeritrin. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Şekil 4: Timosit retroviral transdüksiyon etkinliğinin akım sitometrisi. (A) OP9-DL4 üzerinde birlikte kültüre alınan transdüse edilmemiş timositler; (B) transdüksiyon sonrası 3. günde OP9-DL4 üzerinde retroviral olarak transdübe edilmiş timositler. Kısaltmalar: FSC-A = ileri saçılma-tepe alanı; SSC-A = yan saçılma-tepe alanı; FSC-H = ileri saçılma-tepe yüksekliği; FITC = floresein izotiyosiyanat; PE = fikoeritrin; DN = çift negatif. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
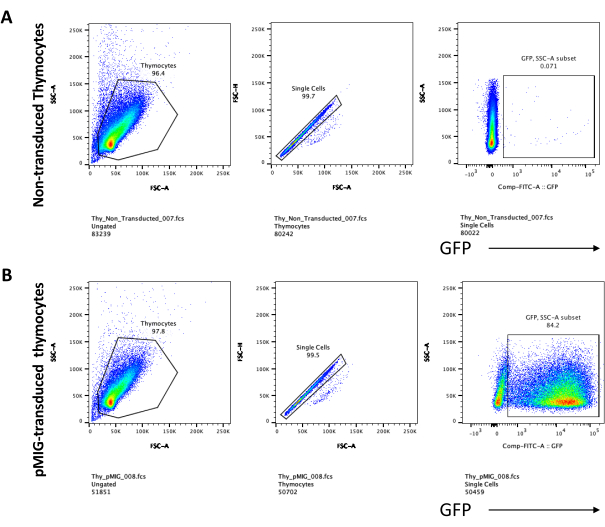
Şekil 5: OP9-DL4 ko-kültüründen 4 günlük sonra transdübe edilmiş timositlerin flowsitometrisi. (A) Transdüksiyonsuz ve (B) pMIG retrovirüs ile transdübe edilmiş. Hücreler ilk önce canlı hücreler üzerinde geçitlendi ve daha sonra boyut ve karmaşıklığa (sırasıyla FCS-A ve SSC-A) göre geçitlendi, ardından FSC-H'ye karşı FSC-A'yı tek hücrelere geçit vermek ve çiftleri dışlamak için çizdi. Dönüştürülmemiş hücreler için aşağıdaki kapı stratejisini kullandık. Tek hücreli kapıdan, hücreler tek pozitifler (CD4 + veya CD8 +), çift pozitifler (CD4 + / CD8 +) ve çift negatifler (CD4 - / CD8 - olarak tanımlandı. Daha sonra, çift negatifler (CD4 − / CD8 −) kapısından, hücreler panel A'da gösterildiği gibi CD44 +, CD25 +, CD44 + / CD25 + ve CD44 − / CD25 - olarak tanımlanmıştır. Panel B'de gösterilen pMIG transdüe hücreler için, tek hücreli kapıdan, hücreler önce GFP + / GFP - olarak tanımlandı ve daha sonra GFP + hücrelerinden, CD4, CD8, CD44 ve CD25 ekspresyonu ile tanımlandığı gibi, ana T hücresi gelişim aşamalarına hücre popülasyonu dağılımı, traduced hücrelerle aynı kapı stratejisi kullanılarak belirlendi. Kısaltmalar: FSC-A = ileri saçılma-tepe alanı; SSC-A = yan saçılma-tepe alanı; FSC-H = ileri saçılma-tepe yüksekliği; FITC = floresein izotiyosiyanat; GFP = yeşil floresan proteini. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Burada tarif edilen protokol, retroviral transfeksiyon ve ardından OP9-DL4 farklılaşma modeli ile timus kaynaklı DN (CD4-/CD8−) T hücre çalışmaları için özel olarak geliştirilmiştir. Bununla birlikte, hücre farklılaşmasının ardından bu transdüksiyon protokolüne tabi tutulacak hedef hücrelerin daha geniş bir disiplinlerarası faydaya sahip olması muhtemeldir. Bu nedenle, olgunlaşmamış timositlere ek olarak, fetal karaciğer veya kemik iliğinden türetilen hücreler gibi hematopoetik kök hücreler bu protokolde potansiyel olarak kullanılabilir.
OP9-DL4 sisteminin, hücre farklılaşması17 ve onkogenez15 dahil olmak üzere çeşitli yönlerden gen fonksiyonunu incelemek için etkili bir model olduğu kanıtlanmıştır. Hematopoetik progenitörlerin retroviral modifikasyonu, stabil genetik modifikasyonu mümkün kılan köklü bir teknik olsa da, OP9-DL4 sisteminde hücre farklılaşmasının indüksiyonu ile retroviral transdüksiyonun birleştirilmesi özen ve beceri gerektirir. Bu protokolle başarıya ulaşmanın kritik yönü, tüm adımların iyi koordine edilmesini sağlamaktır, çünkü protokol, sağlıklı tutulması gereken ve her bir spesifik aşama için gereken ideal birleşimde üç farklı hücre tipinin kullanılmasını içerir. Bunu akılda tutarak, bir sonraki adıma geçmeden önce her adımın uygulanmasından sonra tüm kalite kontrol kontrol noktası analizlerinin yapılması önemlidir. Bu, tüm adımların çalışmasını sağlayacaktır. Bu nedenle, tükenme, transfeksiyon ve transdüksiyon verimliliklerinin kontrol edilmesi, bu protokolün başarılı bir şekilde yürütülmesi için önemlidir ( Şekil 4'teki transdüksiyon verimliliği için tipik bir sonuca bakınız). İyi primer hücre transdüksiyon verimliliği, yüksek viral titre ile bağlantılıdır. Genellikle, daha büyük kesici uçlar daha düşük virüs titrelerine nedenolur 18. Eğitim amacıyla, bu protokolle elde edilebilecek sonuçları temsil etmek için boş bir vektör kullanıyoruz. Deneyimlerimize göre, transdüksiyon ve transfeksiyon verimlilikleri, özellikle GFP gibi viral omurga eksprese eden muhabir genleri göz önüne alındığında, kesici uç boyutuna göre değişir. Birden fazla genin etkileşimini incelerken kullanılabilecek bir strateji, her geni farklı bir transfer vektörüne klonlamak, ardından bireysel virüs üretimi ve son olarak hedef hücrenin birlikte transdüksiyonudur. Bu durumda, tek başına dönüştürülen hücreleri ortadan kaldırmak ve yalnızca birlikte dönüştürülen hücreleri korumak için bir seçim adımı uygulanabilir.
OP9-DL1 / DL4 stromal besleyici katman hücre hatlarının çoğunun, DL1 veya DL4 yapıları7'nin bir parçası olarak GFP'yi ifade etmek için genetik olarak tasarlandığını belirtmek gerekir. Bu protokolde, GFP'yi de ifade eden retroviral bir vektör kullandık; Bununla birlikte, OP9-DL4 hücreleri tarafından eksprese edilen GFP proteininden daha parlaktır ve floresan mikroskobu altında ko-kültürü görselleştirirken transdüksiyon muayenesine müdahale etmez.
OP9 hücreleri, birçok pasajdan sonra, kültürde uzun süreler veya aşırı akıcılık koşulları altında adipositlere farklılaşır19. Bu, büyük vakuollerin gelişimi ile kanıtlanmıştır. Bu nedenle, bu özellikleri sunan OP9 hücreleri bu protokolde kullanılmamalıdır. Aşırı derecede birleşen retrovirüs üreticisi hücrelerin transfekte edilmesi, düşük bir virüs titresine neden olacaktır. Aslında, subconfluent aşama, hücrelerin en transfektabl olduğu zamandır. Ayrıca, düşük birleşimli retrovirüs üreticisi hücrelerin transfekte edilmesi, transfeksiyon sürecindeki hücre stresini azaltacak ve en yüksek virüs titresini verecektir.
Bu protokolde, virüs süpernatanını titre etmemekle birlikte, viral üretimin dolaylı olarak belirlenmesini önleyecek retroviral vektörde bir muhabir genin bulunmaması gibi bazı durumlarda veya deneysel tasarımın hedef hücre genomuna entegre edilmesi için daha doğru sayıda transgen kopyası gerektirdiği durumlarda virüs süpernatant titrasyonu düşünülmelidir. Bununla birlikte, retroviral vektör süpernatant titresinin, titrasyon sonuçları elde edilene kadar -80 °C veya 4 °C'de depolandığında önemli ölçüde azaldığını belirtmek önemlidir. Bu nedenle, transdüksiyon için taze hazırlanmış virüs süpernatantının kullanılması daha iyi transdüksiyon verimliliği sağlayacaktır.
Timus, DN sonrası evre timositleri olan çok sayıda çift pozitif (DP) timosit (% 85'ten fazla) ve yaklaşık% 10 tek pozitif15 hücre (CD4 veya CD8) içerir. DP hücreleri retroviral manipülasyon için in vitro olarak hayatta kalamazken, SP hücreleri dönüştürülemez. Bu nedenle, bu protokol retroviral vektör transdübl DN timositleri üretmek için uygulanabilir.
Açıklamalar
Yazarların açıklayacağı herhangi bir çıkar çatışması yoktur
Teşekkürler
Bu çalışma, Ulusal Kanser Enstitüsü'nün intramural programı, ZIABC009287 projesi tarafından desteklenmiştir. OP9-DL4, Dr. Juan Carlos Zúñiga-Pflücker'den (Sunnybrook Sağlık Bilimleri Merkezi, Toronto, ON, Kanada) elde edildi. Yazarlar, NCI-Frederick Laboratuvar Hayvanları Bilimleri Programı'na sürekli teknik yardımları ve deneysel tavsiyeleri ve girdileri için ve ayrıca Jeff Carrel, Megan Karwan ve Kimberly Klarmann'a akış sitometri yardımı için teşekkür eder. Howard Young'a eleştirel tavsiyeleri ve katkıları için minnettarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma | M3148 | |
| ACK Lysis buffer | Lonza | 10-548E | |
| BSA | Cell Signaling Technology | 9998S | |
| CD4 Microbeads | Miltenyi | 130-049-201 | |
| CD8 Microbeads | Miltenyi | 130-049-401 | |
| Centrifuge 5910R | eppendorf | 5942IP802353 | |
| DMEM | Corning | 10-013-CV | |
| EDTA | Invitrogen | 15575-038 | |
| Fetal calf serum HyClone FBS | ThermoScientific | SH30910.03 | |
| LD columns | Miltenyi | 130-042-901 | |
| L-glutamine | Sigma | G7513 | Freeze glutamine in aliquots and use freshly-thawed glutamine |
| Lipofectamine 2000 | Invitrogen | P/N 52887 | |
| MEM-alpha Medium | Gibco | 12561-072 | |
| OPTI-MEM I Reducing Serum Medium | Invitrogen | 31985-062 | |
| PBS pH 7.2 | Corning | 21-040-CV | |
| pcL-Eco Plasmid | Addgene | 12371 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| pMIG Plasmid | Addgene | 6492 | |
| Polybrene | Chemicon | TR-1003-G | |
| Pre-Separation Filters | Miltenyi | 130-041-407 | |
| recombinant hFLT-3L | PeproTech | 300-19 | |
| recombinant IL-7 | Peprotech | 217-17 | |
| Retrovial packaging cell line Phoenix-Eco | Orbigen | RVC-10002 | |
| Syringe filter (0.45 µm) | Millipore | SLHV033RS |
Referanslar
- Zuniga-Pflucker, J. C. T-cell development made simple. Nature Reviews Immunology. 4 (1), 67 (2004).
- Kodama, H., Nose, M., Niida, S., Nishikawa, S., Nishikawa, S. Involvement of the c-kit receptor in the adhesion of hematopoietic stem cells to stromal cells. Experimental Hematology. 22 (10), 979-984 (1994).
- Nakano, T., Kodama, H., Honjo, T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science. 265 (5175), 1098-1101 (1994).
- Nakano, T., Kodama, H., Honjo, T. In vitro development of primitive and definitive erythrocytes from different precursors. Science. 272 (5262), 722-724 (1996).
- Ueno, H., et al. A stromal cell-derived membrane protein that supports hematopoietic stem cells. Nature Immunology. 4 (5), 457-463 (2003).
- Jaleco, A. C., et al. Differential effects of Notch ligands Delta-1 and Jagged-1 in human lymphoid differentiation. Journal of Experimental Medicine. 194 (7), 991-1002 (2001).
- Mohtashami, M., et al. Direct comparison of Dll1- and Dll4-mediated Notch activation levels shows differential lymphomyeloid lineage commitment outcomes. Journal of Immunology. 185 (2), 867-876 (2010).
- Schmitt, T. M., Zuniga-Pflucker, J. C. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity. 17 (6), 749-756 (2002).
- Mazzucchelli, R., Durum, S. K. Interleukin-7 receptor expression: Intelligent design. Nature Reviews Immunology. 7 (2), 144-154 (2007).
- Robey, E. A., Bluestone, J. A. Notch signaling in lymphocyte development and function. Current Opinion in Immunology. 16 (3), 360-366 (2004).
- Lavaert, M., et al. Integrated scRNA-Seq identifies human postnatal thymus seeding progenitors and regulatory dynamics of differentiating immature thymocytes. Immunity. 52 (6), 1088-1104 (2020).
- Roh, K. H., Roy, K. Engineering approaches for regeneration of T lymphopoiesis. Biomaterials Research. 20 (20), (2016).
- Zlotoff, D. A., et al. CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus. Blood. 115 (10), 1897-1905 (2010).
- Holmes, R., Zuniga-Pflucker, J. C. The OP9-DL1 system: Generation of T-lymphocytes from embryonic or hematopoietic stem cells in vitro. Cold Spring Harbor Protocols. 2009 (2), (2009).
- Cramer, S. D., et al. Mutant IL-7Ralpha and mutant NRas are sufficient to induce murine T cell acute lymphoblastic leukemia. Leukemia. 32 (8), 1795-1882 (2018).
- Treanor, L. M., et al. Interleukin-7 receptor mutants initiate early T cell precursor leukemia in murine thymocyte progenitors with multipotent potential. Journal of Experimental Medicine. 211 (4), 701-713 (2014).
- Yokoyama, K., et al. In vivo leukemogenic potential of an interleukin 7 receptor alpha chain mutant in hematopoietic stem and progenitor cells. Blood. 122 (26), 4259-4263 (2013).
- Simmons, A., Alberola-Ila, J. Retroviral transduction of T cells and T cell precursors. Methods in Molecular Biology. 1323, 99-108 (2016).
- . Retroviral systems Available from: https://web.stanford.edu/group/nolan/_OldWebsite/retroviral_systems/retsys.html (2022)
- Xing, Y., Hogquist, K. A. Isolation, identification, and purification of murine thymic epithelial cells. Journal of Visualized Experiments. (90), e51780 (2014).
- Gray, D. H., et al. Developmental kinetics, turnover, and stimulatory capacity of thymic epithelial cells. Blood. 108 (12), 3777-3785 (2006).
- Godfrey, D. I., Kennedy, J., Suda, T., Zlotnik, A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3-CD4-CD8- triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. Journal of Immunology. 150 (10), 4244-4252 (1993).
- Wang, Y. B., Edinger, M., Mittar, D., McIntyre, C. Studying mouse thymocyte development using multiparametric flow cytometry: An efficient method to improve an 8-color panel on the BD FACSVerse™ system. BD Biosciences–Application Note. , (2012).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- He, X., Park, K., Kappes, D. J. The role of ThPOK in control of CD4/CD8 lineage commitment. Annual Review of Immunology. 28, 295-320 (2010).
- Wang, Y., et al. A conserved CXXC motif in CD3epsilon is critical for T cell development and TCR signaling. PLoS Biology. 7 (12), e1000253 (2009).
- Aliahmad, P., Kadavallore, A., de la Torre, B., Kappes, D., Kaye, J. TOX is required for development of the CD4 T cell lineage gene program. Journal of Immunology. 187 (11), 5931-5940 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır