Method Article
T細胞白血病における癌遺伝子研究のためのデルタ様4発現間質細胞上でのマウス胸腺細胞の共培養と形質導入
要約
このプロトコルでは、マウス胸腺からのダブルネガティブ胸腺細胞の単離とそれに続くレトロウイルス形質導入、およびさらなる機能分析のためのデルタ様4発現骨髄間質細胞株共培養システム(OP9-DL4)での共培養について説明します。
要約
形質導入されたマウス未熟胸腺細胞は、デルタ様4発現骨髄間質細胞株共培養系(OP9-DL4)を用いてインビトロでT細胞に分化させることができる。レトロウイルス形質導入は導入遺伝子組み込みのために細胞を分割する必要があるため、OP9-DL4は造血前駆細胞を培養するのに適した in vitro 環境を提供します。これは、研究者がトランスジェニックマウスを生成する時間のかかるプロセスを回避することを可能にするので、正常なT細胞発生および白血球形成の間の特定の遺伝子の発現の影響を研究する場合に特に有利である。成功した結果を達成するためには、異なるタイプの細胞の同時操作を含む一連の調整されたステップを慎重に実行しなければならない。これらは非常に確立された手順ですが、文献に共通の情報源がないため、多くの場合、一連の最適化が必要であり、時間がかかる可能性があります。このプロトコルは、初代胸腺細胞の形質導入とそれに続くOP9-DL4細胞での分化において効率的であることが示されています。ここで詳述されているのは、OP9-DL4間質細胞上でのレトロウイルス形質導入胸腺細胞の共培養のための迅速かつ最適化されたガイドとして役立つことができるプロトコルです。
概要
OP9骨髄間質細胞株は、いくつかの前駆細胞源からのリンパ球形成の誘導に有用なin vitroシステムを提供します1。OP9細胞を使用した最初の研究では、マクロファージコロニー刺激因子(MCSF)の発現の欠如が、後に胚性幹細胞(ESC)でも示されたように、骨髄由来造血幹細胞(HSC)からの造血およびB細胞分化をサポートするOP9細胞株の能力に寄与することが実証されました2,3,4,5。.以前の研究では、デルタ様1/4発現OP9細胞(OP9-DL1/OP9-DL4)の生成により、T細胞系譜コミットメントの誘導が可能になり6、胸腺成熟を正常に再現する能力が実証されました7,8。簡単に言えば、T細胞の発生は、CD4およびCD8分子の逐次発現によって説明されている。未熟胸腺細胞は「ダブルネガティブ」(DN、CD4−CD8−)であり、CD44およびCD25の表面発現に従ってさらに細分化することができる。DN胸腺細胞は、マウスにおけるCD8発現およびヒトにおけるCD4を特徴とする未成熟シングルポジティブ(ISP)段階を経て分化し、続いてCD4およびCD8の共発現を特徴とする二重陽性(DP)段階、そして最後に、CD4またはCD8の発現を特徴とする成熟シングルポジティブ段階9。造血幹細胞はNotch1受容体を発現し、これは通常、胸腺上皮細胞上に発現するデルタ様4(DL4)と相互作用してT系統分化を誘導する10。したがって、OP9-DL1/4モデルへの関心は徐々に高まり、過去20年間でさまざまなアプリケーションでこのアプローチが広く使用されるようになりました8,11,12,13。DL1とDL4はどちらもインビトロでT細胞分化をサポートすることができますが、インビボでは異なる要件を示し、いくつかの研究では、マウス胸腺環境を再現するのにOP9_DL4 OP9_DL1よりも効率的であることが示唆されています7,14。
OP9-DL1/4システムの潜在的なアプリケーションの中で、このシステムとDN細胞またはHSCのレトロウイルスベクターによる形質導入との組み合わせに特に関心があります。この組み合わせは、正常なT細胞発生および白血球発生の間に遺伝子発現を操作する効果的な方法であり、目的の遺伝子の機能を誘導または阻害する効率的な方法であることが示されている15、16、17。このモデルは、トランスジェニックマウスの作製とは対照的に、柔軟性があり、複数の遺伝子の組み合わせの効果を妥当な時間で検査できるため、白血病15を引き起こす癌遺伝子間のコラボレーションの研究に特に成功しています。さらに、同様のモデルが、正常細胞に癌遺伝子を導入する効果を評価するために以前に使用されてきた15、16、17。さらに、レトロウイルス形質導入は導入遺伝子統合のために細胞分裂を必要とし18、レンチウイルス形質導入は導入遺伝子統合のために細胞を分裂させる必要性を排除することによってこの制限を克服するが、レンチウイルスベクターを用いたDN胸腺細胞の形質導入を成功させることができなかった。したがって、OP9-DL1/DL4は造血前駆細胞を増殖させるのに適したツールである。
OP9-DL4上の形質導入胸腺細胞のリンパ球形成のための標準プロトコルは、成功した結果を達成するために慎重に実行されなければならない一連の調整されたステップを含む。これらは長年にわたってコミュニティに役立ってきた技術ですが、文献で利用可能なプロトコルは断片化されていることがよくあります。その結果、各検査室は手順のさまざまな段階を適応させ最適化することを余儀なくされ、時間がかかる可能性があります。ここでは、このプロトコルは、マウス胸腺からのDN胸腺細胞の単離、それに続くレトロウイルス形質導入およびさらなる機能分析のためのOP9-DL4間質細胞上での共培養について説明しています。この確立されたプロトコルは、初代胸腺細胞の形質導入、それに続くOP9-DL4細胞での分化またはT細胞急性リンパ芽球性白血病の誘導において効率的かつ再現性があることが示されています15。
プロトコル
記載されているすべての動物実験は、NIH機関バイオセーフティ委員会(IBC)および動物管理および使用委員会(ACUC)によって承認されました。このプロトコルで使用されるすべての試薬と材料に関連する詳細については、 材料表 を参照してください。レトロウイルス産生細胞の培養および維持手順の詳細については、公開されているガイドライン19を参照してください。プロトコルの概要については、 図 1 を参照してください。
1. OP9-DL4細胞の培養開始(1日目)
- バイアルを保持し、37°Cの水浴中で穏やかに振とうすることにより、OP9-DL4細胞を迅速に解凍します。 直ちに細胞を5 mLのOP9培地(MEM-α培地、10%FBS、50 U/mLペニシリン/ストレプトマイシン、55 μM 2-メルカプトエタノール、2 mM L-グルタミン)を入れた遠沈管に移し、凍結保護剤を除去します。
- 室温で300 × g で5分間遠心分離します。上清を捨て、細胞を1 mLのOP9培地に再懸濁します。
- 5 mLのOP9培地をT25フラスコに入れ、再懸濁した細胞をこのフラスコに加えます。37°Cおよび5%CO2で培養する。
- 2〜3日後、1:3スプリットを使用して細胞を継代培養します(毎週月曜日、水曜日、金曜日に細胞を通過します)。
注:OP9-DL4セルは、コンフルエントに達する前に分割します。OP9-DL4フラスコは、胸腺細胞との共培養のために、6〜7日目および8〜9日目に80%〜90%コンフルエントでなければなりません。したがって、OP9-DL4セルを分割しながら、その日に必要となるOP9-DL4セルの数を計画することが重要です。- フラスコから培地を廃棄し、単層を1x PBSで洗浄します。PBSを廃棄し、1 mLの0.25%トリプシンを加え、37°Cで1〜5分間、または細胞がフラスコから外れるまでインキュベートします。フラスコを叩いて細胞を取り除きます。
注:(オプション)細胞解離の進行状況は顕微鏡で確認できます。 - 5mLのOP9培地を加えてトリプシンを不活性化し、再懸濁中にフラスコの細胞で覆われた表面をすすぎ、細胞を再懸濁します。
- 細胞懸濁液を室温で300 × g で5分間遠心分離し、3 mLのOP9培地に再懸濁します(1:3分割の場合)。
- 1 mLの細胞懸濁液を、5 mLの新しいOP9培地がすでに含まれているT25フラスコに入れます。残りのセルをフリーズ/破棄します。
- OP9-DL4細胞を凍結するには、細胞1バイアルに対して凍結培地1 mLの比率で、細胞を90%FBS/10%DMSOに再懸濁します。
- 将来の要件に応じて、-80°Cの1 mLクライオバイアルまたは液体窒素で凍結します。長期保存のために液体窒素で保管してください。
- フラスコから培地を廃棄し、単層を1x PBSで洗浄します。PBSを廃棄し、1 mLの0.25%トリプシンを加え、37°Cで1〜5分間、または細胞がフラスコから外れるまでインキュベートします。フラスコを叩いて細胞を取り除きます。
2. レトロウイルス産生細胞株の培養開始(1日目)
- バイアルを保持し、37°Cの水浴中で穏やかに振とうすることにより、レトロウイルス産生細胞株を迅速に解凍します。 直ちに細胞を5 mLのレトロウイルス産生細胞培地(RPC:DMEM、10%FBS)を入れた遠沈管に移し、凍結保護剤を除去します。
- 室温で300 × g で5分間遠心分離します。上清を捨て、細胞を1 mLのRPC培地に再懸濁します。
- 5 mLのRPC培地をT25フラスコに入れ、再懸濁した細胞をこのフラスコに加えます。37°Cおよび5%CO2で培養する。
- 2〜3日ごとに1:5から1:8の分割で細胞を通過させます。
- フラスコを叩いて細胞を取り除き、積極的にピペッティングして細胞を再懸濁します。
注:これらの細胞は、トリプシンを使用せずに積極的なピペッティングを行うことでフラスコ表面から除去できます。あるいは、細胞が容易に剥離し、単一細胞懸濁液に容易にピペットで入れられるようになるまでトリプシン処理(0.05%トリプシン/0.53 mM EDTA)します。
- フラスコを叩いて細胞を取り除き、積極的にピペッティングして細胞を再懸濁します。
- 細胞懸濁液を300 × g で5分間遠心分離し、5 mLのRPC培地に再懸濁します(1:5分割の場合)。
- 1 mLの細胞懸濁液を、すでに5 mLの新しいRPC培地が入っているT25フラスコに入れます。残りのセルをフリーズ/破棄します。OP9-DL4細胞について説明したのと同じ方法でレトロウイルス産生細胞を凍結します(ステップ1.4.4.1–1.4.4.2)。
3. 6ウェルプレートでのレトロウイルス産生細胞の培養開始(4〜5日目)
- トランスフェクションの18〜24時間前に、6ウェル組織培養プレートの各ウェルに70%〜90%のコンフルエンシーでレトロウイルス産生細胞を2 mLのRPC培地に播種し、37°Cおよび5%CO2でインキュベートします。
注:形質導入される胸腺細胞2〜5×105 〜1×106 胸腺細胞ごとに、レトロウイルス産生細胞の2つのウェルをトランスフェクトします。
4.レトロウイルス産生細胞をトランスフェクトして、目的の遺伝子を含むレトロウイルスを生成します(5〜6日目)
- トランスフェクションの1時間前に培地を新しいRPC培地と交換します。
- リポフェクション混合物を調製します(6ウェルプレートの各ウェルに対して、必要に応じてスケールアップします):250 μLの還元血清培地で4 μgのDNA(ヘルパープラスミド(pCL-Eco)2 μgおよびトランスファープラスミド(pMIG)2 μg)を希釈します。穏やかに混ぜる。
- 10 μLのトランスフェクション試薬をステップ4.2の還元血清培地250 uLと混合します。室温で5分間インキュベートします。
- 5分間のインキュベーション後、希釈したDNAを希釈トランスフェクション試薬(総容量=500 μL)と結合します。穏やかに混合し、室温で20〜25分間インキュベートします。
- 500 μLのDNA/トランスフェクション試薬混合物を、レトロウイルス産生細胞を含むウェルに円を描くように滴下し、穏やかに加えます。プレートを前後に揺らして穏やかに混合し、プレートを37°Cのインキュベーターで16〜24時間インキュベートします。
注:サブコンフルエント細胞(80%〜90%)はトランスフェクションに最も適しており、最高のウイルス力価を生成する可能性があります。レトロウイルス産生細胞はフラスコから非常に簡単に外れるため、これらの細胞を取り扱うときは突然の動きを避けてください。
5.レトロウイルス産生細胞培地の変更(6〜7日目)
- トランスフェクションの約16時間後に古い培地を2 mLの新しいRPC培地と交換します。細胞を37°Cで20〜24時間インキュベートし続けます。
- トランスフェクション効率を蛍光顕微鏡で評価します(オプション)。
注:このプロトコルでは、GFP陽性細胞が目的の細胞です( 図2を参照)。このステップは、このプロトコルで使用するために選択されたレトロウイルスベクター(レポーター遺伝子が骨格に存在するかどうか)に依存する。
6.胸腺細胞の調製とCD4 +およびCD8 +細胞の枯渇(6〜7日目)
- 4〜6週齢のC57BL / 6マウスから胸腺を採取します。胸腺の収穫の詳細については、XingとHogquist20を参照してください。
注:マウスは、CO2 吸入とそれに続く頸部脱臼によって安楽死させた。 - 胸腺をペトリ皿中の5mLのPBSに入れることにより、胸腺細胞単一細胞懸濁液を調製する。滅菌ガラススライドを使用して、スライドのつや消し表面の間に胸腺を置き、スライドを静かにこすり合わせて、2つのスライドの間で胸腺を転がします。スライドガラスをすすぎ、細胞を収集し、残りの胸腺間質組織を廃棄します。
注:1つの胸腺からの推定収量は90 × 106–100 ×10 6 細胞であり、CD4およびCD8の枯渇後も細胞の約1%が残ります。生後最初の数週間のマウス胸腺の細胞性は急速に増加し、4〜6週齢でプラトーに達し、その後徐々に退縮するため、若いマウスの胸腺組織を使用して細胞の収量を向上させます21。自動血球カウンターまたは任意の代替方法を使用して細胞をカウントします。 - 胸腺懸濁液5 mLを細胞ストレーナーに通してピペッティングすることにより、胸腺懸濁液を30 μmまたは40 μmのフィルターでろ過します。細胞を300 × g で10分間遠心分離します。
- 上清を除去し、チューブあたり1 mLのバッファーを(サンプルサイズに応じて)1分間添加して、ACK溶解バッファーで赤血球を溶解します。5 mLの細胞枯渇バッファー(500 mLのPBS [pH 7.2]、0.5% BSA、2 mM 0.5M EDTA、pH 8.0)を加えてACK溶解バッファーを不活性化し、300 × g で10分間遠心分離し、カウントのために1〜5 mLの細胞枯渇バッファーに再懸濁します。
注:枯渇前(枯渇前)に氷上で以下を取っておきます:カウントする70 μLの細胞懸濁液(選択したカウント細胞方法によって異なります)およびCD4およびCD8の染色およびフローサイトメトリーによる分析による枯渇の効率を決定するための200 μLの細胞懸濁液22,23。 - 細胞をカウントし、300 × g で10分間遠心分離します。細胞を1×107/80 μLの細胞枯渇バッファーで再懸濁します。CD4およびCD8マイクロビーズを1細胞あたり10μL×107 細胞ずつ添加します。よく混ぜ合わせ、冷蔵庫(2〜8°C)の暗所で15分間インキュベートします。
- 2 mLのデプレッションバッファーですすぎ、フロースルーを廃棄して、デプレッションカラムを準備します。
- ステップ6.6の細胞を1×107 細胞あたり1〜2 mLの枯渇バッファーを加えて洗浄し、300 × g で10分間遠心分離します。上清を取り除いて廃棄する。
- 最大 1.25 × 108 細胞 を 500 μL の空乏バッファーに再懸濁します。細胞懸濁液をカラムに塗布し、フロースルー(標識されていない細胞)を回収します。カラムを1 mLのバッファーで2回洗浄し、フロースルーを回収します。
注: カラムリザーバーが空の場合にのみ、新しいバッファーを追加してください。枯渇後の氷上で以下を取っておきます(枯渇後のコントロール):カウントする70 μLの細胞懸濁液(選択したカウント細胞方法に応じてこれが異なります)およびCD4およびCD8の染色およびフローサイトメトリーによる分析により枯渇の効率を決定するための1,000 μLの細胞懸濁液22,23。 - 枯渇前に採取した200 μLの細胞を、非染色、CD4単一染色、CD8単一染色、CD4/CD8二重染色の4つのFACSチューブに分割して、枯渇効率コントロールを染色します(フローサイトメトリーパラメーターを設定するには、非染色サンプルと単一染色サンプルを使用します)。枯渇後に採取した1,000 μLの細胞を使用してCD4およびCD8を染色し、枯渇前に採取した二重染色サンプルと比較します( 図3の典型的な枯渇結果を参照)。
注:抗体メーカーの推奨に従って、フローサイトメトリー染色の容量を調整します(例:50 μLのバッファーに1 x 106 細胞あたり1 μLの抗CD4-FITC+ 0.5 μLの抗CD8-PE)。
7. OP9-DL4細胞での胸腺細胞の培養(6〜7日目)
- サイトカイン(10 ng/mL組換えIL-7および組換えhFLT-3)を含むOP9培地中の80%〜90%コンフルエントなOP9-DL4細胞のT25フラスコに、2〜5×105 〜×106 個の枯渇後胸腺細胞を入れます。37°Cおよび5%CO2で培養する。OP9-DL4細胞上で約24時間増殖します。
注:この期間は、T細胞を形質導入可能にするために必要です( 図4の典型的な結果を参照)。胸腺細胞とOP9-DL4細胞の共培養用のT25フラスコを1つ予約し、コントロールとして使用する(形質導入されていない)。形質導入されていない胸腺細胞を陰性対照として形質導入胸腺細胞とともに染色し(ステップ9.1)、形質導入効率を評価する。形質導入されていない胸腺細胞は、細胞分化に対する導入遺伝子発現の影響を測定するためにも使用することができる。サイトカイン含有培地は1ヶ月後に廃棄してください。
8.上清からレトロウイルスを採取し、それを使用して胸腺細胞を形質導入する(8〜9日目)
- 6ウェルプレートを傾け、プランジャーを引っ張って上清を吸引しながらプレートの下部に3〜5 mLシリンジを配置して、トランスフェクトされた細胞からレトロウイルスを含む上清を収集します。培地を2 mLの新しいRPC培地と交換します。細胞を37°Cで20〜24時間インキュベートし続け、ステップ8.9の2回目の形質導入を行います。
- レトロウイルス上清を0.45 μmシリンジフィルターでろ過し、ろ液を50 mLチューブに回収します。
注:レトロウイルス上清を凍結しないでください。形質導入のために作りたてのウイルス製剤を使用してください。 - 積極的なピペッティングによりOP9-DL4培養物から胸腺細胞を収集し、フラスコ表面から胸腺細胞およびOP9-DL4細胞を除去した。細胞懸濁液を40 μmセルストレーナーでろ過してOP9-DL4細胞の大部分を除去し、ろ液を50 mLチューブに回収します。
注:OP9細胞は非常に接着性があります。積極的なピペッティングはフラスコからOP9-DL4細胞の一部を除去する可能性がありますが、このプロセス中のOP9-DL4単層の破壊は最小限であり、OP9-DL4細胞は初代胸腺細胞よりもはるかに大きいため、外れたOP9-DL4細胞は40μm細胞ストレーナーでろ過されます。OP9-DL4細胞がまだ80%〜90%コンフルエントである場合は、胸腺細胞を除去し、同じOP9-DL4フラスコに再プレートします。あるいは、新しいOP9-DL4フラスコを準備する必要があります。 - ステップ8.3の濾液中の胸腺細胞を300 × g で5分間遠心分離します。上澄み液を捨てる。
- 50 mLチューブで、胸腺細胞を0.5〜1 mLのOP9培地+サイトカインに再懸濁します(ステップ7.1を参照)。ウイルスを含むRPC培地を1〜2 mL追加します(胸腺細胞培地の2倍のRPC培地)。臭化ヘキサメトリン(10 μg/μLストック濃度)を加えて、8 μgの臭化ヘキサメトリン/mLの全細胞懸濁液を生成します。
- 細胞を850 × g で室温で1時間遠心分離してスピン植します。
- フラスコあたり6 mLのOP9培地+サイトカインに細胞を再懸濁し(ステップ7.1を参照)、懸濁液をOP9-DL4細胞単層に戻します。
注:または、形質導入された胸腺細胞を受け取る準備ができている新しいOP9-DL4フラスコを用意します。胸腺細胞を使用済みのOP9-DL4フラスコに戻す場合は、胸腺細胞の脊髄分泌の1時間中にOP9-DL4細胞に新しいOP9培地を追加して、細胞を健康に保ち、80%〜90%のコンフルエントを確保してください。 - 37°Cで一晩インキュベートします。
- レトロウイルス含有細胞上清の新しいウェルを使用して、手順8.2〜8.7を繰り返します。
9. 形質導入した胸腺細胞をOP9-DL4培養で2〜5日間維持するか、必要に応じて凍結します(9日目+)
- CD4、CD8、CD25、CD44などのT細胞発生マーカーについて胸腺細胞を染色することにより、フローサイトメトリーによって胸腺細胞の分化を評価します23。 図5の典型的な胸腺細胞分化結果を参照されたい。
結果
免疫磁気細胞分離後のCD4およびCD8の磁気的に非標識細胞画分(MACS)を標識し、これを2次元二変量ドットプロットで解析することにより、枯渇効率をフローサイトメトリーで評価できます(図3)。ダブルネガティブ(CD4−、CD8−)細胞の良好な収率は、図3に示すように95%以上である。収率低下の最も一般的な原因の2つは、細胞数とカラム容量を超える標識細胞数に基づくマイクロビーズの誤計算です。ラベル付けされたセルの数に応じて、正しい数のMACS列を選択することをお勧めします。胸腺細胞を扱う場合、標識細胞(DP細胞およびSP細胞)の数は全細胞数とほぼ同じです(96%以上)。細胞カウントは、自動セルカウンター、ノイバウアーチャンバー、または任意の代替方法で行うことができます。その結果、セルカウントに割り当てられるボリュームは、特定のマシンと選択したカウント方法に応じて調整する必要がある場合があります。
枯渇の前後に存在する細胞の数を決定することが重要です。これらの細胞数は、必要なLD枯渇カラムの数を計算し、DN胸腺細胞を適切な数のOP9-DL4フラスコに均等に分配するために必要です。フローサイトメトリーのコントロール(非標識細胞、CD4で標識された細胞、およびCD8で標識された細胞)は、より多くの細胞が含まれているため、予約済みの枯渇前サンプルを使用して実行できます。ただし、ほとんどの細胞はカラム内に保持されることが予想されるため、標識する枯渇後のサンプルには、より高い容量が必要になります。したがって、選択したラベリングプロトコルに従って調整を行う必要がある場合があります。
蛍光遺伝子などのスクリーニング可能なマーカーを発現するベクターを使用する場合、トランスフェクションと形質導入は、蛍光顕微鏡によって大まかかつ経験的に評価できます(図2)。形質導入効率は、ステップ8.3に記載されているように、OP9-DL4単層から胸腺細胞を採取し、フローサイトメトリーによって蛍光遺伝子の発現を調べることによって分析できます。GFPをレポーター遺伝子とする空のレトロウイルスベクターを用いた形質導入の効率は84.2%でした(図4)。
OP9-DL4細胞上のT細胞分化は、形質導入の4日後に観察することができる。フローサイトメトリーは通常、OP9-DL4細胞での共培養および/または導入遺伝子発現によって誘導される細胞分化を評価するために行われ、図5に示すように、細胞をCD4、CD8、CD44、およびCD25で標識しました。マウスにおけるT細胞発生の分子的および細胞的メカニズムを調査するのに有用であることが示されている細胞表面分子標識のいくつかの可能な組み合わせがある24、25、26、27。したがって、蛍光抗体のパネルは、対処される関心のある問題に応じて変化し得る。パネルBに示されている空のレトロウイルスベクターpMIGによるDN胸腺細胞の形質導入は、パネルAに示す非形質導入胸腺細胞とほぼ同じ割合の単一陽性(CD4+またはCD8+)、二重陽性(CD4+/CD8+)、および二重陰性1–4(DN1–DN4)を示し、T細胞の発生が形質導入プロセスの影響を受けなかったことを示しています。
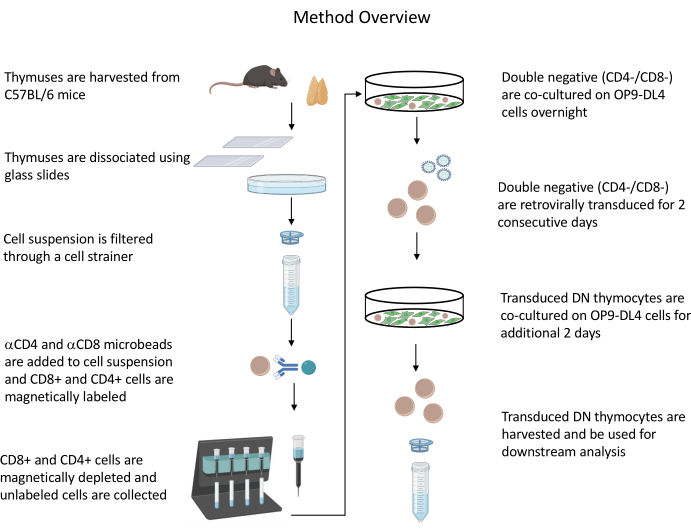
図1:胸腺細胞の単離、形質導入、共培養のステップの図。 省略形: DN = 二重負。この図の拡大版を表示するには、ここをクリックしてください。
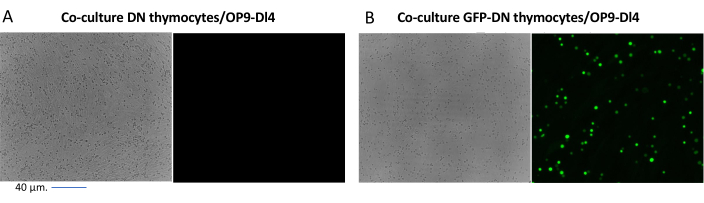
図2: GFP形質導入胸腺細胞または非形質導入胸腺細胞とOP9-DL4細胞の共培養 蛍光顕微鏡。 (A)2回目の形質導入後3日目にOP9-DL4上に形質導入されていない胸腺細胞および(B)安定なGFP発現マウス胸腺細胞。GFP検出に適した40倍レンズと480/30フィルターを備えたオリンパス-IX71蛍光顕微鏡を使用しました。スケールバー= 40μm。略語:GFP =緑色蛍光タンパク質;DN = 二重負。この図の拡大版を表示するには、ここをクリックしてください。
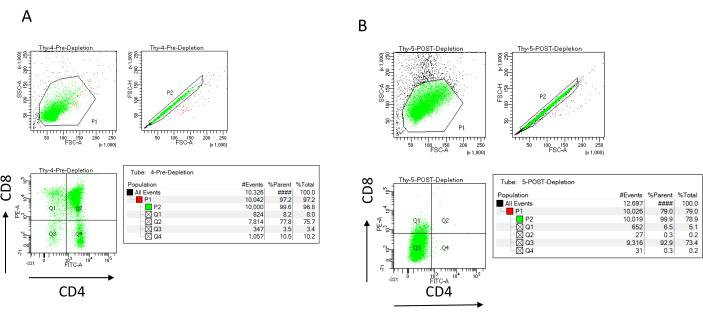
図3:胸腺細胞枯渇のフローサイトメトリー。 7〜8週齢のC57BL/6J雌マウスから得られた胸腺細胞上のCD4およびCD8の発現を分析する代表的なフローサイトメトリープロット(A)枯渇前および(B)CD4+およびCD8+の枯渇後、製造元の指示に従ってマイクロビーズおよびLDカラムを使用します。左側のドットプロットは、イベントのサイズと複雑さ(それぞれFCS-AとSSC-A)に基づくゲートを示しています。中央のパネルは、単一細胞をゲートし、ダブレットを除外するためのFSC-HとFSC-Aを示しています。右のプロットでは、細胞は単一細胞ゲートからCD4およびCD8として定義されました。略語:FSC-A =前方散乱ピーク面積;SSC-A = 側方散乱ピーク面積;FSC-H = 前方散乱ピークの高さ;FITC=フルオレセインイソチオシアネート;PE =フィコエリスリン。この図の拡大版を表示するには、ここをクリックしてください。
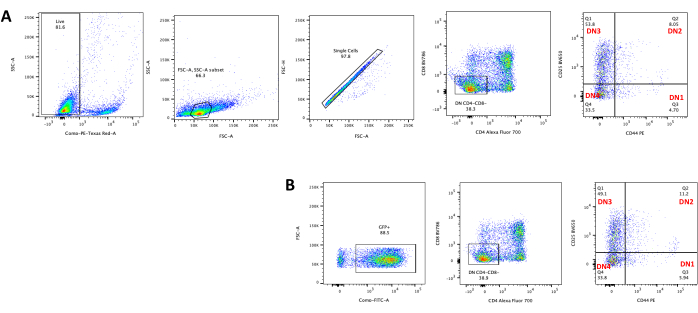
図4:胸腺細胞レトロウイルス形質導入効率のフローサイトメトリー。 (a)OP9-DL4上で共培養された形質導入されていない胸腺細胞;(B)形質導入後3日目にOP9-DL4上の胸腺細胞をレトロウイルス形質導入した。略語:FSC-A =前方散乱ピーク面積;SSC-A = 側方散乱ピーク面積;FSC-H = 前方散乱ピークの高さ;FITC=フルオレセインイソチオシアネート;PE =フィコエリスリン;DN = 二重負。 この図の拡大版を表示するには、ここをクリックしてください。
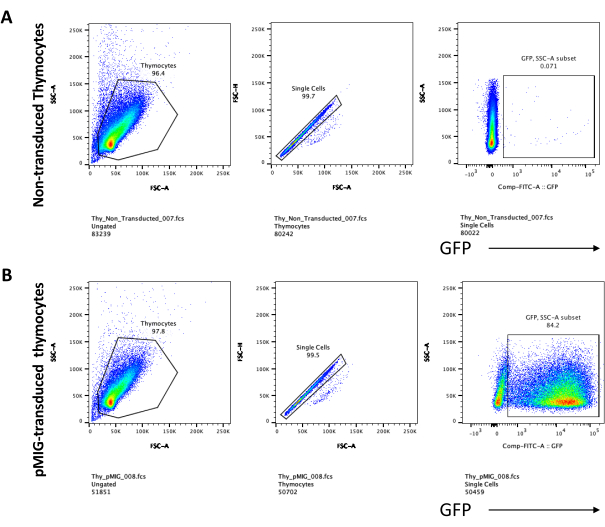
図5:OP9-DL4共培養の4日後の形質導入胸腺細胞のフローサイトメトリー。 (A)形質導入されておらず、(B)pMIGレトロウイルスで形質導入されている。細胞は最初に生細胞上でゲーティングされ、次にサイズと複雑さ(それぞれFCS-AとSSC-A)に基づいてゲーティングされ、次にFSC-HとFSC-Aをプロットして単一細胞にゲートし、ダブレットを除外しました。形質導入されていない細胞については、以下のゲート戦略を用いた。シングルセルゲートから、細胞はシングルポジティブ(CD4+またはCD8+)、ダブルポジティブ(CD4+/CD8+)、およびダブルネガティブ(CD4−/CD8−)と定義した。次に、二重陰性(CD4−/CD8−)ゲートから、パネルAに示すように、細胞をCD44+、CD25+、CD44+/CD25+、およびCD44−/CD25−と定義した。パネルBに示すpMIG形質導入細胞については、単一細胞ゲートから、細胞を最初にGFP+/GFP−と定義し、次にGFP+細胞から、CD4、CD8、CD44、およびCD25発現によって定義される主要なT細胞発生段階への細胞集団分布を、非トラデュース細胞の場合と同じゲート戦略を使用して決定した。略語:FSC-A =前方散乱ピーク面積;SSC-A = 側方散乱ピーク面積;FSC-H = 前方散乱ピークの高さ;FITC=フルオレセインイソチオシアネート;GFP = 緑色蛍光タンパク質。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここで説明するプロトコルは、レトロウイルストランスフェクションとそれに続くOP9-DL4分化モデルを用いた胸腺由来DN(CD4−/CD8−)T細胞研究のために特別に開発されました。しかし、この形質導入プロトコルとそれに続く細胞分化の対象となる標的細胞は、より広い学際的な有用性を有する可能性が高い。したがって、未熟な胸腺細胞に加えて、胎児の肝臓または骨髄のいずれかに由来する細胞などの造血幹細胞をこのプロトコルに使用できる可能性があります。
OP9-DL4システムは、細胞分化17 や発癌15など、さまざまな側面で遺伝子機能を研究するための効果的なモデルであることが証明されています。造血前駆細胞のレトロウイルス修飾は、安定した遺伝子改変を可能にする確立された技術であるが、OP9-DL4系上の細胞分化誘導とレトロウイルス形質導入を組み合わせるには注意と技術が必要である。このプロトコルで成功を達成するための重要な側面は、プロトコルが健康を維持し、特定の段階ごとに必要な理想的な合流点を維持する必要がある3つの異なる細胞タイプを使用することを含むため、すべてのステップが適切に調整されていることを確認することです。そのことを念頭に置いて、次のステップに進む前に、各ステップの実行後にすべての品質管理チェックポイント分析を実行することが重要です。これにより、すべての手順が機能していることが保証されます。したがって、このプロトコルを正常に実行するためには、空乏、トランスフェクション、および形質導入の効率を確認することが重要です( 図4の形質導入効率の典型的な結果を参照)。良好な初代細胞形質導入効率は、高いウイルス力価と関連している。典型的には、より大きなインサートは、より低いウイルス力価をもたらす18。トレーニングの目的で、空のベクトルを使用して、このプロトコルで取得できる結果を表します。私たちの経験では、形質導入とトランスフェクションの効率は、特にGFPなどのウイルス骨格発現レポーター遺伝子を考慮すると、インサートサイズによって異なります。複数の遺伝子の相互作用を研究するときに使用できる1つの戦略は、各遺伝子を異なるトランスファーベクターにクローニングし、続いて個々のウイルス産生を行い、最後に標的細胞の共形質導入を行うことです。その場合、選択ステップを適用して、単一形質導入細胞を排除し、共形質導入細胞のみを保持することができる。
OP9-DL1/DL4間質フィーダー層細胞株の大部分は、DL1またはDL4構築物の一部としてGFPを発現するように遺伝子操作されていることは注目に値する7。このプロトコルでは、GFPも発現するレトロウイルスベクターを使用しました。ただし、OP9-DL4細胞で発現するGFPタンパク質よりも明るく、蛍光顕微鏡で共培養を視覚化する場合の形質導入検査を妨げません。
OP9細胞は、多くの継代後、長期間の培養後、または過剰コンフルエントの条件下で脂肪細胞に分化します19。これは大きな液胞の発達によって証明されています。したがって、これらの特性を示すOP9細胞は、このプロトコルでは使用すべきではありません。過度にコンフルエントなレトロウイルス産生細胞をトランスフェクションすると、ウイルス力価が低くなります。実際、サブコンフルエント段階は、細胞が最も可搬性であるときです。さらに、低コンフルエンスのレトロウイルス産生細胞をトランスフェクションすると、トランスフェクションプロセスにおける細胞ストレスが減少し、最高のウイルス力価が得られます。
このプロトコルでは、ウイルス上清を滴定しませんが、レトロウイルスベクターにレポーター遺伝子がない場合など、ウイルス産生の間接的な決定を妨げる場合や、実験デザインでより正確な数の導入遺伝子コピーを標的細胞ゲノムに組み込む必要がある場合など、ウイルス上清滴定を考慮する必要があります。ただし、滴定結果が得られるまで-80°Cまたは4°Cで保存すると、レトロウイルスベクター上清の力価が大幅に低下することに注意することが重要です。したがって、新たに調製したウイルス上清を形質導入に使用すると、形質導入効率が向上します。
胸腺には、DN後の胸腺細胞である多数のダブルポジティブ(DP)胸腺細胞(85%以上)と約10%のシングルポジティブ15細胞(CD4またはCD8)が含まれています。DP細胞はレトロウイルス操作のために in vitro で生存することはできませんが、SP細胞は形質導入できません。したがって、このプロトコルは、胸腺細胞にレトロウイルスベクター形質導入可能なDNを生成するために適用することができる。
開示事項
著者には開示する利益相反はありません
謝辞
この研究は、国立がん研究所の壁内プログラム、プロジェクトZIABC009287によってサポートされました。OP9-DL4は、Juan Carlos Zúñiga-Pflücker博士(サニーブルック健康科学センター、トロント、オンタリオ州、カナダ)から入手しました。著者らは、NCI-Frederick Laboratory Animal Sciences Programの継続的な技術支援と実験的アドバイスとインプット、およびフローサイトメトリーの支援を提供してくれたJeff Carrel、Megan Karwan、Kimberly Klarmannに感謝しています。重要なアドバイスと意見を提供してくれたハワード・ヤングに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma | M3148 | |
| ACK Lysis buffer | Lonza | 10-548E | |
| BSA | Cell Signaling Technology | 9998S | |
| CD4 Microbeads | Miltenyi | 130-049-201 | |
| CD8 Microbeads | Miltenyi | 130-049-401 | |
| Centrifuge 5910R | eppendorf | 5942IP802353 | |
| DMEM | Corning | 10-013-CV | |
| EDTA | Invitrogen | 15575-038 | |
| Fetal calf serum HyClone FBS | ThermoScientific | SH30910.03 | |
| LD columns | Miltenyi | 130-042-901 | |
| L-glutamine | Sigma | G7513 | Freeze glutamine in aliquots and use freshly-thawed glutamine |
| Lipofectamine 2000 | Invitrogen | P/N 52887 | |
| MEM-alpha Medium | Gibco | 12561-072 | |
| OPTI-MEM I Reducing Serum Medium | Invitrogen | 31985-062 | |
| PBS pH 7.2 | Corning | 21-040-CV | |
| pcL-Eco Plasmid | Addgene | 12371 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| pMIG Plasmid | Addgene | 6492 | |
| Polybrene | Chemicon | TR-1003-G | |
| Pre-Separation Filters | Miltenyi | 130-041-407 | |
| recombinant hFLT-3L | PeproTech | 300-19 | |
| recombinant IL-7 | Peprotech | 217-17 | |
| Retrovial packaging cell line Phoenix-Eco | Orbigen | RVC-10002 | |
| Syringe filter (0.45 µm) | Millipore | SLHV033RS |
参考文献
- Zuniga-Pflucker, J. C. T-cell development made simple. Nature Reviews Immunology. 4 (1), 67 (2004).
- Kodama, H., Nose, M., Niida, S., Nishikawa, S., Nishikawa, S. Involvement of the c-kit receptor in the adhesion of hematopoietic stem cells to stromal cells. Experimental Hematology. 22 (10), 979-984 (1994).
- Nakano, T., Kodama, H., Honjo, T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science. 265 (5175), 1098-1101 (1994).
- Nakano, T., Kodama, H., Honjo, T. In vitro development of primitive and definitive erythrocytes from different precursors. Science. 272 (5262), 722-724 (1996).
- Ueno, H., et al. A stromal cell-derived membrane protein that supports hematopoietic stem cells. Nature Immunology. 4 (5), 457-463 (2003).
- Jaleco, A. C., et al. Differential effects of Notch ligands Delta-1 and Jagged-1 in human lymphoid differentiation. Journal of Experimental Medicine. 194 (7), 991-1002 (2001).
- Mohtashami, M., et al. Direct comparison of Dll1- and Dll4-mediated Notch activation levels shows differential lymphomyeloid lineage commitment outcomes. Journal of Immunology. 185 (2), 867-876 (2010).
- Schmitt, T. M., Zuniga-Pflucker, J. C. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity. 17 (6), 749-756 (2002).
- Mazzucchelli, R., Durum, S. K. Interleukin-7 receptor expression: Intelligent design. Nature Reviews Immunology. 7 (2), 144-154 (2007).
- Robey, E. A., Bluestone, J. A. Notch signaling in lymphocyte development and function. Current Opinion in Immunology. 16 (3), 360-366 (2004).
- Lavaert, M., et al. Integrated scRNA-Seq identifies human postnatal thymus seeding progenitors and regulatory dynamics of differentiating immature thymocytes. Immunity. 52 (6), 1088-1104 (2020).
- Roh, K. H., Roy, K. Engineering approaches for regeneration of T lymphopoiesis. Biomaterials Research. 20 (20), (2016).
- Zlotoff, D. A., et al. CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus. Blood. 115 (10), 1897-1905 (2010).
- Holmes, R., Zuniga-Pflucker, J. C. The OP9-DL1 system: Generation of T-lymphocytes from embryonic or hematopoietic stem cells in vitro. Cold Spring Harbor Protocols. 2009 (2), (2009).
- Cramer, S. D., et al. Mutant IL-7Ralpha and mutant NRas are sufficient to induce murine T cell acute lymphoblastic leukemia. Leukemia. 32 (8), 1795-1882 (2018).
- Treanor, L. M., et al. Interleukin-7 receptor mutants initiate early T cell precursor leukemia in murine thymocyte progenitors with multipotent potential. Journal of Experimental Medicine. 211 (4), 701-713 (2014).
- Yokoyama, K., et al. In vivo leukemogenic potential of an interleukin 7 receptor alpha chain mutant in hematopoietic stem and progenitor cells. Blood. 122 (26), 4259-4263 (2013).
- Simmons, A., Alberola-Ila, J. Retroviral transduction of T cells and T cell precursors. Methods in Molecular Biology. 1323, 99-108 (2016).
- . Retroviral systems Available from: https://web.stanford.edu/group/nolan/_OldWebsite/retroviral_systems/retsys.html (2022)
- Xing, Y., Hogquist, K. A. Isolation, identification, and purification of murine thymic epithelial cells. Journal of Visualized Experiments. (90), e51780 (2014).
- Gray, D. H., et al. Developmental kinetics, turnover, and stimulatory capacity of thymic epithelial cells. Blood. 108 (12), 3777-3785 (2006).
- Godfrey, D. I., Kennedy, J., Suda, T., Zlotnik, A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3-CD4-CD8- triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. Journal of Immunology. 150 (10), 4244-4252 (1993).
- Wang, Y. B., Edinger, M., Mittar, D., McIntyre, C. Studying mouse thymocyte development using multiparametric flow cytometry: An efficient method to improve an 8-color panel on the BD FACSVerse™ system. BD Biosciences–Application Note. , (2012).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- He, X., Park, K., Kappes, D. J. The role of ThPOK in control of CD4/CD8 lineage commitment. Annual Review of Immunology. 28, 295-320 (2010).
- Wang, Y., et al. A conserved CXXC motif in CD3epsilon is critical for T cell development and TCR signaling. PLoS Biology. 7 (12), e1000253 (2009).
- Aliahmad, P., Kadavallore, A., de la Torre, B., Kappes, D., Kaye, J. TOX is required for development of the CD4 T cell lineage gene program. Journal of Immunology. 187 (11), 5931-5940 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved