Method Article
Kokultur und Transduktion von murinen Thymozyten auf Delta-ähnlichen 4-exprimierenden Stromazellen zur Untersuchung von Onkogenen bei T-Zell-Leukämie
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Isolierung von doppelt negativen Thymozyten aus dem Thymus der Maus, gefolgt von retroviraler Transduktion und Co-Kultur auf dem delta-like 4-exprimierenden Knochenmark-Stroma-Zelllinien-Co-Kultursystem (OP9-DL4) zur weiteren funktionellen Analyse.
Zusammenfassung
Transduzierte unreife Thymozyten der Maus können in vitro mit Hilfe des delta-like 4-exprimierenden Knochenmark-Stromazelllinien-Kokultursystems (OP9-DL4) in T-Zellen differenziert werden. Da die retrovirale Transduktion die Teilung von Zellen für die Transgenintegration erfordert, bietet OP9-DL4 eine geeignete in vitro Umgebung für die Kultivierung hämatopoetischer Vorläuferzellen. Dies ist besonders vorteilhaft, wenn es darum geht, die Auswirkungen der Expression eines bestimmten Gens während der normalen T-Zell-Entwicklung und der Leukämogenese zu untersuchen, da es den Forschern ermöglicht, den zeitaufwändigen Prozess der Erzeugung transgener Mäuse zu umgehen. Um erfolgreiche Ergebnisse zu erzielen, muss eine Reihe von koordinierten Schritten, bei denen verschiedene Zelltypen gleichzeitig manipuliert werden, sorgfältig durchgeführt werden. Obwohl es sich um sehr gut etablierte Verfahren handelt, bedeutet das Fehlen einer gemeinsamen Quelle in der Literatur oft, dass eine Reihe von Optimierungen erforderlich sind, die zeitaufwändig sein können. Dieses Protokoll hat sich als effizient bei der Transduktion von primären Thymozyten mit anschließender Differenzierung auf OP9-DL4-Zellen erwiesen. Hier finden Sie ein Protokoll, das als schneller und optimierter Leitfaden für die Co-Kultur von retroviral transduzierten Thymozyten auf OP9-DL4-Stromazellen dienen kann.
Einleitung
Die OP9-Knochenmark-Stromazelllinie stellt ein nützliches In-vitro-System für die Induktion der Lymphopoese aus verschiedenen Quellen von Vorläuferzellendar 1. Die ersten Studien, in denen OP9-Zellen verwendet wurden, zeigten, dass das Fehlen der Expression des Makrophagen-Kolonie-stimulierenden Faktors (MCSF) zur Fähigkeit der OP9-Zelllinie beitrug, die Hämatopoese und die Differenzierung von B-Zellen aus dem Knochenmark zu unterstützen, wie später auch für embryonale Stammzellen (ESCs)2,3,4,5 . In vorangegangenen Studien ermöglichte die Generierung von delta-ähnlichen 1/4-exprimierenden OP9-Zellen (OP9-DL1/OP9-DL4) die Induktion der T-Zell-Linienbindung6 und demonstrierte die Fähigkeit, die Thymusreifung erfolgreich zu rekapitulieren 7,8. Kurz gesagt wurde die Entwicklung von T-Zellen durch die sequentielle Expression von CD4- und CD8-Molekülen beschrieben. Unreife Thymozyten sind "doppelnegativ" (DN, CD4− CD8−) und können entsprechend der Oberflächenexpression von CD44 und CD25 weiter unterteilt werden. DN-Thymozyten differenzieren sich durch das unreife Single-Positive-Stadium (ISP), das durch die CD8-Expression in Mäusen und CD4 im Menschen gekennzeichnet ist, gefolgt vom Double-Positive-Stadium (DP), das durch die Koexpression von CD4 und CD8 gekennzeichnet ist, und schließlich durch das reife Single-Positive-Stadium, das durch die Expression von CD4 oder CD8 gekennzeichnet ist9. HSCs exprimieren den Notch1-Rezeptor, der normalerweise mit dem Delta-like 4 (DL4) interagiert, das auf Thymusepithelzellen exprimiert wird, um die Differenzierung der T-Linie zu induzieren10. Daher hat das Interesse am OP9-DL1/4-Modell schrittweise zugenommen, was dazu geführt hat, dass dieser Ansatz in den letzten zwei Jahrzehnten in einer Vielzahl von Anwendungen in großem Umfang eingesetzt wurde 8,11,12,13. Obwohl DL1 und DL4 beide in der Lage sind, die T-Zell-Differenzierung in vitro zu unterstützen, zeigen sie in vivo unterschiedliche Anforderungen, und einige Studien deuten darauf hin, dass OP9_DL4 bei der Rekapitulation der Thymusumgebung der Maus effizienter ist als OP9_DL1 7,14.
Unter den möglichen Anwendungen des OP9-DL1/4-Systems besteht besonderes Interesse an der Kombination dieses Systems mit der Transduktion von DN-Zellen oder HSCs mit retroviralen Vektoren. Diese Kombination ist ein effektiver Weg, um die Genexpression während der normalen T-Zell-Entwicklung und Leukämiegenese zu manipulieren, und hat sich als effiziente Methode erwiesen, um die Funktion eines Gens von Interesse zu induzieren oder zu hemmen15,16,17. Dieses Modell wurde besonders erfolgreich eingesetzt, um die Zusammenarbeit zwischen den Onkogenen zu untersuchen, die die Leukämieantreiben 15, da es flexibel ist und es ermöglicht, die Auswirkungen mehrerer Genkombinationen in angemessener Zeit zu untersuchen, im Gegensatz zur Erzeugung transgener Mäuse. Darüber hinaus wurden ähnliche Modelle bereits verwendet, um die Auswirkungen der Einführung von Onkogenen in normale Zellen zu beurteilen15,16,17. Darüber hinaus erfordert die retrovirale Transduktion die Teilung von Zellen für die Transgenintegration18, und während die lentivirale Transduktion diese Einschränkung überwinden würde, indem sie die Notwendigkeit von sich teilenden Zellen für die Transgenintegration eliminieren würde, konnten wir die erfolgreiche Transduktion von DN-Thymozyten mit lentiviralen Vektoren nicht erreichen. Somit ist OP9-DL1/DL4 ein geeignetes Werkzeug für die Züchtung hämatopoetischer Vorläuferzellen.
Das Standardprotokoll für die Lymphopoese von transduzierten Thymozyten auf OP9-DL4 umfasst eine Reihe von koordinierten Schritten, die sorgfältig durchgeführt werden müssen, um ein erfolgreiches Ergebnis zu erzielen. Obwohl es sich um Techniken handelt, die der Gemeinschaft seit vielen Jahren gute Dienste leisten, sind die in der Literatur verfügbaren Protokolle oft fragmentiert. Infolgedessen ist jedes Labor gezwungen, verschiedene Phasen des Verfahrens anzupassen und zu optimieren, was zeitaufwändig sein kann. In dieser Arbeit beschreibt dieses Protokoll die Isolierung von DN-Thymozyten aus dem Thymus der Maus, gefolgt von retroviraler Transduktion und Co-Kultur auf OP9-DL4-Stromazellen zur weiteren funktionellen Analyse. Dieses etablierte Protokoll hat sich als effizient und reproduzierbar bei der Transduktion von primären Thymozyten erwiesen, gefolgt von der Differenzierung auf OP9-DL4-Zellen oder der Induktion der akuten lymphatischen T-Zell-Leukämie15.
Protokoll
Alle beschriebenen Tierversuche wurden vom NIH Institutional Biosafety Committee (IBC) und dem Animal Care and Use Committee (ACUC) genehmigt. In der Materialtabelle finden Sie Details zu allen Reagenzien und Materialien, die in diesem Protokoll verwendet werden. In den veröffentlichten Leitlinien19 finden Sie weitere Einzelheiten zu Zellkultur- und Erhaltungsverfahren für Retrovirus-Produzenten. In Abbildung 1 finden Sie einen Überblick über das Protokoll.
1. Beginn der Kultur von OP9-DL4-Zellen (Tag 1)
- Tauen Sie OP9-DL4-Zellen schnell auf, indem Sie die Durchstechflasche halten und vorsichtig in einem Wasserbad bei 37 °C schütteln. Die Zellen werden sofort in ein Zentrifugenröhrchen mit 5 ml des OP9-Mediums (MEM-alpha-Medium, 10 % FBS, 50 U/ml Penicillin/Streptomycin, 55 μM 2-Mercaptoethanol, 2 mM L-Glutamin) überführt, um die Kryoprotektiva zu entfernen.
- Bei 300 × g 5 min bei Raumtemperatur zentrifugieren. Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 1 ml OP9-Medium.
- Geben Sie 5 ml OP9-Medium in einen T25-Kolben und geben Sie die resuspendierten Zellen in diesen Kolben. Kultur bei 37 °C und 5% CO2.
- Nach 2–3 Tagen werden die Zellen im Verhältnis 1:3 subkultiviert (die Zellen werden jeden Montag, Mittwoch und Freitag durchgelassen).
HINWEIS: Teilen Sie die OP9-DL4-Zellen, bevor sie die Konfluenz erreichen. Der OP9-DL4-Kolben muss an den Tagen 6–7 und an den Tagen 8–9+ zu 80–90 % konfluent sein, um eine Co-Kultur mit Thymozyten zu erhalten. Daher ist es wichtig zu planen, wie viele OP9-DL4-Zellen an diesen Tagen benötigt werden, während die OP9-DL4-Zellen aufgeteilt werden.- Entsorgen Sie das Medium aus dem Kolben und waschen Sie die Monoschicht mit 1x PBS. Das PBS wird verworfen, 1 ml 0,25%iges Trypsin hinzugefügt und 1–5 Minuten bei 37 °C inkubiert oder bis sich die Zellen aus dem Kolben gelöst haben. Klopfen Sie auf den Kolben, um die Zellen zu entfernen.
HINWEIS: (Optional) Der Fortschritt der Zelldissoziation kann durch Mikroskopie überprüft werden. - Fügen Sie 5 ml OP9-Medium hinzu, um das Trypsin zu inaktivieren, und resuspendieren Sie die Zellen, indem Sie die zellbedeckte Oberfläche des Kolbens während der Resuspension spülen.
- Die Zellsuspension wird bei 300 × g für 5 min bei Raumtemperatur zentrifugiert und in 3 ml OP9-Medium (für eine Aufteilung von 1:3) resuspendiert.
- Geben Sie 1 ml der Zellsuspension in einen T25-Kolben, der bereits 5 ml frisches OP9-Medium enthält. Frieren Sie die verbleibenden Zellen ein/verwerfen Sie sie.
- Um die OP9-DL4-Zellen einzufrieren, resuspendieren Sie die Zellen in 90 % FBS/10 % DMSO in einem Verhältnis von 1 ml Gefriermedium zu einer Durchstechflasche mit Zellen.
- Einfrieren in 1-ml-Kryoflaschen bei −80 °C oder in flüssigem Stickstoff, je nach zukünftigen Anforderungen. Zur längeren Lagerung in flüssigem Stickstoff lagern.
- Entsorgen Sie das Medium aus dem Kolben und waschen Sie die Monoschicht mit 1x PBS. Das PBS wird verworfen, 1 ml 0,25%iges Trypsin hinzugefügt und 1–5 Minuten bei 37 °C inkubiert oder bis sich die Zellen aus dem Kolben gelöst haben. Klopfen Sie auf den Kolben, um die Zellen zu entfernen.
2. Beginn der Kultivierung der Retrovirus-produzierenden Zelllinie (Tag 1)
- Tauen Sie die Retrovirus-produzierende Zelllinie schnell auf, indem Sie die Durchstechflasche halten und vorsichtig in einem Wasserbad bei 37 °C schütteln. Die Zellen werden sofort in ein Zentrifugenröhrchen mit 5 ml Retrovirus-produzierendem Zellmedium (RPC: DMEM, 10 % FBS) überführt, um das Kryoprotektivum zu entfernen.
- Bei 300 × g 5 min bei Raumtemperatur zentrifugieren. Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 1 ml RPC-Medium.
- Geben Sie 5 ml RPC-Medium in einen T25-Kolben und geben Sie die resuspendierten Zellen in diesen Kolben. Kultur bei 37 °C und 5% CO2.
- Die Zellen werden alle 2–3 Tage im Abstand von 1:5 bis 1:8 durchquert.
- Klopfen Sie auf den Kolben, um die Zellen zu entfernen, und resuspendieren Sie die Zellen durch aggressives Pipettieren.
Anmerkungen: Diese Küvetten können durch aggressives Pipettieren ohne Trypsin von der Kolbenoberfläche entfernt werden. Alternativ können Sie trypsinisieren (0,05 % Trypsin/0,53 mM EDTA), bis sich die Zellen leicht ablösen lassen und leicht in eine Einzelzellsuspension pipettiert werden können.
- Klopfen Sie auf den Kolben, um die Zellen zu entfernen, und resuspendieren Sie die Zellen durch aggressives Pipettieren.
- Zentrifugieren Sie die Zellsuspension bei 300 × g für 5 Minuten und resuspendieren Sie sie in 5 ml RPC-Medium (für eine Aufteilung von 1:5).
- Geben Sie 1 ml der Zellsuspension in einen T25-Kolben, der bereits 5 ml frisches RPC-Medium enthält. Frieren Sie die verbleibenden Zellen ein/verwerfen Sie sie. Frieren Sie die Retrovirus-produzierenden Zellen auf die gleiche Weise ein, wie sie für OP9-DL4-Zellen beschrieben ist (Schritte 1.4.4.1–1.4.4.2).
3. Beginn der Kultivierung der Retrovirus-produzierenden Zellen in 6-Well-Platten (Tage 4–5)
- Die Retrovirus-produzierenden Zellen werden 18–24 h vor der Transfektion bei 70–90 % Konfluenz in jeder Vertiefung einer 6-Well-Gewebekulturplatte in 2 ml RPC-Medium ausgesät und bei 37 °C und 5 % CO2 inkubiert.
HINWEIS: Transfizieren Sie zwei Vertiefungen der Retrovirus-produzierenden Zellen für jeweils 2–5 × 105 bis 1 × 106 Thymozyten, die transduziert werden.
4. Transfektion der Retrovirus-produzierenden Zellen, um das Retrovirus zu erzeugen, das die interessierenden Gene enthält (Tage 5–6)
- Ersetzen Sie das Medium 1 h vor der Transfektion durch frisches RPC-Medium.
- Präparation von Lipofektionsmischungen (für jede Vertiefung einer 6-Well-Platte – Skalierung nach Bedarf): Verdünnen Sie 4 μg DNA (2 μg Helferplasmid (pCL-Eco) und 2 μg Transferplasmid (pMIG) in 250 μl reduziertem Serummedium. Vorsichtig mischen.
- Mischen Sie 10 μl Transfektionsreagenz mit 250 μl des reduzierten Serummediums aus Schritt 4.2. 5 min bei Raumtemperatur inkubieren.
- Nach 5 min Inkubation wird die verdünnte DNA mit einem verdünnten Transfektionsreagenz (Gesamtvolumen = 500 μL) kombiniert. Vorsichtig mischen und 20–25 Minuten bei Raumtemperatur inkubieren.
- Geben Sie die 500 μl DNA/Transfektionsreagenz-Gemische vorsichtig in die Vertiefung, in der sich die Retrovirus-produzierenden Zellen befinden, indem Sie sie mit kreisenden Bewegungen auf die Zellen tropfen lassen. Mischen Sie die Platte vorsichtig, indem Sie sie hin und her schaukeln, und inkubieren Sie die Platte 16–24 Stunden lang in einem Inkubator bei 37 °C.
HINWEIS: Subkonfluente Zellen (80 %–90 %) eignen sich am besten für die Transfektion und erzeugen potenziell den höchsten Virustiter. Da sich die Retrovirus-produzierenden Zellen sehr leicht aus dem Kolben lösen, sollten Sie plötzliche Bewegungen beim Umgang mit diesen Zellen vermeiden.
5. Veränderung des Retrovirus-produzierenden Zellmediums (Tage 6–7)
- Ersetzen Sie das alte Medium ca. 16 h nach der Transfektion durch 2 ml frisches RPC-Medium. Die Inkubation der Zellen erfolgt bei 37 °C für 20–24 h.
- Bewerten Sie die Transfektionseffizienz unter einem Fluoreszenzmikroskop (optional).
HINWEIS: In diesem Protokoll sind GFP-positive Zellen die Zellen, die von Interesse sind (siehe Abbildung 2). Dieser Schritt hängt von dem Retrovirus-Vektor ab, der für dieses Protokoll ausgewählt wurde (ob ein Reportergen im Rückgrat vorhanden ist).
6. Thymozytenpräparation und -depletion von CD4+- und CD8+-Zellen (Tage 6–7)
- Ernten Sie den Thymus von einer 4–6 Wochen alten C57BL/6-Maus. Weitere Informationen zur Thymusernte finden Sie unter Xing und Hogquist20.
HINWEIS: Die Mäuse wurden durch CO2 -Inhalation mit anschließender Zervixluxation eingeschläfert. - Bereiten Sie eine einzellige Thymozytensuspension vor, indem Sie den Thymus in 5 ml PBS in eine Petrischale geben. Platzieren Sie den Thymus mit sterilen Glasobjektträgern zwischen den mattierten Oberflächen der Objektträger und reiben Sie die Objektträger vorsichtig aneinander, indem Sie den Thymus zwischen den beiden Objektträgern rollen. Spülen Sie die Objektträger aus, um die Zellen zu sammeln, und entsorgen Sie das verbleibende Thymusstromagewebe.
HINWEIS: Die geschätzte Ausbeute eines Thymus beträgt 90 × 10 6–100 × 106 Zellen, und etwa 1 % der Zellen bleibt nach CD4- und CD8-Erschöpfung übrig. Verwenden Sie Thymusgewebe von jüngeren Mäusen, um eine bessere Zellausbeute zu erzielen, da die Zellularität des Mausthymus in den ersten Wochen nach der Geburt schnell ansteigt, im Alter von 4–6 Wochen ein Plateau erreicht und sich anschließend progressiv fortbildet21. Zählen Sie die Zellen mit einem automatischen Blutkörperchenzähler oder einer anderen Methode. - Filtern Sie die Thymussuspension durch einen 30 μm oder 40 μm Filter, indem Sie 5 ml der Thymussuspension durch ein Zellsieb pipettieren. Zentrifugieren Sie die Zellen bei 300 × g für 10 Minuten.
- Entfernen Sie den Überstand und lysieren Sie die roten Blutkörperchen mit ACK-Lysepuffer, indem Sie (je nach Probengröße) 1 ml Puffer pro Röhrchen für 1 Minute hinzufügen. Fügen Sie 5 ml Zellabreicherungspuffer hinzu (500 ml PBS [pH 7,2], 0,5 % BSA, 2 mM 0,5 M EDTA, pH 8,0), um den ACK-Lysepuffer zu deaktivieren, zentrifugieren Sie 10 Minuten lang bei 300 × g und resuspendieren Sie ihn zum Zählen in 1–5 ml Zellerschöpfungspuffer.
HINWEIS: Vor der Erschöpfung (vor der Abreicherung) Folgendes auf Eis beiseite stellen: 70 μl Zellsuspension zum Zählen (variieren Sie dies je nach gewählter Zählzellmethode) und 200 μl Zellsuspension, um die Effizienz der Verarmung durch Färbung auf CD4 und CD8 und Analyse durch Durchflusszytometriezu bestimmen 22,23. - Zählen Sie die Zellen und zentrifugieren Sie sie 10 Minuten lang bei 300 × g . Resuspendieren Sie die Zellen bei 1 × 107/80 μl Zellabbaupuffer. Fügen Sie je 10 μl CD4- und CD8-Mikrokügelchen pro 1 × 107 Zellen hinzu. Gut mischen und 15 min dunkel im Kühlschrank (2–8 °C) inkubieren.
- Bereiten Sie eine Depletionssäule vor, indem Sie sie mit 2 ml Depletionspuffer spülen und den Durchfluss verwerfen.
- Waschen Sie die Zellen aus Schritt 6.6, indem Sie 1–2 ml Verarmungspuffer pro 1 × 107 Zellen hinzufügen , und zentrifugieren Sie sie 10 Minuten lang bei 300 × g . Entfernen und entsorgen Sie den Überstand.
- Resuspendieren Sie bis zu 1,25 × 108 Zellen in 500 μl Verarmungspuffer. Wenden Sie die Zellsuspension auf die Säule an, und sammeln Sie den Durchfluss (unbeschriftete Zellen). Waschen Sie die Säule 2x mit 1 ml Puffer und fangen Sie den Durchfluss auf.
HINWEIS: Fügen Sie nur dann einen neuen Puffer hinzu, wenn der Säulenbehälter leer ist. Nach der Depletion (Post-Depletion-Kontrolle) werden auf Eis beiseite gestellt: 70 μl Zellsuspension zum Zählen (variieren Sie dies je nach gewählter Zählzellmethode) und 1.000 μl Zellsuspension, um die Effizienz der Depletion durch Färbung auf CD4 und CD8 und Analyse mittels Durchflusszytometrie zu bestimmen22,23. - Färben Sie die Depletionseffizienzkontrollen, indem Sie die 200 μl der vor der Depletion gesammelten Zellen in vier FACS-Röhrchen aufteilen: ungefärbt, CD4-einfachgefärbt, CD8-einfach gefärbt und CD4/CD8-doppelt gefärbt (verwenden Sie die ungefärbten und einfach gefärbten Proben, um die Durchflusszytometrieparameter festzulegen). Verwenden Sie die 1.000 μl Zellen, die nach der Depletion gesammelt wurden, um CD4 und CD8 zu färben, und vergleichen Sie sie mit der doppelt gefärbten Probe, die vor der Depletion gesammelt wurde (siehe typische Depletionsergebnisse in Abbildung 3).
HINWEIS: Passen Sie die Volumina für die Durchflusszytometrie-Färbung gemäß der Empfehlung des Antikörperherstellers an (z. B. 1 μl Anti-CD4-FITC + 0,5 μl Anti-CD8-PE pro 1 x 106 Zellen in 50 μl Puffer).
7. Kultivierung von Thymozyten auf OP9-DL4-Zellen (Tage 6–7)
- 2–5 × 105 bis 1 × 106 Thymozyten nach Depletion werden in einen T25-Kolben mit 80%–90% konfluenten OP9-DL4-Zellen in OP9-Medium mit Zytokinen (10 ng/ml rekombinantes IL-7 und rekombinantes hFLT-3) gegeben. Kultur bei 37 °C und 5% CO2. Ca. 24 Stunden auf OP9-DL4-Zellen wachsen.
HINWEIS: Diese Dauer ist erforderlich, um die T-Zellen transduzierbar zu machen (siehe typisches Ergebnis in Abbildung 4). Reservieren Sie einen T25-Kolben der Co-Kultur von Thymozyten und OP9-DL4-Zellen, der als Kontrolle verwendet werden soll (nicht transduziert). Die nicht transduzierten Thymozyten werden zusammen mit den transduzierten Thymozyten (Schritt 9.1) als Negativkontrolle gefärbt, um die Transduktionseffizienz zu bewerten. Untransduzierte Thymozyten können auch verwendet werden, um den Effekt der Transgenexpression auf die Zelldifferenzierung zu messen. Verwerfen Sie das zytokinhaltige Medium nach 1 Monat.
8. Ernte des Retrovirus aus dem Überstand und Verwendung zur Transduktion der Thymozyten (Tage 8–9)
- Sammeln Sie den Überstand mit den Retroviren aus den transfizierten Zellen, indem Sie die 6-Well-Platte kippen und eine 3–5-ml-Spritze am Boden der Platte positionieren, während Sie den Kolben ziehen, um den Überstand anzusaugen. Ersetzen Sie das Medium durch 2 ml frisches RPC-Medium. Die Inkubation der Zellen bei 37 °C für 20–24 h für die zweite Transduktion in Schritt 8.9 fortsetzen.
- Filtern Sie den Retrovirusüberstand durch einen 0,45-μm-Spritzenvorsatzfilter und sammeln Sie das Filtrat in einem 50-ml-Röhrchen.
HINWEIS: Frieren Sie den retroviralen Überstand nicht ein. Verwenden Sie ein frisch hergestelltes Viruspräparat für die Transduktion. - Entnahme von Thymozyten aus der OP9-DL4-Kultur durch aggressives Pipettieren, um die Thymozyten und OP9-DL4-Zellen von der Kolbenoberfläche zu entfernen. Filtern Sie die Zellsuspension durch ein 40-μm-Zellsieb, um die meisten OP9-DL4-Zellen zu entfernen, und sammeln Sie das Filtrat in einem 50-ml-Röhrchen.
HINWEIS: OP9-Zellen sind sehr adhärent. Obwohl durch aggressives Pipettieren ein Teil der OP9-DL4-Zellen aus dem Kolben entfernt werden kann, ist die Störung der OP9-DL4-Monoschicht während dieses Prozesses minimal, und die OP9-DL4-Zellen, die sich lösen, werden mit dem 40-μm-Zellsieb herausgefiltert, da die OP9-DL4-Zellen viel größer sind als die primären Thymozyten. Wenn die OP9-DL4-Zellen immer noch zu 80 % bis 90 % konfluent sind, entfernen Sie die Thymozyten und plattieren Sie sie erneut im selben OP9-DL4-Kolben. Alternativ muss ein neuer OP9-DL4-Kolben vorbereitet werden. - Die Thymozyten im Filtrat aus Schritt 8.3 bei 300 × g für 5 min zentrifugieren. Verwerfen Sie den Überstand.
- Im 50-ml-Röhrchen werden die Thymozyten in 0,5–1 ml OP9-Medium + Zytokinen resuspendiert (siehe Schritt 7.1). Fügen Sie 1–2 ml RPC-Medium hinzu, das das Virus enthält (doppelt so viel RPC-Medium wie Thymozytenmedium). Fügen Sie Hexamethrinbromid (10 μg/μl Stammkonzentration) hinzu, um 8 μg Hexamethrinbromid/ml Gesamtzellsuspension zu erhalten.
- Spinokulieren Sie, indem Sie die Zellen bei 850 × g für 1 Stunde bei Raumtemperatur zentrifugieren.
- Resuspendieren Sie die Zellen in 6 ml OP9-Medium + Zytokine pro Kolben (siehe Schritt 7.1) und geben Sie die Suspension wieder auf die OP9-DL4-Zellmonoschicht.
HINWEIS: Halten Sie alternativ neue OP9-DL4-Kolben bereit, um die transduzierten Thymozyten aufzunehmen. Wenn die Thymozyten wieder in einen gebrauchten OP9-DL4-Kolben gegeben werden sollen, stellen Sie sicher, dass Sie den OP9-DL4-Zellen während der 1-stündigen Thymozytenspinokulation frisches OP9-Medium hinzufügen, um die Zellen gesund zu halten und eine Konfluenz von 80 % bis 90 % zu gewährleisten. - Über Nacht bei 37 °C inkubieren.
- Wiederholen Sie die Schritte 8.2–8.7 mit einer neuen Vertiefung des Retrovirus-haltigen Zellüberstands.
9. Aufrechterhaltung der transduzierten Thymozyten auf OP9-DL4-Kultur für 2–5 Tage oder Einfrieren nach Bedarf (Tag 9+)
- Beurteilung der Thymozytendifferenzierung durch Durchflusszytometrie durch Färbung von Thymozyten auf T-Zellentwicklungsmarker wie CD4, CD8, CD25 und CD4423. Siehe typische Ergebnisse der Thymozytendifferenzierung in Abbildung 5.
Ergebnisse
Die Depletionseffizienz kann flusszytometrisch beurteilt werden, indem die magnetisch unmarkierte Zellfraktion für CD4 und CD8 nach immunmagnetischer Zelltrennung (MACS) markiert und an einem zweidimensionalen bivariaten Punktdiagramm analysiert wird (Abbildung 3). Eine gute Ausbeute an doppelt negativen Zellen (CD4−, CD8−) liegt bei 95 % oder mehr, wie in Abbildung 3 dargestellt. Zwei der häufigsten Ursachen für eine geringere Ausbeute sind die Fehlberechnung der Mikrokügelchen aufgrund der Anzahl der Zellen und der Anzahl der markierten Zellen, die die Säulenkapazität überschreiten. Es wird empfohlen, die richtige Anzahl von MACS-Spalten entsprechend der Anzahl der beschrifteten Zellen auszuwählen. Bei der Arbeit mit Thymozyten ist die Anzahl der markierten Zellen (DP- und SP-Zellen) fast gleich der Anzahl der Gesamtzellen (mehr als 96%). Die Zellzählung kann in einem automatischen Zellzähler, einer Neubauer-Kammer oder mit jeder anderen Methode erfolgen. Infolgedessen müssen die für die Zellzählung zugewiesenen Volumina je nach Maschine und gewählter Zählmethode möglicherweise angepasst werden.
Es ist wichtig, die Anzahl der Zellen zu bestimmen, die vor und nach der Verarmung vorhanden sind. Diese Zellzahlen werden benötigt, um die Anzahl der benötigten LD-Depletionssäulen zu berechnen und die DN-Thymozyten gleichmäßig auf die entsprechende Anzahl von OP9-DL4-Kolben zu verteilen. Die Kontrollen für die Durchflusszytometrie (unmarkierte Zellen, CD4-markierte Zellen und CD8-markierte Zellen) können mit der reservierten Pre-Depletion-Probe durchgeführt werden, da diese mehr Zellen enthält. Da jedoch davon ausgegangen wird, dass die meisten Zellen in der Säule verbleiben, erfordert die zu markierende Probe nach der Verarmung ein höheres Volumen. Folglich müssen möglicherweise Anpassungen entsprechend dem gewählten Kennzeichnungsprotokoll vorgenommen werden.
Bei der Verwendung von Vektoren, die screenbare Marker exprimieren, wie z. B. ein Fluoreszenzgen, können die Transfektion und Transduktion grob und empirisch durch Fluoreszenzmikroskopie beurteilt werden (Abbildung 2). Die Transduktionseffizienz kann analysiert werden, indem der Thymozyten aus der OP9-DL4-Monoschicht entnommen wird, wie in Schritt 8.3 beschrieben, und die Expression eines Fluoreszenzgens mittels Durchflusszytometrie untersucht wird. Die Effizienz der Transduktion mit einem leeren retroviralen Vektor mit GFP als Reportergen betrug 84,2 % (Abbildung 4).
Die Differenzierung der T-Zellen auf OP9-DL4-Zellen kann 4 Tage nach der Transduktion beobachtet werden. Die Durchflusszytometrie wird in der Regel durchgeführt, um die durch die Kokultur auf OP9-DL4-Zellen induzierte Zelldifferenzierung und/oder die Transgenexpression zu beurteilen, wie in Abbildung 5 dargestellt, wobei die Zellen für CD4, CD8, CD44 und CD25 markiert wurden. Es gibt mehrere mögliche Kombinationen der Markierung von Zelloberflächenmolekülen, die sich als nützlich erwiesen haben, um die molekularen und zellulären Mechanismen der T-Zell-Entwicklung in Mäusen zu untersuchen24,25,26,27. Daher können die Panels mit fluoreszierenden Antikörpern je nach der Frage, die behandelt wird, variieren. Die Transduktion von DN-Thymozyten mit dem leeren retroviralen Vektor pMIG, die in Tafel B dargestellt ist, zeigte ungefähr die gleichen Anteile an einfach positiven (CD4+ oder CD8+), doppelt positiven (CD4+/CD8+), doppelt negativen (CD4−/CD8−) und ihren Unterstufen doppelt negativ 1–4 (DN1–DN4) wie die nicht transduzierten Thymozyten, die in Tafel A gezeigt werden, was darauf hindeutet, dass die T-Zellentwicklung durch den Transduktionsprozess nicht beeinflusst wurde.
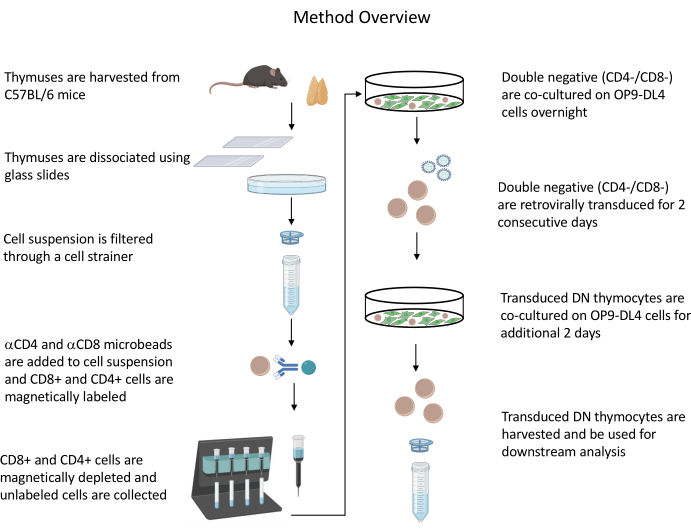
Abbildung 1: Diagramm der Schritte der Thymozytenisolierung, -transduktion und -kokultur. Abkürzung: DN = doppelt negativ. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
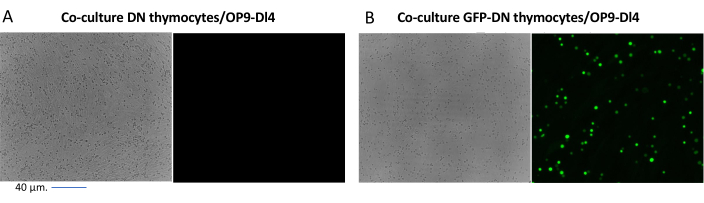
Abbildung 2: Co-Kultur-Fluoreszenzmikroskopie von GFP-transduzierten Thymozyten oder untransduzierten Thymozyten und OP9-DL4-Zellen. (A) Untransduzierte Thymozyten und (B) stabile GFP-exprimierende murine Thymozyten auf OP9-DL4 an Tag 3 nach der zweiten Transduktion. Zum Einsatz kam ein Olympus-IX71 Fluoreszenzmikroskop mit einem 40x-Objektiv und einem 480/30 Filter, der für die GFP-Detektion geeignet ist. Maßstabsbalken = 40 μm. Abkürzungen: GFP = grün fluoreszierendes Protein; DN = doppelt negativ. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
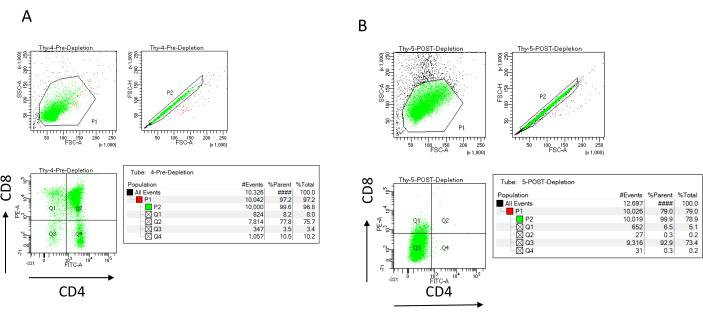
Abbildung 3: Durchflusszytometrie der Thymozytendepletion. Repräsentative Durchflusszytometrie-Diagramme zur Analyse der Expression von CD4 und CD8 auf Thymozyten von 7-8 Wochen alten weiblichen C57BL/6J-Mäusen (A) vor der Depletion und (B) nach der Depletion von CD4+ und CD8+ unter Verwendung von Mikrokügelchen und LD-Säulen gemäß den Anweisungen des Herstellers. Die Punktdiagramme auf der linken Seite zeigen Tore basierend auf der Größe und Komplexität des Ereignisses (FCS-A bzw. SSC-A). Das mittlere Bild zeigt FSC-H im Vergleich zu FSC-A, um einzelne Zellen zu gate und Dubletten auszuschließen. In den Diagrammen auf der rechten Seite wurden die Zellen als CD4 und CD8 aus dem Einzelzell-Gate definiert. Abkürzungen: FSC-A = forward scatter-peak area; SSC-A = seitliche Streupeakfläche; FSC-H = Vorwärtsstreu-Peak-Höhe; FITC = Fluorescein-Isothiocyanat; PE = Phycoerythrin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
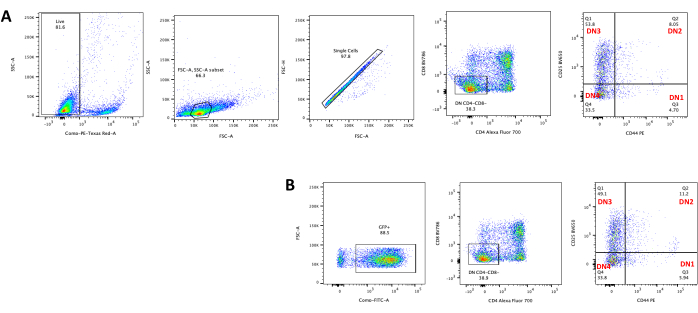
Abbildung 4: Durchflusszytometrie der retroviralen Transduktionseffizienz der Thymozyten. (A) Nicht transduzierte Thymozyten, die auf OP9-DL4 kokultiviert wurden; (B) retroviral transduzierte Thymozyten auf OP9-DL4 an Tag 3 nach der Transduktion. Abkürzungen: FSC-A = forward scatter-peak area; SSC-A = seitliche Streupeakfläche; FSC-H = Vorwärtsstreu-Peak-Höhe; FITC = Fluorescein-Isothiocyanat; PE = Phycoerythrin; DN = doppelt negativ. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
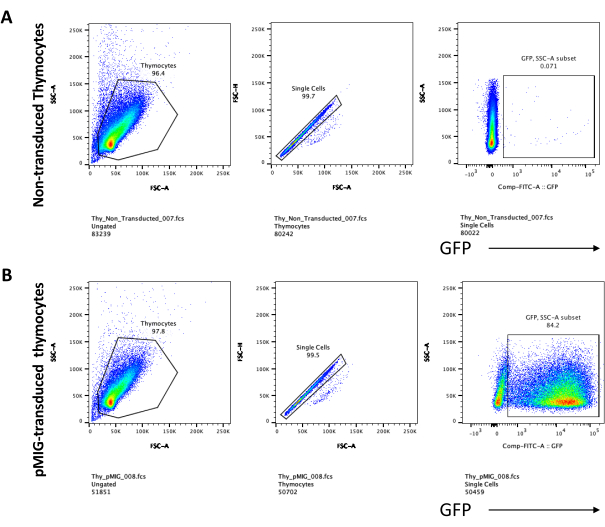
Abbildung 5: Durchflusszytometrie der transduzierten Thymozyten nach 4 Tagen OP9-DL4-Cokultur. (A) Nicht transduziert und (B) transduziert mit pMIG-Retrovirus. Die Zellen wurden zuerst auf lebende Zellen und dann auf der Grundlage von Größe und Komplexität (FCS-A bzw. SSC-A) gegiert, gefolgt von der Darstellung von FSC-H im Vergleich zu FSC-A, um einzelne Zellen zu erreichen und Dubletten auszuschließen. Für nicht transduzierte Zellen haben wir die folgende Gate-Strategie verwendet. Vom Einzelzell-Gate aus wurden die Zellen als einfach positiv (CD4+ oder CD8+), doppelt positiv (CD4+/CD8+) und doppelt negativ (CD4−/CD8−) definiert. Aus dem doppelt negativen Gatter (CD4−/CD8−) wurden die Zellen dann als CD44+, CD25+, CD44+/CD25+ und CD44−/CD25− definiert, wie in Abbildung A gezeigt. Für die pMIG-transduzierten Zellen, die in Tafel B gezeigt sind, wurden die Zellen aus dem Einzelzell-Gate zunächst als GFP+/GFP− definiert, und dann aus GFP+-Zellen wurde die Zellpopulationsverteilung in die wichtigsten T-Zell-Entwicklungsstadien, wie sie durch CD4-, CD8-, CD44- und CD25-Expression definiert sind, mit der gleichen Gate-Strategie wie für die untraducierten Zellen bestimmt. Abkürzungen: FSC-A = forward scatter-peak area; SSC-A = seitliche Streupeakfläche; FSC-H = Vorwärtsstreu-Peak-Höhe; FITC = Fluorescein-Isothiocyanat; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Das hier beschriebene Protokoll wurde speziell für Thymus-abgeleitete DN (CD4−/CD8−) T-Zell-Studien mit retroviraler Transfektion gefolgt von einem OP9-DL4-Differenzierungsmodell entwickelt. Es ist jedoch wahrscheinlich, dass die Zielzellen, die diesem Transduktionsprotokoll mit anschließender Zelldifferenzierung unterzogen werden, einen breiteren interdisziplinären Nutzen haben werden. Daher könnten neben unreifen Thymozyten auch hämatopoetische Stammzellen, wie z. B. Zellen, die entweder aus der fetalen Leber oder dem Knochenmark stammen, in diesem Protokoll verwendet werden.
Das OP9-DL4-System hat sich als effektives Modell erwiesen, um die Genfunktion in einer Vielzahl von Aspekten zu untersuchen, einschließlich der Zelldifferenzierung17 und der Onkogenese15. Während die retrovirale Modifikation hämatopoetischer Vorläuferzellen eine etablierte Technik ist, die eine stabile genetische Modifikation ermöglicht, erfordert die Kombination der Induktion der Zelldifferenzierung auf dem OP9-DL4-System und der retroviralen Transduktion Sorgfalt und Geschicklichkeit. Der entscheidende Aspekt, um mit diesem Protokoll erfolgreich zu sein, besteht darin, sicherzustellen, dass alle Schritte gut koordiniert sind, da das Protokoll die Verwendung von drei verschiedenen Zelltypen beinhaltet, die gesund und auf der idealen Konfluenz gehalten werden müssen, die für jede spezifische Phase erforderlich ist. Vor diesem Hintergrund ist es wichtig, alle Checkpoint-Analysen der Qualitätskontrolle nach der Ausführung jedes Schritts durchzuführen, bevor Sie mit dem nächsten Schritt fortfahren. Dadurch wird sichergestellt, dass alle Schritte funktionieren. Daher ist die Überprüfung der Verarmungs-, Transfektions- und Transduktionseffizienz wichtig für die erfolgreiche Ausführung dieses Protokolls (siehe ein typisches Ergebnis für die Transduktionseffizienz in Abbildung 4). Eine gute Transduktionseffizienz der Primärzellen ist mit einem hohen Virustiter verbunden. Typischerweise führen größere Einsätze zu niedrigeren Virustitern18. Zu Trainingszwecken verwenden wir einen leeren Vektor, um die Ergebnisse darzustellen, die mit diesem Protokoll erzielt werden können. Unserer Erfahrung nach variieren die Transduktions- und Transfektionseffizienzen je nach Insertgröße, insbesondere unter Berücksichtigung der viralen Backbone-exprimierenden Reportergene wie GFP. Eine Strategie, die bei der Untersuchung der Interaktion von mehr als einem Gen angewendet werden kann, besteht darin, jedes Gen in einen anderen Übertragungsvektor zu klonen, gefolgt von der individuellen Virusproduktion und schließlich der Co-Transduktion der Zielzelle. In diesem Fall kann ein Selektionsschritt angewendet werden, um die einfach transduzierten Zellen zu eliminieren und nur die co-transduzierten Zellen zu behalten.
Es ist erwähnenswert, dass die Mehrheit der OP9-DL1/DL4-Stroma-Feeder-Layer-Zelllinien gentechnisch so verändert wurde, dass sie GFP als Teil der DL1- oder DL4-Konstrukte exprimieren7. In diesem Protokoll verwendeten wir einen retroviralen Vektor, der auch GFP exprimiert; Es ist jedoch heller als das GFP-Protein, das von OP9-DL4-Zellen exprimiert wird, und stört die Transduktionsinspektion nicht, wenn die Co-Kultur unter dem Fluoreszenzmikroskop sichtbar wird.
OP9-Zellen differenzieren sich nach vielen Passagen, langen Perioden in Kultur oder unter Bedingungen einer Überkonfluenz zu Adipozyten19. Dies zeigt sich in der Entwicklung großer Vakuolen. Daher sollten OP9-Zellen, die diese Eigenschaften aufweisen, in diesem Protokoll nicht verwendet werden. Die Transfizierung von übermäßig konfluenten Retrovirus-produzierenden Zellen führt zu einem niedrigen Virustiter. In der Tat ist das subkonfluente Stadium die Phase, in der die Zellen am besten transfiktierbar sind. Darüber hinaus verringert die Transfektion von Retrovirus-produzierenden Zellen mit geringer Konfluenz den Zellstress im Transfektionsprozess und liefert den höchsten Virustiter.
Während wir in diesem Protokoll den Virusüberstand nicht titrieren, muss in einigen Fällen eine Titration des Virusüberstands in Betracht gezogen werden, z. B. wenn kein Reportergen im retroviralen Vektor vorhanden ist, was die indirekte Bestimmung der Virusproduktion verhindern würde, oder in Fällen, in denen das Versuchsdesign eine genauere Anzahl der Transgenkopien erfordert, die in das Genom der Zielzelle integriert werden müssen. Es ist jedoch wichtig zu beachten, dass der Titer des retroviralen Vektorüberstandes signifikant abnimmt, wenn er bei −80 °C oder 4 °C gelagert wird, bis die Titrationsergebnisse vorliegen. Daher führt die Verwendung eines frisch zubereiteten Virusüberstands für die Transduktion zu einer besseren Transduktionseffizienz.
Der Thymus enthält eine große Anzahl von doppelt positiven (DP) Thymozyten (mehr als 85 %) und etwa 10 % einfach positive15 Zellen (CD4 oder CD8), die die Thymozyten nach dem DN-Stadium sind. Die DP-Zellen können in vitro für retrovirale Manipulation nicht überleben, während die SP-Zellen nicht transduzierbar sind. Daher kann dieses Protokoll angewendet werden, um retrovirale Vektor-transduzierbare DN-Thymozyten zu generieren.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen
Danksagungen
Diese Arbeit wurde durch das intramurale Programm des National Cancer Institute, Projekt ZIABC009287, unterstützt. OP9-DL4 wurde von Dr. Juan Carlos Zúñiga-Pflücker (Sunnybrook Health Sciences Centre, Toronto, ON, Kanada) erhalten. Die Autoren danken dem NCI-Frederick Laboratory Animal Sciences Program für ihre kontinuierliche technische Unterstützung und experimentelle Beratung und ihren Input sowie Jeff Carrel, Megan Karwan und Kimberly Klarmann für die Unterstützung bei der Durchflusszytometrie. Wir danken Howard Young für kritische Ratschläge und Anregungen.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma | M3148 | |
| ACK Lysis buffer | Lonza | 10-548E | |
| BSA | Cell Signaling Technology | 9998S | |
| CD4 Microbeads | Miltenyi | 130-049-201 | |
| CD8 Microbeads | Miltenyi | 130-049-401 | |
| Centrifuge 5910R | eppendorf | 5942IP802353 | |
| DMEM | Corning | 10-013-CV | |
| EDTA | Invitrogen | 15575-038 | |
| Fetal calf serum HyClone FBS | ThermoScientific | SH30910.03 | |
| LD columns | Miltenyi | 130-042-901 | |
| L-glutamine | Sigma | G7513 | Freeze glutamine in aliquots and use freshly-thawed glutamine |
| Lipofectamine 2000 | Invitrogen | P/N 52887 | |
| MEM-alpha Medium | Gibco | 12561-072 | |
| OPTI-MEM I Reducing Serum Medium | Invitrogen | 31985-062 | |
| PBS pH 7.2 | Corning | 21-040-CV | |
| pcL-Eco Plasmid | Addgene | 12371 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| pMIG Plasmid | Addgene | 6492 | |
| Polybrene | Chemicon | TR-1003-G | |
| Pre-Separation Filters | Miltenyi | 130-041-407 | |
| recombinant hFLT-3L | PeproTech | 300-19 | |
| recombinant IL-7 | Peprotech | 217-17 | |
| Retrovial packaging cell line Phoenix-Eco | Orbigen | RVC-10002 | |
| Syringe filter (0.45 µm) | Millipore | SLHV033RS |
Referenzen
- Zuniga-Pflucker, J. C. T-cell development made simple. Nature Reviews Immunology. 4 (1), 67(2004).
- Kodama, H., Nose, M., Niida, S., Nishikawa, S., Nishikawa, S. Involvement of the c-kit receptor in the adhesion of hematopoietic stem cells to stromal cells. Experimental Hematology. 22 (10), 979-984 (1994).
- Nakano, T., Kodama, H., Honjo, T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science. 265 (5175), 1098-1101 (1994).
- Nakano, T., Kodama, H., Honjo, T. In vitro development of primitive and definitive erythrocytes from different precursors. Science. 272 (5262), 722-724 (1996).
- Ueno, H., et al. A stromal cell-derived membrane protein that supports hematopoietic stem cells. Nature Immunology. 4 (5), 457-463 (2003).
- Jaleco, A. C., et al. Differential effects of Notch ligands Delta-1 and Jagged-1 in human lymphoid differentiation. Journal of Experimental Medicine. 194 (7), 991-1002 (2001).
- Mohtashami, M., et al. Direct comparison of Dll1- and Dll4-mediated Notch activation levels shows differential lymphomyeloid lineage commitment outcomes. Journal of Immunology. 185 (2), 867-876 (2010).
- Schmitt, T. M., Zuniga-Pflucker, J. C. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity. 17 (6), 749-756 (2002).
- Mazzucchelli, R., Durum, S. K. Interleukin-7 receptor expression: Intelligent design. Nature Reviews Immunology. 7 (2), 144-154 (2007).
- Robey, E. A., Bluestone, J. A. Notch signaling in lymphocyte development and function. Current Opinion in Immunology. 16 (3), 360-366 (2004).
- Lavaert, M., et al. Integrated scRNA-Seq identifies human postnatal thymus seeding progenitors and regulatory dynamics of differentiating immature thymocytes. Immunity. 52 (6), 1088-1104 (2020).
- Roh, K. H., Roy, K. Engineering approaches for regeneration of T lymphopoiesis. Biomaterials Research. 20 (20), (2016).
- Zlotoff, D. A., et al. CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus. Blood. 115 (10), 1897-1905 (2010).
- Holmes, R., Zuniga-Pflucker, J. C. The OP9-DL1 system: Generation of T-lymphocytes from embryonic or hematopoietic stem cells in vitro. Cold Spring Harbor Protocols. 2009 (2), (2009).
- Cramer, S. D., et al. Mutant IL-7Ralpha and mutant NRas are sufficient to induce murine T cell acute lymphoblastic leukemia. Leukemia. 32 (8), 1795-1882 (2018).
- Treanor, L. M., et al. Interleukin-7 receptor mutants initiate early T cell precursor leukemia in murine thymocyte progenitors with multipotent potential. Journal of Experimental Medicine. 211 (4), 701-713 (2014).
- Yokoyama, K., et al. In vivo leukemogenic potential of an interleukin 7 receptor alpha chain mutant in hematopoietic stem and progenitor cells. Blood. 122 (26), 4259-4263 (2013).
- Simmons, A., Alberola-Ila, J. Retroviral transduction of T cells and T cell precursors. Methods in Molecular Biology. 1323, 99-108 (2016).
- Retroviral systems. , Nolan Lab. Available from: https://web.stanford.edu/group/nolan/_OldWebsite/retroviral_systems/retsys.html (2022).
- Xing, Y., Hogquist, K. A. Isolation, identification, and purification of murine thymic epithelial cells. Journal of Visualized Experiments. (90), e51780(2014).
- Gray, D. H., et al. Developmental kinetics, turnover, and stimulatory capacity of thymic epithelial cells. Blood. 108 (12), 3777-3785 (2006).
- Godfrey, D. I., Kennedy, J., Suda, T., Zlotnik, A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3-CD4-CD8- triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. Journal of Immunology. 150 (10), 4244-4252 (1993).
- Wang, Y. B., Edinger, M., Mittar, D., McIntyre, C. Studying mouse thymocyte development using multiparametric flow cytometry: An efficient method to improve an 8-color panel on the BD FACSVerse™ system. BD Biosciences–Application Note. , (2012).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- He, X., Park, K., Kappes, D. J. The role of ThPOK in control of CD4/CD8 lineage commitment. Annual Review of Immunology. 28, 295-320 (2010).
- Wang, Y., et al. A conserved CXXC motif in CD3epsilon is critical for T cell development and TCR signaling. PLoS Biology. 7 (12), e1000253(2009).
- Aliahmad, P., Kadavallore, A., de la Torre, B., Kappes, D., Kaye, J. TOX is required for development of the CD4 T cell lineage gene program. Journal of Immunology. 187 (11), 5931-5940 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten