Method Article
תרבית משותפת והתמרה של תימוציטים מורינים על תאי סטרומה דמויי דלתא המבטאים 4 כדי לחקור אונקוגנים בלוקמיה של תאי T
In This Article
Summary
פרוטוקול זה מתאר בידוד של תימוציטים שליליים כפולים מתימוס העכבר ולאחר מכן התמרה רטרו-ויראלית ותרבית משותפת על מערכת תרבית משותפת של קו תאי סטרומה דמוי מח עצם דמוי דלתא (OP9-DL4) לניתוח פונקציונלי נוסף.
Abstract
ניתן להתמיין לתאי T במבחנה באמצעות מערכת התרבית המשותפת של קו תאי סטרומה דמוי דלתא דמוית מח עצם (OP9-DL4). מכיוון שהתמרה רטרו-ויראלית דורשת חלוקת תאים לצורך אינטגרציה טרנסגנית, OP9-DL4 מספק סביבה מתאימה במבחנה לטיפוח תאי אב המטופויטיים. זה יתרון במיוחד כאשר לומדים את ההשפעות של ביטוי של גן מסוים במהלך התפתחות נורמלית של תאי T ולוקמוגנזה, כפי שהוא מאפשר לחוקרים לעקוף את התהליך זמן רב של יצירת עכברים טרנסגניים. כדי להשיג תוצאות מוצלחות, סדרה של צעדים מתואמים הכוללים מניפולציה בו זמנית של סוגים שונים של תאים חייב להתבצע בקפידה. למרות שמדובר בנהלים מבוססים מאוד, היעדר מקור משותף בספרות פירושו לעתים קרובות שנדרשת סדרה של אופטימיזציות, שיכולות לגזול זמן. פרוטוקול זה הוכח כיעיל בהתמרת תימוציטים ראשוניים ולאחר מכן התמיינות בתאי OP9-DL4. מפורט כאן פרוטוקול שיכול לשמש כמדריך מהיר וממוטב לתרבית משותפת של תימוציטים מותמרים רטרו-ויראלית על תאי סטרומה OP9-DL4.
Introduction
קו תאי סטרומה מח עצם OP9 מספק מערכת מבחנה שימושית להשראת לימפופואזיס ממספר מקורות של אבות1. המחקרים הראשונים שהשתמשו בתאי OP9 הראו כי היעדר ביטוי של גורם מגרה מושבת מקרופאגים (MCSF) תרם ליכולת של קו תאי OP9 לתמוך בהמטופויזה ובהתמיינות תאי B מתאי גזע המטופויטיים שמקורם במח עצם (HSCs), כפי שהוכח מאוחר יותר גם עבור תאי גזע עובריים (ESC)2,3,4,5 . במחקרים קודמים, יצירת תאי OP9 דמויי דלתא המבטאים 1/4 (OP9-DL1/OP9-DL4) אפשרה את השראת מחויבות שושלת תאי T6 והדגימה את היכולת לשחזר בהצלחה את ההבשלה התימית 7,8. בקצרה, התפתחות תאי T תוארה על ידי ביטוי רציף של מולקולות CD4 ו- CD8. תימוציטים לא בשלים הם "שליליים כפולים" (DN, CD4− CD8−) וניתן לחלק אותם עוד יותר בהתאם לביטוי פני השטח של CD44 ו- CD25. DN thymocytes מתמיינים באמצעות שלב חיובי יחיד (ISP) לא בשל, המאופיין בביטוי CD8 בעכברים ו- CD4 בבני אדם, ואחריו שלב חיובי כפול (DP), המאופיין בביטוי משותף של CD4 ו- CD8, ולבסוף, שלב חיובי יחיד בוגר, המאופיין בביטוי של CD4 או CD89. HSCs מבטאים את קולטן Notch1, אשר בדרך כלל מקיים אינטראקציה עם 4 דמוי דלתא (DL4) המתבטא על תאי אפיתל תימיים כדי לגרום להתמיינות שושלת T10. לפיכך, העניין במודל OP9-DL1/4 גדל בהדרגה, מה שהוביל לשימוש נרחב בגישה זו במגוון רחב של יישומים בשני העשורים האחרונים 8,11,12,13. למרות ש-DL1 ו-DL4 מסוגלים שניהם לתמוך בהתמיינות תאי T במבחנה, הם מראים דרישות דיפרנציאליות in vivo, וכמה מחקרים הציעו כי OP9_DL4 יעיל יותר מ-OP9_DL1 בשחזור הסביבה התימית של העכבר 7,14.
בין היישומים הפוטנציאליים של מערכת OP9-DL1/4, יש עניין מיוחד בשילוב של מערכת זו עם התמרה של תאי DN או HSCs עם וקטורים רטרו-ויראליים. שילוב זה הוא דרך יעילה לתמרן ביטוי גנים במהלך התפתחות תקינה של תאי T ולוקמוגנזה והוכח כשיטה יעילה לגרום או לעכב את תפקודו של גן מעניין15,16,17. מודל זה שימש בהצלחה רבה לחקר שיתוף הפעולה בין האונקוגנים המניעים לוקמיה15 מכיוון שהוא גמיש ומאפשר לבחון את ההשפעות של שילובי גנים מרובים בזמן סביר, בניגוד ליצירת עכברים טרנסגניים. יתר על כן, מודלים דומים שימשו בעבר כדי להעריך את ההשפעות של החדרת אונקוגנים לתאים נורמליים15,16,17. בנוסף, התמרה רטרו-ויראלית דורשת חלוקת תאים לאינטגרציה טרנסגנית18, ובעוד שהתמרה לנטיויראלית תתגבר על מגבלה זו על ידי ביטול הצורך בחלוקת תאים לאינטגרציה טרנסגנית, לא הצלחנו להשיג את ההעברה המוצלחת של תימוציטי DN באמצעות וקטורים לנטי-ויראליים. לפיכך, OP9-DL1/DL4 הוא כלי מתאים לגידול תאי אב המטופויטיים.
הפרוטוקול הסטנדרטי ללימפופואזיס של תימוציטים מומרים ב- OP9-DL4 כולל סדרה של צעדים מתואמים שיש לבצע בזהירות כדי להשיג תוצאה מוצלחת. למרות שמדובר בטכניקות שמשרתות היטב את הקהילה כבר שנים רבות, לעתים קרובות הפרוטוקולים הזמינים בספרות מקוטעים. כתוצאה מכך, כל מעבדה נאלצת להתאים ולייעל שלבים שונים של ההליך, אשר יכול להיות זמן רב. כאן, פרוטוקול זה מתאר את הבידוד של DN thymocytes מ בלוטת התימוס של העכבר, ואחריו התמרה רטרו-ויראלית ותרבית משותפת על תאי סטרומה OP9-DL4 לניתוח פונקציונלי נוסף. פרוטוקול מבוסס זה הוכח כיעיל וניתן לשחזור בהתמרת תימוציטים ראשוניים, ואחריו התמיינות בתאי OP9-DL4 או השראת לוקמיה לימפובלסטית חריפה של תאי T15.
Protocol
כל הניסויים המתוארים בבעלי חיים אושרו על ידי הוועדה המוסדית לבטיחות ביולוגית של NIH (IBC) והוועדה לטיפול ושימוש בבעלי חיים (ACUC). עיין בטבלת החומרים לפרטים הקשורים לכל הריאגנטים והחומרים המשמשים בפרוטוקול זה. עיין בהנחיותשפורסמו 19 לקבלת פרטים נוספים על תרבית תאים מפיק רטרו-וירוס ונהלי תחזוקה. ראה איור 1 לקבלת סקירה כללית של הפרוטוקול.
1. התחלת תרבית תאי OP9-DL4 (יום 1)
- הפשירו תאי OP9-DL4 במהירות על ידי החזקת הבקבוקון וניעור עדין באמבט מים בטמפרטורה של 37°C. העבר מיד את התאים לצינור צנטריפוגה המכיל 5 מ"ל של תווך OP9 (מדיום MEM-אלפא, 10% FBS, 50 U/mL פניצילין/סטרפטומיצין, 55 מיקרומטר 2-מרקפטואתנול, 2 מ"מ L-גלוטמין) כדי להסיר את חומרי ההקפאה.
- צנטריפוגה ב 300 × גרם במשך 5 דקות בטמפרטורת החדר. השליכו את הסופרנטנט, והשעו מחדש את התאים ב-1 מ"ל של תווך OP9.
- הכניסו 5 מ"ל של OP9 בינוני לצלוחית T25, והוסיפו את התאים המרחפים לצלוחית זו. תרבית ב 37 ° C ו 5% CO2.
- לאחר 2-3 ימים, תרבית משנה של התאים באמצעות פיצול של 1:3 (עוברים את התאים בכל יום שני, רביעי ושישי).
הערה: פצל את תאי OP9-DL4 לפני שהם מגיעים למפגש. בקבוק OP9-DL4 חייב להיות 80%-90% במפגש בימים 6-7 ובימים 8-9+ לתרבית משותפת עם תימוציטים. לכן, חשוב לתכנן כמה תאי OP9-DL4 יידרשו בימים אלה בעת פיצול תאי OP9-DL4.- השליכו את המדיום מהצלוחית, ושטפו את המונושכבה עם 1x PBS. יש להשליך את PBS, להוסיף 1 מ"ל של 0.25% טריפסין, ולדגור במשך 1-5 דקות ב 37 ° C, או עד התאים נעקרו מן הצלוחית. חבטו בבקבוק כדי לעקור את התאים.
הערה: (אופציונלי) ניתן לבדוק את התקדמות הדיסוציאציה של התא באמצעות מיקרוסקופיה. - הוסף 5 מ"ל של מדיום OP9 כדי להשבית את הטריפסין, והשהה מחדש את התאים על ידי שטיפת פני השטח המכוסים בתאים של הבקבוק במהלך ההשעיה.
- צנטריפוגה את מתלה התא ב 300 × גרם למשך 5 דקות בטמפרטורת החדר והשעיה מחדש ב 3 מ"ל של OP9 בינוני (עבור פיצול 1: 3).
- מניחים 1 מ"ל של תרחיף התא לתוך בקבוק T25 שכבר מכיל 5 מ"ל של תווך OP9 טרי. הקפא/השליך את התאים הנותרים.
- כדי להקפיא את תאי OP9-DL4, השהה מחדש את התאים ב- 90% FBS/10% DMSO ביחס של 1 מ"ל של מדיום הקפאה לבקבוקון אחד של תאים.
- יש להקפיא בקריובלים של 1 מ"ל בטמפרטורה של -80°C או בחנקן נוזלי, בהתאם לדרישות העתידיות. יש לאחסן בחנקן נוזלי לאחסון ממושך.
- השליכו את המדיום מהצלוחית, ושטפו את המונושכבה עם 1x PBS. יש להשליך את PBS, להוסיף 1 מ"ל של 0.25% טריפסין, ולדגור במשך 1-5 דקות ב 37 ° C, או עד התאים נעקרו מן הצלוחית. חבטו בבקבוק כדי לעקור את התאים.
2. התחלת התרבית של קו התאים של יצרן רטרו-וירוס (יום 1)
- הפשירו את קו התאים של יצרן הרטרו-וירוס במהירות על ידי החזקת הבקבוקון וניעור עדין באמבט מים בטמפרטורה של 37°C. העבר מיד את התאים לצינור צנטריפוגה המכיל 5 מ"ל של תווך תא יצרן רטרו-וירוס (RPC: DMEM, 10% FBS) כדי להסיר את סוכן cryoprotectant.
- צנטריפוגה ב 300 × גרם במשך 5 דקות בטמפרטורת החדר. להשליך את supernatant, ולהשעות מחדש את התאים ב 1 מ"ל של מדיום RPC.
- מניחים 5 מ"ל של מדיום RPC לתוך בקבוק T25, ומוסיפים את התאים המרחפים לצלוחית זו. תרבית ב 37 ° C ו 5% CO2.
- עברו את התאים כל 2-3 ימים בפיצול של 1:5 עד 1:8.
- חבטו בבקבוק כדי לעקור את התאים, והשהו מחדש את התאים על ידי פיפטינג אגרסיבי.
הערה: ניתן להסיר תאים אלה משטח הבקבוק על ידי פיפטינג אגרסיבי ללא טריפסין. לחלופין, טריפסיניזציה (0.05% טריפסין/0.53 מילימטר EDTA) עד שהתאים מתנתקים בקלות וניתן להפוך אותם בקלות לתרחיף חד-תאי.
- חבטו בבקבוק כדי לעקור את התאים, והשהו מחדש את התאים על ידי פיפטינג אגרסיבי.
- צנטריפוגה את מתלה התא ב 300 × גרם במשך 5 דקות, והשהיה מחדש ב 5 מ"ל של RPC בינוני (עבור פיצול 1: 5).
- מניחים 1 מ"ל של תרחיף התא לתוך בקבוק T25 שכבר מכיל 5 מ"ל של מדיום RPC טרי. הקפא/השליך את התאים הנותרים. הקפיא את התאים המפיקים רטרו-וירוס באותו אופן המתואר עבור תאי OP9-DL4 (שלבים 1.4.4.1–1.4.4.2).
3. התחלת תרבית תאי יצרן הרטרו-וירוס בצלחות 6-באר (ימים 4-5)
- זרעו את התאים המפיקים רטרו-וירוס 18-24 שעות לפני הטרנספקציה במפגש של 70%-90% בכל באר של צלחת תרבית רקמה בת 6 בארות ב-2 מ"ל של תווך RPC, ודגרו ב-37°C ו-5% CO2.
הערה: הדבק שתי בארות של תאים מפיקי רטרו-וירוס עבור כל 2-5 × 105 עד 1 × 106 תימוציטים שיותמרו.
4. הדבקת תאי הרטרו-וירוס המפיקים ליצירת הרטרו-וירוס המכיל את הגנים המעניינים (ימים 5-6)
- החלף את המדיום בתווך RPC טרי 1 שעה לפני ההעברה.
- הכינו תערובות ליפופקציה (לכל באר של צלחת בעלת 6 בארות – הגדילו לפי הצורך): דללו 4 מיקרוגרם דנ"א (2 מיקרוגרם פלסמיד עוזר (pCL-Eco) ו-2 מק"ג פלסמיד העברה (pMIG) ב-250 מיקרוליטר של תווך סרום מופחת. מערבבים בעדינות.
- מערבבים 10 μL של מגיב transfection עם 250 uL של מדיום סרום מופחת משלב 4.2. דוגרים במשך 5 דקות בטמפרטורת החדר.
- לאחר 5 דקות של דגירה, לשלב את ה- DNA מדולל עם מגיב transfection מדולל (נפח כולל = 500 μL). מערבבים בעדינות ודגרים במשך 20-25 דקות בטמפרטורת החדר.
- הוסף את 500 μL של תערובות מגיב DNA / transfection בעדינות לבאר המכילה את התאים המפיקים רטרווירוס על ידי ירידה על התאים בתנועה מעגלית. מערבבים בעדינות על ידי נדנוד הצלחת קדימה ואחורה, ודגרים על הצלחת באינקובטור של 37 מעלות צלזיוס למשך 16-24 שעות.
הערה: תאים תת-פלואנטיים (80%-90%) הם המתאימים ביותר לטרנספקציה ועשויים לייצר את הטיטר הנגיפי הגבוה ביותר. מכיוון שהתאים המפיקים רטרו-וירוס נעקרים בקלות רבה מהצלוחית, הימנעו מתנועות פתאומיות בעת הטיפול בתאים אלה.
5. שינוי תווך התא המפיק רטרו-וירוס (ימים 6-7)
- החלף את המדיום הישן כ 16 שעות לאחר transfection עם 2 מ"ל של מדיום RPC טרי. המשך לדגור על תאים ב 37 ° C במשך 20-24 שעות.
- להעריך את יעילות transfection תחת מיקרוסקופ פלואורסצנטי (אופציונלי).
הערה: בפרוטוקול זה, תאים חיוביים ל-GFP הם התאים המעניינים (ראו איור 2). שלב זה תלוי בווקטור הרטרו-וירוס שנבחר לשימוש בפרוטוקול זה (האם גן מדווח נמצא בעמוד השדרה).
6. הכנת תימוציט ודלדול תאי CD4+ ו-CD8+ (ימים 6-7)
- קצרו את בלוטת התימוס מעכבר C57BL/6 בן 4-6 שבועות. לפרטים נוספים על קצירת בלוטת התימוס, ראו Xing and Hogquist20.
הערה: עכברים הומתו על ידי שאיפת CO2 ואחריה נקע צוואר הרחם. - הכינו תרחיף חד-תאי של תימוציט על-ידי הנחת בלוטת התימוס ב-5 מ"ל PBS בצלחת פטרי. בעזרת מגלשות זכוכית סטריליות, הניחו את בלוטת התימוס בין המשטחים החלביים של המגלשות, ושפשפו בעדינות את המגלשות זו בזו, תוך גלגול בלוטת התימוס בין שתי המגלשות. שטפו את שקופיות הזכוכית כדי לאסוף את התאים, והשליכו את שאריות רקמת הסטרומה התימית.
הערה: התפוקה המשוערת מבלוטת תימוס אחת היא 90 × 10 6-100 ×10 6 תאים, וכ-1% מהתאים יישארו לאחר דלדול CD4 ו-CD8. השתמשו ברקמת בלוטת התימוס מעכברים צעירים יותר לתפוקה טובה יותר של תאים, שכן התאיות של בלוטת התימוס של העכבר בשבועות הראשונים לאחר הלידה עולה במהירות, מגיעה לרמה בגיל 4-6 שבועות, ובהדרגה מעוררת21. ספור את התאים באמצעות מונה תאי דם אוטומטי או כל שיטה חלופית. - סננו את התרחיף התימי דרך מסנן של 30 מיקרומטר או 40 מיקרומטר על ידי פיפטציה של 5 מ"ל של התרחיף התימי דרך מסננת תאים. צנטריפוגה את התאים ב 300 × גרם במשך 10 דקות.
- הסר את supernatant, ו lyse את תאי הדם האדומים עם מאגר ליזה ACK על ידי הוספה (בהתאם לגודל הדגימה) 1 מ"ל של חיץ לכל צינור במשך 1 דקות. הוסף 5 מ"ל של מאגר דלדול תאים (500 מ"ל של PBS [pH 7.2], 0.5% BSA, 2 mM 0.5M EDTA, pH 8.0) כדי להשבית את מאגר ACK lysis, צנטריפוגה ב 300 × גרם למשך 10 דקות, והשהה מחדש ב 1-5 מ"ל של מאגר דלדול התא לספירה.
הערה: הניחו בצד את הדברים הבאים על קרח לפני דלדול (לפני דלדול): 70 μL של תרחיף תאים לספירה (שנו זאת בהתאם לשיטת תא הספירה שנבחרה) ו-200 μL של תרחיף תאים כדי לקבוע את יעילות הדלדול על ידי צביעה עבור CD4 ו-CD8 וניתוח לפי ציטומטריית זרימה22,23. - ספרו את התאים ואת הצנטריפוגה ב-300 × גרם למשך 10 דקות. השהה מחדש את התאים ב- 1 × 107/80 μL של מאגר דלדול תאים. הוסף 10 μL כל אחד של CD4 ו CD8 microbeads לכל 1 × 107 תאים. מערבבים היטב, ודגרים במשך 15 דקות בחושך במקרר (2-8 מעלות צלזיוס).
- הכינו עמוד דלדול על ידי שטיפתו ב-2 מ"ל של חיץ דלדול והשלכת הזרימה.
- שטפו את התאים משלב 6.6 על ידי הוספת 1-2 מ"ל של חיץ דלדול לכל 1 × 107 תאים, וצנטריפוגה ב 300 × גרם למשך 10 דקות. הסר והשליך את הסופר-נטנט.
- השהה עד 1.25 × 108 תאים ב 500 μL של מאגר דלדול. החל את השעיית התא על העמודה ואסוף את הזרימה (תאים ללא תווית). שטפו את העמודה 2x עם 1 מ"ל של חיץ, ואספו את הזרימה.
הערה: הוסף מאגר חדש רק כאשר מאגר העמודות ריק. הניחו בצד את הדברים הבאים על קרח לאחר דלדול (בקרת דלדול): 70 מיקרוליטר של תרחיף תאים לספירה (שנו זאת בהתאם לשיטת תא הספירה שנבחרה) ו-1,000 מיקרוליטר של תרחיף תאים כדי לקבוע את יעילות הדלדול על ידי צביעה עבור CD4 ו-CD8 וניתוח לפי ציטומטריית זרימה22,23. - הכתימו את בקרות יעילות הדלדול על ידי פיצול 200 μL של תאים שנאספו לפני הדלדול לארבעה צינורות FACS: לא מוכתם, CD4 מוכתם יחיד, CD8 מוכתם יחיד ו- CD4 / CD8 מוכתם כפול (השתמש בדגימות לא מוכתמות ומוכתמות בודדות כדי להגדיר את פרמטרי ציטומטריית הזרימה). השתמשו ב-1,000 מיקרוליטר התאים שנאספו לאחר הדלדול כדי להכתים CD4 ו-CD8 והשוו עם הדגימה המוכתמת הכפולה שנאספה לפני הדלדול (ראו תוצאות דלדול אופייניות באיור 3).
הערה: התאם את הנפחים לצביעת ציטומטריית זרימה בהתאם להמלצת יצרן הנוגדנים (לדוגמה, 1 μL של anti-CD4-FITC + 0.5 μL של anti-CD8-PE לכל 1 x 106 תאים ב 50 μL של חיץ).
7. גידול תימוציטים על תאי OP9-DL4 (ימים 6-7)
- הכניסו 2-5 × 10,5 עד 1 × 10,6 תימוציטים לאחר דלדול לתוך בקבוק T25 של 80%-90% תאי OP9-DL4 בזרם OP9 בתווך OP9 המכיל ציטוקינים (10 ng/mL רקומביננטי IL-7 ו-hFLT-3 רקומביננטי). תרבית ב 37 ° C ו 5% CO2. גדל במשך כ-24 שעות על תאי OP9-DL4.
הערה: משך זמן זה נדרש כדי להפוך את תאי T לניתנים להמרה (ראו תוצאה טיפוסית באיור 4). שמור בקבוק T25 אחד של תרבית משותפת של תימוציטים ותאי OP9-DL4 לשימוש כבקרה (ללא טרנספורמציה). התימוציטים שלא עברו המרה יוכתמו יחד עם התימוציטים המומרים (שלב 9.1) כבקרה שלילית להערכת יעילות הטרנסדוקציה. תימוציטים לא מותמרים יכולים לשמש גם למדידת ההשפעה של ביטוי טרנסגנים על התמיינות תאים. יש להשליך את התווך המכיל ציטוקינים לאחר חודש.
8. קצירת הרטרו-וירוס מהסופרנאטנט ושימוש בו להעברת התימוציטים (ימים 8-9)
- אספו את הסופרנאטנט המכיל את הרטרו-וירוסים מהתאים הנגועים על ידי הטיית צלחת 6 בארות ומיקום מזרק 3-5 מ"ל בתחתית הצלחת תוך משיכת הבוכנה כדי לשאוף את הסופרנטנט. החלף את המדיום עם 2 מ"ל של מדיום RPC טרי. המשך לדגור על התאים ב 37 ° C במשך 20-24 שעות עבור ההתמרה השנייה בשלב 8.9.
- מסננים את הסופרנאטנט רטרו-וירוס דרך מסנן מזרק 0.45 מיקרומטר, ואוספים את התסנין בצינור של 50 מ"ל.
הערה: אין להקפיא את הסופרנטנט הרטרו-ויראלי. השתמש בהכנת וירוס טרי להתמרה. - אספו תימוציטים מתרבית OP9-DL4 על ידי פיפטינג אגרסיבי כדי להסיר את תאי התימוציט ותאי OP9-DL4 מפני השטח של הבקבוק. סנן את תרחיף התא דרך מסננת תאים של 40 מיקרומטר כדי להסיר את רוב תאי OP9-DL4, ואסוף את התסנין בצינור של 50 מ"ל.
הערה: תאי OP9 דבקים מאוד. למרות שצנרת אגרסיבית עשויה להסיר חלק מתאי OP9-DL4 מהבקבוק, ההפרעה של החד-שכבה OP9-DL4 במהלך תהליך זה היא מינימלית, ותאי OP9-DL4 שיורדים יסוננו החוצה עם מסננת תאים של 40 מיקרומטר, מכיוון שתאי OP9-DL4 גדולים בהרבה מהתימוציטים הראשוניים. אם תאי OP9-DL4 עדיין חופפים ב-80%-90%, הסירו את התימוציטים, והכניסו אותם מחדש לאותה צלוחיות OP9-DL4. לחלופין, יש להכין בקבוק OP9-DL4 חדש. - צנטריפוגה את התימוציטים בתסנין משלב 8.3 ב 300 × גרם במשך 5 דקות. השליכו את הסופרנטנט.
- בצינור 50 מ"ל, להשעות מחדש את התימוציטים ב 0.5-1 מ"ל של OP9 בינוני + ציטוקינים (ראה שלב 7.1). הוסף 1-2 מ"ל של מדיום RPC המכיל את הנגיף (פי שניים מדיום RPC מאשר מדיום תימוציט). הוסף הקסמתרין ברומיד (ריכוז מלאי של 10 מיקרוגרם/מיקרוליטר) כדי להניב 8 מיקרוגרם של הקסמתרין ברומיד/מ"ל של תרחיף התאים הכולל.
- Spinoculate על ידי צנטריפוגה התאים ב 850 × גרם במשך 1 שעה בטמפרטורת החדר.
- השהה מחדש את התאים ב-6 מ"ל של OP9 בינוני + ציטוקינים לכל בקבוק (ראה שלב 7.1), והוסף את המתלה בחזרה לחד-שכבה של תאי OP9-DL4.
הערה: לחלופין, הצטיידו בצלוחיות OP9-DL4 חדשות מוכנות לקליטת התימוציטים המותמרים. אם רוצים להחזיר את התימוציטים לצלוחית OP9-DL4 משומשת, יש להקפיד להוסיף תווך OP9 טרי לתאי OP9-DL4 במהלך שעה אחת של ספינוקולציה של תימוציטים כדי לשמור על בריאות התאים ולהבטיח מפגש של 80%-90%. - לדגור ב 37 °C (77 °F) במשך הלילה.
- חזור על שלבים 8.2-8.7 באמצעות באר חדשה של סופרנטנט התא המכיל רטרו-וירוס.
9. שמירה על תימוציטים מומרים בתרבית OP9-DL4 למשך 2-5 ימים או הקפאה לפי הצורך (יום 9+)
- הערך את התמיינות התימוציט על ידי ציטומטריית זרימה על ידי צביעת תימוציטים עבור סמני התפתחות תאי T כגון CD4, CD8, CD25 ו- CD4423. ראו תוצאות התמיינות טיפוסיות של תימוציטים באיור 5.
תוצאות
ניתן להעריך את יעילות הדלדול באופן ציטומטרי על-ידי תיוג מקטע התא הלא מסומן מגנטית עבור CD4 ו-CD8 לאחר הפרדת תאים אימונומגנטית (MACS) וניתוח זה על חלקת נקודות דו-ממדית דו-משתנית (איור 3). תפוקה טובה של תאים שליליים כפולים (CD4−, CD8−) היא 95% ומעלה, כפי שמיוצג באיור 3. שתיים מהסיבות הנפוצות ביותר לתנובה נמוכה יותר הן חישוב שגוי של מיקרו-כדוריות בהתבסס על מספר התאים ומספר התאים המסומנים החורגים מקיבולת העמודה. מומלץ לבחור את המספר הנכון של עמודות MACS בהתאם למספר התאים המסומנים. כאשר עובדים עם תימוציטים, מספר התאים המסומנים (תאי DP ו- SP) כמעט שווה למספר התאים הכולל (יותר מ -96%). ספירת תאים יכולה להיעשות במונה תאים אוטומטי, תא נויבאואר, או בכל שיטה חלופית. כתוצאה מכך, ייתכן שיהיה צורך להתאים את אמצעי האחסון המוקצים לספירת תאים בהתאם למכונה הספציפית ולשיטת הספירה שנבחרה.
חשוב לקבוע את מספר התאים הנוכחים לפני ואחרי התרוקנות. ספירות תאים אלה נחוצות כדי לחשב את מספר עמודות דלדול LD הדרושות וכדי לחלק באופן שווה את תימוציטי DN למספר המתאים של צלוחיות OP9-DL4. ניתן לבצע את הפקדים עבור ציטומטריית זרימה (תאים ללא תווית, תאים המסומנים עבור CD4 ותאים המסומנים עבור CD8) עם הדגימה השמורה לפני הדלדול, מכיוון שהיא מכילה תאים נוספים. עם זאת, מכיוון שרוב התאים צפויים להישמר בתוך העמודה, הדגימה שלאחר הדלדול שתסומן תדרוש נפח גבוה יותר. כתוצאה מכך, ייתכן שיהיה צורך לבצע התאמות בהתאם לפרוטוקול ההתוויה שנבחר.
כאשר משתמשים בווקטורים שמבטאים סמנים הניתנים להקרנה, כמו למשל גן פלואורסצנטי, ניתן להעריך באופן גס ואמפירי את הטרנספקציה והטרנסדוקציה באמצעות מיקרוסקופ פלואורסצנטי (איור 2). ניתן לנתח את יעילות ההולכה על ידי קצירת התימוציט מהחד-שכבה OP9-DL4, כמתואר בשלב 8.3, והסתכלות על ביטוי גן פלואורסצנטי על ידי ציטומטריית זרימה. יעילות ההתמרה באמצעות וקטור רטרו-ויראלי ריק עם GFP כגן המדווח הייתה 84.2% (איור 4).
התמיינות תאי T בתאי OP9-DL4 ניתן לראות 4 ימים לאחר ההתמרה. ציטומטריית זרימה מבוצעת בדרך כלל כדי להעריך את התמיינות התאים המושרה על-ידי תרבית משותפת על תאי OP9-DL4 ו/או ביטוי טרנסגנים, כפי שמיוצג באיור 5, שבו התאים סומנו עבור CD4, CD8, CD44 ו-CD25. ישנם מספר שילובים אפשריים של תיוג מולקולות פני התא שהוכחו כשימושיים לחקר המנגנונים המולקולריים והתאיים של התפתחות תאי T בעכברים24,25,26,27. לכן, לוחות הנוגדנים הפלואורסצנטיים עשויים להשתנות בהתאם לשאלת העניין המטופלת. הטרנסדוקציה של תימוציטי DN עם pMIG הווקטורי הרטרו-ויראלי הריק, המוצג בלוח B, הציגה בערך את אותם פרופורציות של תוצאות חיוביות בודדות (CD4+ או CD8+), חיוביות כפולות (CD4+/CD8+), שליליות כפולות (CD4−/CD8−), ותת-השלבים שלה שליליים כפולים 1-4 (DN1-DN4) כמו תימוציטים לא מותמרים, המוצגים בלוח A, דבר המצביע על כך שהתפתחות תאי T לא הושפעה מתהליך הטרנסדוקציה.
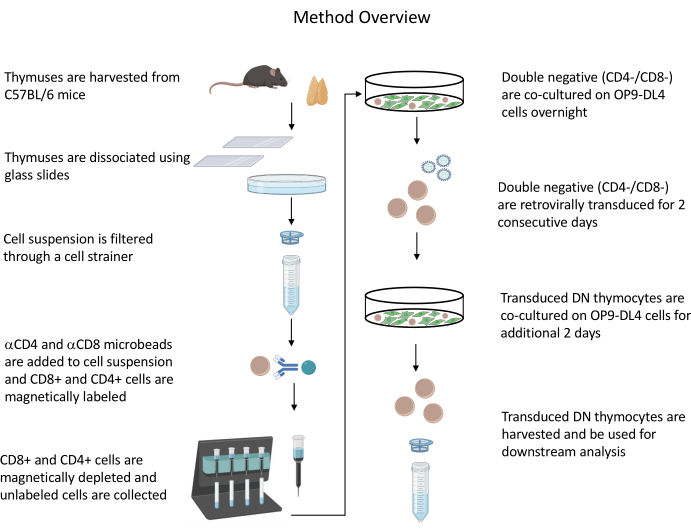
איור 1: דיאגרמה של השלבים של בידוד, התמרה ותרבות משותפת של תימוציטים. קיצור: DN = שלילי כפול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
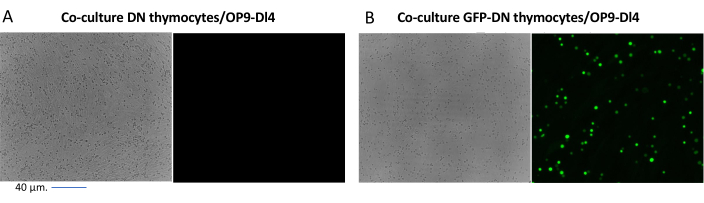
איור 2: מיקרוסקופ פלואורסצנטי בתרבית משותפת של תימוציטים מותמרים GFP או תימוציטים לא מותמרים ותאי OP9-DL4. (A) תימוציטים לא מותמרים ו-(B) תימוציטים מורינים יציבים המבטאים GFP על OP9-DL4 ביום השלישי לאחר ההתמרה השנייה. נעשה שימוש במיקרוסקופ פלואורסצנטי Olympus-IX71 עם עדשת 40x ומסנן 480/30 המתאים לזיהוי GFP. סרגל קנה מידה = 40 מיקרומטר. קיצורים: GFP = חלבון פלואורסצנטי ירוק; DN = שלילי כפול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
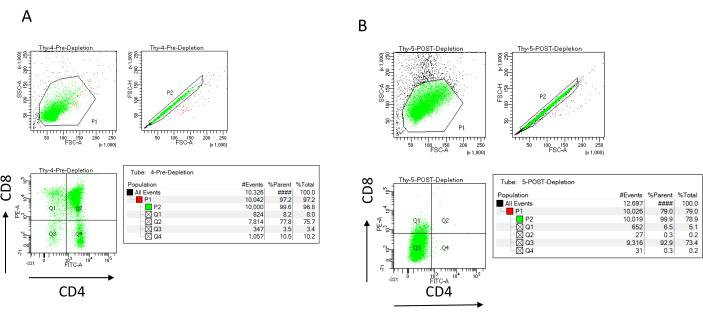
איור 3: ציטומטריית זרימה של דלדול תימוציטים. תרשימי ציטומטריה של זרימה ייצוגית המנתחים את הביטוי של CD4 ו- CD8 על תימוציטים המתקבלים מנקבות עכברים C57BL/6J בנות 7-8 שבועות (A) לפני דלדול ו- (B) לאחר דלדול CD4+ ו- CD8+ באמצעות מיקרו-כדוריות ועמודות LD בהתאם להוראות היצרן. תרשימי הנקודות משמאל מראים שערים בהתבסס על גודל האירוע ומורכבותו (FCS-A ו- SSC-A, בהתאמה). החלונית האמצעית מציגה FSC-H לעומת FSC-A כדי לשער תאים בודדים ולא לכלול תאים כפולים. בחלקות מימין, התאים הוגדרו כ-CD4 ו-CD8 מהשער החד-תאי. קיצורים: FSC-A = אזור פיזור-שיא קדמי; SSC-A = אזור פיזור צדדי; FSC-H = גובה פיזור שיא קדימה; FITC = isothiocyanate fluorescein; PE = phycoerythrin. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
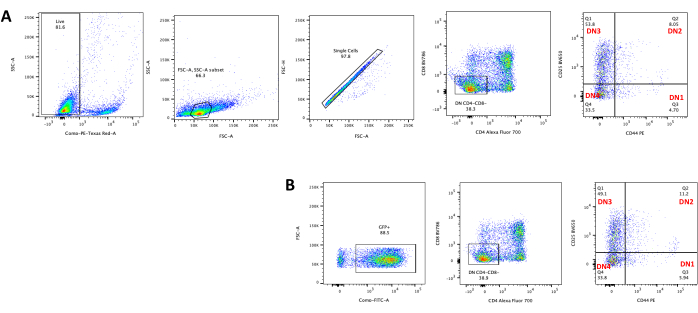
איור 4: ציטומטריית זרימה של יעילות הטרנסדוקציה הרטרו-ויראלית של תימוציט. (A) תימוציטים לא מותמרים בתרבית משותפת על OP9-DL4; (B) תימוציטים מומרים רטרו-ויראלית על OP9-DL4 ביום השלישי לאחר הטרנסדוקציה. קיצורים: FSC-A = אזור פיזור-שיא קדמי; SSC-A = אזור פיזור צדדי; FSC-H = גובה פיזור שיא קדימה; FITC = isothiocyanate fluorescein; PE = phycoerythrin; DN = שלילי כפול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
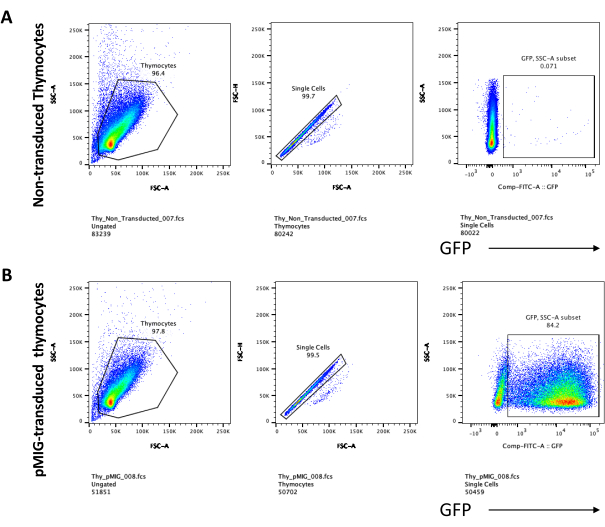
איור 5: Flowcytometry של תימוציטים מותמרים לאחר 4 ימים של תרבית משותפת OP9-DL4. (A) לא מומר ו-(B) מומר עם רטרו-וירוס pMIG. התאים גודרו תחילה על תאים חיים ולאחר מכן גודרו על בסיס גודל ומורכבות (FCS-A ו- SSC-A, בהתאמה), ולאחר מכן התוו FSC-H לעומת FSC-A כדי לשער על תאים בודדים ולא לכלול כפולים. עבור תאים לא מותמרים, השתמשנו באסטרטגיית השער הבאה. משער התא הבודד, התאים הוגדרו כחיוביים בודדים (CD4+ או CD8+), חיוביים כפולים (CD4+/CD8+) ותשליליים כפולים (CD4−/CD8−). לאחר מכן, משער התשלילים הכפולים (CD4−/CD8−), התאים הוגדרו כ- CD44+, CD25+, CD44+/CD25+ ו- CD44−/CD25−, כפי שמוצג בלוח A. עבור תאי pMIG מותמרים, המוצגים בלוח B, מהשער החד-תאי, התאים הוגדרו תחילה כ-GFP+/GFP−, ולאחר מכן מתאי GFP+, התפלגות אוכלוסיית התאים לשלבי ההתפתחות העיקריים של תאי T, כפי שהוגדרו על-ידי ביטוי CD4, CD8, CD44 ו-CD25, נקבעה באמצעות אותה אסטרטגיית שער כמו עבור התאים הלא מסומנים. קיצורים: FSC-A = אזור פיזור-שיא קדמי; SSC-A = אזור פיזור צדדי; FSC-H = גובה פיזור שיא קדימה; FITC = isothiocyanate fluorescein; GFP = חלבון פלואורסצנטי ירוק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
הפרוטוקול המתואר כאן פותח במיוחד עבור מחקרי תאי T שמקורם בבלוטת התימוס DN (CD4−/CD8−) עם טרנספקציה רטרו-ויראלית ואחריה מודל התמיינות OP9-DL4. עם זאת, סביר להניח כי תאי היעד שיהיו כפופים לפרוטוקול זה של התמרה ואחריו התמיינות תאים יהיה תועלת בין-תחומית רחבה יותר. לכן, בנוסף לתימוציטים לא בשלים, תאי גזע המטופויטיים, כגון תאים שמקורם בכבד עוברי או ממח עצם, עשויים לשמש בפרוטוקול זה.
מערכת OP9-DL4 הוכחה כמודל יעיל לחקר תפקוד גנים במגוון היבטים, כולל התמיינות תאים17 ואונקוגנזה15. בעוד ששינוי רטרו-ויראלי של אבות המטופויטיים הוא טכניקה מבוססת היטב המאפשרת שינוי גנטי יציב, שילוב של השראת התמיינות תאים במערכת OP9-DL4 והתמרה רטרו-ויראלית דורש טיפול ומיומנות. ההיבט הקריטי להשגת הצלחה עם פרוטוקול זה הוא להבטיח שכל השלבים מתואמים היטב, שכן הפרוטוקול כולל שימוש בשלושה סוגי תאים שונים שיש לשמור על בריאותם ובמפגש האידיאלי הנדרש לכל שלב ספציפי. עם זאת, חשוב לבצע את כל ניתוחי בקרת האיכות לאחר ביצוע כל שלב לפני שממשיכים לשלב הבא. זה יבטיח כי כל השלבים עובדים. לכן, בדיקת יעילות הדלדול, הטרנספקציה והטרנסדוקציה חשובה לביצוע מוצלח של פרוטוקול זה (ראו תוצאה אופיינית ליעילות הטרנסדוקציה באיור 4). יעילות טובה של התמרה של תאים ראשוניים קשורה לטיטר נגיפי גבוה. בדרך כלל, תוספות גדולות יותר גורמות לטיטרים נמוכים יותר של וירוסים18. למטרות אימון, אנו משתמשים בווקטור ריק כדי לייצג את התוצאות שניתן להשיג באמצעות פרוטוקול זה. מניסיוננו, יעילות הטרנסדוקציה והטרנספקציה משתנות בהתאם לגודל העלון, במיוחד בהתחשב בגנים המבטאים את עמוד השדרה הנגיפי, כגון GFP. אסטרטגיה אחת שניתן להשתמש בה בעת חקר האינטראקציה של יותר מגן אחד היא לשכפל כל גן לווקטור העברה אחר, ואחריו ייצור וירוס בודד, ולבסוף, התמרה משותפת של תא היעד. במקרה כזה, ניתן להחיל שלב בחירה כדי לסלק את התאים המומרים הבודדים ולשמור רק על התאים המומרים המשותפים.
ראוי לציין כי רוב קווי התאים של שכבת מזין סטרומה OP9-DL1/DL4 הונדסו גנטית כדי לבטא GFP כחלק ממבני DL1 או DL47. בפרוטוקול זה השתמשנו בווקטור רטרו-ויראלי המבטא גם GFP; עם זאת, הוא בהיר יותר מחלבון GFP המתבטא על ידי תאי OP9-DL4 ואינו מפריע לבדיקת הטרנסדוקציה בעת הדמיה של התרבות המשותפת תחת המיקרוסקופ הפלואורסצנטי.
תאי OP9 מתמיינים לאדיפוציטים לאחר מעברים רבים, תקופות ארוכות בתרבית, או בתנאים של מפגש יתר19. עדות לכך היא התפתחות של vacuoles גדול. לפיכך, אין להשתמש בתאי OP9 המציגים מאפיינים אלה בפרוטוקול זה. הדבקת תאים מפיקי רטרו-וירוס מתלכדים מדי תגרום לטיטר וירוסים נמוך. ואכן, השלב התת-קונפלואנטי הוא השלב שבו התאים הם הטרנספקטיביים ביותר. יתר על כן, הדבקת תאים מפיקי רטרו-וירוס במפגש נמוך תפחית את הלחץ התא בתהליך הטרנספקציה ותיתן את הטיטר הווירוס הגבוה ביותר.
בעוד שבפרוטוקול זה איננו מבצעים טיטרציה של העל-וירוס (supernatant), יש לשקול טיטרציה סופרנטנטית של וירוסים במקרים מסוימים, כגון בהיעדר גן מדווח בווקטור הרטרו-ויראלי, אשר ימנע קביעה עקיפה של ייצור נגיפי, או במקרים בהם תכנון הניסוי דורש מספר מדויק יותר של עותקי הטרנסגן כדי להשתלב בגנום תא המטרה. עם זאת, חשוב לציין כי הטיטר של סופרנאטנט וקטורי רטרו-ויראלי יורד באופן משמעותי כאשר הוא מאוחסן ב -80 ° C או 4 ° C עד לקבלת תוצאות הטיטרציה. לכן, שימוש בסופרנאטנט וירוסים טרי להעברה יניב יעילות התמרה טובה יותר.
בלוטת התימוס מכילה מספר רב של תימוציטים חיוביים כפולים (DP) (יותר מ-85%)וכ-10% תאים חיוביים בודדים (CD4 או CD8), שהם תימוציטים בשלב שלאחר DN. תאי ה-DP אינם יכולים לשרוד במבחנה לצורך מניפולציה רטרו-ויראלית, בעוד שתאי ה-SP אינם ניתנים לטרנספורמציה. לכן, פרוטוקול זה יכול להיות מיושם כדי ליצור רטרוויראלי וקטור transducible DN thymocytes.
Disclosures
למחברים אין ניגודי עניינים לחשוף
Acknowledgements
עבודה זו נתמכה על ידי תוכנית intramural של המכון הלאומי לסרטן, פרויקט ZIABC009287. OP9-DL4 התקבל מד"ר חואן קרלוס זוניגה-פלוקר (מרכז מדעי הבריאות סוניברוק, טורונטו, ON, קנדה). המחברים מודים לתוכנית למדעי בעלי חיים במעבדה NCI-Frederick על הסיוע הטכני המתמשך והייעוץ והמשוב הניסיוני, כמו גם לג'ף קארל, מייגן קרוואן וקימברלי קלרמן על הסיוע בציטומטריית זרימה. אנו אסירי תודה להווארד יאנג על עצות ביקורתיות ותשומות.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma | M3148 | |
| ACK Lysis buffer | Lonza | 10-548E | |
| BSA | Cell Signaling Technology | 9998S | |
| CD4 Microbeads | Miltenyi | 130-049-201 | |
| CD8 Microbeads | Miltenyi | 130-049-401 | |
| Centrifuge 5910R | eppendorf | 5942IP802353 | |
| DMEM | Corning | 10-013-CV | |
| EDTA | Invitrogen | 15575-038 | |
| Fetal calf serum HyClone FBS | ThermoScientific | SH30910.03 | |
| LD columns | Miltenyi | 130-042-901 | |
| L-glutamine | Sigma | G7513 | Freeze glutamine in aliquots and use freshly-thawed glutamine |
| Lipofectamine 2000 | Invitrogen | P/N 52887 | |
| MEM-alpha Medium | Gibco | 12561-072 | |
| OPTI-MEM I Reducing Serum Medium | Invitrogen | 31985-062 | |
| PBS pH 7.2 | Corning | 21-040-CV | |
| pcL-Eco Plasmid | Addgene | 12371 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| pMIG Plasmid | Addgene | 6492 | |
| Polybrene | Chemicon | TR-1003-G | |
| Pre-Separation Filters | Miltenyi | 130-041-407 | |
| recombinant hFLT-3L | PeproTech | 300-19 | |
| recombinant IL-7 | Peprotech | 217-17 | |
| Retrovial packaging cell line Phoenix-Eco | Orbigen | RVC-10002 | |
| Syringe filter (0.45 µm) | Millipore | SLHV033RS |
References
- Zuniga-Pflucker, J. C. T-cell development made simple. Nature Reviews Immunology. 4 (1), 67 (2004).
- Kodama, H., Nose, M., Niida, S., Nishikawa, S., Nishikawa, S. Involvement of the c-kit receptor in the adhesion of hematopoietic stem cells to stromal cells. Experimental Hematology. 22 (10), 979-984 (1994).
- Nakano, T., Kodama, H., Honjo, T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science. 265 (5175), 1098-1101 (1994).
- Nakano, T., Kodama, H., Honjo, T. In vitro development of primitive and definitive erythrocytes from different precursors. Science. 272 (5262), 722-724 (1996).
- Ueno, H., et al. A stromal cell-derived membrane protein that supports hematopoietic stem cells. Nature Immunology. 4 (5), 457-463 (2003).
- Jaleco, A. C., et al. Differential effects of Notch ligands Delta-1 and Jagged-1 in human lymphoid differentiation. Journal of Experimental Medicine. 194 (7), 991-1002 (2001).
- Mohtashami, M., et al. Direct comparison of Dll1- and Dll4-mediated Notch activation levels shows differential lymphomyeloid lineage commitment outcomes. Journal of Immunology. 185 (2), 867-876 (2010).
- Schmitt, T. M., Zuniga-Pflucker, J. C. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity. 17 (6), 749-756 (2002).
- Mazzucchelli, R., Durum, S. K. Interleukin-7 receptor expression: Intelligent design. Nature Reviews Immunology. 7 (2), 144-154 (2007).
- Robey, E. A., Bluestone, J. A. Notch signaling in lymphocyte development and function. Current Opinion in Immunology. 16 (3), 360-366 (2004).
- Lavaert, M., et al. Integrated scRNA-Seq identifies human postnatal thymus seeding progenitors and regulatory dynamics of differentiating immature thymocytes. Immunity. 52 (6), 1088-1104 (2020).
- Roh, K. H., Roy, K. Engineering approaches for regeneration of T lymphopoiesis. Biomaterials Research. 20 (20), (2016).
- Zlotoff, D. A., et al. CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus. Blood. 115 (10), 1897-1905 (2010).
- Holmes, R., Zuniga-Pflucker, J. C. The OP9-DL1 system: Generation of T-lymphocytes from embryonic or hematopoietic stem cells in vitro. Cold Spring Harbor Protocols. 2009 (2), (2009).
- Cramer, S. D., et al. Mutant IL-7Ralpha and mutant NRas are sufficient to induce murine T cell acute lymphoblastic leukemia. Leukemia. 32 (8), 1795-1882 (2018).
- Treanor, L. M., et al. Interleukin-7 receptor mutants initiate early T cell precursor leukemia in murine thymocyte progenitors with multipotent potential. Journal of Experimental Medicine. 211 (4), 701-713 (2014).
- Yokoyama, K., et al. In vivo leukemogenic potential of an interleukin 7 receptor alpha chain mutant in hematopoietic stem and progenitor cells. Blood. 122 (26), 4259-4263 (2013).
- Simmons, A., Alberola-Ila, J. Retroviral transduction of T cells and T cell precursors. Methods in Molecular Biology. 1323, 99-108 (2016).
- . Retroviral systems Available from: https://web.stanford.edu/group/nolan/_OldWebsite/retroviral_systems/retsys.html (2022)
- Xing, Y., Hogquist, K. A. Isolation, identification, and purification of murine thymic epithelial cells. Journal of Visualized Experiments. (90), e51780 (2014).
- Gray, D. H., et al. Developmental kinetics, turnover, and stimulatory capacity of thymic epithelial cells. Blood. 108 (12), 3777-3785 (2006).
- Godfrey, D. I., Kennedy, J., Suda, T., Zlotnik, A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3-CD4-CD8- triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. Journal of Immunology. 150 (10), 4244-4252 (1993).
- Wang, Y. B., Edinger, M., Mittar, D., McIntyre, C. Studying mouse thymocyte development using multiparametric flow cytometry: An efficient method to improve an 8-color panel on the BD FACSVerse™ system. BD Biosciences–Application Note. , (2012).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- He, X., Park, K., Kappes, D. J. The role of ThPOK in control of CD4/CD8 lineage commitment. Annual Review of Immunology. 28, 295-320 (2010).
- Wang, Y., et al. A conserved CXXC motif in CD3epsilon is critical for T cell development and TCR signaling. PLoS Biology. 7 (12), e1000253 (2009).
- Aliahmad, P., Kadavallore, A., de la Torre, B., Kappes, D., Kaye, J. TOX is required for development of the CD4 T cell lineage gene program. Journal of Immunology. 187 (11), 5931-5940 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved