Method Article
小鼠胸腺细胞在δ样4表达基质细胞上的共培养和转导以研究T细胞白血病的癌基因
摘要
该协议描述了从小鼠胸腺中分离双阴性胸腺细胞,然后在δ样4表达骨髓基质细胞系共培养系统(OP9-DL4)上进行逆转录病毒转导和共培养以进行进一步的功能分析。
摘要
转导的小鼠未成熟胸腺细胞可以使用δ样4表达骨髓基质细胞系共培养系统(OP9-DL4)体外分化为T细胞。由于逆转录病毒转导需要分裂细胞进行转基因整合,OP9-DL4为培养造血祖细胞提供了合适的 体外 环境。这在研究正常T细胞发育和白血病生成过程中特定基因表达的影响时特别有利,因为它允许研究人员规避产生转基因小鼠的耗时过程。为了获得成功的结果,必须仔细执行一系列涉及同时操作不同类型细胞的协调步骤。尽管这些都是非常成熟的过程,但文献中缺乏共同来源通常意味着需要一系列优化,这可能非常耗时。该方案已被证明在转导原代胸腺细胞,然后在OP9-DL4细胞上分化方面是有效的。这里详细介绍了一个方案,可以作为OP9-DL4基质细胞上逆转录病毒转导胸腺细胞共培养的快速和优化指南。
引言
OP9骨髓基质细胞系为从多种祖细胞来源诱导淋巴组织生成提供了有用的体外系统1。使用OP9细胞的第一批研究表明,缺乏巨噬细胞集落刺激因子(MCSF)表达有助于OP9细胞系支持骨髓来源造血干细胞(HSC)的造血和B细胞分化的能力,正如后来在胚胎干细胞(ESCs)中也显示的那样2,3,4,5.在以前的研究中,δ样1/4表达OP9细胞(OP9-DL1 / OP9-DL4)的产生能够诱导T细胞谱系承诺6,并显示出成功概括胸腺成熟的能力7,8。简而言之,T细胞的发育已经通过CD4和CD8分子的顺序表达来描述。未成熟的胸腺细胞是"双阴性"(DN,CD4− CD8−),可以根据CD44和CD25的表面表达进一步细分。DN胸腺细胞通过未成熟单阳性(ISP)阶段分化,其特征在于小鼠中的CD8表达和人类中的CD4,然后是双阳性(DP)阶段,其特征在于CD4和CD8的共表达,最后是成熟的单阳性阶段,其特征在于CD4或CD89的表达。HSC 表达 Notch1 受体,该受体通常与胸腺上皮细胞上表达的 δ 样 4 (DL4) 相互作用以诱导 T 谱系分化10。因此,对OP9-DL1/4模型的兴趣逐渐增加,导致该方法在过去二十年中在各种应用中得到广泛使用8,11,12,13。尽管DL1和DL4都能够在体外支持T细胞分化,但它们在体内显示出差异要求,一些研究表明,在概述小鼠胸腺环境方面,OP9_DL4比OP9_DL1更有效7,14。
在OP9-DL1/4系统的潜在应用中,该系统与DN细胞或HSC与逆转录病毒载体的转导相结合特别令人感兴趣。这种组合是在正常T细胞发育和白血病生成过程中操纵基因表达的有效方法,并且已被证明是诱导或抑制目的基因功能的有效方法15,16,17。该模型特别成功地用于研究驱动白血病15的癌基因之间的合作,因为它具有灵活性,并且能够在合理的时间内检查多个基因组合的影响,与产生转基因小鼠相比。此外,以前已经使用类似的模型来评估将癌基因引入正常细胞的影响15,16,17。此外,逆转录病毒转导需要分裂细胞以进行转基因整合18,虽然慢病毒转导可以通过消除分裂细胞进行转基因整合的需要来克服这一限制,但我们一直无法使用慢病毒载体成功转导DN胸腺细胞。因此,OP9-DL1/DL4是培养造血祖细胞的合适工具。
OP9-DL4上转导胸腺细胞淋巴细胞生成的标准方案涉及一系列协调步骤,必须仔细执行这些步骤才能获得成功的结果。尽管这些技术多年来一直为社区提供良好的服务,但文献中可用的协议通常是支离破碎的。因此,每个实验室都被迫适应和优化程序的不同阶段,这可能非常耗时。在这里,该协议描述了从小鼠胸腺中分离DN胸腺细胞,然后在OP9-DL4基质细胞上进行逆转录病毒转导和共培养以进行进一步的功能分析。该既定方案已被证明在转导原代胸腺细胞方面是有效且可重复的,然后在OP9-DL4细胞上分化或诱导T细胞急性淋巴细胞白血病15。
研究方案
所有描述的动物实验均已获得NIH机构生物安全委员会(IBC)和动物护理和使用委员会(ACUC)的批准。有关与本协议中使用的所有试剂和材料相关的详细信息,请参阅 材料表 。有关逆转录病毒生产者细胞培养和维护程序的更多详细信息,请参阅已发布的指南19。有关协议的概述,请参见 图 1 。
1. 开始培养OP9-DL4细胞(第1天)
- 通过握住小瓶并在37°C的水浴中轻轻摇动来快速解冻OP9-DL4细胞。 立即将细胞转移到含有 5 mL OP9 培养基(MEM-α 培养基、10% FBS、50 U/mL 青霉素/链霉素、55 μM 2-巯基乙醇、2 mM L-谷氨酰胺)的离心管中以除去冷冻保护剂。
- 在室温下以300× g 离心5分钟。弃去上清液,并将细胞重悬于1mL OP9培养基中。
- 将 5 mL OP9 培养基放入 T25 烧瓶中,并将重悬的细胞加入该烧瓶中。在37°C和5%CO2下培养。
- 2-3天后,使用1:3分裂传代细胞(每周一,周三和周五传代细胞)。
注意:在OP9-DL4细胞达到汇合之前将其分开。OP9-DL4烧瓶在第6-7天和第8-9+天必须达到80%–90%的汇合度,以便与胸腺细胞共培养。因此,重要的是要计划在分裂OP9-DL4细胞时需要多少OP9-DL4细胞。- 从烧瓶中弃去培养基,并用1x PBS洗涤单层。弃去PBS,加入1mL的0.25%胰蛋白酶,并在37°C下孵育1-5分钟,或直到细胞从烧瓶中脱落。重击烧瓶以去除细胞。
注意:(可选)可以通过显微镜检查细胞解离的进展。 - 加入 5 mL OP9 培养基以灭活胰蛋白酶,并在重悬期间通过冲洗烧瓶的细胞覆盖表面来重悬细胞。
- 在室温下以 300 × g 离心细胞悬液 5 分钟,然后重悬于 3 mL 的 OP9 培养基中(用于 1:3 分裂)。
- 将 1 mL 细胞悬液放入已经含有 5 mL 新鲜 OP9 培养基的 T25 烧瓶中。冷冻/丢弃剩余的细胞。
- 为了冷冻OP9-DL4细胞,将细胞重悬于90%FBS / 10%DMSO中,比例为1mL冷冻培养基与一瓶细胞。
- 根据未来的要求,在 −80 °C 或液氮下冷冻在 1 mL 冷冻管中。储存在液氮中以延长储存时间。
- 从烧瓶中弃去培养基,并用1x PBS洗涤单层。弃去PBS,加入1mL的0.25%胰蛋白酶,并在37°C下孵育1-5分钟,或直到细胞从烧瓶中脱落。重击烧瓶以去除细胞。
2. 开始逆转录病毒产生细胞系的培养(第 1 天)
- 通过保持小瓶并在37°C的水浴中轻轻摇动来快速解冻逆转录病毒产生细胞系。 立即将细胞转移到含有 5 mL 逆转录病毒产生细胞培养基(RPC:DMEM,10% FBS)的离心管中以除去冷冻保护剂。
- 在室温下以300× g 离心5分钟。弃去上清液,并将细胞重悬于1mL RPC培养基中。
- 将 5 mL RPC 培养基放入 T25 烧瓶中,并将重悬的细胞加入该烧瓶中。在37°C和5%CO2下培养。
- 每 2-3 天以 1:5 至 1:8 的比例传代细胞。
- 重击烧瓶以移开细胞,并通过用力移液重悬细胞。
注意:这些细胞可以通过无胰蛋白酶的强力移液从烧瓶表面去除。或者,胰蛋白酶消化(0.05%胰蛋白酶/ 0.53mM EDTA),直到细胞易于分离并可以很容易地移液成单细胞悬浮液。
- 重击烧瓶以移开细胞,并通过用力移液重悬细胞。
- 将细胞悬液以 300 × g 离心 5 分钟,然后重悬于 5 mL RPC 培养基中(1:5 分裂)。
- 将 1 mL 细胞悬液放入已经含有 5 mL 新鲜 RPC 培养基的 T25 烧瓶中。冷冻/丢弃剩余的细胞。以与OP9-DL4细胞相同的方式冷冻逆转录病毒产生细胞(步骤1.4.4.1–1.4.4.2)。
3. 在 6 孔板中开始培养逆转录病毒产生细胞(第 4-5 天)
- 在转染前 18–24 小时以 70%–90% 汇合度接种逆转录病毒产生细胞,在 2 mL RPC 培养基中的 6 孔组织培养板的每个孔中,并在 37 °C 和 5% CO2 下孵育。
注意:每 2-5 × 105 至 1 × 106 个胸腺细胞转染两个逆转录病毒产生细胞的孔。
4. 转染逆转录病毒产生细胞以产生含有目的基因的逆转录病毒(第 5-6 天)
- 转染前1小时用新鲜的RPC培养基替换培养基。
- 制备脂质转染混合物(对于 6 孔板的每个孔 - 根据需要放大):在 250 μL 还原血清培养基中稀释 4 μgDNA(2 μg 辅助质粒 (pCL-Eco) 和 2 μg 转移质粒 (pMIG)。轻轻混合。
- 将 10 μL 转染试剂与步骤 4.2 中的 250 uL 还原血清培养基混合。在室温下孵育5分钟。
- 孵育5分钟后,将稀释的DNA与稀释的转染试剂(总体积= 500μL)合并。轻轻混合,并在室温下孵育20-25分钟。
- 将 500 μL DNA/转染试剂混合物轻轻加入含有逆转录病毒产生细胞的孔中,方法是以打圈的方式滴到细胞上。通过来回摇动板轻轻混合,并将板在37°C培养箱中孵育16-24小时。
注意:亚汇合细胞(80%–90%)最适合转染,并可能产生最高的病毒滴度。由于逆转录病毒产生细胞很容易从烧瓶中脱落,因此在处理这些细胞时避免突然移动。
5. 改变逆转录病毒产生细胞培养基(第6-7天)
- 转染后约16小时用2mL新鲜RPC培养基替换旧培养基。继续在37°C孵育细胞20-24小时。
- 在荧光显微镜下评估转染效率(可选)。
注意:在此协议中,GFP阳性细胞是感兴趣的细胞(见 图2)。此步骤取决于选择在该协议中使用的逆转录病毒载体(主链中是否存在报告基因)。
6. 胸腺细胞制备和 CD4+ 和 CD8+ 细胞的消耗(第 6-7 天)
- 从4-6周大的C57BL / 6小鼠中收获胸腺。有关胸腺收获的更多详细信息,请参阅Xing和Hogquist20。
注意:小鼠通过吸入CO2 然后颈椎脱位实施安乐死。 - 通过将胸腺放入培养皿中的 5 mL PBS 中来制备胸腺细胞单细胞悬液。使用无菌载玻片,将胸腺放在载玻片的磨砂表面之间,然后将载玻片轻轻摩擦在一起,在两个载玻片之间滚动胸腺。冲洗载玻片以收集细胞,并丢弃残留的胸腺基质组织。
注意:一个胸腺的估计产量为90×10 6-100×106细胞,CD4和CD8耗竭后将保留约1%的细胞。使用年轻小鼠的胸腺组织以获得更好的细胞产量,因为小鼠胸腺在出生后头几周的细胞迅速增加,在4-6周龄达到平台期,随后逐渐渐开线21。使用自动血细胞计数器或任何其他方法对细胞进行计数。 - 通过细胞过滤器移取5mL胸腺悬浮液,通过30μm或40μm过滤器过滤胸腺悬浮液。将细胞以300× g 离心10分钟。
- 除去上清液,并通过每管添加(取决于样品大小)1 mL缓冲液1分钟,用ACK裂解缓冲液裂解红细胞。加入 5 mL 细胞耗竭缓冲液(500 mL PBS [pH 7.2]、0.5% BSA、2 mM 0.5M EDTA、pH 8.0)使 ACK 裂解缓冲液失活,以 300 × g 离心 10 分钟,然后重悬于 1–5 mL 细胞耗竭缓冲液中进行计数。
注意:在耗尽(去除前)之前将以下内容放在冰上:70 μL 细胞悬液计数(根据所选的计数细胞方法而变化)和 200 μL 细胞悬液,通过染色 CD4 和 CD8 并通过流式细胞术分析来确定去除效率22,23。 - 计数细胞,并以300× g 离心10分钟。将细胞重悬于1 × 107/80 μL细胞去除缓冲液中。每 1 个× 107 个细胞中加入 CD4 和 CD8 微珠各 10 μL。充分混合,并在冰箱(2-8°C)中在黑暗中孵育15分钟。
- 用 2 mL 去除缓冲液冲洗并丢弃流出物来制备去除柱。
- 通过每 1 个 1 ×7 个细胞 加入 1–2 mL 去除缓冲液来洗涤步骤 6.6 中的细胞,并以 300 × g 离心 10 分钟。取出并弃去上清液。
- 在 500 μL 耗尽缓冲液中重悬至1.25 × 108 个细胞。将细胞悬液应用于色谱柱,并收集流出物(未标记的细胞)。用 1 mL 缓冲液洗涤色谱柱 2 倍,并收集流出物。
注意:仅当色谱柱储液槽为空时才添加新缓冲液。去除后在冰上留出以下内容(耗尽后对照):70 μL 细胞悬液计数(根据所选的计数细胞方法而变化)和 1,000 μL 细胞悬液,通过染色 CD4 和 CD8 并通过流式细胞术分析来确定去除效率22,23。 - 通过将去除前收集的 200 μL 细胞分成四个 FACS 管来染色去除效率对照:未染色、CD4 单染色、CD8 单染色和 CD4/CD8 双染色(使用未染色和单染色样品设置流式细胞术参数)。使用去除后收集的 1,000 μL 细胞对 CD4 和 CD8 进行染色,并与去除前收集的双染色样品进行比较(参见 图 3 中的典型去除结果)。
注意:根据抗体制造商的建议调整流式细胞术染色体积(例如,50 μL 缓冲液中每 1 x 106 个细胞 1 μL 抗 CD4-FITC + 0.5 μL 抗 CD8-PE)。
7. 在OP9-DL4细胞上培养胸腺细胞(第6-7天)
- 将 2-5 × 105 至 1 × 106 个去除后胸腺细胞放入含有细胞因子(10 ng/mL 重组 IL-7 和重组 hFLT-3)的 OP9 培养基中的 80%–90% 汇合 OP9-DL4 细胞的 T25 烧瓶中。在37°C和5%CO2下培养。在OP9-DL4细胞上生长约24小时。
注意:使T细胞可转导需要此持续时间(参见 图4中的典型结果)。保留一个胸腺细胞和OP9-DL4细胞共培养的T25烧瓶用作对照(未转导)。未转导的胸腺细胞将与转导的胸腺细胞一起染色(步骤9.1)作为阴性对照,以评估转导效率。未转导的胸腺细胞也可用于测量转基因表达对细胞分化的影响。1个月后丢弃含细胞因子的培养基。
8.从上清液中收获逆转录病毒并用它来转导胸腺细胞(第8-9天)
- 通过倾斜 6 孔板并将 3-5 mL 注射器定位在板底部,同时拉动柱塞吸出上清液,从转染的细胞中收集含有逆转录病毒的上清液。用 2 mL 新鲜 RPC 培养基替换培养基。继续将细胞在37°C孵育20-24小时,以便在步骤8.9中进行第二次转导。
- 通过0.45μm注射器过滤器过滤逆转录病毒上清液,并将滤液收集在50mL管中。
注意:不要冷冻逆转录病毒上清液。使用新鲜制备的病毒制剂进行转导。 - 通过积极移液从OP9-DL4培养物中收集胸腺细胞,以从烧瓶表面去除胸腺细胞和OP9-DL4细胞。通过 40 μm 细胞过滤器过滤细胞悬液以去除大部分 OP9-DL4 细胞,并将滤液收集在 50 mL 管中。
注意:OP9细胞非常粘附。虽然积极的移液可以从烧瓶中去除一些OP9-DL4细胞,但在此过程中OP9-DL4单层的破坏很小,并且由于OP9-DL4细胞比原代胸腺细胞大得多,因此脱落的OP9-DL4细胞将被40μm细胞过滤器过滤掉。如果OP9-DL4细胞仍为80%–90%汇合,则取出胸腺细胞,并将它们重新接种在同一OP9-DL4烧瓶中。或者,必须准备一个新的OP9-DL4烧瓶。 - 将步骤8.3中的滤液中的胸腺细胞以300× g 离心5分钟。弃去上清液。
- 在 50 mL 管中,将胸腺细胞重悬于 0.5–1 mL OP9 培养基 + 细胞因子中(参见步骤 7.1)。加入 1–2 mL 含有病毒的 RPC 培养基(RPC 培养基是胸腺细胞培养基的两倍)。加入六氯乙烯溴化物(10 μg/μL 储备液浓度),产生 8 μg 六氯乙烯溴化物/mL 总细胞悬液。
- 通过在室温下以850× g 离心细胞1小时来旋转。
- 将细胞重悬于每个烧瓶的6mL OP9培养基+细胞因子中(参见步骤7.1),并将悬浮液加回OP9-DL4细胞单层。
注意:或者,准备新的OP9-DL4烧瓶以接收转导的胸腺细胞。如果要将胸腺细胞放回用过的OP9-DL4烧瓶中,请确保在胸腺细胞棘细胞形成1小时内向OP9-DL4细胞中添加新鲜的OP9培养基,以保持细胞健康并确保80%-90%的汇合度。 - 在37°C孵育过夜。
- 使用含有逆转录病毒的细胞上清液的新孔重复步骤8.2–8.7。
9.在OP9-DL4培养物上维持转导的胸腺细胞2-5天或根据需要冷冻(第9+天)
- 通过流式细胞术评估胸腺细胞分化,方法是对胸腺细胞进行 T 细胞发育标志物(如 CD4、CD8、CD25 和 CD4423)染色。参见 图5中典型的胸腺细胞分化结果。
结果
通过在免疫磁性细胞分离(MACS)后标记CD4和CD8的磁性未标记细胞组分并在二维双变量点图上进行分析,可以通过流式细胞术评估去除效率(图3)。双阴性(CD4−,CD8−)细胞的良好产量为95%或更高,如图3所示。产量较低的两个最常见原因是根据超过色谱柱容量的细胞数和标记细胞数错误计算微珠。建议根据标记的单元格数量选择正确的MACS列数。当使用胸腺细胞时,标记细胞(DP和SP细胞)的数量几乎等于总细胞的数量(超过96%)。细胞计数可以在自动细胞计数器、Neubauer 室或任何替代方法中进行。因此,可能需要根据特定的机器和所选的计数方法调整分配给细胞计数的体积。
确定耗竭前后存在的细胞数量很重要。需要这些细胞计数来计算所需的LD去除柱的数量,并将DN胸腺细胞均匀分布到适当数量的OP9-DL4烧瓶中。流式细胞术的对照(未标记的细胞、CD4标记的细胞和CD8标记的细胞)可以使用保留的去除前样品进行,因为它包含更多的细胞。然而,由于大多数细胞预计将保留在色谱柱内,因此要标记的去除后样品将需要更高的体积。因此,可能需要根据所选的标记方案进行调整。
当使用表达可筛选标记物(例如荧光基因)的载体时,可以通过荧光显微镜粗略和经验评估转染和转导(图2)。转导效率可以通过从OP9-DL4单层中收获胸腺细胞来分析,如步骤8.3所述,并通过流式细胞术观察荧光基因的表达。使用以GFP为报告基因的空逆转录病毒载体进行转导的效率为84.2%(图4)。
转导后4天可观察到OP9-DL4细胞上的T细胞分化。流式细胞术通常用于评估OP9-DL4细胞共培养和/或转基因表达诱导的细胞分化,如图5所示,其中细胞被标记为CD4,CD8,CD44和CD25。细胞表面分子标记有几种可能的组合已被证明可用于研究小鼠T细胞发育的分子和细胞机制24,25,26,27。因此,荧光抗体组合可能会根据所解决的兴趣问题而有所不同。图B所示的DN胸腺细胞与空逆转录病毒载体pMIG的转导显示出与未转导胸腺细胞大致相同的单阳性(CD4+或CD8+),双阳性(CD4 + / CD8 +),其亚阶段双阴性1-4(DN1-DN4)的比例与未转导的胸腺细胞相同,如图A所示,表明T细胞发育不受转导过程的影响。
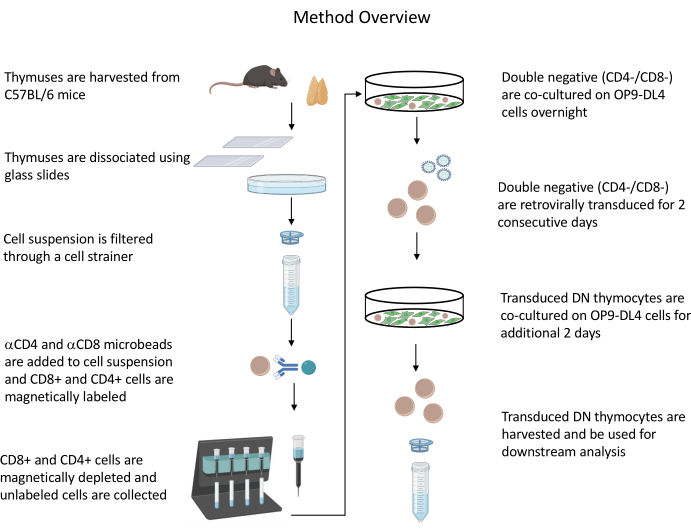
图 1:胸腺细胞分离、转导和共培养步骤示意图。 缩写:DN = 双阴性。 请点击此处查看此图的大图。
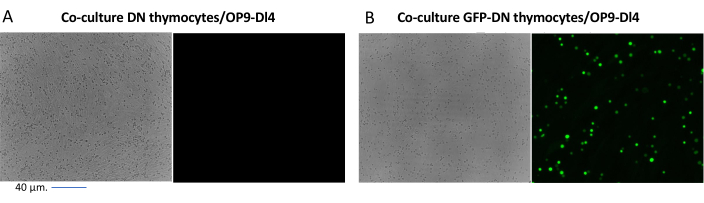
图 2:GFP 转导胸腺细胞或未转导 胸腺细胞和 OP9-DL4 细胞的共培养荧光显微镜。(A)未转导的胸腺细胞和(B)第二次转导后第3天OP9-DL4上稳定的表达GFP的鼠胸腺细胞。使用了带有40倍镜头和适用于GFP检测的480/30滤光片的奥林巴斯-IX71荧光显微镜。比例尺 = 40 μm。缩写:GFP = 绿色荧光蛋白;DN = 双阴性。请点击此处查看此图的大图。
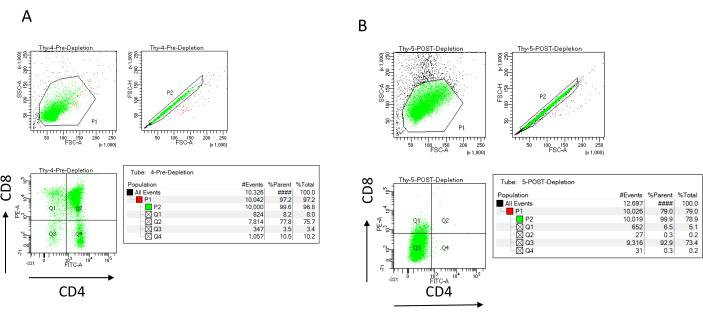
图3:胸腺细胞耗竭的流式细胞术。 代表性流式细胞术图分析CD4和CD8在从7-8周龄C57BL / 6J雌性小鼠(A)去除前和(B)去除后CD4 +和CD8 +根据制造商的说明使用微珠和LD柱获得的胸腺细胞上的表达。左侧的点图显示了基于事件规模和复杂性的门(分别为FCS-A和SSC-A)。中间面板显示了FSC-H与FSC-A来控制单个细胞并排除双峰。在右图中,细胞被定义为来自单细胞门的CD4和CD8。缩写:FSC-A = 前向散射峰面积;SSC-A = 侧散射峰面积;FSC-H = 前向散射峰高度;FITC = 异硫氰酸荧光素;PE = 藻红蛋白。请点击此处查看此图的大图。
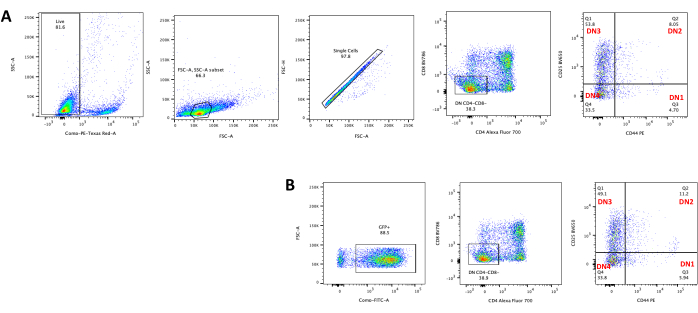
图4:胸腺细胞逆转录病毒转导效率的流式细胞术。 (A)在OP9-DL4上共培养的未转导胸腺细胞;(B)在转导后第3天在OP9-DL4上逆转录病毒转导胸腺细胞。缩写:FSC-A = 前向散射峰面积;SSC-A = 侧散射峰面积;FSC-H = 前向散射峰高度;FITC = 异硫氰酸荧光素;PE = 藻红蛋白;DN = 双阴性。 请点击此处查看此图的大图。
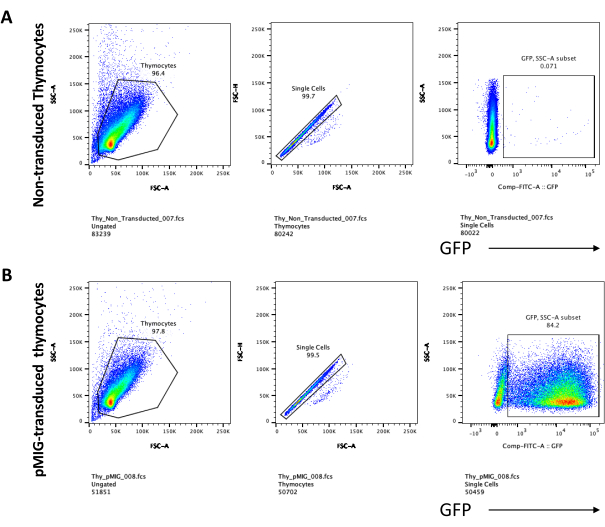
图 5:OP9-DL4 共培养 4 天后转导胸腺细胞的流式细胞术。 (A)未转导和(B)用pMIG逆转录病毒转导。首先在活细胞上对细胞进行门控,然后根据大小和复杂性(分别为FCS-A和SSC-A)进行门控,然后绘制FSC-H与FSC-A以在单个细胞上门控并排除双峰。对于未转导的细胞,我们使用以下门策略。从单细胞门开始,细胞被定义为单阳性(CD4+或CD8+),双阳性(CD4 + / CD8 +)和双阴性(CD4 - / CD8 - )。然后,从双阴性(CD4 - / CD8 - )门,细胞定义为CD44 +,CD25 +,CD44 + / CD25 +和CD44 - / CD25 - 如图A所示。对于图B所示的pMIG转导细胞,从单细胞门,细胞首先定义为GFP + / GFP−,然后从GFP +细胞,使用与未分类细胞相同的门策略确定细胞群分布到主要T细胞发育阶段,如CD4,CD8,CD44和CD25表达所定义。缩写:FSC-A = 前向散射峰面积;SSC-A = 侧散射峰面积;FSC-H = 前向散射峰高度;FITC = 异硫氰酸荧光素;GFP = 绿色荧光蛋白。请点击此处查看此图的大图。
讨论
此处描述的方案是专门为胸腺衍生的DN(CD4−/CD8−)T细胞研究而开发的,采用逆转录病毒转染,然后进行OP9-DL4分化模型。然而,将接受这种转导方案然后进行细胞分化的靶细胞很可能具有更广泛的跨学科用途。因此,除了未成熟的胸腺细胞外,造血干细胞,例如来自胎儿肝脏或骨髓的细胞,可能可用于该方案。
OP9-DL4系统已被证明是从多个方面研究基因功能的有效模型,包括细胞分化17 和肿瘤发生15。虽然造血祖细胞的逆转录病毒修饰是一种成熟的技术,可以实现稳定的遗传修饰,但结合OP9-DL4系统上的细胞分化诱导和逆转录病毒转导需要小心和技巧。使用该协议取得成功的关键方面是确保所有步骤都协调良好,因为该协议涉及使用三种不同的细胞类型,这些细胞类型需要保持健康并处于每个特定阶段所需的理想汇合。考虑到这一点,在执行每个步骤后执行所有质量控制检查点分析非常重要,然后再进行下一步。这将确保所有步骤都正常工作。因此,检查耗竭、转染和转导效率对于成功执行该协议非常重要(参见 图4中转导效率的典型结果)。良好的原代细胞转导效率与高病毒滴度有关。通常,插入片段越大,病毒滴度越低18。出于训练目的,我们使用一个空向量来表示可以通过该协议获得的结果。根据我们的经验,转导和转染效率因插入片段大小而异,特别是考虑到表达病毒骨架的报告基因,如GFP。在研究多个基因的相互作用时可以使用的一种策略是将每个基因克隆到不同的转移载体中,然后是单个病毒的产生,最后是靶细胞的共转导。在这种情况下,可以应用选择步骤来消除单转导的细胞并仅保留共转导的细胞。
值得注意的是,大多数OP9-DL1/DL4基质饲养层细胞系经过基因工程改造,可表达GFP,作为DL1或DL4构建体的一部分7。在该协议中,我们使用了也表达GFP的逆转录病毒载体;然而,它比OP9-DL4细胞表达的GFP蛋白更亮,并且在荧光显微镜下观察共培养物时不会干扰转导检查。
OP9细胞在多次传代后分化为脂肪细胞,长时间培养或在过度融合的条件下19。大液泡的发展证明了这一点。因此,呈现这些特征的OP9细胞不应在本协议中使用。转染过度融合的逆转录病毒产生细胞将导致病毒滴度低。事实上,亚汇合阶段是细胞最易转染的时候。此外,转染低汇合逆转录病毒产生细胞将降低转染过程中的细胞应激,并提供最高的病毒滴度。
虽然在该协议中,我们不滴定病毒上清液,但在某些情况下必须考虑病毒上清液滴定,例如在逆转录病毒载体中没有报告基因的情况下,这将阻止病毒生产的间接测定,或者在实验设计需要更准确数量的转基因拷贝整合到靶细胞基因组的情况下。然而,重要的是要注意,当储存在-80°C或4°C直到获得滴定结果时,逆转录病毒载体上清液的滴度显着降低。因此,使用新鲜制备的病毒上清液进行转导将产生更好的转导效率。
胸腺含有大量的双阳性(DP)胸腺细胞(超过85%)和约10%的单阳性15细胞(CD4或CD8),它们是DN后阶段的胸腺细胞。DP细胞不能 在体外 存活以进行逆转录病毒操作,而SP细胞是不可转导的。因此,该方案可用于产生逆转录病毒载体可转导的DN胸腺细胞。
披露声明
作者没有利益冲突需要披露
致谢
这项工作得到了国家癌症研究所的校内计划ZIABC009287项目的支持。OP9-DL4是从Juan Carlos Zúñiga-Pflücker博士(加拿大安大略省多伦多Sunnybrook健康科学中心)获得的。作者感谢NCI-Frederick实验动物科学计划的持续技术援助和实验建议和投入,以及Jeff Carrel,Megan Karwan和Kimberly Klarmann的流式细胞术帮助。我们感谢霍华德·杨(Howard Young)的重要建议和投入。
材料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma | M3148 | |
| ACK Lysis buffer | Lonza | 10-548E | |
| BSA | Cell Signaling Technology | 9998S | |
| CD4 Microbeads | Miltenyi | 130-049-201 | |
| CD8 Microbeads | Miltenyi | 130-049-401 | |
| Centrifuge 5910R | eppendorf | 5942IP802353 | |
| DMEM | Corning | 10-013-CV | |
| EDTA | Invitrogen | 15575-038 | |
| Fetal calf serum HyClone FBS | ThermoScientific | SH30910.03 | |
| LD columns | Miltenyi | 130-042-901 | |
| L-glutamine | Sigma | G7513 | Freeze glutamine in aliquots and use freshly-thawed glutamine |
| Lipofectamine 2000 | Invitrogen | P/N 52887 | |
| MEM-alpha Medium | Gibco | 12561-072 | |
| OPTI-MEM I Reducing Serum Medium | Invitrogen | 31985-062 | |
| PBS pH 7.2 | Corning | 21-040-CV | |
| pcL-Eco Plasmid | Addgene | 12371 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| pMIG Plasmid | Addgene | 6492 | |
| Polybrene | Chemicon | TR-1003-G | |
| Pre-Separation Filters | Miltenyi | 130-041-407 | |
| recombinant hFLT-3L | PeproTech | 300-19 | |
| recombinant IL-7 | Peprotech | 217-17 | |
| Retrovial packaging cell line Phoenix-Eco | Orbigen | RVC-10002 | |
| Syringe filter (0.45 µm) | Millipore | SLHV033RS |
参考文献
- Zuniga-Pflucker, J. C. T-cell development made simple. Nature Reviews Immunology. 4 (1), 67 (2004).
- Kodama, H., Nose, M., Niida, S., Nishikawa, S., Nishikawa, S. Involvement of the c-kit receptor in the adhesion of hematopoietic stem cells to stromal cells. Experimental Hematology. 22 (10), 979-984 (1994).
- Nakano, T., Kodama, H., Honjo, T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science. 265 (5175), 1098-1101 (1994).
- Nakano, T., Kodama, H., Honjo, T. In vitro development of primitive and definitive erythrocytes from different precursors. Science. 272 (5262), 722-724 (1996).
- Ueno, H., et al. A stromal cell-derived membrane protein that supports hematopoietic stem cells. Nature Immunology. 4 (5), 457-463 (2003).
- Jaleco, A. C., et al. Differential effects of Notch ligands Delta-1 and Jagged-1 in human lymphoid differentiation. Journal of Experimental Medicine. 194 (7), 991-1002 (2001).
- Mohtashami, M., et al. Direct comparison of Dll1- and Dll4-mediated Notch activation levels shows differential lymphomyeloid lineage commitment outcomes. Journal of Immunology. 185 (2), 867-876 (2010).
- Schmitt, T. M., Zuniga-Pflucker, J. C. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity. 17 (6), 749-756 (2002).
- Mazzucchelli, R., Durum, S. K. Interleukin-7 receptor expression: Intelligent design. Nature Reviews Immunology. 7 (2), 144-154 (2007).
- Robey, E. A., Bluestone, J. A. Notch signaling in lymphocyte development and function. Current Opinion in Immunology. 16 (3), 360-366 (2004).
- Lavaert, M., et al. Integrated scRNA-Seq identifies human postnatal thymus seeding progenitors and regulatory dynamics of differentiating immature thymocytes. Immunity. 52 (6), 1088-1104 (2020).
- Roh, K. H., Roy, K. Engineering approaches for regeneration of T lymphopoiesis. Biomaterials Research. 20 (20), (2016).
- Zlotoff, D. A., et al. CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus. Blood. 115 (10), 1897-1905 (2010).
- Holmes, R., Zuniga-Pflucker, J. C. The OP9-DL1 system: Generation of T-lymphocytes from embryonic or hematopoietic stem cells in vitro. Cold Spring Harbor Protocols. 2009 (2), (2009).
- Cramer, S. D., et al. Mutant IL-7Ralpha and mutant NRas are sufficient to induce murine T cell acute lymphoblastic leukemia. Leukemia. 32 (8), 1795-1882 (2018).
- Treanor, L. M., et al. Interleukin-7 receptor mutants initiate early T cell precursor leukemia in murine thymocyte progenitors with multipotent potential. Journal of Experimental Medicine. 211 (4), 701-713 (2014).
- Yokoyama, K., et al. In vivo leukemogenic potential of an interleukin 7 receptor alpha chain mutant in hematopoietic stem and progenitor cells. Blood. 122 (26), 4259-4263 (2013).
- Simmons, A., Alberola-Ila, J. Retroviral transduction of T cells and T cell precursors. Methods in Molecular Biology. 1323, 99-108 (2016).
- . Retroviral systems Available from: https://web.stanford.edu/group/nolan/_OldWebsite/retroviral_systems/retsys.html (2022)
- Xing, Y., Hogquist, K. A. Isolation, identification, and purification of murine thymic epithelial cells. Journal of Visualized Experiments. (90), e51780 (2014).
- Gray, D. H., et al. Developmental kinetics, turnover, and stimulatory capacity of thymic epithelial cells. Blood. 108 (12), 3777-3785 (2006).
- Godfrey, D. I., Kennedy, J., Suda, T., Zlotnik, A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3-CD4-CD8- triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. Journal of Immunology. 150 (10), 4244-4252 (1993).
- Wang, Y. B., Edinger, M., Mittar, D., McIntyre, C. Studying mouse thymocyte development using multiparametric flow cytometry: An efficient method to improve an 8-color panel on the BD FACSVerse™ system. BD Biosciences–Application Note. , (2012).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- He, X., Park, K., Kappes, D. J. The role of ThPOK in control of CD4/CD8 lineage commitment. Annual Review of Immunology. 28, 295-320 (2010).
- Wang, Y., et al. A conserved CXXC motif in CD3epsilon is critical for T cell development and TCR signaling. PLoS Biology. 7 (12), e1000253 (2009).
- Aliahmad, P., Kadavallore, A., de la Torre, B., Kappes, D., Kaye, J. TOX is required for development of the CD4 T cell lineage gene program. Journal of Immunology. 187 (11), 5931-5940 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。