A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بروتوكول تطهير فعال لدراسة تطور البذور في الطماطم (Solanum lycopersicum L.)
In This Article
Summary
تعتبر بذور الطماطم نموذجا مهما لدراسة علم الوراثة وعلم الأحياء التنموي أثناء تكاثر النبات. هذا البروتوكول مفيد لإزالة بذور الطماطم في مراحل النمو المختلفة لمراقبة البنية الجنينية الدقيقة.
Abstract
الطماطم (Solanum lycopersicum L.) هي واحدة من المحاصيل النقدية الرئيسية في جميع أنحاء العالم. تعتبر بذور الطماطم نموذجا مهما لدراسة علم الوراثة وعلم الأحياء التنموي أثناء تكاثر النبات. غالبا ما يتم إعاقة تصور البنية الجنينية الدقيقة داخل بذور الطماطم عن طريق صمغ معطف البذور ، والتكامل متعدد الطبقات ، والسويداء السميك الجدران ، والذي يحتاج إلى حل عن طريق التضمين الشاق. البديل الأبسط هو استخدام تقنيات إزالة الأنسجة التي تحول البذور شبه شفافة باستخدام عوامل كيميائية. على الرغم من أن إجراءات المقاصة التقليدية تسمح برؤية عميقة للبذور الأصغر ذات طبقة البذور الرقيقة ، إلا أن إزالة بذور الطماطم لا تزال تمثل تحديا تقنيا ، خاصة في مراحل النمو المتأخرة.
يظهر هنا بروتوكول تطهير سريع وموفر للعمالة لمراقبة نمو بذور الطماطم من 3 إلى 23 يوما بعد الإزهار عندما يكون التشكل الجنيني على وشك الاكتمال. تجمع هذه الطريقة بين محلول المقاصة القائم على هيدرات الكلورال المستخدم على نطاق واسع في أرابيدوبسيس مع تعديلات أخرى ، بما في ذلك إغفال تثبيت الفورمالين - الأسيتو - الكحول (FAA) ، وإضافة معالجة هيبوكلوريت الصوديوم للبذور ، وإزالة صمغ معطف البذور المخفف ، والغسيل والمعالجة بالتفريغ. يمكن تطبيق هذه الطريقة للإزالة الفعالة لبذور الطماطم في مراحل النمو المختلفة وهي مفيدة في المراقبة الكاملة لعملية تطوير البذور الطافرة بدقة مكانية جيدة. يمكن أيضا تطبيق بروتوكول المقاصة هذا على التصوير العميق للأنواع الأخرى المهمة تجاريا في Solanaceae.
Introduction
الطماطم (S. lycopersicum L.) هي واحدة من أهم محاصيل الخضروات في جميع أنحاء العالم ، حيث يبلغ إنتاجها 186.8 مليون طن من الفواكه السمين من 5.1 مليون هكتار في عام 20201. ينتمي إلى عائلة Solanaceae الكبيرة مع حوالي 2716 نوعا2 ، بما في ذلك العديد من المحاصيل المهمة تجاريا مثل الباذنجان والفلفل والبطاطس والتبغ. الطماطم المزروعة هي نوع ثنائي الصيغة الصبغية (2n = 2x = 24) بحجم جينوم يبلغ حوالي 900 ميجا بايت3. لفترة طويلة ، تم بذل جهد كبير نحو تدجين الطماطم وتكاثرها عن طريق اختيار السمات المرغوبة من Solanum spp. هناك أكثر من 5000 مدخل طماطم مدرج في مركز موارد علم الوراثة للطماطم ويتم تخزين أكثر من 80000 مادة وراثية من الطماطم في جميع أنحاء العالم4. نبات الطماطم معمر في الدفيئة وينتشر بالبذور. تتكون بذرة الطماطم الناضجة من ثلاث حجرات رئيسية: جنين كامل النمو ، السويداء الخلوي المتبقي ، ومعطف البذور الصلب 5,6 (الشكل 1 أ). بعد الإخصاب المزدوج ، يسبق تطور السويداء من النوع الخلوي تطور الزيجوت. في ~ 5-6 أيام بعد الإزهار (DAF) ، لوحظ الجنين ثنائي الخلية لأول مرة عندما يتكون السويداء من ستة إلى ثمانية نوى7. في Solanum pimpinellifolium ، يقترب الجنين من حجمه النهائي بعد 20 DAF ، والبذور قابلة للإنبات بعد 32 DAF8. مع تطور الجنين ، يتم امتصاص السويداء تدريجيا وتبقى كمية صغيرة فقط من السويداء في البذور. يتكون السويداء المتبقي من السويداء micropylar المحيطة بطرف الجذر ، والسويداء الجانبي في بقية البذور 9,10. تم تطوير طبقة البذور الخارجية من البشرة الخارجية السميكة والخشنة للتكامل ، ومع الطبقات الميتة من بقايا التكامل ، فإنها تشكل قشرة صلبة لحماية الجنين والسويداء5.
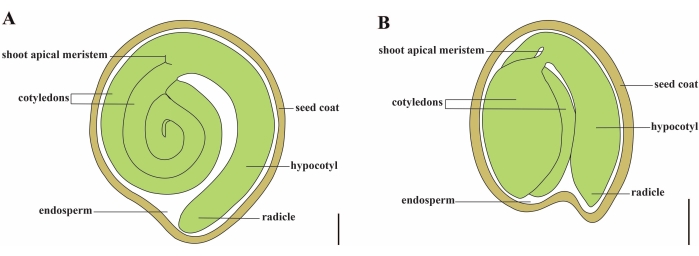
الشكل 1: تمثيل تخطيطي لبذرة ناضجة في Solanum lycopersicum و Arabidopsis thaliana. أ: التشريح الطولي لبذور الطماطم الناضجة. (ب) التشريح الطولي لبذرة أرابيدوبسيس ناضجة. يبلغ حجم بذور الطماطم الناضجة حوالي 70 مرة أكبر من بذور أرابيدوبسيس. قضبان المقياس = (أ) 400 ميكرومتر ، (ب) 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
يعتمد إنتاج بذور الطماطم عالية الجودة على التنسيق بين الجنين والسويداء ومكونات بذور الأم11. يتطلب تشريح الجينات والشبكات الرئيسية في تطوير البذور تسجيلا ظاهريا عميقا وكاملا للبذور الطافرة. يتم تطبيق تقنيات التضمين التقليدية ، مثل القسم شبه الرقيق وقسم البارافين ، على نطاق واسع على بذور الطماطم لمراقبة الهياكل المحلية والدقيقة للجنين12،13،14،15. ومع ذلك ، فإن تحليل تطور البذور من المقاطع الرقيقة عادة ما يكون شاقا ويفتقر إلى الدقة المكانية للمحور z. بالمقارنة ، تعد إزالة الأنسجة طريقة سريعة وفعالة لتحديد المرحلة التنموية لعيوب الجنين التي من المرجح أن تحدث16. تقلل طريقة المقاصة من عتامة الأنسجة الداخلية عن طريق تجانس معامل الانكسار مع واحد أو أكثر من العوامل الكيميائية الحيوية16. تسمح إزالة الأنسجة الكاملة بمراقبة بنية الأنسجة النباتية دون تدمير سلامتها ، وأصبح الجمع بين تقنية المقاصة والتصوير ثلاثي الأبعاد حلا مثاليا للحصول على معلومات حول التشكل والحالة التنموية لعضو النبات17,18. على مر السنين ، تم استخدام تقنيات إزالة البذور في أنواع نباتية مختلفة ، بما في ذلك Arabidopsis thaliana و Hordeum vulgare و Beta vulgaris19،20،21،22،23. من بين هذه ، كانت تقنية إزالة البويضات الكاملة نهجا فعالا لدراسة تطور بذور Arabidopsis ، نظرا لصغر حجمها ، و 4-5 طبقات من خلية معطف البذور ، والسويداء من النوع النووي24,25. مع التحديث المستمر لمخاليط المقاصة المختلفة ، مثل ظهور محلول هوير26 ، تم تصوير الهياكل الداخلية لبويضة الشعير بدرجة عالية من الوضوح على الرغم من أن السويداء يشكل الجزء الأكبر من البذور. يمكن ملاحظة التطور الجنيني لبنجر السكر عن طريق التطهير مع المعالجة الفراغية والتليين بحمض الهيدروكلوريك19. ومع ذلك ، على عكس الأنواع المذكورة أعلاه ، لم يتم الإبلاغ عن الملاحظات الجنينية عن طريق بروتوكولات الإزالة في بذور الطماطم. هذا يمنع التحقيق التفصيلي في التطور الجنيني والبذور للطماطم.
يستخدم هيدرات الكلورال بشكل شائع كمحلول تطهير يسمح بعرض الأنسجة والخلايا المغمورة على مستويات بصرية مختلفة ، ويحافظ بشكل كبير على الخلايا أو مكونات الأنسجة27،28،29. تم استخدام بروتوكول المقاصة القائم على هيدرات الكلورال بنجاح لإزالة البذور بالكامل لمراقبة الجنين والسويداء في Arabidopsis21,28. ومع ذلك ، فإن محلول المقاصة هذا ليس فعالا في إزالة بذور الطماطم ، والتي هي أكثر نفاذية من بذور Arabidopsis. تشمل الحواجز المادية: (1) يحتوي تكامل الطماطم على ما يقرب من 20 طبقة خلية من 3 إلى 15 DAF 30,31 ، (2) السويداء الطماطم من النوع الخلوي ، وليس من النوعالنووي 32 ، و (3) بذور الطماطم أكبر بحوالي 70 مرة في الحجم 33,34 و (4) تنتج كميات كبيرة من صمغ معطف البذور ، مما يمنع تغلغل الكواشف المطهرة ويؤثر على تصور خلايا الجنين.
لذلك ، يقدم هذا التقرير طريقة محسنة للمقاصة القائمة على هيدرات الكلورال لإزالة بذور الطماطم بالكامل في مراحل مختلفة ، مما يسمح بالتصوير العميق لعملية تطور الجنين (الشكل 2).
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد الحلول
- قم بإعداد مثبت FAA بإضافة 2.5 مل من 37٪ فورمالديهايد ، و 2.5 مل من حمض الخليك الجليدي ، و 45 مل من 70٪ إيثانول في أنبوب طرد مركزي سعة 50 مل. دوامة وتخزينها في 4 درجة مئوية. تحضير مثبت FAA طازجا قبل الاستخدام مباشرة.
تنبيه: 37٪ فورمالديهايد مادة أكالة ويحتمل أن تكون مسرطنة إذا تعرضت أو استنشقت. يجب إجراء المثبت في غطاء دخان أثناء ارتداء معدات الحماية الشخصية المناسبة. - تحضير محلول المقاصة بإضافة 5 مل من الجلسرين بنسبة 100٪ ، و 40 جم من هيدرات الكلورال ، و 10 مل من الماء المقطر في زجاجة زجاجية سعة 100 مل ملفوفة بورق القصدير. يذوب باستخدام محرك مغناطيسي طوال الليل في درجة حرارة الغرفة. يمكن تخزين المحلول المحضر عند 4 درجات مئوية لمدة تصل إلى 6 أشهر.
تنبيه: هيدرات الكلورال مادة مسرطنة ولها رائحة نفاذة. قم بإجراء التجربة في غطاء دخان وارتداء معدات الحماية الشخصية المناسبة. من السهل تسييل هيدرات الكلورال في الهواء ويجب عدم تخزينها بكميات كبيرة. يمكن أن يتحلل محلول المقاصة عند تعرضه للضوء ويجب إبعاده عن الضوء. - قم بإعداد المحلول المطهر بإضافة 10 مل من هيبوكلوريت الصوديوم بنسبة 6٪ ، و 40 مل من الماء المقطر ، و 50 ميكرولتر من Tween-20 في أنبوب طرد مركزي سعة 50 مل. دوامة وتخزينها في درجة حرارة الغرفة. تحضير محلول مطهر طازج قبل الاستخدام مباشرة.
ملاحظة: قد ينخفض محتوى الكلور الفعال في هيبوكلوريت الصوديوم الذي تم وضعه لفترة طويلة ، ويمكن زيادة محتوى هيبوكلوريت الصوديوم بنسبة 6٪ وفقا للوضع الفعلي.
2. جمع البذور
- زرع بذور الطماطم (S. lycopersicum L. cv. Micro-Tom ، انظر جدول المواد) في أحواض 8 سم × 8 سم × 8 سم مربعة مليئة بمزيج 1: 1 من تربة مغذيات الزهور والركيزة (v / v) (انظر جدول المواد) ، وتنمو في غرفة نمو مع فترات ضوئية / مظلمة 16/8 ساعة عند 24 ± 2 درجة مئوية (يوم) و 18 ± 2 درجة مئوية (ليلا) ، 60٪ -70٪ رطوبة نسبية ، وشدة ضوء 4000 لوكس. بعد حوالي 6 أسابيع ، دخلت النباتات مرحلة الإزهار.
- ضع علامة على تاريخ ازدهار الزهور المستقلة عند النقش (زاوية فتح البتلات 90 درجة) ، وسجل اليوم التالي للإزهار (DAF).
- حصاد الثمار من 3 إلى 23 نباتات الطماطم DAF ووضعها على الفور على الجليد. قسم الثمار (البذور أو الأجنة) من 3 إلى 23 DAF إلى ثمار مبكرة (3-10 DAF) ، ومتوسطة (11-16 DAF) ، ومتأخرة (17-23 DAF) (بذور أو أجنة).
ملاحظة: لا تجمع الكثير من الفاكهة في وقت واحد وتأكد من تجريد البذور الموجودة في كل فاكهة في غضون 1 ساعة لمزيد من العلاج. - بالنسبة للفواكه المبكرة ، قم بكسر الفاكهة ووضعها على شريحة ، واجمع البذور الطازجة بعناية باستخدام ملقط دقيق تحت المجهر المجسم (انظر جدول المواد) بتكبير 1x إلى 4x. بالنسبة للفواكه المتوسطة والمتأخرة ، قم بكسر الفاكهة وجمع البذور الطازجة مباشرة باستخدام ملقط دقيق.
3. إزالة البذور القائمة على هيدرات الكلورال
ملاحظة: تمت مقارنة35 بروتوكولا تقليديا وبروتوكولا محسنا في هذه الدراسة من أجل كفاءة إزالة البذور.
- المقاصة باستخدام بروتوكول تقليدي
- ضع البذور الطازجة (التي تم الحصول عليها في الخطوة 2.4) على الفور في أنبوب طرد مركزي سعة 2 مل يحتوي على مثبت FAA سعة 1.5 مل واحتضانها على شاكر مداري (5 دورات في الدقيقة ، انظر جدول المواد) لمدة 4 ساعات في درجة حرارة الغرفة.
- قم بتجفيف هذه البذور في سلسلة إيثانول 70٪ و 95٪ و 100٪ إيثانول (v / v) لمدة 1 ساعة لكل منها على شاكر مداري (5 دورة في الدقيقة).
- ضع البذور في 3-5 قطرات من محلول المقاصة (~ 100 ميكرولتر) على الشريحة وقم بتغطية العينة برفق باستخدام غطاء غطاء. استبدل الشريحة بشريحة مقعرة واحدة (انظر جدول المواد) للبذور المتوسطة والمتأخرة.
- احتفظ بهذه الشرائح أو الشرائح المقعرة المفردة في درجة حرارة الغرفة لمدة 30 دقيقة (3 DAF) أو 2 ساعة (6 DAF) أو يوم واحد (9 DAF) أو 3 أيام (12 DAF) أو 7 أيام (14 إلى 22 DAF) اعتمادا على مراحل تطوير مادة البذور (كلما كانت المواد أصغر ، زادت سرعة الإزالة).
- راقب العينات باستخدام مجهر تباين التداخل التفاضلي (DIC) المجهز بكاميرا رقمية (انظر جدول المواد) بتكبير 10x و 20x و 40x. اضبط وحسن سطوع الضوء المرسل وشريط تمرير DIC وفتحة المكثف في الوقت الفعلي لكل عينة والتقاط الصور.
- المقاصة باستخدام البروتوكول الأمثل
- ضع البذور الطازجة (التي تم الحصول عليها في الخطوة 2.4) مباشرة في أنبوب طرد مركزي سعة 2 مل يحتوي على محلول مطهر سعة 1.5 مل (الخطوة 1.3).
ملاحظة: يختلف عدد البذور التي تم جمعها في أنبوب الطرد المركزي سعة 2 مل وفقا لمرحلة نمو البذور. وترد التفاصيل في الجدول 1. - احتضن العينات على شاكر مداري (30 دورة في الدقيقة) في درجة حرارة الغرفة لمدة 3 إلى 50 دقيقة حتى يصبح مخطط طبقة البذور الأعمق مرئيا بوضوح. تخلص من محلول المطهر.
ملاحظة: يعتمد وقت الحضانة المطلوب على مرحلة نمو البذور (كلما تأخرت البذور ، زاد وقت الحضانة). وترد التفاصيل في الجدول 1. - بالنسبة للبذور المتوسطة والمتأخرة ، انقل البذور إلى شريحة وقم بإزالة صمغ البذور بالملقط وإبرة تشريح تحت مجهر مجسم بتكبير 1x إلى 4x. نقل البذور مرة أخرى إلى أنبوب الطرد المركزي الأصلي باستخدام ملقط.
ملاحظة: هذه الخطوة ليست ضرورية للبذور المبكرة. - اغسل البذور 5 مرات ب 1.5 مل من الماء منزوع الأيونات ، 10 ثوان في كل مرة. تخلص من الماء منزوع الأيونات.
- أضف محلول تطهير من 2 × حجم البذور ، متبوعا بمعالجة فراغية لمدة 0 إلى 50 دقيقة (الجدول 1) بمضخة تفريغ (انظر جدول المواد). يتم إجراء المعالجة الفراغية المتقطعة مع كل معالجة فراغ لمدة 10 دقائق متباعدة على فترات 10 دقائق.
- استبدل بمحلول مقاصة جديد من 2 × حجم البذور. احتفظ بأنبوب الطرد المركزي سعة 2 مل الذي يحتوي على البذور في درجة حرارة الغرفة ومحميا من الضوء لمدة 30 دقيقة إلى 7 أيام لتسهيل التطهير (الجدول 1). أثناء الحضانة ، بالنسبة للأجنة المتأخرة ، استبدل محلول المقاصة يوميا بمحلول جديد وأخضع البذور للمعالجة الفراغية لمدة 10 دقائق.
- قم بإعداد البذور التي تم تطهيرها على شرائح أو شرائح مقعرة واحدة وراقبها باستخدام مجهر DIC المجهز بكاميرا رقمية بتكبير 10x و 20x و 40x. اضبط وحسن سطوع الضوء المرسل وشريط تمرير DIC وفتحة المكثف في الوقت الفعلي لكل عينة والتقاط الصور.
- ضع البذور الطازجة (التي تم الحصول عليها في الخطوة 2.4) مباشرة في أنبوب طرد مركزي سعة 2 مل يحتوي على محلول مطهر سعة 1.5 مل (الخطوة 1.3).
Access restricted. Please log in or start a trial to view this content.
النتائج
عندما تم إزالة بذور الطماطم باستخدام طريقة تقليدية كما هو الحال في Arabidopsis ، منعت خلايا السويداء الكثيفة تصور أجنة الطماطم المبكرة عند 3 DAF و 6 DAF (الشكل 3 أ ، ب). مع زيادة الحجم الكلي للجنين ، كان الجنين الكروي بالكاد يمكن تمييزه عند 9 DAF (الشكل 3C). وم...
Access restricted. Please log in or start a trial to view this content.
Discussion
بالمقارنة مع التقسيم الميكانيكي ، تعد تقنية المقاصة أكثر فائدة للتصوير ثلاثي الأبعاد لأنها تحتفظ بسلامة الأنسجة أو الأعضاء النباتية16. غالبا ما تقتصر بروتوكولات المقاصة التقليدية على عينات صغيرة بسبب سهولة اختراق المحاليل الكيميائية. تعتبر بذور الطماطم عينة إشكالية لإزالة ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
يعرب المؤلفون عن امتنانهم للدكتور جي لو والدكتور Xiufen Song لاقتراحاتهما المفيدة حول مجهر تباين التداخل التفاضلي وطريقة المقاصة التقليدية ، على التوالي. تم تمويل هذا البحث من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (31870299) وجمعية تشجيع الابتكار للشباب التابعة للأكاديمية الصينية للعلوم. تم إنشاء الشكل 2 باستخدام BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
References
- FAOSTAT. , Available from: https://www.fao.org/faostat/en/#data/QCL (2022).
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC - The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101(2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49(2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. Taylorson, R. B. 187, Springer. Boston, MA. (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233(2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71(2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148(2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67(2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441(2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382(2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer's solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347(2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3(2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved