É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um Protocolo de Limpeza Eficiente para o Estudo do Desenvolvimento de Sementes em Tomateiro (Solanum lycopersicum L.)
Neste Artigo
Resumo
A semente de tomate é um modelo importante para o estudo da genética e biologia do desenvolvimento durante a reprodução das plantas. Este protocolo é útil para a limpeza de sementes de tomate em diferentes estágios de desenvolvimento para observar a estrutura embrionária mais fina.
Resumo
O tomate (Solanum lycopersicum L.) é uma das principais culturas comerciais em todo o mundo. A semente de tomate é um modelo importante para o estudo da genética e biologia do desenvolvimento durante a reprodução das plantas. A visualização da estrutura embrionária mais fina dentro de uma semente de tomate é muitas vezes dificultada pela mucilagem do revestimento da semente, tegumento em camadas multicelulares e um endosperma de paredes espessas, que precisa ser resolvido por uma laboriosa seção de incorporação. Uma alternativa mais simples é empregar técnicas de limpeza de tecidos que tornam a semente quase transparente usando agentes químicos. Embora os procedimentos convencionais de limpeza permitam uma visão profunda de sementes menores com um revestimento de sementes mais fino, a limpeza de sementes de tomate continua a ser tecnicamente desafiadora, especialmente nos estágios finais de desenvolvimento.
Apresentamos aqui um protocolo de limpeza rápido e que economiza trabalho para observar o desenvolvimento de sementes de tomate de 3 a 23 dias após a floração, quando a morfologia embrionária está quase completa. Este método combina solução de limpeza à base de hidrato de cloral amplamente utilizada em Arabidopsis com outras modificações, incluindo a omissão de fixação de formalina-aceto-álcool (FAA), a adição de tratamento de hipoclorito de sódio de sementes, remoção da mucilagem de revestimento de sementes amolecida e lavagem e tratamento a vácuo. Este método pode ser aplicado para a limpeza eficiente de sementes de tomateiro em diferentes estágios de desenvolvimento e é útil no monitoramento completo do processo de desenvolvimento de sementes mutantes com boa resolução espacial. Este protocolo de limpeza também pode ser aplicado a imagens profundas de outras espécies comercialmente importantes nas Solanaceae.
Introdução
O tomate (S. lycopersicum L.) é uma das culturas vegetais mais importantes do mundo, com uma produção de 186,8 milhões de toneladas de frutos carnudos de 5,1 milhões de hectares em 20201. Pertence à grande família Solanaceae com cerca de 2.716 espécies2, incluindo muitas culturas comercialmente importantes, como berinjela, pimenta, batata e tabaco. O tomateiro cultivado é uma espécie diploide (2n = 2x = 24) com um tamanho de genoma de aproximadamente 900 Mb3. Durante muito tempo, um grande esforço tem sido feito para a domesticação e reprodução do tomate, selecionando características desejáveis de Solanum spp selvagem. Existem mais de 5.000 acessos de tomate listados no Tomato Genetics Resource Center e mais de 80.000 germoplasma de tomates são armazenados em todo o mundo4. A planta de tomate é perene na estufa e se propaga por sementes. Uma semente de tomate madura consiste em três compartimentos principais: um embrião adulto, endosperma residual do tipo celular e um revestimento de sementes duras 5,6 (Figura 1A). Após a dupla fertilização, o desenvolvimento de endospermas do tipo celular precede o desenvolvimento de zigotos. Em ~5-6 dias após a floração (DAF), o proembrião de duas células é observado pela primeira vez quando o endosperma consiste de seis a oito núcleos7. Em Solanum pimpinellifolium, o embrião se aproxima de seu tamanho final após 20 DAF, e as sementes são viáveis para germinação após 32 DAF8. À medida que o embrião se desenvolve, o endosperma é gradualmente absorvido e apenas uma pequena quantidade de endosperma permanece na semente. O endosperma residual consiste em endosperma micropilar ao redor da ponta da radícula e endosperma lateral no restante da semente 9,10. O revestimento externo da semente é desenvolvido a partir da epiderme externa espessada e lignificada do tegumento e, com as camadas mortas de restos de tegumento, formam uma casca dura para proteger o embrião e o endosperma5.
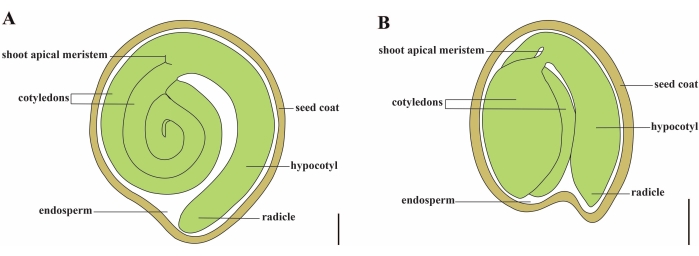
Figura 1: Representação esquemática de uma semente madura em Solanum lycopersicum e Arabidopsis thaliana. (A) Anatomia longitudinal de uma semente de tomateiro madura. (B) Anatomia longitudinal de uma semente madura de Arabidopsis. Uma semente de tomate madura é aproximadamente 70 vezes maior em tamanho do que uma semente de Arabidopsis. Barras de escala = (A) 400 μm, (B) 100 μm. Clique aqui para ver uma versão maior desta figura.
A produção de sementes de tomate de alta qualidade depende da coordenação entre o embrião, o endosperma e os componentes maternos das sementes11. Dissecar genes-chave e redes no desenvolvimento de sementes requer um registro fenotípico profundo e completo de sementes mutantes. Técnicas convencionais de embutimento-seccionamento, como a seção semifina e a seção de parafina, são amplamente aplicadas às sementes de tomateiro para observar as estruturas locais e mais finas do embrião12,13,14,15. No entanto, a análise do desenvolvimento de sementes a partir de seções finas é geralmente trabalhosa e carece de resolução espacial do eixo z. Em comparação, a depuração tecidual é um método rápido e eficiente para identificar o estágio de desenvolvimento dos defeitos embrionários com maior probabilidade de ocorrer16. O método de clareamento reduz a opacidade do tecido interno homogeneizando o índice de refração com um ou mais agentes bioquímicos16. A limpeza de tecidos inteiros permite a observação de uma estrutura tecidual vegetal sem destruir sua integridade, e a combinação de tecnologia de clareamento e imagens tridimensionais tornou-se uma solução ideal para obter informações sobre a morfologia e o estado de desenvolvimento de um órgão vegetal17,18. Ao longo dos anos, técnicas de limpeza de sementes têm sido utilizadas em várias espécies vegetais, incluindo Arabidopsis thaliana, Hordeum vulgare e Beta vulgaris19,20,21,22,23. Dentre estas, a tecnologia de limpeza de óvulos de montagem completa tem sido uma abordagem eficiente para o estudo do desenvolvimento de sementes de Arabidopsis, devido ao seu pequeno tamanho, 4-5 camadas da célula do revestimento da semente e o endosperma do tipo nuclear24,25. Com a atualização contínua de diferentes misturas de clareamento, como o surgimento da solução de Hoyer26, as estruturas internas do óvulo de cevada foram fotografadas com alto grau de clareza, embora seu endosperma constitua a maior parte das sementes. A embriogênese da beterraba sacarina pode ser observada por limpeza combinada com tratamento a vácuo e amolecimento com ácido clorídrico19. No entanto, ao contrário das espécies mencionadas acima, observações embriológicas por protocolos de limpeza em sementes de tomate não foram relatadas. Isso evita uma investigação detalhada sobre o desenvolvimento embrionário e de sementes de tomates.
O hidrato de cloral é comumente utilizado como solução de clareamento que permite que os tecidos e células imersos sejam exibidos em diferentes planos ópticos, preserva substancialmente as células ou componentes teciduais27,28,29. O protocolo de clareamento à base de hidrato de cloral tem sido utilizado com sucesso para a limpeza completa de sementes para observar o embrião e o endosperma de Arabidopsis21,28. No entanto, esta solução de limpeza não é eficiente na limpeza de sementes de tomate, que são mais impermeáveis do que as sementes de Arabidopsis. As barreiras físicas incluem: (1) o tegumento do tomate tem quase 20 camadas celulares em 3 a 15 DAF 30,31, (2) o endosperma do tomate é do tipo celular, não do tipo nuclear 32, e (3) as sementes de tomate são cerca de 70 vezes maiores em tamanho33,34 e (4) produzem grandes quantidades de mucilagem do revestimento da semente, o que bloqueia a penetração de reagentes de limpeza e afeta a visualização das células embrionárias.
Portanto, este relato apresenta um método otimizado de clareamento à base de hidrato de cloral para limpeza integral de sementes de tomateiro em diferentes estágios, o que permite imagens profundas do processo de desenvolvimento embrionário (Figura 2).
Protocolo
1. Preparação de soluções
- Preparar o fixador de FAA adicionando 2,5 mL de formaldeído a 37%, 2,5 mL de ácido acético glacial e 45 mL de etanol a 70% em um tubo de centrífuga de 50 mL. Vórtice e armazená-lo a 4 °C. Prepare recentemente o fixador FAA imediatamente antes de usar.
CUIDADO: 37% de formaldeído é corrosivo e potencialmente cancerígeno se exposto ou inalado. O fixador deve ser realizado em um exaustor enquanto estiver usando o equipamento de proteção individual apropriado. - Prepare a solução de limpeza adicionando 5 mL de glicerol a 100%, 40 g de hidrato de cloral e 10 mL de água destilada em um frasco de vidro de 100 mL envolto com papel alumínio. Dissolva usando um agitador magnético durante a noite à temperatura ambiente. A solução preparada pode ser armazenada a 4 °C por até 6 meses.
CUIDADO: O hidrato de cloral é cancerígeno e tem um cheiro pungente. Realize o experimento em um exaustor e use o equipamento de proteção individual apropriado. O hidrato de cloral é fácil de deliquesce no ar e não deve ser armazenado em grandes quantidades. A solução de limpeza pode se decompor quando exposta à luz e deve ser mantida longe da luz. - Prepare a solução desinfetante adicionando 10 mL de hipoclorito de sódio a 6%, 40 mL de água destilada e 50 μL Tween-20 em um tubo de centrífuga de 50 mL. Vórtice e armazená-lo à temperatura ambiente. Prepare recentemente a solução desinfetante imediatamente antes de utilizar.
NOTA: O teor efetivo de cloro do hipoclorito de sódio que foi colocado por um longo tempo pode diminuir, e o teor de hipoclorito de sódio a 6% pode ser aumentado de acordo com a situação real.
2. Coleta de sementes
- Semear sementes de tomate (S. lycopersicum L. cv. Micro-Tom, ver Tabela de Materiais) em 8 cm × 8 cm × 8 cm bacias quadradas cheias com uma mistura 1:1 de solo e substrato de nutrientes florais (v/v) (ver Tabela de Materiais), e crescer numa sala de crescimento com períodos claros/escuros de 16/8 h a 24 ± 2 °C (dia) e 18 ± 2 °C (noite), 60%-70% de umidade relativa e uma intensidade de luz de 4.000 Lux. Aproximadamente 6 semanas depois, as plantas entraram no estágio de floração.
- Marque a data de floração das flores independentes na antese (o ângulo de abertura das pétalas é de 90°) e registre o dia após a floração (DAF).
- Colha os frutos de 3 a 23 plantas de tomate DAF e coloque-os imediatamente no gelo. Divida os frutos (sementes ou embriões) de 3 a 23 DAF em frutos precoces (3-10 DAF), médios (11-16 DAF) e tardios (17-23 DAF) (sementes ou embriões).
NOTA: Não colete muitos frutos de cada vez e certifique-se de que as sementes em cada fruto sejam retiradas dentro de 1 h para tratamento adicional. - Para frutos precoces, quebre a fruta e coloque-a em uma lâmina e colete sementes frescas cuidadosamente com pinças de precisão sob o estereomicroscópio (veja Tabela de Materiais) com ampliação de 1x a 4x. Para frutos médios e tardios, quebre os frutos e colete diretamente sementes frescas usando pinça de precisão.
3. Limpeza de sementes à base de hidrato de cloral
NOTA: Protocolos convencionais35 e otimizados foram comparados neste estudo quanto à sua eficiência de limpeza de sementes.
- Limpeza usando um protocolo convencional
- Colocar imediatamente as sementes frescas (obtidas na etapa 2.4) num tubo de centrífuga de 2 ml contendo 1,5 ml de fixador FAA e incubar num agitador orbital (5 rpm, ver Tabela de Materiais) durante 4 h à temperatura ambiente.
- Desidratar essas sementes em uma série de etanol de 70%, 95% e 100% de etanol (v/v) por 1 h cada em um agitador orbital (5 rpm).
- Coloque as sementes em 3-5 gotas de solução de limpeza (~ 100 μL) na lâmina e cubra suavemente a amostra com uma folha de cobertura. Substitua o slide por um único slide côncavo (consulte Tabela de materiais) para sementes médias e tardias.
- Mantenha essas lâminas ou lâminas côncavas únicas à temperatura ambiente por 30 min (3 DAF), 2 h (6 DAF), 1 dia (9 DAF), 3 dias (12 DAF) ou 7 dias (14 a 22 DAF), dependendo dos estágios de desenvolvimento do material de semente (quanto mais jovens os materiais, mais rápida a velocidade de limpeza).
- Observe as amostras com um microscópio de contraste de interferência diferencial (DIC) equipado com uma câmera digital (consulte Tabela de Materiais) na ampliação de 10x, 20x e 40x. Ajuste e otimize o brilho da luz transmitida, o controle deslizante DIC e a abertura do condensador em tempo real para cada amostra e capture imagens.
- Limpando usando o protocolo otimizado
- Colocar as sementes frescas (obtidas no passo 2.4) directamente num tubo de centrifugação de 2 ml contendo 1,5 ml de solução desinfetante (passo 1.3).
NOTA: O número de sementes coletadas no tubo de centrífuga de 2 mL varia de acordo com o estágio de desenvolvimento das sementes. Os detalhes estão listados na Tabela 1. - Incubar as amostras num agitador orbital (30 rpm) à temperatura ambiente durante 3 a 50 minutos até que o contorno do revestimento mais interno das sementes seja claramente visível. Rejeitar a solução desinfetante.
NOTA: O tempo de incubação necessário depende do estágio de desenvolvimento das sementes (quanto mais tarde as sementes, maior será o tempo de incubação). Os detalhes estão listados na Tabela 1. - Para sementes médias e tardias, transfira as sementes para uma lâmina e remova a mucilagem da semente com fórceps e uma agulha dissecante sob um estereomicroscópio com ampliação de 1x a 4x. Transfira as sementes de volta para o tubo de centrífuga original usando pinças.
NOTA: Esta etapa não é necessária para sementes precoces. - Lave as sementes 5x com 1,5 mL de água deionizada, 10 s de cada vez. Descarte a água deionizada.
- Adicionar uma solução de limpeza de 2 × volume das sementes, seguida de tratamento a vácuo durante 0 a 50 min (Quadro 1) com uma bomba de vácuo (ver Tabela de Materiais). O tratamento a vácuo intermitente é realizado com cada tratamento a vácuo por 10 minutos espaçados em intervalos de 10 minutos.
- Substitua por uma solução de limpeza fresca de 2 × o volume das sementes. Manter o tubo de centrífuga de 2 mL contendo as sementes em temperatura ambiente e protegido da luz por 30 min a 7 dias para facilitar a limpeza (Tabela 1). Durante a incubação, para embriões tardios, substitua a solução de limpeza diariamente por solução fresca e submeta as sementes ao tratamento a vácuo por 10 min.
- Prepare as sementes limpas em lâminas ou lâminas côncavas simples e observe com o microscópio DIC equipado com uma câmera digital de ampliação de 10x, 20x e 40x. Ajuste e otimize o brilho da luz transmitida, o controle deslizante DIC e a abertura do condensador em tempo real para cada amostra e capture imagens.
- Colocar as sementes frescas (obtidas no passo 2.4) directamente num tubo de centrifugação de 2 ml contendo 1,5 ml de solução desinfetante (passo 1.3).
Resultados
Quando as sementes de tomate foram limpas usando um método convencional como em Arabidopsis, os densos nódulos endospermáticos bloquearam a visualização de embriões de tomate precoces em 3 DAF e 6 DAF (Figura 3A,B). À medida que o volume total do embrião aumentava, um embrião globular era quase indistinguível a 9 DAF (Figura 3C). No entanto, à medida que o tamanho da semente continuou a aumentar, sua permeabilidade diminuiu, ...
Discussão
Em comparação com o corte mecânico, a tecnologia de limpeza é mais vantajosa para imagens tridimensionais, pois mantém a integridade dos tecidos ou órgãos vegetais16. Os protocolos de limpeza convencionais são frequentemente limitados a pequenas amostras devido à penetração mais fácil de soluções químicas. A semente de tomate é uma amostra problemática para a limpeza de tecidos porque é cerca de 70 vezes maior do que uma semente de Arabidopsis em tamanho e tem mais barre...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Os autores são gratos ao Dr. Jie Le e ao Dr. Xiufen Song por suas sugestões úteis sobre microscopia de contraste de interferência diferencial e método de limpeza convencional, respectivamente. Esta pesquisa foi financiada pela Fundação Nacional de Ciências Naturais da China (31870299) e pela Associação de Promoção da Inovação Juvenil da Academia Chinesa de Ciências. A Figura 2 foi criada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
Referências
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC - The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer's solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados