Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un protocolo de limpieza eficiente para el estudio del desarrollo de semillas en tomate (Solanum lycopersicum L.)
En este artículo
Resumen
La semilla de tomate es un modelo importante para estudiar la genética y la biología del desarrollo durante la reproducción de las plantas. Este protocolo es útil para limpiar las semillas de tomate en diferentes etapas de desarrollo para observar la estructura embrionaria más fina.
Resumen
El tomate (Solanum lycopersicum L.) es uno de los principales cultivos comerciales en todo el mundo. La semilla de tomate es un modelo importante para estudiar la genética y la biología del desarrollo durante la reproducción de las plantas. La visualización de la estructura embrionaria más fina dentro de una semilla de tomate a menudo se ve obstaculizada por el mucílago de la capa de semillas, el tegumento de capas múltiples y un endospermo de paredes gruesas, que debe resolverse mediante una laboriosa sección de incrustación. Una alternativa más simple es emplear técnicas de limpieza de tejidos que hacen que la semilla sea casi transparente utilizando agentes químicos. Aunque los procedimientos convencionales de limpieza permiten una visión profunda de las semillas más pequeñas con una capa de semilla más delgada, la limpieza de las semillas de tomate sigue siendo un desafío técnico, especialmente en las últimas etapas de desarrollo.
Aquí se presenta un protocolo de limpieza rápido y que ahorra mano de obra para observar el desarrollo de las semillas de tomate de 3 a 23 días después de la floración, cuando la morfología embrionaria está casi completa. Este método combina la solución de limpieza a base de hidrato de cloral ampliamente utilizada en Arabidopsis con otras modificaciones, incluida la omisión de la fijación de formalina-aceto-alcohol (FAA), la adición del tratamiento con hipoclorito de sodio de las semillas, la eliminación del mucílago de la cubierta de semilla ablandada y el lavado y el tratamiento al vacío. Este método se puede aplicar para la limpieza eficiente de semillas de tomate en diferentes etapas de desarrollo y es útil en el monitoreo completo del proceso de desarrollo de semillas mutantes con buena resolución espacial. Este protocolo de limpieza también se puede aplicar a imágenes profundas de otras especies comercialmente importantes en las solanáceas.
Introducción
El tomate (S. lycopersicum L.) es uno de los cultivos hortícolas más importantes del mundo, con una producción de 186,8 millones de toneladas de frutos carnosos de 5,1 millones de hectáreas en 20201. Pertenece a la gran familia Solanaceae con alrededor de 2.716 especies2, incluyendo muchos cultivos comercialmente importantes como berenjenas, pimientos, patatas y tabaco. El tomate cultivado es una especie diploide (2n = 2x = 24) con un tamaño de genoma de aproximadamente 900 Mb3. Durante mucho tiempo, se ha hecho un gran esfuerzo hacia la domesticación y reproducción del tomate mediante la selección de rasgos deseables de Solanum spp. silvestres. Hay más de 5.000 accesiones de tomate listadas en el Centro de Recursos Genéticos del Tomate y más de 80.000 germoplasma de tomates se almacenan en todo el mundo4. La planta de tomate es perenne en el invernadero y se propaga por semillas. Una semilla de tomate madura consta de tres compartimentos principales: un embrión adulto, endospermo residual de tipo celular y una capa dura de semilla 5,6 (Figura 1A). Después de la doble fertilización, el desarrollo del endospermo de tipo celular precede al desarrollo de cigotos. A ~ 5-6 días después de la floración (DAF), el proembrión bicelular se observa por primera vez cuando el endospermo consta de seis a ocho núcleos7. En Solanum pimpinellifolium, el embrión se acerca a su tamaño final después de 20 DAF, y las semillas son viables para la germinación después de 32 DAF8. A medida que el embrión se desarrolla, el endospermo se absorbe gradualmente y solo queda una pequeña cantidad de endospermo en la semilla. El endospermo residual consiste en endospermo micropilar que rodea la punta de la radícula, y endospermo lateral en el resto de la semilla 9,10. La capa externa de la semilla se desarrolla a partir de la epidermis externa engrosada y lignificada del tegumento, y con las capas muertas de restos de tegumento, forman una cáscara dura para proteger el embrión y el endospermo5.
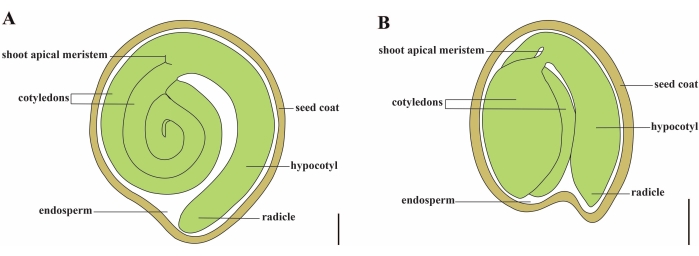
Figura 1: Representación esquemática de una semilla madura en Solanum lycopersicum y Arabidopsis thaliana. (A) Anatomía longitudinal de una semilla de tomate maduro. (B) Anatomía longitudinal de una semilla madura de Arabidopsis. Una semilla de tomate maduro es aproximadamente 70 veces más grande en tamaño que una semilla de Arabidopsis. Barras de escala = (A) 400 μm, (B) 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
La producción de semillas de tomate de alta calidad depende de la coordinación entre el embrión, el endospermo y los componentes de la semilla materna11. La disección de genes y redes clave en el desarrollo de semillas requiere un registro fenotípico profundo y completo de semillas mutantes. Las técnicas convencionales de embutido-seccionamiento, como la sección semifina y la sección de parafina, se aplican ampliamente a las semillas de tomate para observar las estructuras locales y más finas del embrión12,13,14,15. Sin embargo, analizar el desarrollo de la semilla a partir de secciones delgadas suele ser laborioso y carece de resolución espacial del eje z. En comparación, la limpieza del tejido es un método rápido y eficiente para identificar la etapa de desarrollo de los defectos embrionarios que tienen más probabilidades de ocurrir16. El método de depuración reduce la opacidad del tejido interno homogeneizando el índice de refracción con uno o más agentes bioquímicos16. El aclaramiento de tejido completo permite observar la estructura de un tejido vegetal sin destruir su integridad, y la combinación de la tecnología de limpieza y la imagen tridimensional se ha convertido en una solución ideal para obtener información sobre la morfología y el estado de desarrollo de un órgano vegetal17,18. A lo largo de los años, las técnicas de limpieza de semillas se han utilizado en varias especies de plantas, incluyendo Arabidopsis thaliana, Hordeum vulgare y Beta vulgaris 19,20,21,22,23. Entre estos, la tecnología de limpieza de óvulos de montaje completo ha sido un enfoque eficiente para estudiar el desarrollo de semillas de Arabidopsis, debido a su pequeño tamaño, 4-5 capas de la célula de recubrimiento de la semilla y el endospermo de tipo nuclear24,25. Con la actualización continua de diferentes mezclas de aclaramiento, como la aparición de la solución de Hoyer26, las estructuras internas del óvulo de cebada fueron fotografiadas con un alto grado de claridad, aunque su endospermo constituye la mayor parte de las semillas. La embriogénesis de la remolacha azucarera se puede observar mediante la limpieza combinada con el tratamiento al vacío y el ablandamiento con ácido clorhídrico19. Sin embargo, a diferencia de las especies mencionadas anteriormente, no se han reportado observaciones embriológicas mediante protocolos de limpieza en semillas de tomate. Esto impide una investigación detallada sobre el desarrollo embrionario y de semillas de los tomates.
El hidrato de cloral se utiliza comúnmente como una solución de limpieza que permite que los tejidos y células sumergidos se muestren en diferentes planos ópticos, y preserva sustancialmente las células o componentes tisulares27,28,29. El protocolo de limpieza basado en hidrato de cloral se ha utilizado con éxito para el aclaramiento de semillas de montaje completo para observar el embrión y el endospermo de Arabidopsis21,28. Sin embargo, esta solución de limpieza no es eficiente para limpiar las semillas de tomate, que son más impermeables que las semillas de Arabidopsis. Las barreras físicas incluyen: (1) el tegumento del tomate tiene casi 20 capas celulares de 3 a 15 DAF 30,31, (2) el endospermo del tomate es de tipo celular, no de tipo nuclear 32, y (3) las semillas de tomate son aproximadamente 70 veces más grandes en tamaño33,34 y (4) producen grandes cantidades de mucílago de recubrimiento de semillas, lo que bloquea la penetración de los reactivos de limpieza y afecta la visualización de las células embrionarias.
Por lo tanto, este informe presenta un método optimizado de limpieza basado en hidrato de cloral para la limpieza de semillas de tomate de montaje completo en diferentes etapas, lo que permite obtener imágenes profundas del proceso de desarrollo embrionario (Figura 2).
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparación de soluciones
- Prepare el fijador FAA agregando 2.5 ml de formaldehído al 37%, 2.5 ml de ácido acético glacial y 45 ml de etanol al 70% en un tubo de centrífuga de 50 ml. Vortex y almacénelo a 4 °C. Prepare el fijador FAA justo antes de usar.
PRECAUCIÓN: El formaldehído al 37% es corrosivo y potencialmente cancerígeno si se expone o inhala. El fijador debe realizarse en una campana extractora mientras se usa el equipo de protección personal adecuado. - Prepare la solución de limpieza agregando 5 ml de 100% de glicerol, 40 g de hidrato de cloral y 10 ml de agua destilada en una botella de vidrio de 100 ml envuelta con papel de aluminio. Disuelva con un agitador magnético durante la noche a temperatura ambiente. La solución preparada puede conservarse a 4 °C durante un máximo de 6 meses.
PRECAUCIÓN: El hidrato de cloral es cancerígeno y tiene un olor acre. Realice el experimento en una campana extractora y use el equipo de protección personal adecuado. El hidrato de cloral es fácil de delicuescencia en el aire y no debe almacenarse en grandes cantidades. La solución de limpieza puede descomponerse cuando se expone a la luz y debe mantenerse alejada de la luz. - Prepare la solución desinfectante agregando 10 ml de hipoclorito de sodio al 6%, 40 ml de agua destilada y 50 μL Tween-20 en un tubo de centrífuga de 50 ml. Vortex y guárdelo a temperatura ambiente. Prepare la solución desinfectante justo antes de usarla.
NOTA: El contenido efectivo de cloro del hipoclorito de sodio que se ha colocado durante mucho tiempo puede disminuir, y el contenido de hipoclorito de sodio al 6% puede aumentarse de acuerdo con la situación real.
2. Recogida de semillas
- Sembrar semillas de tomate (S. lycopersicum L. cv. Micro-Tom, ver Tabla de materiales) en cuencas cuadradas de 8 cm × 8 cm × 8 cm llenas con una mezcla 1:1 de tierra nutritiva de flores y sustrato (v/v) (ver Tabla de materiales), y cultivar en una sala de crecimiento con períodos claros/oscuros de 16/8 h a 24 ± 2 °C (día) y 18 ± 2 °C (noche), 60%-70% de humedad relativa, y una intensidad de luz de 4.000 Lux. Aproximadamente 6 semanas después, las plantas entraron en la etapa de floración.
- Etiquete la fecha de floración de las flores independientes en la antesis (el ángulo de apertura de los pétalos es de 90°) y registre el día después de la floración (DAF).
- Coseche los frutos de 3 a 23 plantas de tomate DAF e inmediatamente póngalas en hielo. Divida las frutas (semillas o embriones) de 3 a 23 DAF en frutas tempranas (3-10 DAF), medianas (11-16 DAF) y tardías (17-23 DAF) (semillas o embriones).
NOTA: No recoja demasiadas frutas a la vez y asegúrese de que las semillas de cada fruta se eliminen dentro de 1 h para un tratamiento posterior. - Para las frutas tempranas, rompa la fruta y colóquela en un portaobjetos, y recoja las semillas frescas cuidadosamente con pinzas de precisión bajo el microscopio estereoscópico (consulte la Tabla de materiales) con un aumento de 1x a 4x. Para frutas medias y tardías, rompa la fruta y recoja directamente las semillas frescas con pinzas de precisión.
3. Limpieza de semillas a base de hidrato de cloral
NOTA: En este estudio se compararon los protocolos convencionales35 y optimizados por su eficiencia de limpieza de semillas.
- Limpieza mediante un protocolo convencional
- Colocar inmediatamente las semillas frescas (obtenidas en el paso 2.4) en un tubo centrífugo de 2 ml que contenga 1,5 ml de fijador FAA e incubar en un agitador orbital (5 rpm, ver Tabla de materiales) durante 4 h a temperatura ambiente.
- Deshidratar estas semillas en una serie de etanol de 70%, 95% y 100% de etanol (v/v) durante 1 h cada una en un agitador orbital (5 rpm).
- Coloque las semillas en 3-5 gotas de solución transparente (~ 100 μL) en el portaobjetos y cubra suavemente la muestra con un cubreobjetos. Reemplace la diapositiva con una sola diapositiva cóncava (consulte la Tabla de materiales) para semillas medias y tardías.
- Mantenga estos portaobjetos o portaobjetos cóncavos individuales a temperatura ambiente durante 30 min (3 DAF), 2 h (6 DAF), 1 día (9 DAF), 3 días (12 DAF) o 7 días (14 a 22 DAF) dependiendo de las etapas de desarrollo del material de semilla (cuanto más jóvenes sean los materiales, más rápida será la velocidad de limpieza).
- Observe las muestras con un microscopio de contraste de interferencia diferencial (DIC) equipado con una cámara digital (consulte la Tabla de materiales) con un aumento de 10x, 20x y 40x. Ajuste y optimice el brillo de la luz transmitida, el control deslizante DIC y la apertura del condensador en tiempo real para cada muestra y capture imágenes.
- Borrado mediante el protocolo optimizado
- Colocar las semillas frescas (obtenidas en la etapa 2.4) directamente en un tubo de centrífuga de 2 ml que contenga 1,5 ml de solución desinfectante (paso 1.3).
NOTA: El número de semillas recolectadas en el tubo de centrífuga de 2 ml varía según la etapa de desarrollo de las semillas. Los detalles se enumeran en la Tabla 1. - Incubar las muestras en un agitador orbital (30 rpm) a temperatura ambiente durante 3 a 50 minutos hasta que el contorno de la cubierta de semilla más interna sea claramente visible. Deseche la solución desinfectante.
NOTA: El tiempo de incubación requerido depende de la etapa de desarrollo de la semilla (cuanto más tarde sean las semillas, mayor será el tiempo de incubación). Los detalles se enumeran en la Tabla 1. - Para semillas medias y tardías, transfiera las semillas a un portaobjetos y retire el mucílago de la semilla con fórceps y una aguja de disección bajo un microscopio estereoscópico con un aumento de 1x a 4x. Transfiera las semillas de nuevo al tubo de centrífuga original usando pinzas.
NOTA: Este paso no es necesario para las semillas tempranas. - Lave las semillas 5 veces con 1,5 ml de agua desionizada, 10 s cada vez. Deseche el agua desionizada.
- Agregue una solución de limpieza de 2 × el volumen de las semillas, seguido de un tratamiento al vacío de 0 a 50 minutos (Tabla 1) con una bomba de vacío (ver Tabla de materiales). El tratamiento de vacío intermitente se realiza con cada tratamiento de vacío durante 10 minutos espaciados a intervalos de 10 minutos.
- Reemplace con una solución fresca de aclaramiento de 2 × el volumen de las semillas. Mantenga el tubo de centrífuga de 2 ml que contiene las semillas a temperatura ambiente y protegido de la luz durante 30 minutos a 7 días para facilitar la limpieza (Tabla 1). Durante la incubación, para embriones tardíos, reemplace la solución de limpieza diariamente con solución fresca y someta las semillas a un tratamiento de vacío durante 10 minutos.
- Prepare las semillas limpias en portaobjetos o portaobjetos cóncavos individuales y observe con el microscopio DIC equipado con una cámara digital con aumentos de 10x, 20x y 40x. Ajuste y optimice el brillo de la luz transmitida, el control deslizante DIC y la apertura del condensador en tiempo real para cada muestra y capture imágenes.
- Colocar las semillas frescas (obtenidas en la etapa 2.4) directamente en un tubo de centrífuga de 2 ml que contenga 1,5 ml de solución desinfectante (paso 1.3).
Access restricted. Please log in or start a trial to view this content.
Resultados
Cuando las semillas de tomate se eliminaron utilizando un método convencional como en Arabidopsis, las células densas del endospermo bloquearon la visualización de embriones de tomate tempranos a 3 DAF y 6 DAF (Figura 3A, B). A medida que aumentaba el volumen total del embrión, un embrión globular apenas se distinguía a 9 DAF (Figura 3C). Sin embargo, a medida que el tamaño de la semilla continuó aumentando, su permeabilidad dis...
Access restricted. Please log in or start a trial to view this content.
Discusión
En comparación con la sección mecánica, la tecnología de limpieza es más ventajosa para la obtención de imágenes tridimensionales, ya que conserva la integridad de los tejidos u órganos vegetales16. Los protocolos de limpieza convencionales a menudo se limitan a muestras pequeñas debido a la penetración más fácil de las soluciones químicas. La semilla de tomate es una muestra problemática para la limpieza de tejidos porque es aproximadamente 70 veces más grande que una semilla de
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores agradecen al Dr. Jie Le y al Dr. Xiufen Song por sus útiles sugerencias sobre la microscopía de contraste de interferencia diferencial y el método de limpieza convencional, respectivamente. Esta investigación fue financiada por la Fundación Nacional de Ciencias Naturales de China (31870299) y la Asociación de Promoción de la Innovación Juvenil de la Academia China de Ciencias. La figura 2 se creó con BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
Referencias
- FAOSTAT. , Available from: https://www.fao.org/faostat/en/#data/QCL (2022).
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC - The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101(2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49(2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. Taylorson, R. B. 187, Springer. Boston, MA. (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233(2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71(2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148(2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67(2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441(2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382(2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer's solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347(2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3(2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados