A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פרוטוקול ניקוי יעיל לחקר התפתחות זרעים בעגבניות (Solanum lycopersicum L.)
In This Article
Summary
זרעי העגבנייה הם מודל חשוב לחקר גנטיקה וביולוגיה התפתחותית במהלך רבייה של צמחים. פרוטוקול זה שימושי לניקוי זרעי עגבניות בשלבי התפתחות שונים כדי לבחון את המבנה העוברי העדין יותר.
Abstract
עגבניות (Solanum lycopersicum L.) הוא אחד מגידולי המזומנים העיקריים בעולם. זרעי העגבנייה הם מודל חשוב לחקר גנטיקה וביולוגיה התפתחותית במהלך רבייה של צמחים. הדמיה של מבנה עוברי עדין יותר בתוך זרע עגבנייה נפגעת לעתים קרובות על ידי רירית ציפוי זרעים, כסות רב-שכבתית ואנדוספרם בעל דופן עבה, אשר צריך להיפתר על ידי חתך הטבעה מייגע. חלופה פשוטה יותר היא להשתמש בטכניקות ניקוי רקמות שהופכות את הזרע לכמעט שקוף באמצעות חומרים כימיים. למרות שהליכי ניקוי קונבנציונליים מאפשרים תובנה עמוקה לגבי זרעים קטנים יותר עם שכבת זרעים דקה יותר, ניקוי זרעי עגבניות ממשיך להיות מאתגר מבחינה טכנית, במיוחד בשלבי ההתפתחות המאוחרים.
מוצג כאן פרוטוקול ניקוי מהיר וחוסך עבודה לצפייה בהתפתחות זרעי עגבניות בין 3 ל -23 ימים לאחר הפריחה כאשר המורפולוגיה העוברית כמעט הושלמה. שיטה זו משלבת תמיסת ניקוי מבוססת כלור הידרט הנמצאת בשימוש נרחב בערבידופסיס עם שינויים אחרים, כולל השמטת קיבוע פורמלין-אצטו-אלכוהול (FAA), הוספת טיפול בנתרן היפוכלוריט בזרעים, הסרת רירית שכבת הזרעים המרוככת, וטיפול בשטיפה ואקום. שיטה זו יכולה להיות מיושמת לניקוי יעיל של זרעי עגבניות בשלבי התפתחות שונים והיא שימושית במעקב מלא אחר התהליך ההתפתחותי של זרעים מוטנטיים ברזולוציה מרחבית טובה. פרוטוקול ניקוי זה עשוי להיות מיושם גם על הדמיה עמוקה של מינים חשובים מסחריים אחרים בסולניים.
Introduction
עגבניות (S. lycopersicum L.) הוא אחד מגידולי הירקות החשובים ביותר ברחבי העולם, עם תפוקה של 186.8 מיליון טונות של פירות בשרניים מ 5.1 מיליון דונם בשנת 20201. הוא שייך למשפחת Solanaceae הגדולה עם כ-2,716 מינים2, כולל גידולים רבים בעלי חשיבות מסחרית כגון חצילים, פלפלים, תפוחי אדמה וטבק. העגבנייה המעובדת היא מין דיפלואידי (2n = 2x = 24) עם גודל גנום של כ 900 Mb3. במשך זמן רב, נעשה מאמץ רב לקראת ביות עגבניות ורבייה על ידי בחירת תכונות רצויות מסולנום פראי spp. יש יותר מ-5,000 עגבניות במרכז המשאבים לגנטיקה של עגבניות ויותר מ-80,000 נבטים של עגבניות מאוחסנים ברחבי העולם4. צמח העגבנייה הוא רב שנתי בחממה ומתפשט על ידי זרעים. זרע עגבנייה בוגר מורכב משלושה תאים עיקריים: עובר בגידול מלא, אנדוספרם מסוג תאי שיורי ושכבת זרע קשה 5,6 (איור 1A). לאחר הפריה כפולה, התפתחות אנדוספרם מסוג תאי מקדימה את התפתחות הזיגוטים. ב~5-6 ימים לאחר הפריחה (DAF), פרומבריו דו-תאי נצפה לראשונה כאשר האנדוספרם מורכב משישה עד שמונה גרעינים7. ב- Solanum pimpinellifolium, העובר מתקרב לגודלו הסופי לאחר 20 DAF, וזרעים הם בני קיימא לנביטה לאחר 32 DAF8. ככל שהעובר מתפתח, האנדוספרם נספג בהדרגה ורק כמות קטנה של אנדוספרם נשארת בזרע. האנדוספרם השיורי מורכב מאנדוספרם מיקרופילרי המקיף את קצה הרדיקל, ואנדוספרם לרוחב בשאר הזרע 9,10. ציפוי הזרע החיצוני מפותח מאפידרמיס חיצוני מעובה ומכובד של הכסות, ועם השכבות המתות של שרידי הכסות, הם יוצרים קליפה קשה כדי להגן על העובר והאנדוספרם5.
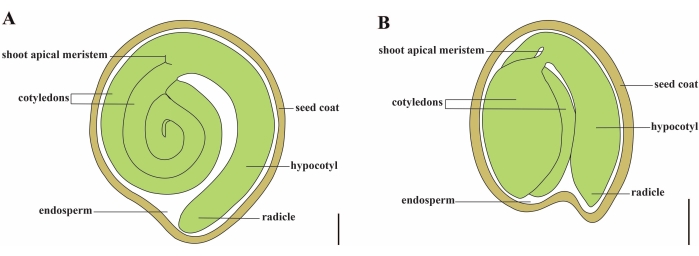
איור 1: ייצוג סכמטי של זרע בוגר בסולנום ליקופרסיום ובערבידופסיס תאליאנה. (A) אנטומיה אורכית של זרעי עגבנייה בוגרים. (B) אנטומיה אורכית של זרע ערבידופסיס בוגר. גודלו של זרע עגבנייה בוגר גדול בערך פי 70 מזרע ערבידופסיס. פסי קנה מידה = (A) 400 μm, (B) 100 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
ייצור זרעי עגבניות איכותיים תלוי בתיאום בין העובר, האנדוספרם ומרכיבי הזרע האימהי11. ניתוח גנים ורשתות מפתח בהתפתחות זרעים דורש רישום פנוטיפי עמוק ומלא של זרעים מוטנטיים. טכניקות חיתוך הטמעה קונבנציונליות, כגון חתך דק למחצה וחתך פרפין, מיושמות באופן נרחב על זרעי עגבניות כדי לבחון את המבנים המקומיים והעדינים יותר של העובר12,13,14,15. עם זאת, ניתוח התפתחות הזרעים מקטעים דקים הוא בדרך כלל מייגע וחסר רזולוציה מרחבית של ציר z. לשם השוואה, ניקוי רקמות הוא שיטה מהירה ויעילה לאיתור השלב ההתפתחותי של פגמים בעוברים שסביר ביותר שיתרחשו16. שיטת הניקוי מפחיתה את האטימות של הרקמה הפנימית על ידי הומוגניזציה של מקדם השבירה עם חומר ביוכימי אחד או יותר16. ניקוי רקמות שלמות מאפשר תצפית על מבנה רקמה צמחית מבלי להרוס את שלמותה, והשילוב של טכנולוגיית ניקוי והדמיה תלת מימדית הפך לפתרון אידיאלי לקבלת מידע על המורפולוגיה והמצב ההתפתחותי של איבר צמחי17,18. במהלך השנים, טכניקות ניקוי זרעים שימשו במיני צמחים שונים, כולל Arabidopsis thaliana, Hordeum vulgare, ו- Beta vulgaris 19,20,21,22,23. בין אלה, טכנולוגיית ניקוי הביציות בהרכבה שלמה הייתה גישה יעילה לחקר התפתחות זרעים של Arabidopsis, בשל גודלו הקטן, 4-5 שכבות של תא ציפוי הזרע, והאנדוספרם מסוג גרעיני24,25. עם העדכון המתמשך של תערובות ניקוי שונות, כגון הופעת הפתרון של Hoyer26, מבנים פנימיים של ביצית השעורה צולמו עם רמה גבוהה של בהירות למרות אנדוספרם שלה מהווה את עיקר הזרעים. Embryogenesis של סלק סוכר ניתן לראות על ידי ניקוי בשילוב עם טיפול ואקום ריכוך עם חומצה הידרוכלורית19. עם זאת, בניגוד למינים שהוזכרו לעיל, לא דווח על תצפיות אמבריולוגיות על ידי ניקוי פרוטוקולים בזרעי עגבניות. זה מונע חקירה מפורטת של התפתחות עוברית וזרעים של עגבניות.
כלורל הידרט משמש בדרך כלל כתמיסת ניקוי המאפשרת להציג את הרקמות והתאים השקועים במישורים אופטיים שונים, ומשמרת באופן משמעותי את התאים או מרכיבי הרקמה27,28,29. פרוטוקול ניקוי מבוסס כלורל הידרט שימש בהצלחה לניקוי שלם של זרעים כדי לבחון את העובר והאנדוספרם של Arabidopsis21,28. עם זאת, פתרון ניקוי זה אינו יעיל בניקוי זרעי עגבניות, שהם אטומים יותר מזרעי ערבידופסיס. המחסומים הפיזיים כוללים: (1) לכסות העגבניות יש כמעט 20 שכבות תאים ב-3 עד 15 DAF 30,31, (2) אנדוספרם העגבניות הוא מסוג תאים, לא מסוג גרעיני 32, ו-(3) זרעי עגבניות גדולים בערך פי 70 בגודל33,34 ו-(4) מייצרים כמויות גדולות של רירית ציפוי זרעים, מה שחוסם את החדירה של ריאגנטים לניקוי ומשפיע על הדמיה של תאי עובר.
לכן, דוח זה מציג שיטת ניקוי אופטימלית המבוססת על כלור הידרט לניקוי שלם של זרעי עגבניות בשלבים שונים, המאפשרת הדמיה עמוקה של תהליך התפתחות העובר (איור 2).
Protocol
1. הכנת פתרונות
- הכינו את ה-FAA על ידי הוספת 2.5 מ"ל של 37% פורמלדהיד, 2.5 מ"ל של חומצה אצטית קרחונית ו-45 מ"ל של 70% אתנול בצינור צנטריפוגה של 50 מ"ל. מערבולת ולאחסן אותו ב 4 מעלות צלזיוס. יש להכין את FAA באופן קבוע ממש לפני השימוש.
אזהרה: 37% פורמלדהיד הוא קורוזיבי ועלול להיות מסרטן אם נחשף או נשאף. יש לבצע את הקיבעון במכסה אדים תוך לבישת ציוד מגן אישי מתאים. - הכינו תמיסת ניקוי על ידי הוספת 5 מ"ל של 100% גליצרול, 40 גרם כלור הידרט ו-10 מ"ל מים מזוקקים בבקבוק זכוכית של 100 מ"ל עטוף בנייר כסף. יש להמיס באמצעות מערבל מגנטי למשך לילה בטמפרטורת החדר. הפתרון מוכן יכול להיות מאוחסן ב 4 °C במשך עד 6 חודשים.
אזהרה: כלורל הידרט הוא מסרטן ובעל ריח חריף. בצעו את הניסוי במכסה אדים וענדו ציוד מגן אישי מתאים. כלור הידרט קל לזייף באוויר ואין לאחסן אותו בכמויות גדולות. תמיסת הניקוי יכולה להתפרק כאשר היא נחשפת לאור ויש להרחיקה מהאור. - הכן את תמיסת החיטוי על ידי הוספת 10 מ"ל של 6% נתרן היפוכלוריט, 40 מ"ל מים מזוקקים ו-50 μL Tween-20 בצינור צנטריפוגה של 50 מ"ל. מערבולות ולאחסן אותו בטמפרטורת החדר. הכן טרי את תמיסת החיטוי ממש לפני השימוש.
הערה: תכולת הכלור האפקטיבית של נתרן היפוכלוריט שהונחה במשך זמן רב עשויה לרדת, וניתן להגדיל את התוכן של 6% נתרן היפוכלוריט בהתאם למצב בפועל.
2. איסוף זרעים
- זורעים זרעי עגבניות (S. lycopersicum L. cv. Micro-Tom, ראו טבלת חומרים) ב-8 ס"מ × 8 ס"מ × כיורים מרובעים בגודל 8 ס"מ מלאים בתערובת של 1:1 של אדמה ומצע של פרחים מזינים (v/v) (ראו טבלת חומרים), וגדלים בחדר גידול עם תקופות אור/חושך של 16/8 שעות ב-24 ± 2 מעלות צלזיוס (יום) ו-18 ± 2 מעלות צלזיוס (לילה), 60%-70% לחות יחסית, ועוצמת אור של 4,000 לוקס. כ-6 שבועות לאחר מכן נכנסו הצמחים לשלב הפריחה.
- תייג את תאריך הפריחה של פרחים עצמאיים באנתזה (זווית הפתיחה של עלי הכותרת היא 90 מעלות), ותעד את היום שלאחר הפריחה (DAF).
- לקצור את הפירות מ 3 עד 23 צמחי עגבניות DAF ומיד לשים אותם על קרח. חלקו פירות (זרעים או עוברים) מ-3 עד 23 DAF לפירות מוקדמים (3-10 DAF), אמצעיים (11-16 DAF) ומאוחרים (17-23 DAF) (זרעים או עוברים).
הערה: אין לאסוף יותר מדי פירות בכל פעם ולוודא שהזרעים בכל פרי מופשטים תוך שעה להמשך טיפול. - עבור פירות מוקדמים, שוברים את הפרי ומניחים אותו על מגלשה, ואוספים זרעים טריים בזהירות עם מלקחיים מדויקים מתחת לסטריאומיקרוסקופ (ראו טבלת חומרים) בהגדלה של פי 1 עד 4. לפירות בינוניים ומאוחרים, שוברים את הפרי ואוספים ישירות זרעים טריים באמצעות מלקחיים מדויקים.
3. ניקוי זרעים על בסיס כלורל הידרט
הערה:35 פרוטוקולים קונבנציונליים וממוטבים הושוו במחקר זה ליעילות ניקוי הזרעים שלהם.
- ניקוי באמצעות פרוטוקול קונבנציונלי
- מניחים זרעים טריים (המתקבלים בשלב 2.4) מיד בצינור צנטריפוגה 2 מ"ל המכיל 1.5 מ"ל FAA מקובע ודגירה על שייקר אורביטלי (5 סל"ד, ראו טבלת חומרים) למשך 4 שעות בטמפרטורת החדר.
- ייבשו את הזרעים האלה בסדרת אתנול של 70%, 95% ו-100% אתנול (v/v) למשך שעה אחת כל אחד על שייקר אורביטלי (5 סל"ד).
- מניחים את הזרעים ב-3-5 טיפות של תמיסת ניקוי (~100 μL) על המגלשה ומכסים בעדינות את הדגימה בכיסוי. החלף את השקופית בשקופית קעורה אחת (ראה טבלת חומרים) עבור זרעים אמצעיים ומאוחרים.
- שמור שקופיות אלה או שקופיות קעורות בודדות בטמפרטורת החדר למשך 30 דקות (3 DAF), שעתיים (6 DAF), יום אחד (9 DAF), 3 ימים (12 DAF) או 7 ימים (14 עד 22 DAF) בהתאם לשלבי ההתפתחות של חומר הזרע (ככל שהחומרים צעירים יותר, כך מהירות הניקוי מהירה יותר).
- התבונן בדגימות באמצעות מיקרוסקופ ניגוד הפרעות דיפרנציאלי (DIC) המצויד במצלמה דיגיטלית (ראה טבלת חומרים) בהגדלה של 10x, 20x ו- 40x. כוונן ומטב את בהירות האור המועברת, מחוון DIC ומפתח צמצם המעבה בזמן אמת עבור כל דגימה ולכוד תמונות.
- ניקוי באמצעות הפרוטוקול הממוטב
- הכניסו זרעים טריים (שהתקבלו בשלב 2.4) ישירות לתוך צינור צנטריפוגה של 2 מ"ל המכיל תמיסת חיטוי של 1.5 מ"ל (שלב 1.3).
הערה: מספר הזרעים שנאספו בצינור הצנטריפוגה של 2 מ"ל משתנה בהתאם לשלב ההתפתחותי של הזרעים. הפרטים מפורטים בטבלה 1. - דגירה של הדגימות על שייקר אורביטלי (30 סל"ד) בטמפרטורת החדר למשך 3 עד 50 דקות עד שניתן יהיה לראות בבירור את קווי המתאר הפנימיים ביותר של שכבת הזרעים. השליכו את תמיסת החיטוי.
הערה: זמן הדגירה הנדרש תלוי בשלב התפתחות הזרעים (ככל שהזרעים מאוחרים יותר, כך זמן הדגירה יהיה ארוך יותר). הפרטים מפורטים בטבלה 1. - עבור זרעים אמצעיים ומאוחרים, מעבירים את הזרעים למגלשה ומסירים את רירית הזרעים בעזרת מלקחיים ומחט ניתוח תחת סטריאומיקרוסקופ בהגדלה של פי 1 עד 4. מעבירים את הזרעים בחזרה לצינור הצנטריפוגה המקורי באמצעות מלקחיים.
הערה: שלב זה אינו הכרחי עבור זרעים מוקדמים. - לשטוף את הזרעים 5x עם 1.5 מ"ל מים deionized, 10 שניות בכל פעם. השליכו את המים שעברו דה-יוניזציה.
- הוסף תמיסת ניקוי של 2 × נפח הזרעים, ולאחר מכן טיפול ואקום במשך 0 עד 50 דקות (טבלה 1) עם משאבת ואקום (ראה טבלת חומרים). טיפול ואקום לסירוגין מבוצע עם כל טיפול ואקום במשך 10 דקות במרווחים של 10 דקות.
- החלף עם פתרון ניקוי טרי של 2 × נפח הזרעים. שמור את צינור הצנטריפוגה 2 מ"ל המכיל את הזרעים בטמפרטורת החדר ומוגן מפני אור למשך 30 דקות עד 7 ימים כדי להקל על הניקוי (טבלה 1). במהלך הדגירה, עבור עוברים מאוחרים, יש להחליף את תמיסת הניקוי מדי יום בתמיסה טרייה ולהכפיף את הזרעים לטיפול ואקום למשך 10 דקות.
- הכן את הזרעים המנוקים על שקופיות או שקופיות קעורות בודדות והתבונן באמצעות מיקרוסקופ DIC המצויד במצלמה דיגיטלית בהגדלה של 10x, 20x ו- 40x. כוונן ומטב את בהירות האור המועברת, מחוון DIC ומפתח צמצם המעבה בזמן אמת עבור כל דגימה ולכוד תמונות.
- הכניסו זרעים טריים (שהתקבלו בשלב 2.4) ישירות לתוך צינור צנטריפוגה של 2 מ"ל המכיל תמיסת חיטוי של 1.5 מ"ל (שלב 1.3).
תוצאות
כאשר זרעי עגבניות נוקו בשיטה קונבנציונלית כמו בערבידופסיס, תאי אנדוספרם צפופים חסמו את ההדמיה של עוברי עגבניות מוקדמים ב-3 DAF ו-6 DAF (איור 3A,B). ככל שהנפח הכולל של העובר גדל, בקושי ניתן היה להבחין בעובר כדורי ב-9 DAF (איור 3C). עם זאת, ככל שגודל הזרע המש?...
Discussion
בהשוואה לחיתוך מכני, טכנולוגיית הסליקה מועילה יותר להדמיה תלת מימדית מכיוון שהיא שומרת על שלמות רקמות הצמח או איברים16. פרוטוקולי ניקוי קונבנציונליים מוגבלים לעתים קרובות לדגימות קטנות בשל חדירה קלה יותר של תמיסות כימיות. זרעי עגבניות הם דגימה בעייתית לניקוי רקמות מכיוון שה?...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
המחברים מודים לד"ר ג'יה לה ולד"ר שיופן סונג על הצעותיהם המועילות למיקרוסקופיה של ניגודיות הפרעות דיפרנציאליות ולשיטת הניקוי הקונבנציונלית, בהתאמה. מחקר זה מומן על ידי הקרן הלאומית למדעי הטבע של סין (31870299) והאגודה לקידום חדשנות לנוער של האקדמיה הסינית למדעים. איור 2 נוצר עם BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
References
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC - The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer's solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetics. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved