A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فحص عالي المحتوى لتحديد المركبات المعدلة للسمية الخلوية المعتمدة على الأجسام المضادة
* These authors contributed equally
In This Article
Summary
يقدم هذا البروتوكول تقنية آلية عالية الإنتاجية قائمة على الصور لتحديد المركبات التي تعدل قتل خلايا سرطان الثدي بوساطة الخلايا القاتلة الطبيعية في وجود جسم مضاد علاجي مضاد ل HER-2.
Abstract
أحدث العلاج المناعي بالأجسام المضادة الخاصة بالمستضد أو مثبطات نقاط التفتيش المناعية ثورة في علاج سرطان الثدي. يمكن استهداف خلايا سرطان الثدي التي تعبر عن مستقبل عامل نمو البشرة HER2 بواسطة الجسم المضاد ل HER-2 تراستوزوماب. السمية الخلوية المعتمدة على الأجسام المضادة (ADCC) هي آلية مهمة متورطة في العمل المضاد للأورام ل HER-2. يمكن التعرف على Trastuzumab المرتبط بالخلايا السرطانية بواسطة مستقبلات Fc للخلايا المستجيبة ADCC (على سبيل المثال ، الخلايا القاتلة الطبيعية (NK) ، والبلاعم ، والخلايا المحببة) ، مما يؤدي إلى النشاط السام للخلايا لهذه الخلايا المناعية مما يؤدي إلى موت الخلايا السرطانية. شرعنا في تطوير مقايسة قائمة على الصور لقياس كمية ADCC لتحديد مركبات معدل ADCC الجديدة عن طريق فحص المحتوى العالي. في الفحص ، يتم زراعة خلايا سرطان الثدي HER2 JIMT-1 بشكل مفرط مع خلايا NK-92 في وجود تراستوزوماب ، ويتم قياس موت الخلايا المستهدفة عن طريق الفحص المجهري الآلي وتحليل الصور الكمي. تتميز الخلايا المستهدفة عن الخلايا المستجيبة بناء على مضان EGFP. نوضح كيف يمكن اختبار المكتبات المركبة في الفحص لتحديد أدوية ADCC المعدلة. لهذا الغرض ، تم إنشاء لوحة اختبار مكتبة مركبة باستخدام مواد كيميائية دقيقة تم اختيارها عشوائيا من رف المختبر. كما تم تضمين ثلاثة مركبات مزعزعة للاستقرار من الأنابيب الدقيقة (كولشيسين ، فينكريستين ، بودوفيلوتوكسين) من المتوقع أن تتداخل مع هجرة الخلايا القاتلة الطبيعية وتحللها في مكتبة الاختبار. حددت شاشة الاختبار جميع مركبات التحكم الإيجابية الثلاثة كنتائج تثبت مدى ملاءمة الطريقة لتحديد الأدوية المعدلة ل ADCC في مكتبة كيميائية. باستخدام هذا الفحص ، يمكن إجراء شاشات المكتبة المركبة لتحديد المركبات المعززة ل ADCC والتي يمكن استخدامها كعوامل علاجية مساعدة لعلاج المرضى الذين يتلقون علاجات مناعية مضادة للسرطان. بالإضافة إلى ذلك ، يمكن أيضا استخدام الطريقة لتحديد أي آثار جانبية غير مرغوب فيها مثبطة ل ADCC للأدوية العلاجية التي يتناولها مرضى السرطان لمؤشرات مختلفة.
Introduction
يمثل العلاج المناعي بالأجسام المضادة للسرطان أو مثبطات نقاط التفتيش المناعية أو الخلايا التائية المعبرة عن مستقبلات المستضد الخيمري (CAR-T) نهجا قويا لعلاج السرطان1،2،3. Trastuzumab هو جسم مضاد أحادي النسيلة متوافق مع البشر HER-2 (مستقبل عامل نمو البشرة البشري 2) يستخدم لعلاج المرحلة المبكرة الإيجابية HER-2 أو سرطان الثدي النقيلي ، وكذلك سرطان المعدة النقيلي الإيجابي HER-24،5،6. وهو يعمل في المقام الأول عن طريق تثبيط تأثير تحفيز الانتشار لعامل نمو البشرة4. ومع ذلك ، فقد تم الإبلاغ عن أن تراستوزوماب يؤدي بكفاءة إلى موت الخلايا السرطانية حتى لو فقدت الخلايا السرطانية استجابتها لتحفيز HER-27. يرجع هذا التأثير المتناقض للجسم المضاد إلى السمية الخلوية المعتمدة على الأجسام المضادة (ADCC)7. يمكن التوسط في ADCC بواسطة الخلايا القاتلة الطبيعية (NK) والخلايا المحببة والبلاعم المعروفة مجتمعة باسم الخلايا المستجيبة ل ADCC 8,9. إذا ارتبط جسم مضاد ، مثل تراستوزوماب ، بالخلايا السرطانية ، فإن هذه الخلايا المستجيبة تستخدم مستقبلات Fc الخاصة بها لربط المنطقة الثابتة (Fc) من الجسم المضاد. يربط الجسم المضاد الخلايا السرطانية والخلايا المستجيبة الحاملة للمستقبلات Fc ، مما يؤدي إلى إطلاق وسطاءها السامةللخلايا 10. تطلق الخلايا القاتلة الطبيعية الشحنة السامة للخلايا من حبيباتها التي تحتوي على البيرفورين لتوليد المسام في غشاء الخلية المستهدف والجرانزيم (مما يؤدي إلى مسارات إشارات موت الخلايا) في المشبك المناعي مما يؤدي إلى موت الخلايا المبرمج للخلايا السرطانية (انظر الشكل 1).
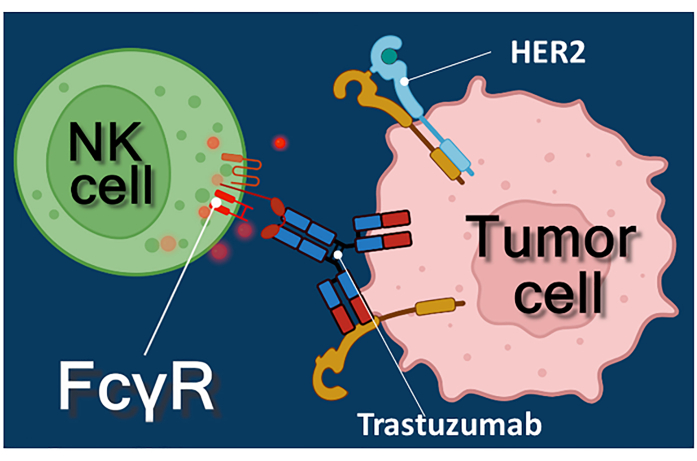
الشكل 1: تفاعلات المستجيب والخلية المستهدفة في ADCC . يتعرف مستقبل Fcγ لسطح الخلية لخلية NK المستجيبة على منطقة Fc للجسم المضاد ل HER2 trastuzumab المحدد لجزيء HER2 المعبر عنه على سطح الخلية السرطانية. وهكذا ، يتم إنشاء ما يسمى المشبك المناعي بين الخليتين ، مما يؤدي إلى الإخراج الموجه للحبيبات السامة للخلايا في الخلية المستجيبة. تؤدي جزيئات البيرفورين والجرانزيم المنبعثة في النهاية إلى موت الخلايا المبرمج للخلية المستهدفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم تطوير العديد من المقايسات سابقا لتحديد السمية الخلوية ، بما في ذلك ADCC. المعيار الذهبي هو طريقة إطلاق الكروم المشع ، حيث يتم تمييز الخلايا المستهدفة بنظير 51Cr المشع ، ويتم قياس ADCC عن طريق قياس النشاط الإشعاعي من طافية الخلايا المستهدفة المحللة11. بسبب المشاكل الواضحة بسبب المعالجة الصارمة للأدوية والنفايات المشعة وتخزينها والتخلص منها ، أصبحت هذه الطريقة غير شائعة بشكل متزايد بين علماء الحياة. بالإضافة إلى ذلك ، فهي غير قابلة للتطبيقات عالية الإنتاجية أيضا. يمكن أن يوفر قياس نشاط الإنزيمات (على سبيل المثال ، نازعة هيدروجين اللاكتات) المنبعثة من الخلايا المستهدفة المقتولة بديلا غير مشع لمقايسة 51Cr12. ومع ذلك ، تفشل هذه المقايسات في التمييز بين موت الخلايا المستهدفة والمستجيبة. أثبت استشعار مقاومة الخلايا الكهربائية (ECIS) أنه مناسب للقياس الكمي ل ADCC13 ، لكن معدات ECIS غير متوفرة في معظم المختبرات ، والتقنية غير متوافقة مع التطبيقات / الفحص عالي الإنتاجية. تمثل الخلايا ذات العلامات الفلورية بديلا شائعا في العديد من فحوصات بيولوجيا الخلية وغالبا ما تستخدم في قياس التدفق الخلوي أو التطبيقات القائمة على قارئ الألواح14،15،16. ومع ذلك ، غالبا ما تحتوي هذه المقايسات على خطوات غسيل أو لا تتوافق مع التطبيقات عالية الإنتاجية (على سبيل المثال ، التقنيات القائمة على قياس التدفق الخلوي). تفشل بعض مقايسات السمية الخلوية الشائعة ، والتي يجب أن تكون مناسبة من الناحية النظرية للقياس الكمي ل ADCC ، في تحديد كفاءة ADCC بشكل موثوق13. في الآونة الأخيرة ، مع انتشار المجهر الفلوري متحد البؤر ، أصبحت المقايسات القائمة على الصور والمحتوى العالي شائعة بشكل متزايد في مختلف مجالات علوم الحياة17. من ناحية ، أصبحت معدات التصوير الخلوي الآن في كل مكان ، بينما ، من ناحية أخرى ، يمكن جمع المعلمات المورفولوجية التي لا نهاية لها تقريبا من الصور المكتسبة. لذلك ، شرعنا في تطوير فحص ADCC متوافق مع فحص المحتوى العالي وإثبات ملاءمته لفحص المكتبة المركبة.
هنا ، نقدم مقايسة ADCC القائمة على الصور ونوضح كيف يمكن استخدام هذا الاختبار لفحص المحتوى العالي (HCS) لتحديد مركبات تعديل ADCC. يعتمد النموذج على الخلايا المستهدفة لسرطان الثدي JIMT-1 ، والخلايا المستجيبة CD16.176V.NK-92 والجسم المضاد أحادي النسيلة المضاد ل HER2 تراستوزوماب. باستخدام هذه الطريقة ، من الممكن تحديد الأدوية التي يمكن أن تعزز عمل قتل الورم للخلايا القاتلة الطبيعية أو الحصول على نظرة ثاقبة لآلية ADCC بوساطة الخلايا القاتلة الطبيعية من خلال تحديد الجزيئات الصغيرة التي تتداخل مع ADCC. نقترح أن علماء الحياة الذين يهدفون إلى قياس السمية الخلوية بوساطة الخلايا مع إيلاء اهتمام خاص ل ADCC قد يستفيدون من استخدام هذا الاختبار إما لعلم الاكتشاف أو تطوير الأدوية. قد يكون هذا الاختبار بديلا إذا كان لدى المختبر إمكانية الوصول إلى بعض الخبرة في التصوير الفلوري وتحليل الصور الكمية.
Protocol
ملاحظة: يتم عرض الخطوات الرئيسية لسير عمل الفحص في الشكل 2.
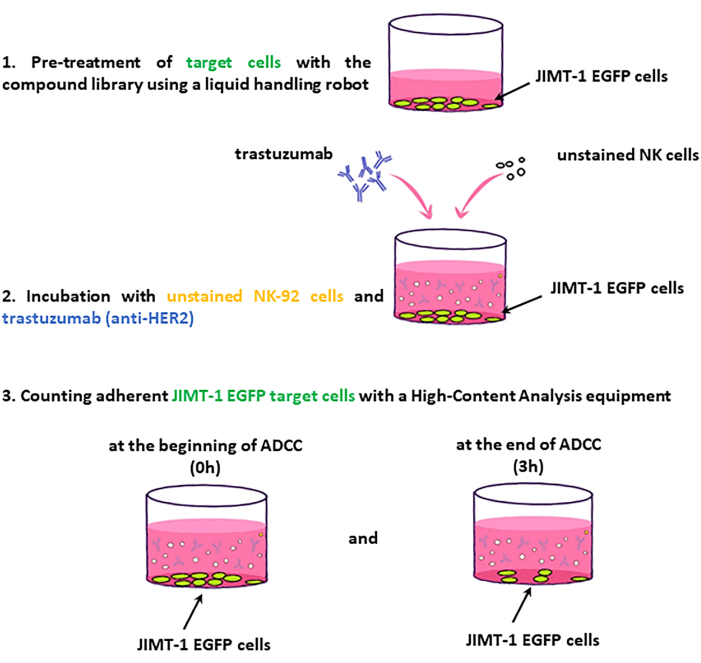
الشكل 2: سير عمل شاشة ADCC. يتم التعامل مع الخلايا المستهدفة JIMT-1-EGFP المصنفة في 96 لوحة HCS جيدا بأدوية مكتبة المركب. في المقابل ، تتم إضافة خلايا NK (المستجيب) غير الملوثة و trastuzumab ، ويتم تصوير اللوحة عند نقطة زمنية 0 وبعد 3 ساعات من الحضانة. يعتمد تقييم ADCC على التغيير في عدد الخلايا المستهدفة القابلة للحياة (الملتصقة بالسطح). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. طلاء لوحة HCS
- قم بتغطية 96 لوحة فحص عالية المحتوى (HSC) بمتوسط JIMT-1 50 ميكرولتر / بئر (وسط DMEM / F-12 مكمل بمصل بقري جنيني بنسبة 20٪ (FBS) ، 0.3 وحدة / مل أنسولين (100 وحدة دولية / مل ، Humulin R ، و 1٪ بنسلين - ستربتومايسين).
- ضع اللوحة في حاضنة CO2 لمدة 1 ساعة.
ملاحظة: الطلاء أمر بالغ الأهمية لربط خلايا JIMT-1 بالسطح الزجاجي للوحة.
2. بذر خلايا البروتين الفلوري الأخضر المحسن JIMT-1 (EGFP)
ملاحظة: تم إنشاء خلايا JIMT-1 المعبرة عن EGFP في عملنا السابق18 ، وتم استزراع الخلايا في قوارير زراعة الأنسجة T25 في وسائط JIMT-1 (انظر التكوين في الخطوة 1.1).
- اغسل الخلايا ب 2 مل من برنامج تلفزيوني معقم.
- أضف 1 مل من التربسين-EDTA إلى القارورة وضع القارورة مرة أخرى في حاضنة CO2 لمدة 10 دقائق.
- بعد الحضانة ، انقر فوق القارورة للتحقق مما إذا كانت خلايا JIMT-1 منفصلة.
- أوقف عملية الهضم باستخدام 2 مل من وسائط JIMT-1 واجمع تعليق الخلية في أنبوب سعة 15 مل.
- عد الخلايا التي تحتوي على 0.4٪ تريبان أزرق (80 ميكرولتر من الصبغة + 20 ميكرولتر من تعليق الخلية) في غرفة بوركر واضبط رقم الخلية على 133،000 خلية / مل.
- نضح وسط الطلاء من لوحة البئر 96 (الخطوة 1.2).
- ماصة 75 ميكرولتر من تعليق الخلية لكل بئر من ألواح HCS (انظر جدول المواد).
- اسمح للخلايا بالالتصاق أثناء الحضانة الليلية عند 37 درجة مئوية في حاضنة CO2 .
3. المعالجة المسبقة لخلايا JIMT-1 EGFP مع المكتبة المركبة
- نضح الوسط من خلايا JIMT-1 وأضف 50 ميكرولتر / وسيط JIMT-1 طازج جيدا إلى الآبار. انقل اللوحة إلى مختبر الفحص عالي الإنتاجية.
ملاحظة: استخدام روبوت معالجة السوائل يجعل إضافة المكتبات المركبة أكثر كفاءة وقابلية للتكرار. - انقل مركبات الاختبار من لوحة المكتبة المركبة إلى لوحة الفحص باستخدام أداة دبوس تمت معايرتها إلى حجم 25 nL. أداء هذا أربع مرات. أربع جولات من النقل تعطي حجما نهائيا يبلغ 100 نانولتر (وتركيز نهائي 20 ميكرومتر).
- بين كل خطوة ، اغسل أداة الدبوس ، أولا باستخدام 50٪ DMSO ثم باستخدام 70٪ من الإيثانول.
- احتضان الألواح لمدة 1 ساعة في حاضنة CO2 عند 37 درجة مئوية.
4. بدء مقايسة ADCC عن طريق إضافة خلايا المستجيب
ملاحظة: تم استزراع خلايا CD16.176V.NK92 (المشار إليها فيما يلي باسم خلايا NK92) في α-MEM مع 20٪ FBS و 1٪ MEM-NEAA و 1٪ Na-pyruvate و 1٪ جلوتامين و 1٪ بنسلين - ستربتومايسين و 100 وحدة دولية / مل IL-2.
- عد خلايا NK92 مع تريبان الأزرق (80 ميكرولتر من الصبغة + 20 ميكرولتر من تعليق الخلية). اضبط رقم الخلية على 400000 خلية / مل.
- جهاز طرد مركزي 4 مل من تعليق الخلية عند 150 × جم لمدة 3 دقائق في درجة حرارة الغرفة.
- قم بإعداد وسط ADCC عن طريق إضافة 20 ميكروغرام / مل من الجسم المضاد ل HER2 (تراستوزوماب) إلى وسط JIMT-1.
- أعد تعليق حبيبات الخلايا القاتلة الطبيعية في وسط ADCC سعة 5 مل.
- ماصة 20000 خلية NK في 50 ميكرولتر من وسط ADCC إلى خلايا JIMT-1 المستهدفة. الحجم النهائي هو 100 ميكرولتر ، وتركيز تراستوزوماب النهائي هو 10 ميكروغرام / مل.
- ضع لوحة الفحص في معدات تحليل المحتوى العالي مع حاضنة مدمجة عند 37 درجة مئوية.
5. التصوير
ملاحظة: يجب تصوير اللوحات في نقطتين زمنيتين ، أولا ، مباشرة بعد إضافة الخلايا المستجيبة إلى الخلايا المستهدفة والثانية ، عند 3 ساعات بعد إضافة الخلايا القاتلة الطبيعية. للتصوير ، يمكن استخدام محلل المحتوى العالي وبرامجه أو البدائل المناسبة (انظر جدول المواد).
- حدد نوع اللوحة (حامل خلية 96 بئرا فائق) من قائمة اللوحات.
- حدد التركيز البؤري التلقائي لذروتين إذا تم إجراء الفحص في لوحات.
- استخدم هدف 10x في الوضع غير البؤري.
- حدد Binning 2 لمضاعفة نسبة الإشارة إلى الضوضاء.
- التقط صورا ساطعة عند 650-760 نانومتر وصور فلورية لخلايا JIMT-1 المحولة بواسطة EGFP عند أطوال موجية 488 نانومتر (إثارة) و 500-550 نانومتر (انبعاث).
- حدد عدد الحقول وعدد النقاط الزمنية للتصوير.
6. تحليل الصور
ملاحظة: لتحليل كفاءة ADCC ، يتم حساب خلايا JIMT-1 القابلة للحياة. تنفصل الخلايا المستهدفة التي قتلها ADCC عن السطح وتبتعد عن المستوى البؤري للمجهر. لذلك ، فإن الفرق بين عدد الخلايا القابلة للحياة في بداية ونهاية تفاعل ADCC يتوافق مع الخلايا المستهدفة التي تم التخلص منها بواسطة ADCC. لإظهار كيفية إنشاء تسلسل التقييم ، يتم عرض بئر ADCC للتحكم في الفيديو.
- استخدم الوحدة النمطية البحث عن الخلايا للكشف عن المناطق في الصورة التي تتوافق مع الخلايا .
ملاحظة: يتم الكشف عن كل خلية كمنطقة على الصورة ذات كثافة مضان أعلى من محيطها. - حدد الخلايا باستخدام خوارزمية M المدمجة بقطر لا يقل عن 80 ميكرومتر.
- اضبط حساسية التقسيم ، التي تطرد جسما كبيرا إلى كائنات أصغر ، على 0.5.
- اضبط الحد المشترك (أدنى مستوى لكثافة البكسل) على 0.
- استبعد اكتشاف منطقة الخلفية ذات الكثافة الفلورية العالية EGFP في خطوتين.
- أولا، استخدم الدالة حساب خصائص الكثافة لتحديد شدة مضان EGFP في منطقة الخلايا المحددة مسبقا.
- قم بتعيين الحد الأدنى والحد الأقصى للكثافة باستخدام خيار تحديد المحتوى .
النتائج
لتوضيح كيفية عمل الفحص في الحياة الواقعية ، أنشأنا مكتبة اختبار من 16 مركبا تم اختيارها عشوائيا من أرفف المختبر (الشكل 3). بالإضافة إلى ذلك ، تم تضمين DMSO أيضا كعنصر تحكم سلبي ، وثلاثة مركبات مثبطة لبلمرة الأنابيب الدقيقة (كولشيسين ، فينكريستين ، وبودوفيلوتوكسين) كضوابط إيجاب...
Discussion
تم وصف رد فعل ADCC منذ وقت طويل نسبيا. كما تم وصف الأحداث الجزيئية الرئيسية للعملية19. تتراوح طرق قياس ADCC من مقايسة إطلاق الكروم المشع القياسي الذهبي ، ومقايسات إطلاق الإنزيم السيتوبلازمي إلى العديد من قياس التدفق الخلوي القائم على التألق أو مقايسات الصفائح الدقيقة20
Disclosures
لم يبلغ المؤلفون عن أي تضارب في المصالح.
Acknowledgements
تلقت LV تمويلا من منح المكتب الوطني للبحث والتطوير والابتكار GINOP-2.3.2-15-2016-00010 TUMORDNS "، GINOP-2.3.2-15-2016-00048-STAYALIVE و OTKA K132193 ، K147482. تم الحصول على خلايا CD16.176V.NK-92 من الدكتور كيري س. كامبل (مركز فوكس تشيس ، فيلابدلفيا ، بنسلفانيا ، نيابة عن برينك بيولوجيكس ، lnc. San Diego، CA) ، محمية ببراءات اختراع في جميع أنحاء العالم ، وتم ترخيصها من قبل Nantkwest، lnc. يعرب المؤلفون عن امتنانهم لجيورجي فيرب وأرباد زوور لمساعدتهم في استخدام خط الخلايا NK-92 وعلى المشورة الفنية.
Materials
| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
References
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved