Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
High-Content-Screening-Assay zur Identifizierung von Antikörper-abhängigen zellulären Zytotoxizitäts-modifizierenden Verbindungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine automatisierte, bildbasierte Hochdurchsatztechnik vor, um Verbindungen zu identifizieren, die die natürliche Killerzell-vermittelte Abtötung von Brustkrebszellen in Gegenwart eines therapeutischen Anti-HER2-Antikörpers modulieren.
Zusammenfassung
Die Immuntherapie mit antigenspezifischen Antikörpern oder Immun-Checkpoint-Inhibitoren hat die Therapie von Brustkrebs revolutioniert. Brustkrebszellen, die den epidermalen Wachstumsfaktorrezeptor HER2 exprimieren, können mit dem Anti-HER2-Antikörper Trastuzumab angegriffen werden. Die Antikörper-abhängige zelluläre Zytotoxizität (ADCC) ist ein wichtiger Mechanismus, der an der Antitumorwirkung von HER2 beteiligt ist. Trastuzumab, das an Krebszellen gebunden ist, kann von den Fc-Rezeptoren von ADCC-Effektorzellen (z. B. natürlichen Killerzellen, Makrophagen und Granulozyten) erkannt werden, wodurch die zytotoxische Aktivität dieser Immunzellen ausgelöst wird, die zum Tod von Krebszellen führt. Wir haben uns zum Ziel gesetzt, einen bildbasierten Assay für die Quantifizierung von ADCC zu entwickeln, um neuartige ADCC-Modulatorverbindungen durch High-Content-Screening zu identifizieren. In dem Assay werden HER2-überexprimierende JIMT-1-Brustkrebszellen mit NK-92-Zellen in Gegenwart von Trastuzumab kokultiviert, und der Zielzelltod wird durch automatisierte Mikroskopie und quantitative Bildanalyse quantifiziert. Zielzellen werden anhand ihrer EGFP-Fluoreszenz von Effektorzellen unterschieden. Wir zeigen, wie Substanzbibliotheken im Assay getestet werden können, um ADCC-Modulatoren zu identifizieren. Zu diesem Zweck wurde eine Compound-Library-Testplatte mit zufällig ausgewählten Feinchemikalien aus dem Laborregal aufgebaut. Drei Mikrotubuli-destabilisierende Verbindungen (Colchicin, Vincristin, Podophyllotoxin), von denen angenommen wird, dass sie die Migration und Degranulation von NK-Zellen stören, wurden ebenfalls in die Testbibliothek aufgenommen. Das Testscreening identifizierte alle drei Positivkontrollverbindungen als Treffer, was die Eignung der Methode zur Identifizierung von ADCC-modifizierenden Medikamenten in einer chemischen Bibliothek belegt. Mit diesem Assay können Substanzbibliotheks-Screenings durchgeführt werden, um ADCC-verstärkende Verbindungen zu identifizieren, die als adjuvante Therapeutika für die Behandlung von Patienten verwendet werden könnten, die Krebsimmuntherapien erhalten. Darüber hinaus können mit der Methode auch unerwünschte ADCC-hemmende Nebenwirkungen von Therapeutika identifiziert werden, die von Krebspatienten für verschiedene Indikationen eingenommen werden.
Einleitung
Die Immuntherapie mit Antikrebsantikörpern, Immun-Checkpoint-Inhibitoren oder chimären Antigenrezeptor-exprimierenden T (CAR-T)-Zellen stellt einen wirksamen Ansatz zur Krebsbehandlung dar 1,2,3. Trastuzumab ist ein humanisierter monoklonaler Anti-HER2-Antikörper (humaner epidermaler Wachstumsfaktor-Rezeptor 2), der zur Behandlung von HER2-positivem Brustkrebs im Frühstadium oder metastasierendem Brustkrebs sowie HER2-positivem metastasierendem Magenkrebs eingesetzt wird 4,5,6. Es wirkt in erster Linie, indem es die proliferationsstimulierende Wirkung des epidermalen Wachstumsfaktors4 hemmt. Es wurde jedoch berichtet, dass Trastuzumab den Tod von Krebszellen effizient auslöst, selbst wenn die Krebszellen nicht mehr auf die HER2-Stimulation ansprechen7. Diese paradoxe Wirkung des Antikörpers ist auf die Antikörper-abhängige zellvermittelte Zytotoxizität (ADCC) zurückzuführen7. ADCC kann durch natürliche Killerzellen (NK-Zellen), Granulozyten und Makrophagen vermittelt werden, die zusammen als Effektorzellen von ADCC 8,9 bekannt sind. Bindet ein Antikörper wie Trastuzumab an Tumorzellen, dann binden diese Effektorzellen über ihre Fc-Rezeptoren an die konstante (Fc) Region des Antikörpers. Der Antikörper überbrückt die Tumorzellen und die Fc-Rezeptor-tragenden Effektorzellen und löst die Freisetzung ihrer zytotoxischen Mediatorenaus 10. Natürliche Killerzellen setzen die zytotoxische Fracht ihrer perforinhaltigen Granula frei, um Poren in der Zielzellmembran und Granzym (das Signalwege für den Zelltod auslöst) in die Immunsynapse zu erzeugen, was zur Apoptose der Krebszellen führt (siehe Abbildung 1).
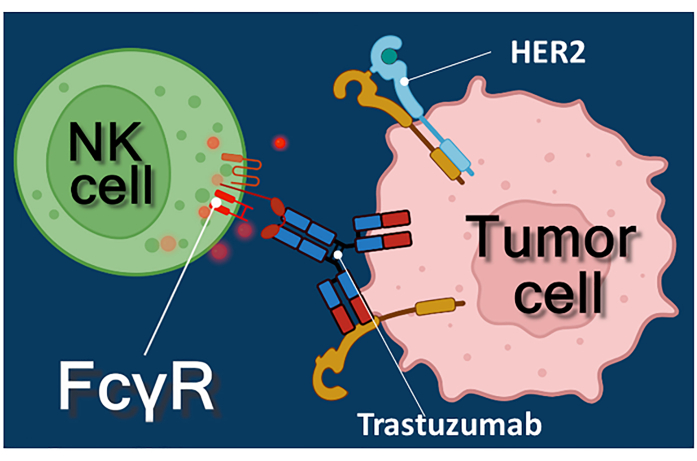
Abbildung 1: Effektor- und Zielzellinteraktionen im ADCC. Der Fcγ-Rezeptor der Effektor-NK-Zelle auf der Zelloberfläche erkennt die Fc-Region des Anti-HER2-Trastuzumab-Antikörpers, der spezifisch für das auf der Oberfläche der Tumorzelle exprimierte HER2-Molekül ist. So entsteht zwischen den beiden Zellen die sogenannte immunologische Synapse, die die gerichtete Exozytose zytotoxischer Granula der Effektorzelle induziert. Die freigesetzten Perforin- und Granzym-Moleküle führen schließlich zur Apoptose der Zielzelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Zur Quantifizierung der Zytotoxizität wurden bereits mehrere Assays entwickelt, darunter ADCC. Der Goldstandard ist die Methode zur Freisetzung von radioaktivem Chrom, bei der die Zielzellen mit radioaktivem 51Cr-Isotop markiert werden und ADCC durch Messung der Radioaktivität aus dem Überstand lysierter Zielzellenquantifiziert wird 11. Aufgrund der offensichtlichen Probleme, die sich aus der streng reglementierten Handhabung, Lagerung und Entsorgung von radioaktiven Pharmakonen und Abfällen ergeben, ist diese Methode unter Biowissenschaftlern zunehmend unbeliebt geworden. Darüber hinaus ist es auch nicht für Anwendungen mit hohem Durchsatz geeignet. Die Messung der Aktivität von Enzymen (z. B. Laktat-Dehydrogenase), die aus den abgetöteten Zielzellen freigesetzt werden, kann eine nicht-radioaktive Alternative zum 51-Cr-Assaydarstellen 12. Diese Assays unterscheiden jedoch nicht zwischen Ziel- und Effektorzelltod. Die elektrische Zellsubstrat-Impedanzmessung (ECIS) erwies sich als geeignet für die Quantifizierung von ADCC13, aber die ECIS-Geräte sind in den meisten Labors nicht verfügbar, und die Technik ist nicht mit Hochdurchsatzanwendungen/Screening kompatibel. Fluoreszenzmarkierte Zellen stellen eine beliebte Alternative in vielen zellbiologischen Assays dar und werden häufig in der Durchflusszytometrie oder in Plate-Reader-basierten Anwendungen verwendet14,15,16. Diese Assays enthalten jedoch häufig Waschschritte oder sind anderweitig nicht mit Hochdurchsatzanwendungen (z. B. Durchflusszytometrie-basierte Techniken) kompatibel. Einige gängige Zytotoxizitätsassays, die theoretisch für die ADCC-Quantifizierung geeignet sein sollten, sind nicht in der Lage, die ADCC-Effizienz zuverlässig zu bestimmen13. In jüngster Zeit werden mit der Verbreitung der konfokalen Fluoreszenzmikroskopie bildbasierte High-Content-Assays in verschiedenen Bereichen der Biowissenschaften immer beliebter17. Auf der einen Seite sind Zellbildgebungsgeräte mittlerweile ziemlich allgegenwärtig, auf der anderen Seite lassen sich aus den aufgenommenen Bildern praktisch unendlich viele morphologische Parameter ableiten. Daher haben wir uns zum Ziel gesetzt, einen High-Content-Screening-kompatiblen ADCC-Assay zu entwickeln und seine Eignung für das Screening von Substanzbibliotheken zu demonstrieren.
Hier stellen wir einen bildbasierten ADCC-Assay vor und zeigen, wie dieser Assay für das High-Content-Screening (HCS) verwendet werden kann, um ADCC-modulierende Verbindungen zu identifizieren. Das Modell basiert auf JIMT-1 Mammakarzinom-Zielzellen, CD16.176V.NK-92 Effektorzellen und dem humanisierten monoklonalen Anti-HER2-Antikörper Trastuzumab. Mit dieser Methode ist es möglich, Medikamente zu identifizieren, die die tumorabtötende Wirkung von NK-Zellen verstärken können, oder Einblicke in den Mechanismus der NZ-Zell-vermittelten ADCC zu gewinnen, indem kleine Moleküle identifiziert werden, die die ADCC stören. Wir schlagen vor, dass Biowissenschaftler, die die zellvermittelte Zytotoxizität unter besonderer Berücksichtigung von ADCC quantifizieren wollen, von der Verwendung dieses Assays entweder für die Entdeckungswissenschaft oder die Arzneimittelentwicklung profitieren könnten. Dieser Assay kann eine Alternative sein, wenn ein Labor Zugang zu und Erfahrung in der Fluoreszenzbildgebung und quantitativen Bildanalyse hat.
Protokoll
HINWEIS: Die wichtigsten Schritte des Assay-Workflows sind in Abbildung 2 dargestellt.
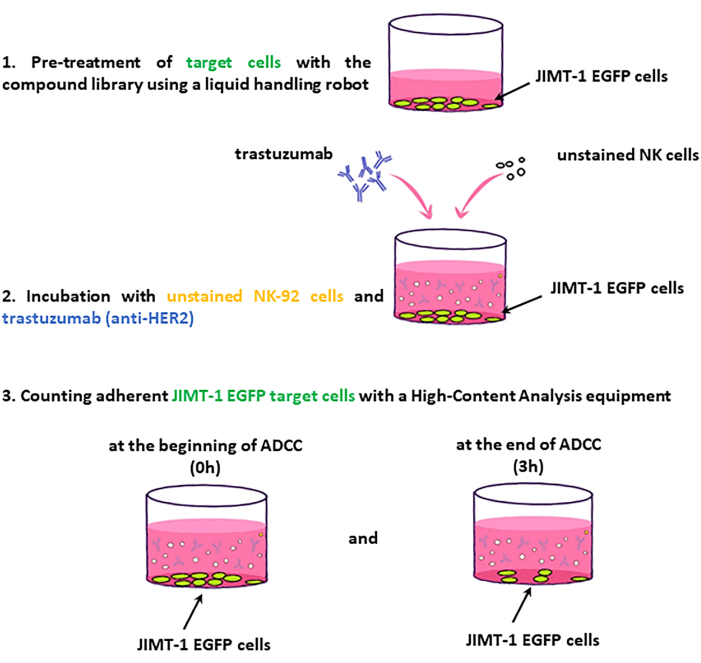
Abbildung 2: Workflow des ADCC-Bildschirms. JIMT-1-EGFP-Zielzellen, die in 96 Well-HCS-Platten ausgesät wurden, werden mit Medikamenten aus der Substanzbibliothek behandelt. Im Gegenzug werden ungefärbte NK-Zellen (Effektorzellen) und Trastuzumab hinzugefügt, und die Platte wird zum Zeitpunkt 0 und nach 3 Stunden Inkubation abgebildet. Die ADCC-Bewertung basiert auf der Veränderung der Anzahl der lebensfähigen (oberflächenadhärenten) Zielzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
1. Beschichtung der HCS-Platte
- Beschichten Sie die 96-Well-High-Content-Screening-Platten (HSC) mit 50 μl/well JIMT-1-Medium (DMEM/F-12-Medium, ergänzt mit 20 % fetalem Kälberserum (FBS), 0,3 U/ml Insulin (100 I.E./ml, Humulin R und 1 % Penicillin-Streptomycin).
- Stellen Sie die Platte für 1 h in einen CO2 - Inkubator.
Anmerkungen: Die Beschichtung ist entscheidend für die Befestigung von JIMT-1-Zellen an der Glasoberfläche der Platte.
2. Aussaat von JIMT-1 Enhanced Green Fluorescent Protein (EGFP) Zellen
ANMERKUNG: EGFP-exprimierende JIMT-1-Zellen wurden in unserer früheren Arbeit18 erzeugt, und die Zellen wurden in T25-Gewebekulturflaschen in JIMT-1-Medien kultiviert (siehe Zusammensetzung in Schritt 1.1).
- Waschen Sie die Zellen mit 2 ml sterilem PBS.
- Geben Sie 1 ml Trypsin-EDTA in den Kolben und stellen Sie den Kolben wieder für 10 Minuten in einen CO2 -Inkubator.
- Klopfen Sie nach der Inkubation auf den Kolben, um zu prüfen, ob sich JIMT-1-Zellen abgelöst haben.
- Stoppen Sie den Aufschluss mit 2 ml JIMT-1-Medien und sammeln Sie die Zellsuspension in einem 15-ml-Röhrchen.
- Zählen Sie die Zellen mit 0,4% Trypanblau (80 μL des Farbstoffs + 20 μL der Zellsuspension) in einer Bürker-Kammer und stellen Sie die Zellzahl auf 133.000 Zellen/ml ein.
- Saugen Sie das Beschichtungsmedium von der 96-Well-Platte ab (Schritt 1.2).
- Pipettieren Sie 75 μl der Zellsuspension in jede Vertiefung der HCS-Platten (siehe Materialtabelle).
- Lassen Sie die Zellen während einer nächtlichen Inkubation bei 37 °C in einem CO2 - Inkubator anhaften.
3. Vorbehandlung von JIMT-1 EGFP-Zellen mit der Substanzbibliothek
- Aspirieren Sie das Medium aus den JIMT-1-Zellen und geben Sie 50 μl frisches JIMT-1-Medium in die Wells. Übergeben Sie die Platte an das Hochdurchsatz-Screening-Labor.
HINWEIS: Die Verwendung eines Liquid-Handling-Roboters macht das Hinzufügen von Compound-Bibliotheken effizienter und reproduzierbarer. - Übertragen Sie die Testverbindungen mit einem auf ein Volumen von 25 nL kalibrierten Stiftwerkzeug von der Platte der Substanzbibliothek auf die Assay-Platte. Führen Sie dies viermal durch. Vier Transferrunden ergeben ein Endvolumen von 100 nL (und eine Endkonzentration von 20 μM).
- Waschen Sie das Stiftwerkzeug zwischen jedem Schritt zuerst mit 50 % DMSO und dann mit 70 % Ethanol.
- Inkubieren Sie die Platten für 1 h in einem CO2 - Inkubator bei 37 °C.
4. Starten des ADCC-Assays durch Hinzufügen der Effektorzellen
ANMERKUNG: CD16.176V.NK92-Zellen (im Folgenden als NK92-Zellen bezeichnet) wurden in α-MEM kultiviert, das mit 20 % FBS, 1 % MEM-NEAA, 1 % Na-Pyruvat, 1 % Glutamin, 1 % Penicillin-Streptomycin und 100 IU/ml IL-2 ergänzt wurde.
- Zählen Sie NK92-Zellen mit Trypanblau (80 μl des Farbstoffs + 20 μl der Zellsuspension). Stellen Sie die Zellzahl auf 400.000 Zellen/ml ein.
- Zentrifugieren Sie 4 ml der Zellsuspension bei 150 x g für 3 min bei Raumtemperatur.
- Bereiten Sie das ADCC-Medium vor, indem Sie dem JIMT-1-Medium 20 μg/ml Anti-HER2-Antikörper (Trastuzumab) hinzufügen.
- Resuspendieren Sie das NK-Zellpellet in 5 ml ADCC-Medium.
- Pipettieren Sie 20.000 NK-Zellen in 50 μl ADCC-Medium auf die JIMT-1-Zielzellen. Das Endvolumen beträgt 100 μl und die endgültige Trastuzumab-Konzentration 10 μg/ml.
- Setzen Sie die Testplatte in das High-Content-Analysegerät mit integriertem Inkubator ein, das auf 37 °C eingestellt ist.
5. Bildgebung
HINWEIS: Die Platten sollten zu zwei Zeitpunkten abgebildet werden, erstens unmittelbar nach der Zugabe der Effektorzellen zu den Zielzellen und zweitens 3 h nach der Zugabe von NK-Zellen. Für die Bildgebung können der High-Content-Analyzer und seine Software oder geeignete Alternativen verwendet werden (siehe Materialtabelle).
- Wählen Sie Plattentyp (96-Well-Zellträger ultra) aus der Liste der Platten aus.
- Wählen Sie den Zwei-Peak-Autofokus , wenn der Assay in Platten durchgeführt wird.
- Verwenden Sie ein 10-fach-Objektiv im nicht-konfokalen Modus.
- Wählen Sie Binning 2 , um das Signal-Rausch-Verhältnis zu verdoppeln.
- Nehmen Sie Hellfeldbilder bei 650-760 nm und Fluoreszenzbilder der EGFP-transduzierten JIMT-1-Zellen bei 488 nm (Anregung) und 500-550 nm (Emission) Wellenlängen auf.
- Wählen Sie die Anzahl der Felder und die Anzahl der Zeitpunkte für das Imaging aus.
6. Bildanalyse
HINWEIS: Um die ADCC-Effizienz zu analysieren, werden die lebensfähigen JIMT-1-Zellen gezählt. Zielzellen, die durch ADCC abgetötet werden, lösen sich von der Oberfläche und bewegen sich von der Fokusebene des Mikroskops weg. Daher entspricht die Differenz zwischen der Anzahl der lebensfähigen Zellen zu Beginn und am Ende der ADCC-Reaktion den Zielzellen, die durch ADCC eliminiert werden. Um zu zeigen, wie die Auswertesequenz aufgebaut wird, wird im Video ein Kontroll-ADCC-Bohrloch gezeigt.
- Verwenden Sie das Modul Zellen suchen , um Bereiche im Bild zu erkennen, die Zellen entsprechen.
HINWEIS: Jede Zelle wird als ein Bereich auf dem Bild mit einer höheren Fluoreszenzintensität als ihre Umgebung erkannt. - Wählen Sie Zellen mit dem integrierten M-Algorithmus mit einem Durchmesser von mindestens 80 μm aus.
- Legen Sie die Aufteilungsempfindlichkeit, mit der ein großes Objekt in kleinere Objekte aufgeteilt wird, auf 0,5 fest.
- Legen Sie den allgemeinen Schwellenwert (die niedrigste Stufe der Pixelintensität) auf 0 fest.
- Schließen Sie die Detektion von Hintergrundflächen mit hoher EGFP-Fluoreszenzintensität in zwei Schritten aus.
- Verwenden Sie zunächst die Funktion Intensitätseigenschaften berechnen , um die EGFP-Fluoreszenzintensität im zuvor ausgewählten Zellbereich zu bestimmen.
- Legen Sie den minimalen und maximalen Intensitätsschwellenwert mit der Option Population auswählen fest.
Ergebnisse
Um zu demonstrieren, wie der Assay in der Praxis funktioniert, haben wir eine Testbibliothek mit 16 Verbindungen erstellt, die nach dem Zufallsprinzip aus den Laborregalen ausgewählt wurden (Abbildung 3). Darüber hinaus wurde DMSO als Negativkontrolle und drei Mikrotubuli-Polymerisationshemmerverbindungen (Colchicin, Vincristin und Podophyllotoxin) als Positivkontrollen eingeschlossen. Letztere sollten ADCC hemmen, indem sie die Migration von NK-Zellen zu den Krebszellen und die Degranulat...
Diskussion
Die ADCC-Reaktion wurde schon vor relativ langer Zeit beschrieben. Wichtige molekulare Ereignisse des Prozesses wurden ebenfalls beschrieben19. Die Methoden zur Messung der ADCC reichen vom Goldstandard für den Assay zur Freisetzung von radioaktivem Chrom über zytoplasmatische Enzymfreisetzungsassays bis hin zu verschiedenen fluoreszenzbasierten Durchflusszytometrie- oder Mikrotiterplatten-Assays20. Eine häufige Einschränkung dieser Assays besteht jedoch darin, dass sie...
Offenlegungen
Die Autoren berichten über keinen Interessenkonflikt.
Danksagungen
LV erhielt Mittel aus den Zuschüssen des Nationalen Forschungs-, Entwicklungs- und Innovationsamtes GINOP-2.3.2-15-2016-00010 TUMORDNS", GINOP-2.3.2-15-2016-00048-STAYALIVE und OTKA K132193, K147482. CD16.176V.NK-92-Zellen wurden von Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, im Auftrag von Brink Biologics, lnc. San Diego, CA), sind weltweit durch Patente geschützt und wurden von Nantkwest, lnc, lizenziert. Die Autoren danken György Vereb und Árpád Szöőr für ihre Hilfe bei der Verwendung der NK-92-Zelllinie und für die technische Beratung.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Referenzen
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten