È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Test di screening ad alto contenuto per l'identificazione di composti modificanti la citotossicità cellulare anticorpo-dipendenti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo presenta una tecnica automatizzata ad alto rendimento basata su immagini per identificare i composti che modulano l'uccisione delle cellule di cancro al seno mediate da cellule natural killer in presenza di un anticorpo terapeutico anti-HER-2.
Abstract
L'immunoterapia con anticorpi antigene-specifici o inibitori del checkpoint immunitario ha rivoluzionato la terapia del cancro al seno. Le cellule del cancro al seno che esprimono il recettore del fattore di crescita epidermico HER2 possono essere prese di mira dall'anticorpo anti-HER-2 trastuzumab. La citotossicità cellulare anticorpo-dipendente (ADCC) è un importante meccanismo implicato nell'azione antitumorale di HER-2. Trastuzumab legato alle cellule tumorali può essere riconosciuto dai recettori Fc delle cellule effettrici ADCC (ad esempio, cellule natural killer (NK), macrofagi e granulociti), innescando l'attività citotossica di queste cellule immunitarie che portano alla morte delle cellule tumorali. Abbiamo deciso di sviluppare un saggio basato su immagini per la quantificazione dell'ADCC per identificare nuovi composti modulatori ADCC mediante screening ad alto contenuto. Nel test, le cellule di carcinoma mammario JIMT-1 che sovraesprimono HER2 sono co-coltivate con cellule NK-92 in presenza di trastuzumab e la morte delle cellule bersaglio viene quantificata mediante microscopia automatizzata e analisi quantitativa delle immagini. Le cellule bersaglio si distinguono dalle cellule effettrici in base alla loro fluorescenza EGFP. Mostriamo come le librerie di composti possono essere testate nel test per identificare i farmaci modulatori ADCC. A tale scopo, è stata allestita una piastra di prova per librerie composte utilizzando prodotti chimici fini selezionati a caso dallo scaffale del laboratorio. Nella libreria di test sono stati inclusi anche tre composti destabilizzanti per microtubuli (colchicina, vincristina, podofillotossina) che dovrebbero interferire con la migrazione e la degranulazione delle cellule NK. Lo screening del test ha identificato tutti e tre i composti di controllo positivi come risultati che dimostrano l'idoneità del metodo per identificare i farmaci modificanti l'ADCC in una libreria chimica. Con questo test, è possibile eseguire screening della libreria di composti per identificare composti che potenziano l'ADCC che potrebbero essere utilizzati come agenti terapeutici adiuvanti per il trattamento di pazienti sottoposti a immunoterapie antitumorali. Inoltre, il metodo può anche essere utilizzato per identificare eventuali effetti collaterali indesiderati che inibiscono l'ADCC dei farmaci terapeutici assunti dai pazienti oncologici per diverse indicazioni.
Introduzione
L'immunoterapia con anticorpi antitumorali, inibitori del checkpoint immunitario o cellule T (CAR-T) che esprimono il recettore dell'antigene chimerico rappresenta un potente approccio al trattamento del cancro 1,2,3. Trastuzumab è un anticorpo monoclonale umanizzato anti-HER-2 (recettore 2 del fattore di crescita epidermico umano) utilizzato per il trattamento del carcinoma mammario HER-2 positivo allo stadio iniziale o metastatico, nonché del carcinoma gastrico metastatico HER-2 positivo 4,5,6. Agisce principalmente inibendo l'effetto stimolante della proliferazione del fattore di crescita epidermico4. È stato riportato, tuttavia, che trastuzumab innesca efficacemente la morte delle cellule tumorali anche se le cellule tumorali hanno perso la loro reattività alla stimolazione di HER-27. Questo effetto paradossale dell'anticorpo è dovuto alla citotossicità cellulo-mediata anticorpo-dipendente (ADCC)7. L'ADCC può essere mediato da cellule natural killer (NK), granulociti e macrofagi noti collettivamente come cellule effettrici di ADCC 8,9. Se un anticorpo, come trastuzumab, si lega alle cellule tumorali, allora queste cellule effettrici usano i loro recettori Fc per legare la regione costante (Fc) dell'anticorpo. L'anticorpo collega le cellule tumorali e le cellule effettrici portatrici del recettore Fc, innescando il rilascio dei loro mediatori citotossici10. Le cellule natural killer rilasciano il carico citotossico dei loro granuli contenenti perforina per generare pori nella membrana cellulare bersaglio e granzima (innescando le vie di segnalazione della morte cellulare) nella sinapsi immunitaria che porta all'apoptosi delle cellule tumorali (vedi Figura 1).
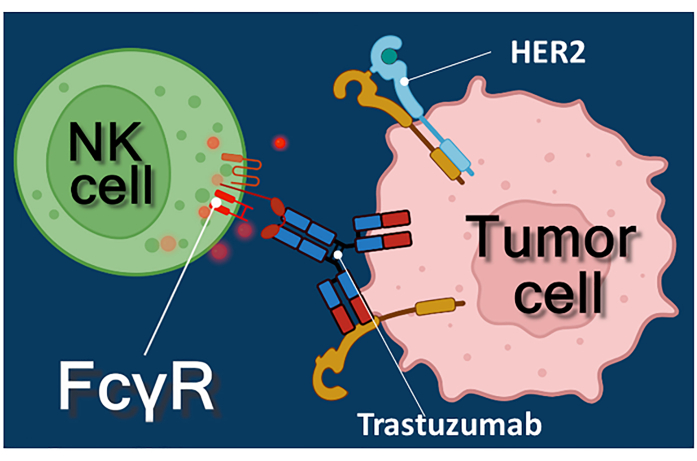
Figura 1: Interazioni effettore e cellula bersaglio nell'ADCC. Il recettore Fcγ della superficie cellulare della cellula effettrice NK riconosce la regione Fc dell'anticorpo anti-HER2 trastuzumab specifico per la molecola HER2 espressa sulla superficie della cellula tumorale. Pertanto, la cosiddetta sinapsi immunologica si stabilisce tra le due cellule, inducendo l'esocitosi diretta dei granuli citotossici della cellula effettrice. Le molecole di perforina e granzima rilasciate alla fine provocano l'apoptosi della cellula bersaglio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Diversi saggi sono stati precedentemente sviluppati per quantificare la citotossicità, incluso l'ADCC. Il gold standard è il metodo di rilascio del cromo radioattivo, in cui le cellule bersaglio sono etichettate con isotopo radioattivo 51Cr e l'ADCC è quantificato misurando la radioattività dal surnatante delle cellule bersaglio lisate11. A causa degli ovvi problemi dovuti alla manipolazione, allo stoccaggio e allo smaltimento strettamente regolamentati di farmaci e rifiuti radioattivi, questo metodo è diventato sempre meno popolare tra gli scienziati della vita. Inoltre, non è nemmeno suscettibile di applicazioni ad alta produttività. La misurazione dell'attività degli enzimi (ad esempio, lattato-deidrogenasi) rilasciati dalle cellule bersaglio uccise può fornire un'alternativa non radioattiva al test 51Cr12. Questi test, tuttavia, non riescono a distinguere tra morte delle cellule bersaglio e cellule effettrici. L'Electric Cell-substrate Impedance Sensing (ECIS) si è dimostrato adatto per la quantificazione dell'ADCC13, ma l'apparecchiatura ECIS non è disponibile nella maggior parte dei laboratori e la tecnica non è compatibile con applicazioni/screening ad alto rendimento. Le cellule marcate con fluorescenza rappresentano un'alternativa popolare in molti saggi di biologia cellulare e sono spesso utilizzate nella citometria a flusso o nelle applicazioni basate su lettori di piastre14,15,16. Tuttavia, questi test spesso contengono fasi di lavaggio o sono altrimenti incompatibili con applicazioni ad alta produttività (ad esempio, tecniche basate sulla citometria a flusso). Alcuni test di citotossicità popolari, che in teoria dovrebbero essere adatti per la quantificazione dell'ADCC, non riescono a determinare in modo affidabile l'efficienza dell'ADCC13. Recentemente, con la diffusione della microscopia confocale fluorescente, i saggi basati su immagini e ad alto contenuto stanno diventando sempre più popolari in vari settori delle scienze della vita17. Da un lato, le apparecchiature di imaging cellulare sono ora piuttosto onnipresenti, mentre, d'altra parte, i parametri morfologici virtualmente infiniti possono essere raccolti dalle immagini acquisite. Pertanto, abbiamo deciso di sviluppare un test ADCC compatibile con lo screening ad alto contenuto e di dimostrare la sua idoneità per lo screening delle librerie composte.
Qui, presentiamo un test ADCC basato su immagini e dimostriamo come questo test può essere utilizzato per lo screening ad alto contenuto (HCS) per identificare i composti modulanti ADCC. Il modello si basa sulle cellule bersaglio del carcinoma mammario JIMT-1, sulle cellule effettrici CD16.176V.NK-92 e sull'anticorpo monoclonale umanizzato anti-HER2 trastuzumab. Con questo metodo, è possibile identificare farmaci che possono migliorare l'azione di uccisione del tumore delle cellule NK o ottenere informazioni sul meccanismo dell'ADCC mediato dalle cellule NK identificando piccole molecole che interferiscono con l'ADCC. Suggeriamo che gli scienziati della vita che mirano a quantificare la citotossicità cellulo-mediata con particolare riguardo all'ADCC possono trarre beneficio dall'uso di questo test sia per la scienza della scoperta che per lo sviluppo di farmaci. Questo test può essere un'alternativa se un laboratorio ha accesso e una certa esperienza nell'imaging fluorescente e nell'analisi quantitativa delle immagini.
Protocollo
NOTA: i passaggi chiave del flusso di lavoro del test sono presentati nella Figura 2.
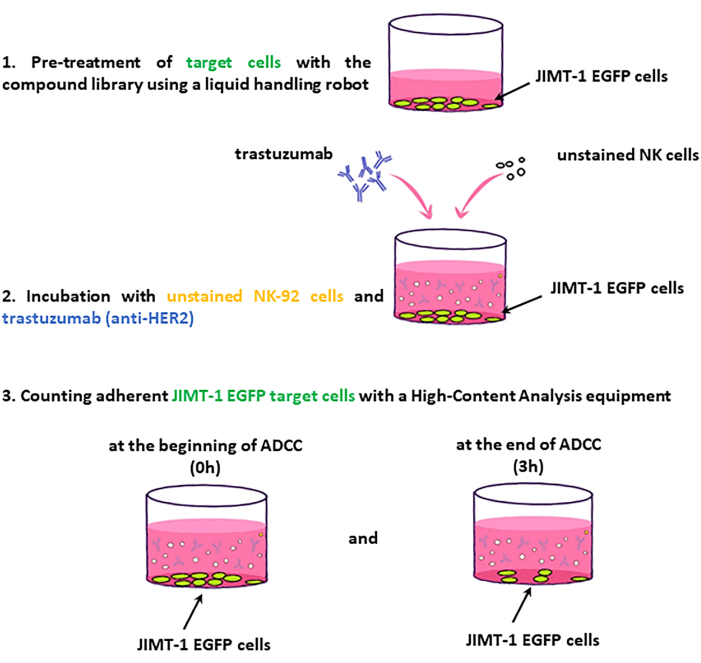
Figura 2: Flusso di lavoro della schermata ADCC. Le cellule bersaglio JIMT-1-EGFP seminate in 96 piastre HCS sono trattate con farmaci della libreria composta. A loro volta, vengono aggiunte cellule NK (effettrici) non colorate e trastuzumab e la piastra viene ripresa a 0 timepoint e dopo 3 ore di incubazione. La valutazione dell'ADCC si basa sulla variazione del numero di cellule bersaglio vitali (aderenti alla superficie). Fare clic qui per visualizzare una versione ingrandita di questa figura.
1. Rivestimento della piastra HCS
- Rivestire le piastre di screening ad alto contenuto (HSC) a 96 pozzetti con terreno JIMT-1 da 50 μL/pozzetto (terreno DMEM/F-12 integrato con siero bovino fetale al 20% (FBS), insulina 0,3 U/mL (100 UI/ml, Humulin R e 1% penicillina-streptomicina).
- Posizionare la piastra in un incubatore di CO2 per 1 ora.
NOTA: Il rivestimento è fondamentale per attaccare le celle JIMT-1 alla superficie di vetro della piastra.
2. Semina di cellule JIMT-1 Enhanced Green Fluorescent Protein (EGFP)
NOTA: Le cellule JIMT-1 che esprimono EGFP sono state generate nel nostro precedente lavoro18 e le cellule sono state coltivate in flaconi di coltura tissutale T25 in terreni JIMT-1 (vedere la composizione nel passaggio 1.1).
- Lavare le cellule con 2 ml di PBS sterile.
- Aggiungere 1 mL di tripsina-EDTA al matraccio e rimetterlo in un incubatore di CO2 per 10 minuti.
- Dopo l'incubazione, toccare il pallone per verificare se le cellule JIMT-1 sono staccate.
- Interrompere la digestione con 2 mL di mezzi JIMT-1 e raccogliere la sospensione cellulare in un tubo da 15 ml.
- Contare le cellule con 0,4% di blu tripano (80 μL del colorante + 20 μL della sospensione cellulare) in una camera Bürker e regolare il numero di cellule a 133.000 cellule / ml.
- Aspirare il mezzo di rivestimento dalla piastra a 96 pozzetti (passo 1.2).
- Pipettare 75 μL della sospensione cellulare su ciascun pozzetto delle piastre HCS (vedere Tabella dei materiali).
- Consentire alle cellule di attaccarsi durante un'incubazione notturna a 37 °C in un incubatore a CO2 .
3. Pretrattamento delle cellule JIMT-1 EGFP con la libreria di composti
- Aspirare il mezzo dalle cellule JIMT-1 e aggiungere 50 μL/pozzetto di terreno JIMT-1 fresco ai pozzetti. Trasferire la piastra al laboratorio di screening ad alta produttività.
NOTA: L'utilizzo di un robot per la gestione dei liquidi rende l'aggiunta di librerie di composti più efficiente e riproducibile. - Trasferire i composti in esame dalla piastra di libreria del composto alla piastra di analisi con uno strumento a perno calibrato su un volume di 25 nL. Esegui questa operazione quattro volte. Quattro cicli di trasferimento danno un volume finale di 100 nL (e una concentrazione finale di 20 μM).
- Tra un passaggio e l'altro, lavare lo strumento perno, prima con il 50% di DMSO e poi con il 70% di etanolo.
- Incubare le piastre per 1 ora in un incubatore a CO2 a 37 °C.
4. Avvio del test ADCC aggiungendo le cellule effettrici
NOTA: Le cellule CD16.176V.NK92 (di seguito denominate cellule NK92) sono state coltivate in α-MEM integrate con 20% FBS, 1% MEM-NEAA, 1% Na-piruvato, 1% glutammina, 1% penicillina-streptomicina e 100 UI/mL IL-2.
- Contare le cellule NK92 con blu tripano (80 μL del colorante + 20 μL della sospensione cellulare). Regolare il numero di celle a 400.000 celle/ml.
- Centrifugare 4 mL della sospensione cellulare a 150 x g per 3 minuti a temperatura ambiente.
- Preparare il mezzo ADCC aggiungendo 20 μg/mL di anticorpo anti-HER2 (trastuzumab) al mezzo JIMT-1.
- Risospendere il pellet della cella NK in 5 mL di terreno ADCC.
- Pipettare 20.000 cellule NK in 50 μL di terreno ADCC fino alle cellule JIMT-1 target. Il volume finale è di 100 μL e la concentrazione finale di trastuzumab è di 10 μg/ml.
- Posizionare la piastra di analisi nell'apparecchiatura di analisi ad alto contenuto con un incubatore incorporato impostato a 37 °C.
5. Imaging
NOTA: Le lastre devono essere visualizzate in due punti temporali, in primo luogo, immediatamente dopo l'aggiunta delle cellule effettrici alle cellule bersaglio e in secondo luogo, a 3 ore dopo l'aggiunta di cellule NK. Per l'imaging, è possibile utilizzare l'analizzatore ad alto contenuto e il suo software o alternative adeguate (vedi Tabella dei materiali).
- Selezionare Tipo di piastra (96-well cell carrier ultra) dall'elenco delle piastre.
- Selezionare l'autofocus a due picchi se il test viene eseguito in lastre.
- Usa l'obiettivo 10x in modalità non confocale.
- Selezionare Binning 2 per raddoppiare il rapporto segnale/rumore.
- Immagini in campo chiaro a 650-760 nm e immagini fluorescenti delle celle JIMT-1 trasdotte da EGFP a lunghezze d'onda di 488 nm (eccitazione) e 500-550 nm (emissione).
- Selezionare il numero di campi e il numero di punti temporali per l'imaging.
6. Analisi delle immagini
NOTA: Per analizzare l'efficienza dell'ADCC, vengono contate le cellule JIMT-1 vitali. Le cellule bersaglio uccise dall'ADCC si staccano dalla superficie e si allontanano dal piano focale del microscopio. Pertanto, la differenza tra il numero di cellule vitali all'inizio e alla fine della reazione ADCC corrisponde alle cellule bersaglio eliminate dall'ADCC. Per mostrare come costruire la sequenza di valutazione, nel video viene mostrato un pozzetto ADCC di controllo.
- Utilizzare il modulo Trova celle per rilevare le regioni dell'immagine corrispondenti alle celle.
NOTA: Ogni cellula viene rilevata come una regione dell'immagine con un'intensità di fluorescenza superiore rispetto all'ambiente circostante. - Selezionare le celle utilizzando l'algoritmo M integrato con un diametro minimo di 80 μm.
- Impostate Sensibilità di divisione, che suddivide un oggetto di grandi dimensioni in oggetti più piccoli, su 0.5.
- Imposta la soglia comune (il livello più basso di intensità dei pixel) su 0.
- Escludere il rilevamento dell'area di fondo con alta intensità di fluorescenza EGFP in due fasi.
- Innanzitutto, utilizzare la funzione Calcola proprietà intensità per determinare l'intensità di fluorescenza EGFP nella regione Celle selezionata in precedenza.
- Impostare la soglia di intensità minima e massima utilizzando l'opzione Seleziona popolazione .
Risultati
Per dimostrare come funziona il test nella vita reale, abbiamo creato una libreria di test di 16 composti selezionati casualmente dagli scaffali di laboratorio (Figura 3). Inoltre, il DMSO è stato incluso anche come controllo negativo e tre composti inibitori della polimerizzazione dei microtubuli (colchicina, vincristina e podofillotossina) come controlli positivi. Ci si aspettava che questi ultimi inibissero l'ADCC interferendo con la migrazione delle cellule NK verso le cellule tumorali ...
Discussione
La reazione ADCC è stata descritta relativamente molto tempo fa. Sono stati descritti anche eventi molecolari chiave del processo19. I metodi per misurare l'ADCC vanno dal saggio di rilascio di cromo radioattivo gold standard, ai saggi di rilascio di enzimi citoplasmatici a diversi test di citometria a flusso o micropiastre basati sulla fluorescenza20. Tuttavia, una limitazione comune di questi test è che non sono suscettibili di applicazioni ad alta produttività. In pre...
Divulgazioni
Gli autori non segnalano alcun conflitto di interessi.
Riconoscimenti
LV ha ricevuto finanziamenti dall'Ufficio nazionale per la ricerca, lo sviluppo e l'innovazione sovvenzioni GINOP-2.3.2-15-2016-00010 TUMORDNS", GINOP-2.3.2-15-2016-00048-STAYALIVE e OTKA K132193, K147482. Le cellule CD16.176V.NK-92 sono state ottenute dal Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, per conto di Brink Biologics, lnc. San Diego, CA), sono protetti da brevetti in tutto il mondo e sono stati concessi in licenza da Nantkwest, lnc. Gli autori sono grati a György Vereb e Árpád Szöőr per il loro aiuto nell'uso della linea cellulare NK-92 e per i consigli tecnici.
Materiali
| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Riferimenti
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon