このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
抗体依存性細胞傷害修飾化合物の同定のためのハイコンテントスクリーニングアッセイ(英語)
* これらの著者は同等に貢献しました
要約
このプロトコルは、治療用抗HER-2抗体の存在下でナチュラルキラー細胞媒介性乳がん細胞死滅を調節する化合物を同定するための自動化された画像ベースのハイスループット技術を提示します。
要約
抗原特異的抗体または免疫チェックポイント阻害剤による免疫療法は、乳がんの治療に革命をもたらしました。上皮成長因子受容体HER2を発現する乳癌細胞は、抗HER-2抗体トラスツズマブによって標的とすることができる。抗体依存性細胞傷害(ADCC)は、HER-2の抗腫瘍作用に関与する重要なメカニズムです。がん細胞に結合したトラスツズマブは、ADCCエフェクター細胞(ナチュラルキラー(NK)細胞、マクロファージ、顆粒球など)のFc受容体によって認識され、これらの免疫細胞の細胞傷害活性を引き起こし、がん細胞死につながります。私たちは、ハイコンテントスクリーニングによって新規ADCCモジュレーター化合物を同定するために、ADCCを定量するための画像ベースのアッセイの開発に着手しました。本アッセイでは、HER2過剰発現JIMT-1乳癌細胞をトラスツズマブ存在下でNK-92細胞と共培養し、自動顕微鏡および定量画像解析により標的細胞死を定量します。標的細胞は、EGFP蛍光に基づいてエフェクター細胞と区別されます。ADCCモジュレーター薬を同定するために、アッセイで化合物ライブラリをテストする方法を示します。この目的のために、ラボの棚からランダムに選択されたファインケミカルを使用して、化合物ライブラリのテストプレートをセットアップしました。NK細胞の移動と脱顆粒を妨げると予想される3つの微小管不安定化化合物(コルヒチン、ビンクリスチン、ポドフィロトキシン)もテストライブラリに含まれていました。テストスクリーニングでは、3つのポジティブコントロール化合物すべてがヒットとして識別され、化学ライブラリ内のADCC修飾薬を同定するための方法の適合性が証明されました。このアッセイでは、化合物ライブラリースクリーニングを実施して、抗がん免疫療法を受けている患者の治療のための補助治療薬として使用できるADCC増強化合物を同定することができます。さらに、この方法は、異なる適応症のために癌患者によって服用された治療薬の望ましくないADCC阻害副作用を特定するためにも使用することができる。
概要
抗がん抗体、免疫チェックポイント阻害剤、またはキメラ抗原受容体発現T(CAR-T)細胞による免疫療法は、がん治療への強力なアプローチです1,2,3。トラスツズマブは、HER-2陽性の早期または転移性乳がん、ならびにHER-2陽性の転移性胃がんの治療に使用されるヒト化モノクローナル抗HER-2(ヒト上皮成長因子受容体2)抗体である4,5,6。主に上皮成長因子4の増殖刺激作用を阻害することにより作用する。しかし、トラスツズマブは、がん細胞がHER-2刺激に対する反応性を失っても、効率的にがん細胞死を引き起こすことが報告されています7。抗体のこの逆説的な効果は、抗体依存性細胞媒介性細胞傷害(ADCC)7によるものです。ADCCは、ADCCのエフェクター細胞と総称されるナチュラルキラー(NK)細胞、顆粒球、およびマクロファージによって媒介され得る8,9。トラスツズマブなどの抗体が腫瘍細胞に結合する場合、これらのエフェクター細胞はそれらのFc受容体を使用して抗体の定常(Fc)領域に結合します。抗体は、腫瘍細胞とFc受容体担持エフェクター細胞を架橋し、それらの細胞傷害性メディエクター10の放出を誘発する。ナチュラルキラー細胞は、パーフォリンを含む顆粒の細胞傷害性カーゴを放出して、標的細胞膜とグランザイム(細胞死シグナル伝達経路をトリガーする)に孔を生成し、免疫シナプスに働きかけ、がん細胞のアポトーシスを引き起こします(図1を参照)。
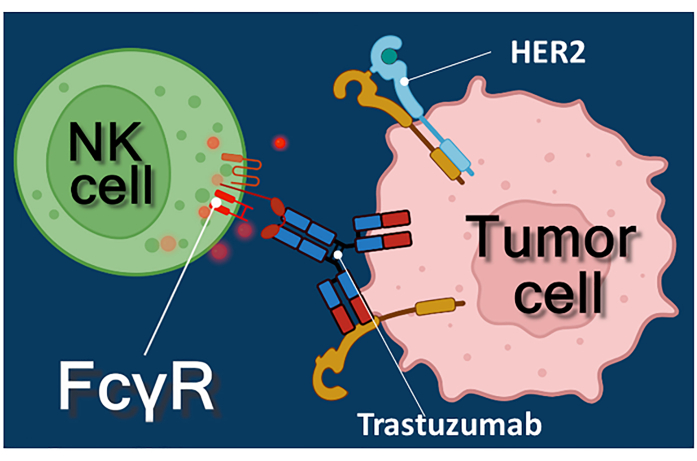
図1:ADCCにおけるエフェクターと標的細胞の相互作用。 エフェクターNK細胞の細胞表面Fcγレセプターは、腫瘍細胞の表面に発現しているHER2分子に特異的な抗HER2トラスツズマブ抗体のFc領域を認識する。したがって、いわゆる免疫学的シナプスが2つの細胞間に確立され、エフェクター細胞の細胞傷害性顆粒の指向性エキソサイトーシスを誘導する。放出されたパーフォリンおよびグランザイム分子は、最終的に標的細胞のアポトーシスをもたらす。 この図の拡大版を表示するには、ここをクリックしてください。
ADCCを含むいくつかのアッセイが細胞毒性を定量化するために以前に開発されている。ゴールドスタンダードは放射性クロム放出法であり、標的細胞を放射性51Cr同位体で標識し、溶解した標的細胞11の上清から放射能を測定することでADCCを定量する。放射性ファーモンおよび廃棄物の取り扱い、保管、および処分が厳しく規制されているため、この方法は生命科学者の間でますます人気がなくなりました。さらに、高スループットのアプリケーションにも適していません。死滅した標的細胞から放出される酵素(例えば、乳酸脱水素酵素)の活性を測定することは、51Crアッセイ12に代わる非放射性代替物を提供することができる。しかし、これらのアッセイでは、標的細胞死とエフェクター細胞死を区別できません。電気セル基板インピーダンスセンシング(ECIS)はADCC13の定量に適していることが証明されましたが、ECIS機器はほとんどのラボで利用できず、この手法はハイスループットアプリケーション/スクリーニングと互換性がありません。蛍光標識された細胞は、多くの細胞生物学アッセイで一般的な代替手段であり、フローサイトメトリーまたはプレートリーダーベースのアプリケーションでよく使用されます14、15、16。ただし、これらのアッセイには洗浄ステップが含まれていることが多く、ハイスループットアプリケーション(フローサイトメトリーベースの技術など)とは互換性がありません。理論的にはADCC定量に適しているはずのいくつかの一般的な細胞毒性アッセイは、ADCC効率を確実に決定することができません13。近年、蛍光共焦点顕微鏡の普及に伴い、画像ベースのハイコンテントアッセイがライフサイエンスの様々な分野でますます普及してきている17。一方では、細胞イメージング装置は現在かなりユビキタスですが、他方では、取得した画像から事実上無限の形態学的パラメータを収集することができます。そこで、ハイコンテントスクリーニング対応のADCCアッセイを開発し、化合物ライブラリースクリーニングへの適合性を実証することを目指しました。
ここでは、画像ベースのADCCアッセイを紹介し、このアッセイをハイコンテントスクリーニング(HCS)に使用してADCC調節化合物を同定する方法を示します。このモデルは、JIMT-1乳癌標的細胞、CD16.176V.NK-92エフェクター細胞、およびヒト化モノクローナル抗HER2抗体トラスツズマブに基づいています。この方法により、ADCCを妨害する低分子を同定することで、NK細胞の殺腫瘍作用を増強できる薬剤を同定したり、NK細胞を介したADCCのメカニズムを解明したりすることができます。ADCCに関して細胞媒介性細胞毒性の定量化を目指す生命科学者は、このアッセイを発見科学または医薬品開発のいずれかに使用することで恩恵を受ける可能性があることを示唆しています。このアッセイは、ラボが蛍光イメージングと定量画像分析にアクセスし、ある程度の経験がある場合の代替手段となる可能性があります。
プロトコル
注:アッセイワークフローの主要なステップを 図2に示します。
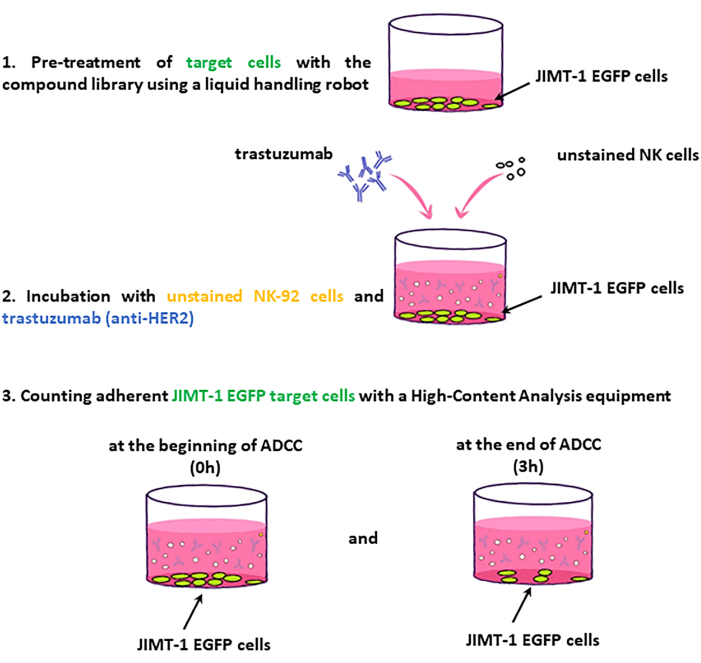
図2:ADCC画面のワークフロー。 JIMT-1-EGFP標的細胞を96穴HCSプレートに播種し、化合物ライブラリーの薬剤で処理する。次に、染色されていないNK(エフェクター)細胞およびトラスツズマブを添加し、プレートを0時点および3時間のインキュベーション後に画像化する。ADCC評価は、生存可能な(表面接着性の)標的細胞の数の変化に基づいている。 この図の拡大版を表示するには、ここをクリックしてください。
1. HCSプレートのコーティング
- 96ウェルハイコンテントスクリーニング(HSC)プレートを50 μL/ウェルJIMT-1培地(20%ウシ胎児血清(FBS)、0.3 U/mLインスリン(100 IU/mL、フムリンR、および1%ペニシリン-ストレプトマイシンを添加したDMEM/F-12培地)でコーティングします。
- プレートをCO2 インキュベーターに1時間入れます。
注:JIMT-1セルをプレートのガラス表面に取り付けるには、コーティングが重要です。
2. JIMT-1増強緑色蛍光タンパク質(EGFP)細胞の播種
注:EGFP発現JIMT-1細胞は、以前の研究18で生成し、細胞をJIMT-1培地中のT25組織培養フラスコで培養しました(ステップ1.1の組成を参照)。
- 2 mLの滅菌PBSで細胞を洗浄します。
- 1 mLのトリプシン-EDTAをフラスコに加え、フラスコをCO2 インキュベーターに10分間戻します。
- インキュベーション後、フラスコをタップしてJIMT-1細胞が剥離しているかどうかを確認します。
- 2 mLのJIMT-1培地で消化を停止し、細胞懸濁液を15 mLチューブに回収します。
- ビュルカーチャンバー内で0.4%トリパンブルー(80 μLの色素+ 20 μLの細胞懸濁液)で細胞をカウントし、細胞数を133, 000細胞/ mLに調整します。
- 96ウェルプレートからコーティング媒体を吸引します(ステップ1.2)。
- 75 μLの細胞懸濁液をHCSプレートの各ウェルにピペットで入れます( 材料の表を参照)。
- CO2インキュベーター内で37°Cで一晩インキュベーションしている間、細胞を付着させます。
3. 化合物ライブラリーによるJIMT-1 EGFP細胞の前処理
- JIMT-1細胞から培地を吸引し、50 μL/ウェルの新鮮なJIMT-1培地をウェルに加えます。プレートをハイスループットスクリーニングラボに移します。
注:リキッドハンドリングロボットを使用すると、化合物ライブラリの追加がより効率的かつ再現性高くなります。 - 25 nL容量に較正されたピンツールを用いて、化合物ライブラリープレートからアッセイプレートに試験化合物を移します。これを4回実行します。4回の移送により、最終容量は100 nL(および最終濃度は20 μM)になります。
- 各ステップの間に、最初に50%DMSOで、次に70%エタノールでピンツールを洗浄します。
- プレートを37°CのCO2 インキュベーターで1時間インキュベートします。
4. エフェクター細胞を添加してADCCアッセイを開始する
注:CD16.176V.NK92細胞(以下、NK92細胞と呼ぶ)は、20%FBS、1%MEM-NEAA、1%Na-ピルビン酸、1%グルタミン、1%ペニシリン-ストレプトマイシンおよび100IU/mL IL-2を添加したα-MEMで培養した。
- NK92細胞をトリパンブルー(80 μLの色素+ 20 μLの細胞懸濁液)でカウントします。細胞数を400,000細胞/mLに調整します。
- 4 mLの細胞懸濁液を150 x g で室温で3分間遠心分離します。
- JIMT-1培地に20 μg/mLの抗HER2抗体(トラスツズマブ)を添加してADCC培地を調製します。
- NK細胞ペレットを5 mL ADCC培地に再懸濁します。
- 50 μLのADCC培地中の20,000 NK細胞を標的JIMT-1細胞にピペットで移管します。最終容量は100μL、最終トラスツズマブ濃度は10μg/mLです。
- アッセイプレートを、37°Cに設定した内蔵インキュベーターを備えたハイコンテント分析装置に入れます。
5. イメージング
注:プレートは、1つ目は標的細胞へのエフェクター細胞添加直後、2つ目はNK細胞添加後3時間の2つの時点で画像化する必要があります。イメージングには、ハイコンテントアナライザーとそのソフトウェア、または適切な代替品を使用できます( 材料表を参照)。
- プレートのリストからプレートタイプ(96ウェルセルキャリアウルトラ)を選択します。
- アッセイがプレートで行われる場合は、 2つのピークオートフォーカス を選択します。
- 非共焦点モードで10倍対物レンズを使用します。
- ビニング2を選択して、信号対雑音比を2倍にします。
- 650-760 nmの明視野画像と、488 nm(励起)および500-550 nm(発光)の波長でEGFP形質導入JIMT-1細胞の蛍光画像を撮影します。
- イメージングのフィールド数とタイムポイント数を選択します。
6. 画像解析
注:ADCC効率を分析するために、生存可能なJIMT-1細胞がカウントされます。ADCCによって殺された標的細胞は表面から剥離し、顕微鏡の焦点面から離れます。したがって、ADCC反応の開始時と終了時の生細胞数の差は、ADCCによって排除される標的細胞に相当する。評価シーケンスの構築方法を示すために、コントロールADCCウェルがビデオに示されています。
- セルの検索モジュールを使用して、 セル に対応する画像上の領域を検出します。
注:各細胞は、周囲よりも蛍光強度が高い画像上の領域として検出されます。 - 組み込みの M アルゴリズムを使用して、直径80μm以上の細胞を選択します。
- 大きなオブジェクトを小さなオブジェクトに分割する [分割感度]を 0.5 に設定します。
- [共通しきい値] (ピクセル強度の最低レベル) を 0 に設定します。
- 2段階でEGFP蛍光強度の高いバックグラウンド領域の検出を除外します。
- まず、強度 プロパティの計算 機能を使用して、以前に選択した 細胞 領域のEGFP蛍光強度を決定します。
- [母集団の選択] オプションを使用して、最小強度と最大強度の閾値を設定します。
結果
アッセイが実際にどのように機能するかを示すために、ラボの棚からランダムに選択された16化合物のテストライブラリを作成しました(図3)。さらに、DMSOも陰性対照として、3つの微小管重合阻害剤化合物(コルヒチン、ビンクリスチン、およびポドフィロトキシン)を陽性対照として含めた。後者は、NK細胞のがん細胞への遊走やNK細胞の脱顆粒を妨害することでADCCを阻?...
ディスカッション
ADCC反応は比較的前に説明されています。プロセスの重要な分子イベントも記載されている19。ADCCを測定するための方法は、ゴールドスタンダードの放射性クロム放出アッセイ、細胞質酵素放出アッセイからいくつかの蛍光ベースのフローサイトメトリーまたはマイクロプレートアッセイにまで及ぶ20。ただし、これらのアッセイの一般的な制限は、ハイス?...
開示事項
著者らは利益相反を報告していない。
謝辞
LVは、国立研究開発イノベーションオフィスの助成金GINOP-2.3.2-15-2016-00010 TUMORDNS」、GINOP-2.3.2-15-2016-00048-STAYALIVEおよびOTKA K132193、K147482から資金提供を受けました。CD16.176V.NK-92細胞は、Dr. Kerry S. Campbell(Fox Chase Center, Philapedlphia, Pen, Brink Biologics, lnc.カリフォルニア州サンディエゴ)は、世界中の特許によって保護されており、nantkwest、lncによってライセンスされています。著者らは、NK-92細胞株の使用と技術的助言を提供してくれたGyörgy VerebとÁrpád Szöőrに感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
参考文献
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved