É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaio de Triagem de Alto Conteúdo para Identificação de Compostos Modificadores de Citotoxicidade Celular Dependente de Anticorpos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo apresenta uma técnica automatizada de alto rendimento baseada em imagem para identificar compostos que modulam a morte de células de câncer de mama mediadas por células natural killer na presença de um anticorpo terapêutico anti-HER-2.
Resumo
A imunoterapia com anticorpos antígeno-específicos ou inibidores de checkpoints imunológicos revolucionou a terapia do câncer de mama. Células de câncer de mama que expressam o receptor HER2 do fator de crescimento epidérmico podem ser alvo do anticorpo anti-HER-2 trastuzumabe. A citotoxicidade celular dependente de anticorpos (ADCC) é um importante mecanismo implicado na ação antitumoral do HER-2. O trastuzumabe ligado às células cancerosas pode ser reconhecido pelos receptores Fc das células efetoras do ADCC (por exemplo, células natural killer (NK), macrófagos e granulócitos), desencadeando a atividade citotóxica dessas células imunes levando à morte das células cancerígenas. Nós nos propusemos a desenvolver um ensaio baseado em imagem para a quantificação de ADCC para identificar novos compostos moduladores do ADCC por triagem de alto conteúdo. No ensaio, células de câncer de mama JIMT-1 superexpressando HER2 são co-cultivadas com células NK-92 na presença de trastuzumabe, e a morte da célula-alvo é quantificada por microscopia automatizada e análise quantitativa de imagens. As células-alvo distinguem-se das células efetoras com base em sua fluorescência EGFP. Mostramos como bibliotecas de compostos podem ser testadas no ensaio para identificar drogas moduladoras do ADCC. Para este propósito, uma placa de teste de biblioteca de compostos foi montada usando produtos químicos finos selecionados aleatoriamente fora da prateleira do laboratório. Três compostos desestabilizadores de microtúbulos (colchicina, vincristina, podofilotoxina) que devem interferir na migração e degranulação das células NK também foram incluídos na biblioteca de testes. A tela de teste identificou todos os três compostos de controle positivo como acertos que comprovam a adequação do método para identificar drogas modificadoras do ADCC em uma biblioteca química. Com este ensaio, telas de bibliotecas de compostos podem ser realizadas para identificar compostos que aumentam o ADCC que poderiam ser usados como agentes terapêuticos adjuvantes para o tratamento de pacientes recebendo imunoterapias anticâncer. Além disso, o método também pode ser usado para identificar quaisquer efeitos colaterais indesejáveis inibidores do ADCC de drogas terapêuticas tomadas por pacientes com câncer para diferentes indicações.
Introdução
A imunoterapia com anticorpos anticâncer, inibidores de checkpoints imunes ou células T (CAR-T) que expressam receptores de antígenos quiméricos representa uma abordagem poderosa para o tratamento do câncer 1,2,3. O trastuzumabe é um anticorpo monoclonal humanizado anti-HER-2 (human epidermal growth factor receptor 2) utilizado no tratamento do câncer de mama em estádio inicial ou metastático positivo para HER-2, bem como do câncer gástrico metastático positivo para HER-2 4,5,6. Atua principalmente inibindo o efeito estimulador da proliferação do fator de crescimento epidérmico4. Tem sido relatado, no entanto, que o trastuzumabe desencadeia eficientemente a morte de células cancerígenas, mesmo que as células cancerosas tenham perdido sua responsividade à estimulação de HER-27. Esse efeito paradoxal do anticorpo é devido à citotoxicidade mediada por células dependentes de anticorpos (ADCC)7. O ADCC pode ser mediado por células natural killer (NK), granulócitos e macrófagos conhecidos coletivamente como células efetoras do ADCC 8,9. Se um anticorpo, como o trastuzumabe, se liga às células tumorais, então essas células efetoras usam seus receptores Fc para se ligar à região constante (Fc) do anticorpo. O anticorpo faz a ponte entre as células tumorais e as células efetoras do receptor Fc, desencadeando a liberação de seus mediadores citotóxicos10. As células natural killer liberam a carga citotóxica de seus grânulos contendo perforina para gerar poros na membrana da célula-alvo e granzima (desencadeando vias de sinalização de morte celular) na sinapse imune levando à apoptose das células cancerosas (ver Figura 1).
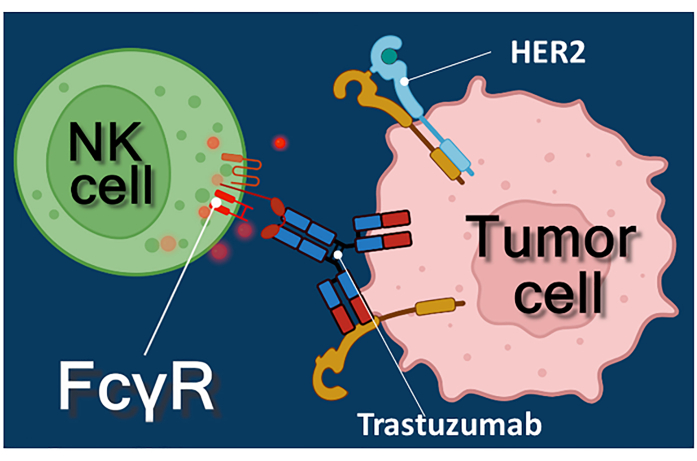
Figura 1: Interações entre efetor e célula-alvo no ADCC. O receptor Fcγ de superfície celular da célula NK efetora reconhece a região Fc do anticorpo anti-HER2 trastuzumabe específico para a molécula HER2 expressa na superfície da célula tumoral. Assim, a chamada sinapse imunológica se estabelece entre as duas células, induzindo a exocitose dirigida dos grânulos citotóxicos da célula efetora. As moléculas de perforina e granzima liberadas acabam resultando em apoptose da célula-alvo. Clique aqui para ver uma versão maior desta figura.
Vários ensaios foram previamente desenvolvidos para quantificar a citotoxicidade, incluindo o ADCC. O padrão-ouro é o método de liberação radioativa de cromo, onde as células-alvo são marcadas com o isótopo radioativo 51Cr, e o ADCC é quantificado pela medida da radioatividade do sobrenadante das células-alvo lisadas11. Devido aos problemas óbvios devido ao manuseio, armazenamento e descarte estritamente regulamentados de fármacos e resíduos radioativos, esse método tem se tornado cada vez mais popular entre os cientistas da vida. Além disso, também não é passível de aplicativos de alto rendimento. A medição da atividade de enzimas (por exemplo, lactato-desidrogenase) liberadas das células-alvo mortas pode fornecer uma alternativa não radioativa ao ensaio de 51Cr12. Esses ensaios, no entanto, não conseguem distinguir entre mortes celulares alvo e efetora. O Sensor de Impedância Célula-Substrato Elétrico (ECIS) mostrou-se adequado para a quantificação do ADCC13, mas o equipamento ECIS não está disponível na maioria dos laboratórios, e a técnica não é compatível com aplicações/triagem de alto rendimento. Células marcadas fluorescentemente representam uma alternativa popular em muitos ensaios de biologia celular e são frequentemente usadas em citometria de fluxo ou aplicações baseadas em leitores de placas14,15,16. No entanto, esses ensaios geralmente contêm etapas de lavagem ou são incompatíveis com aplicações de alto rendimento (por exemplo, técnicas baseadas em citometria de fluxo). Alguns ensaios populares de citotoxicidade, que teoricamente deveriam ser adequados para a quantificação do ADCC, falham em determinar de forma confiável a eficiência do ADCC13. Recentemente, com a disseminação da microscopia confocal fluorescente, ensaios baseados em imagens e de alto conteúdo estão se tornando cada vez mais populares em várias áreas das ciências da vida17. Por um lado, os equipamentos de imagem celular são agora bastante ubíquos, enquanto, por outro lado, parâmetros morfológicos virtualmente infinitos podem ser coletados a partir das imagens adquiridas. Portanto, nos propusemos a desenvolver um ensaio ADCC compatível com triagem de alto conteúdo e demonstrar sua adequação para triagem de bibliotecas compostas.
Aqui, apresentamos um ensaio ADCC baseado em imagem e demonstramos como este ensaio pode ser usado para triagem de alto conteúdo (HCS) para identificar compostos moduladores do ADCC. O modelo é baseado em células-alvo do carcinoma de mama JIMT-1, células efetoras CD16.176V.NK-92 e trastuzumabe monoclonal anticorpo anti-HER2 humanizado. Com esse método, é possível identificar drogas que possam aumentar a ação tumoral das células NK ou obter informações sobre o mecanismo do ADCC mediado por células NK através da identificação de pequenas moléculas que interferem com o ADCC. Sugerimos que cientistas da vida com o objetivo de quantificar a citotoxicidade mediada por células, com especial atenção ao ADCC, podem se beneficiar do uso deste ensaio tanto para a ciência da descoberta quanto para o desenvolvimento de fármacos. Este ensaio pode ser uma alternativa se um laboratório tiver acesso e alguma experiência em imagem fluorescente e análise quantitativa de imagens.
Protocolo
NOTA: As principais etapas do fluxo de trabalho de ensaio são apresentadas na Figura 2.
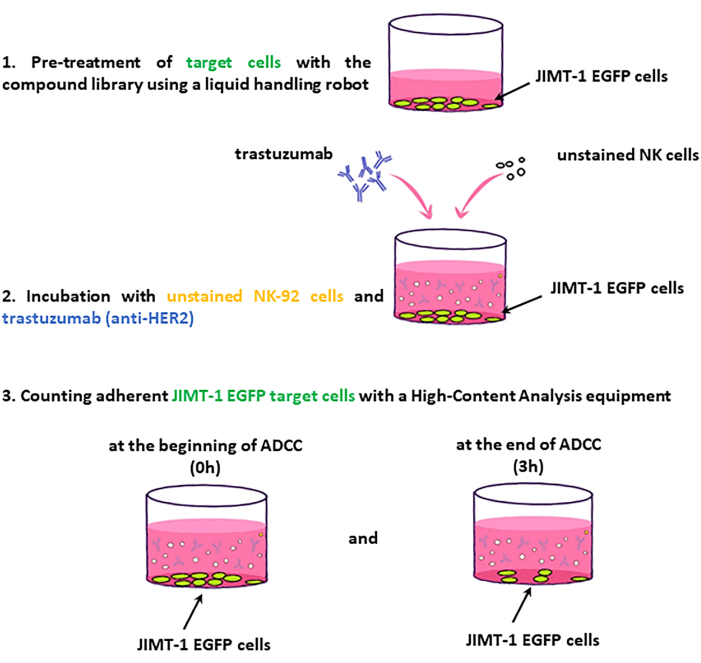
Figura 2: Fluxo de trabalho da tela do ADCC. As células-alvo do JIMT-1-EGFP semeadas em placas HCS de 96 poços são tratadas com drogas da biblioteca de compostos. Por sua vez, células NK (efetoras) não coradas e trastuzumabe são adicionados, e a placa é imageada em 0 momento e após 3 h de incubação. A avaliação do ADCC baseia-se na mudança no número de células-alvo viáveis (aderentes à superfície). Clique aqui para ver uma versão maior desta figura.
1. Revestimento da placa HCS
- Revestir as placas de triagem de alto conteúdo (HSC) de 96 poços com meio JIMT-1 de 50 μL/poço (meio DMEM/F-12 suplementado com 20% de soro fetal bovino (FBS), 0,3 U/mL de insulina (100 UI/mL, Humulin R e 1% de penicilina-estreptomicina).
- Coloque a placa em uma incubadora de CO2 por 1 h.
NOTA: O revestimento é crucial para fixar as células JIMT-1 à superfície de vidro da placa.
2. Semeadura de células JIMT-1 Enhanced Green Fluorescent Protein (EGFP)
NOTA: Células JIMT-1 expressando EGFP foram geradas em nosso trabalho anterior18, e as células foram cultivadas em frascos de cultura de tecido T25 em meio JIMT-1 (ver composição na etapa 1.1).
- Lavar as células com 2 mL de PBS estéril.
- Adicionar 1 ml de tripsina-EDTA ao balão e voltar a colocá-lo numa incubadora de CO2 durante 10 minutos.
- Após a incubação, toque no balão para verificar se as células JIMT-1 estão destacadas.
- Interromper a digestão com 2 ml de meio JIMT-1 e recolher a suspensão celular num tubo de 15 ml.
- Contar as células com azul de tripano a 0,4% (80 μL do corante + 20 μL da suspensão celular) em uma câmara de Bürker e ajustar o número de células para 133.000 células/mL.
- Aspirar o meio de revestimento da placa de 96 poços (passo 1.2).
- Pipetar 75 μL da suspensão celular para cada poço das placas HCS (ver Tabela de Materiais).
- Permitir que as células se liguem durante uma incubação noturna a 37 °C em uma incubadora de CO2 .
3. Pré-tratamento de células JIMT-1 EGFP com a biblioteca de compostos
- Aspirar o meio das células JIMT-1 e adicionar 50 μL/bem fresco meio JIMT-1 aos poços. Transfira a placa para o laboratório de triagem de alto rendimento.
NOTA: O uso de um robô de manuseio de líquidos torna a adição de bibliotecas de compostos mais eficiente e reproduzível. - Transfira os compostos de teste da placa de biblioteca de compostos para a placa de ensaio com uma ferramenta de pino calibrada para um volume de 25 nL. Execute isso quatro vezes. Quatro rodadas de transferência dão um volume final de 100 nL (e uma concentração final de 20 μM).
- Entre cada etapa, lave a ferramenta do pino, primeiro com DMSO 50% e depois com etanol 70%.
- Incubar as placas durante 1 h numa incubadora de CO2 a 37 °C.
4. Iniciar o ensaio ADCC adicionando as células efetoras
NOTA: Células CD16.176V.NK92 (doravante denominadas células NK92) foram cultivadas em α-MEM suplementado com 20% de SFB, 1% de MEM-NEAA, 1% de Na-piruvato, 1% de glutamina, 1% de penicilina-estreptomicina e 100 UI/mL de IL-2.
- Contar células NK92 com azul de tripano (80 μL do corante + 20 μL da suspensão celular). Ajuste o número de células para 400.000 células/mL.
- Centrifugar 4 mL da suspensão celular a 150 x g por 3 min à temperatura ambiente.
- Preparar o meio ADCC adicionando 20 μg/mL de anticorpo anti-HER2 (trastuzumabe) ao meio JIMT-1.
- Ressuspender o pellet de células NK em meio ADCC de 5 mL.
- Pipetar 20.000 células NK em 50 μL de meio ADCC para as células alvo JIMT-1. O volume final é de 100 μL e a concentração final de trastuzumabe é de 10 μg/mL.
- Coloque a placa de ensaio no equipamento de análise de alto teor com uma incubadora integrada regulada a 37 °C.
5. Exames por imagem
NOTA: As placas devem ser fotografadas em dois momentos, primeiro, imediatamente após a adição das células efetoras às células-alvo e segundo, em 3 h após a adição das células NK. Para geração de imagens, o analisador de alto conteúdo e seu software ou alternativas adequadas podem ser usados (consulte Tabela de materiais).
- Selecione Tipo de placa (ultra portador de célula de 96 poços) na lista de placas.
- Selecione o foco automático de dois picos se o ensaio for realizado em placas.
- Use a objetiva de 10x no modo não confocal.
- Selecione Binning 2 para dobrar a relação sinal/ruído.
- Tire imagens de campo brilhante a 650-760 nm e imagens fluorescentes das células JIMT-1 transduzidas por EGFP a comprimentos de onda de 488 nm (excitação) e 500-550 nm (emissão).
- Selecione o número de campos e o número de pontos de tempo para a geração de imagens.
6. Análise das imagens
NOTA: Para analisar a eficiência do ADCC, as células JIMT-1 viáveis são contadas. As células-alvo mortas pelo ADCC se desprendem da superfície e se afastam do plano focal do microscópio. Portanto, a diferença entre o número de células viáveis no início e no final da reação do ADCC corresponde às células-alvo eliminadas pelo ADCC. Para mostrar como construir a sequência de avaliação, um poço de controle ADCC é mostrado no vídeo.
- Use o módulo Localizar células para detectar regiões na imagem que correspondem às células .
NOTA: Cada célula é detectada como uma região na imagem com uma intensidade de fluorescência mais alta do que seu entorno. - Selecione células usando o algoritmo M embutido com um mínimo de 80 μm de diâmetro.
- Defina a sensibilidade de divisão, que divide um objeto grande em objetos menores, como 0,5.
- Defina o limite Comum (o nível mais baixo de intensidade de pixel) como 0.
- Exclua a detecção de área de fundo com alta intensidade de fluorescência EGFP em duas etapas.
- Primeiro, use a função Calcular propriedades de intensidade para determinar a intensidade de fluorescência EGFP na região Células selecionada anteriormente.
- Defina o limite de intensidade mínima e máxima usando a opção Selecionar população .
Resultados
Para demonstrar como o ensaio funciona na vida real, criamos uma biblioteca de testes de 16 compostos selecionados aleatoriamente das prateleiras do laboratório (Figura 3). Além disso, o DMSO também foi incluído como controle negativo e três compostos inibidores da polimerização de microtúbulos (colchicina, vincristina e podofilotoxina) como controles positivos. Esperava-se que estes últimos inibissem o ADCC, interferindo com a migração de células NK para as células cancerosas e...
Discussão
A reação do ADCC tem sido descrita há relativamente muito tempo. Eventos moleculares importantes do processo também foram descritos19. Os métodos de medição do ADCC vão desde o ensaio de liberação radioativa de cromo padrão-ouro, ensaios de liberação enzimática citoplasmática até vários ensaios de citometria de fluxo ou microplacas baseados em fluorescência20. No entanto, uma limitação comum desses ensaios é que eles não são passíveis de aplicativos ...
Divulgações
Os autores declaram a inexistência de conflitos de interesse.
Agradecimentos
LV recebeu financiamento do National Research, Development and Innovation Office grants GINOP-2.3.2-15-2016-00010 TUMORDNS", GINOP-2.3.2-15-2016-00048-STAYALIVE e OTKA K132193, K147482. As células CD16.176V.NK-92 foram obtidas do Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, em nome da Brink Biologics, lnc. San Diego, CA), são protegidos por patentes em todo o mundo, e foram licenciados pela Nantkwest, lnc. Os autores agradecem a György Vereb e Árpád Szöőr por sua ajuda com o uso da linha celular NK-92 e pelo aconselhamento técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Referências
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados