Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Antikor Bağımlı Hücresel Sitotoksisiteyi Modifiye Eden Bileşiklerin Tanımlanması için Yüksek İçerikli Tarama Testi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, terapötik bir anti-HER-2 antikoru varlığında doğal öldürücü hücre aracılı meme kanseri hücresi öldürmeyi modüle eden bileşikleri tanımlamak için otomatik, görüntü tabanlı yüksek verimli bir teknik sunar.
Özet
Antijene özgü antikorlar veya immün kontrol noktası inhibitörleri ile immünoterapi, meme kanseri tedavisinde devrim yaratmıştır. Epidermal büyüme faktörü reseptörü HER2'yi eksprese eden meme kanseri hücreleri, anti-HER-2 antikoru trastuzumab tarafından hedeflenebilir. Antikora bağımlı hücresel sitotoksisite (ADCC), HER-2'nin antitümör etkisinde rol oynayan önemli bir mekanizmadır. Kanser hücrelerine bağlı trastuzumab, ADCC efektör hücrelerinin (örneğin, doğal öldürücü (NK) hücreler, makrofajlar ve granülositler) Fc reseptörleri tarafından tanınabilir ve bu bağışıklık hücrelerinin sitotoksik aktivitesini tetikleyerek kanser hücresi ölümüne yol açar. Yüksek içerikli tarama ile yeni ADCC modülatör bileşiklerini tanımlamak için ADCC'nin nicelleştirilmesi için görüntü tabanlı bir tahlil geliştirmek üzere yola çıktık. Tahlilde, JIMT-1 meme kanseri hücrelerini aşırı eksprese eden HER2, trastuzumab varlığında NK-92 hücreleri ile birlikte kültürlenir ve hedef hücre ölümü otomatik mikroskopi ve kantitatif görüntü analizi ile ölçülür. Hedef hücreler, EGFP floresanlarına göre efektör hücrelerden ayırt edilir. ADCC modülatör ilaçlarını tanımlamak için bileşik kütüphanelerin tahlilde nasıl test edilebileceğini gösteriyoruz. Bu amaçla, laboratuvar rafından rastgele seçilmiş ince kimyasallar kullanılarak bir bileşik kütüphane test plakası kuruldu. NK hücre göçü ve degranülasyonuna müdahale etmesi beklenen üç mikrotübül destabilize edici bileşik (kolşisin, vinkristin, podofillotoksin) de test kütüphanesine dahil edildi. Test ekranı, üç pozitif kontrol bileşiğinin hepsini, kimyasal bir kütüphanede ADCC modifiye edici ilaçları tanımlamak için yöntemin uygunluğunu kanıtlayan isabetler olarak tanımladı. Bu tahlil ile, antikanser immünoterapileri alan hastaların tedavisinde adjuvan terapötik ajanlar olarak kullanılabilecek ADCC arttırıcı bileşikleri tanımlamak için bileşik kütüphane ekranları yapılabilir. Ek olarak, yöntem, kanser hastaları tarafından farklı endikasyonlar için alınan terapötik ilaçların istenmeyen ADCC inhibe edici yan etkilerini tanımlamak için de kullanılabilir.
Giriş
Antikanser antikorları, immün kontrol noktası inhibitörleri veya kimerik antijen reseptörü eksprese eden T (CAR-T) hücreleri ile immünoterapi, kanser tedavisine güçlü bir yaklaşımı temsil eder 1,2,3. Trastuzumab, HER-2 pozitif erken evre veya metastatik meme kanserinin yanı sıra HER-2 pozitif metastatik mide kanseri 4,5,6 tedavisinde kullanılan insanlaştırılmış bir monoklonal anti-HER-2 (insan epidermal büyüme faktörü reseptörü 2) antikorudur. Öncelikle epidermal büyüme faktörü4'ün proliferasyon uyarıcı etkisini inhibe ederek etki eder. Bununla birlikte, trastuzumab'ın, kanser hücreleri HER-2 stimülasyonuna 7 yanıtlarını kaybetmiş olsalar bile, kanser hücresi ölümünü etkili bir şekilde tetiklediği bildirilmiştir. Antikorun bu paradoksal etkisi, antikor bağımlı hücre aracılı sitotoksisiteye (ADCC)7 bağlıdır. ADCC, topluca ADCC 8,9'un efektör hücreleri olarak bilinen doğal öldürücü (NK) hücreler, granülositler ve makrofajlar tarafından aracılık edilebilir. Trastuzumab gibi bir antikor tümör hücrelerine bağlanırsa, bu efektör hücreler antikorun sabit (Fc) bölgesini bağlamak için Fc reseptörlerini kullanırlar. Antikor, tümör hücreleri ile Fc reseptörü taşıyan efektör hücreler arasında köprü kurarak sitotoksik mediatörlerinin salınımını tetikler10. Doğal öldürücü hücreler, hedef hücre zarında gözenekler oluşturmak için perforin içeren granüllerinin sitotoksik yükünü ve granzimi (hücre ölümü sinyal yollarını tetikleyen) kanser hücrelerinin apoptozuna yol açan immün sinapsa salgılarlar (bkz. Şekil 1).
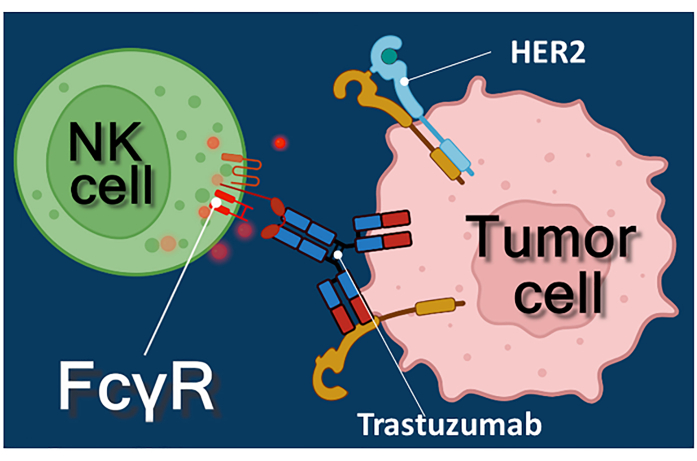
Şekil 1: ADCC'de efektör ve hedef hücre etkileşimleri. Efektör NK hücresinin hücre yüzeyi Fcγ reseptörü, tümör hücresinin yüzeyinde eksprese edilen HER2 molekülüne özgü anti-HER2 trastuzumab antikorunun Fc bölgesini tanır. Böylece, iki hücre arasında immünolojik sinaps adı verilen ve efektör hücrenin sitotoksik granüllerinin yönlendirilmiş ekzositozunu indükleyen sinaps kurulur. Salınan perforin ve granzim molekülleri sonunda hedef hücrenin apoptozu ile sonuçlanır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
ADCC de dahil olmak üzere sitotoksisiteyi ölçmek için daha önce çeşitli testler geliştirilmiştir. Altın standart, hedef hücrelerin radyoaktif 51Cr izotopu ile etiketlendiği radyoaktif krom salınım yöntemidir ve ADCC, lize edilmiş hedef hücrelerin süpernatantından radyoaktivite ölçülerek ölçülür11. Radyoaktif farmasötiklerin ve atıkların sıkı bir şekilde düzenlenmesi, depolanması ve bertaraf edilmesinden kaynaklanan bariz sorunlar nedeniyle, bu yöntem yaşam bilimcileri arasında giderek daha popüler hale gelmemiştir. Ayrıca, yüksek verimli uygulamalar için de uygun değildir. Öldürülen hedef hücrelerden salınan enzimlerin (örneğin, laktat-dehidrojenaz) aktivitesinin ölçülmesi, 51Cr testi12'ye radyoaktif olmayan bir alternatif sağlayabilir. Bununla birlikte, bu tahliller hedef ve efektör hücre ölümlerini ayırt etmekte başarısız olmaktadır. Elektrik Hücresi-substrat Empedans Algılama (ECIS), ADCC13'ün nicelleştirilmesi için uygun olduğunu kanıtladı, ancak ECIS ekipmanı çoğu laboratuvarda mevcut değildir ve teknik, yüksek verimli uygulamalar / tarama ile uyumlu değildir. Floresan olarak etiketlenmiş hücreler, birçok hücre biyolojisi tahlilinde popüler bir alternatiftir ve genellikle akış sitometrisinde veya plaka okuyucu tabanlı uygulamalarda kullanılır14,15,16. Bununla birlikte, bu testler genellikle yıkama adımları içerir veya yüksek verimli uygulamalarla (örneğin, akış sitometrisine dayalı teknikler) uyumsuzdur. Teoride ADCC nicelleştirmesi için uygun olması gereken bazı popüler sitotoksisite testleri, ADCC verimliliğini güvenilir bir şekilde belirleyememektedir13. Son zamanlarda, floresan konfokal mikroskopinin yayılmasıyla, görüntü tabanlı, yüksek içerikli analizler yaşam bilimlerinin çeşitli alanlarında giderek daha popüler hale gelmektedir17. Bir yandan, hücre görüntüleme ekipmanı artık oldukça yaygınken, diğer yandan, elde edilen görüntülerden neredeyse sonsuz morfolojik parametreler toplanabilir. Bu nedenle, yüksek içerikli tarama uyumlu bir ADCC testi geliştirmek ve bileşik kütüphane taramasına uygunluğunu göstermek için yola çıktık.
Burada, görüntü tabanlı bir ADCC testi sunuyoruz ve bu tahlilin ADCC modüle edici bileşikleri tanımlamak için Yüksek İçerik Taraması (HCS) için nasıl kullanılabileceğini gösteriyoruz. Model, JIMT-1 meme karsinomu hedef hücrelerine, CD16.176V.NK-92 efektör hücrelerine ve insanlaştırılmış monoklonal anti-HER2 antikoru trastuzumab'a dayanmaktadır. Bu yöntemle, NK hücrelerinin tümör öldürme etkisini artırabilecek ilaçları tanımlamak veya ADCC'ye müdahale eden küçük molekülleri tanımlayarak NK hücre aracılı ADCC'nin mekanizması hakkında fikir edinmek mümkündür. ADCC'ye özel olarak hücre aracılı sitotoksisiteyi ölçmeyi amaçlayan yaşam bilimcilerinin, bu tahlili keşif bilimi veya ilaç geliştirme için kullanmaktan fayda sağlayabileceğini öneriyoruz. Bu tahlil, bir laboratuvarın floresan görüntüleme ve kantitatif görüntü analizine erişimi ve bu konuda bazı deneyimleri varsa alternatif olabilir.
Protokol
NOT: Tahlil iş akışının temel adımları Şekil 2'de sunulmuştur.
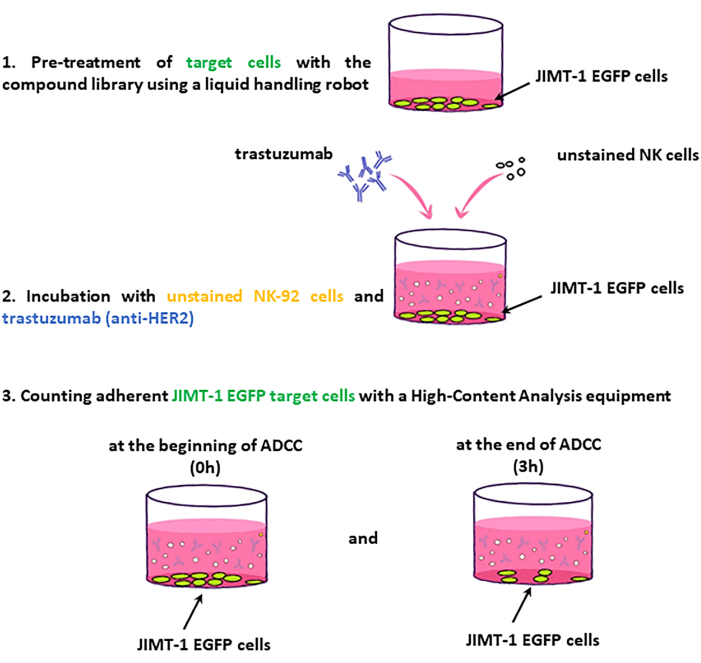
Şekil 2: ADCC ekranının iş akışı. 96 kuyucuklu HCS plakasına tohumlanan JIMT-1-EGFP hedef hücreleri, bileşik kütüphanesinin ilaçlarıyla muamele edilir. Buna karşılık, lekesiz NK (efektör) hücreleri ve trastuzumab eklenir ve plaka 0 zaman noktasında ve 3 saatlik inkübasyondan sonra görüntülenir. ADCC değerlendirmesi, canlı (yüzeye yapışkan) hedef hücrelerin sayısındaki değişime dayanır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
1. HCS plakasının kaplanması
- 96 kuyucuklu yüksek içerikli tarama (HSC) plakasını 50 μL/kuyu JIMT-1 besiyeri (DMEM/F-12 besiyeri, %20 fetal sığır serumu (FBS), 0.3 U/mL insülin (100 IU/mL, Humulin R ve %1 penisilin-streptomisin) ile kaplayın.
- Plakayı 1 saat boyunca bir CO2 inkübatörüne yerleştirin.
NOT: JIMT-1 hücrelerini plakanın cam yüzeyine bağlamak için kaplama çok önemlidir.
2. JIMT-1 Geliştirilmiş Yeşil Floresan Protein (EGFP) hücrelerinin tohumlanması
NOT: EGFP eksprese eden JIMT-1 hücreleri önceki çalışmamız18'de üretildi ve hücreler JIMT-1 ortamındaki T25 doku kültürü şişelerinde kültürlendi (adım 1.1'deki kompozisyona bakınız).
- Hücreleri 2 mL steril PBS ile yıkayın.
- Şişeye 1 mL tripsin-EDTA ekleyin ve şişeyi 10 dakika boyunca bir CO2 inkübatörüne geri koyun.
- Kuluçkadan sonra, JIMT-1 hücrelerinin ayrılıp ayrılmadığını kontrol etmek için şişeye dokunun.
- 2 mL JIMT-1 ortamı ile sindirimi durdurun ve hücre süspansiyonunu 15 mL'lik bir tüpe toplayın.
- Bir Bürker odasında% 0.4 tripan mavisi (boyanın 80 μL'si + hücre süspansiyonunun 20 μL'si) olan hücreleri sayın ve hücre numarasını 133.000 hücre / mL'ye ayarlayın.
- Kaplama ortamını 96 kuyucuklu plakadan aspire edin (adım 1.2).
- HCS plakalarının her bir kuyucuğuna hücre süspansiyonunun 75 μL'lik pipetini alın (bkz.
- Bir CO2 inkübatöründe 37 ° C'de bir gece inkübasyonu sırasında hücrelerin bağlanmasına izin verin.
3. JIMT-1 EGFP hücrelerinin bileşik kütüphanesi ile ön muamelesi
- Ortamı JIMT-1 hücrelerinden aspire edin ve kuyucuklara 50 μL / kuyu taze JIMT-1 ortamı ekleyin. Plakayı yüksek verimli eleme laboratuvarına aktarın.
NOT: Bir sıvı taşıma robotu kullanmak, bileşik kütüphanelerin eklenmesini daha verimli ve tekrarlanabilir hale getirir. - Test bileşiklerini, 25 nL hacme kalibre edilmiş bir pim aleti ile bileşik kütüphane plakasından tahlil plakasına aktarın. Bunu dört kez gerçekleştirin. Dört transfer turu, 100 nL'lik bir son hacim (ve 20 μM nihai konsantrasyon) verir.
- Her adım arasında, pim aletini önce% 50 DMSO vedaha sonra% 70 etanol ile yıkayın.
- Plakaları 37 ° C'de bir CO2 inkübatörde 1 saat boyunca inkübe edin.
4. Efektör hücreleri ekleyerek ADCC testinin başlatılması
NOT: CD16.176V.NK92 hücreleri (bundan böyle NK92 hücreleri olarak anılacaktır), %20 FBS, %1 MEM-NEAA, %1 Na-piruvat, %1 glutamin, %1 penisilin-streptomisin ve 100 IU/mL IL-2 ile desteklenmiş α-MEM'de kültüre alınmıştır.
- Tripan mavisi ile NK92 hücrelerini sayın (boyanın 80 μL'si + hücre süspansiyonunun 20 μL'si). Hücre numarasını 400.000 hücre/mL olarak ayarlayın.
- Hücre süspansiyonunun 4 mL'sini oda sıcaklığında 3 dakika boyunca 150 x g'de santrifüjleyin.
- JIMT-1 ortamına 20 μg / mL anti-HER2 antikoru (trastuzumab) ekleyerek ADCC ortamını hazırlayın.
- NK hücre peletini 5 mL ADCC ortamında yeniden askıya alın.
- Hedef JIMT-1 hücrelerine 50 μL ADCC ortamında 20.000 NK hücreyi pipetleyin. Son hacim 100 μL'dir ve nihai trastuzumab konsantrasyonu 10 μg / mL'dir.
- Tahlil plakasını, 37 °C'de ayarlanmış dahili bir inkübatöre sahip yüksek içerikli analiz ekipmanına yerleştirin.
5. Görüntüleme
NOT: Plakalar, birincisi, efektör hücrelerin hedef hücrelere eklenmesinden hemen sonra ve ikincisi, NK hücrelerinin eklenmesinden 3 saat sonra olmak üzere iki zaman noktasında görüntülenmelidir. Görüntüleme için, yüksek içerikli analizör ve yazılımı veya uygun alternatifleri kullanılabilir (bkz.
- Plakalar listesinden Plaka tipi (96 delikli hücre taşıyıcı ultra) seçeneğini belirleyin.
- Tahlil plakalarda gerçekleştiriliyorsa İki tepe otomatik odaklamasını seçin.
- Konfokal olmayan modda 10x objektif kullanın.
- Sinyal-gürültü oranını iki katına çıkarmak için Binning 2'yi seçin.
- 650-760 nm'de parlak alan görüntüleri ve 488 nm (uyarım) ve 500-550 nm (emisyon) dalga boylarında EGFP dönüştürülmüş JIMT-1 hücrelerinin floresan görüntülerini çekin.
- Görüntüleme için alan sayısını ve zaman noktası sayısını seçin.
6. Görüntü analizi
NOT: ADCC verimliliğini analiz etmek için, uygulanabilir JIMT-1 hücreleri sayılır. ADCC tarafından öldürülen hedef hücreler yüzeyden ayrılır ve mikroskobun odak düzleminden uzaklaşır. Bu nedenle, ADCC reaksiyonunun başlangıcındaki ve sonundaki canlı hücrelerin sayısı arasındaki fark, ADCC tarafından elimine edilen hedef hücrelere karşılık gelir. Değerlendirme dizisinin nasıl oluşturulacağını göstermek için, videoda bir kontrol ADCC kuyusu gösterilir.
- Görüntüdeki hücrelere karşılık gelen bölgeleri algılamak için Hücreleri bul modülünü kullanın.
NOT: Her hücre, görüntüde, çevresinden daha yüksek floresan yoğunluğuna sahip bir bölge olarak algılanır. - Çapı en az 80 μm olan yerleşik M algoritmasını kullanarak hücreleri seçin.
- Büyük bir nesneyi daha küçük nesnelere ayıran Bölme duyarlılığını 0,5 olarak ayarlayın.
- Ortak eşiği (en düşük piksel yoğunluğu düzeyi) değerini 0 olarak ayarlayın.
- Yüksek EGFP floresan yoğunluğuna sahip arka plan alanının algılanmasını iki adımda hariç tutun.
- İlk olarak, önceden seçilen Hücreler bölgesindeki EGFP floresan yoğunluğunu belirlemek için Yoğunluk Özelliklerini Hesapla işlevini kullanın.
- Nüfus seç seçeneğini kullanarak minimum ve maksimum yoğunluk eşiğini ayarlayın.
Sonuçlar
Tahlilin gerçek hayatta nasıl çalıştığını göstermek için, laboratuvar raflarından rastgele seçilen 16 bileşikten oluşan bir test kütüphanesi oluşturduk (Şekil 3). Ek olarak, DMSO ayrıca negatif kontrol olarak ve pozitif kontroller olarak üç mikrotübül polimerizasyon inhibitörü bileşiği (kolşisin, vinkristin ve podofillotoksin) dahil edildi. İkincisinin, kanser hücrelerine NK hücre göçüne ve NK hücre degranülasyonuna müdahale ederek ADCC'yi inhibe etmesi ...
Tartışmalar
ADCC reaksiyonu nispeten uzun zaman önce tanımlanmıştır. Sürecin anahtar moleküler olayları da tanımlanmıştır19. ADCC'yi ölçme yöntemleri, altın standart radyoaktif krom salınım testinden, sitoplazmik enzim salınım testlerinden birkaç floresan bazlı akış sitometrisine veya mikroplaka tahlillerinekadar uzanır 20. Bununla birlikte, bu testlerin ortak bir sınırlaması, yüksek verimli uygulamalara uygun olmamalarıdır. Daha önce, ADCC modifiye edic...
Açıklamalar
Yazarlar çıkar çatışması olmadığını bildirmektedir.
Teşekkürler
LV, Ulusal Araştırma, Geliştirme ve İnovasyon Ofisi'nden GINOP-2.3.2-15-2016-00010 TUMORDNS", GINOP-2.3.2-15-2016-00048-STAYALIVE ve OTKA K132193, K147482 hibelerinden fon aldı. CD16.176V.NK-92 hücreleri Dr. Kerry S. Campbell'den (Fox Chase Center, Philapedlphia, PA, Brink Biologics, lnc. San Diego, CA), dünya çapında patentlerle korunmaktadır ve Nantkwest, lnc tarafından lisanslanmıştır. Yazarlar, NK-92 hücre hattının kullanımı ve teknik tavsiyeler için György Vereb ve Árpád Szöőr'e teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Referanslar
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır