A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج العزلة الاجتماعية: نموذج القوارض غير الغازية للتوتر والقلق
In This Article
Summary
يظهر هنا نموذج فأر القلق الناجم عن العزلة الاجتماعية (SI) والذي يستخدم الفئران البرية من النوع C56BL / 6J للحث على التوتر والسلوك الشبيه بالقلق مع الحد الأدنى من التعامل وعدم وجود إجراءات جراحية. يعكس هذا النموذج أنماط الحياة الحديثة للعزلة الاجتماعية وهو مثالي لدراسة القلق والاضطرابات ذات الصلة.
Abstract
اضطرابات القلق هي أحد الأسباب الرئيسية للإعاقة في الولايات المتحدة (الولايات المتحدة). العلاجات الحالية ليست فعالة دائما وأقل من 50 ٪ من المرضى يحققون مغفرة كاملة. تتمثل إحدى الخطوات الحاسمة في تطوير مزيل القلق الجديد في تطوير واستخدام نموذج حيواني ، مثل الفئران ، لدراسة التغيرات المرضية واختبار هدف (أهداف) الدواء وفعاليته وسلامته. تشمل الأساليب الحالية التلاعب الجيني ، أو الإدارة المزمنة للجزيئات المسببة للقلق ، أو إدارة الإجهاد البيئي. ومع ذلك ، قد لا تعكس هذه الأساليب بشكل واقعي القلق الناجم عن الحياة اليومية. يصف هذا البروتوكول نموذجا جديدا للقلق ، يحاكي الأنماط المتعمدة أو غير المقصودة للعزلة الاجتماعية في الحياة الحديثة. يقلل نموذج القلق الناجم عن العزلة الاجتماعية من الانحرافات والغزو المتصور ويستخدم الفئران البرية من النوع C57BL / 6. في هذا البروتوكول ، يتم وضع الفئران التي تتراوح أعمارها بين 6 و 8 أسابيع (ذكور وإناث) منفردة في أقفاص غير شفافة لحجب البيئة الخارجية بصريا ، مثل الفئران المجاورة ، لمدة 4 أسابيع. لا يتم توفير أي إثراء بيئي (مثل الألعاب) ، ويتم تقليل مواد الفراش بنسبة 50٪ ، ويتم إعطاء أي علاج للدواء كشكل أجار ، ويتم تقليل التعرض / التعامل مع الفئران. تظهر الفئران المعزولة اجتماعيا التي تم إنشاؤها باستخدام هذا البروتوكول سلوكا يشبه القلق ، والعدوان ، فضلا عن انخفاض الإدراك.
Introduction
تمثل اضطرابات القلق أكبر فئة وعبء للأمراض العقلية في الولايات المتحدة (الولايات المتحدة) ، حيث تتجاوز التكاليف السنوية ذات الصلة 42 مليار دولار أمريكي 1,2,3. في السنوات الأخيرة ، زاد القلق والتوتر من انتشار الانتحار والتفكير في الانتحار بأكثر من 16٪ 4. المرضى الذين يعانون من أمراض مزمنة معرضون بشكل خاص للآثار الثانوية غير المقصودة للضائقة العقلية أو انخفاض الوظيفة الإدراكية5. تشمل العلاجات الحالية للقلق العلاج النفسي أو الأدوية أو مزيج من الاثنين6. ومع ذلك ، على الرغم من هذه الأزمة ، أقل من 50 ٪ من المرضى يحققون مغفرة كاملة 6,7. مزيلات القلق مثل البنزوديازيبينات (BZs) ومثبطات امتصاص السيروتونين الانتقائية (SSRIs) لها عيوب كبيرة أو تنتج تأثيرات فورية قليلة أو معدومة8. علاوة على ذلك ، هناك ندرة نسبية في مزيلات القلق الجديدة قيد التطوير ، والتي تواجهها العملية المكلفة والمستهلكة للوقت لتطوير الأدوية 9,10.
تتمثل إحدى الخطوات الحاسمة في عملية تطوير الأدوية في إنشاء واستخدام نموذج حيواني ، مثل الفئران ، لدراسة التغيرات المرضية واختبار سلامة الأدوية وفعاليتها11. تشمل الأساليب الحالية لإنشاء نماذج حيوانية للقلق 1) التلاعب الجيني ، مثل التخلص من مستقبلات السيروتونين (5-HT1A) أو مستقبلات γ حمض أمينوبتيريك A (GABAAR) α الوحدات الفرعية12 ؛ 2) إدارة محرضات القلق بشكل مزمن مثل الكورتيكوستيرون أو عديدات السكاريد الدهنية (LPS)13,14 ؛ أو 3) إدارة الإجهاد البيئي بما في ذلك الهزيمة الاجتماعية وانفصال الأمهات15. ومع ذلك ، قد لا تعكس هذه الطرق بشكل واقعي القلق الناجم عن الحياة اليومية ، وبالتالي قد لا تكون مناسبة للتحقيق في الآلية الأساسية أو اختبار الأدوية الجديدة.
مثل البشر ، الفئران والجرذان مخلوقات اجتماعية للغاية16،17،18. يعد الاتصال الاجتماعي والتفاعلات الاجتماعية أمرا ضروريا لصحة الدماغ المثلى وهما أمران حاسمان للنمو العصبي السليم خلال فترة التربية19. وبالتالي ، فإن انفصال الأم أو العزلة الاجتماعية خلال فترة التربية ينتج عنها فئران تظهر المزيد من القلق والاكتئاب والتغيرات في النقل العصبي20. علاوة على ذلك ، فإن الاستمالة الاجتماعية أو الاستمالة هي شكل شائع من الترابط أو السلوك المريح بين الفئران والجرذان التي تعيش معا21. وبالتالي ، فإن التنشئة الاجتماعية هي جزء لا يتجزأ من حياة القوارض ، والعزلة تؤثر سلبا على صحتهم.
في هذا السياق ، يصف البروتوكول الحالي نموذجا جديدا للقلق لتقليد الأنماط المتعمدة أو غير المقصودة للعزلة الاجتماعية في الحياة الحديثة. يقلل نموذج العزلة الاجتماعية (SI) هذا من الانحرافات والغزو المتصور ويستخدم الفئران البرية البالغة من النوع C57BL / 6 وفئران Sprague-Dawley (SD). يركز البروتوكول المقدم هنا على نموذج الفئران القلقة بناء على أدلتنا المنشورة ، والتي أظهرت زيادة السلوك الشبيه بالقلق ، والعدوان ، وانخفاض الإدراك ، وزيادة الالتهاب العصبي نتيجة للعزلة الاجتماعية22،23،24. يتم تأكيد السلوك الشبيه بالقلق من خلال اختبارات المتاهة المرتفعة (EPM) والمجال المفتوح (OF) ، بينما يتم قياس الوظيفة المعرفية من خلال اختبارات التعرف على الأشياء الجديدة (NOR) والتعرف على السياق الجديد (NCR). هذا النموذج مفيد للتحقيق في القلق والاضطرابات ذات الصلة ولكن يمكن أيضا تكييفه أو تعديله لدراسة التطور الطبيعي وتطور الضعف الإدراكي المعتدل وكذلك التغيرات الأيضية بسبب الإجهاد.
Protocol
يتم إجراء جميع التجارب على الحيوانات وفقا للبروتوكولات المعتمدة من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات بجامعة جنوب كاليفورنيا (USC) ، ويتم تنفيذ جميع الطرق وفقا للإرشادات واللوائح والتوصيات ذات الصلة.
1. الحيوانات
- الحصول على موافقة لجان رعاية الحيوان المناسبة للدراسة.
- اضبط بيت الحيوان على دورة 12 ساعة من الضوء الداكن مع التحكم في درجة الحرارة والرطوبة بين 24 ± 2 درجة مئوية و 50٪ -60٪ على التوالي.
- الحصول على ذكور و / أو إناث الفئران البرية من النوع C57BL / 6 الذين تتراوح أعمارهم بين 6-8 أسابيع. بعد تقسيم الحيوانات حسب الجنس ، قم بتعيينها عشوائيا إلى إحدى المجموعات التالية: 1) منزل جماعي مع معالجة المركبات ؛ 2) منزل المجموعة مع العلاج من تعاطي المخدرات. 3) العزلة الاجتماعية مع علاج السيارة ؛ أو 4) العزلة الاجتماعية مع العلاج من تعاطي المخدرات. استهدف ما لا يقل عن أربعة فئران لكل مجموعة لكل جنس (من الناحية المثالية ستة فئران لكل مجموعة).
- عند وصول الفئران ، تأقلمهم مع بيت الحيوان لمدة 24 ساعة على الأقل. يجب أن تصل الفئران منفردة.
2. إعداد القفص
- بالنسبة لحيوانات العزلة الاجتماعية ، خذ قفص فأر قياسي (75 في مساحة أرضية 2) وأضف نصف كمية الفراش وقطعة 1 في2 من القطن (أو ما يعادلها) للتعشيش.
- لف الجدران الخارجية للأقفاص في أكياس بلاستيكية سوداء غير شفافة (أو ما يعادلها) وآمن باستخدام شريط لاصق. تأكد من أن الفئران لا تستطيع رؤية البيئة الخارجية أو الحيوانات المحيطة.
- اترك الجزء العلوي والسفلي من القفص غير ملفوف ، ما لم تتمكن الفئران من رؤية الحيوانات المجاورة من خلالها.
- عند التغليف ، تأكد من عدم إمكانية الوصول إلى أي جزء من الكيس من داخل القفص. هذا لمنع الحيوان من تمزيق الكيس.
- لا تقم بتضمين أي شكل من أشكال الإثراء البيئي ، مثل الألعاب أو عجلات الجري.
- بعناية وبلطف ضع الفئران في الأقفاص المعدة. توفير الغذاء والماء الإعلان.
- فئران التحكم في المنزل في مجموعات من اثنين أو ثلاثة في ظل ظروف الأقفاص العادية (على سبيل المثال ، في قفص فأر قياسي [75 في مساحةأرضية ] ، وكمية كاملة من الفراش ، وقطعة قطن 2 في2 أو ما يعادلها للتعشيش ، وعدم التفاف الأكياس غير الشفافة).
- تأكد من أن الفئران التي تضم مجموعة متوافقة مع بعضها البعض (أي لا يوجد قتال / صراعات بينها). في حالة حدوث تعارض ، قم بإزالة المعتدي واستبعده من التحليل.
- فصل ذكور وإناث الفئران عن السكن والحفاظ على مسافة بين الذكور والإناث لتجنب إمكانية التأثير على تغيرات مستوى الغدد الصماء لدى إناث الفئران بسبب قدرتها على الشم.
3. الرعاية والعلاج خلال فترة العزل الاجتماعي
- إزعاج الفئران بأقل قدر ممكن خلال فترة العزلة الاجتماعية. قم بتنفيذ أي إجراءات وأنشطة ، مثل تغييرات الأقفاص وإدارة العلاج ، خلال فترة نشاطها (أي أثناء الدورة المظلمة) وتحت الحد الأدنى من اضطرابات الضوضاء.
- تغيير الأقفاص مرة واحدة فقط في الأسبوع خلال دورة الظلام. يمكن إزالة نفس الكيس البلاستيكي وإعادة لفه في أقفاص جديدة ، ما لم يكن هناك ضرر كبير.
- بالنسبة للفئران الضابطة (التي تضم مجموعة سكنية) ، قم بتغيير الأقفاص مرتين في الأسبوع أو أكثر حسب الضرورة أثناء الدورة المظلمة.
- تأكد من أن الفئران لديها الكثير من الماء والطعام لتستمر على الأقل 1 أسبوع.
- استمر في عزل (أو إيواء المجموعة) الفئران لمدة 4 أسابيع على الأقل لرؤية أفضل النتائج.
4. إعداد عقار / علاج أجار - علاج دوائي غير جراحي
- إذا كانت العلاجات (على سبيل المثال ، الأدوية قيد التحقيق) متضمنة في الدراسة ، فمن الأفضل إدارة العلاج بأقل قدر ممكن من المناولة ، من خلال استخدام أشكال أجار. تسبب الطرق مثل الحقن والتزويج الفموي ضغطا إضافيا على الفئران قد يصبح عاملا مربكا للقلق.
- ضبط توقيت وتواتر العلاج بناء على طبيعة الدواء المستخدم.
ملاحظة: في هذه الدراسة، تم استخدام 2 ملغم/كغم ثنائي هيدروميريسيتين (DHM, [(2R,3R)-3,5,7-ثلاثي هيدروكسي-2- (3,4,5-ثلاثي هيدروكسي فينيل)-2,3-ثنائي هيدروكرومين-4-واحد]) كعلاج. تم إعطاء DHM يوميا ، بجرعة واحدة ، خلال المرحلة المظلمة من آخر 2 أسابيع من فترة العزل (أو منزل المجموعة). - لتحضير العلاج ، أضف 3٪ (وزن / حجم) أجار في ماء منزوع الأيونات (DI) والحرارة إلى ~ 90 درجة مئوية ليذوب. الحل سوف فقاعة. منع الانسكاب أو الغليان.
ملاحظة: سخني المحلول في دورق زجاجي عبر فترات قصيرة مدتها 10 ثوان من الميكروويف.
تنبيه: الأواني الزجاجية ستكون ساخنة. ارتد معدات الحماية الشخصية المناسبة (PPE) عند التعامل مع المحلول. - قم بتدوير المحلول وتأكد بصريا من حل متجانس.
ملاحظة: يجب أن يكون المحلول شفافا وأصفر فاتح إلى بني فاتح اللون. - بينما لا يزال المحلول دافئا ، أضف 5٪ (وزن / حجم) سكروز والجرعة المطلوبة من العلاج. أضف السكروز فقط ولا تضيف معاملة الفائدة إلى التحكم في السيارة.
- قم بتدوير المحلول وتأكد بصريا من حل متجانس. ثم ، صب الحل في قالب واتركه يبرد في درجة حرارة الغرفة لتصلب. إذا كان العلاج حساسا للضوء ، فتأكد من حمايته من الضوء.
ملاحظة: يجب أن يكون المحلول لزجا قليلا. - بمجرد أن يتجمد ، يقطع الآجار إلى مكعبات بحجم 0.5 سم × 0.5 سم × 0.5 سم ويخزن في درجة حرارة 4 درجات مئوية حتى يتم تناوله.
- لإدارة العلاج ، ضع مكعبا واحدا على قارب وزن صغير. خلال المرحلة المظلمة من دورة الضوء والظلام ، ضع قارب وزن أجار بهدوء وبعناية في أقفاص فردية ، دون لمس الماوس. اسمح للماوس باستهلاك الأجار.
ملاحظة: تقضي الفئران عادة 15-45 دقيقة لتستهلك الآجار بالكامل. - تأكد من الاستهلاك الكامل للأجار ثم قم بإزالة قارب الوزن بعناية من القفص. كرر حسب الضرورة.
- تحضير مكعبات أجار أسبوعيا للحفاظ على طازجة وتجنب أي تلوث.
5. تحليل السلوك
- إجراء الاختبارات السلوكية بعد 24 ساعة من اليوم الأخير من فترة العزل لمدة 4 أسابيع (أو أكثر). إجراء الاختبارات خلال المرحلة المظلمة تحت الإضاءة الحمراء غير المباشرة والتسجيل باستخدام كاميرا فيديو.
- رتب ثلاثة أفراد على الأقل لإجراء تسجيل يدوي في وضع عدم الاتصال بطريقة مزدوجة التعمية لتقليل التحيز والخطأ.
- متاهة مرتفعة بالإضافة إلى (EPM)
- تحضير جهاز EPM. تم الحصول على الجهاز المستخدم في هذا البروتوكول تجاريا (انظر جدول المواد) ومصنوع من البلاستيك غير الشفاف بذراعين مفتوحين وذراعين مغلقين (33 سم × 5 سم لكل منهما ، أذرع مفتوحة عمودية على الأذرع المغلقة) مع منصة مركزية 5 سم × 5 سم. ارفع الجهاز 50 سم فوق الأرض.
- ضع الحيوان على وسط الجهاز ، في مواجهة ذراع مفتوحة. اسمح للحيوان بالاستكشاف لمدة 5 دقائق وتسجيل نشاطه باستخدام كاميرا فيديو.
- قم بتنظيف الجهاز بعد كل عن طريق مسح جميع الأسطح تماما بمطهر (70٪ كحول إيثيلي). تأكد من القضاء على جميع فضلات القوارض.
- سجل سلوك الفئران في وضع عدم الاتصال بناء على الوقت الذي تقضيه في أذرع مفتوحة وأذرع مغلقة ومنصة مركزية باستخدام ساعة توقيت. ابدأ تشغيل ساعة الإيقاف عندما يضع الماوس ثلاثة مخالب على الأقل في الذراع أو المنصة المعنية.
- اختبار المجال المفتوح (OF)
- تحضير جهاز OF. الجهاز المستخدم في هذا البروتوكول (انظر جدول المواد) مصنوع من البلاستيك غير الشفاف بقياس 50 سم × 50 سم × 38 سم (الطول × العرض × الارتفاع).
- ارسم شبكات مربعة (10 سم × 10 سم لكل منهما) في الحقل ليصبح المجموع 25 شبكة.
- ضع الحيوان في وسط الحقل واتركه للاستكشاف لمدة 10 دقائق. سجل نشاطهم على كاميرا فيديو.
- قم بتنظيف الجهاز بعد كل عن طريق مسح كل السطح تماما بمطهر (70٪ كحول إيثيلي). تأكد من القضاء على جميع فضلات القوارض.
- سجل سلوك الفئران في وضع عدم الاتصال بناء على الوقت الذي تقضيه في المنطقة المركزية ، والوقت الذي تقضيه في الزوايا ، والمسافة الإجمالية المقطوعة ، وعدد المرات التي تربى فيها الفأر.
- استخدم ساعة توقيت لتسجيل الوقت الذي تقضيه في الوسط أو الزاوية. ابدأ تشغيل ساعة الإيقاف عندما يضع الماوس ثلاثة مخالب على الأقل في المنطقة المعنية.
- استخدم عدادا لتسجيل المسافة المقطوعة وتكرار التربية. احسب عدد المربعات التي يدخلها الماوس (عندما يضع الماوس ثلاثة مخالب على الأقل في المربع). عد تربية عندما يقف الماوس بوضوح على الكفوف الخلفية. لا تحسب عندما يقف الماوس ويميل على الجدران أو عندما يقف للتعريس.
- اختبار التعرف على الأشياء الجديدة (NOR)
- قم بإجراء هذا الاختبار على مدار 3 أيام. في اليوم 1 ، قم بإعداد جهاز حقل مفتوح بحجم 50 سم × 50 سم × 38 سم (الطول × العرض × الارتفاع). ضع الحيوان في وسط الحقل المفتوح واتركه يتعرف لمدة 5 دقائق. ثم ضع الحيوان مرة أخرى في قفص منزله.
- قم بتنظيف الجهاز بعد كل عن طريق مسح جميع الأسطح تماما بمطهر (70٪ كحول إيثيلي). تأكد من القضاء على جميع فضلات القوارض.
- في اليوم 2 ، قم بإعداد نفس جهاز الحقل المفتوح ووضع كائنين متطابقين ، مثل مكعب صغير. ضعهما بشكل متماثل على بعد حوالي 20 سم. ضع الحيوان في وسط الجهاز واتركه للاستكشاف لمدة 5 دقائق. ثم ضع الحيوان مرة أخرى في قفص منزله.
- قم بتنظيف الجهاز بعد كل عن طريق مسح جميع الأسطح تماما بمطهر (70٪ كحول إيثيلي). تأكد من القضاء على جميع فضلات القوارض.
- في اليوم 3 ، قم بإعداد نفس جهاز الحقل المفتوح وأحد الكائنات من اليوم 2 (أي مكعب صغير) ، والذي سيعمل ككائن مألوف. ضع شيئا جديدا آخر مختلفا ، مثل هرم خشبي ، بشكل متماثل عن الكائن المألوف على بعد حوالي 20 سم. اسمح للحيوان بالاستكشاف لمدة 3 دقائق وسجل نشاطه على كاميرا فيديو.
- قم بتنظيف الجهاز بعد كل عن طريق مسح جميع الأسطح تماما بمطهر (70٪ كحول إيثيلي). تأكد من القضاء على جميع فضلات القوارض.
- سجل سلوك الفئران في وضع عدم الاتصال بناء على الوقت الذي تقضيه في استكشاف الكائن المألوف والكائن الجديد. احسب مؤشر التعرف على الكائنات (ORI٪) ، حيث
 يمثل ؛ tf و tn أوقات استكشاف الأشياء المألوفة والجديدة ، على التوالي.
يمثل ؛ tf و tn أوقات استكشاف الأشياء المألوفة والجديدة ، على التوالي.
- قم بإجراء هذا الاختبار على مدار 3 أيام. في اليوم 1 ، قم بإعداد جهاز حقل مفتوح بحجم 50 سم × 50 سم × 38 سم (الطول × العرض × الارتفاع). ضع الحيوان في وسط الحقل المفتوح واتركه يتعرف لمدة 5 دقائق. ثم ضع الحيوان مرة أخرى في قفص منزله.
- اختبار التعرف على السياق الجديد (NCR)
- إجراء هذا الاختبار على مدى 2 أيام. قم بإعداد حقلين مفتوحين بشكل واضح وزوجين من الكائنات ذات الشكل المميز. يمكن استخدام جهاز OF كأحد السياقات (حقل مفتوح). يجب أن يكون السياق الآخر بنفس الحجم ولكن بشكل مختلف ، مثل حقل مفتوح دائري.
- في اليوم 1 ، ضع زوجا واحدا من الأشياء المتطابقة (أي مكعبين) في السياق المربع والزوج الآخر من الكائنات المتطابقة (أي هرمين) في السياق الدائري. يجب وضع الأشياء بشكل متماثل على بعد 15-20 سم.
- ضع الحيوان في المنتصف واتركه للاستكشاف لمدة 5 دقائق في سياق واحد. كرر في السياق الآخر. ثم ضع الحيوان مرة أخرى في قفص المنزل.
- قم بتنظيف الجهاز بعد كل عن طريق مسح جميع الأسطح تماما بمطهر (70٪ كحول إيثيلي). تأكد من القضاء على جميع فضلات القوارض.
- في اليوم 2 ، قم بتبديل أحد الكائنات من سياق واحد مع الآخر (على سبيل المثال ، ضع مكعبا واحدا وهرما واحدا في السياق المربع ، ومكعبا واحدا وهرما واحدا في السياق الدائري).
- ضع الحيوان في الوسط واتركه للاستكشاف لمدة 3 دقائق. سجل نشاطهم على كاميرا فيديو. لا تحتاج الحيوانات إلى التسجيل في كلا السياقين.
- قم بتنظيف الجهاز بعد كل عن طريق مسح جميع الأسطح تماما بمطهر (70٪ كحول إيثيلي). تأكد من القضاء على جميع فضلات القوارض.
- سجل سلوك الفئران في وضع عدم الاتصال بناء على الوقت الذي تقضيه في استكشاف الأشياء المميزة. احسب مؤشر التعرف (RI٪) كنسبة الوقت المستغرق في التحقيق في الكائن الجديد "خارج السياق" (أي الهرم في السياق المربع) مقابل الكائن "في السياق" المألوف (أي المكعب في السياق المربع).
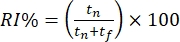 .
.
النتائج
تم تعديل جميع النتائج والأرقام التمثيلية من منشوراتنا الأخيرة22,23. لتقييم آثار العزلة الاجتماعية على القلق والسلوك الاستكشافي ، تم إجراء اختبارات EPM و OF بعد 24 ساعة من تاريخ انتهاء فترة العزلة الاجتماعية لمدة 4 أسابيع. قضت الفئران المعزولة اجتماعيا وقتا أقل ب...
Discussion
تشمل الخطوات الحاسمة في البروتوكول الإعداد الصحيح لأقفاص العزل الاجتماعي (أي لف الأكياس غير الشفافة وتقليل كمية الفراش) ، وتقليل التعامل مع الفئران وإزعاجها طوال فترة العزل ، والتأكد من حصول الفئران على أجار مع الدواء واستهلاكه تماما. من الأهمية بمكان الحفاظ على حالة بيت الحيوان أو ?...
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل هذا العمل من قبل منحة المعهد الوطني للصحة AA17991 (إلى JL) ، ومؤسسة Carefree Biotechnology Foundation (إلى JL) ، وجامعة جنوب كاليفورنيا (USC) ، وجائزة USC Graduate School Travel / Research (إلى SW) منحة الملحقية الثقافية السعودية (إلى A.A.O.) ، وبرنامج المنح الدراسية للمهن الصحية للجيش (إلى A.S.S.).
Materials
| Name | Company | Catalog Number | Comments |
| Black Plastic Bags | Office Depot | 791932 | 24" x 32" |
| Elevated Plus Maze | SD Instruments | NA | Black color |
| Open Field enclosure | SD Instruments | NA | White color |
| Select Agar | Invitrogen | 30391-023 | |
| Square cotton for nesting (nestlet) | Ancare Corporation | NC9365966 | Divide a 2" square piece into 4 pieces to create a 1" square piece for isolation group |
| Sucrose | Sigma | S1888-1KG | |
| Weigh boat | SIgma | HS1420A | Small, square white polystyrene |
References
- Craske, M. G., et al. Anxiety disorders. Nature Reviews Disease Primers. 3 (1), 17024 (2017).
- Kasper, S., den Boer, J., Ad Sitsen, J. . Handbook of Depression and Anxiety: A Biological Approach. , (2003).
- Konnopka, A., König, H. Economic burden of anxiety disorders: a systematic review and meta-analysis. Pharmacoeconomics. 38 (1), 25-37 (2020).
- Batterham, P. J., et al. Effects of the COVID-19 pandemic on suicidal ideation in a representative Australian population sample-Longitudinal cohort study. Journal of Affective Disorders. 300, 385-391 (2022).
- Ismail, I. I., Kamel, W. A., Al-Hashel, J. Y. Association of COVID-19 pandemic and rate of cognitive decline in patients with dementia and mild cognitive impairment: a cross-sectional study. Gerontology and Geriatric Medicine. 7, 23337214211005223 (2021).
- . NIMH. Anxiety Disorders Available from: https://www.nimh.nih.gov/health/topics/anxiety-disorders/index.shtml (2018)
- Roy-Byrne, P. Treatment-refractory anxiety; definition, risk factors, and treatment challenges. Dialogues in Clinical Neuroscience. 17 (2), 191-206 (2015).
- Cassano, G. B., Baldini Rossi, N., Pini, S. Psychopharmacology of anxiety disorders. Dialogues in Clinical Neuroscience. 4 (3), 271-285 (2002).
- Garakani, A., et al. Pharmacotherapy of anxiety disorders: current and emerging treatment options. Frontiers in Psychiatry. 11, 595584 (2020).
- Hutson, P. H., Clark, J. A., Cross, A. J. CNS target identification and validation: avoiding the valley of death or naive optimism. Annual Review of Pharmacology and Toxicology. 57 (1), 171-187 (2017).
- Hart, P. C., Proetzel, G., Wiles, M. V., et al. Experimental models of anxiety for drug discovery and brain research. Mouse Models for Drug Discovery: Methods and Protocols. , 271-291 (2016).
- Scherma, M., Giunti, E., Fratta, W., Fadda, P. Gene knockout animal models of depression, anxiety and obsessive compulsive disorders. Psychiatric Genetics. 29 (5), 191-199 (2019).
- Liu, W. -. Z., et al. Identification of a prefrontal cortex-to-amygdala pathway for chronic stress-induced anxiety. Nature Communications. 11 (1), 2221 (2020).
- Zheng, Z. -. H., et al. Neuroinflammation induces anxiety- and depressive-like behavior by modulating neuronal plasticity in the basolateral amygdala. Brain, Behavior, and Immunity. 91, 505-518 (2021).
- Toth, I., Neumann, I. D. Animal models of social avoidance and social fear. Cell and Tissue Research. 354 (1), 107-118 (2013).
- Wang, F., Kessels, H. W., Hu, H. The mouse that roared: neural mechanisms of social hierarchy. Trends in Neurosciences. 37 (11), 674-682 (2014).
- Endo, N., et al. Multiple animal positioning system shows that socially-reared mice influence the social proximity of isolation-reared cagemates. Communications Biology. 1 (1), 225 (2018).
- Netser, S., et al. Distinct dynamics of social motivation drive differential social behavior in laboratory rat and mouse strains. Nature Communications. 11 (1), 5908 (2020).
- Krimberg, J. S., Lumertz, F. S., Orso, R., Viola, T. W., de Almeida, R. M. M. Impact of social isolation on the oxytocinergic system: A systematic review and meta-analysis of rodent data. Neuroscience & Biobehavioral Reviews. 134, 104549 (2022).
- Mumtaz, F., Khan, M. I., Zubair, M., Dehpour, A. R. Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomedicine & Pharmacotherapy. 105, 1205-1222 (2018).
- Ranade, S. Comforting in mice. Nature Neuroscience. 24 (12), 1640 (2021).
- Al Omran, A. J., et al. Social isolation induces neuroinflammation and microglia overactivation, while dihydromyricetin prevents and improves them. Journal of Neuroinflammation. 19 (1), 2 (2022).
- Watanabe, S., et al. Dihydromyricetin improves social isolation-induced cognitive impairments and astrocytic changes in mice. Scientific Reports. 12 (1), 5899 (2022).
- Silva, J., et al. Modulation of hippocampal GABAergic neurotransmission and gephyrin levels by dihydromyricetin improves anxiety. Frontiers in Pharmacology. 11, 1008 (2020).
- Porter, V. R., et al. Frequency and characteristics of anxiety among patients with Alzheimer's disease and related dementias. Journal of Neuropsychiatry and Clinical Neuroscience. 15 (2), 180-186 (2003).
- Hossain, M. M., et al. Prevalence of anxiety and depression in South Asia during COVID-19: A systematic review and meta-analysis. Heliyon. 7 (4), 06677 (2021).
- . NHGRI. Knockout Mice Fact Sheet Available from: https://www.genome.gov/about-genomics/fact-sheets/Knockout-Mice-Fact-Sheet (2020)
- Takahashi, A. Social stress and aggression in murine models. Current Topics in Behavioral Neuroscience. 54, 181-208 (2022).
- Lam, R. W. Challenges in the treatment of anxiety disorders: beyond guidelines. International Journal of Psychiatry in Clinical Practice. 10, 18-24 (2006).
- Sullens, D. G., et al. Social isolation induces hyperactivity and exploration in aged female mice. PLoS One. 16 (2), 0245355 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved