JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
사회적 격리 모델 : 스트레스와 불안의 비 침습적 설치류 모델
요약
여기에 제시된 것은 야생형 C56BL/6J 마우스를 활용하여 최소한의 취급과 침습적 절차 없이 스트레스와 불안과 유사한 행동을 유도하는 사회적 고립(SI) 유발 불안 마우스 모델입니다. 이 모델은 사회적 고립의 현대 생활 패턴을 반영하며 불안 및 관련 장애를 연구하는 데 이상적입니다.
초록
불안 장애는 미국에서 장애의 주요 원인 중 하나입니다. 현재의 치료법이 항상 효과적인 것은 아니며 환자의 50 % 미만이 완전한 관해를 달성합니다. 새로운 불안 완화제를 개발하는 데 중요한 단계는 마우스와 같은 동물 모델을 개발하고 활용하여 병리학 적 변화를 연구하고 약물 표적, 효능 및 안전성을 테스트하는 것입니다. 현재의 접근법에는 유전자 조작, 불안 유발 분자의 만성 투여 또는 환경 스트레스 투여가 포함됩니다. 그러나 이러한 방법은 일상 생활 전반에 걸쳐 유발 된 불안을 현실적으로 반영하지 않을 수 있습니다. 이 프로토콜은 현대 생활에서 사회적 고립의 의도적 또는 의도하지 않은 패턴을 모방하는 새로운 불안 모델을 설명합니다. 사회적 고립으로 인한 불안 모델은 인지된 산만함과 침습성을 최소화하고 야생형 C57BL/6 마우스를 활용합니다. 이 프로토콜에서, 6 내지 8주령 마우스(수컷 및 암컷)는 4주 동안 이웃 마우스와 같은 외부 환경을 시각적으로 차단하기 위해 불투명한 케이지에 단독으로 수용된다. 환경 농축 (예 : 장난감)이 제공되지 않고 침구 재료가 50 % 감소하고 약물 치료가 한천 형태로 투여되며 마우스의 노출 / 취급이 최소화됩니다. 이 프로토콜을 사용하여 생성 된 사회적으로 고립 된 마우스는 더 큰 불안과 같은 행동, 공격성 및인지 감소를 나타냅니다.
서문
불안 장애는 미국에서 정신 질환의 가장 큰 등급과 부담을 나타내며 관련 연간 비용은 미화 420억 달러를 초과합니다 1,2,3. 최근 몇 년 동안 불안과 스트레스로 인해 자살 및 자살 생각의 유병률이 16% 이상 증가했습니다4. 만성 질환이 있는 환자는 정신적 고통 또는인지 기능 저하의 의도하지 않은 2차 영향에 특히 취약합니다5. 불안에 대한 현재 치료에는 심리 치료, 약물 치료 또는 둘 다의 조합이 포함됩니다6. 그러나 이러한 위기에도 불구하고 환자의 50 % 미만이 완전한 관해를 달성합니다 6,7. 벤조디아제핀(BZ) 및 선택적 세로토닌 재흡수 억제제(SSRI)와 같은 불안 완화제는 심각한 단점이 있거나즉각적인 영향을 거의 또는 전혀 생성하지 않습니다8. 더욱이, 개발 중인 새로운 불안 완화제가 상대적으로 부족하며, 비용과 시간이 많이 소요되는약물 개발 과정으로 인해 어려움을 겪고 있습니다9,10.
약물 개발 과정에서 중요한 단계는 병리학 적 변화를 연구하고 약물 안전성 및 효능을 테스트하기 위해 마우스와 같은 동물 모델을 수립하고 활용하는 것입니다11. 불안 동물 모델을 확립하기 위한 현재의 접근법은 1) 유전자 조작, 예컨대 세로토닌 수용체 (5-HT1A) 또는 γ-아미노부티르산 A 수용체 (GABAAR) α 서브유닛12; 2) 코르티코스테론 또는 지질 다당류(LPS)와 같은 불안 유발제를 만성적으로 투여하는 경우13,14; 또는 3) 사회적 패배 및 모성 분리를 포함한 환경 스트레스 관리15. 그러나 이러한 방법은 일상 생활 전반에 걸쳐 유발 된 불안을 현실적으로 반영하지 않을 수 있으므로 기본 메커니즘을 조사하거나 새로운 약물을 테스트하는 데 적합하지 않을 수 있습니다.
인간과 마찬가지로 생쥐와 쥐는 매우 사회적인 생물입니다16,17,18. 사회적 접촉과 사회적 상호 작용은 최적의 뇌 건강에 필수적이며 양육 기간 동안 적절한 신경 발달에 중요합니다19. 따라서 양육 기간 동안 모성 분리 또는 사회적 고립은 더 많은 불안, 우울증 및 신경 전달의 변화를 보이는 마우스를 초래합니다20. 또한, 사회적 손질 또는 동종 손질은 함께 사는 생쥐와 쥐 사이에서 유대감 또는 위안 행동의 일반적인 형태입니다21. 따라서 사회화는 설치류 생활의 필수적인 부분이며 격리는 건강에 부정적인 영향을 미칩니다.
이러한 맥락에서 본 프로토콜은 현대 생활에서 사회적 고립의 의도적 또는 의도하지 않은 패턴을 모방하는 새로운 불안 모델을 설명합니다. 이 사회적 격리 (SI) 모델은인지 된 산만 함과 침습성을 최소화하고 성인 야생형 C57BL / 6 마우스와 Sprague-Dawley (SD) 쥐를 활용합니다. 여기에 제시된 프로토콜은 사회적 고립의 결과로 불안과 같은 행동, 공격성,인지 감소 및 신경 염증 증가를 보여준 발표 된 증거를 기반으로 한 불안 마우스 모델에 중점을 둡니다 22,23,24. 불안과 유사한 행동은 상승 된 플러스 미로 (EPM) 및 오픈 필드 (OF) 테스트에 의해 확인되는 반면,인지 기능은 새로운 객체 인식 (NOR) 및 새로운 상황 인식 (NCR) 테스트에 의해 측정됩니다. 이 모델은 불안 및 관련 장애를 조사하는 데 유용하지만 스트레스로 인한 대사 변화뿐만 아니라 경미한인지 장애의 자연적 진행 및 발달을 연구하기 위해 적용하거나 수정할 수도 있습니다.
프로토콜
모든 동물 실험은 서던 캘리포니아 대학교 (USC) 기관 동물 관리 및 사용위원회 (IACUC)에서 승인 한 프로토콜에 따라 수행되며 모든 방법은 관련 지침, 규정 및 권장 사항에 따라 수행됩니다.
1. 동물
- 연구를 위해 적절한 동물 관리위원회의 승인을 받으십시오.
- 사육장을 각각 24± 2 ° C와 50 % -60 % 사이의 제어 된 온도와 습도로 어두운 빛 12 시간 주기로 설정하십시오.
- 6-8주령의 수컷 및/또는 암컷 야생형 C57BL/6 마우스를 얻습니다. 동물을 성별로 계층화 한 후 무작위로 다음 그룹 중 하나에 할당하십시오 : 1) 차량 치료가있는 그룹 하우스; 2) 약물 치료가있는 그룹 하우스; 3) 차량 치료로 인한 사회적 고립; 또는 4) 약물 치료로 인한 사회적 고립. 성별 당 그룹 당 최소 4 마리의 마우스를 목표로합니다 (이상적으로는 그룹 당 6 마리의 마우스).
- 생쥐가 도착하면 적어도 24 시간 동안 동물 사육장에 적응하십시오. 마우스는 단독으로 도착해야합니다.
2. 케이지 설정
- 사회적 격리 동물의 경우 표준 마우스 케이지 (2 층 공간에 75 개)를 가져 와서 침구 양의 절반과 둥지를 짓기 위해면1/2 (또는 이에 상응하는 것)을 추가하십시오.
- 케이지의 외벽을 불투명한 검은색 비닐 봉지(또는 이와 동등한 것)로 싸서 테이프로 고정합니다. 쥐가 외부 환경이나 주변 동물을 볼 수 없는지 확인하십시오.
- 쥐가 이웃 동물을 볼 수 없다면 새장의 상단과 하단을 포장하지 않은 상태로 두십시오.
- 포장할 때 케이지 내부에서 가방의 한 부분에 접근할 수 없는지 확인하십시오. 이것은 동물이 가방을 찢는 것을 방지하기위한 것입니다.
- 장난감이나 달리는 바퀴와 같은 어떤 형태의 환경 강화도 포함하지 마십시오.
- 조심스럽게 부드럽게 마우스를 준비된 케이지에 넣으십시오. 음식과 물을 자유롭게 제공하십시오.
- 정상적인 케이지 조건 (즉, 표준 마우스 케이지 [75 in 2 바닥 공간], 전체 양의 침구, 2 in 2 개의면 또는 이와 동등한 중첩 및 불투명 한 가방의 포장 없음) 하에서2 개 또는 3 개의 그룹으로 하우스 컨트롤 마우스).
- 그룹에 수용된 마우스가 서로 호환되는지 확인합니다(즉, 마우스 사이에 싸움/충돌이 없음). 충돌이 발생하면 공격자를 제거하고 분석에서 제외합니다.
- 수컷 및 암컷 마우스 하우징을 분리하고 암컷 마우스의 냄새 능력으로 인해 내분비 수준 변화에 영향을 미칠 가능성을 피하기 위해 수컷과 암컷 사이의 거리를 유지하십시오.
3. 사회적 격리 기간 동안의 보살핌과 치료
- 사회적 격리 기간 동안 가능한 한 최소한으로 마우스를 방해하십시오. 케이지 교체 및 치료 투여와 같은 모든 절차와 활동을 활동 기간 동안 (즉, 어두운주기 동안) 및 최소한의 소음 방해 하에서 수행하십시오.
- 어두운주기 동안 일주일에 한 번만 케이지를 교체하십시오. 심각한 손상이 없는 한 동일한 비닐 봉지를 제거하고 새 케이지에 다시 포장할 수 있습니다.
- 대조군(그룹 수용) 마우스의 경우, 어두운 주기 동안 필요에 따라 일주일에 두 번 또는 그 이상 케이지를 교체하십시오.
- 생쥐가 최소 1주일 동안 사용할 수 있는 충분한 물과 음식이 있는지 확인하십시오.
- 최적의 결과를 보기 위해 최소 4주 동안 마우스를 계속 분리(또는 그룹 하우징)합니다.
4. 한천 약물/치료 준비 - 비침습적 약물 치료
- 치료 (예 : 조사중인 약물)가 연구에 관련된 경우 한천 형태를 사용하여 가능한 한 적은 취급으로 치료를 관리하는 것이 이상적입니다. 주사 및 구강 위관과 같은 경로는 생쥐에게 추가적인 스트레스를가하여 불안의 교란 요인이 될 수 있습니다.
- 사용 된 약물의 특성에 따라 치료시기와 빈도를 조정하십시오.
참고: 이 연구에서는 2mg/kg 디히드로미리세틴(DHM, [(2R,3R)-3,5,7-트리하이드록시-2-(3,4,5-트리하이드록시페닐)-2,3-디하이드로크로멘-4-온])을 치료로 사용했습니다. DHM은 격리(또는 그룹 하우스) 기간의 마지막 2주의 암흑기 동안 단일 용량으로 매일 투여되었습니다. - 처리를 준비하려면 탈이온수(DI)에 3%(w/v) 한천을 넣고 ~90°C로 가열하여 용해시킵니다. 솔루션이 거품을 일으킬 것입니다. 엎지르거나 끓는 것을 방지하십시오.
알림: 유리 플라스크 에서 10초 간격으로 전자레인지에 돌리면서 용액을 가열합니다.
주의 : 유리 제품이 뜨거울 것입니다. 용액을 취급할 때 적절한 개인 보호 장비(PPE)를 착용하십시오. - 솔루션을 소용돌이 치고 시각적으로 균일 한 솔루션을 보장합니다.
알림: 용액은 반투명하고 밝은 노란색에서 밝은 갈색이어야합니다. - 용액이 여전히 따뜻할 때 5%(w/v) 자당과 원하는 치료 용량을 추가합니다. 자당만 추가하고 관심 치료를 차량 제어에 추가하지 마십시오.
- 솔루션을 소용돌이 치고 시각적으로 균일 한 솔루션을 보장합니다. 그런 다음 용액을 몰드에 붓고 실온에서 식혀 응고시킵니다. 치료가 빛에 민감한 경우 빛으로부터 보호하십시오.
알림: 용액은 약간 점성이 있어야 합니다. - 일단 응고되면, 한천을 0.5 cm x 0.5 cm x 0.5 cm의 입방체로 절단하고, 투여될 때까지 4°C에서 저장한다.
- 치료를 관리하려면 단일 큐브를 작은 계량 보트에 놓습니다. 명암주기의 어두운 단계에서 마우스를 만지지 않고 한천 계량 보트를 개별 케이지에 조용하고 조심스럽게 놓습니다. 마우스가 한천을 섭취하도록 허용합니다.
참고: 마우스는 일반적으로 한천을 완전히 섭취하는 데 15-45분을 소비합니다. - 한천의 완전한 소비를 확인한 다음 케이지에서 계량 보트를 조심스럽게 제거하십시오. 필요에 따라 반복합니다.
- 신선하게 유지하고 오염을 피하기 위해 매주 한천 큐브를 준비하십시오.
5. 행동 분석
- 24주(또는 그 이상) 격리 기간의 마지막 날로부터 4시간 후에 행동 테스트를 수행합니다. 어두운 단계에서 간접 적색 조명 아래에서 테스트를 수행하고 비디오 카메라로 녹화하십시오.
- 편향과 오류를 최소화하기 위해 이중 맹검 방식으로 수동 오프라인 채점을 수행하도록 최소 3명을 배치합니다.
- 상승 된 플러스 미로 (EPM)
- EPM 장치를 준비하십시오. 이 프로토콜에 사용 된 장치는 상업적으로 얻어졌으며 ( 재료 표 참조) 2 개의 열린 암과 2 개의 닫힌 팔 (각각 33cm x 5cm, 닫힌 팔에 수직 인 열린 팔)이있는 불투명 플라스틱으로 만들어졌으며 중앙 플랫폼이 5cm x 5cm입니다. 장치를 바닥에서 50cm 위로 들어 올리십시오.
- 동물을 열린 팔을 향하게하여 장치의 중앙에 놓습니다. 동물이 5 분 동안 탐험하고 비디오 카메라를 사용하여 활동을 기록하도록합니다.
- 소독제 (70 % 에틸 알코올)로 모든 표면을 철저히 닦아서 각 동물 후에 장치를 청소하십시오. 모든 설치류 배설물을 닦아내십시오.
- 스톱워치를 사용하여 두 팔을 벌리고, 팔을 닫고, 중앙 플랫폼에서 보낸 시간을 기준으로 마우스의 행동을 오프라인으로 채점합니다. 마우스가 각 팔이나 플랫폼에 최소 3 개의 발을 놓을 때 스톱워치를 시작하십시오.
- 오픈 필드 (OF) 테스트
- OF 장치를 준비합니다. 이 프로토콜에 사용 된 장치 ( 재료 표 참조)는 50cm x 50cm x 38cm (길이 x 너비 x 높이) 크기의 불투명 플라스틱으로 만들어졌습니다.
- 필드에 정사각형 격자 (각각 10cm x 10cm)를 그려 총 25 개의 격자를 만듭니다.
- 동물을 들판 중앙에 놓고 10 분 동안 탐험 할 수 있습니다. 비디오 카메라에 활동을 기록하십시오.
- 소독제 (70 % 에틸 알코올)로 모든 표면을 완전히 닦아서 각 동물 후에 장치를 청소하십시오. 모든 설치류 배설물을 닦아내십시오.
- 중앙 영역에서 보낸 시간, 모서리에서 보낸 시간, 이동한 총 거리 및 마우스가 사육한 횟수를 기준으로 마우스의 행동을 오프라인으로 채점합니다.
- 스톱워치를 사용하여 중앙 또는 모서리에서 보낸 시간을 기록합니다. 마우스가 해당 영역에 최소 3 개의 발을 놓을 때 스톱워치를 시작하십시오.
- 카운터를 사용하여 이동 거리와 양육 빈도를 기록하십시오. 마우스가 입력하는 사각형 수를 세십시오 (마우스가 사각형에 적어도 3 개의 발을 놓을 때). 마우스가 뒷발에 분명히 서있을 때 양육을 세십시오. 마우스가 일어 서서 벽에 기대어 있거나 손질하기 위해 일어 설 때 계산하지 마십시오.
- 새로운 물체 인식(NOR) 테스트
- 이 테스트를 3일에 걸쳐 수행합니다. 1 일째에 50cm x 50cm x 38cm (길이 x 너비 x 높이)의 오픈 필드 장치를 준비하십시오. 동물을 열린 필드의 중앙에 놓고 5 분 동안 익숙해 지도록하십시오. 그런 다음 동물을 집 새장에 다시 넣으십시오.
- 소독제 (70 % 에틸 알코올)로 모든 표면을 철저히 닦아서 각 동물 후에 장치를 청소하십시오. 모든 설치류 배설물을 닦아내십시오.
- 2 일째에 동일한 오픈 필드 장치를 준비하고 작은 큐브와 같은 두 개의 동일한 물체를 놓습니다. 약 20cm 간격으로 대칭으로 놓습니다. 동물을 장치의 중앙에 놓고 5 분 동안 탐험 할 수 있습니다. 그런 다음 동물을 집 새장에 다시 넣으십시오.
- 소독제 (70 % 에틸 알코올)로 모든 표면을 철저히 닦아서 각 동물 후에 장치를 청소하십시오. 모든 설치류 배설물을 닦아내십시오.
- 3일째에, 동일한 오픈 필드 장치 및 2일차의 물체들 중 하나(즉, 작은 입방체)를 준비하는데, 이는 익숙한 물체로서 기능할 것이다. 나무 피라미드와 같은 다른 다른 새로운 물체를 친숙한 물체와 대칭으로 약 20cm 간격으로 배치합니다. 동물이 3 분 동안 탐험하고 비디오 카메라에 활동을 기록하도록하십시오.
- 소독제 (70 % 에틸 알코올)로 모든 표면을 철저히 닦아서 각 동물 후에 장치를 청소하십시오. 모든 설치류 배설물을 닦아내십시오.
- 익숙한 물체와 새로운 물체를 탐색하는 데 소요된 시간을 기준으로 마우스의 행동을 오프라인으로 채점합니다. 물체 인식 지수(ORI%)를 계산하고, 여기서
 ;tf 및tn은 각각 친숙한 물체와 새로운 물체를 탐색하는 시간을 나타낸다.
;tf 및tn은 각각 친숙한 물체와 새로운 물체를 탐색하는 시간을 나타낸다.
- 이 테스트를 3일에 걸쳐 수행합니다. 1 일째에 50cm x 50cm x 38cm (길이 x 너비 x 높이)의 오픈 필드 장치를 준비하십시오. 동물을 열린 필드의 중앙에 놓고 5 분 동안 익숙해 지도록하십시오. 그런 다음 동물을 집 새장에 다시 넣으십시오.
- 새로운 상황 인식(NCR) 테스트
- 이 테스트를 2일에 걸쳐 수행합니다. 두 개의 뚜렷한 모양의 열린 필드와 두 쌍의 뚜렷한 모양의 물체를 준비하십시오. OF 장치는 하나의 컨텍스트(오픈 필드)로서 사용될 수 있다. 다른 컨텍스트는 둥근 열린 필드와 같이 크기는 비슷하지만 모양이 달라야 합니다.
- 1일째에 정사각형 컨텍스트에 동일한 객체 한 쌍(즉, 두 개의 큐브)을 배치하고 다른 한 쌍의 동일한 객체(즉, 두 개의 피라미드)를 원형 컨텍스트에 배치합니다. 물체는 대칭으로 15-20cm 떨어져 있어야합니다.
- 동물을 중앙에 놓고 한 상황에서 5 분 동안 탐험 할 수 있습니다. 다른 컨텍스트에서 반복하십시오. 그런 다음 동물을 집 케이지에 다시 넣으십시오.
- 소독제 (70 % 에틸 알코올)로 모든 표면을 철저히 닦아서 각 동물 후에 장치를 청소하십시오. 모든 설치류 배설물을 닦아내십시오.
- 2일째에 한 컨텍스트의 개체 중 하나를 다른 컨텍스트로 바꿉니다(즉, 정사각형 컨텍스트에 하나의 큐브와 하나의 피라미드를 배치하고 원형 컨텍스트에 하나의 큐브와 하나의 피라미드를 배치).
- 동물을 중앙에 놓고 3 분 동안 탐험 할 수 있습니다. 비디오 카메라에 활동을 기록하십시오. 동물은 두 문맥 모두에서 기록 될 필요가 없습니다.
- 소독제 (70 % 에틸 알코올)로 모든 표면을 철저히 닦아서 각 동물 후에 장치를 청소하십시오. 모든 설치류 배설물을 닦아내십시오.
- 별개의 개체를 탐색하는 데 소요된 시간을 기준으로 오프라인에서 마우스의 행동에 점수를 매깁니다. 인식 지수(RI%)를 새로운 "컨텍스트 외" 개체(즉, 정사각형 컨텍스트의 피라미드)와 친숙한 "컨텍스트 내" 개체(즉, 사각형 컨텍스트의 큐브)를 조사하는 데 소요된 시간의 비율로 계산합니다.
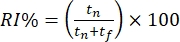 .
.
결과
모든 대표 결과와 수치는 최근 간행물22,23에서 수정되었습니다. 사회적 고립이 불안과 탐색적 행동에 미치는 영향을 평가하기 위해 EPM 및 OF 테스트는 4주간의 사회적 격리 기간 종료일로부터 24시간 후에 수행되었습니다. 사회적으로 격리된 마우스는 대조군(2.31±± 0.27분)에 비해 개방된 팔(1.28 0.17분)에서 훨씬 적은 시간을 보냈고, 대조군(2.24± 0.31분)에 ...
토론
프로토콜의 중요한 단계에는 사회적 격리 케이지를 적절하게 설정하고(즉, 불투명한 가방을 감싸고 침구의 양을 줄이는 것), 격리 기간 동안 마우스의 취급 및 교란을 최소화하고, 마우스가 약물로 한천을 완전히 획득하고 섭취하도록 하는 것이 포함됩니다. 사육장 또는 주거 상태를 일정한 온도와 습도로 유지하고 외부 간섭을 최소화하는 것이 중요합니다. 소음 방해 (예 : 대화, 장비 소음...
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 국립 보건원 보조금 AA17991 (J.L.), Carefree Biotechnology Foundation (J.L.), University of Southern California (USC), USC 대학원 여행 / 연구 상 (SW)의 지원을 받았습니다. 사우디 아라비아 문화 선교 장학금 (AAO에) 및 육군 보건 직업 장학금 프로그램 (ASS에).
자료
| Name | Company | Catalog Number | Comments |
| Black Plastic Bags | Office Depot | 791932 | 24" x 32" |
| Elevated Plus Maze | SD Instruments | NA | Black color |
| Open Field enclosure | SD Instruments | NA | White color |
| Select Agar | Invitrogen | 30391-023 | |
| Square cotton for nesting (nestlet) | Ancare Corporation | NC9365966 | Divide a 2" square piece into 4 pieces to create a 1" square piece for isolation group |
| Sucrose | Sigma | S1888-1KG | |
| Weigh boat | SIgma | HS1420A | Small, square white polystyrene |
참고문헌
- Craske, M. G., et al. Anxiety disorders. Nature Reviews Disease Primers. 3 (1), 17024 (2017).
- Kasper, S., den Boer, J., Ad Sitsen, J. . Handbook of Depression and Anxiety: A Biological Approach. , (2003).
- Konnopka, A., König, H. Economic burden of anxiety disorders: a systematic review and meta-analysis. Pharmacoeconomics. 38 (1), 25-37 (2020).
- Batterham, P. J., et al. Effects of the COVID-19 pandemic on suicidal ideation in a representative Australian population sample-Longitudinal cohort study. Journal of Affective Disorders. 300, 385-391 (2022).
- Ismail, I. I., Kamel, W. A., Al-Hashel, J. Y. Association of COVID-19 pandemic and rate of cognitive decline in patients with dementia and mild cognitive impairment: a cross-sectional study. Gerontology and Geriatric Medicine. 7, 23337214211005223 (2021).
- . NIMH. Anxiety Disorders Available from: https://www.nimh.nih.gov/health/topics/anxiety-disorders/index.shtml (2018)
- Roy-Byrne, P. Treatment-refractory anxiety; definition, risk factors, and treatment challenges. Dialogues in Clinical Neuroscience. 17 (2), 191-206 (2015).
- Cassano, G. B., Baldini Rossi, N., Pini, S. Psychopharmacology of anxiety disorders. Dialogues in Clinical Neuroscience. 4 (3), 271-285 (2002).
- Garakani, A., et al. Pharmacotherapy of anxiety disorders: current and emerging treatment options. Frontiers in Psychiatry. 11, 595584 (2020).
- Hutson, P. H., Clark, J. A., Cross, A. J. CNS target identification and validation: avoiding the valley of death or naive optimism. Annual Review of Pharmacology and Toxicology. 57 (1), 171-187 (2017).
- Hart, P. C., Proetzel, G., Wiles, M. V., et al. Experimental models of anxiety for drug discovery and brain research. Mouse Models for Drug Discovery: Methods and Protocols. , 271-291 (2016).
- Scherma, M., Giunti, E., Fratta, W., Fadda, P. Gene knockout animal models of depression, anxiety and obsessive compulsive disorders. Psychiatric Genetics. 29 (5), 191-199 (2019).
- Liu, W. -. Z., et al. Identification of a prefrontal cortex-to-amygdala pathway for chronic stress-induced anxiety. Nature Communications. 11 (1), 2221 (2020).
- Zheng, Z. -. H., et al. Neuroinflammation induces anxiety- and depressive-like behavior by modulating neuronal plasticity in the basolateral amygdala. Brain, Behavior, and Immunity. 91, 505-518 (2021).
- Toth, I., Neumann, I. D. Animal models of social avoidance and social fear. Cell and Tissue Research. 354 (1), 107-118 (2013).
- Wang, F., Kessels, H. W., Hu, H. The mouse that roared: neural mechanisms of social hierarchy. Trends in Neurosciences. 37 (11), 674-682 (2014).
- Endo, N., et al. Multiple animal positioning system shows that socially-reared mice influence the social proximity of isolation-reared cagemates. Communications Biology. 1 (1), 225 (2018).
- Netser, S., et al. Distinct dynamics of social motivation drive differential social behavior in laboratory rat and mouse strains. Nature Communications. 11 (1), 5908 (2020).
- Krimberg, J. S., Lumertz, F. S., Orso, R., Viola, T. W., de Almeida, R. M. M. Impact of social isolation on the oxytocinergic system: A systematic review and meta-analysis of rodent data. Neuroscience & Biobehavioral Reviews. 134, 104549 (2022).
- Mumtaz, F., Khan, M. I., Zubair, M., Dehpour, A. R. Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomedicine & Pharmacotherapy. 105, 1205-1222 (2018).
- Ranade, S. Comforting in mice. Nature Neuroscience. 24 (12), 1640 (2021).
- Al Omran, A. J., et al. Social isolation induces neuroinflammation and microglia overactivation, while dihydromyricetin prevents and improves them. Journal of Neuroinflammation. 19 (1), 2 (2022).
- Watanabe, S., et al. Dihydromyricetin improves social isolation-induced cognitive impairments and astrocytic changes in mice. Scientific Reports. 12 (1), 5899 (2022).
- Silva, J., et al. Modulation of hippocampal GABAergic neurotransmission and gephyrin levels by dihydromyricetin improves anxiety. Frontiers in Pharmacology. 11, 1008 (2020).
- Porter, V. R., et al. Frequency and characteristics of anxiety among patients with Alzheimer's disease and related dementias. Journal of Neuropsychiatry and Clinical Neuroscience. 15 (2), 180-186 (2003).
- Hossain, M. M., et al. Prevalence of anxiety and depression in South Asia during COVID-19: A systematic review and meta-analysis. Heliyon. 7 (4), 06677 (2021).
- . NHGRI. Knockout Mice Fact Sheet Available from: https://www.genome.gov/about-genomics/fact-sheets/Knockout-Mice-Fact-Sheet (2020)
- Takahashi, A. Social stress and aggression in murine models. Current Topics in Behavioral Neuroscience. 54, 181-208 (2022).
- Lam, R. W. Challenges in the treatment of anxiety disorders: beyond guidelines. International Journal of Psychiatry in Clinical Practice. 10, 18-24 (2006).
- Sullens, D. G., et al. Social isolation induces hyperactivity and exploration in aged female mice. PLoS One. 16 (2), 0245355 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유