このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
社会的孤立モデル:ストレスと不安の非侵襲的げっ歯類モデル
要約
ここで紹介するのは、野生型C56BL / 6Jマウスを利用して、最小限の取り扱いと侵襲的な手順なしでストレスや不安のような行動を誘発する社会的孤立(SI)誘発不安マウスモデルです。このモデルは、社会的孤立の現代の生活パターンを反映しており、不安や関連する障害を研究するのに理想的です。
要約
不安障害は、米国(US)の障害の主な原因の1つです。現在の治療法は必ずしも効果的ではなく、患者の50%未満が完全寛解を達成しています。新しい抗不安薬を開発する上で重要なステップは、マウスなどの動物モデルを開発および利用して、病理学的変化を研究し、薬物標的、有効性、および安全性をテストすることです。現在のアプローチには、遺伝子操作、不安誘発分子の慢性投与、または環境ストレスの管理が含まれます。しかし、これらの方法は、日常生活を通じて誘発された不安を現実的に反映していない可能性があります。このプロトコルは、現代生活における社会的孤立の意図的または意図的でないパターンを模倣する新しい不安モデルを記述します。社会的孤立誘発性不安モデルは、知覚される注意散漫と侵襲性を最小限に抑え、野生型C57BL / 6マウスを利用します。このプロトコルでは、6〜8週齢のマウス(オスとメス)を不透明なケージに単独で収容し、隣接するマウスなどの外部環境を4週間視覚的に遮断します。環境濃縮物(おもちゃなど)は提供されず、寝具材料は50%削減され、薬物の治療は寒天形態として投与され、マウスの曝露/取り扱いは最小限に抑えられます。このプロトコルを使用して生成された社会的に孤立したマウスは、より大きな不安様行動、攻撃性、および認知機能の低下を示します。
概要
不安障害は、米国(US)で最大の精神疾患のクラスと負担を表しており、関連する年間コストは420億米ドルを超えています1,2,3。近年、不安とストレスにより、自殺と自殺念慮の有病率が16%以上上昇しています4。慢性疾患の患者は、精神的苦痛または認知機能の低下の意図しない二次的影響に対して特に脆弱です5。不安神経症の現在の治療法には、心理療法、薬物療法、または両方の6つの組み合わせが含まれます。しかし、この危機にもかかわらず、患者の50%未満が完全寛解を達成します6,7。ベンゾジアゼピン(BZ)や選択的セロトニン再取り込み阻害薬(SSRI)などの抗不安薬には重大な欠点があるか、即時の効果がほとんどまたはまったくありません8。さらに、開発中の新規抗不安薬は比較的不足しており、医薬品開発の費用と時間のかかるプロセスによって課題があります9,10。
医薬品開発プロセスにおける重要なステップは、病理学的変化を研究し、薬物の安全性と有効性をテストするためのマウスなどの動物モデルの確立と利用です11。不安動物モデルを確立するための現在のアプローチには、1)セロトニン受容体(5-HT1A)またはγ-アミノ酪酸A受容体(GABAAR)αサブユニット12をノックアウトするなどの遺伝子操作が含まれます。2)コルチコステロンやリポ多糖(LPS)などの不安誘発剤を慢性投与する13,14;または3)社会的敗北や母親の分離を含む環境ストレスの管理15。しかし、これらの方法は、日常生活を通じて誘発される不安を現実的に反映していない可能性があるため、根本的なメカニズムの調査や新薬のテストには適していない可能性があります。
人間のように、マウスとラットは非常に社会的な生き物です16,17,18。社会的接触と社会的相互作用は、最適な脳の健康に不可欠であり、飼育期間中の適切な神経発達にとって重要です19。したがって、飼育期間中の母体分離または社会的孤立は、より多くの不安、抑うつ、および神経伝達の変化を示すマウスをもたらす20。さらに、社会的グルーミングまたはアログルーミングは、同居するマウスおよびラットの間で結合または慰め行動の一般的な形態である21。したがって、社会化はげっ歯類の生活の不可欠な部分であり、孤立は彼らの健康に悪影響を及ぼします。
これに関連して、本プロトコルは、現代生活における社会的孤立の意図的または非意図的なパターンを模倣するための新しい不安モデルを記述する。この社会的隔離(SI)モデルは、知覚される注意散漫と侵襲性を最小限に抑え、成体の野生型C57BL / 6マウスとSprague-Dawley(SD)ラットを利用します。 ここで提示されたプロトコルは、社会的孤立の結果として不安様行動、攻撃性、認知機能の低下、および神経炎症の増加を示した、公開された証拠に基づく不安マウスモデルに焦点を当てています22,23,24。不安様行動は高架プラス迷路(EPM)およびオープンフィールド(OF)テストによって確認され、認知機能は新規物体認識(NOR)および新規コンテキスト認識(NCR)テストによって測定されます。このモデルは、不安および関連する障害の調査に役立ちますが、軽度認知障害の自然な進行と発達、およびストレスによる代謝変化を研究するために適応または変更することもできます。
プロトコル
すべての動物実験は、南カリフォルニア大学(USC)の施設内動物管理および使用委員会(IACUC)によって承認されたプロトコルに従って実施され、すべての方法は関連するガイドライン、規制、および推奨事項に従って実施されます。
1.動物
- 研究のために適切な動物管理委員会から承認を得てください。
- ビバリウムを暗光12時間サイクルに設定し、温度と湿度をそれぞれ24〜2°Cから2%±50%〜60%に制御します。
- 6〜8週齢のオスおよび/またはメスの野生型C57BL / 6マウスを入手します。動物を性別で層別化した後、それらを次のグループのいずれかにランダムに割り当てます:1)車両治療のあるグループハウス。2)薬物治療を伴うグループハウス。3)車両治療による社会的孤立。または4)薬物治療による社会的孤立。性別ごとにグループごとに少なくとも4匹のマウスを目指します(理想的にはグループごとに6匹のマウス)。
- マウスが到着したら、少なくとも24時間ビバリウムに順応させます。マウスは単独で収容されて到着する必要があります。
2.ケージのセットアップ
- 社会的隔離動物の場合は、標準的なマウスケージ(2階面積に75個)を用意し、寝具の半分の量と1分の2の綿(または同等のもの)をネスティングに追加します。
- ケージの外壁を不透明な黒いビニール袋(または同等のもの)で包み、テープで固定します。マウスが外部環境や周囲の動物を見ることができないことを確認してください。
- ケージの上部と下部は、マウスがそれらを通して隣接する動物を見ることができない限り、包装されていないままにしておきます。
- 包むときは、ケージの内側からバッグのセグメントにアクセスできないことを確認してください。これは、動物がバッグを引き裂くのを防ぐためです。
- おもちゃやランニングホイールなど、いかなる形態の環境エンリッチメントも含めないでください。
- 準備したケージにマウスを慎重にそして穏やかに置きます。食料と水を 自由に提供します。
- 通常のケージ条件下で2つまたは3つのグループでコントロールマウスをハウスします(すなわち、標準的なマウスケージ[2フロアスペースで75]、寝具の全量、ネスティング用の2イン2ピースまたは同等の綿、および不透明なバッグの包装なし)。
- グループ収容マウスが互いに互換性があることを確認します(つまり、それらの間に戦い/対立がない)。競合が発生した場合は、攻撃者を削除し、分析から除外します。
- オスとメスのマウスを分離し、オスとメスの間の距離を保ち、匂いを嗅ぐ能力によるメスマウスの内分泌レベルの変化に影響を与える可能性を回避します。
3.社会的孤立期間中のケアと治療
- 社会的隔離期間中は、マウスをできるだけ最小限に抑えます。ケージの変更や治療管理などの手順や活動を、活動期間中(つまり、ダークサイクル中)に、最小限のノイズ障害の下で実行します。.
- 暗いサイクルの間に週に一度だけケージを交換してください。重大な損傷がない限り、同じビニール袋を取り外して新しいケージに再包装することができます。
- 対照(グループハウス)マウスの場合、暗サイクル中に必要に応じて週に2回以上ケージを交換します。
- マウスが少なくとも1週間続くのに十分な水と食物を持っていることを確認してください。
- 最適な結果を得るために、マウスを少なくとも4週間分離(またはグループハウジング)し続けます。
4.寒天薬/治療の準備-非侵襲的な薬物治療
- 治療(例:.、調査中の薬物)が研究に関与している場合は、寒天形態を利用して、できるだけ少ない取り扱いで治療を行うのが理想的です。.注射や経口強制投与などの経路は、不安の交絡因子となる可能性のあるマウスに追加のストレスを与えます。
- 使用する薬の性質に基づいて治療のタイミングと頻度を調整します。
注:この研究では、2 mg / kgのジヒドロミリセチン(DHM、[(2R,3R)-3,5,7-トリヒドロキシ-2-(3,4,5-トリヒドロキシフェニル)-2,3-ジヒドロクロメン-4-オン])が治療として使用されました。DHMは、隔離(またはグループハウス)期間の最後の2週間の暗期に、単回投与で毎日投与されました。 - 処理を準備するには、脱イオン(DI)水に3%(w/v)寒天を加え、~90°Cに加熱して溶解させます。溶液が泡立ちます。こぼれや沸騰を防ぎます。
注意: ガラス フラスコ内の 溶液を、10秒間隔で電子レンジで加熱します。
注意: ガラス製品は熱くなります。ソリューションを取り扱うときは、適切な個人用保護具(PPE)を着用してください。 - 溶液を回転させ、均質な溶液を視覚的に確認します。
注意: 溶液は半透明で、淡黄色から薄茶色の色である必要があります。 - 溶液がまだ温かいうちに、5%(w / v)のスクロースと希望する治療用量を追加します。スクロースのみを追加し、目的の処理を車両制御に追加しないでください。
- 溶液を回転させ、均質な溶液を視覚的に確認します。次に、溶液を型に流し込み、室温で冷まして固化させます。治療が光に敏感な場合は、必ず光から保護してください。
注:溶液はわずかに粘性があるはずです。 - 固まったら、寒天を0.5cm×0.5cm×0.5cmの立方体に切断し、投与まで4°Cで保存します。
- 治療を行うには、1つの立方体を小さな計量ボートに置きます。明暗サイクルの暗期には、マウスに触れずに、寒天重量ボートを個々のケージに静かに慎重に置きます。マウスが寒天を消費できるようにします。
注:マウスは通常、寒天を完全に消費するために15〜45分を費やします。 - 寒天が完全に消費されていることを確認してから、ケージから計量ボートを慎重に取り外します。必要に応じて繰り返します。
- 寒天キューブを毎週準備して、新鮮さを保ち、汚染を防ぎます。
5.行動分析
- 4週間(またはそれ以上)の隔離期間の最終日から24時間後に行動テストを実行します。間接的な赤色照明の下で暗期にテストを実施し、ビデオカメラで記録します。
- バイアスとエラーを最小限に抑えるために、二重盲検方式で手動のオフラインスコアリングを実施するように少なくとも3人の個人を配置します。
- 高架プラス迷路 (EPM)
- EPM 装置を準備します。このプロトコルで使用される装置は商業的に入手され( 材料の表を参照)、5cm x 5cmの中央プラットフォームを備えた2つのオープンアームと2つのクローズドアーム(それぞれ33cm x 5cm、クローズドアームに垂直なオープンアーム)を備えた不透明なプラスチックでできています。装置を床から50 cm上に持ち上げます。
- 動物を装置の中央に置き、開いた腕に面して。動物が5分間探索し、ビデオカメラを使用して活動を記録できるようにします。
- 消毒剤(70%エチルアルコール)ですべての表面を完全に拭いて、各動物の後に装置を清掃します。げっ歯類の糞がすべて拭き取られていることを確認してください。
- ストップウォッチを使用して、両手を広げた時間、腕を閉じた腕、および中央のプラットフォームで過ごした時間に基づいて、マウスの動作をオフラインでスコアリングします。マウスがそれぞれの腕またはプラットフォームに少なくとも3つの足を置いたときにストップウォッチを開始します。
- オープンフィールド(OF)テスト
- OF装置を準備します。このプロトコルで使用された装置( 材料表を参照)は、50 cm x 50 cm x 38 cm(長さx幅x高さ)の不透明なプラスチックでできていました。
- フィールドに正方形のグリッド(それぞれ10 cm x 10 cm)を描画し、合計25のグリッドを作成します。
- 動物を畑の中央に置き、10分間探索します。ビデオカメラで彼らの活動を記録します。
- 消毒剤(70%エチルアルコール)で表面全体を徹底的に拭いて、各動物の後に装置を清掃します。げっ歯類の糞がすべて拭き取られていることを確認してください。
- 中央ゾーンで過ごした時間、コーナーで過ごした時間、合計移動距離、およびマウスが飼育した回数に基づいて、マウスの動作をオフラインでスコアリングします。
- ストップウォッチを使用して、中央またはコーナーで過ごした時間を記録します。マウスがそれぞれの領域に少なくとも3つの足を置いたときにストップウォッチを開始します。
- カウンターを使用して、移動距離と飼育頻度を記録します。マウスが入る正方形の数を数えます(マウスが正方形に少なくとも3つの足を置いたとき)。マウスが明らかに後ろ足で立ち上がったときに飼育を数えます。マウスが立ち上がって壁にもたれかかるとき、またはマウスがグルーミングに立ち向かうときは数えないでください。
- 新規物体認識(NOR)テスト
- このテストを3日間にわたって実行します。1日目に、50 cm x 50 cm x 38 cm(長さx幅x高さ)のオープンフィールド装置を準備します。動物をオープンフィールドの中央に置き、5分間慣れさせます。次に、動物を家のケージに戻します。
- 消毒剤(70%エチルアルコール)ですべての表面を完全に拭いて、各動物の後に装置を清掃します。げっ歯類の糞がすべて拭き取られていることを確認してください。
- 2日目に、同じオープンフィールド装置を準備し、小さな立方体などの2つの同一のオブジェクトを配置します。それらを約20 cm離して対称的に置きます。動物を装置の中央に置き、5分間探索させる。次に、動物を家のケージに戻します。
- 消毒剤(70%エチルアルコール)ですべての表面を完全に拭いて、各動物の後に装置を清掃します。げっ歯類の糞がすべて拭き取られていることを確認してください。
- 3日目に、同じオープンフィールド装置と、2日目のオブジェクトの1つ(つまり、小さな立方体)を準備します。木製のピラミッドなどの別の異なる斬新なオブジェクトを、おなじみのオブジェクトから約20 cm離して対称に配置します。動物が3分間探索し、ビデオカメラで活動を記録できるようにします。
- 消毒剤(70%エチルアルコール)ですべての表面を完全に拭いて、各動物の後に装置を清掃します。げっ歯類の糞がすべて拭き取られていることを確認してください。
- おなじみのオブジェクトと新しいオブジェクトの探索に費やされた時間に基づいて、マウスの動作をオフラインでスコアリングします。物体認識指数(ORI%)
 を計算します。 tf とtn は、それぞれ身近な物体と斬新な物体を探索する時間を表します。
を計算します。 tf とtn は、それぞれ身近な物体と斬新な物体を探索する時間を表します。
- このテストを3日間にわたって実行します。1日目に、50 cm x 50 cm x 38 cm(長さx幅x高さ)のオープンフィールド装置を準備します。動物をオープンフィールドの中央に置き、5分間慣れさせます。次に、動物を家のケージに戻します。
- 新しいコンテキスト認識(NCR)テスト
- このテストを2日間にわたって実行します。2つの異なる形状のオープンフィールドと2組の異なる形状のオブジェクトを準備します。OF装置は、コンテキスト(オープンフィールド)の1つとして使用することができる。他のコンテキストは、丸いオープンフィールドなど、サイズが似ているが形状が異なる必要があります。
- 1日目に、1組の同一オブジェクト(つまり、2つの立方体)を正方形のコンテキストに配置し、もう一方の同一のオブジェクトのペア(つまり、2つのピラミッド)を丸いコンテキストに配置します。オブジェクトは対称的に15〜20 cm離して配置する必要があります。
- 動物を中央に置き、1つのコンテキストで5分間探索できるようにします。他のコンテキストで繰り返します。次に、動物を家のケージに戻します。
- 消毒剤(70%エチルアルコール)ですべての表面を完全に拭いて、各動物の後に装置を清掃します。げっ歯類の糞がすべて拭き取られていることを確認してください。
- 2日目に、あるコンテキストのオブジェクトの1つを他のコンテキストと交換します(つまり、正方形のコンテキストに1つの立方体と1つのピラミッドを配置し、丸いコンテキストに1つの立方体と1つのピラミッドを配置します)。
- 動物を中央に置き、3分間探索します。ビデオカメラで彼らの活動を記録します。動物は両方の状況で記録する必要はありません。
- 消毒剤(70%エチルアルコール)ですべての表面を完全に拭いて、各動物の後に装置を清掃します。げっ歯類の糞がすべて拭き取られていることを確認してください。
- 個別のオブジェクトの探索に費やした時間に基づいて、マウスの動作をオフラインでスコアリングします。認識指数(RI%)を、新しい「コンテキスト外」オブジェクト(つまり、正方形のコンテキストのピラミッド)と、おなじみの「コンテキスト内」オブジェクト(つまり、正方形のコンテキストの立方体)の調査に費やされた時間の割合として計算します。
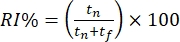 .
.
結果
すべての代表的な結果と数値は、最近の出版物22,23から修正されました。不安と探索的行動に対する社会的孤立の影響を評価するために、EPMおよびOFテストは、4週間の社会的隔離期間の終了日から24時間後に実行されました。社会的に孤立したマウスは、対照群(2.31 ± 0.27分)と比較して開放群での滞在時間(1.28 ± 0.17分)が有意に短く、対照群(2.24 ± 0.3...
ディスカッション
プロトコルの重要なステップには、社会的隔離ケージの適切なセットアップ(すなわち、不透明なバッグの包装と寝具の量の削減)、隔離期間中のマウスの取り扱いと妨害の最小化、 およびマウスが薬物を含む寒天を完全に入手して消費することを確認することが含まれます。ビバリウムまたはハウジングの状態を一定の温度と湿度に維持し、外部干渉を最小限に抑えることが重要です?...
開示事項
著者は利益相反を宣言しません。
謝辞
この研究は、国立衛生研究所の助成金AA17991(J.L.)、ケアフリーバイオテクノロジー財団(J.L.)、南カリフォルニア大学(USC)、USC大学院旅行/研究賞(S.W.)によって資金提供されました。サウジアラビア文化ミッション奨学金(AAOへ)、および陸軍医療専門職奨学金プログラム(ASSへ)。
資料
| Name | Company | Catalog Number | Comments |
| Black Plastic Bags | Office Depot | 791932 | 24" x 32" |
| Elevated Plus Maze | SD Instruments | NA | Black color |
| Open Field enclosure | SD Instruments | NA | White color |
| Select Agar | Invitrogen | 30391-023 | |
| Square cotton for nesting (nestlet) | Ancare Corporation | NC9365966 | Divide a 2" square piece into 4 pieces to create a 1" square piece for isolation group |
| Sucrose | Sigma | S1888-1KG | |
| Weigh boat | SIgma | HS1420A | Small, square white polystyrene |
参考文献
- Craske, M. G., et al. Anxiety disorders. Nature Reviews Disease Primers. 3 (1), 17024 (2017).
- Kasper, S., den Boer, J., Ad Sitsen, J. . Handbook of Depression and Anxiety: A Biological Approach. , (2003).
- Konnopka, A., König, H. Economic burden of anxiety disorders: a systematic review and meta-analysis. Pharmacoeconomics. 38 (1), 25-37 (2020).
- Batterham, P. J., et al. Effects of the COVID-19 pandemic on suicidal ideation in a representative Australian population sample-Longitudinal cohort study. Journal of Affective Disorders. 300, 385-391 (2022).
- Ismail, I. I., Kamel, W. A., Al-Hashel, J. Y. Association of COVID-19 pandemic and rate of cognitive decline in patients with dementia and mild cognitive impairment: a cross-sectional study. Gerontology and Geriatric Medicine. 7, 23337214211005223 (2021).
- . NIMH. Anxiety Disorders Available from: https://www.nimh.nih.gov/health/topics/anxiety-disorders/index.shtml (2018)
- Roy-Byrne, P. Treatment-refractory anxiety; definition, risk factors, and treatment challenges. Dialogues in Clinical Neuroscience. 17 (2), 191-206 (2015).
- Cassano, G. B., Baldini Rossi, N., Pini, S. Psychopharmacology of anxiety disorders. Dialogues in Clinical Neuroscience. 4 (3), 271-285 (2002).
- Garakani, A., et al. Pharmacotherapy of anxiety disorders: current and emerging treatment options. Frontiers in Psychiatry. 11, 595584 (2020).
- Hutson, P. H., Clark, J. A., Cross, A. J. CNS target identification and validation: avoiding the valley of death or naive optimism. Annual Review of Pharmacology and Toxicology. 57 (1), 171-187 (2017).
- Hart, P. C., Proetzel, G., Wiles, M. V., et al. Experimental models of anxiety for drug discovery and brain research. Mouse Models for Drug Discovery: Methods and Protocols. , 271-291 (2016).
- Scherma, M., Giunti, E., Fratta, W., Fadda, P. Gene knockout animal models of depression, anxiety and obsessive compulsive disorders. Psychiatric Genetics. 29 (5), 191-199 (2019).
- Liu, W. -. Z., et al. Identification of a prefrontal cortex-to-amygdala pathway for chronic stress-induced anxiety. Nature Communications. 11 (1), 2221 (2020).
- Zheng, Z. -. H., et al. Neuroinflammation induces anxiety- and depressive-like behavior by modulating neuronal plasticity in the basolateral amygdala. Brain, Behavior, and Immunity. 91, 505-518 (2021).
- Toth, I., Neumann, I. D. Animal models of social avoidance and social fear. Cell and Tissue Research. 354 (1), 107-118 (2013).
- Wang, F., Kessels, H. W., Hu, H. The mouse that roared: neural mechanisms of social hierarchy. Trends in Neurosciences. 37 (11), 674-682 (2014).
- Endo, N., et al. Multiple animal positioning system shows that socially-reared mice influence the social proximity of isolation-reared cagemates. Communications Biology. 1 (1), 225 (2018).
- Netser, S., et al. Distinct dynamics of social motivation drive differential social behavior in laboratory rat and mouse strains. Nature Communications. 11 (1), 5908 (2020).
- Krimberg, J. S., Lumertz, F. S., Orso, R., Viola, T. W., de Almeida, R. M. M. Impact of social isolation on the oxytocinergic system: A systematic review and meta-analysis of rodent data. Neuroscience & Biobehavioral Reviews. 134, 104549 (2022).
- Mumtaz, F., Khan, M. I., Zubair, M., Dehpour, A. R. Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomedicine & Pharmacotherapy. 105, 1205-1222 (2018).
- Ranade, S. Comforting in mice. Nature Neuroscience. 24 (12), 1640 (2021).
- Al Omran, A. J., et al. Social isolation induces neuroinflammation and microglia overactivation, while dihydromyricetin prevents and improves them. Journal of Neuroinflammation. 19 (1), 2 (2022).
- Watanabe, S., et al. Dihydromyricetin improves social isolation-induced cognitive impairments and astrocytic changes in mice. Scientific Reports. 12 (1), 5899 (2022).
- Silva, J., et al. Modulation of hippocampal GABAergic neurotransmission and gephyrin levels by dihydromyricetin improves anxiety. Frontiers in Pharmacology. 11, 1008 (2020).
- Porter, V. R., et al. Frequency and characteristics of anxiety among patients with Alzheimer's disease and related dementias. Journal of Neuropsychiatry and Clinical Neuroscience. 15 (2), 180-186 (2003).
- Hossain, M. M., et al. Prevalence of anxiety and depression in South Asia during COVID-19: A systematic review and meta-analysis. Heliyon. 7 (4), 06677 (2021).
- . NHGRI. Knockout Mice Fact Sheet Available from: https://www.genome.gov/about-genomics/fact-sheets/Knockout-Mice-Fact-Sheet (2020)
- Takahashi, A. Social stress and aggression in murine models. Current Topics in Behavioral Neuroscience. 54, 181-208 (2022).
- Lam, R. W. Challenges in the treatment of anxiety disorders: beyond guidelines. International Journal of Psychiatry in Clinical Practice. 10, 18-24 (2006).
- Sullens, D. G., et al. Social isolation induces hyperactivity and exploration in aged female mice. PLoS One. 16 (2), 0245355 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved