È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello di isolamento sociale: un modello non invasivo di roditori di stress e ansia
In questo articolo
Riepilogo
Presentato qui è un modello murino di ansia indotto dall'isolamento sociale (SI) che utilizza topi selvatici C56BL / 6J per indurre stress e comportamenti ansiosi con una gestione minima e senza procedure invasive. Questo modello riflette i moderni modelli di vita di isolamento sociale ed è ideale per studiare l'ansia e i disturbi correlati.
Abstract
I disturbi d'ansia sono una delle principali cause di disabilità negli Stati Uniti (USA). I trattamenti attuali non sono sempre efficaci e meno del 50% dei pazienti raggiunge la remissione completa. Un passo fondamentale nello sviluppo di un nuovo ansiolitico è quello di sviluppare e utilizzare un modello animale, come i topi, per studiare i cambiamenti patologici e testare i bersagli farmacologici, l'efficacia e la sicurezza. Gli approcci attuali includono la manipolazione genetica, la somministrazione cronica di molecole che inducono ansia o la somministrazione di stress ambientale. Questi metodi, tuttavia, potrebbero non riflettere realisticamente l'ansia indotta durante la vita quotidiana. Questo protocollo descrive un nuovo modello di ansia, che imita i modelli intenzionali o non intenzionali di isolamento sociale nella vita moderna. Il modello di ansia indotta dall'isolamento sociale riduce al minimo le distrazioni percepite e l'invasività e utilizza topi selvatici C57BL / 6. In questo protocollo, topi di 6-8 settimane (maschi e femmine) sono alloggiati singolarmente in gabbie opache per bloccare visivamente l'ambiente esterno, come i topi vicini, per 4 settimane. Non vengono forniti arricchimenti ambientali (come i giocattoli), il materiale della lettiera è ridotto del 50%, qualsiasi trattamento del farmaco viene somministrato sotto forma di agar e l'esposizione / manipolazione dei topi è ridotta al minimo. I topi socialmente isolati generati utilizzando questo protocollo mostrano un maggiore comportamento ansioso, aggressività e diminuzione della cognizione.
Introduzione
I disturbi d'ansia rappresentano la più grande classe e onere di malattie mentali negli Stati Uniti (USA), con costi annuali correlati superiori a US $ 42 miliardi 1,2,3. Negli ultimi anni, l'ansia e lo stress hanno aumentato la prevalenza del suicidio e dell'ideazione suicida di oltre il 16%4. I pazienti con malattie croniche sono particolarmente vulnerabili agli effetti secondari non intenzionali del disagio mentale o alla ridotta funzione cognitiva5. I trattamenti attuali per l'ansia includono psicoterapia, farmaci o una combinazione di entrambi6. Tuttavia, nonostante questa crisi, meno del 50% dei pazienti raggiunge la remissione completa 6,7. Gli ansiolitici come le benzodiazepine (BZ) e gli inibitori selettivi della ricaptazione della serotonina (SSRI) hanno inconvenienti significativi o producono effetti immediati minimi o nulli8. Inoltre, vi è una relativa scarsità di nuovi ansiolitici in fase di sviluppo, messa alla prova dal costoso e dispendioso processo di sviluppo di farmaci 9,10.
Un passo fondamentale nel processo di sviluppo del farmaco è la creazione e l'utilizzo di un modello animale, come i topi, per studiare i cambiamenti patologici e testare la sicurezza e l'efficacia dei farmaci11. Gli attuali approcci per stabilire modelli animali di ansia includono 1) manipolazione genetica, come l'eliminazione dei recettori della serotonina (5-HT1A) o del recettore dell'acido γ-aminobutirrico A (GABAAR) α subunità12; 2) somministrazione cronica di induttori ansiogeni quali corticosterone o lipopolisaccaridi (LPS)13,14; o 3) amministrare lo stress ambientale, compresa la sconfitta sociale e la separazione materna15. Questi metodi, tuttavia, potrebbero non riflettere realisticamente l'ansia indotta durante la vita quotidiana e quindi potrebbero non essere adatti per indagare il meccanismo sottostante o testare nuovi farmaci.
Come gli esseri umani, topi e ratti sono creature altamente sociali16,17,18. Il contatto sociale e le interazioni sociali sono essenziali per una salute ottimale del cervello e sono fondamentali per un corretto sviluppo neurologico durante il periodo di allevamento19. Pertanto, la separazione materna o l'isolamento sociale durante il periodo di allevamento si traduce in topi che mostrano più ansia, depressione e cambiamenti nella neurotrasmissione20. Inoltre, il social grooming o allogrooming è una forma comune di legame o comportamento confortante tra topi e ratti che vivono insieme21. Pertanto, la socializzazione è parte integrante della vita dei roditori e l'isolamento ha un impatto negativo sulla loro salute.
In questo contesto, il presente protocollo descrive un nuovo modello di ansia per imitare i modelli intenzionali o non intenzionali di isolamento sociale nella vita moderna. Questo modello di isolamento sociale (SI) riduce al minimo le distrazioni percepite e l'invasività e utilizza topi adulti selvatici di tipo C57BL / 6 e ratti Sprague-Dawley (SD). Il protocollo presentato qui si concentra sul modello di topi ansiosi basato sulle nostre prove pubblicate, che hanno mostrato un aumento del comportamento simile all'ansia, aggressività, diminuzione della cognizione e aumento della neuroinfiammazione a causa dell'isolamento sociale22,23,24. Il comportamento ansioso è confermato dai test più elevati più labirinto (EPM) e campo aperto (OF), mentre la funzione cognitiva è misurata dai test di riconoscimento di nuovi oggetti (NOR) e di riconoscimento del nuovo contesto (NCR). Questo modello è utile per studiare l'ansia e i disturbi correlati, ma può anche essere adattato o modificato per studiare la progressione naturale e lo sviluppo del decadimento cognitivo lieve e dei cambiamenti metabolici dovuti allo stress.
Protocollo
Tutti gli esperimenti sugli animali vengono eseguiti secondo i protocolli approvati dal Comitato istituzionale per la cura e l'uso degli animali (IACUC) della University of Southern California (USC) e tutti i metodi sono eseguiti in conformità con le linee guida, i regolamenti e le raccomandazioni pertinenti.
1. Animali
- Ottenere l'approvazione da parte dei comitati appropriati per la cura degli animali per lo studio.
- Impostare il vivaio su un ciclo buio-chiaro di 12 ore con temperatura e umidità controllate tra 24 ± 2 °C e 50%-60%, rispettivamente.
- Ottenere topi selvatici maschi e/o femmine di tipo C57BL/6 di età compresa tra 6 e 8 settimane. Dopo aver stratificato gli animali per sesso, assegnarli casualmente a uno dei seguenti gruppi: 1) casa del gruppo con trattamento del veicolo; 2) casa di gruppo con trattamento farmacologico; 3) isolamento sociale con trattamento del veicolo; o 4) isolamento sociale con trattamento farmacologico. Punta ad almeno quattro topi per gruppo per sesso (idealmente sei topi per gruppo).
- All'arrivo dei topi, acclimatarli al vivaio per almeno 24 ore. I topi dovrebbero arrivare alloggiati singolarmente.
2. Configurazione della gabbia
- Per gli animali con isolamento sociale, prendi una gabbia per topi standard (75 in 2 spazi) e aggiungi metà della quantità di biancheria da letto e un pezzo di cotone 1 su2 (o equivalente) per la nidificazione.
- Avvolgere le pareti esterne delle gabbie in sacchetti di plastica nera opachi (o equivalenti) e fissarli con del nastro adesivo. Assicurati che i topi non possano vedere l'ambiente esterno o gli animali circostanti.
- Lasciare la parte superiore e inferiore della gabbia scartata, a meno che i topi non possano vedere gli animali vicini attraverso di loro.
- Durante l'avvolgimento, assicurarsi che nessun segmento della borsa sia accessibile dall'interno della gabbia. Questo per evitare che l'animale strappi la borsa.
- Non includere alcuna forma di arricchimento ambientale, come giocattoli o ruote da corsa.
- Posizionare con cura e delicatamente i topi nelle gabbie preparate. Fornire cibo e acqua ad libitum.
- Topi di controllo domestici in gruppi di due o tre in condizioni di gabbia normali (cioè, in una gabbia per topi standard [75 in 2 spazio], una quantità completa di lettiera, un pezzo di cotone 2 in2 o equivalente per la nidificazione e nessun involucro di sacchetti opachi).
- Assicurati che i topi alloggiati in gruppo siano compatibili tra loro (cioè, non ci sono combattimenti / conflitti tra loro). Se si verifica un conflitto, rimuovere l'aggressore ed escluderlo dall'analisi.
- Separare l'alloggiamento dei topi maschi e femmine e mantenere la distanza tra maschi e femmine per evitare la possibilità di influenzare i cambiamenti del livello endocrino dei topi femmina a causa della loro capacità di odorare.
3. Cura e trattamento durante il periodo di isolamento sociale
- Disturbare i topi il meno possibile durante il periodo di isolamento sociale. Eseguire qualsiasi procedura e attività, come il cambio della gabbia e la somministrazione del trattamento, durante il loro periodo attivo (cioè durante il ciclo buio) e con disturbi minimi del rumore.
- Cambiare le gabbie solo una volta alla settimana durante il ciclo buio. Lo stesso sacchetto di plastica può essere rimosso e riavvolto in nuove gabbie, a meno che non siano presenti danni significativi.
- Per i topi di controllo (ospitati in gruppo), cambiare le gabbie due volte alla settimana o più, se necessario durante il ciclo buio.
- Assicurati che i topi abbiano molta acqua e cibo per durare almeno 1 settimana.
- Continuare a isolare (o ospitare in gruppo) i topi per almeno 4 settimane per vedere risultati ottimali.
4. Preparazione farmaco/trattamento Agar: un trattamento farmacologico non invasivo
- Se i trattamenti (ad esempio, i farmaci in esame) sono coinvolti nello studio, idealmente somministrare il trattamento con la minor manipolazione possibile, utilizzando forme di agar. Percorsi come l'iniezione e il gavage orale infliggono ulteriore stress ai topi che può diventare un fattore confondente dell'ansia.
- Regolare i tempi e la frequenza del trattamento in base alla natura del farmaco utilizzato.
NOTA: In questo studio, 2 mg/kg di diidromiricetina (DHM, [(2R,3R)-3,5,7-triidrossi-2-(3,4,5-triidrossifenil)-2,3-diidrocromen-4-one]) sono stati utilizzati come trattamento. Il DHM è stato somministrato quotidianamente, in una singola dose, durante la fase oscura delle ultime 2 settimane del periodo di isolamento (o casa di gruppo). - Per preparare il trattamento, aggiungere il 3% (p/v) di agar in acqua deionizzata (DI) e portare a ~90 °C per sciogliere. La soluzione bollerà. Evitare fuoriuscite o bolliture.
NOTA: Riscaldare la soluzione in un matraccio di vetro con brevi intervalli di 10 secondi di microonde.
ATTENZIONE: La vetreria sarà calda. Indossare dispositivi di protezione individuale (DPI) appropriati quando si maneggia la soluzione. - Ruotare la soluzione e garantire visivamente una soluzione omogenea.
NOTA: La soluzione deve essere traslucida e di colore da giallo chiaro a marrone chiaro. - Mentre la soluzione è ancora calda, aggiungere il 5% (p/v) di saccarosio e la dose desiderata di trattamento. Aggiungere solo saccarosio e non aggiungere il trattamento di interesse al controllo del veicolo.
- Ruotare la soluzione e garantire visivamente una soluzione omogenea. Quindi, versare la soluzione in uno stampo e lasciare raffreddare a temperatura ambiente per solidificare. Se il trattamento è sensibile alla luce, assicurarsi di proteggerlo dalla luce.
NOTA: la soluzione deve essere leggermente viscosa. - Una volta solidificato, tagliare l'agar a cubetti di 0,5 cm x 0,5 cm x 0,5 cm e conservare a 4 °C fino alla somministrazione.
- Per somministrare il trattamento, posizionare un singolo cubo su una piccola barca di pesatura. Durante la fase buia del ciclo luce-buio, posizionare silenziosamente e con cura la barca di peso dell'agar in gabbie individuali, senza toccare il mouse. Lasciare che il mouse consumi l'agar.
NOTA: I topi in genere impiegano 15-45 minuti per consumare completamente l'agar. - Confermare il consumo completo dell'agar e quindi rimuovere con attenzione la barca di pesatura dalla gabbia. Ripetere se necessario.
- Preparare i cubetti di agar settimanalmente per mantenerli freschi ed evitare qualsiasi contaminazione.
5. Analisi del comportamento
- Eseguire test comportamentali 24 ore dopo l'ultimo giorno del periodo di isolamento di 4 settimane (o più). Condurre test durante la fase di buio sotto illuminazione rossa indiretta e registrare con una videocamera.
- Disporre almeno tre persone per eseguire il punteggio offline manuale in doppio cieco per ridurre al minimo distorsioni ed errori.
- Labirinto sopraelevato più (EPM)
- Preparare l'apparecchio EPM. L'apparato utilizzato in questo protocollo è stato ottenuto commercialmente (vedi Tabella dei materiali) e realizzato in plastica opaca con due bracci aperti e due bracci chiusi (33 cm x 5 cm ciascuno, bracci aperti perpendicolarmente ai bracci chiusi) con una piattaforma centrale di 5 cm x 5 cm. Sollevare l'apparecchio di 50 cm dal pavimento.
- Posizionare l'animale al centro dell'apparecchio, rivolto verso un braccio aperto. Consenti all'animale di esplorare per 5 minuti e registra la sua attività utilizzando una videocamera.
- Pulire l'apparecchio dopo ogni animale pulendo accuratamente tutte le superfici con disinfettante (alcool etilico al 70%). Assicurarsi che tutti gli escrementi di roditori siano stati cancellati.
- Assegna un punteggio al comportamento dei topi offline in base al tempo trascorso in braccia aperte, braccia chiuse e alla piattaforma centrale utilizzando un cronometro. Avviare il cronometro quando il mouse posiziona almeno tre zampe nel rispettivo braccio o piattaforma.
- Test in campo aperto (OF)
- Preparare l'apparecchio OF. L'apparecchio utilizzato in questo protocollo (vedi Tabella dei materiali) era realizzato in plastica opaca che misurava 50 cm x 50 cm x 38 cm (lunghezza x larghezza x altezza).
- Disegna griglie quadrate (10 cm x 10 cm ciascuna) sul campo per un totale di 25 griglie.
- Posiziona l'animale al centro del campo e lascia esplorare per 10 minuti. Registra la loro attività su una videocamera.
- Pulire l'apparecchio dopo ogni animale strofinando accuratamente tutta la superficie con disinfettante (alcool etilico al 70%). Assicurarsi che tutti gli escrementi di roditori siano stati cancellati.
- Assegna un punteggio al comportamento dei topi offline in base al tempo trascorso nella zona centrale, al tempo trascorso negli angoli, alla distanza totale percorsa e al numero di volte che il topo è cresciuto.
- Usa un cronometro per registrare il tempo trascorso al centro o nell'angolo. Avviare il cronometro quando il mouse posiziona almeno tre zampe nella rispettiva area.
- Utilizzare un contatore per registrare la distanza percorsa e la frequenza di allevamento. Conta il numero di quadrati che il mouse inserisce (quando il mouse posiziona almeno tre zampe nel quadrato). Conta l'allevamento quando il topo si alza chiaramente sulle zampe posteriori. Non contare quando il topo si alza e si appoggia alle pareti o quando si alza per pulire.
- Test di riconoscimento di nuovi oggetti (NOR)
- Eseguire questo test per 3 giorni. Il giorno 1, preparare un apparecchio in campo aperto di 50 cm x 50 cm x 38 cm (lunghezza x larghezza x altezza). Posizionare l'animale al centro del campo aperto e lasciare familiarizzare per 5 minuti. Quindi rimetti l'animale nella sua gabbia di casa.
- Pulire l'apparecchio dopo ogni animale pulendo accuratamente tutte le superfici con disinfettante (alcool etilico al 70%). Assicurarsi che tutti gli escrementi di roditori siano stati cancellati.
- Il giorno 2, prepara lo stesso apparato di campo aperto e posiziona due oggetti identici, come un piccolo cubo. Posizionali simmetricamente a circa 20 cm di distanza. Posizionare l'animale al centro dell'apparato e lasciare esplorare per 5 minuti. Quindi rimetti l'animale nella sua gabbia di casa.
- Pulire l'apparecchio dopo ogni animale pulendo accuratamente tutte le superfici con disinfettante (alcool etilico al 70%). Assicurarsi che tutti gli escrementi di roditori siano stati cancellati.
- Il giorno 3, prepara lo stesso apparato in campo aperto e uno degli oggetti del giorno 2 (cioè un piccolo cubo), che funzionerà come l'oggetto familiare. Posiziona un altro oggetto nuovo dissimile, come una piramide di legno, simmetricamente dall'oggetto familiare a circa 20 cm di distanza. Consenti all'animale di esplorare per 3 minuti e registra la sua attività su una videocamera.
- Pulire l'apparecchio dopo ogni animale pulendo accuratamente tutte le superfici con disinfettante (alcool etilico al 70%). Assicurarsi che tutti gli escrementi di roditori siano stati cancellati.
- Assegna un punteggio al comportamento dei topi offline in base al tempo trascorso a esplorare l'oggetto familiare e l'oggetto nuovo. Calcola l'indice di riconoscimento degli oggetti (ORI%), dove
 ; tf e tn rappresentano rispettivamente i tempi di esplorazione degli oggetti familiari e nuovi.
; tf e tn rappresentano rispettivamente i tempi di esplorazione degli oggetti familiari e nuovi.
- Eseguire questo test per 3 giorni. Il giorno 1, preparare un apparecchio in campo aperto di 50 cm x 50 cm x 38 cm (lunghezza x larghezza x altezza). Posizionare l'animale al centro del campo aperto e lasciare familiarizzare per 5 minuti. Quindi rimetti l'animale nella sua gabbia di casa.
- Nuovo test di riconoscimento del contesto (NCR)
- Eseguire questo test per 2 giorni. Preparate due campi aperti di forma distinta e due coppie di oggetti di forma distinta. L'apparato OF può essere utilizzato come uno dei contesti (campo aperto). L'altro contesto deve avere dimensioni simili ma di forma diversa, ad esempio un campo aperto rotondo.
- Il giorno 1, posiziona una coppia di oggetti identici (cioè due cubi) nel contesto quadrato e l'altra coppia di oggetti identici (cioè due piramidi) nel contesto rotondo. Gli oggetti devono essere posizionati simmetricamente a 15-20 cm di distanza.
- Posiziona l'animale al centro e lascia esplorare per 5 minuti in un contesto. Ripeti nell'altro contesto. Quindi, rimetti l'animale nella sua gabbia di casa.
- Pulire l'apparecchio dopo ogni animale pulendo accuratamente tutte le superfici con disinfettante (alcool etilico al 70%). Assicurarsi che tutti gli escrementi di roditori siano stati cancellati.
- Il giorno 2, scambia uno degli oggetti da un contesto con l'altro (cioè, posiziona un cubo e una piramide nel contesto quadrato e un cubo e una piramide nel contesto rotondo).
- Posiziona l'animale al centro e lascia esplorare per 3 minuti. Registra la loro attività su una videocamera. Gli animali non hanno bisogno di essere registrati in entrambi i contesti.
- Pulire l'apparecchio dopo ogni animale pulendo accuratamente tutte le superfici con disinfettante (alcool etilico al 70%). Assicurarsi che tutti gli escrementi di roditori siano stati cancellati.
- Assegna un punteggio al comportamento dei topi offline in base al tempo trascorso a esplorare gli oggetti distinti. Calcola l'indice di riconoscimento (RI%) come la proporzione di tempo trascorso a studiare il nuovo oggetto "fuori contesto" (cioè la piramide nel contesto quadrato) rispetto al familiare oggetto "in-context" (cioè il cubo nel contesto quadrato).
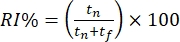 .
.
Risultati
Tutti i risultati e le cifre rappresentativi sono stati modificati dalle nostre recenti pubblicazioni22,23. Per valutare gli effetti dell'isolamento sociale sull'ansia e sul comportamento esplorativo, i test EPM e OF sono stati eseguiti 24 ore dopo la data di fine del periodo di isolamento sociale di 4 settimane. I topi socialmente isolati hanno trascorso significativamente meno tempo nel braccio aperto (1,28 ± 0,17 min) rispetto al controllo (2,31 ± 0,27 min) ...
Discussione
I passaggi critici nel protocollo includono la corretta impostazione delle gabbie di isolamento sociale (cioè l'avvolgimento di sacchetti opachi e la riduzione della quantità di lettiera), riducendo al minimo la manipolazione e il disturbo dei topi durante il periodo di isolamento e assicurandosi che i topi ottengano e consumino completamente l'agar con il farmaco. È fondamentale che il vivaio o le condizioni abitative siano mantenute a temperatura e umidità costanti, nonché a ridurre al minimo le interfere...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato finanziato dal National Institute of Health grant AA17991 (a J.L.), Carefree Biotechnology Foundation (a J.L.), University of Southern California (USC), USC Graduate School Travel / Research Award (a S.W.) Borsa di studio della missione culturale dell'Arabia Saudita (ad A.A.O.) e programma di borse di studio per le professioni sanitarie dell'esercito (all'ASS).
Materiali
| Name | Company | Catalog Number | Comments |
| Black Plastic Bags | Office Depot | 791932 | 24" x 32" |
| Elevated Plus Maze | SD Instruments | NA | Black color |
| Open Field enclosure | SD Instruments | NA | White color |
| Select Agar | Invitrogen | 30391-023 | |
| Square cotton for nesting (nestlet) | Ancare Corporation | NC9365966 | Divide a 2" square piece into 4 pieces to create a 1" square piece for isolation group |
| Sucrose | Sigma | S1888-1KG | |
| Weigh boat | SIgma | HS1420A | Small, square white polystyrene |
Riferimenti
- Craske, M. G., et al. Anxiety disorders. Nature Reviews Disease Primers. 3 (1), 17024 (2017).
- Kasper, S., den Boer, J., Ad Sitsen, J. . Handbook of Depression and Anxiety: A Biological Approach. , (2003).
- Konnopka, A., König, H. Economic burden of anxiety disorders: a systematic review and meta-analysis. Pharmacoeconomics. 38 (1), 25-37 (2020).
- Batterham, P. J., et al. Effects of the COVID-19 pandemic on suicidal ideation in a representative Australian population sample-Longitudinal cohort study. Journal of Affective Disorders. 300, 385-391 (2022).
- Ismail, I. I., Kamel, W. A., Al-Hashel, J. Y. Association of COVID-19 pandemic and rate of cognitive decline in patients with dementia and mild cognitive impairment: a cross-sectional study. Gerontology and Geriatric Medicine. 7, 23337214211005223 (2021).
- . NIMH. Anxiety Disorders Available from: https://www.nimh.nih.gov/health/topics/anxiety-disorders/index.shtml (2018)
- Roy-Byrne, P. Treatment-refractory anxiety; definition, risk factors, and treatment challenges. Dialogues in Clinical Neuroscience. 17 (2), 191-206 (2015).
- Cassano, G. B., Baldini Rossi, N., Pini, S. Psychopharmacology of anxiety disorders. Dialogues in Clinical Neuroscience. 4 (3), 271-285 (2002).
- Garakani, A., et al. Pharmacotherapy of anxiety disorders: current and emerging treatment options. Frontiers in Psychiatry. 11, 595584 (2020).
- Hutson, P. H., Clark, J. A., Cross, A. J. CNS target identification and validation: avoiding the valley of death or naive optimism. Annual Review of Pharmacology and Toxicology. 57 (1), 171-187 (2017).
- Hart, P. C., Proetzel, G., Wiles, M. V., et al. Experimental models of anxiety for drug discovery and brain research. Mouse Models for Drug Discovery: Methods and Protocols. , 271-291 (2016).
- Scherma, M., Giunti, E., Fratta, W., Fadda, P. Gene knockout animal models of depression, anxiety and obsessive compulsive disorders. Psychiatric Genetics. 29 (5), 191-199 (2019).
- Liu, W. -. Z., et al. Identification of a prefrontal cortex-to-amygdala pathway for chronic stress-induced anxiety. Nature Communications. 11 (1), 2221 (2020).
- Zheng, Z. -. H., et al. Neuroinflammation induces anxiety- and depressive-like behavior by modulating neuronal plasticity in the basolateral amygdala. Brain, Behavior, and Immunity. 91, 505-518 (2021).
- Toth, I., Neumann, I. D. Animal models of social avoidance and social fear. Cell and Tissue Research. 354 (1), 107-118 (2013).
- Wang, F., Kessels, H. W., Hu, H. The mouse that roared: neural mechanisms of social hierarchy. Trends in Neurosciences. 37 (11), 674-682 (2014).
- Endo, N., et al. Multiple animal positioning system shows that socially-reared mice influence the social proximity of isolation-reared cagemates. Communications Biology. 1 (1), 225 (2018).
- Netser, S., et al. Distinct dynamics of social motivation drive differential social behavior in laboratory rat and mouse strains. Nature Communications. 11 (1), 5908 (2020).
- Krimberg, J. S., Lumertz, F. S., Orso, R., Viola, T. W., de Almeida, R. M. M. Impact of social isolation on the oxytocinergic system: A systematic review and meta-analysis of rodent data. Neuroscience & Biobehavioral Reviews. 134, 104549 (2022).
- Mumtaz, F., Khan, M. I., Zubair, M., Dehpour, A. R. Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomedicine & Pharmacotherapy. 105, 1205-1222 (2018).
- Ranade, S. Comforting in mice. Nature Neuroscience. 24 (12), 1640 (2021).
- Al Omran, A. J., et al. Social isolation induces neuroinflammation and microglia overactivation, while dihydromyricetin prevents and improves them. Journal of Neuroinflammation. 19 (1), 2 (2022).
- Watanabe, S., et al. Dihydromyricetin improves social isolation-induced cognitive impairments and astrocytic changes in mice. Scientific Reports. 12 (1), 5899 (2022).
- Silva, J., et al. Modulation of hippocampal GABAergic neurotransmission and gephyrin levels by dihydromyricetin improves anxiety. Frontiers in Pharmacology. 11, 1008 (2020).
- Porter, V. R., et al. Frequency and characteristics of anxiety among patients with Alzheimer's disease and related dementias. Journal of Neuropsychiatry and Clinical Neuroscience. 15 (2), 180-186 (2003).
- Hossain, M. M., et al. Prevalence of anxiety and depression in South Asia during COVID-19: A systematic review and meta-analysis. Heliyon. 7 (4), 06677 (2021).
- . NHGRI. Knockout Mice Fact Sheet Available from: https://www.genome.gov/about-genomics/fact-sheets/Knockout-Mice-Fact-Sheet (2020)
- Takahashi, A. Social stress and aggression in murine models. Current Topics in Behavioral Neuroscience. 54, 181-208 (2022).
- Lam, R. W. Challenges in the treatment of anxiety disorders: beyond guidelines. International Journal of Psychiatry in Clinical Practice. 10, 18-24 (2006).
- Sullens, D. G., et al. Social isolation induces hyperactivity and exploration in aged female mice. PLoS One. 16 (2), 0245355 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon