Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de aislamiento social: un modelo no invasivo de estrés y ansiedad para roedores
En este artículo
Resumen
Aquí se presenta un modelo de ratón de ansiedad inducida por aislamiento social (SI) que utiliza ratones salvajes tipo C56BL / 6J para inducir estrés y comportamiento similar a la ansiedad con un manejo mínimo y sin procedimientos invasivos. Este modelo refleja los patrones de vida modernos de aislamiento social y es ideal para estudiar la ansiedad y los trastornos relacionados.
Resumen
Los trastornos de ansiedad son una de las principales causas de discapacidad en los Estados Unidos (EE.UU.). Los tratamientos actuales no siempre son efectivos y menos del 50% de los pacientes logran la remisión completa. Un paso crítico en el desarrollo de un nuevo ansiolítico es desarrollar y utilizar un modelo animal, como ratones, para estudiar cambios patológicos y probar objetivos, eficacia y seguridad de los medicamentos. Los enfoques actuales incluyen la manipulación genética, la administración crónica de moléculas que inducen ansiedad o la administración de estrés ambiental. Estos métodos, sin embargo, pueden no reflejar de manera realista la ansiedad inducida a lo largo de la vida diaria. Este protocolo describe un nuevo modelo de ansiedad, que imita los patrones intencionales o no intencionales de aislamiento social en la vida moderna. El modelo de ansiedad inducida por el aislamiento social minimiza las distracciones percibidas y la invasividad y utiliza ratones salvajes tipo C57BL / 6. En este protocolo, los ratones de 6 a 8 semanas de edad (machos y hembras) se alojan individualmente en jaulas opacas para bloquear visualmente el entorno externo, como los ratones vecinos, durante 4 semanas. No se proporcionan enriquecimientos ambientales (como juguetes), el material de cama se reduce en un 50%, cualquier tratamiento de medicamento se administra como una forma de agar y se minimiza la exposición / manipulación de los ratones. Los ratones socialmente aislados generados usando este protocolo exhiben un mayor comportamiento similar a la ansiedad, agresión, así como disminución de la cognición.
Introducción
Los trastornos de ansiedad representan la mayor clase y carga de enfermedades mentales en los Estados Unidos (EE.UU.), con costos anuales relacionados que superan los US $ 42 mil millones 1,2,3. En los últimos años, la ansiedad y el estrés han aumentado la prevalencia del suicidio y la ideación suicida en más del 16%4. Los pacientes con enfermedades crónicas son especialmente vulnerables a los efectos secundarios no deseados de la angustia mental o la reducción de la función cognitiva5. Los tratamientos actuales para la ansiedad incluyen psicoterapia, medicamentos o una combinación de ambos6. Sin embargo, a pesar de esta crisis, menos del 50% de los pacientes logran la remisión completa 6,7. Los ansiolíticos como las benzodiazepinas (BZ) y los inhibidores selectivos de la recaptación de serotonina (ISRS) tienen inconvenientes significativos o producen poco o ningún efecto inmediato8. Además, existe una relativa escasez de nuevos ansiolíticos en desarrollo, desafiada por el costoso y lento proceso de desarrollo de fármacos 9,10.
Un paso crítico en el proceso de desarrollo de medicamentos es el establecimiento y la utilización de un modelo animal, como ratones, para estudiar cambios patológicos y probar la seguridad y eficacia de los medicamentos11. Los enfoques actuales para establecer modelos animales de ansiedad incluyen 1) manipulación genética, como eliminar los receptores de serotonina (5-HT1A) o el receptor A del ácido γ-aminobutírico A (GABAAR) α subunidades12; 2) administrar crónicamente inductores de ansiedad como corticosterona o lipopolisacáridos (LPS)13,14; o 3) administrar el estrés ambiental, incluida la derrota social y la separación materna15. Sin embargo, estos métodos pueden no reflejar de manera realista la ansiedad inducida a lo largo de la vida diaria y, por lo tanto, pueden no ser adecuados para investigar el mecanismo subyacente o probar nuevos medicamentos.
Al igual que los humanos, los ratones y las ratas son criaturas altamente sociales16,17,18. El contacto social y las interacciones sociales son esenciales para una salud cerebral óptima y son fundamentales para el desarrollo neurológico adecuado durante el período de crianza19. Así, la separación materna o aislamiento social durante el período de crianza resulta en ratones que muestran más ansiedad, depresión y cambios en la neurotransmisión20. Además, el aseo social o allogrooming es una forma común de comportamiento de unión o reconfortante entre ratones y ratas que viven juntos21. Por lo tanto, la socialización es una parte integral de la vida de los roedores, y el aislamiento afecta negativamente su salud.
En este contexto, el presente protocolo describe un nuevo modelo de ansiedad para imitar los patrones intencionales o no intencionales de aislamiento social en la vida moderna. Este modelo de aislamiento social (SI) minimiza las distracciones percibidas y la invasividad y utiliza ratones adultos de tipo salvaje C57BL / 6 y ratas Sprague-Dawley (SD). El protocolo presentado aquí se centra en el modelo de ratones de ansiedad basado en nuestra evidencia publicada, que mostró un aumento del comportamiento similar a la ansiedad, agresión, disminución de la cognición y aumento de la neuroinflamación como resultado del aislamiento social22,23,24. El comportamiento similar a la ansiedad se confirma mediante las pruebas de laberinto elevado plus (EPM) y campo abierto (OF), mientras que la función cognitiva se mide mediante pruebas de reconocimiento de objetos novedosos (NOR) y reconocimiento de contexto novedoso (NCR). Este modelo es útil para investigar la ansiedad y los trastornos relacionados, pero también se puede adaptar o modificar para estudiar la progresión natural y el desarrollo del deterioro cognitivo leve, así como los cambios metabólicos debidos al estrés.
Protocolo
Todos los experimentos con animales se realizan de acuerdo con los protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad del Sur de California (USC), y todos los métodos se llevan a cabo de acuerdo con las pautas, regulaciones y recomendaciones relevantes.
1. Animales
- Obtener la aprobación de los comités de cuidado de animales apropiados para el estudio.
- Ajuste el vivero a un ciclo de luz oscura de 12 h con temperatura y humedad controladas entre 24 ± 2 ° C y 50% -60%, respectivamente.
- Obtener ratones machos y/o hembras salvajes de tipo C57BL/6 de 6 a 8 semanas de edad. Después de estratificar a los animales por sexo, asígnelos aleatoriamente a uno de los siguientes grupos: 1) casa grupal con tratamiento de vehículo; 2) casa grupal con tratamiento de drogas; 3) aislamiento social con tratamiento de vehículos; o 4) aislamiento social con tratamiento de drogas. Trate de tener al menos cuatro ratones por grupo por sexo (idealmente seis ratones por grupo).
- A la llegada de los ratones, aclimatarlos al vivero durante al menos 24 h. Los ratones deben llegar alojados individualmente.
2. Configuración de la jaula
- Para los animales de aislamiento social, tome una jaula de ratón estándar (75 en 2 pisos) y agregue la mitad de la cantidad de ropa de cama y una pieza de algodón de 1 en2 (o equivalente) para anidar.
- Envuelva las paredes exteriores de las jaulas en bolsas de plástico negras opacas (o equivalente) y asegúrelas con cinta adhesiva. Asegúrese de que los ratones no puedan ver el ambiente exterior o los animales circundantes.
- Deje la parte superior e inferior de la jaula sin envolver, a menos que los ratones puedan ver a los animales vecinos a través de ellos.
- Al envolver, asegúrese de que ningún segmento de la bolsa sea accesible desde el interior de la jaula. Esto es para evitar que el animal rompa la bolsa.
- No incluya ninguna forma de enriquecimiento ambiental, como juguetes o ruedas para correr.
- Coloque con cuidado y suavidad a los ratones en las jaulas preparadas. Proporcionar alimentos y agua ad libitum.
- Ratones de control domésticos en grupos de dos o tres en condiciones normales de jaula (es decir, en una jaula de ratón estándar [75 en 2 pisos], una cantidad completa de ropa de cama, una pieza de algodón 2 en2 o equivalente para anidar, y sin envoltura de bolsas opacas).
- Asegúrese de que los ratones alojados en grupo sean compatibles entre sí (es decir, que no haya peleas / conflictos entre ellos). Si se produce un conflicto, eliminar al agresor y excluir del análisis.
- Separe el alojamiento de ratones machos y hembras y mantenga la distancia entre los machos y las hembras para evitar la posibilidad de afectar los cambios en el nivel endocrino de los ratones hembra debido a su capacidad para oler.
3. Atención y tratamiento durante el período de aislamiento social
- Molestar a los ratones lo menos posible durante el período de aislamiento social. Realice cualquier procedimiento y actividad, como cambios de jaula y administración de tratamiento, durante su período activo (es decir, durante el ciclo oscuro) y bajo perturbaciones mínimas de ruido.
- Cambie las jaulas solo una vez a la semana durante el ciclo oscuro. La misma bolsa de plástico se puede quitar y volver a envolver en jaulas nuevas, a menos que haya daños significativos.
- Para ratones de control (alojados en grupo), cambie las jaulas dos veces por semana o más según sea necesario durante el ciclo oscuro.
- Asegúrese de que los ratones tengan suficiente agua y comida para que duren al menos 1 semana.
- Continúe aislando (o alojando en grupo) a los ratones durante al menos 4 semanas para ver resultados óptimos.
4. Preparación de fármaco / tratamiento de agar: un tratamiento farmacológico no invasivo
- Si los tratamientos (por ejemplo, medicamentos bajo investigación) están involucrados en el estudio, lo ideal es administrar el tratamiento con el menor manejo posible, utilizando formas de agar. Rutas como la inyección y el sonda oral infligen estrés adicional a los ratones que puede convertirse en un factor de confusión de ansiedad.
- Ajuste el momento y la frecuencia del tratamiento según la naturaleza del medicamento utilizado.
NOTA: En este estudio, se utilizó 2 mg/kg de dihidromiricetina (DHM, [(2R,3R)-3,5,7-trihidroxi-2-(3,4,5-trihidroxifenil)-2,3-dihidrocromo-4-ona]) como tratamiento. DHM se administró diariamente, en una sola dosis, durante la fase oscura de las últimas 2 semanas del período de aislamiento (o casa grupal). - Para preparar el tratamiento, agregue agar al 3% (p/v) en agua desionizada (DI) y caliente a ~90 °C para disolver. La solución burbujeará. Evite derrames o ebullición.
NOTA: Calentar la solución en un matraz de vidrio a intervalos cortos de 10 s de microondas.
PRECAUCIÓN: La cristalería estará caliente. Use el equipo de protección personal (EPP) adecuado cuando manipule la solución. - Agite la solución y asegure visualmente una solución homogénea.
NOTA: La solución debe ser translúcida y de color amarillo claro a marrón claro. - Mientras la solución aún está caliente, agregue sacarosa al 5% (p/v) y la dosis deseada de tratamiento. Sólo añadir sacarosa y no añadir el tratamiento de interés al control del vehículo.
- Agite la solución y asegure visualmente una solución homogénea. Luego, vierta la solución en un molde y deje enfriar a temperatura ambiente para que se solidifique. Si el tratamiento es sensible a la luz, asegúrese de protegerlo de la luz.
NOTA: La solución debe ser ligeramente viscosa. - Una vez solidificado, cortar el agar en cubos de 0,5 cm x 0,5 cm x 0,5 cm y almacenar a 4 °C hasta su administración.
- Para administrar el tratamiento, coloque un solo cubo en un bote de pesaje pequeño. Durante la fase oscura del ciclo de luz-oscuridad, coloque silenciosa y cuidadosamente el bote de pesaje de agar en jaulas individuales, sin tocar el mouse. Permite que el ratón consuma el agar.
NOTA: Los ratones suelen pasar de 15 a 45 minutos para consumir completamente el agar. - Confirme el consumo completo del agar y luego retire con cuidado el bote de pesaje de la jaula. Repita según sea necesario.
- Prepare cubos de agar semanalmente para mantenerlos frescos y evitar cualquier contaminación.
5. Análisis de comportamiento
- Realizar pruebas de comportamiento 24 h después del último día del período de aislamiento de 4 semanas (o más). Realice pruebas durante la fase oscura bajo iluminación roja indirecta y grabe con una cámara de video.
- Organice al menos tres personas para realizar la puntuación manual fuera de línea de manera doble ciego para minimizar el sesgo y el error.
- Laberinto elevado más (EPM)
- Prepare el aparato EPM. El aparato utilizado en este protocolo fue obtenido comercialmente (ver Tabla de Materiales) y hecho de plástico opaco con dos brazos abiertos y dos brazos cerrados (33 cm x 5 cm cada uno, brazos abiertos perpendiculares a los brazos cerrados) con una plataforma central de 5 cm x 5 cm. Elevar el aparato 50 cm por encima del suelo.
- Coloque al animal en el centro del aparato, frente a un brazo abierto. Permita que el animal explore durante 5 minutos y grabe su actividad con una cámara de video.
- Limpie el aparato después de cada animal limpiando bien todas las superficies con desinfectante (alcohol etílico al 70%). Asegúrese de que todos los excrementos de roedores se limpien.
- Puntúe el comportamiento de los ratones fuera de línea en función del tiempo que pasó en brazos abiertos, brazos cerrados y la plataforma central usando un cronómetro. Inicie el cronómetro cuando el mouse coloque al menos tres patas en el brazo o plataforma respectivos.
- Prueba de campo abierto (OF)
- Prepare el aparato OF. El aparato utilizado en este protocolo (ver Tabla de materiales) estaba hecho de plástico opaco que mide 50 cm x 50 cm x 38 cm (largo x ancho x alto).
- Dibuje cuadrículas cuadradas (10 cm x 10 cm cada una) en el campo para un total de 25 cuadrículas.
- Coloque al animal en el centro del campo y deje explorar durante 10 minutos. Grabe su actividad en una cámara de video.
- Limpie el aparato después de cada animal limpiando bien toda la superficie con desinfectante (alcohol etílico al 70%). Asegúrese de que todos los excrementos de roedores se limpien.
- Puntúe el comportamiento de los ratones sin conexión en función del tiempo pasado en la zona central, el tiempo pasado en las esquinas, la distancia total recorrida y el número de veces que el mouse se levantó.
- Use un cronómetro para registrar el tiempo que pasa en el centro o en la esquina. Inicie el cronómetro cuando el mouse coloque al menos tres patas en el área respectiva.
- Use un contador para registrar la distancia recorrida y la frecuencia de crianza. Cuente el número de cuadrados que ingresa el mouse (cuando el mouse coloca al menos tres patas en el cuadrado). Cuenta la crianza cuando el ratón se pone claramente de pie sobre sus patas traseras. No cuente cuando el ratón se levanta y se apoya contra las paredes o cuando se levanta para acicalarse.
- Prueba de reconocimiento de objetos novedosos (NOR)
- Realice esta prueba durante 3 días. El día 1, prepare un aparato de campo abierto de 50 cm x 50 cm x 38 cm (largo x ancho x alto). Coloque al animal en el centro del campo abierto y deje que se familiarice durante 5 minutos. Luego coloque al animal de nuevo en su jaula de origen.
- Limpie el aparato después de cada animal limpiando bien todas las superficies con desinfectante (alcohol etílico al 70%). Asegúrese de que todos los excrementos de roedores se limpien.
- El día 2, prepare el mismo aparato de campo abierto y coloque dos objetos idénticos, como un cubo pequeño. Colócalos simétricamente a unos 20 cm de distancia. Coloque al animal en el centro del aparato y deje explorar durante 5 min. Luego coloque al animal de nuevo en su jaula de origen.
- Limpie el aparato después de cada animal limpiando bien todas las superficies con desinfectante (alcohol etílico al 70%). Asegúrese de que todos los excrementos de roedores se limpien.
- El día 3, prepare el mismo aparato de campo abierto y uno de los objetos del día 2 (es decir, un cubo pequeño), que funcionará como el objeto familiar. Coloque otro objeto novedoso diferente, como una pirámide de madera, simétricamente del objeto familiar a unos 20 cm de distancia. Permita que el animal explore durante 3 minutos y grabe su actividad en una cámara de video.
- Limpie el aparato después de cada animal limpiando bien todas las superficies con desinfectante (alcohol etílico al 70%). Asegúrese de que todos los excrementos de roedores se limpien.
- Puntúe el comportamiento de los ratones fuera de línea en función del tiempo dedicado a explorar el objeto familiar y el objeto novedoso. Calcule el índice de reconocimiento de objetos (ORI%), donde
 ; tf y tn representan los tiempos de exploración de los objetos familiares y novedosos, respectivamente.
; tf y tn representan los tiempos de exploración de los objetos familiares y novedosos, respectivamente.
- Realice esta prueba durante 3 días. El día 1, prepare un aparato de campo abierto de 50 cm x 50 cm x 38 cm (largo x ancho x alto). Coloque al animal en el centro del campo abierto y deje que se familiarice durante 5 minutos. Luego coloque al animal de nuevo en su jaula de origen.
- Prueba de reconocimiento de contexto novedoso (NCR)
- Realice esta prueba durante 2 días. Prepare dos campos abiertos de forma distinta y dos pares de objetos de forma distinta. El aparato OF se puede utilizar como uno de los contextos (campo abierto). El otro contexto debe ser de tamaño similar pero forma diferente, como un campo abierto redondo.
- El día 1, coloque un par de objetos idénticos (es decir, dos cubos) en el contexto cuadrado y el otro par de objetos idénticos (es decir, dos pirámides) en el contexto redondo. Los objetos deben colocarse simétricamente a 15-20 cm de distancia.
- Coloque al animal en el centro y permita explorar durante 5 minutos en un contexto. Repita en el otro contexto. Luego, coloque al animal nuevamente en su jaula doméstica.
- Limpie el aparato después de cada animal limpiando bien todas las superficies con desinfectante (alcohol etílico al 70%). Asegúrese de que todos los excrementos de roedores se limpien.
- El día 2, intercambie uno de los objetos de un contexto con el otro (es decir, coloque un cubo y una pirámide en el contexto cuadrado, y un cubo y una pirámide en el contexto redondo).
- Coloque al animal en el centro y deje explorar durante 3 minutos. Grabe su actividad en una cámara de video. Los animales no necesitan ser registrados en ambos contextos.
- Limpie el aparato después de cada animal limpiando bien todas las superficies con desinfectante (alcohol etílico al 70%). Asegúrese de que todos los excrementos de roedores se limpien.
- Puntúe el comportamiento de los ratones fuera de línea en función del tiempo dedicado a explorar los distintos objetos. Calcule el índice de reconocimiento (RI%) como la proporción de tiempo dedicado a investigar el nuevo objeto "fuera de contexto" (es decir, la pirámide en el contexto cuadrado) frente al objeto familiar "en contexto" (es decir, el cubo en el contexto cuadrado).
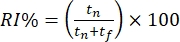 .
.
Resultados
Todos los resultados y cifras representativos fueron modificados de nuestras publicaciones recientes22,23. Para evaluar los efectos del aislamiento social sobre la ansiedad y el comportamiento exploratorio, se realizaron pruebas EPM e OF 24 h después de la fecha de finalización del período de aislamiento social de 4 semanas. Los ratones socialmente aislados pasaron significativamente menos tiempo en el brazo abierto (1,28 ± 0,17 min) en comparación con el co...
Discusión
Los pasos críticos en el protocolo incluyen la configuración adecuada de las jaulas de aislamiento social (es decir, envolver bolsas opacas y reducir la cantidad de ropa de cama), minimizar el manejo y la perturbación de los ratones durante todo el período de aislamiento y asegurarse de que los ratones obtengan y consuman el agar con el medicamento por completo. Es fundamental que la condición del vivero o de la vivienda se mantenga a una temperatura y humedad constantes, así como que se minimicen las inte...
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Este trabajo fue financiado por la subvención AA17991 del Instituto Nacional de Salud (a J.L.), Carefree Biotechnology Foundation (a J.L.), University of Southern California (USC), USC Graduate School Travel/Research Award (a S.W.) Beca de Misión Cultural de Arabia Saudita (a A.A.O.) y Programa de Becas de Profesiones de la Salud del Ejército (a A.S.S.).
Materiales
| Name | Company | Catalog Number | Comments |
| Black Plastic Bags | Office Depot | 791932 | 24" x 32" |
| Elevated Plus Maze | SD Instruments | NA | Black color |
| Open Field enclosure | SD Instruments | NA | White color |
| Select Agar | Invitrogen | 30391-023 | |
| Square cotton for nesting (nestlet) | Ancare Corporation | NC9365966 | Divide a 2" square piece into 4 pieces to create a 1" square piece for isolation group |
| Sucrose | Sigma | S1888-1KG | |
| Weigh boat | SIgma | HS1420A | Small, square white polystyrene |
Referencias
- Craske, M. G., et al. Anxiety disorders. Nature Reviews Disease Primers. 3 (1), 17024 (2017).
- Kasper, S., den Boer, J., Ad Sitsen, J. . Handbook of Depression and Anxiety: A Biological Approach. , (2003).
- Konnopka, A., König, H. Economic burden of anxiety disorders: a systematic review and meta-analysis. Pharmacoeconomics. 38 (1), 25-37 (2020).
- Batterham, P. J., et al. Effects of the COVID-19 pandemic on suicidal ideation in a representative Australian population sample-Longitudinal cohort study. Journal of Affective Disorders. 300, 385-391 (2022).
- Ismail, I. I., Kamel, W. A., Al-Hashel, J. Y. Association of COVID-19 pandemic and rate of cognitive decline in patients with dementia and mild cognitive impairment: a cross-sectional study. Gerontology and Geriatric Medicine. 7, 23337214211005223 (2021).
- . NIMH. Anxiety Disorders Available from: https://www.nimh.nih.gov/health/topics/anxiety-disorders/index.shtml (2018)
- Roy-Byrne, P. Treatment-refractory anxiety; definition, risk factors, and treatment challenges. Dialogues in Clinical Neuroscience. 17 (2), 191-206 (2015).
- Cassano, G. B., Baldini Rossi, N., Pini, S. Psychopharmacology of anxiety disorders. Dialogues in Clinical Neuroscience. 4 (3), 271-285 (2002).
- Garakani, A., et al. Pharmacotherapy of anxiety disorders: current and emerging treatment options. Frontiers in Psychiatry. 11, 595584 (2020).
- Hutson, P. H., Clark, J. A., Cross, A. J. CNS target identification and validation: avoiding the valley of death or naive optimism. Annual Review of Pharmacology and Toxicology. 57 (1), 171-187 (2017).
- Hart, P. C., Proetzel, G., Wiles, M. V., et al. Experimental models of anxiety for drug discovery and brain research. Mouse Models for Drug Discovery: Methods and Protocols. , 271-291 (2016).
- Scherma, M., Giunti, E., Fratta, W., Fadda, P. Gene knockout animal models of depression, anxiety and obsessive compulsive disorders. Psychiatric Genetics. 29 (5), 191-199 (2019).
- Liu, W. -. Z., et al. Identification of a prefrontal cortex-to-amygdala pathway for chronic stress-induced anxiety. Nature Communications. 11 (1), 2221 (2020).
- Zheng, Z. -. H., et al. Neuroinflammation induces anxiety- and depressive-like behavior by modulating neuronal plasticity in the basolateral amygdala. Brain, Behavior, and Immunity. 91, 505-518 (2021).
- Toth, I., Neumann, I. D. Animal models of social avoidance and social fear. Cell and Tissue Research. 354 (1), 107-118 (2013).
- Wang, F., Kessels, H. W., Hu, H. The mouse that roared: neural mechanisms of social hierarchy. Trends in Neurosciences. 37 (11), 674-682 (2014).
- Endo, N., et al. Multiple animal positioning system shows that socially-reared mice influence the social proximity of isolation-reared cagemates. Communications Biology. 1 (1), 225 (2018).
- Netser, S., et al. Distinct dynamics of social motivation drive differential social behavior in laboratory rat and mouse strains. Nature Communications. 11 (1), 5908 (2020).
- Krimberg, J. S., Lumertz, F. S., Orso, R., Viola, T. W., de Almeida, R. M. M. Impact of social isolation on the oxytocinergic system: A systematic review and meta-analysis of rodent data. Neuroscience & Biobehavioral Reviews. 134, 104549 (2022).
- Mumtaz, F., Khan, M. I., Zubair, M., Dehpour, A. R. Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomedicine & Pharmacotherapy. 105, 1205-1222 (2018).
- Ranade, S. Comforting in mice. Nature Neuroscience. 24 (12), 1640 (2021).
- Al Omran, A. J., et al. Social isolation induces neuroinflammation and microglia overactivation, while dihydromyricetin prevents and improves them. Journal of Neuroinflammation. 19 (1), 2 (2022).
- Watanabe, S., et al. Dihydromyricetin improves social isolation-induced cognitive impairments and astrocytic changes in mice. Scientific Reports. 12 (1), 5899 (2022).
- Silva, J., et al. Modulation of hippocampal GABAergic neurotransmission and gephyrin levels by dihydromyricetin improves anxiety. Frontiers in Pharmacology. 11, 1008 (2020).
- Porter, V. R., et al. Frequency and characteristics of anxiety among patients with Alzheimer's disease and related dementias. Journal of Neuropsychiatry and Clinical Neuroscience. 15 (2), 180-186 (2003).
- Hossain, M. M., et al. Prevalence of anxiety and depression in South Asia during COVID-19: A systematic review and meta-analysis. Heliyon. 7 (4), 06677 (2021).
- . NHGRI. Knockout Mice Fact Sheet Available from: https://www.genome.gov/about-genomics/fact-sheets/Knockout-Mice-Fact-Sheet (2020)
- Takahashi, A. Social stress and aggression in murine models. Current Topics in Behavioral Neuroscience. 54, 181-208 (2022).
- Lam, R. W. Challenges in the treatment of anxiety disorders: beyond guidelines. International Journal of Psychiatry in Clinical Practice. 10, 18-24 (2006).
- Sullens, D. G., et al. Social isolation induces hyperactivity and exploration in aged female mice. PLoS One. 16 (2), 0245355 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados