Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle d’isolement social : un modèle non invasif de stress et d’anxiété chez les rongeurs
Dans cet article
Résumé
Présenté ici est un modèle de souris d’anxiété induite par l’isolement social (SI) qui utilise des souris sauvages de type C56BL / 6J pour induire un comportement stressant et anxieux avec une manipulation minimale et sans procédures invasives. Ce modèle reflète les modes de vie modernes d’isolement social et est idéal pour étudier l’anxiété et les troubles connexes.
Résumé
Les troubles anxieux sont l’une des principales causes d’invalidité aux États-Unis. Les traitements actuels ne sont pas toujours efficaces et moins de 50% des patients obtiennent une rémission complète. Une étape critique dans le développement d’un nouvel anxiolytique consiste à développer et à utiliser un modèle animal, tel que des souris, pour étudier les changements pathologiques et tester la ou les cibles médicamenteuses, l’efficacité et l’innocuité. Les approches actuelles comprennent la manipulation génétique, l’administration chronique de molécules anxiogènes ou l’administration de stress environnemental. Ces méthodes, cependant, peuvent ne pas refléter de manière réaliste l’anxiété induite tout au long de la vie quotidienne. Ce protocole décrit un nouveau modèle d’anxiété, qui imite les modèles intentionnels ou non intentionnels d’isolement social dans la vie moderne. Le modèle d’anxiété induite par l’isolement social minimise les distractions perçues et le caractère envahissant et utilise des souris sauvages de type C57BL / 6. Dans ce protocole, les souris âgées de 6 à 8 semaines (mâles et femelles) sont logées seules dans des cages opaques pour bloquer visuellement l’environnement extérieur, comme les souris voisines, pendant 4 semaines. Aucun enrichissement de l’environnement (comme des jouets) n’est fourni, le matériel de litière est réduit de 50 %, tout traitement de médicament est administré sous forme de gélose et l’exposition et la manipulation des souris est minimisée. Les souris socialement isolées générées à l’aide de ce protocole présentent un comportement anxieux plus important, une agressivité et une diminution de la cognition.
Introduction
Les troubles anxieux représentent la plus grande classe et le plus grand fardeau de maladies mentales aux États-Unis, avec des coûts annuels connexes dépassant 42 milliards de dollars américains 1,2,3. Au cours des dernières années, l’anxiété et le stress ont augmenté la prévalence du suicide et des idées suicidaires de plus de 16 %4. Les patients atteints de maladies chroniques sont particulièrement vulnérables aux effets secondaires involontaires de la détresse mentale ou de la fonction cognitive réduite5. Les traitements actuels de l’anxiété comprennent la psychothérapie, les médicaments ou une combinaison des deux6. Cependant, malgré cette crise, moins de 50% des patients obtiennent une rémission complète 6,7. Les anxiolytiques tels que les benzodiazépines (BZ) et les inhibiteurs sélectifs du recaptage de la sérotonine (ISRS) présentent des inconvénients importants ou produisent peu ou pas d’effets immédiats8. De plus, il existe une pénurie relative de nouveaux anxiolytiques en cours de développement, mise à l’épreuve par le processus coûteux et long de développement de médicaments 9,10.
Une étape critique dans le processus de développement de médicaments est l’établissement et l’utilisation d’un modèle animal, tel que les souris, pour étudier les changements pathologiques et tester l’innocuité et l’efficacitédes médicaments 11. Les approches actuelles pour établir des modèles animaux d’anxiété comprennent 1) la manipulation génétique, comme l’élimination des récepteurs de la sérotonine (5-HT1A) ou du récepteur A de l’acide γ-aminobutyrique (GABAAR) α sous-unités12; 2) administrer de façon chronique des anxiogènes tels que la corticostérone ou les lipopolysaccharides (LPS)13,14; ou 3) administrer le stress environnemental, y compris la défaite sociale et la séparation maternelle15. Ces méthodes, cependant, peuvent ne pas refléter de manière réaliste l’anxiété induite tout au long de la vie quotidienne et peuvent donc ne pas convenir pour étudier le mécanisme sous-jacent ou tester de nouveaux médicaments.
Comme les humains, les souris et les rats sont des créatures très sociales16,17,18. Les contacts sociaux et les interactions sociales sont essentiels à une santé optimale du cerveau et sont essentiels au bon développement neurologique pendant la période d’élevage19. Ainsi, la séparation maternelle ou l’isolement social pendant la période d’élevage entraîne chez les souris plus d’anxiété, de dépression et de changements dans la neurotransmission20. De plus, le toilettage social ou le toilettage social est une forme courante de liaison ou de comportement réconfortant chez les souris et les rats qui vivent ensemble21. Ainsi, la socialisation fait partie intégrante de la vie des rongeurs et l’isolement a un impact négatif sur leur santé.
Dans ce contexte, le présent protocole décrit un nouveau modèle d’anxiété pour imiter les modèles intentionnels ou non intentionnels d’isolement social dans la vie moderne. Ce modèle d’isolement social (SI) minimise les distractions perçues et le caractère envahissant et utilise des souris adultes sauvages de type C57BL/6 et des rats Sprague-Dawley (SD). Le protocole présenté ici se concentre sur le modèle de souris anxieuses basé sur nos preuves publiées, qui ont montré une augmentation du comportement anxieux, de l’agressivité, une diminution de la cognition et une augmentation de la neuroinflammation à la suite de l’isolement social22,23,24. Le comportement anxieux est confirmé par les tests de labyrinthe plus élevé (EPM) et de champ ouvert (OF), tandis que la fonction cognitive est mesurée par des tests de reconnaissance de nouveaux objets (NOR) et de reconnaissance de nouveaux contextes (NCR). Ce modèle est utile pour étudier l’anxiété et les troubles connexes, mais peut également être adapté ou modifié pour étudier la progression naturelle et le développement de troubles cognitifs légers ainsi que les changements métaboliques dus au stress.
Protocole
Toutes les expériences sur les animaux sont effectuées conformément aux protocoles approuvés par le Comité institutionnel de soin et d’utilisation des animaux (IACUC) de l’Université de Californie du Sud (USC), et toutes les méthodes sont effectuées conformément aux directives, réglementations et recommandations pertinentes.
1. Animaux
- Obtenir l’approbation des comités de protection des animaux appropriés pour l’étude.
- Réglez le vivarium sur un cycle de 12 h à la lumière sombre avec une température et une humidité contrôlées entre 24 ± 2 °C et 50% à 60%, respectivement.
- Obtenir des souris sauvages mâles et/ou femelles de type C57BL/6 âgées de 6 à 8 semaines. Après avoir stratifié les animaux par sexe, assignez-les au hasard à l’un des groupes suivants: 1) maison de groupe avec traitement par véhicule; 2) maison de groupe avec traitement de la toxicomanie; 3) l’isolement social avec traitement du véhicule; ou 4) l’isolement social avec traitement de la toxicomanie. Visez au moins quatre souris par groupe et par sexe (idéalement six souris par groupe).
- À l’arrivée des souris, acclimatez-les au vivarium pendant au moins 24 h. Les souris doivent arriver logées seules.
2. Configuration de la cage
- Pour les animaux en isolement social, prenez une cage à souris standard (75 sur 2 au sol) et ajoutez la moitié de la litière et un morceau de coton 1 sur2 (ou l’équivalent) pour la nidification.
- Enveloppez les parois extérieures des cages dans des sacs en plastique opaques et noirs (ou l’équivalent) et fixez-les à l’aide de ruban adhésif. Assurez-vous que les souris ne peuvent pas voir l’environnement extérieur ou les animaux environnants.
- Laissez le haut et le bas de la cage non emballés, à moins que les souris ne puissent voir les animaux voisins à travers elles.
- Lors de l’emballage, assurez-vous qu’aucun segment du sac n’est accessible de l’intérieur de la cage. C’est pour empêcher l’animal de déchirer le sac.
- N’incluez aucune forme d’enrichissement de l’environnement, comme les jouets ou les roues de course.
- Placez soigneusement et doucement les souris dans les cages préparées. Fournir de la nourriture et de l’eau ad libitum.
- Souris témoins domestiques en groupes de deux ou trois dans des conditions normales de cage (c.-à-d. dans une cage à souris standard [75 dans2 étages], une quantité complète de litière, un morceau de coton 2 en2 ou l’équivalent pour la nidification, et aucun emballage de sacs opaques).
- Assurez-vous que les souris hébergées en groupe sont compatibles les unes avec les autres (c.-à-d. qu’il n’y a pas de bagarres ou de conflits entre elles). En cas de conflit, retirez l’agresseur et excluez-le de l’analyse.
- Séparez le logement des souris mâles et femelles et gardez une distance entre les mâles et les femelles pour éviter la possibilité d’affecter les changements de niveau endocrinien des souris femelles en raison de leur capacité à sentir.
3. Soins et traitement pendant la période d’isolement social
- Dérangez les souris le moins possible pendant la période d’isolement social. Effectuer toutes les procédures et activités, telles que les changements de cage et l’administration du traitement, pendant leur période active (c.-à-d. pendant le cycle sombre) et sous des perturbations sonores minimales.
- Changez les cages seulement une fois par semaine pendant le cycle sombre. Le même sac en plastique peut être retiré et réemballé dans de nouvelles cages, à moins de dommages importants.
- Pour les souris témoins (hébergées en groupe), changez les cages deux fois par semaine ou plus au besoin pendant le cycle sombre.
- Assurez-vous que les souris ont beaucoup d’eau et de nourriture pour durer au moins 1 semaine.
- Continuez à isoler (ou à héberger en groupe) les souris pendant au moins 4 semaines pour obtenir des résultats optimaux.
4. Préparation médicamenteuse / traitement par gélose - un traitement médicamenteux non invasif
- Si des traitements (p. ex. des médicaments à l’étude) sont impliqués dans l’étude, idéalement administrer le traitement avec le moins de manipulation possible, en utilisant des formes de gélose . Des voies telles que l’injection et le gavage oral infligent un stress supplémentaire aux souris qui peut devenir un facteur de confusion de l’anxiété.
- Ajustez le moment et la fréquence du traitement en fonction de la nature du médicament utilisé.
REMARQUE : Dans cette étude, 2 mg/kg de dihydromyricétine (DHM, [(2R,3R)-3,5,7-trihydroxy-2-(3,4,5-trihydroxyphényl)-2,3-dihydrochromène-4-one]) ont été utilisés comme traitement. La DHM a été administrée quotidiennement, en une seule dose, pendant la phase sombre des 2 dernières semaines de la période d’isolement (ou de maison de groupe). - Pour préparer le traitement, ajouter 3 % (p/v) de gélose dans de l’eau désionisée (DI) et chauffer à ~90 °C pour dissoudre. La solution va buller. Prévenir les déversements ou l’ébullition.
NOTE: Chauffer la solution dans une fiole en verre par de courts intervalles de 10 s au micro-ondes.
ATTENTION : La verrerie sera chaude. Porter un équipement de protection individuelle (EPI) approprié lors de la manipulation de la solution. - Faites tourbillonner la solution et assurez-vous visuellement d’une solution homogène.
REMARQUE: La solution doit être translucide et de couleur jaune clair à brun clair. - Pendant que la solution est encore chaude, ajouter 5% (p/v) de saccharose et la dose de traitement désirée. Ajoutez seulement du saccharose et n’ajoutez pas le traitement d’intérêt à la commande du véhicule.
- Faites tourbillonner la solution et assurez-vous visuellement d’une solution homogène. Ensuite, versez la solution dans un moule et laissez refroidir à température ambiante pour solidifier. Si le traitement est sensible à la lumière, assurez-vous de le protéger de la lumière.
REMARQUE: La solution doit être légèrement visqueuse. - Une fois solidifiée, couper la gélose en cubes de 0,5 cm x 0,5 cm x 0,5 cm et conserver à 4 °C jusqu’à administration.
- Pour administrer le traitement, placez un seul cube sur un petit bateau de pesée. Pendant la phase sombre du cycle lumière-obscurité, placez tranquillement et soigneusement le bateau de pesée d’agar dans des cages individuelles, sans toucher la souris. Laissez la souris consommer l’agar.
REMARQUE: Les souris passent généralement 15 à 45 minutes à consommer complètement la gélose agar. - Confirmez la consommation complète de la gélose, puis retirez soigneusement le bateau de pesée de la cage. Répétez l’opération si nécessaire.
- Préparez des cubes de gélose chaque semaine pour les garder fraîches et éviter toute contamination.
5. Analyse du comportement
- Effectuez des tests comportementaux 24 h après le dernier jour de la période d’isolement de 4 semaines (ou plus). Effectuez des tests pendant la phase sombre sous éclairage rouge indirect et enregistrez avec une caméra vidéo.
- Demandez à au moins trois personnes d’effectuer une notation manuelle hors ligne de manière à double insu afin de minimiser les biais et les erreurs.
- Labyrinthe surélevé plus (EPM)
- Préparez l’appareil EPM. L’appareil utilisé dans ce protocole a été obtenu commercialement (voir Tableau des matériaux) et fait de plastique opaque avec deux bras ouverts et deux bras fermés (33 cm x 5 cm chacun, bras ouverts perpendiculaires aux bras fermés) avec une plate-forme centrale de 5 cm x 5 cm. Élever l’appareil à 50 cm au-dessus du sol.
- Placez l’animal au centre de l’appareil, face à un bras ouvert. Laissez l’animal explorer pendant 5 minutes et enregistrez son activité à l’aide d’une caméra vidéo.
- Nettoyez l’appareil après chaque animal en essuyant soigneusement toutes les surfaces avec un désinfectant (alcool éthylique à 70%). Assurez-vous que toutes les excréments de rongeurs sont essuyés.
- Évaluez le comportement des souris hors ligne en fonction du temps passé à bras ouverts, bras fermés et plate-forme centrale à l’aide d’un chronomètre. Démarrez le chronomètre lorsque la souris place au moins trois pattes dans le bras ou la plate-forme respective.
- Test en champ ouvert (OF)
- Préparez l’appareil du FO. L’appareil utilisé dans ce protocole (voir le tableau des matériaux) était en plastique opaque mesurant 50 cm x 50 cm x 38 cm (longueur x largeur x hauteur).
- Dessinez des grilles carrées (10 cm x 10 cm chacune) sur le terrain pour un total de 25 grilles.
- Placez l’animal au centre du champ et laissez-le explorer pendant 10 min. Enregistrez leur activité sur une caméra vidéo.
- Nettoyez l’appareil après chaque animal en essuyant soigneusement toutes les surfaces avec un désinfectant (alcool éthylique à 70%). Assurez-vous que toutes les excréments de rongeurs sont essuyés.
- Évaluez le comportement des souris hors ligne en fonction du temps passé dans la zone centrale, du temps passé dans les coins, de la distance totale parcourue et du nombre de fois que la souris a élevé.
- Utilisez un chronomètre pour enregistrer le temps passé au centre ou dans un coin. Démarrez le chronomètre lorsque la souris place au moins trois pattes dans la zone respective.
- Utilisez un compteur pour noter la distance parcourue et la fréquence d’élevage. Comptez le nombre de carrés saisis par la souris (lorsque la souris place au moins trois pattes dans le carré). Comptez l’élevage lorsque la souris se lève clairement sur ses pattes postérieures. Ne comptez pas quand la souris se lève et s’appuie contre les murs ou quand elle se lève pour se toiletter.
- Test de reconnaissance de nouveaux objets (NOR)
- Effectuez ce test sur 3 jours. Le jour 1, préparez un appareil en plein champ de 50 cm x 50 cm x 38 cm (longueur x largeur x hauteur). Placez l’animal au centre du champ ouvert et laissez-le se familiariser pendant 5 min. Ensuite, replacez l’animal dans sa cage familiale.
- Nettoyez l’appareil après chaque animal en essuyant soigneusement toutes les surfaces avec un désinfectant (alcool éthylique à 70%). Assurez-vous que toutes les excréments de rongeurs sont essuyés.
- Le jour 2, préparez le même appareil en plein champ et placez deux objets identiques, comme un petit cube. Placez-les symétriquement à environ 20 cm l’un de l’autre. Placez l’animal au centre de l’appareil et laissez explorer pendant 5 min. Ensuite, replacez l’animal dans sa cage familiale.
- Nettoyez l’appareil après chaque animal en essuyant soigneusement toutes les surfaces avec un désinfectant (alcool éthylique à 70%). Assurez-vous que toutes les excréments de rongeurs sont essuyés.
- Le jour 3, préparez le même appareil en champ ouvert et l’un des objets du jour 2 (c.-à-d. petit cube), qui fonctionnera comme l’objet familier. Placez un autre objet nouveau différent, tel qu’une pyramide en bois, symétriquement de l’objet familier à environ 20 cm de distance. Laissez l’animal explorer pendant 3 minutes et enregistrez son activité sur une caméra vidéo.
- Nettoyez l’appareil après chaque animal en essuyant soigneusement toutes les surfaces avec un désinfectant (alcool éthylique à 70%). Assurez-vous que toutes les excréments de rongeurs sont essuyés.
- Évaluez le comportement des souris hors ligne en fonction du temps passé à explorer l’objet familier et le nouvel objet. Calculez l’indice de reconnaissance d’objets (ORI%), où
 ; tf et tn représentent respectivement les temps d’exploration des objets familiers et nouveaux.
; tf et tn représentent respectivement les temps d’exploration des objets familiers et nouveaux.
- Effectuez ce test sur 3 jours. Le jour 1, préparez un appareil en plein champ de 50 cm x 50 cm x 38 cm (longueur x largeur x hauteur). Placez l’animal au centre du champ ouvert et laissez-le se familiariser pendant 5 min. Ensuite, replacez l’animal dans sa cage familiale.
- Test de reconnaissance de contexte novateur (NCR)
- Effectuez ce test sur 2 jours. Préparez deux champs ouverts de forme distincte et deux paires d’objets de forme distincte. L’appareil OF peut être utilisé comme l’un des contextes (champ ouvert). L’autre contexte doit être de taille similaire mais de forme différente, comme un champ ouvert rond.
- Le jour 1, placez une paire d’objets identiques (c.-à-d. deux cubes) dans le contexte carré et l’autre paire d’objets identiques (c.-à-d. deux pyramides) dans le contexte rond. Les objets doivent être placés symétriquement à 15-20 cm de distance.
- Placez l’animal au centre et laissez-le explorer pendant 5 min dans un contexte. Répétez dans l’autre contexte. Ensuite, replacez l’animal dans sa cage familiale.
- Nettoyez l’appareil après chaque animal en essuyant soigneusement toutes les surfaces avec un désinfectant (alcool éthylique à 70%). Assurez-vous que toutes les excréments de rongeurs sont essuyés.
- Le jour 2, échangez l’un des objets d’un contexte avec l’autre (c’est-à-dire placez un cube et une pyramide dans le contexte carré, et un cube et une pyramide dans le contexte rond).
- Placez l’animal au centre et laissez-le explorer pendant 3 min. Enregistrez leur activité sur une caméra vidéo. Les animaux n’ont pas besoin d’être enregistrés dans les deux contextes.
- Nettoyez l’appareil après chaque animal en essuyant soigneusement toutes les surfaces avec un désinfectant (alcool éthylique à 70%). Assurez-vous que toutes les excréments de rongeurs sont essuyés.
- Évaluez le comportement des souris hors ligne en fonction du temps passé à explorer les objets distincts. Calculez l’indice de reconnaissance (IR%) comme la proportion de temps passé à étudier le nouvel objet « hors contexte » (c.-à-d. la pyramide dans le contexte carré) par rapport à l’objet familier « dans le contexte » (c.-à-d. le cube dans le contexte carré).
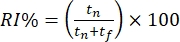 .
.
Résultats
Tous les résultats et chiffres représentatifs ont été modifiés à partir de nos publications récentes22,23. Pour évaluer les effets de l’isolement social sur l’anxiété et le comportement exploratoire, des tests EPM et OF ont été effectués 24 heures après la date de fin de la période d’isolement social de 4 semaines. Les souris socialement isolées ont passé significativement moins de temps dans le bras ouvert (1,28 ± 0,17 min) par rapport au...
Discussion
Les étapes critiques du protocole comprennent la mise en place adéquate des cages d’isolement social (c.-à-d. l’emballage de sacs opaques et la réduction de la quantité de litière), la minimisation de la manipulation et de la perturbation des souris tout au long de la période d’isolement et l’assurance que les souris obtiennent et consomment complètement la gélose avec du médicament. Il est essentiel que le vivarium ou l’état du logement soit maintenu à une température et une humidité con...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été financé par la subvention AA17991 du National Institute of Health (à J.L.), Carefree Biotechnology Foundation (à J.L.), University of Southern California (USC), USC Graduate School Travel/Research Award (à S.W.) Saudi Arabia Cultural Mission Scholarship (à A.A.O.) et Army Health Professions Scholarship Program (à A.S.S.).
matériels
| Name | Company | Catalog Number | Comments |
| Black Plastic Bags | Office Depot | 791932 | 24" x 32" |
| Elevated Plus Maze | SD Instruments | NA | Black color |
| Open Field enclosure | SD Instruments | NA | White color |
| Select Agar | Invitrogen | 30391-023 | |
| Square cotton for nesting (nestlet) | Ancare Corporation | NC9365966 | Divide a 2" square piece into 4 pieces to create a 1" square piece for isolation group |
| Sucrose | Sigma | S1888-1KG | |
| Weigh boat | SIgma | HS1420A | Small, square white polystyrene |
Références
- Craske, M. G., et al. Anxiety disorders. Nature Reviews Disease Primers. 3 (1), 17024 (2017).
- Kasper, S., den Boer, J., Ad Sitsen, J. . Handbook of Depression and Anxiety: A Biological Approach. , (2003).
- Konnopka, A., König, H. Economic burden of anxiety disorders: a systematic review and meta-analysis. Pharmacoeconomics. 38 (1), 25-37 (2020).
- Batterham, P. J., et al. Effects of the COVID-19 pandemic on suicidal ideation in a representative Australian population sample-Longitudinal cohort study. Journal of Affective Disorders. 300, 385-391 (2022).
- Ismail, I. I., Kamel, W. A., Al-Hashel, J. Y. Association of COVID-19 pandemic and rate of cognitive decline in patients with dementia and mild cognitive impairment: a cross-sectional study. Gerontology and Geriatric Medicine. 7, 23337214211005223 (2021).
- . NIMH. Anxiety Disorders Available from: https://www.nimh.nih.gov/health/topics/anxiety-disorders/index.shtml (2018)
- Roy-Byrne, P. Treatment-refractory anxiety; definition, risk factors, and treatment challenges. Dialogues in Clinical Neuroscience. 17 (2), 191-206 (2015).
- Cassano, G. B., Baldini Rossi, N., Pini, S. Psychopharmacology of anxiety disorders. Dialogues in Clinical Neuroscience. 4 (3), 271-285 (2002).
- Garakani, A., et al. Pharmacotherapy of anxiety disorders: current and emerging treatment options. Frontiers in Psychiatry. 11, 595584 (2020).
- Hutson, P. H., Clark, J. A., Cross, A. J. CNS target identification and validation: avoiding the valley of death or naive optimism. Annual Review of Pharmacology and Toxicology. 57 (1), 171-187 (2017).
- Hart, P. C., Proetzel, G., Wiles, M. V., et al. Experimental models of anxiety for drug discovery and brain research. Mouse Models for Drug Discovery: Methods and Protocols. , 271-291 (2016).
- Scherma, M., Giunti, E., Fratta, W., Fadda, P. Gene knockout animal models of depression, anxiety and obsessive compulsive disorders. Psychiatric Genetics. 29 (5), 191-199 (2019).
- Liu, W. -. Z., et al. Identification of a prefrontal cortex-to-amygdala pathway for chronic stress-induced anxiety. Nature Communications. 11 (1), 2221 (2020).
- Zheng, Z. -. H., et al. Neuroinflammation induces anxiety- and depressive-like behavior by modulating neuronal plasticity in the basolateral amygdala. Brain, Behavior, and Immunity. 91, 505-518 (2021).
- Toth, I., Neumann, I. D. Animal models of social avoidance and social fear. Cell and Tissue Research. 354 (1), 107-118 (2013).
- Wang, F., Kessels, H. W., Hu, H. The mouse that roared: neural mechanisms of social hierarchy. Trends in Neurosciences. 37 (11), 674-682 (2014).
- Endo, N., et al. Multiple animal positioning system shows that socially-reared mice influence the social proximity of isolation-reared cagemates. Communications Biology. 1 (1), 225 (2018).
- Netser, S., et al. Distinct dynamics of social motivation drive differential social behavior in laboratory rat and mouse strains. Nature Communications. 11 (1), 5908 (2020).
- Krimberg, J. S., Lumertz, F. S., Orso, R., Viola, T. W., de Almeida, R. M. M. Impact of social isolation on the oxytocinergic system: A systematic review and meta-analysis of rodent data. Neuroscience & Biobehavioral Reviews. 134, 104549 (2022).
- Mumtaz, F., Khan, M. I., Zubair, M., Dehpour, A. R. Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomedicine & Pharmacotherapy. 105, 1205-1222 (2018).
- Ranade, S. Comforting in mice. Nature Neuroscience. 24 (12), 1640 (2021).
- Al Omran, A. J., et al. Social isolation induces neuroinflammation and microglia overactivation, while dihydromyricetin prevents and improves them. Journal of Neuroinflammation. 19 (1), 2 (2022).
- Watanabe, S., et al. Dihydromyricetin improves social isolation-induced cognitive impairments and astrocytic changes in mice. Scientific Reports. 12 (1), 5899 (2022).
- Silva, J., et al. Modulation of hippocampal GABAergic neurotransmission and gephyrin levels by dihydromyricetin improves anxiety. Frontiers in Pharmacology. 11, 1008 (2020).
- Porter, V. R., et al. Frequency and characteristics of anxiety among patients with Alzheimer's disease and related dementias. Journal of Neuropsychiatry and Clinical Neuroscience. 15 (2), 180-186 (2003).
- Hossain, M. M., et al. Prevalence of anxiety and depression in South Asia during COVID-19: A systematic review and meta-analysis. Heliyon. 7 (4), 06677 (2021).
- . NHGRI. Knockout Mice Fact Sheet Available from: https://www.genome.gov/about-genomics/fact-sheets/Knockout-Mice-Fact-Sheet (2020)
- Takahashi, A. Social stress and aggression in murine models. Current Topics in Behavioral Neuroscience. 54, 181-208 (2022).
- Lam, R. W. Challenges in the treatment of anxiety disorders: beyond guidelines. International Journal of Psychiatry in Clinical Practice. 10, 18-24 (2006).
- Sullens, D. G., et al. Social isolation induces hyperactivity and exploration in aged female mice. PLoS One. 16 (2), 0245355 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon