É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo de Isolamento Social: Um Modelo de Roedores Não Invasivo de Estresse e Ansiedade
Neste Artigo
Resumo
Apresentamos aqui um modelo de rato de ansiedade induzido por isolamento social (SI) que utiliza camundongos selvagens do tipo C56BL/6J para induzir estresse e comportamento semelhante à ansiedade com manuseio mínimo e sem procedimentos invasivos. Este modelo reflete os padrões da vida moderna de isolamento social e é ideal para estudar ansiedade e distúrbios relacionados.
Resumo
Os transtornos de ansiedade são uma das principais causas de incapacidade nos Estados Unidos (EUA). Os tratamentos atuais nem sempre são eficazes e menos de 50% dos pacientes atingem a remissão completa. Um passo crítico no desenvolvimento de um novo ansiolítico é desenvolver e utilizar um modelo animal, como camundongos, para estudar mudanças patológicas e testar alvo(s) de drogas, eficácia e segurança. As abordagens atuais incluem manipulação genética, administração crônica de moléculas indutoras de ansiedade ou administração de estresse ambiental. Esses métodos, no entanto, podem não refletir realisticamente a ansiedade induzida ao longo da vida diária. Este protocolo descreve um novo modelo de ansiedade, que imita os padrões intencionais ou não intencionais de isolamento social na vida moderna. O modelo de ansiedade induzida pelo isolamento social minimiza as distrações percebidas e a invasividade e utiliza camundongos selvagens do tipo C57BL/6. Neste protocolo, camundongos de 6 a 8 semanas de idade (macho e fêmea) são alojados individualmente em gaiolas opacas para bloquear visualmente o ambiente externo, como camundongos vizinhos, por 4 semanas. Nenhum enriquecimento ambiental (como brinquedos) é fornecido, o material de cama é reduzido em 50%, qualquer tratamento da droga é administrado como uma forma de ágar e a exposição / manuseio dos ratos é minimizada. Camundongos socialmente isolados gerados usando este protocolo exibem maior comportamento semelhante à ansiedade, agressão, bem como diminuição da cognição.
Introdução
Os transtornos de ansiedade representam a maior classe e carga de doenças mentais nos Estados Unidos (EUA), com custos anuais relacionados superiores a US$ 42 bilhões 1,2,3. Nos últimos anos, a ansiedade e o estresse aumentaram a prevalência de suicídio e ideação suicida em mais de 16%4. Pacientes com doenças crônicas são especialmente vulneráveis a efeitos secundários não intencionais de sofrimento mental ou função cognitiva reduzida5. Os tratamentos atuais para a ansiedade incluem psicoterapia, medicamentos ou uma combinação de ambos6. No entanto, apesar dessa crise, menos de 50% dos pacientes atingem a remissão completa 6,7. Ansiolíticos como benzodiazepínicos (BZs) e inibidores seletivos da recaptação da serotonina (ISRSs) têm desvantagens significativas ou produzem pouco ou nenhum efeito imediato8. Além disso, há uma relativa escassez de novos ansiolíticos em desenvolvimento, desafiados pelo dispendioso e demorado processo de desenvolvimento de medicamentos 9,10.
Um passo crítico no processo de desenvolvimento de medicamentos é o estabelecimento e a utilização de um modelo animal, como camundongos, para estudar alterações patológicas e testar a segurança e a eficácia dos medicamentos11. As abordagens atuais para o estabelecimento de modelos animais de ansiedade incluem 1) manipulação genética, como nocautear os receptores de serotonina (5-HT1A) ou o receptor de ácido γ-aminobutírico A (GABAAR) α subunidades12; 2) administração crônica de indutores de ansiedade, como corticosterona ou lipopolissacarídeos (LPS)13,14; ou 3) administrar estresse ambiental, incluindo derrota social e separação materna15. Esses métodos, no entanto, podem não refletir realisticamente a ansiedade induzida ao longo da vida diária e, portanto, podem não ser adequados para investigar o mecanismo subjacente ou testar novas drogas.
Assim como os humanos, camundongos e ratos são criaturas altamente sociais16,17,18. O contato social e as interações sociais são essenciais para a saúde cerebral ideal e são críticos para o neurodesenvolvimento adequado durante o período de criação19. Assim, a separação materna ou isolamento social durante o período de criação resulta em camundongos que apresentam mais ansiedade, depressão e alterações na neurotransmissão20. Além disso, o allogrooming social ou allogrooming é uma forma comum de comportamento de vínculo ou conforto entre camundongos e ratos que vivem juntos21. Assim, a socialização é parte integrante da vida dos roedores, e o isolamento afeta negativamente sua saúde.
Nesse contexto, o presente protocolo descreve um novo modelo de ansiedade para imitar os padrões intencionais ou não intencionais de isolamento social na vida moderna. Este modelo de isolamento social (SI) minimiza as distrações percebidas e a invasividade e utiliza camundongos adultos do tipo selvagem C57BL/6 e ratos Sprague-Dawley (SD). O protocolo aqui apresentado enfoca o modelo de camundongos de ansiedade com base em nossas evidências publicadas, que mostraram aumento do comportamento semelhante à ansiedade, agressão, diminuição da cognição e aumento da neuroinflamação como resultado do isolamento social22,23,24. O comportamento semelhante à ansiedade é confirmado pelos testes de labirinto elevado (EPM) e campo aberto (OF), enquanto a função cognitiva é medida por novos testes de reconhecimento de objetos (NOR) e reconhecimento de contexto (NCR). Este modelo é útil para investigar ansiedade e distúrbios relacionados, mas também pode ser adaptado ou modificado para estudar a progressão natural e o desenvolvimento de comprometimento cognitivo leve, bem como alterações metabólicas devido ao estresse.
Protocolo
Todos os experimentos em animais são realizados de acordo com os protocolos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade do Sul da Califórnia (USC), e todos os métodos são realizados de acordo com diretrizes, regulamentos e recomendações relevantes.
1. Animais
- Obter a aprovação dos comitês de cuidados com os animais apropriados para o estudo.
- Ajuste o biotério para um ciclo escuro-claro de 12 h com temperatura e umidade controladas entre 24 ± 2 °C e 50%-60%, respectivamente.
- Obtenha camundongos machos e/ou fêmeas do tipo selvagem C57BL/6 com idade entre 6-8 semanas. Após estratificação dos animais por sexo, atribua-os aleatoriamente a um dos seguintes grupos: 1) casa de grupo com tratamento de veículo; 2) casa de grupo com tratamento medicamentoso; 3) isolamento social com tratamento veicular; ou 4) isolamento social com tratamento medicamentoso. Aponte para pelo menos quatro ratos por grupo por sexo (idealmente seis ratos por grupo).
- Após a chegada dos ratos, aclimatá-los ao biotério por pelo menos 24 h. Os ratos devem chegar alojados isoladamente.
2. Configuração da gaiola
- Para animais de isolamento social, pegue uma gaiola de rato padrão (75 em 2 espaços no chão) e adicione metade da quantidade de roupa de cama e um pedaço de algodão 1 em2 (ou equivalente) para nidificação.
- Envolva as paredes externas das gaiolas em sacos plásticos pretos opacos (ou equivalentes) e prenda usando fita adesiva. Certifique-se de que os ratos não possam ver o ambiente externo ou os animais ao redor.
- Deixe a parte superior e inferior da gaiola desembrulhadas, a menos que os ratos possam ver os animais vizinhos através deles.
- Ao embrulhar, certifique-se de que nenhum segmento do saco seja acessível a partir do interior da gaiola. Isso é para evitar que o animal rasgue a bolsa.
- Não inclua qualquer forma de enriquecimento ambiental, como brinquedos ou rodas de corrida.
- Coloque com cuidado e gentileza os ratos nas gaiolas preparadas. Fornecer comida e água ad libitum.
- Ratos de controle doméstico em grupos de dois ou três em condições normais de enjaulamento (ou seja, em uma gaiola de rato padrão [75 em 2 andares], uma quantidade total de cama, um pedaço de algodão2 em2 ou equivalente para nidificação e sem embrulho de sacos opacos).
- Certifique-se de que os ratos alojados em grupo sejam compatíveis entre si (ou seja, não haja brigas/conflitos entre eles). Se ocorrer conflito, remova o agressor e exclua da análise.
- Separe o alojamento de camundongos machos e fêmeas e mantenha distância entre os machos e as fêmeas para evitar a possibilidade de afetar as mudanças no nível endócrino de camundongos fêmeas devido à sua capacidade de cheirar.
3. Cuidados e tratamento durante o período de isolamento social
- Perturbe os ratos o mínimo possível durante o período de isolamento social. Realizar quaisquer procedimentos e atividades, como mudanças de gaiola e administração de tratamento, durante seu período ativo (ou seja, durante o ciclo escuro) e sob distúrbios mínimos de ruído.
- Troque as gaiolas apenas uma vez por semana durante o ciclo escuro. O mesmo saco plástico pode ser removido e reembrulhado em novas gaiolas, a menos que haja danos significativos.
- Para ratos de controle (alojados em grupo), troque as gaiolas duas vezes por semana ou mais, conforme necessário, durante o ciclo escuro.
- Certifique-se de que os ratos tenham muita água e comida para durar pelo menos 1 semana.
- Continue isolando (ou agrupando o alojamento) dos ratos por pelo menos 4 semanas para ver os melhores resultados.
4. Preparação de ágar/fármaco - um tratamento medicamentoso não invasivo
- Se os tratamentos (por exemplo, medicamentos sob investigação) estiverem envolvidos no estudo, idealmente administre o tratamento com o mínimo de manuseio possível, utilizando formas de ágar. Rotas como injeção e gavagem oral infligem estresse adicional aos camundongos que podem se tornar um fator de confusão de ansiedade.
- Ajuste o tempo e a frequência do tratamento com base na natureza da droga usada.
NOTA: Neste estudo, 2 mg/kg de di-hidromiricetina (DHM, [(2R,3R)-3,5,7-trihidroxi-2-(3,4,5-trihidroxifenil)-2,3-diidrocromo-4-ona]) foram utilizados como tratamento. DHM foi administrado diariamente, em dose única, durante a fase escura das últimas 2 semanas do período de isolamento (ou casa de grupo). - Para preparar o tratamento, adicione 3% (p/v) de ágar em água deionizada (DI) e aqueça a ~90 °C para dissolver. A solução vai borbulhar. Evite derramamento ou fervura.
NOTA: Aqueça a solução num balão de vidro através de intervalos curtos de 10 s de micro-ondas.
CUIDADO: Os copos estarão quentes. Use equipamentos de proteção individual (EPI) apropriados ao manusear a solução. - Gire a solução e garanta visualmente uma solução homogênea.
NOTA: A solução deve ser translúcida e de coloração amarelo claro a castanho claro. - Enquanto a solução ainda estiver quente, adicione 5% (p/v) de sacarose e a dose desejada de tratamento. Adicione apenas sacarose e não adicione o tratamento de interesse ao controle do veículo.
- Gire a solução e garanta visualmente uma solução homogênea. Em seguida, despeje a solução em um molde e deixe esfriar à temperatura ambiente para solidificar. Se o tratamento for sensível à luz, certifique-se de protegê-lo da luz.
NOTA: A solução deve ser ligeiramente viscosa. - Uma vez solidificado, corte o ágar em cubos de 0,5 cm x 0,5 cm x 0,5 cm e guarde a 4 °C até à administração.
- Para administrar o tratamento, coloque um único cubo em um pequeno barco de pesagem. Durante a fase escura do ciclo claro-escuro, coloque silenciosa e cuidadosamente o barco pesado em ágar em gaiolas individuais, sem tocar no mouse. Permita que o mouse consuma o ágar.
NOTA: Os ratos normalmente gastam 15-45 minutos para consumir completamente o ágar. - Confirme o consumo completo do ágar e, em seguida, remova cuidadosamente o barco de pesagem da gaiola. Repita conforme necessário.
- Prepare cubos de ágar semanalmente para se manter fresco e evitar qualquer contaminação.
5. Análise do comportamento
- Realizar testes comportamentais 24 h após o último dia do período de isolamento de 4 semanas (ou mais). Realize testes durante a fase escura sob iluminação vermelha indireta e grave com uma câmera de vídeo.
- Organize pelo menos três indivíduos para conduzir a pontuação offline manual de maneira duplamente cega para minimizar o viés e o erro.
- Labirinto elevado mais (EPM)
- Preparar o aparelho EPM. O aparelho utilizado neste protocolo foi obtido comercialmente (ver Tabela de Materiais) e confeccionado em plástico opaco com dois braços abertos e dois braços fechados (33 cm x 5 cm cada, braços abertos perpendiculares aos braços fechados) com plataforma central de 5 cm x 5 cm. Eleve o aparelho 50 cm acima do chão.
- Coloque o animal no centro do aparelho, de frente para um braço aberto. Permita que o animal explore por 5 minutos e registre sua atividade usando uma câmera de vídeo.
- Limpe o aparelho após cada animal, limpando cuidadosamente todas as superfícies com desinfetante (álcool etílico a 70%). Certifique-se de que todos os excrementos de roedores sejam apagados.
- Classifique o comportamento dos ratos off-line com base no tempo gasto em braços abertos, braços fechados e na plataforma central usando um cronômetro. Inicie o cronômetro quando o mouse colocar pelo menos três patas no respectivo braço ou plataforma.
- Teste de campo aberto (OF)
- Prepare o aparelho OF. O aparelho utilizado neste protocolo (ver Tabela de Materiais) foi feito de plástico opaco medindo 50 cm x 50 cm x 38 cm (comprimento x largura x altura).
- Desenhe grades quadradas (10 cm x 10 cm cada) no campo para um total de 25 grades.
- Coloque o animal no centro do campo e deixe explorar por 10 min. Registre sua atividade em uma câmera de vídeo.
- Limpe o aparelho após cada animal, limpando cuidadosamente toda a superfície com desinfetante (álcool etílico a 70%). Certifique-se de que todos os excrementos de roedores sejam apagados.
- Classifique o comportamento dos ratos offline com base no tempo gasto na zona central, no tempo gasto nos cantos, na distância total percorrida e no número de vezes que o mouse foi criado.
- Use um cronômetro para registrar o tempo gasto no centro ou canto. Inicie o cronômetro quando o mouse colocar pelo menos três patas na respectiva área.
- Use um contador para registrar a distância percorrida e a frequência de criação. Conte o número de quadrados que o rato entra (quando o rato coloca pelo menos três patas no quadrado). Conte a criação quando o rato se levantar claramente em suas patas traseiras. Não conte quando o rato se levanta e se encosta às paredes ou quando se levanta para se arrumar.
- Teste de reconhecimento de novos objetos (NOR)
- Realize este teste ao longo de 3 dias. No dia 1, prepare um aparelho de campo aberto de 50 cm x 50 cm x 38 cm (comprimento x largura x altura). Coloque o animal no centro do campo aberto e deixe se familiarizar por 5 min. Em seguida, coloque o animal de volta em sua gaiola de origem.
- Limpe o aparelho após cada animal, limpando cuidadosamente todas as superfícies com desinfetante (álcool etílico a 70%). Certifique-se de que todos os excrementos de roedores sejam apagados.
- No dia 2, prepare o mesmo aparelho de campo aberto e coloque dois objetos idênticos, como um pequeno cubo. Coloque-os simetricamente a cerca de 20 cm de distância. Coloque o animal no centro do aparelho e deixe explorar por 5 min. Em seguida, coloque o animal de volta em sua gaiola de origem.
- Limpe o aparelho após cada animal, limpando cuidadosamente todas as superfícies com desinfetante (álcool etílico a 70%). Certifique-se de que todos os excrementos de roedores sejam apagados.
- No dia 3, prepare o mesmo aparelho de campo aberto e um dos objetos do dia 2 (ou seja, um pequeno cubo), que funcionará como o objeto familiar. Coloque outro objeto novo e diferente, como uma pirâmide de madeira, simetricamente do objeto familiar a cerca de 20 cm de distância. Permita que o animal explore por 3 minutos e registre sua atividade em uma câmera de vídeo.
- Limpe o aparelho após cada animal, limpando cuidadosamente todas as superfícies com desinfetante (álcool etílico a 70%). Certifique-se de que todos os excrementos de roedores sejam apagados.
- Classifique o comportamento dos ratos offline com base no tempo gasto explorando o objeto familiar e o novo objeto. Calcule o índice de reconhecimento de objetos (ORI%), onde
 ; tf e tn representam os tempos de exploração dos objetos familiares e novos, respectivamente.
; tf e tn representam os tempos de exploração dos objetos familiares e novos, respectivamente.
- Realize este teste ao longo de 3 dias. No dia 1, prepare um aparelho de campo aberto de 50 cm x 50 cm x 38 cm (comprimento x largura x altura). Coloque o animal no centro do campo aberto e deixe se familiarizar por 5 min. Em seguida, coloque o animal de volta em sua gaiola de origem.
- Teste de reconhecimento de contexto novo (NCR)
- Realize este teste ao longo de 2 dias. Prepare dois campos abertos de forma distinta e dois pares de objetos de forma distinta. O aparelho OF pode ser utilizado como um dos contextos (campo aberto). O outro contexto deve ser de tamanho semelhante, mas de forma diferente, como um campo aberto redondo.
- No dia 1, coloque um par de objetos idênticos (ou seja, dois cubos) no contexto quadrado e o outro par de objetos idênticos (ou seja, duas pirâmides) no contexto redondo. Os objetos devem ser colocados simetricamente a 15-20 cm de distância.
- Coloque o animal no centro e deixe explorar por 5 minutos em um contexto. Repita no outro contexto. Em seguida, coloque o animal de volta em sua gaiola de origem.
- Limpe o aparelho após cada animal, limpando cuidadosamente todas as superfícies com desinfetante (álcool etílico a 70%). Certifique-se de que todos os excrementos de roedores sejam apagados.
- No dia 2, troque um dos objetos de um contexto com o outro (ou seja, coloque um cubo e uma pirâmide no contexto quadrado e um cubo e uma pirâmide no contexto redondo).
- Coloque o animal no centro e deixe explorar por 3 min. Registre sua atividade em uma câmera de vídeo. Os animais não precisam ser registrados em ambos os contextos.
- Limpe o aparelho após cada animal, limpando cuidadosamente todas as superfícies com desinfetante (álcool etílico a 70%). Certifique-se de que todos os excrementos de roedores sejam apagados.
- Pontuar o comportamento dos ratos offline com base no tempo gasto explorando os objetos distintos. Calcule o índice de reconhecimento (IR%) como a proporção de tempo gasto investigando o novo objeto "fora de contexto" (ou seja, a pirâmide no contexto quadrado) versus o objeto familiar "no contexto" (ou seja, o cubo no contexto quadrado).
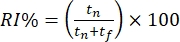 .
.
Resultados
Todos os resultados e números representativos foram modificados a partir de nossas publicações recentes22,23. Para avaliar os efeitos do isolamento social sobre a ansiedade e o comportamento exploratório, foram realizados testes EPM e OF 24 h após a data de término do período de isolamento social de 4 semanas. Camundongos socialmente isolados passaram significativamente menos tempo no braço aberto (1,28 ± 0,17 min) em comparação com o controle (2,31 ±...
Discussão
As etapas críticas do protocolo incluem a configuração adequada das gaiolas de isolamento social (ou seja, o embrulho de sacos opacos e a redução da quantidade de cama), minimizando o manuseio e a perturbação dos ratos durante todo o período de isolamento e certificando-se de que os ratos obtenham e consumam o ágar com a droga completamente. É fundamental que o biotério ou a condição de alojamento seja mantido a uma temperatura e umidade constantes, bem como minimizadas as interferências externas. ...
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi financiado pelo National Institute of Health grant AA17991 (para J.L.), Carefree Biotechnology Foundation (para J.L.), University of Southern California (USC), USC Graduate School Travel/Research Award (para S.W.) Bolsa de Estudo da Missão Cultural da Arábia Saudita (para A.A.O.), e Programa de Bolsas de Estudo para Profissões de Saúde do Exército (para A.S.S.).
Materiais
| Name | Company | Catalog Number | Comments |
| Black Plastic Bags | Office Depot | 791932 | 24" x 32" |
| Elevated Plus Maze | SD Instruments | NA | Black color |
| Open Field enclosure | SD Instruments | NA | White color |
| Select Agar | Invitrogen | 30391-023 | |
| Square cotton for nesting (nestlet) | Ancare Corporation | NC9365966 | Divide a 2" square piece into 4 pieces to create a 1" square piece for isolation group |
| Sucrose | Sigma | S1888-1KG | |
| Weigh boat | SIgma | HS1420A | Small, square white polystyrene |
Referências
- Craske, M. G., et al. Anxiety disorders. Nature Reviews Disease Primers. 3 (1), 17024 (2017).
- Kasper, S., den Boer, J., Ad Sitsen, J. . Handbook of Depression and Anxiety: A Biological Approach. , (2003).
- Konnopka, A., König, H. Economic burden of anxiety disorders: a systematic review and meta-analysis. Pharmacoeconomics. 38 (1), 25-37 (2020).
- Batterham, P. J., et al. Effects of the COVID-19 pandemic on suicidal ideation in a representative Australian population sample-Longitudinal cohort study. Journal of Affective Disorders. 300, 385-391 (2022).
- Ismail, I. I., Kamel, W. A., Al-Hashel, J. Y. Association of COVID-19 pandemic and rate of cognitive decline in patients with dementia and mild cognitive impairment: a cross-sectional study. Gerontology and Geriatric Medicine. 7, 23337214211005223 (2021).
- . NIMH. Anxiety Disorders Available from: https://www.nimh.nih.gov/health/topics/anxiety-disorders/index.shtml (2018)
- Roy-Byrne, P. Treatment-refractory anxiety; definition, risk factors, and treatment challenges. Dialogues in Clinical Neuroscience. 17 (2), 191-206 (2015).
- Cassano, G. B., Baldini Rossi, N., Pini, S. Psychopharmacology of anxiety disorders. Dialogues in Clinical Neuroscience. 4 (3), 271-285 (2002).
- Garakani, A., et al. Pharmacotherapy of anxiety disorders: current and emerging treatment options. Frontiers in Psychiatry. 11, 595584 (2020).
- Hutson, P. H., Clark, J. A., Cross, A. J. CNS target identification and validation: avoiding the valley of death or naive optimism. Annual Review of Pharmacology and Toxicology. 57 (1), 171-187 (2017).
- Hart, P. C., Proetzel, G., Wiles, M. V., et al. Experimental models of anxiety for drug discovery and brain research. Mouse Models for Drug Discovery: Methods and Protocols. , 271-291 (2016).
- Scherma, M., Giunti, E., Fratta, W., Fadda, P. Gene knockout animal models of depression, anxiety and obsessive compulsive disorders. Psychiatric Genetics. 29 (5), 191-199 (2019).
- Liu, W. -. Z., et al. Identification of a prefrontal cortex-to-amygdala pathway for chronic stress-induced anxiety. Nature Communications. 11 (1), 2221 (2020).
- Zheng, Z. -. H., et al. Neuroinflammation induces anxiety- and depressive-like behavior by modulating neuronal plasticity in the basolateral amygdala. Brain, Behavior, and Immunity. 91, 505-518 (2021).
- Toth, I., Neumann, I. D. Animal models of social avoidance and social fear. Cell and Tissue Research. 354 (1), 107-118 (2013).
- Wang, F., Kessels, H. W., Hu, H. The mouse that roared: neural mechanisms of social hierarchy. Trends in Neurosciences. 37 (11), 674-682 (2014).
- Endo, N., et al. Multiple animal positioning system shows that socially-reared mice influence the social proximity of isolation-reared cagemates. Communications Biology. 1 (1), 225 (2018).
- Netser, S., et al. Distinct dynamics of social motivation drive differential social behavior in laboratory rat and mouse strains. Nature Communications. 11 (1), 5908 (2020).
- Krimberg, J. S., Lumertz, F. S., Orso, R., Viola, T. W., de Almeida, R. M. M. Impact of social isolation on the oxytocinergic system: A systematic review and meta-analysis of rodent data. Neuroscience & Biobehavioral Reviews. 134, 104549 (2022).
- Mumtaz, F., Khan, M. I., Zubair, M., Dehpour, A. R. Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomedicine & Pharmacotherapy. 105, 1205-1222 (2018).
- Ranade, S. Comforting in mice. Nature Neuroscience. 24 (12), 1640 (2021).
- Al Omran, A. J., et al. Social isolation induces neuroinflammation and microglia overactivation, while dihydromyricetin prevents and improves them. Journal of Neuroinflammation. 19 (1), 2 (2022).
- Watanabe, S., et al. Dihydromyricetin improves social isolation-induced cognitive impairments and astrocytic changes in mice. Scientific Reports. 12 (1), 5899 (2022).
- Silva, J., et al. Modulation of hippocampal GABAergic neurotransmission and gephyrin levels by dihydromyricetin improves anxiety. Frontiers in Pharmacology. 11, 1008 (2020).
- Porter, V. R., et al. Frequency and characteristics of anxiety among patients with Alzheimer's disease and related dementias. Journal of Neuropsychiatry and Clinical Neuroscience. 15 (2), 180-186 (2003).
- Hossain, M. M., et al. Prevalence of anxiety and depression in South Asia during COVID-19: A systematic review and meta-analysis. Heliyon. 7 (4), 06677 (2021).
- . NHGRI. Knockout Mice Fact Sheet Available from: https://www.genome.gov/about-genomics/fact-sheets/Knockout-Mice-Fact-Sheet (2020)
- Takahashi, A. Social stress and aggression in murine models. Current Topics in Behavioral Neuroscience. 54, 181-208 (2022).
- Lam, R. W. Challenges in the treatment of anxiety disorders: beyond guidelines. International Journal of Psychiatry in Clinical Practice. 10, 18-24 (2006).
- Sullens, D. G., et al. Social isolation induces hyperactivity and exploration in aged female mice. PLoS One. 16 (2), 0245355 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados