需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
社会隔离模型:压力和焦虑的非侵入性啮齿动物模型
摘要
这里介绍的是一种社会隔离(SI)诱导的焦虑小鼠模型,该模型利用野生型C56BL / 6J小鼠以最少的处理和无侵入性程序诱导压力和焦虑样行为。该模型反映了社会孤立的现代生活模式,是研究焦虑和相关疾病的理想选择。
摘要
焦虑症是美国(US)残疾的主要原因之一。目前的治疗并不总是有效的,只有不到50%的患者达到完全缓解。开发新型抗焦虑药的关键步骤是开发和利用动物模型(例如小鼠)来研究病理变化并测试药物靶点、疗效和安全性。目前的方法包括基因操作,长期给予焦虑诱导分子或管理环境压力。然而,这些方法可能无法现实地反映日常生活中引起的焦虑。该协议描述了一种新的焦虑模型,该模型模仿了现代生活中有意或无意的社会孤立模式。社会孤立诱导的焦虑模型最大限度地减少了感知到的干扰和侵入性,并利用野生型C57BL / 6小鼠。在该协议中,将6至8周龄的小鼠(雄性和雌性)单独饲养在不透明的笼子中,以视觉上阻挡外部环境,例如邻近的小鼠4周。不提供环境富集(如玩具),垫料减少50%,任何药物处理均以琼脂形式施用,并且尽量减少小鼠的暴露/处理。使用该协议生成的社会孤立小鼠表现出更大的焦虑样行为,攻击性以及认知能力下降。
引言
焦虑症是美国精神疾病的最大类别和负担,相关年度成本超过420亿美元1,2,3。近年来,焦虑和压力使自杀和自杀意念的患病率提高了 16% 以上4。慢性病患者特别容易受到精神困扰或认知功能下降的意外继发性影响5.目前对焦虑症的治疗包括心理治疗、药物治疗或两者的组合6.然而,尽管存在这种危机,只有不到 50% 的患者达到完全缓解6,7。苯二氮卓类药物(BZs)和选择性5-羟色胺再摄取抑制剂(SSRIs)等抗焦虑药具有明显的缺点或几乎不产生立竿见影的效果8。此外,正在开发的新型抗焦虑药相对稀缺,受到昂贵且耗时的药物开发过程的挑战9,10。
药物开发过程中的一个关键步骤是建立和利用动物模型,例如小鼠,以研究病理变化并测试药物的安全性和有效性11。目前建立焦虑动物模型的方法包括1)基因操作,例如敲除血清素受体(5-HT1A)或γ-氨基丁酸A受体(GABAAR)α亚基12;2)长期给予焦虑诱导剂,如皮质酮或脂多糖(LPS)13,14;或 3) 施加环境压力,包括社会失败和母体分离15.然而,这些方法可能无法真实地反映日常生活中引起的焦虑,因此可能不适合研究潜在机制或测试新药。
像人类一样,老鼠和老鼠是高度社会化的生物16,17,18。社交接触和社交互动对于最佳的大脑健康至关重要,并且对于饲养期间的正常神经发育至关重要19。因此,在饲养期间,母体分离或社会孤立导致小鼠表现出更多的焦虑,抑郁和神经传递的变化20。此外,社交梳理或同种异体整理是生活在一起的小鼠和大鼠之间常见的结合或安慰行为形式21。因此,社会化是啮齿动物生活中不可或缺的一部分,隔离会对它们的健康产生负面影响。
在这种情况下,本协议描述了一种新的焦虑模型,以模仿现代生活中有意或无意的社会孤立模式。这种社会隔离(SI)模型最大限度地减少了感知的干扰和侵入性,并利用了成年野生型C57BL / 6小鼠和Sprague-Dawley(SD)大鼠。 这里介绍的方案侧重于基于我们发表的证据的焦虑小鼠模型,该模型显示由于社会孤立,焦虑样行为,攻击性,认知能力下降和神经炎症增加22,23,24。焦虑样行为通过升高加迷宫 (EPM) 和开放场地 (OF) 测试得到证实,而认知功能通过新型物体识别 (NOR) 和新型上下文识别 (NCR) 测试来测量。该模型可用于研究焦虑和相关疾病,但也可以调整或修改以研究轻度认知障碍的自然进展和发展以及压力引起的代谢变化。
研究方案
所有动物实验均按照南加州大学(USC)机构动物护理和使用委员会(IACUC)批准的协议进行,所有方法均按照相关指南,法规和建议进行。
1. 动物
- 获得适当的动物护理委员会的批准以进行研究。
- 将动物园设置为暗光12小时循环,温度和湿度分别控制在24±2°C和50%-60%之间。
- 获得6-8周龄的雄性和/或雌性野生型C57BL / 6小鼠。按性别对动物进行分层后,将它们随机分配到以下组之一:1)经过车辆处理的组舍;2)接受药物治疗的集体住宅;3)通过车辆处理进行社会隔离;或4)药物治疗的社会隔离。目标是每组每性别至少四只小鼠(理想情况下每组六只小鼠)。
- 小鼠到达后,使它们适应动物园至少24小时。小鼠应单独饲养到达。
2. 笼子设置
- 对于社会隔离动物,使用标准鼠笼(2 楼空间 75 个),并添加一半的床上用品和 1 合2 的棉花(或等效物)筑巢。
- 用不透明的黑色塑料袋(或同等物品)包裹笼子的外壁,并用胶带固定。确保小鼠看不到外部环境或周围的动物。
- 保持笼子的顶部和底部未包裹,除非老鼠可以通过它们看到邻近的动物。
- 包装时,请确保袋子的任何部分都无法从笼子内部进入。这是为了防止动物将袋子撕开。
- 请勿包含任何形式的环境浓缩物,例如玩具或跑轮。
- 小心而轻柔地将小鼠放入准备好的笼子中。 随意提供食物和水。
- 在正常笼子条件下(即,在标准小鼠笼[75 在2楼空间]中,全量的床上用品,2合2 的棉花或等效的套料,以及不透明袋子的包裹),以两到三组为一组进行家控。
- 确保群体饲养的小鼠彼此兼容(即它们之间没有战斗/冲突)。如果发生冲突,请移除攻击者并从分析中排除。
- 将雄性和雌性小鼠分开饲养,并在雄性和雌性之间保持距离,以避免由于嗅觉能力而影响雌性小鼠内分泌水平变化的可能性。
3. 社会隔离期间的护理和治疗
- 在社交隔离期间尽可能少地打扰小鼠。在活动期间(即,在黑暗周期期间)和最小的噪音干扰下执行任何程序和活动,例如更换笼子和治疗管理。
- 在黑暗周期期间,每周只更换一次笼子。相同的塑料袋可以取出并重新包装到新的笼子中,除非存在重大损坏。
- 对于对照(群体饲养)小鼠,在黑暗周期中根据需要每周更换两次或更多笼子。
- 确保小鼠有足够的水和食物至少持续 1 周。
- 继续分离(或分组住房)小鼠至少4周,以获得最佳结果。
4. 琼脂药物/治疗制剂-一种非侵入性药物治疗
- 如果研究中涉及治疗(例如,正在研究的药物),理想情况下,利用琼脂形式以尽可能少的处理方式进行治疗。注射和口服强饲等途径会给小鼠带来额外的压力,这可能成为焦虑的混杂因素。
- 根据所用药物的性质调整治疗的时间和频率。
注意:在本研究中,使用2mg / kg二氢杨梅素(DHM,[(2R,3R)-3,5,7-三羟基-2-(3,4,5-三羟基苯基)-2,3-二氢苯并吡喃-4-酮])作为治疗。在隔离(或集体住宅)期间的最后2周的黑暗阶段,每天以单剂量施用DHM。 - 为了准备处理,在去离子(DI)水中加入3%(w / v)琼脂并加热至~90°C以溶解。溶液会冒泡。防止溢出或沸腾。
注意:通过短时间的10秒微波 加热 玻璃烧瓶中的溶液。
注意:玻璃器皿会很热。处理溶液时,请穿戴适当的个人防护装备(PPE)。 - 旋转解决方案并目视确保解决方案均匀。
注意:溶液应该是半透明的,浅黄色至浅棕色。 - 当溶液仍然温暖时,加入5%(w / v)蔗糖和所需剂量的处理。仅添加蔗糖,不将感兴趣的处理添加到车辆对照中。
- 旋转解决方案并目视确保解决方案均匀。然后,将溶液倒入模具中,在室温下冷却以固化。如果治疗对光敏感,请确保保护它免受光照。
注意:溶液应略带粘性。 - 凝固后,将琼脂切成0.5cm x 0.5cm x 0.5cm的立方体,并储存在4°C直至给药。
- 要进行治疗,请将单个立方体放在一个小称重船上。在明暗循环的黑暗阶段,安静而小心地将琼脂称重船放入单独的笼子中,不要触摸鼠标。让鼠标消耗琼脂。
注意:小鼠通常需要15-45分钟才能完全消耗琼脂。 - 确认琼脂完全消耗,然后小心地将秤船从笼子中取出。根据需要重复此操作。
- 每周准备琼脂块以保持新鲜并避免任何污染。
5. 行为分析
- 在4周(或更长时间)隔离期的最后一天后24小时进行行为测试。在间接红光下的暗阶段进行测试,并用摄像机记录。
- 安排至少三人以双盲方式进行人工离线评分,以尽量减少偏差和错误。
- 高架加迷宫 (EPM)
- 准备 EPM 设备。本协议中使用的设备是商业获得的(见 材料表),由不透明塑料制成,具有两个张开臂和两个闭合臂(每个33厘米x 5厘米,垂直于闭合臂的张开臂),中心平台为5厘米x 5厘米。将设备抬高到离地板 50 厘米处。
- 将动物放在设备的中心,面向张开的手臂。让动物探索5分钟并使用摄像机记录其活动。
- 用消毒剂(70%乙醇)彻底擦拭所有表面,在每只动物之后清洁设备。确保擦去所有啮齿动物粪便。
- 使用秒表根据张开双臂、闭合双臂和中央平台所花费的时间对小鼠的行为进行离线评分。当鼠标将至少三只爪子放在相应的手臂或平台上时,启动秒表。
- 开放现场 (OF) 测试
- 准备 OF 设备。本协议中使用的设备(见 材料表)由不透明塑料制成,尺寸为50厘米x 50厘米x 38厘米(长x宽x高)。
- 在场地上绘制方形网格(每个 10 厘米 x 10 厘米),总共 25 个网格。
- 将动物放在田野的中心,让其探索10分钟。在摄像机上记录他们的活动。
- 在每只动物之后,用消毒剂(70%乙醇)彻底擦拭所有表面来清洁设备。确保擦去所有啮齿动物粪便。
- 根据在中心区域花费的时间、在角落花费的时间、行进的总距离和鼠标饲养的次数,对小鼠的行为进行离线评分。
- 使用秒表记录在中心或角落花费的时间。当鼠标在相应区域放置至少三个爪子时,启动秒表。
- 使用计数器记录行进的距离和饲养频率。计算鼠标进入的方块数(当鼠标在正方形中放置至少三个爪子时)。当老鼠清楚地用后爪站起来时,计数饲养。当鼠标站起来靠在墙上或站起来梳理毛发时,不要数数。
- 新型物体识别(NOR)测试
- 在 3 天内执行此测试。在第 1 天,准备一个 50 厘米 x 50 厘米 x 38 厘米(长 x 宽 x 高)的开放现场设备。将动物放在空地的中心,让其熟悉5分钟。然后将动物放回其家笼中。
- 用消毒剂(70%乙醇)彻底擦拭所有表面,在每只动物之后清洁设备。确保擦去所有啮齿动物粪便。
- 在第2天,准备相同的开放场地设备并放置两个相同的物体,例如一个小立方体。将它们对称放置,相距约 20 厘米。将动物放在设备的中心,并允许探索5分钟。然后将动物放回其家笼中。
- 用消毒剂(70%乙醇)彻底擦拭所有表面,在每只动物之后清洁设备。确保擦去所有啮齿动物粪便。
- 在第3天,准备相同的开放场地设备和来自第2天的一个物体(即小立方体),它将作为熟悉的物体。将另一个不同的新物体(例如木制金字塔)与熟悉的物体对称放置约20厘米。让动物探索 3 分钟并在摄像机上记录它们的活动。
- 用消毒剂(70%乙醇)彻底擦拭所有表面,在每只动物之后清洁设备。确保擦去所有啮齿动物粪便。
- 根据探索熟悉物体和新物体所花费的时间,对小鼠的行为进行离线评分。计算物体识别指数(ORI%),其中
 tf 和tn 分别代表探索熟悉和新颖物体的时间。
tf 和tn 分别代表探索熟悉和新颖物体的时间。
- 在 3 天内执行此测试。在第 1 天,准备一个 50 厘米 x 50 厘米 x 38 厘米(长 x 宽 x 高)的开放现场设备。将动物放在空地的中心,让其熟悉5分钟。然后将动物放回其家笼中。
- 新型上下文识别 (NCR) 测试
- 在 2 天内执行此测试。准备两个形状明显的空地和两对形状明显的物体。OF设备可以用作上下文之一(开放领域)。另一个上下文应具有相似的大小但形状不同,例如圆形开放区域。
- 在第 1 天,将一对相同的对象(即两个立方体)放在正方形上下文中,将另一对相同的对象(即两个金字塔)放在圆形上下文中。物体应对称放置,相距15-20厘米。
- 将动物放在中心,并在一个环境中探索5分钟。在其他上下文中重复。然后,将动物放回其家庭笼子中。
- 用消毒剂(70%乙醇)彻底擦拭所有表面,在每只动物之后清洁设备。确保擦去所有啮齿动物粪便。
- 在第 2 天,将一个上下文中的一个对象与另一个上下文交换(即,在方形上下文中放置一个立方体和一个金字塔,在圆形上下文中放置一个立方体和一个金字塔)。
- 将动物放在中心,探索3分钟。在摄像机上记录他们的活动。动物不需要在两种情况下都记录下来。
- 用消毒剂(70%乙醇)彻底擦拭所有表面,在每只动物之后清洁设备。确保擦去所有啮齿动物粪便。
- 根据探索不同物体所花费的时间对小鼠的行为进行离线评分。计算识别指数 (RI%) 作为调查新颖的"脱离上下文"对象(即方形上下文中的金字塔)与熟悉的"上下文"对象(即方形上下文中的立方体)所花费的时间比例。
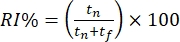 .
.
结果
所有具有代表性的结果和数据均根据我们最近的出版物22,23进行了修改。为了评估社会隔离对焦虑和探索行为的影响,在4周的社会隔离期结束后24小时进行了EPM和OF测试。与对照组(2.3±1±0.27分钟)相比,社会孤立小鼠在开放臂上花费的时间(1.280.17分钟)显着减少,并且在闭合臂中的时间(3.31±0.27分钟)与对照组(2.24±0.31分钟)相比(
讨论
协议中的关键步骤包括正确设置社会隔离笼(即包裹不透明袋子并减少床上用品的数量),在整个隔离期间尽量减少对小鼠的处理和干扰, 并确保小鼠完全获得和食用琼脂。至关重要的是,将动物饲养场或饲养所的条件保持在恒定的温度和湿度,并尽量减少外部干扰。应付出巨大努力,尽可能减少这些混杂因素,包括但不限于噪音干扰(例如,交谈、设备噪音等)、过度处理和在暗光周期...
披露声明
作者声明不存在利益冲突。
致谢
这项工作由美国国立卫生研究院拨款AA17991(致J.L.),无忧无虑生物技术基金会(致J.L.),南加州大学(USC),南加州大学研究生院旅行/研究奖(致SW)资助。沙特阿拉伯文化使命奖学金(致AAO)和陆军卫生专业奖学金计划(致ASS)。
材料
| Name | Company | Catalog Number | Comments |
| Black Plastic Bags | Office Depot | 791932 | 24" x 32" |
| Elevated Plus Maze | SD Instruments | NA | Black color |
| Open Field enclosure | SD Instruments | NA | White color |
| Select Agar | Invitrogen | 30391-023 | |
| Square cotton for nesting (nestlet) | Ancare Corporation | NC9365966 | Divide a 2" square piece into 4 pieces to create a 1" square piece for isolation group |
| Sucrose | Sigma | S1888-1KG | |
| Weigh boat | SIgma | HS1420A | Small, square white polystyrene |
参考文献
- Craske, M. G., et al. Anxiety disorders. Nature Reviews Disease Primers. 3 (1), 17024 (2017).
- Kasper, S., den Boer, J., Ad Sitsen, J. . Handbook of Depression and Anxiety: A Biological Approach. , (2003).
- Konnopka, A., König, H. Economic burden of anxiety disorders: a systematic review and meta-analysis. Pharmacoeconomics. 38 (1), 25-37 (2020).
- Batterham, P. J., et al. Effects of the COVID-19 pandemic on suicidal ideation in a representative Australian population sample-Longitudinal cohort study. Journal of Affective Disorders. 300, 385-391 (2022).
- Ismail, I. I., Kamel, W. A., Al-Hashel, J. Y. Association of COVID-19 pandemic and rate of cognitive decline in patients with dementia and mild cognitive impairment: a cross-sectional study. Gerontology and Geriatric Medicine. 7, 23337214211005223 (2021).
- . NIMH. Anxiety Disorders Available from: https://www.nimh.nih.gov/health/topics/anxiety-disorders/index.shtml (2018)
- Roy-Byrne, P. Treatment-refractory anxiety; definition, risk factors, and treatment challenges. Dialogues in Clinical Neuroscience. 17 (2), 191-206 (2015).
- Cassano, G. B., Baldini Rossi, N., Pini, S. Psychopharmacology of anxiety disorders. Dialogues in Clinical Neuroscience. 4 (3), 271-285 (2002).
- Garakani, A., et al. Pharmacotherapy of anxiety disorders: current and emerging treatment options. Frontiers in Psychiatry. 11, 595584 (2020).
- Hutson, P. H., Clark, J. A., Cross, A. J. CNS target identification and validation: avoiding the valley of death or naive optimism. Annual Review of Pharmacology and Toxicology. 57 (1), 171-187 (2017).
- Hart, P. C., Proetzel, G., Wiles, M. V., et al. Experimental models of anxiety for drug discovery and brain research. Mouse Models for Drug Discovery: Methods and Protocols. , 271-291 (2016).
- Scherma, M., Giunti, E., Fratta, W., Fadda, P. Gene knockout animal models of depression, anxiety and obsessive compulsive disorders. Psychiatric Genetics. 29 (5), 191-199 (2019).
- Liu, W. -. Z., et al. Identification of a prefrontal cortex-to-amygdala pathway for chronic stress-induced anxiety. Nature Communications. 11 (1), 2221 (2020).
- Zheng, Z. -. H., et al. Neuroinflammation induces anxiety- and depressive-like behavior by modulating neuronal plasticity in the basolateral amygdala. Brain, Behavior, and Immunity. 91, 505-518 (2021).
- Toth, I., Neumann, I. D. Animal models of social avoidance and social fear. Cell and Tissue Research. 354 (1), 107-118 (2013).
- Wang, F., Kessels, H. W., Hu, H. The mouse that roared: neural mechanisms of social hierarchy. Trends in Neurosciences. 37 (11), 674-682 (2014).
- Endo, N., et al. Multiple animal positioning system shows that socially-reared mice influence the social proximity of isolation-reared cagemates. Communications Biology. 1 (1), 225 (2018).
- Netser, S., et al. Distinct dynamics of social motivation drive differential social behavior in laboratory rat and mouse strains. Nature Communications. 11 (1), 5908 (2020).
- Krimberg, J. S., Lumertz, F. S., Orso, R., Viola, T. W., de Almeida, R. M. M. Impact of social isolation on the oxytocinergic system: A systematic review and meta-analysis of rodent data. Neuroscience & Biobehavioral Reviews. 134, 104549 (2022).
- Mumtaz, F., Khan, M. I., Zubair, M., Dehpour, A. R. Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomedicine & Pharmacotherapy. 105, 1205-1222 (2018).
- Ranade, S. Comforting in mice. Nature Neuroscience. 24 (12), 1640 (2021).
- Al Omran, A. J., et al. Social isolation induces neuroinflammation and microglia overactivation, while dihydromyricetin prevents and improves them. Journal of Neuroinflammation. 19 (1), 2 (2022).
- Watanabe, S., et al. Dihydromyricetin improves social isolation-induced cognitive impairments and astrocytic changes in mice. Scientific Reports. 12 (1), 5899 (2022).
- Silva, J., et al. Modulation of hippocampal GABAergic neurotransmission and gephyrin levels by dihydromyricetin improves anxiety. Frontiers in Pharmacology. 11, 1008 (2020).
- Porter, V. R., et al. Frequency and characteristics of anxiety among patients with Alzheimer's disease and related dementias. Journal of Neuropsychiatry and Clinical Neuroscience. 15 (2), 180-186 (2003).
- Hossain, M. M., et al. Prevalence of anxiety and depression in South Asia during COVID-19: A systematic review and meta-analysis. Heliyon. 7 (4), 06677 (2021).
- . NHGRI. Knockout Mice Fact Sheet Available from: https://www.genome.gov/about-genomics/fact-sheets/Knockout-Mice-Fact-Sheet (2020)
- Takahashi, A. Social stress and aggression in murine models. Current Topics in Behavioral Neuroscience. 54, 181-208 (2022).
- Lam, R. W. Challenges in the treatment of anxiety disorders: beyond guidelines. International Journal of Psychiatry in Clinical Practice. 10, 18-24 (2006).
- Sullens, D. G., et al. Social isolation induces hyperactivity and exploration in aged female mice. PLoS One. 16 (2), 0245355 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。