Method Article
تمايز الخلايا العظمية الوظيفية من الخلايا الوحيدة CD14 + للدم المحيطي البشري
* These authors contributed equally
In This Article
Summary
الخلايا الآكلة للعظم هي خلايا رئيسية لامتصاص العظام في الجسم. يصف هذا البروتوكول طريقة موثوقة للتمايز في المختبر بين الخلايا الآكلة للعظم من وحيدات الدم المحيطية البشرية. يمكن استخدام هذه الطريقة كأداة مهمة لزيادة فهم بيولوجيا ناقضة العظم في الاتزان الداخلي والأمراض.
Abstract
الخلايا الآكلة للعظم (OCs) هي خلايا تمتص العظام وتلعب دورا محوريا في نمو الهيكل العظمي وإعادة تشكيل عظام البالغين. تحدث العديد من اضطرابات العظام بسبب زيادة تمايز وتفعيل OCs ، وبالتالي فإن تثبيط هذه البيولوجيا المرضية هو مبدأ علاجي رئيسي. هناك عاملان رئيسيان يقودان تمايز OCs عن السلائف النخاعية: عامل تحفيز مستعمرة البلاعم (M-CSF) ومنشط مستقبلات العامل النووي kappa-B ligand (RANKL). من المعروف منذ فترة طويلة أن الخلايا الوحيدة CD14 + المنتشرة البشرية تتمايز إلى OCs في المختبر. ومع ذلك ، فإن وقت التعرض وتركيز RANKL يؤثران على كفاءة التمايز. في الواقع ، تم وصف بروتوكولات لتوليد OCs البشرية في المختبر ، لكنها غالبا ما تؤدي إلى عملية تمايز سيئة وطويلة. هنا ، يتم توفير بروتوكول قوي وموحد لتوليد OCs بشرية ناضجة نشطة وظيفيا في الوقت المناسب. يتم إثراء الخلايا الوحيدة CD14 + من خلايا الدم أحادية النواة المحيطية البشرية (PBMCs) ويتم تجهيزها ب M-CSF لتنظيم RANK. يؤدي التعرض اللاحق ل RANKL إلى توليد OCs بطريقة تعتمد على الجرعة والوقت. يتم تحديد OCs وقياسها عن طريق تلطيخ الفوسفاتيز المقاوم لحمض طرطرات (TRAP) وتحليل المجهر الضوئي. يستخدم تلطيخ التألق المناعي للنوى و F-actin لتحديد OCs النشطة وظيفيا. بالإضافة إلى ذلك ، يتم إثراء OSCAR + CD14− OCs الناضجة بشكل أكبر عن طريق فرز خلايا قياس التدفق الخلوي ، ووظيفة OC المحددة كميا بواسطة مقايسات ارتشاف المعادن (أو العاج / العظام) وتشكيل حلقة الأكتين. أخيرا ، يتم استخدام مثبط OC معروف ، روتينون ، على OCs الناضجة ، مما يدل على أن إنتاج أدينوسين ثلاثي الفوسفات (ATP) ضروري لسلامة حلقة الأكتين ووظيفة OC. في الختام ، تم إنشاء اختبار قوي للتمييز بين أعداد كبيرة من OCs في هذا العمل ، والذي بالاقتران مع تلطيخ حلقة الأكتين ومقايسة ATP يوفر نموذجا مفيدا في المختبر لتقييم وظيفة OC وفحص المركبات العلاجية الجديدة التي يمكن أن تعدل عملية التمايز.
Introduction
الخلايا العظمية (OCs) هي خلايا عملاقة متعددة النوى من سلالة المكونة للدم مع قدرة فريدة على امتصاص العظام. هم مسؤولون عن التطوير وإعادة البناء المستمر للهيكل العظمي 1,2. في مراحل الهيكل العظمي للتطور ، يتم اشتقاق OCs والبلاعم المقيمة في الأنسجة من أسلاف الكريات الحمر النخاعي واستعمار مكانة العظام وأنسجة الأعضاء. في الظروف الفسيولوجية ، هناك حاجة إلى أسلاف الكريات الحمر النخاعية لنمو العظام الطبيعي وثوران الأسنان ، في حين أن تدفق وحيدات الدم المتداولة في مكانة العظام يوفر صيانة ما بعد الولادة ل OCs ، كتلة العظام ، وتجويف نخاع العظم3. في ظل الظروف المرضية ، يتم تجنيد الخلايا الوحيدة إلى مواقع الالتهاب النشط ويمكن أن تسهم في تدمير العظام المرضي 4,5.
يعاني المرضى الذين يعانون من عدة أشكال من التهاب المفاصل من التهاب المفاصل ، مما يؤدي إلى تدمير المفاصل التدريجي الناجم عن OCs6. على سبيل المثال ، في التهاب المفاصل الروماتويدي (RA) ، تكون OCs المفرطة النشاط مسؤولة عن تآكل العظام المرضي وتدمير المفاصل 7,8 ، وغالبا ما لا تحسن العلاجات الحالية أو توقف تلف العظام9،10،11. تم الإبلاغ عن تغيرات في الخلايا الوحيدة المتداولة من حيث توزيع السكان والتوقيعات النسخية واللاجينية في مرضى التهاب المفاصل الروماتويدي12،13،14. علاوة على ذلك ، تم الإبلاغ عن أن استجابات الخلايا الوحيدة المتغيرة للتحفيز الالتهابي تؤثر على تكوين العظم في مرضى التهاب المفاصل الروماتويدي المصابين بمرض نشط15،16،17.
تمايز OCs هو عملية معقدة متعددة الخطوات تشمل التزام خلايا السلائف النخاعية بالتمايز إلى سلائف OC. أثناء تكوين العظم ، تصبح OCs عملاقة ومتعددة النوى من خلال اندماج الخلايا الخلوية ، والتحلل الخلوي غير المكتمل ، وعملية إعادة التدوير النووي الموصوفة بالانشطار والاندماج18،19،20. سمحت القدرة على التمييز بين OCs في المختبر بإحراز تقدم كبير في فهم بيولوجيا العظام21. تتمايز OCs عن السلائف عند التعرض لعامل تحفيز مستعمرة البلاعم (M-CSF) ومنشط مستقبلات العامل النووي kappa-B ligand (RANKL). هذا الأخير ضروري للتطور الطبيعي ووظيفة OCs في المختبر وفي الجسم الحي ، حتى في ظل الظروف الالتهابية6،22،23. يتم تقديم RANKL بواسطة بانيات العظم والخلايا العظمية ، وكذلك عن طريق الخلايا التائية المنشطة والخلايا الليفية في الغشاء الزليلي RA الملتهب2،24،25. أثناء عملية تمايز OC ، تقوم الخلايا الوحيدة المعرضة ل M-CSF بتنظيم منشط مستقبلات العامل النووي kappa-B (RANK) على غشاء الخلية ، وتحت التحفيز اللاحق باستخدام RANKL ، تتمايز إلى فوسفاتيز حمض أحادي النواة مقاوم للطرطرات (TRAP) قبل OCs ثم إلى OCs متعددة النوى15,26. تنتج OCs العديد من الإنزيمات ، وأهمها TRAP ، الذي يتيح تحلل البروتينات الفوسفاتية داخل العظام27. منظم وعلامة تمايز OC هو المستقبل المرتبط ب OC (OSCAR). يتم تنظيمه مبكرا في خلايا السلائف التي تلتزم بسلالة OC28. يمكن ل OCs العملاقة الناضجة متعددة النوى أن تتحلل (تمتص) المصفوفة الهيكلية عن طريق إنشاء منطقة مانعة للتسرب كبيرة ، وهي مصنوعة من حلقة أكتين تحيط بحدود مكشكشة21،29،30. تتطلب قدرة ارتشاف العظام ل OCs إعادة تنظيم الهيكل الخلوي وما يترتب على ذلك من استقطاب وتشكيل غشاء ملتوي ، وهو ما يسمى بالحدود المكشكشة. يحيط بالحدود المكشكشة شريط دائري كبير من هيكل غني ب F-actin ، وهو حلقة الأكتين أو منطقة الختم. تعد سلامة حلقة الأكتين ضرورية ل OCs لإعادة امتصاص العظام في كل من المختبر والجسم الحي ، ويرتبط تكوين الحدود المكشكشة المعيب بتعبير ثلاثي فوسفاتاز الأدينوزين الفراغي السفلي (V-ATPase)31،32،33. علاوة على ذلك ، فإن OCs عبارة عن خلايا غنية بالميتوكوندريا ، ويرتبط أدينوسين ثلاثي الفوسفات (ATP) بهياكل شبيهة بالميتوكوندريا في OCs المترجمة عند الحدودالمكشكشة 31،32،33. يعمل روتينون كمثبط قوي لمركب الميتوكوندريا I ويؤثر على إنتاج ATP. كما ثبت أن روتينون يمنع تمايز OC والوظيفة34.
يصف هذا البروتوكول طريقة فعالة ومحسنة لتكوين العظم في المختبر من عينات الدم المحيطية البشرية. في الدم المحيطي البشري ، تعد الخلايا الوحيدة CD14 + المصدر الرئيسي ل OCs15،35،36. في هذا البروتوكول ، تم تعديل حركية التعرض وتركيزات M-CSF و RANKL من أجل تكوين عظمي عظمي مثالي. يتم فصل الخلايا أحادية النواة أولا عن كريات الدم الحمراء والمحببة الموجودة في الدم الكامل عن طريق تدرج الكثافة. ثم يتم تخصيبها لوحيدات CD14 + باستخدام الانتقاء الإيجابي بواسطة الخرز المغناطيسي. ثم يتم تحضين الخلايا الوحيدة CD14 + المعزولة بين عشية وضحاها باستخدام M-CSF. هذا يهيئ الوحيدات لتنظيم التعبير عن الرتبة15,26. تؤدي الإضافة اللاحقة ل RANKL إلى تكوين العظم وتعدد النوى بطريقة تعتمد على الوقت. تظهر OCs النشطة المعاد امتصاصها التوزيع المميز لحلقات F-actin على حافة غشاء الخلية30,32 وتلطيخ TRAP. يتم تحليل OCs الناضجة عن طريق تحديد خلايا TRAP + متعددة النوى (أكثر من ثلاث نوى). يمكن تقييم القدرة الوظيفية ل OCs الناضجة من خلال ارتشافها وسلامة حلقة الأكتين وإنتاج ATP. علاوة على ذلك ، يمكن إثراء CD14− OSCAR + OCs المتمايزة واستخدامها لتقييم تأثيرات بعض المركبات على وظائف OC عن طريق ارتشاف المعادن (أو العاج) وتنظيم F-actin. بالإضافة إلى ذلك ، في هذا العمل ، يتم استخدام مثبط OC المعروف ، rotenone ، كنموذج لمركب يؤثر على وظائف OCs. يرتبط انخفاض نشاط ارتشاف OC تحت روتينون بانخفاض إنتاج ATP وتجزئة حلقة الأكتين. في الختام ، ينشئ هذا البروتوكول مقايسة قوية يمكن استخدامها كطريقة مرجعية لدراسة العديد من الجوانب البيولوجية لتمايز OC ووظيفته في المختبر.
يمكن استخدام هذه المنهجية لتقييم (1) إمكانات الخلايا الوحيدة المنتشرة للتمييز إلى OCs في الصحة والأمراض ، وكذلك (2) تأثير المرشحين العلاجيين على تمايز OC ووظيفته. يتيح بروتوكول تكوين العظم القوي هذا تحديد فعالية وآليات العلاجات المستهدفة للعظام على كل من تمايز OC من خلايا السلائف ووظيفة OCs الناضجة.
Protocol
يتم توفير معاطف بافي التي تم الحصول عليها من خدمة نقل الدم الوطنية الاسكتلندية (إدنبرة) ومخاريط الكريات البيض التي تم الحصول عليها من NHS Blood and Transplant (نيوكاسل) لباحثي جامعة غلاسكو في شكل مجهول المصدر بالكامل (غير قابل للتحديد) من المتبرعين بالدم بموافقة كاملة من NHS. يتم إنتاج معطف بافي ومكونات الدم المخروطية الكريات البيض من التبرع بالدم القياسي NHS المقدم في مركز التبرع بالدم التابع ل NHS في اسكتلندا أو إنجلترا. يعطي المتبرع بالدم موافقة مستنيرة في وقت التبرع بالدم لفائض الدم غير المستخدم في الممارسة السريرية القياسية ل NHS لاستخدامها في الدراسات البحثية الطبية المعتمدة. يتم الاحتفاظ بالموافقة الأخلاقية من لجنة أخلاقيات البحث NHS ونماذج موافقة المتبرعين الموقعة لاستخدام هذه التبرعات بالدم من قبل خدمة التبرع بالدم NHS. تم طلب الموافقة على الوصول إلى هذه التبرعات بالدم الموافق عليها واستخدامها في الدراسات البحثية الطبية المعتمدة والحصول عليها باستخدام عملية التطبيق والمراجعة الداخلية القياسية للخدمة الوطنية لنقل الدم (اسكتلندا) و NHS Blood and Transport (إنجلترا). لم تكن هناك حاجة إلى موافقة أخرى من NHS REC أو موافقة اللجنة الأخلاقية الداخلية لجامعة غلاسكو لاستخدام مكونات الدم للدراسات البحثية الطبية المعتمدة.
1. ملاحظات عامة قبل البدء
- المضي قدما في جميع الأعمال بالدم بحذر. النظر في المخاطر المحتملة لمختلف العوامل المعدية التي قد تكون موجودة في العينات.
- إجراء جميع الأعمال بحذر في مختبر السلامة البيولوجية في ظل ظروف معقمة أثناء ارتداء القفازات ومعاطف المختبر.
- القيام بالتخلص من السلامة الأحيائية وفقا للمبادئ التوجيهية المحلية.
- الحصول على الموافقة المناسبة والموافقات الأخلاقية قبل جمع العينات وفقا للوائح السلطة المحلية.
- بشكل عام ، سينتج 1 مل من الدم الطازج مليون PBMCs ، وتمثل وحيدات CD14 + حوالي 10٪ -30٪ من PBMCs. بالمقارنة ، يمكن أن يحتوي 10 مل من مخروط الكريات البيض على 5 × 10 8-15 × 108 PBMCs. لمزيد من التفاصيل حول عزل PBMC ، راجع البروتوكولالسابق 37.
2. عزل خلايا الدم أحادية النواة المحيطية (PBMCs) من الدم الكامل
- اجمع الكمية المطلوبة من الدم الطازج من المتبرعين الأصحاء في أنابيب جمع الهيبارين الليثيوم.
ملاحظة: يمكن أيضا استخدام أنابيب تجميع أخرى تحتوي على مضادات التخثر المناسبة (مثل أنابيب هيبارين الصوديوم). لارتفاع عدد الخلايا ، يمكن استخدام مخاريط الكريات البيض أو المعاطف الممتلئة. - لعزل PBMCs ، انقل الدم إلى أنبوب جديد سعة 50 مل ، وقم بتخفيفه باستخدام محلول ملحي معقم 1x مخزن بالفوسفات (PBS) بنسبة 1: 1 أو 1: 3 للدم الطازج أو مخاريط الكريات البيض / معاطف بافي ، على التوالي.
- امزج الخلايا برفق عدة مرات عن طريق الانقلاب.
- تحضير أنابيب سعة 15 مل تحتوي على 3 مل من وسط تدرج الكثافة. ضع ببطء 8-10 مل من الدم المخفف على الجزء العلوي من وسط تدرج الكثافة ، وأجهزة الطرد المركزي عند 400 × جم لمدة 30 دقيقة في درجة حرارة الغرفة (RT) بدون فرامل.
ملاحظة: ضع الدم بعناية فوق وسط تدرج الكثافة لمنع الاختلاط. قد يؤدي الخلط إلى فقدان PBMCs. - تخلص بعناية من الطبقة العليا (التي تحتوي على البلازما) باستخدام ماصة باستور ، واجمع الطبقة السفلية البينية التي تحتوي على PBMCs (هيكل أبيض يشبه الحلقة) ، وانقل هذه الطبقة إلى أنبوب جديد سعة 50 مل.
- قم بتعليق الخلايا باستخدام 1x PBS معقم يصل إلى 50 مل ، واغسل وسط تدرج الكثافة المتبقية عن طريق الطرد المركزي عند 300 × جم لمدة 10 دقائق في RT مع الفرامل الكاملة.
- لإزالة الصفائح الدموية المتبقية ، كرر العملية مع دوران أبطأ إضافي عند 200 × جم لمدة 10 دقائق في RT بدون فرامل.
- اختياري: لإزالة ترحيل خلايا الدم الحمراء ، قم بتخفيف محلول تحلل خلايا الدم الحمراء (10x ، جدول المواد) 1:10 في الماء المقطر ، وقم بتطبيق 3 مل من المخزن المؤقت المخفف على الحبيبات. تخلط وتحتضن لمدة 3 دقائق. اغسل الحبيبات حتى 50 مل من 1x PBS ، وأجهزة الطرد المركزي عند 300 × جم لمدة 10 دقائق في RT مع الفرامل الكاملة.
- أعد تعليق PBMCs المعزولة والمنقاة في 20 مل من 1x PBS وعدها باستخدام مقياس الدم أو اتباع الطرق القياسية الأخرى.
ملاحظة: يجب ضبط طرق تخفيف الخلايا وعد الخلايا وفقا لذلك بناء على كثافة الخلية وجهاز العد المستخدم.
3. إثراء وحيدات CD14 + من PBMCs
- اعزل الخلايا الوحيدة CD14 + من PBMCs باستخدام مجموعة اختيار CD14 + البشرية وفقا لبروتوكول الشركة المصنعة (جدول المواد).
ملاحظة: وحيدات CD14 + CD16− الكلاسيكية هي المصدر الرئيسي لسلائف OC35 ؛ يمكن النظر في طرق تنقية بديلة. - انقل 1 × 107 PBMCs إلى أنبوب بوليسترين مستدير القاع مناسب (أي يناسب مغناطيس مجموعة التحديد) ، وقم بتجميع الخلايا عند 300 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية في المخزن المؤقت لفصل الخلايا (PBS ، مصل بقري جنيني 2٪ [FBS] ، 1 mM ethylenediaminetetraacetic acid [EDTA]) إلى تركيز نهائي قدره 1 × 108 خلايا / مل ، واحتضانها ب 10 ميكرولتر من كوكتيل الأجسام المضادة لكل 100 ميكرولتر مع الغطاء لمدة 10 دقائق.
ملاحظة: يتم إعادة تعليق الخلايا عند 1 × 108 خلايا / مل ؛ اضبط مستويات الصوت وفقا لذلك. - بعد الحضانة ، أضف 10 ميكرولتر من حبات الجسيمات النانوية المغناطيسية لكل 100 ميكرولتر ، واحتضانها لمدة 3 دقائق مع الغطاء.
ملاحظة: اضبط أحجام كوكتيل الأجسام المضادة والخرز المغناطيسي للحصول على تركيز 10 ميكرولتر / مل. - قم بتعبئة الحجم إلى 2.5 مل باستخدام المخزن المؤقت لفصل الخلايا ، ضع الأنبوب في مغناطيس (بدون غطاء) ، واحتضانه لمدة 3 دقائق. تخلص من عدد الخلايا السالبة بحركة واحدة مستمرة عن طريق الانقلاب بينما لا يزال الأنبوب في المغناطيس.
ملاحظة: في حالة استخدام >2 × 108 PBMCs ومغناطيس أكبر ، قم بتعبئة ما يصل إلى 5 مل أو 10 مل باستخدام مخزن مؤقت لفصل الخلايا باتباع إرشادات الشركة المصنعة. - قم بإزالة الأنبوب من المغناطيس ، واغسل الخلايا الوحيدة CD14 + المخصبة المتصلة بالخرز المغناطيسي عن طريق تعليقها في 2.5 مل من المخزن المؤقت لفصل الخلايا. احتضان لمدة 3 دقائق داخل المغناطيس كما كان من قبل ، وتجاهل الكسر السالب ، وكرر مرة أخرى.
- أجهزة الطرد المركزي جميع الخلايا التي تم جمعها في 300 × غرام لمدة 5 دقائق ، وتجاهل المادة الطافية ، وإعادة تعليق الخلايا في 5 مل من الحد الأدنى من الوسط الأساسي ألفا (α-MEM ؛ جدول المواد) مكمل ب 1٪ L-glutamine و 1٪ بنسلين / ستربتومايسين (كامل α-MEM) و 10٪ FBS.
ملاحظة: يوصى بفحص نقاء ما بعد التخصيب عن طريق قياس التدفق الخلوي ، ويجب توقع نقاء ≥96٪. خطوات الغسيل الإضافية (الخطوة 3.6) يمكن أن تزيد من النقاء.
4. تمايز OC في المختبر
- عد الخلايا الوحيدة CD14 + المخصبة باستخدام مقياس الدم.
- قم بتجميع الخلايا عند 300 × جم لمدة 5 دقائق ، وأعد تعليقها عند 1 × 106 خلايا / مل بالكامل α-MEM مع استكمال 10٪ FBS.
- للتمييز بين OCs ، أضف M-CSF بتركيز نهائي قدره 25 نانوغرام / مل إلى تعليق الخلية.
ملاحظة: بالنسبة ل 1 مل من معلق الخلية ، أضف 0.25 ميكرولتر من M-CSF من تركيز مخزون 100 ميكروغرام / مل. - امزج عن طريق السحب جيدا لتجانس تعليق الخلية واللوحة 100 ميكرولتر / بئر في لوحة مسطحة القاع 96 بئرا إلى كثافة خلية نهائية تبلغ 1 × 105 خلايا / بئر.
- أضف 200 ميكرولتر / بئر من الماء المقطر المعقم إلى الآبار حول الخلايا المطلية لمنع التبخر المتوسط وتأثيرات الحافة في نظام الاستزراع.
- احتضان الخلايا طوال الليل ، لمدة 18-20 ساعة تقريبا ، عند 37 درجة مئوية مع 5٪ CO2.
- بعد الحضانة طوال الليل ، قم بإزالة نصف الوسط بعناية (50 ميكرولتر / بئر) عن طريق الشفط باستخدام ماصة P200 ، وتجنب لمس قاع البئر ، واستبدلها ب α-MEM كاملة دافئة جديدة تحتوي على 10٪ FBS و 25 نانوغرام / مل m-CSF و 50 نانوغرام / مل RANKL لتركيز نهائي قدره 25 نانوغرام / مل
ملاحظة: بالنسبة ل 1 مل من الوسط ، أضف 0.25 ميكرولتر من M-CSF و 0.5 ميكرولتر من RANKL من تركيز مخزون 100 ميكروغرام / مل. - قم بتغيير الوسائط كل 3 أيام وقم بتمييز الخلايا إلى OCs لمدة 7-14 يوما (الشكل 1).
ملاحظة: حافظ على تركيزات M-CSF و RANKL متسقة في جميع أنحاء الثقافة.
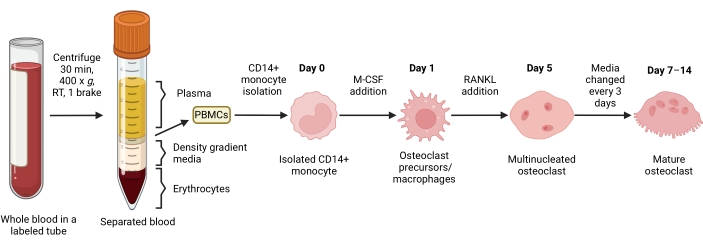
الشكل 1: سير عمل تمايز OC. نظرة عامة تخطيطية على عزل الخلايا الوحيدة CD14 + من PBMCs والتمايز إلى OCs الناضجة في وجود M-CSF و RANKL لمدة 7-14 يوما. RT = درجة حرارة الغرفة. تم إنشاء الصورة باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. فخ تلطيخ ل ناقضات العظم
- قم بإزالة الوسط بعناية ، وقم بإصلاح OCs الملتصقة المتمايزة ب 100 ميكرولتر / بئر من المحلول المثبت المعد مسبقا ، واحتضانها لمدة 1 دقيقة. لا تلمس قاع الآبار لتجنب خدش الخلايا الملتصقة.
ملاحظة: يتم تحضير المحلول المثبت على النحو التالي: 12.5 مل من محلول السيترات (مدرج في مجموعة تلطيخ TRAP) ، و 32.5 مل من الأسيتون ، و 5 مل من 37٪ فورمالديهايد. - اغسل الآبار ثلاث مرات ب 300 ميكرولتر من الماء المقطر المعقم. اضغط على الأطباق الجافة بعد الغسيل.
- تحضير محلول تلطيخ وفقا لتعليمات الشركة الصانعة (جدول المواد) ؛ إضافة 5 ميكرولتر من العقيق السريع و 5 ميكرولتر من نتريت الصوديوم لصنع محلول العقيق السريع ؛ تخلط عن طريق الانقلاب ، وتحتضن لمدة 3 دقائق في RT. تحضير 1 مل من محلول التلوين عن طريق خلط 900 ميكرولتر من الماء المقطر المعقم ، و 10 ميكرولتر من النفثول ، و 40 ميكرولتر من محلول الأسيتات ، و 50 ميكرولتر من محلول طرطرات ، و 10 ميكرولتر من محلول العقيق السريع.
- أضف 100 ميكرولتر / بئر من محلول التلوين الطازج ، واحتضن الطبق على حرارة 37 درجة مئوية في الظلام لمدة 20 دقيقة.
- بعد الحضانة ، قم بإزالة محلول التلوين عن طريق الانقلاب ، واغسل اللوحة ثلاث مرات ب 300 ميكرولتر / بئر من الماء المقطر.
- قم بإزالة الماء الزائد عن طريق النقر على الأطباق على المناشف الورقية. اترك الألواح مفتوحة ومحمية من الضوء لتجف في الهواء طوال الليل.
ملاحظة: يمكن تخزين الأطباق الجافة لمدة تصل إلى 6 أشهر. في بعض الأحيان ، يمكن للمخازن المؤقتة المتبقية أن تعزز تطور العفن ، والذي يكون مرئيا تحت المجهر ؛ يمكن إزالة هذا في أي وقت عن طريق غسل الآبار المصابة بالماء المقطر وتركها تجف في الهواء مرة أخرى. - التقط صورا بمعدل 10 أضعاف أو 20 ضعفا باستخدام مجهر برايت فيلد مع خيار البلاط لالتقاط سطح البئر بالكامل.
- عد يدويا OCs التي تم تحديدها على أنها خلايا ملطخة باللون الأرجواني TRAP + مع أكثر من ثلاث نوى باستخدام برنامج تحليل الصور مع مكون إضافي لعداد الخلايا.
ملاحظة: تعتمد أعداد TRAP + OCs لكل بئر على المانحين وقد تختلف من ~ 200-1600 OCs / بئر ، بمتوسط حوالي 1000 OCs / well. علاوة على ذلك ، لتحليل البيانات ، يجب تحديد أرقام OC في ثلاثة آبار مختلفة (النسخ المتماثلة التقنية) ، ويجب حساب المتوسط لكل حالة ولكل تكرار بيولوجي.
6. مقايسة ارتشاف العظام
- قم بطلاء الخلايا الوحيدة CD14 + المخصبة حديثا على 96 لوحة مقايسة عظمية جيدة مغلفة بفوسفات الكالسيوم عند 1 × 105 خلايا / بئر ، وقم بتمييز OCs لمدة 7-14 يوما ، كما هو موضح في الخطوات 4.1-4.8 ، وتغيير الوسيط كل 3 أيام.
ملاحظة: يمكن استخدام العاج / العاج أو شرائح العظام القشرية البقرية بدلا من لوحات فحص العظام. إذا كان الأمر كذلك ، فيجب إطالة الوقت الإجمالي للثقافة إلى 14-21 يوما بسبب الركيزة الأكثر تعقيدا التي سيتم امتصاصها. - في نقطة النهاية ، قم بإزالة الوسط بعناية ، وتجنب لمس قاع البئر ، وقم بتحليل الخلايا بمحلول هيبوكلوريت الصوديوم بنسبة 10٪. اغسل الآبار ثلاث مرات بالماء المقطر.
- امسح الألواح الجافة باستخدام مجهر برايت فيلد ، وقم بتحليل / تحديد الصور المكتسبة لحفر الارتشاف باستخدام برنامج تحليل الصور.
7. تلطيخ حلقة الأكتين الفلورسنت
- صفيحة 100 ميكرولتر / بئر من الخلايا الوحيدة CD14 + المعزولة في شريحة غرفة 18 بئرا بكثافة خلية 1 × 105 خلايا / بئر. قم بتمييز OCs في وجود M-CSF و RANKL كما هو موضح من قبل (الخطوات 4.1-4.8) ، بما في ذلك تغيير الوسيط كل 3 أيام.
- في نقطة وقت النهاية ، قم بإزالة الوسط برفق ، واغسل كل بئر مرتين باستخدام 200 ميكرولتر / بئر من PBS الذي تم تسخينه مسبقا ، درجة الحموضة 7.4. لا تدع الآبار تجف بين أي من الخطوات.
- ثبت العينة ب 100 ميكرولتر / بئر من محلول الفورمالديهايد 4٪ في PBS ، واحتضانها لمدة 10 دقائق في RT على شاكر مداري مع اهتزاز لطيف.
ملاحظة: يمكن أن يعطل الميثانول الأكتين أثناء عملية التثبيت. لذلك ، من الأفضل تجنب أي مثبتات تحتوي على الميثانول. المثبت المفضل هو الفورمالديهايد الخالي من الميثانول. تم ضبط الهزاز المداري المستخدم في هذه الخطوة من البروتوكول على إعداد طاقة 3 من 10. - اغسل مرتين باستخدام 200 ميكرولتر / بئر من PBS ، وتخلل الخلايا ب 100 ميكرولتر / بئر من محلول Triton X-100 المخفف بنسبة 0.1٪ في PBS ، واحتضانه لمدة 10 دقائق في RT على شاكر مداري مع اهتزاز لطيف.
- اغسل مرتين باستخدام 200 ميكرولتر / بئر من PBS. لمنع الارتباط غير النوعي وزيادة الإشارة ، أضف 100 ميكرولتر / بئر من محلول الحجب المصنوع من محلول مصل البقر 2٪ (BSA) / PBS. احتضان لمدة 20 دقيقة في RT على شاكر مداري مع اهتزاز لطيف.
- قم بإزالة محلول الحجب ، وأضف 100 ميكرولتر / بئر من محلول القضيب المترافق بالفلورسنت المخفف في محلول 2٪ BSA / PBS. احتضان لمدة 20 دقيقة في RT على شاكر مداري مع اهتزاز لطيف ومحمي من الضوء.
ملاحظة: اضبط تركيز صبغة القضيب وفقا لتوصيات الشركة المصنعة. - اغسل مرتين باستخدام 200 ميكرولتر / بئر من PBS ، وقم بتلطيخ النوى ب 100 ميكرولتر / بئر من محلول PBS يحتوي على 300 نانومتر DAPI ، واحتضانها لمدة 10-15 دقيقة في RT على شاكر مداري مع اهتزاز لطيف ومحمي من الضوء.
ملاحظة: يتم تخفيف DAPI في الماء المقطر لصنع محلول مخزون DAPI 14.3 mM (5 mg / mL). يتم تخفيف محلول المخزون إلى التركيز النهائي البالغ 300 ميكرومتر. أخيرا ، يتم تخفيف محلول 300 μM DAPI مرة أخرى في PBS إلى تركيز نهائي يبلغ 300 نانومتر. - بعد 10-15 دقيقة ، قم بإزالة محلول DAPI واستبدله ب 100 ميكرولتر / بئر PBS.
ملاحظة: وفقا لشرائح الحجرة المختارة، إما أن تخزن بحجم مناسب من PBS (100 ميكرولتر/بئر لشرائح الحجرة ذات 18 بئرا)، أو قم بتركيب الشريحة باستخدام زلات غطاء ووسيط تركيب مناسب. يمكن تخزين شرائح الغرفة لمدة تصل إلى 1 أسبوع في الثلاجة. بالنسبة لشرائح الغرفة المكونة من 18 بئرا ، استخدم حجم تلطيخ 50-100 ميكرولتر و 200-300 ميكرولتر للغسيل. قم بتوسيع نطاق أحجام شرائح الحجرة الأخرى وفقا لذلك. لتجنب التبخر ، احتفظ بأغطية الأغطية داخل حاوية مغطاة خلال أوقات الحضانة. يوصى باستخدام شاكر مداري ولكنه ليس ضروريا. - تصور التلوين باستخدام المجاهر المناعية المناسبة أو المجاهر متحدة البؤر والتكبير بين 4x إلى 40x.
8. إثراء OCs الناضجة وسلائف OC عن طريق فرز قياس التدفق الخلوي
- أعد تعليق وحيدات CD14 + المخصبة حديثا عند 1 × 106 خلايا / مل ، وقم بتمييزها إلى OCs ناضجة في وجود M-CSF و RANKL بنفس الطريقة الموضحة أعلاه (الخطوات 4.1-4.8).
ملاحظة: عند التوسع من لوحة 96 بئرا إلى حجم لوحة أكبر ، اتبع الجدول 1 ؛ يتم حساب هذه الأحجام بدءا من محلول 1 × 106 خلايا / مل وتوفر كثافة مثالية للاندماج بين الخلايا والخلايا. - في اليوم 7 ، اغسل الآبار مرة واحدة باستخدام برنامج تلفزيوني دافئ ، وأضف 50 ميكرولتر إلى 1 مل (الحجم الذي يحدده حجم اللوحة المستخدمة) من أكوتاز. احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO2 لمدة 20 دقيقة.
- بعد الحضانة ، تحقق من الألواح تحت المجهر الضوئي لمعرفة ما إذا كانت الخلايا قد انفصلت. علاوة على ذلك ، افصل الخلايا عن طريق النقر على الألواح من جميع الجوانب وسحبها لأعلى ولأسفل.
- اجمع معلق الخلية في أنبوب مخروطي سعة 15 مل. اغسل الآبار باستخدام برنامج تلفزيوني دافئ (بدون Ca 2+ ، بدون Mg2+) ، وادمجها مع تعليق الخلية. كرر الخطوات 8.2-8.3 مرة أو مرتين حتى تنفصل معظم الخلايا.
ملاحظة: Accutase ، الطريقة الموصى بها قبل تلطيخ السطح لتحليل التدفق الخلوي ، لا تفصل OCs كبيرة جدا. معدل الاسترداد ~ 50٪ -70٪. - أجهزة الطرد المركزي الخلايا في 300 × غرام لمدة 5 دقائق ، وإعادة تعليق بيليه الخلية في 1 مل من PBS ، وعد الخلايا عن طريق استبعاد تريبان الأزرق.
- أعد تعليق الخلايا عند 1 × 106 خلايا / مل ، وقم بإزالة 100 ميكرولتر المقابلة ل 1 × 105 خلايا ، وانقل تلك الخلايا إلى أنبوب اختبار بولي بروبيلين جديد. أضف 200 ميكرولتر من المخزن المؤقت لفرز الخلايا ، وضعه جانبا على الجليد كعنصر تحكم غير ملوث.
- قم بتلطيخ بقية الخلايا بصبغة حية / ميتة مخففة في الساعة 1: 750 لمدة 10 دقائق في RT ومحمية من الضوء.
ملاحظة: يجب إجراء تلطيخ حي / ميت في حالة عدم وجود FBS لتجنب تلطيخ الخلفية العالية. - قم بتعبئة أنبوب التجميع سعة 15 مل الذي يحتوي على تعليق الخلايا الملطخة الحية / الميتة مع مخزن مؤقت لفرز الخلايا الدافئة (1x PBS ، بدون Ca 2+ ، بدون Mg2+ ، 1٪ FBS ، و 5 mM EDTA) ، وأجهزة طرد مركزي عند 300 × جم لمدة 5 دقائق لتكوير الخلايا.
ملاحظة: يوصى بتركيز عال من EDTA وتركيز منخفض من FBS في مخزن الفرز لمنع كتل الخلايا. - قم بإزالة وحدة تخزين تتوافق مع 1 × 105 خلايا ، وانقلها إلى أنبوب اختبار بولي بروبيلين جديد للتحكم في النمط المتماثل OSCAR. انقل جميع الخلايا المتبقية إلى أنبوب اختبار بولي بروبيلين آخر لتلطيخها وفرز الخلايا.
ملاحظة: تستخدم أنابيب اختبار البولي بروبلين للفرز لأن الخلايا أقل عرضة للالتصاق بهذه الأنابيب من أنابيب البوليسترين. - قم بتدوير الأنابيب عند 400 × جم لمدة 5 دقائق لتكوير الخلايا ، وتخلص من المادة الطافية الزائدة عن طريق الانقلاب.
- أعد تعليق حبيبات الخلية في محلول مزيج رئيسي للأجسام المضادة محضر وفقا للجدول 2. قم بتلطيخ أنبوب التحكم في النمط المتماثل OSCAR بالجسم المضاد CD14 والتحكم في النمط المتماثل OSCAR بدلا من الجسم المضاد OSCAR.
- احتضان الخلايا على حرارة 4 درجات مئوية محمية من الضوء لمدة 30 دقيقة.
- بعد 30 دقيقة ، اغسل الخلايا بإضافة خمسة مجلدات من المخزن المؤقت لفرز الخلايا ، وأجهزة الطرد المركزي عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أعد تعليق الخلايا في 300-1000 ميكرولتر من المخزن المؤقت لفرز الخلايا الباردة ، واحصل على الخلايا باستخدام آلة فرز قياس التدفق الخلوي المزودة بفوهة 100 ميكرومتر.
ملاحظة: OCs هي خلايا لزجة للغاية ، لذلك من المهم ترشيحها من خلال غشاء معقم 70 ميكرومتر قبل الفرز. - قم ببوابة OCs و ما قبل OCs ك CD14−OSCAR +. اضبط بوابة OSCAR + بناء على أنبوب التحكم في النمط المتماثل OSCAR.
- اجمع الخلايا التي تم فرزها في أنابيب اختبار البولي بروبلين التي تحتوي على α-MEM كاملة مكملة ب 20٪ FBS عند 8 درجات مئوية.
- بعد الفرز, حبيبات الخلايا عن طريق الطرد المركزي عند 300 × غرام لمدة 5 دقائق في RT, عد الخلايا, وإعادة التعليق للتطبيقات النهائية.
ملاحظة: عادة ، للحصول على ~ 1 × 105 مرتبة مسبقا OCs / OCs ، ابدأ من ~ 10 × 106 خلايا مطلية في اليوم 0. يتأثر معدل الاسترداد المنخفض بفقدان الخلايا أثناء الانفصال مع accutase والمعالجة للتلطيخ والفرز. يوصى بتنفيذ الإجراء بأكمله باستخدام مخازن وكواشف معقمة ، والعمل في ظل ظروف معقمة.
9. مقايسة ATP لنشاط الميتوكوندريا
- احتضان وحيدات CD14 + المخصبة في وجود M-CSF و RANKL في لوحة 96 بئرا بنفس الطريقة الموضحة من قبل (الخطوات 4.1-4.8). لوحة أربعة شروط إضافية في ثلاث نسخ لاستخدامها كضوابط.
- قم بإجراء مقايسة ATP باستخدام مجموعة مقايسة اكتشاف ATP التلألؤ وفقا لدليل الشركة المصنعة. باختصار ، لتحضير محلول ATP ، أضف 10 مل من محلول الركيزة العازلة إلى الركيزة المجففة بالتجميد ، واتركها لاحتضانها في RT لمدة 30 دقيقة.
ملاحظة: يمكن استخدام طرق مختلفة لقياس إنتاج ATP داخل الخلايا. هنا ، استخدمنا الكشف عن إنتاج ATP عن طريق التلألؤ. - أثناء الحضانة ، قم بإعداد وإضافة عناصر التحكم مباشرة إلى آبار التحكم على النحو التالي: 2-Deoxy-D-glucose (2DG) عند 10 mM و 100 mM ، oligomycin عند 1 μM ، و 100 mM 2DG بالاشتراك مع 1 μM oligomycin. احتضان لمدة 30 دقيقة عند 37 درجة مئوية مع 5٪ CO2.
ملاحظة: يمنع 2DG تحلل السكر ، في حين أن oligomycin هو مثبط للفسفرة التأكسدية. يؤدي الجمع بين هذين المثبطين إلى فقدان كامل لإنتاج ATP عن طريق تحلل الجلوكوز والفسفرة التأكسدية ، مما يعني أنهما يعملان كعنصر تحكم داخلي لمقايسة ATP. بالنسبة لعناصر التحكم 10 mM و 100 mM 2DG ، أضف 0.5 ميكرولتر و 5 ميكرولتر من محلول مخزون 2M 2DG لكل بئر استزراع 100 ميكرولتر ، على التوالي. بالنسبة ل 1 ميكرومتر oligomycin ، قم بتخفيف محلول المخزون 5 mM 1: 100 في المتوسط ، وأضف 2 ميكرولتر / بئر إلى آبار التحكم المخصصة. بالنسبة للتحكم الأخير ، أضف 5 ميكرولتر من 2DG و 2 ميكرولتر من محلول oligomycin المخفف لكل بئر. - أضف 50 ميكرولتر من محلول ATP إلى كل بئر لإيقاف التفاعل ، واحتضان RT على شاكر عند 700 دورة في الدقيقة لمدة 5-10 دقائق محمية من الضوء.
- انقل 100 ميكرولتر من المادة الطافية إلى لوحة ذات قاع أبيض 96 بئرا مخصصة لفحص ATP ، واقرأ اللوحة باستخدام قارئ التلألؤ.
النتائج
جيل OC من الخلايا الوحيدة CD14 +
تهدف هذه الطريقة إلى التمييز بسهولة بين عدد كبير من OCs من الخلايا الوحيدة CD14 + في الدم المحيطي البشري في المختبر ، عادة في أسبوع واحد. أولا ، تم إثراء الخلايا الوحيدة CD14 + من PBMCs وتجهيزها ب M-CSF بين عشية وضحاها لتنظيم RANK ، كما ورد سابقا15. بعد تحضير الخلية الأحادية ، لتحديد التركيز الأمثل ل RANKL لتمايز OC ونضجه ، تم استخدام تركيزات RANKL البالغة 1 نانوغرام / مل ، و 25 نانوغرام / مل ، و 50 نانوغرام / مل ، و 100 نانوغرام / مل ، جنبا إلى جنب مع 25 نانوغرام / مل m-CSF. أنتجت إضافة RANKL أعدادا متزايدة من OCs الكبيرة متعددة النوى إيجابية TRAP بطريقة تعتمد على الجرعة ، وتم تقييم ذلك باستخدام تلطيخ TRAP. يتم تعريف OCs الناضجة على أنها خلايا إيجابية TRAP ذات نوى متعددة (عادة أكثر من ثلاثة. الشكل 2 ألف ، ب والشكل التكميلي 1). علاوة على ذلك ، تم فحص حركية تمايز OC من الخلايا الوحيدة باستخدام تلطيخ TRAP والفحص المجهري الضوئي على مدار فترة استزراع مدتها 2-14 يوما. في هذه الحالة ، تم اختيار تمايز OC باستخدام تركيز متوسط قدره 50 نانوغرام / مل RANKL لتقييم مدى سرعة تمايز OCs في الثقافة. في ظروف الاستزراع هذه ، كانت OCs متعددة النوى مرئية من اليوم 5 فصاعدا ، وتم الوصول إلى التمايز الأمثل في اليوم 7 (الشكل 2C). أدت الحضانة المطولة للمزارع بعد 10 أيام على البلاستيك إلى خلايا مدمجة عملاقة بشكل غير طبيعي. في هذا البروتوكول ، عادة ما يتم استخدام الأيام 6-8 كنقطة نهاية مثالية لتوليد OC. يمكن تحديد OCs أو استخدامها في المقايسات النهائية.
التقييم الوظيفي ل OCs المتمايزة
لتحديد النشاط الوظيفي ل OCs المتولدة ، قمنا بفحص نشاطها الارتشاف عن طريق التمييز بين OCs على سطح معدني. نظرا لأن OCs الكبيرة لا يتم إنشاؤها إلا بعد فترة استزراع مدتها 7 أيام ، ولإتاحة الوقت الكافي لامتصاص الركيزة المعدنية ، فقد تم الحفاظ على الثقافات حتى اليوم 10. لوحظ تكوين ثقوب مستديرة ، أو حفر ارتشاف ، فقط على الأسطح المعدنية للآبار التي تحتوي على خلايا تمت معالجتها بكل من M-CSF و RANKL (الشكل 3). وبالتالي ، فإن النسبة المئوية للسطح المعدني المذاب (حفر الارتشاف) تسمح بتحديد قدرة امتصاص OC. بالإضافة إلى ذلك ، فإن OCs المتباينة باتباع هذا البروتوكول حتى اليوم 7 ، على كل من شرائح الغرفة البلاستيكية والزجاجية ، أظهرت بنية حلقة أكتين جيدة التنظيم يمكن تصورها عن طريق تلطيخ الفلورسنت المناعي (الشكل التكميلي 2).
تأثير مثبط على وظيفة OC الناضجة
تم استخدام ظروف الاستزراع المذكورة أعلاه لتحديد القدرة الوظيفية ل OCs المتولدة في المختبر في وجود مثبط OC المعروف ، rotenone34. تم تمييز OCs لمدة 6-8 أيام ، وتم إثراء CD14−OSCAR + OCs وسلائف OC عن طريق قياس التدفق الخلوي (الشكل 4). ثم تم طلاء الخلايا المخصبة عند 50000 خلية / لكل بئر على صفيحة 96 بئرا مغلفة بالمعادن في وسط مؤيد ل osteoclasts (25 نانوغرام / مل M-CSF و RANKL) لمدة 3 أيام. المعالجة بالروتينون (الشكل 5 أ ، ب) تمنع بشكل معتمد على الجرعة ارتشاف السطح المعدني مقارنة ببئر التحكم غير المعالج ، بما يتفق مع الدراسات السابقة34. بالإضافة إلى ذلك ، تم تقييم وظائف OC من خلال إنتاج ATP وتشكيل حلقة الأكتين. ارتبط تثبيط ارتشاف OC المعتمد على الروتينون بتثبيط إنتاج ATP (الشكل 5C). إعادة امتصاص OCs هي خلايا شديدة الاستقطاب تنظم قدرتها على الارتشاف من خلال تعزيز تنظيم الهيكل الخلوي. تم استخدام القضيب المترافق Alexa fluor 647 لتسمية الهيكل الخلوي F-actin ل OCs الناضجة المستزرعة في وجود أو عدم وجود الروتينون. تسبب روتينون في تجزئة حلقة الأكتين المشتقة من RANKL من OCs الناضجة (الشكل 5D).
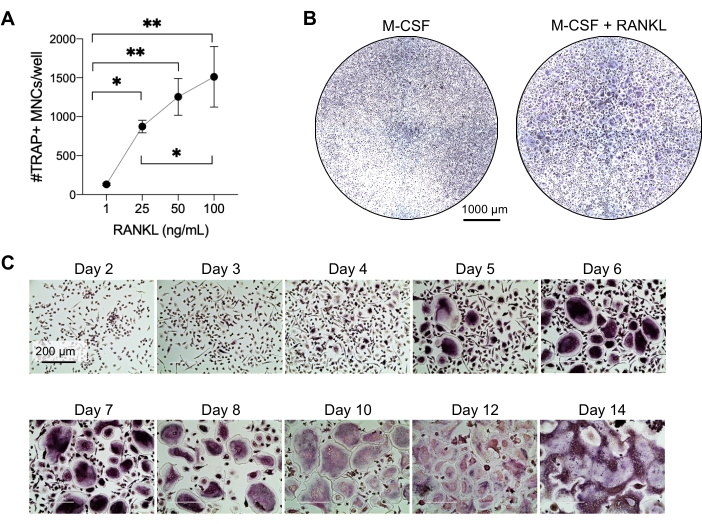
الشكل 2: OCs تتمايز بكفاءة عن سلائف الخلايا الوحيدة CD14 + . تم إثراء الخلايا الوحيدة CD14 + مغناطيسيا ، ومطلية في 1 × 105 خلايا / بئر في 96 لوحة بئر ، وتم حضنها طوال الليل ب 25 نانوغرام / مل M-CSF. (أ) تم تحفيز الخلايا الوحيدة المحضرة M-CSF بتركيزات متزايدة من RANKL (1 نانوغرام / مل ، 25 نانوغرام / مل ، 50 نانوغرام / مل ، و 100 نانوغرام / مل) ، ثابتة ، وملطخة ب TRAP في اليوم 7. تم الحصول على الصور ، وتم حساب الخلايا متعددة النوى TRAP + (MNCs). تظهر الصور التمثيلية لتلطيخ TRAP في الشكل التكميلي 1. تظهر أشرطة الخطأ متوسط ± SD (n = 3). تم تحليل البيانات باستخدام اختبار مقارنات متعددة أحادي الاتجاه ANOVA و Holm-Sidak للبيانات المقترنة. * P ≤ 0.05 و ** P ≤ 0.005. (ب) صورة تمثيلية لبئر ملطخة ب TRAP لصفيحة 96 بئرا توضح الكمية النموذجية من OCs / البئر المتوقعة ومورفولوجيتها تحت 25 نانوغرام / مل RANK-L مقارنة بالبلاعم المشتقة من M-CSF في اليوم 7. قضبان المقياس: 1000 ميكرومتر. (C) صور تمثيلية لتشكيل OC أقل من 50 نانوغرام / مل تم تقييم RANKL عبر تلطيخ TRAP من اليوم 2 إلى اليوم 14. OCs مرئية من اليوم 5 فصاعدا. توجد OCs العملاقة المنصهرة بشكل غير طبيعي بعد 10 أيام. قضبان المقياس: 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
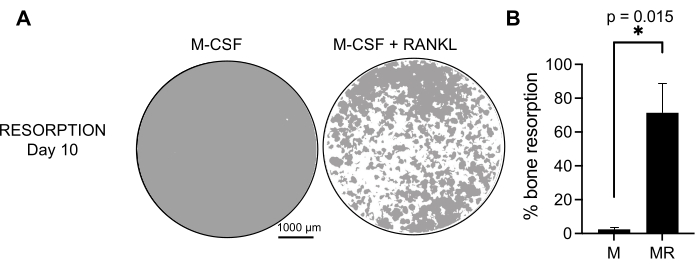
الشكل 3: OCs الامتصاصية متباينة عن الخلايا الوحيدة CD14 + . تم تمييز خلايا CD14 + المعزولة من PBMCs لمدة 10 أيام إلى OCs في وجود 25 نانوغرام / مل M-CSF (M) و RANKL (R) على ألواح فحص سطح المعادن (مقايسة العظام). (أ) صور للآبار التمثيلية التي أعيد بناؤها والتي تم التقاطها بتكبير 10x لتحليل الارتشاف في اليوم 10 (الركيزة المعدنية باللون الرمادي ؛ حفر الارتشاف باللون الأبيض). قضبان المقياس: 1000 ميكرومتر. (ب) التحديد الكمي للنسبة المئوية للمساحة المعاد امتصاصها. تم تحليل بيانات الارتشاف باستخدام تحليل Wilcoxon المزدوج. تظهر أشرطة الخطأ متوسط ± SD (n = 7). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
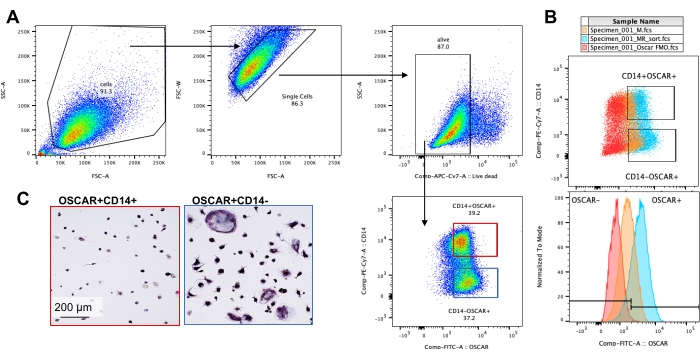
الشكل 4: إثراء قياس التدفق الخلوي ل CD14−OSCAR + OCs. تم إثراء وحيدات CD14 + من PBMCs ، وتم تمييز OCs كما هو موضح سابقا. تم فصل ثقافات OC الملتصقة مع accutase وملطخة لقياس التدفق الخلوي. (أ-ج) تم فرز OCs في اليوم 8 بناء على تعبير CD14 و OSCAR. (أ) استراتيجية الفرز التمثيلي للبوابات. كانت الخلايا عبارة عن بوابات فردية ، سلبية للتلطيخ الميت ، وتم فرز المجموعات الفرعية CD14 + OSCAR + (الأحمر) و CD14 − OSCAR + (الأزرق). (ب) مخططات تمثيلية توضح تلطيخ OSCAR المتداخل ل OCs المشتقة من RANKL (سماوي) والتحكم في الضامة المشتقة من M-CSF (برتقالي). باللون الأحمر يوجد عنصر التحكم الملون بنمط نظائر OSCAR ل OCs المشتقة من RANKL. (ج) تم طلاء المجموعات التي تم فرزها على البلاستيك وسمح لها بالالتصاق لمدة 2 ساعة في وسط pro-OC (25 نانوغرام / مل mL M-CSF و 50 نانوغرام / مل RANKL) ، متبوعا بتلطيخ TRAP والتصور. تظهر الصور التمثيلية نقصا في خلايا TRAP + في المجموعة الفرعية CD14 + (الحمراء) و TRAP + أحادية ومتعددة النوى قبل OCs و OCs في المجموعة الفرعية CD14− (الأزرق). قضبان المقياس: 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
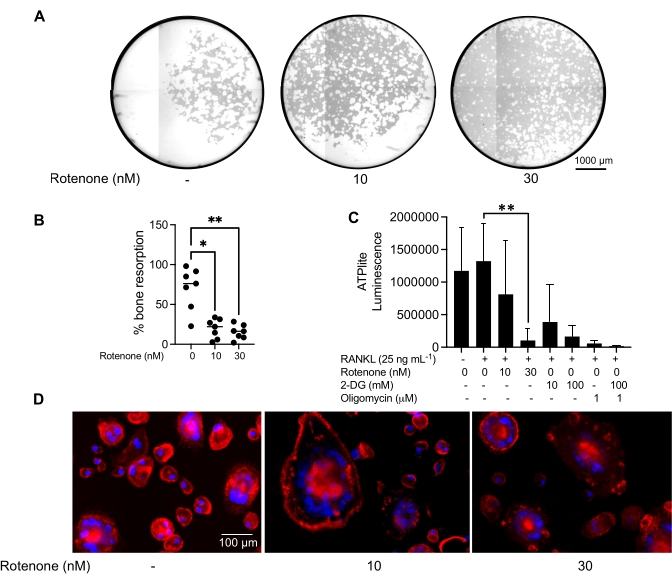
الشكل 5: فحوصات لتقييم وظيفة OCs الناضجة. لتقييم وظيفة OCs الناضجة ، تم استزراع خلايا CD14 + المعزولة من PBMCs إما باستخدام M-CSF (M) وحده أو مع RANKL (R) لمدة 7 أيام ، وتم إثراء OCs عن طريق قياس التدفق الخلوي ، ثم تمت معالجة OCs بالمثبط روتينون لمدة 24 ساعة. (أ) تم فرز OCs الناضجة عن طريق قياس التدفق الخلوي (CD14−OSCAR+ ) وتم استزراعها على سطح مقايسة معدنية في وجود أو عدم وجود روتينون لمدة 3 أيام ، وبعد ذلك تم تبييض الخلايا وتصويرها بمعدل 10x للكشف عن المنطقة المعاد امتصاصها (حفر الارتشاف باللون الأبيض). (أ) صور تمثيلية أعيد بناؤها للآبار. قضبان المقياس: 1000 ميكرومتر. (ب) التحديد الكمي للنسبة المئوية للمساحة المعاد امتصاصها. تم تحليل البيانات في (B) باستخدام ANOVA أحادي الاتجاه مع اختبار Dunn للمقارنات المتعددة (n = 7) ؛ * P ≤ 0.05 و ** P ≤ 0.01. تظهر أشرطة الخطأ متوسط ± SD. (C) إجمالي محتوى ATP داخل الخلايا ل OCs الناضجة غير المتمايزة واليوم 7 المتمايزة المتباينة مع RANKL والمعالجة إما بالمركبة أو الروتينون (10 نانومتر و 30 نانومتر). هنا ، تم استخدام 2DG و oligomycin كضوابط إيجابية للفحص وأضيفت قبل 30 دقيقة من تحلل الخلية وقياس ATP. تظهر أشرطة الخطأ متوسط ± SD (n = 4). تم تحليل البيانات باستخدام اختبار مقارنة متعدد الاتجاه ANOVA و Dunnett أحادي الاتجاه للبيانات المقترنة. ** P ≤ 0.01. (د) صورة تمثيلية بمعدل 20 ضعفا ل OCs الناضجة الملطخة بتكوين حلقة الأكتين (أحمر) ونوى (أزرق) ، توضح فقدان حلقة الأكتين مع المثبط. قضبان المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
| شكل لوحة | 96 لوحة جيدة | 48 لوحة جيدة | 24 لوحة جيدة | 12 لوحة جيدة | 6 لوحة جيدة |
| حجم | 100 ميكرولتر | 225–250 ميكرولتر | 450-500 ميكرولتر | 0.8-1 مل | 1.8-2 مل |
الجدول 1: حجم تعليق الخلية لتنسيقات الألواح المختلفة. يتم حساب الأحجام بدءا من محلول 1 × 106 خلايا / مل وتوفر كثافة مثالية لاندماج الخلايا الخلوية.
| فلوروفور ، استنساخ | الحجم (ميكرولتر) لكل 106 خلايا | |
| سي دي 14 | PE / السيانين 7 ، HCD14 | 5 ميكرولتر |
| اوسكار | FITC, REA494 | 10 ميكرولتر |
| المخزن المؤقت لفرز الخلايا | 80 ميكرولتر |
الجدول 2: محلول مزيج الأجسام المضادة الرئيسي.
الشكل التكميلي 1: تلطيخ TRAP لاستجابة جرعة RANKL. تم إثراء الخلايا الوحيدة CD14 + مغناطيسيا ، ومطلية عند 1 × 105 خلايا / بئر في 96 لوحة بئر ، وتم حضنها طوال الليل ب 25 نانوغرام / مل m-CSF ، كما في الشكل 2. تظهر الصور التمثيلية لتلطيخ TRAP الخلايا الوحيدة المحضرة MCSF محفزة بتركيزات متزايدة من RANKL (1 نانوغرام / مل ، 25 نانوغرام / مل ، 50 نانوغرام / مل ، و 100 نانوغرام / مل) ، ثابتة ، وملطخة ل TRAP في اليوم 7. قضبان المقياس: 400 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 2: تلطيخ الحلقة العاملة في OCs متمايزة تماما. (أ) تكبير 10x ل OCs متباينة على بلاستيك TC وملطخة ب AF647 phalloidin (باللون الأحمر). شريط المقياس: 400 ميكرومتر. (B) تكبير 40x ل OCs متباينة على شرائح الغرفة الزجاجية وملطخة ب AF488 phalloidin (باللون الأصفر). شريط المقياس: 100 ميكرومتر ، النوى ملطخة ب DAPI ، كما هو موضح باللون الأزرق في (A) والسماوي في (B). الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 3: تأثير دفعات FBS المختلفة على كفاءة تمايز OC. تم تمييز OCs عن الخلايا الوحيدة CD14 + في وجود 25 نانوغرام / مل M-CSF و 50 نانوغرام / مل رانكل (MR) لمدة 7 أيام. كانت آبار التحكم تحتوي على M-CSF فقط (M). (أ) تكبير تمثيلي 10x (أشرطة المقياس: 400 ميكرومتر) و (ب) القياس الكمي ل OCs الملطخة ب TRAP متباينة عن متبرع واحد في دفعتين مختلفتين من FBS. تظهر أشرطة الخطأ متوسط ± SD لثلاث نسخ متماثلة تقنية. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
تعد الثقافة السهلة وعزل أعداد كبيرة من OCs الوظيفية في المختبر مهمة لتعزيز فهم بيولوجيا العظام والأمراض بوساطة OC. كلاسيكيا ، تم إنشاء OCs في الثقافات المشتركة مع بانيات العظم أو الخلايا اللحمية والخلايا المكونة للدم من الطحال أو نخاع العظام38,39. كان الاختراق الكبير في فهم تكوين العظم هو تحديد RANKL باعتباره المنظم الرئيسي لتشكيل OC والتمايز والبقاء على قيد الحياة40. استخدمت البروتوكولات المبكرة لأنظمة الاستزراع المعتمدة على RANKL PBMCs لتوليد OC21،41،42. ومع ذلك ، فإن هذه الثقافات المختلطة طويلة وتقدم العديد من العوامل المربكة التي تحد من القدرة على اختبار التأثيرات المباشرة على تمايز OC ووظيفته. يصف هذا البروتوكول نموذجا فعالا وموثوقا به في المختبر لتكوين العظم الكلاستي من الخلايا الوحيدة CD14 + المحيطية البشرية حيث يمكن الحصول على تكوين العظم الأمثل في غضون 7 أيام (الشكل 1 والشكل 2) ، وهو أسرع بكثير عند مقارنته ببعض البروتوكولات الأخرى43،44،45،46. السمات المميزة الرئيسية لهذا البروتوكول هي (1) استخدام وحيدات CD14 + المنقاة ، (2) فتيلة الوحيدات مع M-CSF قبل التعرض ل RANKL ، (3) طول المزرعة (<7 أيام) ، و (4) الكشف الموثوق عن تثبيط تكوين OC (تلطيخ TRAP) والوظيفة (الارتشاف ، إنتاج ATP ، إعادة تنظيم حلقة الأكتين) مع مثبطات.
أثناء تحسين المنهجية ، تم تحديد العديد من النقاط الحرجة. وقد لوحظ أن التمايز في المختبر من OCs يعتمد إلى حد كبير على كثافة البذر من وحيدات CD14 +. وبالتالي ، في هذا البروتوكول ، يتم زرع الخلايا بكثافة عالية (1 × 105 خلايا / بئر من صفيحة 96 بئرا ، في 100 ميكرولتر من الوسط) ، حيث أنه من الضروري أن تكون الخلايا قادرة على التفاعل مع بعضها البعض وأن تكون على مقربة من الاندماج وتصبح OCs ناضجة. وبالمثل ، فإن بذر الخلايا بكثافة عالية جدا يحد من تمايزها ونموها بسبب القيود المتوسطة ونقص المساحة المطلوبة. علاوة على ذلك ، لتحقيق أقصى قدر من النجاح مع هذا البروتوكول ، من المهم إجراء فصل تدرج الكثافة بعناية والتأكد من أن السكان المخصبين لخلايا CD14 + نقية قدر الإمكان. على سبيل المثال ، تؤدي خطوات الغسيل غير الكافية إلى عدم إزالة الصفائح الدموية ، مما يمنع بالتالي تمايز OC47,48. وبالمثل ، فإن وجود تلوث طفيف للخلايا التائية في مستحضرات CD14 + المعزولة المحفزة باستخدام M-CSF وحده يمكن أن يؤدي إلى تمايز OC ، ربما عن طريق إفراز RANKL بواسطة الخلايا التائية49. لذلك ، من المهم تضمين عنصر تحكم M-CSF لكل تجربة. يوصى أيضا بإجراء فحص روتيني للنقاء ، خاصة عند استخدام مجموعة عزل جديدة ، لضمان نقاء العينة.
يتم تحقيق أرقام OC المثلى (النطاق: ~ 200-1600 OCs / well) باستخدام وسط α-MEM المخصب بالنيوكليوسيدات و L-glutamine. تؤثر وسائط الاستزراع التقليدية الأخرى ، بما في ذلك وسيط النسر المعدل في Dulbecco (DMEM) ووسط معهد روزويل بارك التذكاري (RPMI) 1640 ، على عائد OC. يمكن أن يؤثر مصدر FBS أيضا على تكوين العظم. يمكن أن تؤدي الدفعات المختلفة من FBS إلى تقليل تكوين العظم المشتق من RANK-L ، بالإضافة إلى ظهور أعداد منخفضة من الخلايا متعددة النوى TRAP + في عناصر التحكم M-CSF (الشكل التكميلي 3). لذلك، لتحقيق نتائج متسقة، ينصح باختبار دفعات FBS جديدة قبل الاستخدام والاستمرار في نفس الدفعة طوال التجارب لتقليل الاختلافات في عملية التمايز. بالإضافة إلى ذلك ، فإن التباين من جهة مانحة إلى مانحة ، من حيث العدد الإجمالي ل OCs المتمايزة التي تم الحصول عليها في نقطة زمنية نهائية ، يشكل قيدا عند استخدام هذا البروتوكول لمقارنة ، على سبيل المثال ، المتبرعين الأصحاء بالمرضى. في هذه الحالات ، من الضروري استخدام نفس الظروف بالضبط ونفس الكمية من الكواشف المتوسطة و FBS والكواشف الأخرى.
خطوة أخرى ضرورية لتمايز OC الأمثل والنضج هي تحضير الخلايا الوحيدة باستخدام M-CSF قبل إضافة RANKL. يؤدي تعرض الخلايا ل M-CSF 18-24 h قبل RANKL إلى تهيئة الخلايا الوحيدة لتنظيم تعبير RANK15,26. تضمن إضافة RANKL في هذه المرحلة الزمنية التمايز الأمثل OC بطريقة تعتمد على الجرعة. تختلف درجة تمايز OC من مانح إلى آخر. ومع ذلك ، فإن 25 نانوغرام / مل RANKL عادة ما تكون كافية للتمييز بين عدد كبير من OCs في معظم الجهات المانحة. بالإضافة إلى ذلك ، يمكن استخدام 25 نانوغرام / مل RANKL في المقايسات للفحص الأولي للمركبات ، لأنه يسهل تقييم كل من التأثيرات المعززة والمثبطة لمركبات الاختبار. استخدمت أنظمة الاستزراع الأخرى أوقات أطول قبل حضانة M-CSF قبل إضافة RANKL ، ولكن هذا يؤدي إلى وقت زراعة أطول لتكوين العظم50. بالإضافة إلى ذلك ، فإن ترك الخلايا الوحيدة المهيأة لاحتضانها بين عشية وضحاها يسمح لها بالالتصاق باللوحة ، وإن لم تكن في حالة ملتصقة تماما. لذلك ، عند تقديم RANKL لأول مرة ، يجب تغيير الوسط نصف بعناية فائقة بدلا من تغييره بالكامل لمنع انفصال وفقدان الخلايا الوحيدة المجهزة. يحتاج الوسيط أيضا إلى التحديث كل 3-4 أيام لتجنب النضوب المتوسط ومنع موت الخلايا. علاوة على ذلك ، نظرا للحجم المنخفض المستخدم في هذا الفحص (100 ميكرولتر / بئر في صفيحة 96 بئرا) ، من الأهمية بمكان وجود إطار من الآبار الفارغة المملوءة بمحلول مائي (أي H2O أو PBS المقطر المعقم) حول آبار الفحص. هذا يمنع التبخر المتوسط وتأثيرات الحافة.
أخيرا ، بالنسبة للمقايسات الأيضية (على سبيل المثال ، مقايسات ATP) ، من الضروري أن تكون الخلايا قابلة للحياة لتجنب الانحراف المعياري الهائل بين النسخ المتماثلة (الشكل 5). تعد الصلاحية العالية للخلايا مهمة أيضا لفرز الخلايا ولمزيد من زراعة OCs المصنفة (الشكل 4). هذه الطريقة ، ومع ذلك ، لديها العديد من القيود. OCs الناضجة تماما ملتصقة للغاية ويصعب فصلها عن اللوحات. غالبا ما يكون من المستحيل فصل OCs الأكبر ، مما قد يؤدي إلى انخفاض إنتاجية الخلايا. لذلك ، يجب حساب الخلايا بعد الفرز وقبل الطلاء بالتركيز المطلوب. علاوة على ذلك ، في البروتوكول الحالي ، يتم استخدام طريقة غير إنزيمية (accutase) لفصل OCs لمنع تغيرات الغشاء في تلطيخ سطح المصب لقياس التدفق الخلوي. كما تم اختبار استخدام كاشطات الخلايا (ذات النهايات الناعمة أو الصلبة) وأدى إلى موت الخلايا المرتفع. يمكن استخدام الانفصال الأنزيمي باستخدام محاليل Trypsin / EDTA بنسبة 0.05٪ للحصول على إنتاجية أعلى من OCs المنفصلة عندما لا تكون سلامة الغشاء مطلوبة للتطبيقات النهائية. بالإضافة إلى ذلك ، لمنع OCs من التكتل معا ، يوصى بشدة باستخدام تركيز عال من EDTA في جميع المخازن المؤقتة بعد انفصال الخلايا ، وكذلك الترشيح المناسب قبل اكتساب قياس التدفق الخلوي. من المهم ملاحظة أن ثقافات OC هي مجموعة غير متجانسة من الخلايا تتكون من OCs الناضجة وسلائف OC والبلاعم. يمكن تمييز البلاعم بسهولة عن OCs ، على الرغم من أن كلا من OCs أحادية النواة و OCs متعددة النواة تعبر عن OSCAR ولا يمكن تمييزها بالطريقة الحالية (الشكل 4). والواقع أن هذه المسألة الأخيرة تشكل القيد الرئيسي لهذه الطريقة. بالإضافة إلى ذلك ، يوجد تعبير منخفض عن OSCAR أيضا في ثقافات M-CSF (الشكل 4B) وقد يشير إلى البلاعم التي يتم إعدادها للالتزام بنسب OC. من المهم ضبط بوابة خلايا OSCAR + بناء على إشارة تلطيخ FMO ، كما هو موضح في الشكل 4B.
باختصار ، يصف هذا البروتوكول طريقة محسنة وقوية للإنتاج الفعال ل OCs النشطة والناضجة وظيفيا من الخلايا الوحيدة البشرية الأولية المتداولة. تكمن قوة هذا البروتوكول في قدرته على توليد OCs في فترة زمنية قصيرة وإنتاج أعداد كبيرة من OCs المتباينة. تفتح هذه الطريقة الطريق للتحقيق في الآليات الأساسية الكامنة وراء تمايز OC ووظيفته.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم مصالح متنافسة.
Acknowledgements
يعترف المؤلفون بامتنان بمرفق Flow Core ومرفق التصوير في غلاسكو (GIF) داخل كلية العدوى والمناعة لدعمهم ومساعدتهم في هذا العمل.
Materials
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 well chamber slides | ibidi | 81816 | |
| 8-well glass chamber slides | Ibidi | 80807 | |
| 96-well TC plate | Corning | 3596 | |
| 96-well osteo assay stripwell plate | Corning | 3989 | |
| Acetate solution | Sigma Aldrich | 386-3 | from kit Cat No. 387A-1KT |
| Acetone | VWR | 20066.330 | |
| Acid phosphatase, Leukocyte (TRAP) kit | SIGMA-ALDRICH | 387A-1KT | |
| Alexa Fluor 488 Phalloidin | Theremo Fisher - Invitrogen | A12379 | AF488 |
| Alexa Fluor 647 Phalloidin | Thermo Fisher - Invitrogen | A22287 | AF647 |
| Alfa Aesar 2-Deoxy-D-glucose | Fisher Scientific | 11321867 | 2DG, 98% |
| Alpha minimum essential medium | gibco | 22571-020 | |
| ATPlite 1step | PerkinElmer | 6016731 | Luminiscence ATP detection assay system |
| BD FACSAria III cell sorter | BD Biosciences | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418-100G | |
| Cell culture microplate, 96-well, PS, F-bottom | Greiner bio-one | 655083 | White-bottom plates |
| Citrate solution | Sigma Aldrich | 91-5 | from kit Cat No. 387A-1KT |
| Corning 6ml round-bottom polystyrene test tubes | Fisher Scientific | 352054 | |
| Corning osteo assay surface multiple well plate | Sigma-Aldrich | CLS3989 | |
| Corning osteo assay Surface multiple well plate 1 x 8 stripwell | Corning | CLS3989-2EA | |
| DAPI | Theremo Fisher | D3571 | |
| EasySep human CD14 positive selection kit | STEMCELL Technologies | 17858 | |
| EasySep red blood cell lysis buffer (10x) | StemCell Technologies | 20110 | |
| eBioscience fixable viability dye eFluor 780 | Theremo Fisher - Invitrogen | 65-0865-14 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E7889-100ML | |
| EVOS FL auto imaging system | Thermo Fisher | A32678 | |
| Falcon round-bottom polypropylene test tubes with cap | Fisher Scientific | 10314791 | |
| Falcon tubes 15 mL | Corning | 430790 | |
| Falcon tubes 50 mL | Corning | 430828 | |
| Fast Garnet GBC base solution | Sigma Aldrich | 387-2 | from kit Cat No. 387A-1KT |
| Fetal bovine serum | gibco | 10500-064 | FBS |
| Ficoll-Paque Plus | cytiva | 17144003 | |
| Formaldehyde | Sigma-Aldrich | F-8775 | |
| Human sRANK ligand | PEPROTECH | 310-01-100UG | Receptor activator of nuclear factor kappa-B ligand (RANKL) |
| ImageJ Image analysis software | Image J | version 2.9.0 | |
| L-glutamine | gibco | 25030-024 | |
| Lithium heparin tubes (9 mL) | VACUETTE | 455084 | |
| Macrophage colony-stimulating factor | PEPROTECH | 300-25-100UG | M-CSF |
| Napthol AS-BI phosphoric acid solution | Sigma Aldrich | 387-1 | from kit Cat No. 387A-1KT |
| Neubauer hemacytometer counting chamber | Camlab | SKU 1127885 | |
| Oligomycin from Streptomyces Diastatochromogenes | Sigma-Aldrich | Q4876-5MG | |
| OSCAR Antibody, anti-human, Vio Bright FITC, REAfinit | Miltenyi Biotec | 130-107-661 and 130-107-617 | Clone REA494 |
| PE/Cyanine7 anti-human CD14 antibody | Biolegend | 325618 | Clone HCD14 |
| Penicilin/streptomycin | SIGMA | P0781 | |
| PHERAstar machine and software | BMG LABTECH | ||
| Phosphate-buffered saline (DPBS, 1x) | gibco | 14190-094 | |
| REA control antibody (S), human IgG1, Vio Bright FITC, REAfinity | Miltenyi Biotec | 130-113-443 | |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044-1L | |
| Sodium nitrite solution | Sigma Aldrich | 91-4 | from kit Cat No. 387A-1KT |
| Tartrate solution | Sigma Aldrich | 387-3 | from kit Cat No. 387A-1KT |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Trypan blue | Sigma-Aldrich | T8154-100ML |
References
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Boyce, B. F., Xing, L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives Of Biochemistry and Biophysics. 473 (2), 139-146 (2008).
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Agemura, T., Hasegawa, T., Yari, S., Kikuta, J., Ishii, M. Arthritis-associated osteoclastogenic macrophages (AtoMs) participate in pathological bone erosion in rheumatoid arthritis. Immunological Medicine. 45 (1), 22-26 (2022).
- Hasegawa, T., et al. Identification of a novel arthritis-associated osteoclast precursor macrophage regulated by FoxM1. Nature Immunology. 20 (12), 1631-1643 (2019).
- Walsh, N. C., Crotti, T. N., Goldring, S. R., Gravallese, E. M. Rheumatic diseases: The effects of inflammation on bone. Immunological Reviews. 208 (1), 228-251 (2005).
- Gravallese, E. M., et al. Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis. The American Journal of Pathology. 152 (4), 943-951 (1998).
- Bromley, M., Woolley, D. E. Chondroclasts and osteoclasts at subchondral sites of erosion in the rheumatoid joint. Arthritis & Rheumatism. 27 (9), 968-975 (1984).
- Kleyer, A., Schett, G. Arthritis and bone loss: A hen and egg story. Current Opinion in Rheumatology. 26 (1), 80-84 (2014).
- Kawai, V. K., Stein, C. M., Perrien, D. S., Griffin, M. R. Effects of anti-tumor necrosis factor α (anti-TNF) agents on bone. Current Opinion in Rheumatology. 24 (5), 576-585 (2012).
- Siebert, S., Tsoukas, A., Robertson, J., McInnes, I. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases. Pharmacological Reviews. 67 (2), 280-309 (2015).
- Smiljanovic, B., et al. Monocyte alterations in rheumatoid arthritis are dominated by preterm release from bone marrow and prominent triggering in the joint. Annals of the Rheumatic Diseases. 77 (2), 300-308 (2018).
- Anderson, J. R., et al. 1H NMR metabolomics identifies underlying inflammatory pathology in osteoarthritis and rheumatoid arthritis synovial joints. Journal of Proteome Research. 17 (11), 3780-3790 (2018).
- McGarry, T., et al. Rheumatoid arthritis CD14+ monocytes display metabolic and inflammatory dysfunction, a phenotype that precedes clinical manifestation of disease. Clinical & Translational Immunology. 10 (1), 1237(2021).
- Ansalone, C., et al. TNF is a homoeostatic regulator of distinct epigenetically primed human osteoclast precursors. Annals of the Rheumatic Diseases. 80 (6), 748-757 (2021).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis and Rheumatology. 73 (7), 1145-1154 (2021).
- Allard-Chamard, H., et al. Osteoclasts and their circulating precursors in rheumatoid arthritis: Relationships with disease activity and bone erosions. Bone Reports. 12, 100282(2020).
- Takegahara, N., et al. Involvement of receptor activator of nuclear factor-κB ligand (RANKL)-induced incomplete cytokinesis in the polyploidization of osteoclasts. The Journal of Biological Chemistry. 291 (7), 3439-3454 (2016).
- Jansen, I. D. C., Vermeer, J. A. F., Bloemen, V., Stap, J., Everts, V. Osteoclast fusion and fission. Calcified Tissue International. 90 (6), 515-522 (2012).
- McDonald, M. M., et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 184 (5), 1330-1347 (2021).
- Lacey, D. L., et al. Bench to bedside: Elucidation of the OPG-RANK-RANKL pathway and the development of denosumab. Nature Reviews Drug Discovery. 11 (5), 401-419 (2012).
- Zhao, B., Grimes, S. N., Li, S., Hu, X., Ivashkiv, L. B. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J. The Journal of Experimental Medicine. 209 (2), 319-334 (2012).
- Zhao, B. Does TNF promote or restrain osteoclastogenesis and inflammatory bone resorption. Critical Reviews in Immunology. 38 (4), 253-261 (2018).
- Crotti, T. N., et al. Receptor activator NF-κB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Annals of the Rheumatic Diseases. 61 (12), 1047-1054 (2002).
- Kim, H. R., et al. Reciprocal activation of CD4+ T cells and synovial fibroblasts by stromal cell-derived factor 1 promotes RANKL expression and osteoclastogenesis in rheumatoid arthritis. Arthritis and Rheumatology. 66 (3), 538-548 (2014).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor κB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Hayman, A. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
- Nedeva, I. R., Vitale, M., Elson, A., Hoyland, J. A., Bella, J. Role of OSCAR signaling in osteoclastogenesis and bone disease. Frontiers in Cell and Developmental Biology. 9, 780(2021).
- Boyce, B. F., Yoneda, T., Lowe, C., Soriano, P., Mundy, G. R. Requirement of pp60c-src expression for osteoclasts to form ruffled borders and resorb bone in mice. The Journal of Clinical Investigation. 90 (4), 1622-1627 (1992).
- Matsubara, T., et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin. Biochemical and Biophysical Research Communications. 489 (4), 472-476 (2017).
- Roscher, A., et al. The F-actin modulator SWAP-70 controls podosome patterning in osteoclasts. Bone Reports. 5, 214-221 (2016).
- Jurdic, P., Saltel, F., Chabadel, A., Destaing, O. Podosome and sealing zone: Specificity of the osteoclast model. European Journal of Cell Biology. 85 (3-4), 195-202 (2006).
- Francis, M. J. O., et al. ATPase pumps in osteoclasts and osteoblasts. The International Journal of Biochemistry & Cell Biology. 34 (5), 459-476 (2002).
- Kwak, H. B., et al. Inhibition of osteoclast differentiation and bone resorption by rotenone, through down-regulation of RANKL-induced c-Fos and NFATc1 expression. Bone. 46 (3), 724-731 (2010).
- Massey, H. M., Flanagan, A. M. Human osteoclasts derive from CD14-positive monocytes. British Journal of Haematology. 106 (1), 167-170 (1999).
- Xue, J., et al. CD14+CD16-monocytes are the main precursors of osteoclasts in rheumatoid arthritis via expressing Tyro3TK. Arthritis Research and Therapy. 22 (1), 221(2020).
- Marco-Casanova, P., et al. Preparation of peripheral blood mononuclear cell pellets and plasma from a single blood draw at clinical trial sites for biomarker analysis. Journal of Visualized Experiments. (169), e60776(2021).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Matsuzaki, K., et al. Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. Biochemical and Biophysical Research Communications. 246 (1), 199-204 (1998).
- Shalhoub, V., et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell precursors. Journal of Cellular Biochemistry. 72 (2), 251-261 (1999).
- Neale, S. D., Smith, R., Wass, J. A. H., Athanasou, N. A. Osteoclast differentiation from circulating mononuclear precursors in Paget's disease is hypersensitive to 1,25-dihydroxyvitamin D3 and RANKL. Bone. 27 (3), 409-416 (2000).
- Abdallah, D., et al. An optimized method to generate human active osteoclasts from peripheral blood monocytes. Frontiers in Immunology. 9, 632(2018).
- Komano, Y., Nanki, T., Hayashida, K., Taniguchi, K., Nobuyuki, M. Identification of a human peripheral blood monocyte subset that differentiates into osteoclasts. Arthritis Research and Therapy. 8 (5), 152(2006).
- Kylmäoja, E., et al. Peripheral blood monocytes show increased osteoclast differentiation potential compared to bone marrow monocytes. Heliyon. 4 (9), 00780(2018).
- Wang, D., et al. Platelet-rich plasma inhibits RANKL-induced osteoclast differentiation through activation of Wnt pathway during bone remodeling. International Journal of Molecular Medicine. 41 (2), 729-738 (2018).
- Cenni, E., Avnet, S., Fotia, C., Salerno, M., Baldini, N. Platelet-rich plasma impairs osteoclast generation from human precursors of peripheral blood. Journal of Orthopaedic Research. 28 (6), 792-797 (2010).
- D'Amico, L., Roato, I. Cross-talk between T cells and osteoclasts in bone resorption. BoneKEy Reports. 1 (6), 82(2012).
- Quinn, J. M. W., Elliott, J., Gillespie, M. T., Martin, T. J. A combination of osteoclast differentiation factor and macrophage-colony stimulating factor is sufficient for both human and mouse osteoclast formation in vitro. Endocrinology. 139 (10), 4424-4427 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved