Method Article
Fonksiyonel Osteoklastların İnsan Periferik Kanı CD14+ Monositlerinden Farklılaşması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Osteoklastlar vücuttaki anahtar kemik emici hücrelerdir. Bu protokol, osteoklastların insan periferik kan monositlerinden in vitro farklılaşması için güvenilir bir yöntem tanımlamaktadır. Bu yöntem, homeostazda ve hastalıklarda osteoklast biyolojisini daha iyi anlamak için önemli bir araç olarak kullanılabilir.
Özet
Osteoklastlar (OC'ler), iskelet gelişiminde ve yetişkin kemik yeniden şekillenmesinde önemli rol oynayan kemik emici hücrelerdir. Birçok kemik bozukluğu, OC'lerin artmış farklılaşması ve aktivasyonundan kaynaklanır, bu nedenle bu patobiyolojinin inhibisyonu anahtar bir terapötik prensiptir. OC'lerin miyeloid öncüllerden farklılaşmasını sağlayan iki temel faktör vardır: makrofaj koloni uyarıcı faktör (M-CSF) ve nükleer faktör kappa-B ligandının (RANKL) reseptör aktivatörü. İnsan dolaşımındaki CD14 + monositlerin in vitro OC'lere farklılaştığı uzun zamandır bilinmektedir. Bununla birlikte, maruz kalma süresi ve RANKL konsantrasyonu, farklılaşma verimliliğini etkiler. Gerçekten de, in vitro insan OC'lerinin üretimi için protokoller tanımlanmıştır, ancak bunlar genellikle zayıf ve uzun bir farklılaşma sürecine neden olmaktadır. Burada, işlevsel olarak aktif olgun insan OC'lerini zamanında üretmek için sağlam ve standartlaştırılmış bir protokol sağlanmıştır. CD14 + monositler, insan periferik kan mononükleer hücrelerinden (PBMC'ler) zenginleştirilir ve RANK'yi yükseltmek için M-CSF ile astarlanır. Daha sonra RANKL'ye maruz kalmak, doza ve zamana bağlı bir şekilde OC'ler üretir. OC'ler, tartarat aside dirençli fosfataz (TRAP) ve ışık mikroskobu analizi ile boyanarak tanımlanır ve ölçülür. Çekirdeklerin ve F-aktinin immünofloresan boyaması, fonksiyonel olarak aktif OC'leri tanımlamak için kullanılır. Ek olarak, OSCAR + CD14 − olgun OC'ler, akış sitometri hücresi sıralama ve OC işlevselliği mineral (veya dentin / kemik) rezorpsiyon testleri ve aktin halkası oluşumu ile ölçülerek daha da zenginleştirilir. Son olarak, bilinen bir OC inhibitörü olan rotenon, olgun OC'lerde kullanılır ve adenozin trifosfat (ATP) üretiminin aktin halkası bütünlüğü ve OC fonksiyonu için gerekli olduğunu gösterir. Sonuç olarak, bu çalışmada, aktin halkası boyama ve ATP testi ile kombinasyon halinde, OC fonksiyonunu değerlendirmek ve farklılaşma sürecini modüle edebilen yeni terapötik bileşikleri taramak için yararlı bir in vitro model sağlayan bu çalışmada çok sayıda OC'yi ayırt etmek için sağlam bir tahlil yapılmıştır.
Giriş
Osteoklastlar (OC'ler), kemiği rezorbe etmek için eşsiz bir kapasiteye sahip hematopoetik soyun çok çekirdekli dev hücreleridir. İskelet 1,2'nin geliştirilmesinden ve sürekli yeniden şekillendirilmesinden sorumludurlar. Gelişimin iskelet evrelerinde, OC'ler ve dokuda yerleşik makrofajlar eritro-miyeloid progenitörlerden türetilir ve kemik nişini ve organ dokularını kolonize eder. Fizyolojik koşullarda, normal kemik gelişimi ve diş erüpsiyonu için eritro-miyeloid progenitörler gereklidir, dolaşımdaki kan monositlerinin kemik nişine akması, OC'lerin, kemik kütlesinin ve kemik iliği boşluğunun doğum sonrası bakımını sağlar3. Patolojik koşullar altında, monositler aktif inflamasyon bölgelerine alınır ve patolojik kemik yıkımına katkıda bulunabilir 4,5.
Çeşitli artrit formları olan hastalar eklem iltihabı yaşarlar ve OCs6'nın neden olduğu ilerleyici eklem yıkımına yol açarlar. Örneğin, romatoid artritte (RA), aşırı aktive olmuş OC'ler patolojik kemik erozyonu ve eklem yıkımından sorumludur 7,8 ve mevcut tedaviler genellikle kemik hasarını iyileştirmez veya durdurmaz 9,10,11. RA hastalarında dolaşımdaki monositlerde hem popülasyon dağılımı hem de transkriptomik ve epigenetik imzalar açısından değişiklikler bildirilmiştir12,13,14. Ayrıca, aktif hastalığı olan RA hastalarında inflamatuar stimülasyona verilen monosit yanıtlarının değişmiş monosit yanıtlarının osteoklastogenezi etkilediği bildirilmiştir15,16,17.
OC'lerin farklılaşması, miyeloid öncü hücrelerin OC öncüllerine farklılaşmaya bağlılığını içeren karmaşık çok adımlı bir süreçtir. Osteoklastogenez sırasında, OC'ler hücre-hücre füzyonu, eksik sitokinezi ve fisyon ve füzyon 18,19,20 olarak tanımlanan nükleer bir geri dönüşüm süreci yoluyla dev ve çok çekirdekli hale gelir. OC'leri in vitro olarak ayırt etme yeteneği, kemik biyolojisinin anlaşılmasında önemli ilerlemelere izin vermiştir21. OC'ler, makrofaj koloni uyarıcı faktöre (M-CSF) ve nükleer faktör kappa-B ligandının (RANKL) reseptör aktivatörüne maruz kaldıklarında öncüllerden ayrılırlar. İkincisi, enflamatuar koşullar altında bile OC'lerin in vitro ve in vivo normal gelişimi ve işlevi için gereklidir 6,22,23. RANKL, osteoblastlar ve osteositlerin yanı sıra iltihaplı RA sinovyum 2,24,25'teki aktive T hücreleri ve fibroblastlar tarafından sunulur. OC farklılaşma işlemi sırasında, M-CSF'ye maruz kalan monositler, hücre zarlarındaki nükleer faktör kappa-B (RANK) ekspresyonunun reseptör aktivatörünü yukarı regüle eder ve daha sonra RANKL ile uyarılma altında, tartarat dirençli asit fosfataz (TRAP) pozitif mononükleer pre-OC'lere ve daha sonra çok çekirdekli OC'lere 15,26'ya farklılaşır. OC'ler birkaç enzim üretir, bunların arasında en önemlisi, kemik27 içindeki fosfoproteinlerin parçalanmasını sağlayan TRAP'tır. OC farklılaşmasının bir düzenleyicisi ve belirteci, OC ile ilişkili reseptördür (OSCAR). OC soyu28'e bağlı öncü hücrelerde erken regüle edilir. Olgun dev çok çekirdekli OC'ler, karıştırılmış bir sınır21,29,30'u çevreleyen bir aktin halkasından yapılmış büyük bir sızdırmazlık bölgesi oluşturarak iskelet matrisini bozabilir (rezorbe edebilir). OC'lerin kemik rezorpsiyon kabiliyeti, sitoiskeletin yeniden düzenlenmesini ve bunun sonucunda polarizasyonu ve karıştırılmış sınır olarak adlandırılan kıvrımlı bir zarın oluşumunu gerektirir. Karıştırılmış sınır, aktin halkası veya sızdırmazlık bölgesi olan F-aktin bakımından zengin bir yapının büyük bir dairesel bandı ile çevrilidir. Aktin halka bütünlüğü, OC'lerin hem in vitro hem de in vivo kemiği rezorbe etmesi için gereklidir ve kusurlu karıştırılmış sınır oluşumu alt vakuolar adenozin trifosfataz (V-ATPaz) ekspresyonu31,32,33 ile ilişkilidir. Dahası, OC'ler mitokondri bakımından zengin hücrelerdir ve adenozin trifosfat (ATP), karıştırılmış sınırda lokalize olan OC'lerdeki mitokondriyal benzeri yapılarla ilişkilidir31,32,33. Rotenon, mitokondriyal kompleks I'in güçlü bir inhibitörü olarak işlev görür ve ATP üretimini etkiler. Rotenonun ayrıca OC farklılaşmasını ve fonksiyon34'ü inhibe ettiği gösterilmiştir.
Bu protokol, insan periferik kan örneklerinden in vitro osteoklastogenezin etkili ve optimize edilmiş bir yöntemini tanımlamaktadır. İnsan periferik kanında CD14+ monositler OC'lerinana kaynağıdır 15,35,36. Bu protokolde, maruziyetin kinetiği ve M-CSF ve RANKL konsantrasyonları optimum osteoklastogenez için ayarlanmıştır. Mononükleer hücreler ilk önce tam kanda bulunan eritrositlerden ve granülositlerden yoğunluk gradyanı ile ayrılır; daha sonra manyetik boncuklarla pozitif seleksiyon kullanılarak CD14 + monositler için zenginleştirilirler. İzole CD14+ monositler daha sonra M-CSF ile gece boyunca inkübe edilir. Bu, monositleri RANK 15,26'nın ifadesini yukarı regüle etmeye hazırlar. Daha sonra RANKL'nin eklenmesi, osteoklastogenezi ve multinükleasyonu zamana bağlı bir şekilde indükler. Aktif emici OC'ler, hücre zarının kenarındaki F-aktin halkalarının karakteristik dağılımını30,32 ve TRAP için boyama gösterir. Olgun OC'ler, TRAP + çok çekirdekli (üçten fazla çekirdek) hücrelerin nicelleştirilmesiyle analiz edilir. Olgun OC'lerin fonksiyonel kapasiteleri rezorpsiyonları, aktin halkası bütünlüğü ve ATP üretimi ile değerlendirilebilir. Ayrıca, farklılaştırılmış CD14-OSCAR + OC'ler zenginleştirilebilir ve bazı bileşiklerin OC işlevselliği üzerindeki etkilerini mineral (veya dentin) rezorpsiyonu ve F-aktin organizasyonu yoluyla değerlendirmek için kullanılabilir. Ek olarak, bu çalışmada, bilinen bir OC inhibitörü olan rotenone, OC'lerin işlevselliğini etkileyen bir bileşiğin bir örneği olarak kullanılmıştır. Rotenon altında azalmış OC rezorpsiyon aktivitesi, azalmış ATP üretimi ve aktin halkası parçalanması ile ilişkilidir. Sonuç olarak, bu protokol, OC farklılaşmasının ve fonksiyonunun in vitro olarak çeşitli biyolojik yönlerini incelemek için referans yöntem olarak kullanılabilecek sağlam bir tahlil oluşturur.
Bu metodoloji, (1) dolaşımdaki monositlerin sağlık ve hastalıklarda OC'lere farklılaşma potansiyelini ve (2) terapötik adayların OC farklılaşması ve fonksiyonu üzerindeki etkisini değerlendirmek için kullanılabilir. Bu sağlam osteoklastogenez protokolü, kemik hedefli tedavilerin hem öncü hücrelerden OC farklılaşması hem de olgun OC'lerin fonksiyonu üzerindeki etkinliğinin ve mekanizmalarının belirlenmesini sağlar.
Protokol
İskoç Ulusal Kan Transfüzyon Servisi'nden (Edinburgh) elde edilen Buffy paltoları ve NHS Kan ve Nakil'den (Newcastle) elde edilen lökosit konileri, Glasgow Üniversitesi araştırmacılarına, tamamen rıza gösteren NHS kan bağışçılarından tamamen anonimleştirilmiş (tanımlanamayan) bir biçimde sağlanmaktadır. Buffy ceket ve lökosit koni kan bileşenleri, İskoçya veya İngiltere'deki bir NHS kan bağışı merkezinde verilen NHS standart kan bağışından üretilir. Kan bağışçısı, onaylanmış tıbbi araştırma çalışmaları için kullanılmak üzere standart NHS klinik uygulamasında kullanılmayan fazla kan için kan bağışı sırasında bilgilendirilmiş onay verir. NHS Araştırma Etik Komitesi'nden etik onay ve bu kan bağışlarını kullanmak için imzalanmış bağışçı onay formları NHS kan bağışı servisi tarafından tutulur. Bu onaylanmış kan bağışlarına erişim ve onaylanmış tıbbi araştırma çalışmalarında kullanma onayı, Ulusal Kan Transfüzyon Servisi (İskoçya) ve NHS Kan ve Taşımacılığı'nın (İngiltere) standart dahili uygulama ve inceleme süreci kullanılarak aranmış ve kazanılmıştır. Onaylanmış tıbbi araştırma çalışmaları için kan bileşenlerini kullanmak için başka NHS REC onayı veya dahili Glasgow Üniversitesi etik komitesi onayı gerekli değildi.
1. Başlamadan önce genel notlar
- Tüm çalışmalara dikkatle kanla devam edin. Numunelerde bulunabilecek çeşitli bulaşıcı ajanların potansiyel tehlikelerini göz önünde bulundurun.
- Biyogüvenlik laboratuvarında eldiven ve laboratuvar önlükleri giyerek steril koşullar altında tüm çalışmaları dikkatli bir şekilde yürütün.
- Biyogüvenlik bertarafını yerel yönergelere göre gerçekleştirin.
- Yerel otorite yönetmeliklerine göre numune toplamadan önce uygun onay ve etik onayları alın.
- Genel olarak, 1 mL taze kan 1 milyon PBMC verir ve CD14 + monositler PBMC'lerin yaklaşık% 10-30'unu oluşturur. Buna karşılık, bir lökosit konisinin 10 mL'si 5 x 10 8-15 x 108 PBMC içerebilir. PBMC yalıtımı hakkında daha fazla ayrıntı için, önceki bir protokol37'ye bakın.
2. Periferik kan mononükleer hücrelerinin (PBMC'ler) tam kandan izolasyonu
- Sağlıklı donörlerden gerekli miktarda taze kanı lityum heparin toplama tüplerine toplayın.
NOT: Uygun antikoagülanlara sahip diğer toplama tüpleri de kullanılabilir (örneğin, sodyum heparin tüpleri). Daha yüksek hücre sayıları için lökosit konileri veya kabarık katlar kullanılabilir. - PBMC'leri izole etmek için, kanı yeni bir 50 mL tüpe aktarın ve sırasıyla taze kan veya lökosit konileri / kabarık katlar için 1: 1 veya 1: 3 oranında steril 1x fosfat tamponlu salin (PBS) ile seyreltin.
- Hücreleri ters çevirerek birkaç kez yavaşça karıştırın.
- 3 mL yoğunluk gradyan ortamı içeren 15 mL tüpler hazırlayın. Yoğunluk gradyan ortamının üstüne yavaşça 8-10 mL seyreltilmiş kan katlayın ve fren yapmadan oda sıcaklığında (RT) 30 dakika boyunca 400 x g'de santrifüj yapın.
NOT: Karışmayı önlemek için kanı yoğunluk gradyanı ortamının üzerine dikkatlice uygulayın. Karıştırma, PBMC'lerin kaybına neden olabilir. - Üst tabakayı (plazmayı içeren) bir Pasteur pipet ile dikkatlice atın, PBMC'leri içeren alt fazlar arası tabakayı (beyaz, halka benzeri yapı) toplayın ve bu katmanı yeni bir 50 mL tüpe aktarın.
- Hücreleri 50 mL'ye kadar steril 1x PBS ile askıya alın ve RT'de tam frenle 10 dakika boyunca 300 x g'de santrifüj yaparak artık yoğunluk gradyan ortamını yıkayın.
- Artık trombositleri çıkarmak için, işlemi RT'de frensiz 10 dakika boyunca 200 x g'de ek bir yavaş dönüşle tekrarlayın.
- İsteğe bağlı: Kırmızı kan hücrelerinin taşınmasını gidermek için, kırmızı kan hücresi lizis tamponunu (10x, Malzeme Tablosu) 1:10 oranında damıtılmış suda seyreltin ve seyreltilmiş tamponun 3 mL'sini pelet üzerine uygulayın. Karıştırın ve 3 dakika boyunca inkübe edin. Peletleri 50 mL'ye kadar 1x PBS'de yıkayın ve RT'de tam frenle 10 dakika boyunca 300 x g'de santrifüj yapın.
- İzole edilmiş ve saflaştırılmış PBMC'leri 20 mL 1x PBS'de tekrar askıya alın ve bir hemasitometre kullanarak veya diğer standart yöntemleri izleyerek sayın.
NOT: Hücre seyreltme ve hücre sayma yöntemleri, kullanılan hücre yoğunluğuna ve sayma cihazına göre ayarlanmalıdır.
3. PBMC'lerden CD14 + monositlerin zenginleştirilmesi
- CD14+ monositlerini, üreticinin protokolüne göre bir insan CD14+ seçim kiti ile PBMC'lerden izole edin (Malzeme Tablosu).
NOT: Klasik CD14 + CD16 − monositler, OC öncülleri35'in ana kaynağıdır; alternatif saflaştırma yöntemleri düşünülebilir. - 1 x 107 PBMC'leri uygun bir polistiren yuvarlak tabanlı tüpe (yani, seçim kiti mıknatısına uyan) aktarın ve hücreleri 5 dakika boyunca 300 x g'de pelet haline getirin.
- Süpernatanı atın, hücre peletini hücre ayırma tamponunda (PBS,% 2 fetal sığır serumu [FBS], 1 mM etilendiamintetraasetik asit [EDTA]) 1 x 108 hücre / mL'lik nihai bir konsantrasyona kadar askıya alın ve kapağı 10 dakika boyunca açıkken 100 μL başına 10 μL antikor kokteyli ile inkübe edin.
NOT: Hücreler 1 x 108 hücre/mL'de yeniden askıya alınır; Ses düzeylerini buna göre ayarlayın. - İnkübasyondan sonra, 100 μL başına 10 μL manyetik nanopartikül boncukları ekleyin ve kapak açıkken 3 dakika boyunca inkübe edin.
NOT: Antikor kokteylinin ve manyetik boncukların hacimlerini 10 μL/mL konsantrasyon elde edecek şekilde ayarlayın. - Hücre ayırma tamponu ile ses seviyesini 2,5 mL'ye yükseltin, tüpü bir mıknatısa yerleştirin (kapaksız) ve 3 dakika boyunca inkübe edin. Negatif hücre popülasyonunu, tüp hala mıknatısın içindeyken ters çevirerek sürekli bir hareketle atın.
NOT: >2 x 108 PBMC ve daha büyük bir mıknatıs kullanıyorsanız, üreticinin talimatlarını izleyerek hücre ayırma arabelleğiyle 5 mL veya 10 mL'ye kadar doldurun. - Tüpü mıknatıstan çıkarın ve manyetik boncuklara tutturulmuş zenginleştirilmiş CD14 + monositleri, hücre ayırma tamponunun 2,5 mL'sinde askıya alarak yıkayın. Daha önce olduğu gibi mıknatısın içinde 3 dakika inkübe edin, negatif fraksiyonu atın ve bir kez daha tekrarlayın.
- Toplanan tüm hücreleri 5 dakika boyunca 300 x g'de santrifüj edin, süpernatanı atın ve hücreleri 5 mL alfa minimum esansiyel ortamda (α-MEM; Malzeme Tablosu) % 1 L-glutamin,% 1 penisilin / streptomisin (tam α-MEM) ve% 10 FBS ile desteklenir.
NOT: Akış sitometrisi ile zenginleştirme sonrası saflık kontrolü önerilir ve %≥96 saflık beklenmelidir. Ek yıkama adımları (adım 3.6) saflığı artırabilir.
4. OC farklılaşması in vitro
- Bir hemasitometre kullanarak zenginleştirilmiş CD14 + monositleri sayın.
- Hücreleri 5 dakika boyunca 300 x g'de pelet haline getirin ve% 10 FBS ile desteklenmiş tam α-MEM'de 1 x 106 hücre / mL'de yeniden askıya alın.
- OC'leri ayırt etmek için, hücre süspansiyonuna 25 ng / mL'lik son konsantrasyonda M-CSF ekleyin.
NOT: 1 mL hücre süspansiyonu için, 100 μg/mL stok konsantrasyonundan 0,25 μL M-CSF ekleyin. - Hücre süspansiyonunu homojenize etmek için pipetleyerek iyice karıştırın ve düz tabanlı 96 delikli bir plakada 100 μL/kuyucuk plakasını 1 x 10 5 hücre/kuyucuklunihai hücre yoğunluğuna kadar karıştırın.
- Kültür sisteminde orta buharlaşmayı ve kenar etkilerini önlemek için kaplanmış hücrelerin etrafındaki kuyucuklara 200 μL/kuyu steril damıtılmış su ekleyin.
- Hücreleri gece boyunca, yaklaşık 18-20 saat boyunca,% 5 CO2 ile 37 ° C'de inkübe edin.
- Gece boyunca inkübasyondan sonra, bir P200 pipet kullanarak aspirasyon yoluyla ortamın yarısını (50 μL / kuyucuk) dikkatlice çıkarın, kuyunun dibine dokunmaktan kaçının ve 25 ng / mL'lik bir son konsantrasyon için % 10 FBS, 25 ng / mL M-CSF ve 50 ng / mL RANKL içeren taze ılık komple α-MEM ile değiştirin
NOT: 1 mL ortam için, 100 μg/mL stok konsantrasyonundan 0,25 μL M-CSF ve 0,5 μL RANKL ekleyin. - Ortamı her 3 günde bir değiştirin ve hücreleri 7-14 gün boyunca OC'lere ayırın (Şekil 1).
NOT: M-CSF ve RANKL konsantrasyonlarını kültür boyunca tutarlı tutun.
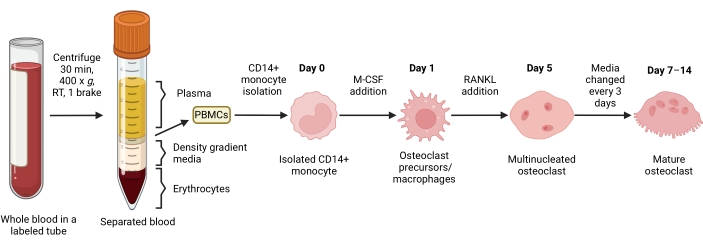
Şekil 1: OC farklılaştırma iş akışı. PBMC'lerden CD14+ monosit izolasyonuna şematik genel bakış ve 7-14 gün boyunca M-CSF ve RANKL varlığında olgun OC'lere farklılaşma. RT = oda sıcaklığı. BioRender.com ile oluşturulan görüntü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
5. Osteoklastlar için TRAP boyama
- Ortamı dikkatlice çıkarın, farklılaşmış yapışkan OC'leri önceden hazırlanmış fiksatif çözeltinin 100 μL / kuyusu ile sabitleyin ve 1 dakika boyunca inkübe edin. Yapışkan hücrelerin çizilmesini önlemek için kuyucukların dibine dokunmayın.
NOT: Fiksatif çözelti aşağıdaki gibi hazırlanır: 12.5 mL sitrat çözeltisi (TRAP boyama kitine dahildir), 32.5 mL aseton ve 5 mL% 37 formaldehit. - Kuyucukları 300 μL steril damıtılmış su ile üç kez yıkayın. Yıkadıktan sonra plakaları kurutun.
- Üreticinin talimatlarına göre bir boyama çözeltisi hazırlayın (Malzeme Tablosu); Hızlı Garnet çözeltisini yapmak için 5 μL Hızlı Garnet ve 5 μL sodyum nitrit ekleyin; 900 μL steril damıtılmış su, 10 μL naftol, 40 μL asetat çözeltisi, 50 μL tartarat çözeltisi ve 10 μL Hızlı Garnet çözeltisini karıştırarak 1 mL boyama çözeltisi hazırlayın.
- 100 μL/kuyucuk taze hazırlanmış boyama çözeltisi ekleyin ve plakayı karanlıkta 37 °C'de 20 dakika boyunca inkübe edin.
- Kuluçkadan sonra, boyama çözeltisini ters çevirerek çıkarın ve plakayı 300 μL / damıtılmış su kuyusu ile üç kez yıkayın.
- Tabakları kağıt havluların üzerine dokunarak fazla suyu çıkarın. Plakaları açık bırakın ve gece boyunca hava kuruması için ışıktan koruyun.
NOT: Kuru plakalar 6 aya kadar saklanabilir. Bazen, artık tamponlar mikroskop altında görülebilen küf gelişimini teşvik edebilir; Bu, etkilenen kuyucukları damıtılmış suyla yıkayarak ve tekrar hava kurumasını sağlayarak herhangi bir zamanda çıkarılabilir. - Tüm kuyu yüzeyini yakalamak için karo seçeneğine sahip bir parlak alan mikroskobu kullanarak 10x veya 20x'te görüntü çekin.
- Hücre sayacı eklentisine sahip bir görüntü analiz yazılımı kullanarak üçten fazla çekirdeğe sahip TRAP+ mor boyalı hücreler olarak tanımlanan OC'leri manuel olarak sayın.
NOT: Kuyu başına TRAP+ OC sayıları donöre bağlıdır ve ~200-1.600 OC / kuyu arasında değişebilir, ortalama yaklaşık 1.000 OC / kuyu ile değişebilir. Ayrıca, verileri analiz etmek için, OC sayıları üç farklı kuyucukta (teknik replikalar) belirlenmeli ve her koşul ve her biyolojik replika için ortalama hesaplanmalıdır.
6. Kemik rezorpsiyon testi
- Taze zenginleştirilmiş CD14+ monositleri, kalsiyum fosfatla kaplanmış 96 delikli osteo-tahlil plakaları üzerine 1 x 105 hücre/kuyuda plakalayın ve OC'leri 4.1-4.8. adımlarda belirtildiği gibi 7-14 gün boyunca ayırt edin ve ortamı her 3 günde bir değiştirin.
NOT: Osteo-tahlil plakaları yerine dentin / fildişi veya sığır kortikal kemik dilimleri kullanılabilir. Eğer öyleyse, kültürün toplam süresi, emilecek daha karmaşık substrat nedeniyle 14-21 güne uzatılmalıdır. - Bitiş noktasında, kuyucuğun dibine dokunmaktan kaçınarak ortamı dikkatlice çıkarın ve hücreleri% 10 sodyum hipoklorit çözeltisi ile lize edin. Kuyucukları damıtılmış suyla üç kez yıkayın.
- Kuru plakaları parlak alan mikroskobu kullanarak tarayın ve bir görüntü analiz yazılımı kullanarak rezorpsiyon çukurlarının elde edilen görüntülerini analiz edin / ölçün.
7. Aktin halkası floresan boyama
- İzole CD14 + monositlerin plakası 100 μL / kuyusu, 1 x 10 5 hücre /kuyu hücre yoğunluğunda 18 delikli bir oda slaytında. OC'leri daha önce açıklandığı gibi M-CSF ve RANKL varlığında ayırt edin (adım 4.1-4.8), ortamı her 3 günde bir değiştirmek dahil.
- Bitiş noktasında, ortamı yavaşça çıkarın ve her bir kuyucuğu 200 μL / önceden ısıtılmış PBS, pH 7.4 ile iki kez yıkayın. Kuyucukların herhangi bir adım arasında kurumasına izin vermeyin.
- Numuneyi PBS'de 100 μL/kuyucuk %4 formaldehit çözeltisi ile sabitleyin ve hafif sallama ile bir orbital çalkalayıcıda RT'de 10 dakika boyunca inkübe edin.
NOT: Metanol, fiksasyon işlemi sırasında aktini bozabilir. Bu nedenle, metanol içeren fiksatiflerden kaçınmak en iyisidir. Tercih edilen fiksatif metanol içermeyen formaldehittir. Protokolün bu adımında kullanılan yörüngesel çalkalayıcı, 10 üzerinden 3'lük bir güç ayarına ayarlandı. - 200 μL/kuyucuk PBS ile iki kez yıkayın, PBS'de seyreltilmiş %0,1 Triton X-100 çözeltisinin 100 μL/kuyusu ile hücreleri geçirgen hale getirin ve hafif sallama ile bir orbital çalkalayıcıda RT'de 10 dakika inkübe edin.
- 200 μL/kuyucuk PBS ile iki kez yıkayın. Spesifik olmayan bağlanmayı bloke etmek ve sinyali arttırmak için,% 2 sığır serum albümini (BSA) / PBS çözeltisi ile yapılan 100 μL / kuyu bloke edici çözelti ekleyin. RT'de 20 dakika boyunca hafif sallama ile yörüngesel bir çalkalayıcıda inkübe edin.
- Bloke edici çözeltiyi çıkarın ve% 2 BSA / PBS çözeltisi içinde seyreltilmiş 100 μL / kuyucuklu floresan konjuge faloidin çözeltisi ekleyin. RT'de 20 dakika boyunca hafif sallama ve ışıktan korunan bir yörüngesel çalkalayıcı üzerinde inkübe edin.
NOT: Phalloidin boyasının konsantrasyonunu üreticinin tavsiyelerine göre ayarlayın. - 200 μL/kuyucuk PBS ile iki kez yıkayın, çekirdekleri 300 nM DAPI içeren bir PBS çözeltisinin 100 μL/kuyusu ile lekeleyin ve RT'de 10-15 dakika boyunca hafif sallama ve ışıktan korunan bir orbital çalkalayıcıda inkübe edin.
NOT: DAPI, 14,3 mM (5 mg/mL) DAPI stok çözeltisi oluşturmak için damıtılmış suda seyreltilir. Stok çözeltisi ayrıca 300 μM'lik nihai konsantrasyona kadar seyreltilir. Son olarak, 300 μM DAPI çözeltisi PBS'de bir kez daha 300 nM'lik bir nihai konsantrasyona seyreltilir. - 10-15 dakika sonra, DAPI çözeltisini çıkarın ve 100 μL/kuyu PBS ile değiştirin.
NOT: Seçilen hazneli kızaklara bağlı olarak, ya uygun bir PBS hacmiyle (18 delikli hazneli slaytlar için 100 μL/kuyu) saklayın ya da sürgüyü kapak fişleri ve uygun bir montaj ortamı ile monte edin. Oda slaytları buzdolabında 1 haftaya kadar saklanabilir. 18 delikli hazneli slaytlar için, 50-100 μL boyama hacmi ve yıkama için 200-300 μL kullanın. Diğer oda slayt boyutları için ölçeği uygun şekilde artırın. Buharlaşmayı önlemek için, inkübasyon süreleri boyunca kapakları kapalı bir kabın içinde tutun. Bir orbital çalkalayıcının kullanılması tavsiye edilir, ancak gerekli değildir. - Uygun immünofloresan veya konfokal mikroskoplar ve 4x ila 40x arasında büyütmeler kullanarak boyamayı görselleştirin.
8. Olgun OC'lerin ve OC öncüllerinin akış sitometrisi sıralama yoluyla zenginleştirilmesi
- Yeni zenginleştirilmiş CD14+ monositleri 1 x 106 hücre/mL'de yeniden askıya alın ve yukarıda tarif edildiği gibi M-CSF ve RANKL varlığında olgun OC'lere ayırın (adım 4.1-4.8).
NOT: 96 delikli bir plakadan daha büyük bir plaka boyutuna ölçeklendirirken, Tablo 1'i izleyin; Bu hacimler 1 x 106 hücre/mL çözeltiden başlayarak hesaplanır ve hücre-hücre füzyonu için optimum yoğunluk sağlar. - 7. günde, kuyucukları bir kez ılık PBS ile yıkayın ve 1 mL'ye (kullanılan plaka boyutuna göre belirlenen hacim) 50 μL akutaz ekleyin. Hücreleri 37 ° C'de 20 dakika boyunca% 5 CO2 ile inkübe edin.
- İnkübasyondan sonra, hücrelerin ayrılıp ayrılmadığını görmek için plakaları ışık mikroskobu altında kontrol edin. Ayrıca, plakaları her tarafa dokundurarak ve yukarı ve aşağı pipetleyerek hücreleri ayırın.
- Hücre süspansiyonunu 15 mL'lik bir konik tüpte toplayın. Kuyucukları ılık PBS ile yıkayın (Ca 2 + yok, Mg2 + yok) ve bunları hücre süspansiyonu ile birleştirin. Hücrelerin çoğu ayrılana kadar 8.2-8.3 arasındaki adımları bir veya iki kez yineleyin.
NOT: Akış sitometrik analizi için yüzey boyamadan önce önerilen yöntem olan Accutase, çok büyük OC'leri ayırmaz. İyileşme oranı ~% 50 -% 70'tir. - Hücreleri 5 dakika boyunca 300 x g'de santrifüj edin, hücre peletini 1 mL PBS'de yeniden askıya alın ve hücreleri tripan mavisi dışlama ile sayın.
- Hücreleri 1 x 106 hücre / mL'de yeniden askıya alın, 1 x 105 hücreye karşılık gelen 100 μL'yi çıkarın ve bu hücreleri yeni bir polipropilen test tüpüne aktarın. Hücre sıralama tamponundan 200 μL ekleyin ve bunu lekesiz kontrol olarak buz üzerinde bir kenara koyun.
- Hücrelerin geri kalanını RT'de 10 dakika boyunca 1:750'de seyreltilmiş ve ışıktan korunan canlı / ölü boya ile lekeleyin.
NOT: Yüksek arka plan lekelemesini önlemek için FBS'nin yokluğunda canlı/ölü boyama yapılmalıdır. - Canlı/ölü lekeli hücre süspansiyonunu içeren 15 mL toplama tüpünü sıcak hücre sıralama tamponu (1x PBS, Ca 2+, Mg2+, %1 FBS ve 5 mM EDTA) ile doldurun ve hücreleri pelet haline getirmek için 5 dakika boyunca 300 x g'de santrifüj yapın.
NOT: Hücre kümelenmelerini önlemek için sıralama tamponunda yüksek konsantrasyonda EDTA ve düşük FBS konsantrasyonu önerilir. - 1 x 105 hücreye karşılık gelen bir hacmi çıkarın ve bunları OSCAR izotip kontrolü için yeni bir polipropilen test tüpüne aktarın. Kalan tüm hücreleri, boyama ve hücre sıralama için başka bir polipropilen test tüpüne aktarın.
NOT: Polipropilen test tüpleri, hücrelerin bu tüplere polistiren tüplere göre daha az yapışma olasılığı daha düşük olduğu için sıralama için kullanılır. - Hücreleri pelet haline getirmek için tüpleri 5 dakika boyunca 400 x g'de döndürün ve fazla süpernatantı ters çevirerek atın.
- Hücre peletini Tablo 2'yi takiben hazırlanan bir antikor ana karışım çözeltisinde yeniden askıya alın. OSCAR izotip kontrol tüpünü, OSCAR antikoru yerine CD14 antikoru ve OSCAR izotip kontrolü ile lekeleyin.
- Hücreleri 4 ° C'de ışıktan korunarak 30 dakika boyunca inkübe edin.
- 30 dakika sonra, beş hacim hücre sıralama tamponu ekleyerek hücreleri yıkayın ve 4 ° C'de 5 dakika boyunca 400 x g'de santrifüj yapın.
- Hücreleri 300-1.000 μL soğuk hücre ayıklama tamponunda yeniden askıya alın ve 100μM nozul ile donatılmış bir akış sitometri ayıklama makinesi kullanarak hücreleri elde edin.
NOT: OC'ler çok yapışkan hücrelerdir, bu nedenle sıralamadan önce bunları steril bir 70 μm membrandan filtrelemek önemlidir. - OC'leri ve OC öncesi OC'leri CD14−OSCAR+ olarak açın. OSCAR+ kapısını OSCAR izotip kontrol tüpüne göre ayarlayın.
- Sıralanmış hücreleri, 8 ° C'de% 20 FBS ile desteklenmiş tam α-MEM içeren polipropilen test tüplerinde toplayın.
- Sıralamadan sonra, RT'de 5 dakika boyunca 300 x g'de santrifüjleme ile hücreleri pelet haline getirin, hücreleri sayın ve aşağı akış uygulamaları için yeniden askıya alın.
NOT: Genellikle, ~1 x 105 sıralanmış OC öncesi / OC'leri elde etmek için, 0. günde kaplanmış ~ 10 x 106 hücreden başlayın. Düşük iyileşme oranı, akütase ile ayrılma sırasında hücre kaybından ve boyama ve sıralama işleminden etkilenir. Tüm prosedürün steril tamponlar ve reaktifler kullanılarak yapılması ve steril koşullar altında çalışılması önerilir.
9. Mitokondriyal aktivite için ATP testi
- Zenginleştirilmiş CD14+ monositleri, M-CSF ve RANKL varlığında, daha önce tarif edildiği gibi 96 delikli bir plakada inkübe edin (adım 4.1-4.8). Plaka kontrol olarak kullanmak için üçlü olarak dört ekstra koşul.
- ATP testini, üreticinin el kitabına göre lüminesans ATP algılama tahlil kiti ile yapın. Kısaca, ATP çözeltisini hazırlamak için, liyofilize substrata 10 mL substrat tampon çözeltisi ekleyin ve 30 dakika boyunca RT'de inkübe etmeye bırakın.
NOT: Hücre içi ATP üretimini ölçmek için farklı yöntemler kullanılabilir. Burada, ATP üretiminin lüminesans ile tespitini kullandık. - İnkübasyon sırasında, kontrolleri aşağıdaki gibi hazırlayın ve doğrudan kontrol kuyucuklarına ekleyin: 10 mM ve 100 mM'de 2-Deoksi-D-glikoz (2DG), 1 μM'de oligomisin ve 1 μM oligomisin ile kombinasyon halinde 100 mM 2DG. %5 CO2 ile 37 °C'de 30 dakika inkübe edin.
NOT: 2DG glikolizi bloke ederken, oligomisin oksidatif fosforilasyonun bir inhibitörüdür. Bu iki inhibitörün birleştirilmesi, glikoliz ve oksidatif fosforilasyon yoluyla ATP üretiminin tamamen kaybedilmesine neden olur, böylece ATP testi için bir iç kontrol görevi görürler. 10 mM ve 100 mM 2DG kontrolleri için, 100 μL kültür kuyusu başına sırasıyla 0,5 μL ve 5 μL 2M 2DG stok çözeltisi ekleyin. 1 μM oligomisin için, 5 mM stok çözeltisini 1:100 oranında ortada seyreltin ve özel kontrol kuyularına 2 μL/kuyu ekleyin. Son kontrol için, kuyucuk başına 5 μL 2DG ve 2 μL seyreltilmiş oligomisin çözeltisi ekleyin. - Reaksiyonu durdurmak için her bir kuyucuğa 50 μL ATP çözeltisi ekleyin ve RT'de ışıktan korunan 5-10 dakika boyunca 700 rpm'de bir çalkalayıcı üzerinde inkübe edin.
- Süpernatantın 100 μL'sini ATP testi için özel 96 delikli beyaz tabanlı bir plakaya aktarın ve plakayı bir lüminesans okuyucu kullanarak okuyun.
Sonuçlar
CD14+ monositlerden OC üretimi
Bu yöntem, çok sayıda OC'yi insan periferik kan CD14 + monositlerinden in vitro, tipik olarak 1 hafta içinde kolayca ayırt etmeyi amaçlamıştır. İlk olarak, CD14 + monositleri PBMC'lerden zenginleştirildi ve daha önce bildirildiği gibi RANK'ı yükseltmek için bir gecede M-CSF ile astarlandı15. Monosit astarlamayı takiben, OC farklılaşması ve olgunlaşması için optimum RANKL konsantrasyonunu belirlemek için, 25ng / mL M-CSF ile birlikte 1 ng / mL, 25 ng / mL, 50 ng / mL ve 100 ng / mL'lik RANKL konsantrasyonları kullanıldı. RANKL ilavesi, doza bağımlı bir şekilde artan sayıda büyük TRAP-pozitif çok çekirdekli OC üretti ve bu, TRAP boyama kullanılarak değerlendirildi. Olgun OC'ler, çoklu çekirdeğe sahip TRAP-pozitif hücreler olarak tanımlanır (tipik olarak üçten fazla; Şekil 2A,B ve Ek Şekil 1). Ayrıca, OC'nin monositlerden farklılaşmasının kinetiği, 2-14 günlük bir kültür periyodu boyunca TRAP boyama ve ışık mikroskobu kullanılarak araştırıldı. Bu örnekte, OC'lerin kültürde ne kadar hızlı farklılaştığını değerlendirmek için 50 ng / mL RANKL'lik bir ara konsantrasyon kullanılarak OC farklılaşması seçildi. Bu kültür koşullarında, çok çekirdekli OC'ler 5. günden itibaren görülebildi ve 7. günde optimal farklılaşmaya ulaşıldı (Şekil 2C). Kültürlerin plastikler üzerinde 10 günden fazla uzun süre inkübasyonu, anormal derecede dev kaynaşmış hücrelerle sonuçlandı. Bu protokolde, 6-8. günler genellikle OC üretiminin optimal bitiş noktası olarak kullanılır. OC'ler ölçülebilir veya aşağı akış testleri için kullanılabilir.
Farklılaştırılmış OC'lerin fonksiyonel değerlendirmesi
Üretilen OC'lerin fonksiyonel aktivitesini belirlemek için, mineralize bir yüzey üzerindeki OC'leri ayırt ederek emici aktivitelerini inceledik. Büyük OC'ler sadece 7 günlük bir kültür periyodundan sonra üretildiğinden ve mineral substratı emmek için yeterli zamana izin vermek için, kültürler 10. güne kadar korunmuştur. Yuvarlak deliklerin veya rezorpsiyon çukurlarının oluşumu, sadece hem M-CSF hem de RANKL ile muamele edilmiş hücreleri içeren kuyucukların mineralize yüzeylerinde gözlenmiştir (Şekil 3). Böylece, çözünmüş mineralize yüzeyin yüzdesi (rezorpsiyon çukurları) OC emici kapasitesinin belirlenmesine izin verir. Ek olarak, bu protokolü takiben 7. güne kadar hem plastik hem de cam hazneli slaytlarda farklılaşan OC'ler, immünofloresan boyama ile görselleştirilebilen iyi organize edilmiş bir aktin halkası yapısı göstermiştir (Ek Şekil 2).
Bir inhibitörün olgun OC fonksiyonu üzerindeki etkisi
Yukarıda belirtilen kültürleme koşulları, bilinen OC inhibitörü rotenon34'ün varlığında in vitro üretilen OC'lerin fonksiyonel kapasitesini belirlemek için kullanılmıştır. OC'ler 6-8 gün boyunca farklılaştırıldı ve CD14-OSCAR+ OC'ler ve OC öncülleri akım sitometrisi ile zenginleştirildi (Şekil 4). Zenginleştirilmiş hücreler daha sonra 3 gün boyunca pro-osteoklastojenik ortamda (25 ng / mL, M-CSF ve RANKL) mineral kaplı 96 delikli bir plaka üzerine kuyu başına 50.000 hücre / kaplanmış olarak kaplandı. Rotenon ile tedavi (Şekil 5A, B) doza bağlı olarak, önceki çalışmalarla tutarlı olarak, tedavi edilmemiş kontrol kuyusuna kıyasla mineralize yüzeyin emilimini inhibe etmiştir34. Ek olarak, OC işlevselliği ATP üretimi ve aktin halkası oluşumu ile değerlendirildi. OC rezorpsiyonunun rotenona bağımlı inhibisyonu, ATP üretiminin inhibisyonu ile ilişkiliydi (Şekil 5C). Rezorbe eden OC'ler, sitoiskelet organizasyonunu teşvik ederek rezorptif kapasitelerini düzenleyen oldukça polarize hücrelerdir. Alexa fluor 647 konjuge phalloidin, rotenon varlığında veya yokluğunda kültürlenen olgun OC'lerin F-aktin sitoiskeletini etiketlemek için kullanıldı. Rotenon, olgun OC'lerin RANKL türevi aktin halkasının parçalanmasına neden olmuştur (Şekil 5D).
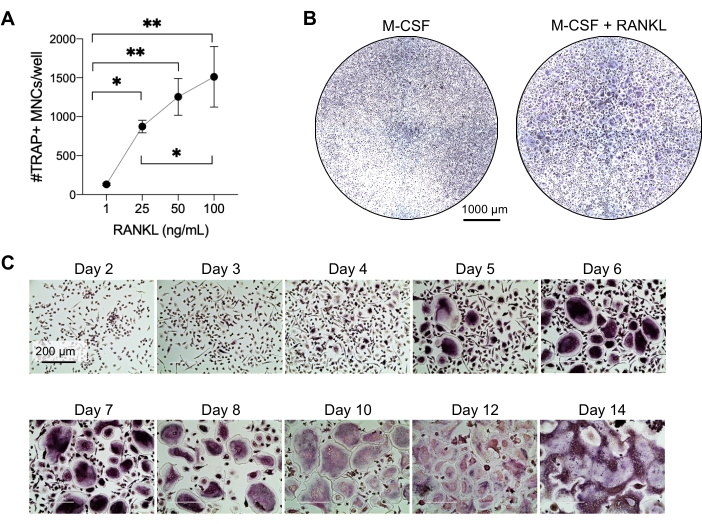
Şekil 2: CD14+ monosit öncüllerinden etkili bir şekilde ayrılan OC'ler. CD14+ monositler manyetik olarak zenginleştirildi, 96 delikli plakalarda 1 x 105 hücre/kuyuda kaplandı ve 25 ng/mL M-CSF ile gece boyunca inkübe edildi. (A) M-CSF astarlı monositler, artan konsantrasyonlarda RANKL (1 ng / mL, 25 ng / mL, 50 ng / mL ve 100 ng / mL) ile uyarıldı, 7. günde sabitlendi ve TRAP için boyandı. Görüntüler elde edildi ve TRAP + çok çekirdekli hücreler (ÇUŞ'lar) sayıldı. TRAP boyamasının temsili görüntüleri Ek Şekil 1'de gösterilmiştir. Hata çubukları ortalama ± SD gösterir (n = 3). Veriler, eşleştirilmiş veriler için tek yönlü ANOVA ve Holm-Sidak'ın çoklu karşılaştırma testi ile analiz edilmiştir; * P ≤ 0.05 ve ** P ≤ 0.005. (B) 7. günde M-CSF türevi makrofajlara kıyasla tipik OC / iyi beklenen OC miktarını ve morfolojilerini 25 ng / mL RANK-L'nin altında gösteren 96 delikli bir plakanın TRAP boyalı bir kuyusunun temsili görüntüsü. Ölçek çubukları: 1000 μm. (C) 50 ng/mL RANKL'nin altındaki OC oluşumunun temsili görüntüleri, 2. günden 14. güne kadar TRAP boyama ile değerlendirildi. OC'ler 5. günden itibaren görülebilir. Dev anormal şekilde kaynaşmış OC'ler 10 gün sonra ortaya çıkar. Ölçek çubukları: 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
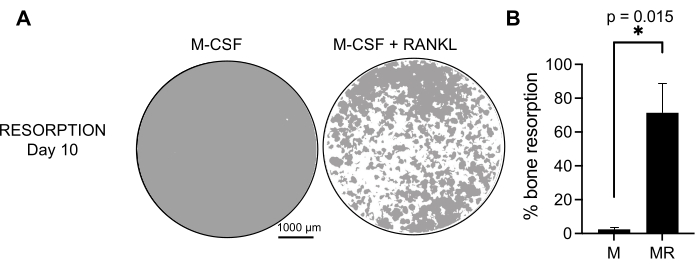
Şekil 3: CD14+ monositlerden farklılaşan emici OC'ler. PBMC'lerden izole edilen CD14+ hücreleri, mineral tahlil yüzey (osteo-tahlil) plakalarında 25 ng/mL, M-CSF (M) ve RANKL (R) varlığında 10 gün boyunca OC'lere farklılaştırıldı. (A) 10. günde rezorpsiyonu analiz etmek için 10x büyütmede çekilen temsili yeniden yapılandırılmış kuyucukların görüntüleri (gri renkte mineral substrat; beyaz renkte rezorpsiyon çukurları). Ölçek çubukları: 1000 μm. (B) Emilen alanın yüzdesinin ölçülmesi. Rezorpsiyon verileri Wilcoxon eşleştirilmiş analizi ile analiz edildi. Hata çubukları ortalama ± SD gösterir (n = 7). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
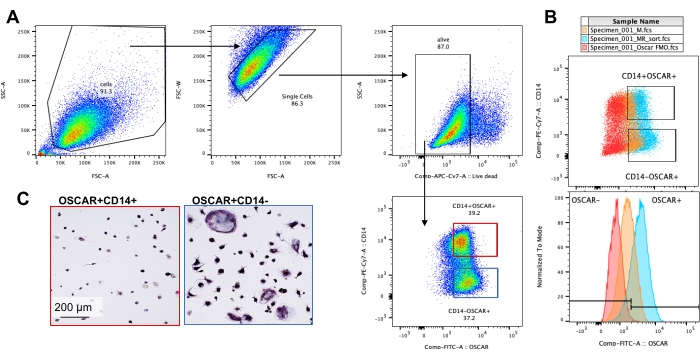
Şekil 4: CD14−OSCAR+ OC'lerin akış sitometrisi zenginleştirmesi. CD14 + monositleri PBMC'lerden zenginleştirildi ve OC'ler daha önce tarif edildiği gibi farklılaştırıldı. Yapışkan OC kültürleri accutase ile ayrıldı ve flow sitometrisi için boyandı. (A-C) 8. gündeki OC'ler CD14 ve OSCAR ekspresyonuna göre sıralandı. (A) Temsilci sıralama geçit stratejisi. Hücreler ölü boyama için negatif olan singlet'lar olarak kapatıldı ve CD14 + OSCAR + (kırmızı) ve CD14 − OSCAR + (mavi) alt kümeleri sıralandı. (B) RANKL türevi OC'lerin (camgöbeği) örtüşen OSCAR boyamasını gösteren temsili grafikler ve kontrol M-CSF türevli makrofajlar (turuncu). Kırmızı renkte, RANKL türevi OC'lerin OSCAR izotip boyalı kontrolü bulunur. (C) Sıralanan popülasyonlar plastik üzerine kaplandı ve pro-OC ortamında (25 ng / mL M-CSF ve 50 ng / mL RANKL) 2 saat boyunca yapışmasına izin verildi, ardından TRAP boyama ve görselleştirme yapıldı. Temsili görüntüler, CD14+ alt kümesinde (kırmızı) TRAP+ hücrelerinin eksikliğini ve CD14− alt kümesinde (mavi) mono ve çok çekirdekli TRAP+ ön OC'leri ve OC'leri gösterir. Ölçek çubukları: 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
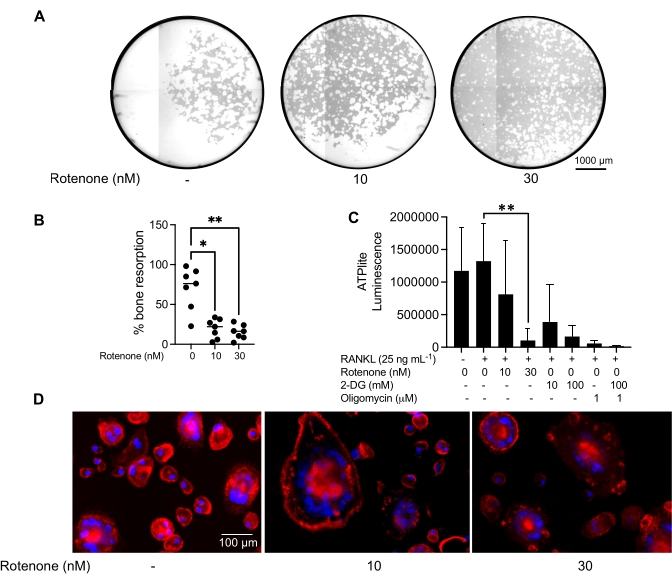
Şekil 5: Olgun OC'lerin işlevini değerlendirmek için yapılan testler. Olgun OC'lerin fonksiyonunu değerlendirmek için, PBMC'lerden izole edilen CD14+ hücreleri ya tek başına M-CSF (M) ile kültürlendi ya da 7 gün boyunca RANKL (R) ile kombine edildi, OC'ler akış sitometrisi ile zenginleştirildi ve OC'ler daha sonra 24 saat boyunca inhibitör rotenon ile tedavi edildi. (A) Olgun OC'ler akış sitometrisi (CD14-OSCAR+ ) ile sıralandı ) ve 3 gün boyunca rotenon varlığında veya yokluğunda bir mineral tahlil yüzeyinde kültürlendi, daha sonra hücreler ağartıldı ve emilen alanı (beyaz rezorpsiyon çukurları) ortaya çıkarmak için 10x'te görüntülendi. (A) Kuyuların temsili olarak yeniden yapılandırılmış görüntüleri. Ölçek çubukları: 1000 μm. (B) Emilen alanın yüzdesinin nicelleştirilmesi. (B)'deki veriler Dunn'ın çoklu karşılaştırma testi (n=7) ile tek yönlü ANOVA ile analiz edilmiştir; * P ≤ 0,05 ve ** P ≤ 0,01. Hata çubukları ortalama ± SD'yi gösterir. (C) RANKL ile farklılaştırılan ve araç veya rotenon (10 nM ve 30 nM) ile tedavi edilen farklılaşmamış ve gün 7 farklılaşmış olgun OC'lerin toplam hücre içi ATP içeriği. Burada, 2DG ve oligomisin tahlil için pozitif kontrol olarak kullanıldı ve hücre lizisi ve ATP miktarından 30 dakika önce eklendi. Hata çubukları ortalama ± SD (n = 4) gösterir. Veriler, tek yönlü bir ANOVA ve Dunnett'in eşleştirilmiş veriler için çoklu karşılaştırma testi ile analiz edilmiştir. ** P ≤ 0,01. (D) Aktin halkası oluşumu (kırmızı) ve çekirdekler (mavi) için boyanmış, aktin halkasının inhibitör ile kaybını gösteren olgun OC'lerin temsili 20x görüntüsü. Ölçek çubukları: 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Plaka formatı | 96 kuyu plakası | 48 kuyu plakası | 24 kuyu plakası | 12 kuyu plakası | 6 kuyu plakası |
| hacim | 100 μL | 225–250 μL | 450–500 μL | 0,8–1 mL | 1,8–2 mL |
Tablo 1: Farklı plaka formatları için hücre süspansiyonunun hacmi. Hacimler 1 x 106 hücre/mL çözeltiden başlayarak hesaplanır ve hücre-hücre füzyonu için optimum yoğunluk sağlar.
| Florofor, klon | 106 hücre başına hacim (μL) | |
| CD14 | PE/Siyanin7, HCD14 | 5 μL |
| OSCAR | FITC, REA494 | 10 μL |
| Hücre sıralama arabelleği | 80 μL |
Tablo 2 : Antikor ana karışım çözeltisi.
Ek Şekil 1: RANKL doz yanıtının TRAP boyaması. CD14+ monositler manyetik olarak zenginleştirilmiş, 96 delikli plakalarda 1 x 105 hücre/kuyuda kaplanmış ve Şekil 2'de olduğu gibi 25 ng/mL M-CSF ile gece boyunca inkübe edilmiştir. TRAP boyamasının temsili görüntüleri, artan RANKL konsantrasyonları (1 ng / mL, 25 ng / mL, 50 ng / mL ve 100 ng / mL) ile uyarılan, 7. günde TRAP için sabitlenmiş ve boyanmış MCSF astarlı monositleri göstermektedir. Ölçek çubukları: 400 μm. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Tamamen farklılaşmış OC'lerde hareketli halka boyaması. (A) TC plastik üzerinde farklılaştırılmış ve AF647 falloidin (kırmızı renkte) ile boyanmış OC'lerin 10 kat büyütülmesi. Ölçek çubuğu: 400 μm. (B) Cam hazneli slaytlarda farklılaştırılmış ve AF488 falloidin (sarı renkte) ile boyanmış OC'lerin 40x büyütülmesi. Ölçek çubuğu: 100 μm.Çekirdekler DAPI ile boyanır, (A) içinde mavi ve (B) içinde camgöbeği ile gösterilir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3: Farklı FBS partilerinin OC farklılaşma verimliliği üzerindeki etkisi. OC'ler CD14+ monositlerden 7 gün boyunca 25 ng/mL M-CSF ve 50 ng/mL RANKL (MR) varlığında ayırt edildi. Kontrol kuyularında sadece M-CSF (M) vardı. (A) Temsili 10x büyütme (ölçek çubukları: 400 μm) ve (B) iki farklı FBS grubunda bir donörden farklılaştırılmış TRAP boyalı OC'lerin nicelleştirilmesi. Hata çubukları, üç teknik çoğaltmanın ortalama ± SD'sini gösterir. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Çok sayıda fonksiyonel OC'nin in vitro olarak kolay kültürlenmesi ve izolasyonu, kemik biyolojisi ve OC aracılı hastalıkların anlaşılmasını ilerletmek için önemlidir. Klasik olarak, OC'ler osteoblastlar veya stromal hücreler ve dalak veya kemik iliğinden hematopoetik hücreler ile ko-kültürlerde üretildi38,39. Osteoklastogenezin anlaşılmasında önemli bir atılım, RANKL'nin OC oluşumunun, farklılaşmasının ve sağkalımının ana düzenleyicisi olarak tanımlanmasıydı40. RANKL'ye bağımlı kültür sistemlerinin erken protokolleri, OC üretimi 21,41,42 için PBMC'leri kullandı. Bununla birlikte, bu karışık kültürler uzundur ve OC farklılaşması ve fonksiyonu üzerindeki doğrudan etkileri test etme yeteneğini sınırlayan birçok kafa karıştırıcı faktör sunar. Bu protokol, optimal osteoklastogenezin 7 gün içinde elde edilebildiği insan periferik CD14 + monositlerinden osteoklastogenezin etkili ve güvenilir bir in vitro modelini tanımlamaktadır (Şekil 1 ve Şekil 2), diğer bazı protokollerle karşılaştırıldığında oldukça hızlıdır43,44,45,46. Bu protokolün ana ayırt edici özellikleri (1) saflaştırılmış CD14 + monositlerin kullanımı, (2) monositlerin RANKL'ye maruz kalmadan önce M-CSF ile astarlanması, (3) kültürün uzunluğu (<7 gün) ve (4) OC oluşumunun (TRAP boyama) ve fonksiyonun (rezorpsiyon, ATP üretimi, aktin halkası yeniden düzenlenmesi) inhibitörlerle inhibisyonunun güvenilir bir şekilde tespit edilmesidir.
Metodolojinin optimizasyonu sırasında, birkaç kritik nokta belirlenmiştir. OC'lerin in vitro farklılaşmasının büyük ölçüde CD14 + monositlerinin tohumlama yoğunluğuna bağlı olduğu gözlenmiştir. Böylece, bu protokolde, hücreler yüksek yoğunlukta (1 x 105 hücre / 96 delikli bir plakanın kuyusu, 100 μL ortamda) tohumlanır, çünkü hücrelerin birbirleriyle etkileşime girebilmeleri ve kaynaşmaya ve olgun OC'ler haline gelmelerine yakın olmaları esastır. Benzer şekilde, hücrelerin çok yüksek bir yoğunlukta tohumlanması, orta sınırlamalar ve gerekli alanın eksikliği nedeniyle farklılaşmalarını ve büyümelerini sınırlar. Ayrıca, bu protokolle maksimum başarı elde etmek için, yoğunluk gradyanı ayrımını dikkatli bir şekilde gerçekleştirmek ve CD14 + hücrelerinin zenginleştirilmiş popülasyonunun mümkün olduğunca saf olmasını sağlamak önemlidir. Örneğin, yetersiz yıkama adımları, trombositlerin çıkarılmamasına neden olur ve bu da OC farklılaşmasını47,48'i inhibe eder. Benzer şekilde, tek başına M-CSF ile uyarılan izole CD14 + preparatlarında minör T hücresi kontaminasyonunun varlığı, potansiyel olarak T hücreleri49 tarafından RANKL sekresyonu yoluyla OC farklılaşmasına neden olabilir. Bu nedenle, her deney için bir M-CSF kontrolü eklemek önemlidir. Özellikle yeni bir izolasyon kiti kullanırken rutin saflık kontrolü, numunenin saflığını sağlamak için de önerilir.
Optimum OC sayıları (aralık: ~200-1.600 OC / kuyu), nükleozitler ve L-glutamin ile zenginleştirilmiş α-MEM ortamı kullanılarak elde edilir. Dulbecco'nun modifiye kartal ortamı (DMEM) ve Roswell Park Memorial Institute (RPMI) 1640 ortamı da dahil olmak üzere diğer geleneksel kültür ortamları, OC verimini etkiler. FBS'nin kaynağı osteoklastogenezi de etkileyebilir. Farklı FBS partileri, RANK-L kaynaklı osteoklastogenezin azalmasına ve M-CSF kontrollerinde düşük sayıda TRAP + çok çekirdekli hücrenin ortaya çıkmasına neden olabilir (Ek Şekil 3). Bu nedenle, tutarlı sonuçlar elde etmek için, yeni FBS partilerini kullanmadan önce test etmeniz ve farklılaştırma sürecindeki varyasyonları en aza indirmek için deneyler boyunca aynı partiyle devam etmeniz önerilir. Ek olarak, donörden donöre değişkenlik, bitiş noktasında elde edilen farklılaşmış OC'lerin toplam sayısı açısından, örneğin sağlıklı donörleri hastalarla karşılaştırmak için bu protokolü kullanırken bir sınırlama oluşturur. Bu gibi durumlarda, tam olarak aynı koşulları ve aynı miktarda ortam, FBS ve diğer reaktifleri kullanmak zorunludur.
Optimum OC farklılaşması ve olgunlaşması için bir diğer gerekli adım, RANKL ilavesinden önce monositlerin M-CSF ile astarlanmasıdır. Hücrelerin RANKL'den önce M-CSF 18-24 saate maruz kalması, monositleri RANK ekspresyonu 15,26'yı yukarı regüle etmeye hazırlar. Bu zaman noktasında RANKL ilavesi, doza bağımlı bir şekilde optimal OC farklılaşmasını sağlar. OC farklılaşma derecesi donörden donöre değişir; Bununla birlikte, 25 ng / mL RANKL genellikle çoğu donörde çok sayıda OC'yi ayırt etmek için yeterlidir. Ek olarak, 25 ng / mL RANKL, test bileşiklerinin hem arttırıcı hem de inhibitör etkilerinin değerlendirilmesini kolaylaştırdığı için, bileşiklerin ilk taraması için tahlillerde kullanılabilir. Diğer kültür sistemleri, RANKL ilavesinden önce daha uzun M-CSF ön inkübasyon süreleri kullanmıştır, ancak bu, osteoklastogenez50 için daha uzun bir kültürleme süresi ile sonuçlanır. Ek olarak, astarlanmış monositleri gece boyunca inkübe etmeye bırakmak, tamamen yapışkan bir durumda olmasa da, plakaya yapışmalarını sağlar. Bu nedenle, RANKL ilk kez tanıtıldığında, astarlanmış monositlerin ayrılmasını ve kaybını önlemek için ortam tamamen değiştirilmek yerine çok dikkatli bir şekilde yarı yarıya değiştirilmelidir. Orta derecede tükenmeyi önlemek ve hücre ölümünü önlemek için ortamın her 3-4 günde bir yenilenmesi gerekir. Ayrıca, bu tahlilde kullanılan düşük hacim nedeniyle (96 delikli bir plakada 100 μL / kuyu), tahlil kuyularının etrafında sulu bir çözelti (yani, steril damıtılmışH2O veya PBS) ile doldurulmuş boş kuyucuklardan oluşan bir çerçeveye sahip olmak son derece önemlidir. Bu, orta buharlaşmayı ve kenar etkilerini önler.
Son olarak, metabolik tahliller için (örneğin, ATP tahlilleri), replikalar arasında büyük standart sapmalardan kaçınmak için hücrelerin canlı olması zorunludur (Şekil 5). Hücrelerin yüksek canlılığı, hücrelerin sıralanması ve sıralanan OC'lerin daha fazla kültürlenmesi için de önemlidir (Şekil 4). Bununla birlikte, bu yöntemin birkaç sınırlaması vardır. Tamamen olgun OC'ler çok yapışkandır ve plakalardan ayrılması zordur. Daha büyük OC'lerin ayrılması genellikle imkansızdır, bu da daha düşük bir hücre verimine yol açabilir. Bu nedenle, hücrelerin sıralamadan sonra ve gerekli konsantrasyonda kaplanmadan önce sayılması gerekir. Ayrıca, mevcut protokolde, akış sitometrisi için aşağı akış yüzey boyamasında membran değişikliklerini önlemek için OC'leri ayırmak için enzimatik olmayan bir yöntem (accutase) kullanılmaktadır. Hücre kazıyıcıların kullanımı (hem yumuşak hem de sert uçlu) da test edildi ve yüksek hücre ölümüne yol açtı. %0,05 Tripsin/EDTA çözeltileri kullanan enzimatik dekolmanı, çıkış yönündeki uygulamalar için membran bütünlüğü gerekmediğinde daha yüksek müstakil OC verimi için kullanılabilir. Ek olarak, OC'lerin bir araya toplanmasını önlemek için, hücre ayrılmasını takiben tüm tamponlarda yüksek konsantrasyonda EDTA kullanılması ve akış sitometrisi ediniminden önce uygun filtreleme şiddetle tavsiye edilir. OC kültürlerinin olgun OC'ler, OC öncülleri ve makrofajlardan oluşan heterojen bir hücre popülasyonu olduğunu belirtmek önemlidir. Makrofajlar OC'lerden kolayca ayırt edilebilir, ancak hem mononükleer pre-OC'ler hem de multinükleer OC'ler OSCAR'ı ifade eder ve mevcut yöntemle ayırt edilemez (Şekil 4). Gerçekten de, bu son konu, bu yöntemin temel sınırlamasını oluşturmaktadır. Ek olarak, düşük bir OSCAR ekspresyonu M-CSF kültürlerinde de mevcuttur (Şekil 4B) ve OC soyağacı taahhüdü için hazırlanmış makrofajları gösterebilir. OSCAR+ hücrelerinin kapısını, Şekil 4B'de gösterildiği gibi, FMO boyama sinyaline göre ayarlamak önemlidir.
Özetle, bu protokol, dolaşımdaki birincil insan monositlerinden aktif ve fonksiyonel olarak olgun OC'lerin verimli üretimi için optimize edilmiş ve sağlam bir yöntemi açıklamaktadır. Bu protokolün gücü, kısa sürede OC üretme ve çok sayıda farklılaşmış OC üretme yeteneğidir. Bu yöntem, OC farklılaşmasının ve fonksiyonunun altında yatan temel mekanizmaların araştırılmasının yolunu açar.
Açıklamalar
Yazarlar birbiriyle çelişen çıkarları olmadığını beyan ederler.
Teşekkürler
Yazarlar, bu çalışmadaki destekleri ve yardımları için Enfeksiyon ve Bağışıklık Okulu bünyesindeki Flow Core Facility ve Glasgow Imaging Facility'ye (GIF) minnetle teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 well chamber slides | ibidi | 81816 | |
| 8-well glass chamber slides | Ibidi | 80807 | |
| 96-well TC plate | Corning | 3596 | |
| 96-well osteo assay stripwell plate | Corning | 3989 | |
| Acetate solution | Sigma Aldrich | 386-3 | from kit Cat No. 387A-1KT |
| Acetone | VWR | 20066.330 | |
| Acid phosphatase, Leukocyte (TRAP) kit | SIGMA-ALDRICH | 387A-1KT | |
| Alexa Fluor 488 Phalloidin | Theremo Fisher - Invitrogen | A12379 | AF488 |
| Alexa Fluor 647 Phalloidin | Thermo Fisher - Invitrogen | A22287 | AF647 |
| Alfa Aesar 2-Deoxy-D-glucose | Fisher Scientific | 11321867 | 2DG, 98% |
| Alpha minimum essential medium | gibco | 22571-020 | |
| ATPlite 1step | PerkinElmer | 6016731 | Luminiscence ATP detection assay system |
| BD FACSAria III cell sorter | BD Biosciences | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418-100G | |
| Cell culture microplate, 96-well, PS, F-bottom | Greiner bio-one | 655083 | White-bottom plates |
| Citrate solution | Sigma Aldrich | 91-5 | from kit Cat No. 387A-1KT |
| Corning 6ml round-bottom polystyrene test tubes | Fisher Scientific | 352054 | |
| Corning osteo assay surface multiple well plate | Sigma-Aldrich | CLS3989 | |
| Corning osteo assay Surface multiple well plate 1 x 8 stripwell | Corning | CLS3989-2EA | |
| DAPI | Theremo Fisher | D3571 | |
| EasySep human CD14 positive selection kit | STEMCELL Technologies | 17858 | |
| EasySep red blood cell lysis buffer (10x) | StemCell Technologies | 20110 | |
| eBioscience fixable viability dye eFluor 780 | Theremo Fisher - Invitrogen | 65-0865-14 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E7889-100ML | |
| EVOS FL auto imaging system | Thermo Fisher | A32678 | |
| Falcon round-bottom polypropylene test tubes with cap | Fisher Scientific | 10314791 | |
| Falcon tubes 15 mL | Corning | 430790 | |
| Falcon tubes 50 mL | Corning | 430828 | |
| Fast Garnet GBC base solution | Sigma Aldrich | 387-2 | from kit Cat No. 387A-1KT |
| Fetal bovine serum | gibco | 10500-064 | FBS |
| Ficoll-Paque Plus | cytiva | 17144003 | |
| Formaldehyde | Sigma-Aldrich | F-8775 | |
| Human sRANK ligand | PEPROTECH | 310-01-100UG | Receptor activator of nuclear factor kappa-B ligand (RANKL) |
| ImageJ Image analysis software | Image J | version 2.9.0 | |
| L-glutamine | gibco | 25030-024 | |
| Lithium heparin tubes (9 mL) | VACUETTE | 455084 | |
| Macrophage colony-stimulating factor | PEPROTECH | 300-25-100UG | M-CSF |
| Napthol AS-BI phosphoric acid solution | Sigma Aldrich | 387-1 | from kit Cat No. 387A-1KT |
| Neubauer hemacytometer counting chamber | Camlab | SKU 1127885 | |
| Oligomycin from Streptomyces Diastatochromogenes | Sigma-Aldrich | Q4876-5MG | |
| OSCAR Antibody, anti-human, Vio Bright FITC, REAfinit | Miltenyi Biotec | 130-107-661 and 130-107-617 | Clone REA494 |
| PE/Cyanine7 anti-human CD14 antibody | Biolegend | 325618 | Clone HCD14 |
| Penicilin/streptomycin | SIGMA | P0781 | |
| PHERAstar machine and software | BMG LABTECH | ||
| Phosphate-buffered saline (DPBS, 1x) | gibco | 14190-094 | |
| REA control antibody (S), human IgG1, Vio Bright FITC, REAfinity | Miltenyi Biotec | 130-113-443 | |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044-1L | |
| Sodium nitrite solution | Sigma Aldrich | 91-4 | from kit Cat No. 387A-1KT |
| Tartrate solution | Sigma Aldrich | 387-3 | from kit Cat No. 387A-1KT |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Trypan blue | Sigma-Aldrich | T8154-100ML |
Referanslar
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Boyce, B. F., Xing, L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives Of Biochemistry and Biophysics. 473 (2), 139-146 (2008).
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Agemura, T., Hasegawa, T., Yari, S., Kikuta, J., Ishii, M. Arthritis-associated osteoclastogenic macrophages (AtoMs) participate in pathological bone erosion in rheumatoid arthritis. Immunological Medicine. 45 (1), 22-26 (2022).
- Hasegawa, T., et al. Identification of a novel arthritis-associated osteoclast precursor macrophage regulated by FoxM1. Nature Immunology. 20 (12), 1631-1643 (2019).
- Walsh, N. C., Crotti, T. N., Goldring, S. R., Gravallese, E. M. Rheumatic diseases: The effects of inflammation on bone. Immunological Reviews. 208 (1), 228-251 (2005).
- Gravallese, E. M., et al. Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis. The American Journal of Pathology. 152 (4), 943-951 (1998).
- Bromley, M., Woolley, D. E. Chondroclasts and osteoclasts at subchondral sites of erosion in the rheumatoid joint. Arthritis & Rheumatism. 27 (9), 968-975 (1984).
- Kleyer, A., Schett, G. Arthritis and bone loss: A hen and egg story. Current Opinion in Rheumatology. 26 (1), 80-84 (2014).
- Kawai, V. K., Stein, C. M., Perrien, D. S., Griffin, M. R. Effects of anti-tumor necrosis factor α (anti-TNF) agents on bone. Current Opinion in Rheumatology. 24 (5), 576-585 (2012).
- Siebert, S., Tsoukas, A., Robertson, J., McInnes, I. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases. Pharmacological Reviews. 67 (2), 280-309 (2015).
- Smiljanovic, B., et al. Monocyte alterations in rheumatoid arthritis are dominated by preterm release from bone marrow and prominent triggering in the joint. Annals of the Rheumatic Diseases. 77 (2), 300-308 (2018).
- Anderson, J. R., et al. 1H NMR metabolomics identifies underlying inflammatory pathology in osteoarthritis and rheumatoid arthritis synovial joints. Journal of Proteome Research. 17 (11), 3780-3790 (2018).
- McGarry, T., et al. Rheumatoid arthritis CD14+ monocytes display metabolic and inflammatory dysfunction, a phenotype that precedes clinical manifestation of disease. Clinical & Translational Immunology. 10 (1), 1237(2021).
- Ansalone, C., et al. TNF is a homoeostatic regulator of distinct epigenetically primed human osteoclast precursors. Annals of the Rheumatic Diseases. 80 (6), 748-757 (2021).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis and Rheumatology. 73 (7), 1145-1154 (2021).
- Allard-Chamard, H., et al. Osteoclasts and their circulating precursors in rheumatoid arthritis: Relationships with disease activity and bone erosions. Bone Reports. 12, 100282(2020).
- Takegahara, N., et al. Involvement of receptor activator of nuclear factor-κB ligand (RANKL)-induced incomplete cytokinesis in the polyploidization of osteoclasts. The Journal of Biological Chemistry. 291 (7), 3439-3454 (2016).
- Jansen, I. D. C., Vermeer, J. A. F., Bloemen, V., Stap, J., Everts, V. Osteoclast fusion and fission. Calcified Tissue International. 90 (6), 515-522 (2012).
- McDonald, M. M., et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 184 (5), 1330-1347 (2021).
- Lacey, D. L., et al. Bench to bedside: Elucidation of the OPG-RANK-RANKL pathway and the development of denosumab. Nature Reviews Drug Discovery. 11 (5), 401-419 (2012).
- Zhao, B., Grimes, S. N., Li, S., Hu, X., Ivashkiv, L. B. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J. The Journal of Experimental Medicine. 209 (2), 319-334 (2012).
- Zhao, B. Does TNF promote or restrain osteoclastogenesis and inflammatory bone resorption. Critical Reviews in Immunology. 38 (4), 253-261 (2018).
- Crotti, T. N., et al. Receptor activator NF-κB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Annals of the Rheumatic Diseases. 61 (12), 1047-1054 (2002).
- Kim, H. R., et al. Reciprocal activation of CD4+ T cells and synovial fibroblasts by stromal cell-derived factor 1 promotes RANKL expression and osteoclastogenesis in rheumatoid arthritis. Arthritis and Rheumatology. 66 (3), 538-548 (2014).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor κB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Hayman, A. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
- Nedeva, I. R., Vitale, M., Elson, A., Hoyland, J. A., Bella, J. Role of OSCAR signaling in osteoclastogenesis and bone disease. Frontiers in Cell and Developmental Biology. 9, 780(2021).
- Boyce, B. F., Yoneda, T., Lowe, C., Soriano, P., Mundy, G. R. Requirement of pp60c-src expression for osteoclasts to form ruffled borders and resorb bone in mice. The Journal of Clinical Investigation. 90 (4), 1622-1627 (1992).
- Matsubara, T., et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin. Biochemical and Biophysical Research Communications. 489 (4), 472-476 (2017).
- Roscher, A., et al. The F-actin modulator SWAP-70 controls podosome patterning in osteoclasts. Bone Reports. 5, 214-221 (2016).
- Jurdic, P., Saltel, F., Chabadel, A., Destaing, O. Podosome and sealing zone: Specificity of the osteoclast model. European Journal of Cell Biology. 85 (3-4), 195-202 (2006).
- Francis, M. J. O., et al. ATPase pumps in osteoclasts and osteoblasts. The International Journal of Biochemistry & Cell Biology. 34 (5), 459-476 (2002).
- Kwak, H. B., et al. Inhibition of osteoclast differentiation and bone resorption by rotenone, through down-regulation of RANKL-induced c-Fos and NFATc1 expression. Bone. 46 (3), 724-731 (2010).
- Massey, H. M., Flanagan, A. M. Human osteoclasts derive from CD14-positive monocytes. British Journal of Haematology. 106 (1), 167-170 (1999).
- Xue, J., et al. CD14+CD16-monocytes are the main precursors of osteoclasts in rheumatoid arthritis via expressing Tyro3TK. Arthritis Research and Therapy. 22 (1), 221(2020).
- Marco-Casanova, P., et al. Preparation of peripheral blood mononuclear cell pellets and plasma from a single blood draw at clinical trial sites for biomarker analysis. Journal of Visualized Experiments. (169), e60776(2021).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Matsuzaki, K., et al. Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. Biochemical and Biophysical Research Communications. 246 (1), 199-204 (1998).
- Shalhoub, V., et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell precursors. Journal of Cellular Biochemistry. 72 (2), 251-261 (1999).
- Neale, S. D., Smith, R., Wass, J. A. H., Athanasou, N. A. Osteoclast differentiation from circulating mononuclear precursors in Paget's disease is hypersensitive to 1,25-dihydroxyvitamin D3 and RANKL. Bone. 27 (3), 409-416 (2000).
- Abdallah, D., et al. An optimized method to generate human active osteoclasts from peripheral blood monocytes. Frontiers in Immunology. 9, 632(2018).
- Komano, Y., Nanki, T., Hayashida, K., Taniguchi, K., Nobuyuki, M. Identification of a human peripheral blood monocyte subset that differentiates into osteoclasts. Arthritis Research and Therapy. 8 (5), 152(2006).
- Kylmäoja, E., et al. Peripheral blood monocytes show increased osteoclast differentiation potential compared to bone marrow monocytes. Heliyon. 4 (9), 00780(2018).
- Wang, D., et al. Platelet-rich plasma inhibits RANKL-induced osteoclast differentiation through activation of Wnt pathway during bone remodeling. International Journal of Molecular Medicine. 41 (2), 729-738 (2018).
- Cenni, E., Avnet, S., Fotia, C., Salerno, M., Baldini, N. Platelet-rich plasma impairs osteoclast generation from human precursors of peripheral blood. Journal of Orthopaedic Research. 28 (6), 792-797 (2010).
- D'Amico, L., Roato, I. Cross-talk between T cells and osteoclasts in bone resorption. BoneKEy Reports. 1 (6), 82(2012).
- Quinn, J. M. W., Elliott, J., Gillespie, M. T., Martin, T. J. A combination of osteoclast differentiation factor and macrophage-colony stimulating factor is sufficient for both human and mouse osteoclast formation in vitro. Endocrinology. 139 (10), 4424-4427 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır