Method Article
Différenciation des ostéoclastes fonctionnels des monocytes CD14+ du sang périphérique humain
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les ostéoclastes sont des cellules clés qui résorbent les os dans le corps. Ce protocole décrit une méthode fiable pour la différenciation in vitro des ostéoclastes des monocytes du sang périphérique humain. Cette méthode peut être utilisée comme un outil important pour mieux comprendre la biologie des ostéoclastes dans l’homéostasie et dans les maladies.
Résumé
Les ostéoclastes (CO) sont des cellules résorbant les os qui jouent un rôle central dans le développement du squelette et le remodelage osseux chez l’adulte. Plusieurs troubles osseux sont causés par une différenciation et une activation accrues des CO, de sorte que l’inhibition de cette pathobiologie est un principe thérapeutique clé. Deux facteurs clés déterminent la différenciation des CO des précurseurs myéloïdes : le facteur de stimulation des colonies de macrophages (M-CSF) et l’activateur des récepteurs du ligand kappa-B du facteur nucléaire (RANKL). On sait depuis longtemps que les monocytes CD14+ circulants humains se différencient en CO in vitro. Cependant, le temps d’exposition et la concentration de RANKL influencent l’efficacité de la différenciation. En effet, des protocoles pour la génération de CO humains in vitro ont été décrits, mais ils aboutissent souvent à un processus de différenciation long et médiocre. Ici, un protocole robuste et normalisé pour générer des CO humains matures fonctionnellement actifs en temps opportun est fourni. Les monocytes CD14+ sont enrichis à partir de cellules mononucléées du sang périphérique humain (PBMC) et amorcés avec du M-CSF pour réguler positivement RANK. L’exposition ultérieure à RANKL génère des CO en fonction de la dose et du temps. Les CO sont identifiés et quantifiés par coloration à l’aide de phosphatase résistante aux acides au tartrate (TRAP) et d’une analyse par microscopie optique. La coloration par immunofluorescence des noyaux et de la F-actine est utilisée pour identifier les CO fonctionnellement actifs. De plus, les CO matures OSCAR+CD14− sont enrichis par le tri cellulaire par cytométrie en flux et la fonctionnalité du CO quantifiée par des tests de résorption minérale (ou dentine/os) et la formation d’un cycle d’actine. Enfin, un inhibiteur connu du CO, la roténone, est utilisé sur les CO matures, démontrant que la production d’adénosine triphosphate (ATP) est essentielle à l’intégrité du cycle actine et à la fonction OC. En conclusion, un test robuste pour différencier un grand nombre de CO est établi dans ce travail, qui, en combinaison avec la coloration du cycle d’actine et un test ATP, fournit un modèle in vitro utile pour évaluer la fonction OC et dépister de nouveaux composés thérapeutiques capables de moduler le processus de différenciation.
Introduction
Les ostéoclastes (OC) sont des cellules géantes multinucléées de lignée hématopoïétique avec une capacité unique à résorber les os. Ils sont responsables du développement et du remodelage continu du squelette 1,2. Dans les phases squelettiques du développement, les CO et les macrophages résidant dans les tissus sont dérivés de progéniteurs érythro-myéloïdes et colonisent la niche osseuse et les tissus organiques. Dans des conditions physiologiques, les progéniteurs érythro-myéloïdes sont nécessaires au développement normal des os et à l’éruption dentaire, tandis que l’afflux de monocytes sanguins circulants dans la niche osseuse assure le maintien postnatal des CO, de la masse osseuse et de la cavité médullaire3. Dans des conditions pathologiques, les monocytes sont recrutés sur des sites d’inflammation active et peuvent contribuer à la destruction osseuse pathologique 4,5.
Les patients atteints de plusieurs formes d’arthrite éprouvent une inflammation articulaire, conduisant à une destruction articulaire progressive causée par les CO6. Par exemple, dans la polyarthrite rhumatoïde (PR), les CO suractivés sont responsables de l’érosion osseuse pathologique et de la destruction des articulations7,8, et les traitements actuels n’améliorent ou n’arrêtent souvent pas les lésions osseuses9,10,11. Des altérations des monocytes circulants en termes de distribution de la population et de signatures transcriptomiques et épigénétiques ont été rapportées chez des patients atteints de PR12,13,14. De plus, il a été rapporté que les réponses monocytaires altérées à la stimulation inflammatoire affectent l’ostéoclastogenèse chez les patients atteints de PR atteints de maladie active15,16,17.
La différenciation des CO est un processus complexe en plusieurs étapes comprenant l’engagement des cellules précurseurs myéloïdes à la différenciation en précurseurs du CO. Au cours de l’ostéoclastogenèse, les CO deviennent géants et multinucléés par fusion cellule-cellule, cytocinèse incomplète et un processus de recyclage nucléaire décrit comme fission et fusion18,19,20. La capacité de différencier les CO in vitro a permis des avancées significatives dans la compréhension de la biologie osseuse21. Les CO se différencient des précurseurs lorsqu’ils sont exposés au facteur de stimulation des colonies de macrophages (M-CSF) et à l’activateur des récepteurs du ligand kappa-B du facteur nucléaire (RANKL). Ce dernier est essentiel pour le développement normal et la fonction des CO in vitro et in vivo, même dans des conditions inflammatoires 6,22,23. RANKL est présenté par les ostéoblastes et les ostéocytes, ainsi que par les lymphocytes T activés et les fibroblastes dans la synoviale 2,24,25 enflammée de PR. Au cours du processus de différenciation OC, les monocytes exposés au M-CSF régulent positivement l’activateur du récepteur de l’expression du facteur nucléaire kappa-B (RANK) sur leur membrane cellulaire et, sous stimulation ultérieure avec RANKL, se différencient en pré-CO mononucléés positifs à la phosphatase acide résistante au tartrate (TRAP), puis en CO multinucléés15,26. Les CO produisent plusieurs enzymes, la principale d’entre elles étant TRAP, qui permet la dégradation des phosphoprotéines dans l’os27. Un régulateur et marqueur de la différenciation OC est le récepteur associé à OC (OSCAR). Il est régulé à la hausse tôt dans les cellules précurseurs s’engageant dans la lignée OC28. Les OC géants multinucléés matures peuvent dégrader (résorber) la matrice squelettique en générant une grande zone d’étanchéité, qui est constituée d’un anneau d’actine entourant une bordure ébouriffée21,29,30. La capacité de résorption osseuse des CO nécessite une réorganisation du cytosquelette et la polarisation et la formation d’une membrane alambiquée, appelée bordure ébouriffée. La bordure ébouriffée est entourée d’une grande bande circulaire d’une structure riche en F-actine, qui est l’anneau d’actine ou la zone de scellement. L’intégrité du cycle d’actine est essentielle pour que les CO résorbent l’os à la fois in vitro et in vivo, et une formation défectueuse de bordure ébouriffée est associée à une expression inférieure de l’adénosine triphosphatase vacuolaire (V-ATPase)31,32,33. De plus, les CO sont des cellules riches en mitochondries, et l’adénosine triphosphate (ATP) s’associe à des structures de type mitochondrial dans les CO localisées à la frontière ébouriffée31,32,33. La roténone agit comme un puissant inhibiteur du complexe mitochondrial I et a un impact sur la production d’ATP. Il a également été démontré que la roténone inhibe la différenciation et la fonctionOC 34.
Ce protocole décrit une méthode efficace et optimisée d’ostéoclastogenèse in vitro à partir d’échantillons de sang périphérique humain. Dans le sang périphérique humain, les monocytes CD14+ sont la principale source de CO15,35,36. Dans ce protocole, la cinétique d’exposition et les concentrations de M-CSF et de RANKL ont été ajustées pour une ostéoclastogenèse optimale. Les cellules mononucléaires sont d’abord séparées des érythrocytes et des granulocytes présents dans le sang total par gradient de densité; ils sont ensuite enrichis pour les monocytes CD14+ par sélection positive par billes magnétiques. Les monocytes CD14+ isolés sont ensuite incubés pendant une nuit avec du M-CSF. Cela amorce les monocytes à réguler positivement l’expression de RANK15,26. L’ajout ultérieur de RANKL induit l’ostéoclastogenèse et la multinucléation de manière dépendante du temps. Les CO à résorbation active montrent la distribution caractéristique des anneaux F-actine au bord de la membrane cellulaire30,32 et la coloration pour TRAP. Les CO matures sont analysés en quantifiant les cellules multinucléées TRAP+ (plus de trois noyaux). La capacité fonctionnelle des CO matures peut être évaluée par leur résorption, l’intégrité du cycle actine et la production d’ATP. De plus, les CO CD14− OSCAR+ différenciés peuvent être enrichis et utilisés pour évaluer les effets de certains composés sur la fonctionnalité du CO via la résorption minérale (ou dentine) et l’organisation de la F-actine. De plus, dans ce travail, un inhibiteur connu du CO, la roténone, est utilisé comme exemple d’un composé qui affecte la fonctionnalité des CO. Une activité réduite de résorption du CO sous la roténone est associée à une production réduite d’ATP et à une fragmentation du cycle d’actine. En conclusion, ce protocole établit un essai robuste qui peut être utilisé comme méthode de référence pour étudier plusieurs aspects biologiques de la différenciation et de la fonction OC in vitro.
Cette méthodologie peut être utilisée pour évaluer (1) le potentiel des monocytes circulants à se différencier en CO dans la santé et les maladies, ainsi que (2) l’impact des candidats thérapeutiques sur la différenciation et la fonction des CO. Ce protocole robuste d’ostéoclastogenèse permet de déterminer l’efficacité et les mécanismes des thérapies ciblant les os à la fois sur la différenciation du CO par rapport aux cellules précurseurs et sur la fonction des CO matures.
Protocole
Les blouses leucocytaires obtenues auprès du Scottish National Blood Transfusion Service (Édimbourg) et les cônes leucocytaires obtenus auprès du NHS Blood and Transplant (Newcastle) sont fournis aux chercheurs de l’Université de Glasgow sous une forme entièrement anonymisée (non identifiable) provenant de donneurs de sang pleinement consentants du NHS. Le pelage leucocytaire et les composants sanguins du cône leucocytaire sont produits à partir d’un don de sang standard du NHS donné dans un centre de donneurs de sang du NHS en Écosse ou en Angleterre. Le donneur de sang donne son consentement éclairé au moment du don de sang pour le surplus de sang non utilisé dans la pratique clinique standard du NHS pour être utilisé pour des études de recherche médicale approuvées. L’approbation éthique du comité d’éthique de la recherche du NHS et les formulaires de consentement du donneur signés pour utiliser ces dons de sang sont détenus par le service de don de sang du NHS. L’autorisation d’accéder à ces dons de sang consentis et de les utiliser dans le cadre d’études de recherche médicale approuvées a été demandée et obtenue à l’aide du processus interne standard de demande et d’examen du National Blood Transfusion Service (Écosse) et du NHS Blood and Transport (Angleterre). Aucune autre approbation du NHS REC ou de l’approbation du comité d’éthique interne de l’Université de Glasgow n’a été requise pour utiliser les composants sanguins pour les études de recherche médicale approuvées.
1. Notes générales avant de commencer
- Procédez à tous les travaux avec du sang avec prudence. Tenez compte des dangers potentiels de divers agents infectieux qui peuvent être présents dans les échantillons.
- Effectuer tout le travail avec prudence dans le laboratoire de biosécurité dans des conditions stériles tout en portant des gants et des sarraus de laboratoire.
- Effectuer l’élimination de la biosécurité conformément aux directives locales.
- Obtenir le consentement approprié et les approbations éthiques avant le prélèvement d’échantillons conformément aux réglementations des autorités locales.
- En général, 1 mL de sang frais produira 1 million de PBMC, et les monocytes CD14+ représentent environ 10 % à 30 % des PBMC. En comparaison, 10 mL d’un cône leucocytaire peuvent contenir 5 x 10 8-15 x 108 PBMC. Pour plus de détails sur l’isolation PBMC, reportez-vous au protocole37 précédent.
2. Isolement des cellules mononucléées du sang périphérique (PBMC) à partir du sang total
- Recueillir le volume requis de sang frais provenant de donneurs sains dans des tubes de prélèvement d’héparine de lithium.
REMARQUE : D’autres tubes de collecte contenant des anticoagulants appropriés peuvent également être utilisés (p. ex. tubes d’héparine sodique). Pour un nombre de cellules plus élevé, des cônes leucocytaires ou des couches leucocytaires peuvent être utilisés. - Pour isoler les PBMC, transférer le sang dans un nouveau tube de 50 mL et le diluer avec une solution saline tamponnée au phosphate (PBS) 1x stérile dans un rapport de 1:1 ou 1:3 pour le sang frais ou les cônes leucocytaires/couches leucocytaires, respectivement.
- Mélanger doucement les cellules plusieurs fois par inversion.
- Préparer des tubes de 15 mL contenant 3 mL de milieu gradient de densité. Déposer lentement 8 à 10 mL de sang dilué sur le milieu du gradient de densité et centrifuger à 400 x g pendant 30 minutes à température ambiante (RT) sans frein.
REMARQUE: Appliquez le sang avec précaution sur le milieu de gradient de densité pour éviter le mélange. Le mélange peut entraîner la perte de PBMC. - Jetez soigneusement la couche supérieure (contenant le plasma) à l’aide d’une pipette Pasteur, recueillez la couche interphasée inférieure contenant les PBMC (structure blanche en forme d’anneau) et transférez cette couche dans un nouveau tube de 50 mL.
- Suspendre les cellules avec 1x PBS stérile jusqu’à 50 mL et laver le milieu de gradient de densité résiduelle en centrifugeant à 300 x g pendant 10 min à TA avec le frein à fond.
- Pour éliminer les plaquettes résiduelles, répétez le processus avec un spin supplémentaire plus lent à 200 x g pendant 10 min à TA sans frein.
- Facultatif : Pour éliminer le transfert des globules rouges, diluer le tampon de lyse des globules rouges (10x, table des matières) 1:10 dans de l’eau distillée et appliquer 3 mL du tampon dilué sur la pastille. Mélanger et incuber pendant 3 min. Laver la pastille dans un maximum de 50 ml de 1x PBS et centrifuger à 300 x g pendant 10 min à TA avec le frein à fond.
- Remettez en suspension les PBMC isolés et purifiés dans 20 mL de 1x PBS et comptez-les à l’aide d’un hémocytomètre ou en suivant d’autres méthodes standard.
NOTA: Les méthodes de dilution et de comptage des cellules doivent être ajustées en conséquence en fonction de la densité des cellules et du dispositif de comptage utilisé.
3. Enrichissement des monocytes CD14+ à partir des PBMC
- Isoler les monocytes CD14+ des PBMC à l’aide d’un kit de sélection de CD14+ humain selon le protocole du fabricant (Table of Materials).
REMARQUE : Les monocytes CD14+CD16− classiques sont la principale source de précurseurs du CO35 ; D’autres méthodes de purification peuvent être envisagées. - Transférer 1 x 107 PBMC dans un tube à fond rond en polystyrène approprié (c.-à-d. qui s’adapte à l’aimant du kit de sélection) et granuler les cellules à 300 x g pendant 5 min.
- Jeter le surnageant, remettre en suspension la pastille cellulaire dans un tampon de séparation cellulaire (PBS, sérum fœtal bovin à 2 %, acide éthylènediaminetétraacétique [EDTA] 1 mM) jusqu’à une concentration finale de 1 x 108 cellules/mL et incuber avec 10 μL de cocktail d’anticorps par 100 μL avec le couvercle en place pendant 10 min.
REMARQUE : Les cellules sont remises en suspension à 1 x 108 cellules/mL; Ajustez les volumes en conséquence. - Après l’incubation, ajouter 10 μL de billes de nanoparticules magnétiques par 100 μL et incuber pendant 3 min avec le couvercle.
REMARQUE : Ajustez les volumes du cocktail d’anticorps et des billes magnétiques pour obtenir une concentration de 10 μL/mL. - Complétez le volume à 2,5 mL avec le tampon de séparation cellulaire, placez le tube dans un aimant (sans le couvercle) et incuber pendant 3 min. Éliminer la population cellulaire négative par un mouvement continu par inversion pendant que le tube est encore dans l’aimant.
REMARQUE : Si vous utilisez >2 x 108 PBMC et un aimant plus grand, complétez à 5 mL ou 10 mL avec un tampon de séparation cellulaire en suivant les instructions du fabricant. - Retirez le tube de l’aimant et lavez les monocytes CD14+ enrichis fixés aux billes magnétiques en les remettant en suspension dans 2,5 mL du tampon de séparation cellulaire. Incuber pendant 3 minutes à l’intérieur de l’aimant comme précédemment, jeter la fraction négative et répéter une fois de plus.
- centrifuger toutes les cellules prélevées à 300 x g pendant 5 min, jeter le surnageant et remettre les cellules en suspension dans 5 mL de milieu essentiel alpha minimum (α-MEM; Tableau des matériaux) supplémenté avec 1% de L-glutamine, 1% de pénicilline / streptomycine (α-MEM complet) et 10% FBS.
REMARQUE: Un contrôle de pureté post-enrichissement par cytométrie de flux est recommandé, et une pureté de ≥ 96% devrait être attendue. Des étapes de lavage supplémentaires (étape 3.6) peuvent augmenter la pureté.
4. Différenciation OC in vitro
- Compter les monocytes CD14+ enrichis à l’aide d’un hémocytomètre.
- Ensemencer les cellules à 300 x g pendant 5 minutes et les remettre en suspension à 1 x 106 cellules/mL en α-MEM complet complété par 10% FBS.
- Pour différencier les CO, ajouter du M-CSF à une concentration finale de 25 ng/mL à la suspension cellulaire.
REMARQUE : Pour 1 mL de suspension cellulaire, ajouter 0,25 μL de M-CSF à partir d’une concentration mère de 100 μg/mL. - Mélanger en pipetant soigneusement pour homogénéiser la suspension cellulaire et plaquer 100 μL/puits dans une plaque à fond plat de 96 puits jusqu’à obtenir une densité cellulaire finale de 1 x 105 cellules/puits.
- Ajouter 200 μL/puits d’eau distillée stérile dans les puits autour des cellules plaquées pour éviter l’évaporation du milieu et les effets de bord dans le système de culture.
- Incuber les cellules pendant une nuit, pendant environ 18-20 h, à 37 °C avec 5% de CO2.
- Après une nuit d’incubation, retirer délicatement la moitié du milieu (50 μL/puits) par aspiration à l’aide d’une pipette P200, en évitant de toucher le fond du puits, et remplacer par du α-MEM complet chaud et frais contenant 10 % de FBS, 25 ng/mL DE M-CSF et 50 ng/mL de RANKL pour une concentration finale de 25 ng/mL.
REMARQUE : Pour 1 mL de milieu, ajouter 0,25 μL de M-CSF et 0,5 μL de RANKL à partir d’une concentration mère de 100 μg/mL. - Changez le média tous les 3 jours et différenciez les cellules en CO pendant 7 à 14 jours (Figure 1).
REMARQUE : Maintenir les concentrations de M-CSF et de RANKL constantes dans toute la culture.
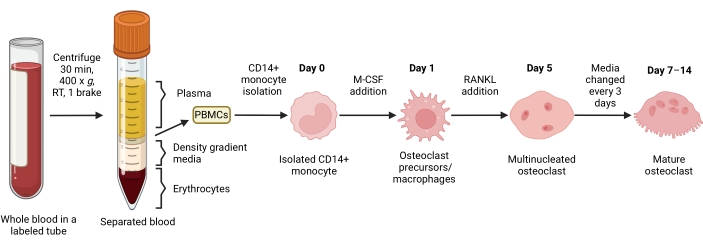
Figure 1 : Workflow de différenciation OC. Vue d’ensemble schématique de l’isolement des monocytes CD14+ à partir des PBMC et de la différenciation en CO matures en présence de M-CSF et de RANKL pendant 7 à 14 jours. RT = température ambiante. Image créée avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Coloration TRAP pour ostéoclastes
- Retirer délicatement le milieu, fixer les CO adhérents différenciés avec 100 μL/puits de la solution fixatrice préalablement préparée et incuber pendant 1 min. Ne touchez pas le fond des puits pour éviter de rayer les cellules adhérentes.
REMARQUE : La solution fixatrice est préparée comme suit : 12,5 mL de solution de citrate (incluse dans la trousse de coloration TRAP), 32,5 mL d’acétone et 5 mL de formaldéhyde à 37 %. - Lavez les puits trois fois avec 300 μL d’eau distillée stérile. Tapotez les assiettes pour sécher après le lavage.
- Préparer une solution de coloration selon les instructions du fabricant (tableau des matériaux); ajouter 5 μL de grenat rapide et 5 μL de nitrite de sodium pour obtenir la solution de grenat rapide; mélanger par inversion et incuber pendant 3 min à TA. Préparer 1 mL de solution de coloration en mélangeant 900 μL d’eau distillée stérile, 10 μL de naphtol, 40 μL de solution d’acétate, 50 μL de solution de tartrate et 10 μL de solution de grenat rapide.
- Ajouter 100 μL/puits de solution de coloration fraîchement préparée et incuber la plaque à 37 °C dans l’obscurité pendant 20 min.
- Après l’incubation, retirer la solution de coloration par inversion et laver la plaque trois fois avec 300 μL/puits d’eau distillée.
- Enlevez l’excès d’eau en tapotant les assiettes sur des serviettes en papier. Laissez les plaques ouvertes et protégées de la lumière pour sécher à l’air pendant la nuit.
REMARQUE: Les plaques sèches peuvent être conservées jusqu’à 6 mois. Parfois, les tampons résiduels peuvent favoriser le développement de moisissures, ce qui est visible au microscope; Cela peut être éliminé à tout moment en lavant les puits concernés avec de l’eau distillée et en les laissant sécher à l’air libre. - Prenez des images à 10x ou 20x à l’aide d’un microscope à fond clair avec une option de tuile pour capturer toute la surface du puits.
- Comptez manuellement les CO identifiés comme des cellules colorées violettes TRAP+ avec plus de trois noyaux à l’aide d’un logiciel d’analyse d’images avec un plug-in de compteur de cellules.
REMARQUE : Le nombre de CO TRAP+ par puits dépend du donneur et peut varier de ~200 à 1 600 OC/puits, avec une moyenne d’environ 1 000 OC/puits. De plus, pour analyser les données, les nombres de CO doivent être déterminés dans trois puits différents (répétitions techniques), et la moyenne doit être calculée pour chaque condition et pour chaque répétition biologique.
6. Essai de résorption osseuse
- Plaquer les monocytes CD14+ fraîchement enrichis sur des plaques d’ostéodosage à 96 puits recouvertes de phosphate de calcium à 1 x 105 cellules/puits, et différencier les CO pendant 7 à 14 jours, comme indiqué aux étapes 4.1 à 4.8, et changer le milieu tous les 3 jours.
NOTE: Des tranches d’os corticaux dentaires / ivoire ou bovins peuvent être utilisées à la place des plaques d’ostéo-dosage. Si tel est le cas, la durée totale de la culture doit être prolongée à 14-21 jours en raison du substrat plus complexe à résorber. - À la fin, retirez soigneusement le milieu, en évitant de toucher le fond du puits, et lyser les cellules avec une solution d’hypochlorite de sodium à 10%. Lavez les puits trois fois avec de l’eau distillée.
- Numériser les plaques sèches à l’aide d’un microscope à fond clair, et analyser/quantifier les images acquises des fosses de résorption à l’aide d’un logiciel d’analyse d’images.
7. Coloration fluorescente à anneau d’actine
- Plaque de 100 μL/puits des monocytes CD14+ isolés dans une lame de chambre de 18 puits à une densité cellulaire de 1 x 105 cellules/puits. Différencier les CO en présence de M-CSF et de RANKL comme décrit précédemment (étapes 4.1-4.8), y compris changer le milieu tous les 3 jours.
- À la fin, retirez doucement le milieu et lavez chaque puits deux fois avec 200 μL/puits de PBS préchauffé, pH 7,4. Ne laissez pas les puits sécher entre les étapes.
- Fixer l’échantillon avec 100 μL/puits de solution de formaldéhyde à 4 % dans du PBS et incuber pendant 10 min à TA sur un agitateur orbital en agitant doucement.
REMARQUE: Le méthanol peut perturber l’actine pendant le processus de fixation. Par conséquent, il est préférable d’éviter tout fixateur contenant du méthanol. Le fixateur préféré est le formaldéhyde sans méthanol. L’agitateur orbital utilisé dans cette étape du protocole a été réglé à un réglage de puissance de 3 sur 10. - Laver deux fois avec 200 μL/puits de PBS, perméabiliser les cellules avec 100 μL/puits de solution de Triton X-100 à 0,1 % diluée dans du PBS et incuber pendant 10 min à TA sur un agitateur orbital en agitant doucement.
- Laver deux fois avec 200 μL/puits de PBS. Pour bloquer la liaison non spécifique et augmenter le signal, ajouter 100 μL/puits de solution de blocage faite avec 2 % d’albumine sérique bovine (BSA)/solution PBS. Incuber pendant 20 min à RT sur un agitateur orbital avec agitation douce.
- Retirer la solution de blocage et ajouter 100 μL/puits de solution de phalloïdine conjuguée par fluorescence diluée dans une solution de BSA/PBS à 2 %. Incuber pendant 20 min à RT sur un agitateur orbital à agitation douce et à l’abri de la lumière.
NOTE: Ajustez la concentration du colorant phalloïdine selon les recommandations du fabricant. - Laver deux fois avec 200 μL/puits de PBS, colorer les noyaux avec 100 μL/puits d’une solution de PBS contenant 300 nM de DAPI et incuber pendant 10-15 min à TA sur un agitateur orbital avec agitation douce et à l’abri de la lumière.
REMARQUE : Le DAPI est dilué dans de l’eau distillée pour obtenir une solution mère de DAPI de 14,3 mM (5 mg/mL). La solution mère est ensuite diluée jusqu’à la concentration finale de 300 μM. Enfin, la solution DAPI 300 μM est diluée une fois de plus dans du PBS jusqu’à une concentration finale de 300 nM. - Après 10-15 min, retirez la solution DAPI et remplacez-la par du PBS de 100 μL/puits.
REMARQUE: Selon les glissières de chambre choisies, soit stocker avec un volume approprié de PBS (100 μL / puits pour les glissières de chambre à 18 puits), soit monter la glissière avec des lames de couverture et un support de montage approprié. Les lames de chambre peuvent être conservées jusqu’à 1 semaine au réfrigérateur. Pour les lames de chambre à 18 puits, utilisez un volume de coloration de 50 à 100 μL et de 200 à 300 μL pour le lavage. Augmentez la taille des glissières des autres chambres en conséquence. Pour éviter l’évaporation, conservez les lamelles de couverture dans un récipient couvert pendant les périodes d’incubation. L’utilisation d’un agitateur orbital est recommandée mais pas indispensable. - Visualisez la coloration à l’aide de microscopes d’immunofluorescence ou confocaux appropriés et de grossissements entre 4x et 40x.
8. Enrichissement des CO matures et des précurseurs de CO par tri par cytométrie en flux
- Remettez en suspension les monocytes CD14+ fraîchement enrichis à 1 x 106 cellules/ml et différenciez-les en CO matures en présence de M-CSF et de RANKL de la même manière que décrite ci-dessus (étapes 4.1-4.8).
REMARQUE : Lorsque vous passez d’une plaque de 96 puits à une plaque de plus grande taille, suivez le tableau 1; ces volumes sont calculés à partir d’une solution 1 x 106 cellules/ml et fournissent une densité optimale pour la fusion cellule-cellule. - Le jour 7, laver les puits une fois avec du PBS chaud et ajouter 50 μL à 1 mL (volume déterminé par la taille de la plaque utilisée) d’accutase. Incuber les cellules à 37 °C avec 5% de CO2 pendant 20 min.
- Après l’incubation, vérifiez les plaques au microscope optique pour voir si les cellules se sont détachées. De plus, détachez les cellules en tapotant les plaques de tous les côtés et en les pipetant de haut en bas.
- Recueillir la suspension cellulaire dans un tube conique de 15 mL. Lavez les puits avec du PBS chaud (pas de Ca 2+, pas de Mg2+) et combinez-les avec la suspension cellulaire. Répétez les étapes 8.2-8.3 une ou deux fois jusqu’à ce que la plupart des cellules se soient détachées.
REMARQUE: Accutase, la méthode recommandée avant la coloration de surface pour l’analyse cytométrique en flux, ne détache pas les très gros CO. Le taux de récupération est de ~50%-70%. - Centrifuger les cellules à 300 x g pendant 5 min, remettre en suspension la pastille cellulaire dans 1 mL de PBS et compter les cellules par exclusion du bleu de trypan.
- Remettez les cellules en suspension à 1 x 106 cellules/mL, retirez 100 μL correspondant à 1 x 105 cellules et transférez ces cellules dans un nouveau tube à essai en polypropylène. Ajoutez 200 μL du tampon de tri cellulaire et mettez-le de côté sur de la glace comme témoin non coloré.
- Colorer le reste des cellules avec un colorant vivant/mort dilué à 1:750 pendant 10 min à TA et à l’abri de la lumière.
REMARQUE: La coloration vivante / morte doit être effectuée en l’absence de FBS pour éviter une coloration de fond élevée. - Remplissez le tube collecteur de 15 mL contenant la suspension de cellules colorées vivantes/mortes avec un tampon de tri de cellules chaudes (1x PBS, pas de Ca 2+, pas de Mg2+, 1% FBS et 5 mM d’EDTA), et centrifugez à 300 x g pendant 5 minutes pour enduire les cellules.
REMARQUE: Une concentration élevée d’EDTA et une faible concentration de FBS sont recommandées dans le tampon de tri pour éviter les amas cellulaires. - Retirer un volume correspondant à 1 x 105 cellules, et les transférer dans un nouveau tube à essai en polypropylène pour le contrôle de l’isotype OSCAR. Transférer toutes les cellules restantes dans un autre tube à essai en polypropylène pour la coloration et le tri des cellules.
REMARQUE: Les tubes à essai en polypropylène sont utilisés pour le tri car les cellules sont moins susceptibles d’adhérer à ces tubes qu’aux tubes en polystyrène. - Faire tourner les tubes à 400 x g pendant 5 min pour enduire les cellules, et éliminer l’excès de surnageant par inversion.
- Remettez en suspension la pastille cellulaire dans une solution de mélange principal d’anticorps préparée conformément au tableau 2. Colorer le tube de contrôle de l’isotype OSCAR avec l’anticorps CD14 et le contrôle de l’isotype OSCAR à la place de l’anticorps OSCAR.
- Incuber les cellules à 4 °C à l’abri de la lumière pendant 30 min.
- Après 30 min, laver les cellules en ajoutant cinq volumes du tampon de tri des cellules, et centrifuger à 400 x g pendant 5 min à 4 °C.
- Remettez les cellules en suspension dans 300 à 1 000 μL de tampon de tri de cellules froides et acquérez les cellules à l’aide d’une machine de tri par cytométrie en flux équipée d’une buse de 100 μM.
REMARQUE: Les CO sont des cellules très collantes, il est donc important de les filtrer à travers une membrane stérile de 70 μm avant le tri. - Entrez les CO et les pré-OC en CD14−OSCAR+. Réglez la porte OSCAR+ en fonction du tube de commande d’isotype OSCAR.
- Recueillir les cellules triées dans des tubes à essai en polypropylène contenant du α-MEM complet complété par 20% de FBS à 8 °C.
- Après tri, granuler les cellules par centrifugation à 300 x g pendant 5 min à TA, compter les cellules et les remettre en suspension pour les applications en aval.
REMARQUE: Habituellement, pour obtenir ~1 x 105 pré-OC / OC triés, commencez à partir de ~10 x 106 cellules plaquées au jour 0. Le faible taux de récupération est influencé par la perte cellulaire lors du détachement avec accutase et par le traitement de la coloration et du tri. Il est recommandé d’effectuer l’ensemble de la procédure en utilisant des tampons et des réactifs stériles et de travailler dans des conditions stériles.
9. Test ATP pour l’activité mitochondriale
- Incuber les monocytes CD14+ enrichis en présence de M-CSF et de RANKL dans une plaque à 96 puits de la même manière que décrite précédemment (étapes 4.1-4.8). Plaquer quatre conditions supplémentaires en trois exemplaires à utiliser comme témoins.
- Effectuez le test ATP avec le kit de test de détection ATP par luminescence conformément au manuel du fabricant. Brièvement, pour préparer la solution d’ATP, ajouter 10 mL de la solution tampon du substrat au substrat lyophilisé et laisser incuber à TA pendant 30 min.
REMARQUE: Différentes méthodes peuvent être utilisées pour mesurer la production intracellulaire d’ATP. Ici, nous avons utilisé la détection de la production d’ATP par luminescence. - Pendant l’incubation, préparer et ajouter les témoins directement dans les puits témoins comme suit : 2-désoxy-D-glucose (2DG) à 10 mM et 100 mM, oligomycine à 1 μM et 100 mM 2DG en association avec 1 μM d’oligomycine. Incuber pendant 30 min à 37 °C avec 5% de CO2.
REMARQUE: Le 2DG bloque la glycolyse, tandis que l’oligomycine est un inhibiteur de la phosphorylation oxydative. La combinaison de ces deux inhibiteurs entraîne une perte complète de la production d’ATP par glycolyse et phosphorylation oxydative, ce qui signifie qu’ils servent de contrôle interne pour le test ATP. Pour les témoins 10 mM et 100 mM 2DG, ajouter 0,5 μL et 5 μL de solution mère 2M 2DG par puits de culture de 100 μL, respectivement. Pour 1 μM d’oligomycine, diluer la solution mère de 5 mM 1:100 dans un milieu et ajouter 2 μL/puits dans les puits témoins dédiés. Pour le dernier contrôle, ajouter 5 μL de 2DG et 2 μL de solution d’oligomycine diluée par puits. - Ajouter 50 μL de la solution d’ATP à chaque puits pour arrêter la réaction, et incuber à TA sur un agitateur à 700 tr/min pendant 5-10 min à l’abri de la lumière.
- Transférer 100 μL du surnageant sur une plaque à fond blanc à 96 puits spécifique pour le test ATP et lire la plaque à l’aide d’un lecteur de luminescence.
Résultats
Génération de CO à partir de monocytes CD14+
Cette méthode visait à différencier facilement un grand nombre de CO des monocytes CD14+ du sang périphérique humain in vitro, généralement en 1 semaine. Tout d’abord, les monocytes CD14+ ont été enrichis à partir de PBMC et amorcés avec du M-CSF pendant la nuit pour réguler à la hausse RANK, comme indiqué précédemment15. Après l’amorçage des monocytes, pour déterminer la concentration optimale de RANKL pour la différenciation et la maturation du CO, des concentrations de RANKL de 1 ng/mL, 25 ng/mL, 50 ng/mL et 100 ng/mL, ainsi que 25 ng/mL DE M-CSF, ont été utilisées. L’ajout de RANKL a produit un nombre croissant de grands CO multinucléés positifs au TRAP d’une manière dose-dépendante, et cela a été évalué à l’aide de la coloration TRAP. Les CO matures sont définis comme des cellules TRAP-positives avec plusieurs noyaux (généralement plus de trois; Figure 2A,B et Figure supplémentaire 1). De plus, la cinétique de la différenciation OC des monocytes a été étudiée à l’aide de la coloration TRAP et de la microscopie optique sur une période de culture de 2 à 14 jours. Dans ce cas, la différenciation OC à l’aide d’une concentration intermédiaire de 50 ng/mL RANKL a été choisie pour évaluer la vitesse à laquelle les CO se différencient en culture. Dans ces conditions de culture, les CO multinucléés étaient visibles à partir du jour 5, et une différenciation optimale a été atteinte le jour 7 (Figure 2C). L’incubation prolongée de cultures au-delà de 10 jours sur des plastiques a abouti à des cellules fusionnées anormalement géantes. Dans ce protocole, les jours 6 à 8 sont généralement utilisés comme critère d’évaluation optimal de la génération de CO. Les CO peuvent être quantifiés ou utilisés pour des essais en aval.
Évaluation fonctionnelle des CO différenciés
Pour déterminer l’activité fonctionnelle des CO générés, nous avons examiné leur activité résorptive en différenciant les CO sur une surface minéralisée. Comme les gros CO ne sont générés qu’après une période de culture de 7 jours, et pour laisser suffisamment de temps pour résorber le substrat minéral, les cultures ont été maintenues jusqu’au jour 10. La formation de trous ronds, ou fosses de résorption, n’a été observée que sur les surfaces minéralisées de puits contenant des cellules qui avaient été traitées à la fois avec du M-CSF et du RANKL (Figure 3). Ainsi, le pourcentage de surface minéralisée dissoute (fosses de résorption) permet de déterminer la capacité de résorption du CO. De plus, les CO différenciés suivant ce protocole jusqu’au jour 7, à la fois sur des lames de chambre en plastique et en verre, présentaient une structure d’anneau d’actine bien organisée qui pouvait être visualisée par coloration immunofluorescente (figure supplémentaire 2).
Effet d’un inhibiteur sur la fonction OC mature
Les conditions de culture mentionnées ci-dessus ont été utilisées pour déterminer la capacité fonctionnelle des CO générés in vitro en présence de l’inhibiteur connu du CO, la roténone34. Les CO ont été différenciés pendant 6 à 8 jours, et les CO CD14−OSCAR+ et les précurseurs OC ont été enrichis par cytométrie en flux (Figure 4). Les cellules enrichies ont ensuite été plaquées à 50 000 cellules/par puits sur une plaque minérale de 96 puits dans un milieu pro-ostéoclastogène (25 ng/ml de m-CSF et RANKL) pendant 3 jours. Le traitement à la roténone (figure 5A,B) a inhibé la résorption de la surface minéralisée par rapport au puits témoin non traité, conformément aux études antérieures34. De plus, la fonctionnalité du CO a été évaluée via la production d’ATP et la formation d’anneaux d’actine. L’inhibition de la résorption du CO dépendante de la roténone était associée à l’inhibition de la production d’ATP (Figure 5C). Les CO résorbants sont des cellules hautement polarisées qui régulent leur capacité de résorption en favorisant l’organisation du cytosquelette. La phalloïdine conjuguée Alexa fluor 647 a été utilisée pour marquer le cytosquelette F-actine des CO matures cultivés en présence ou en l’absence de roténone. La roténone a provoqué la fragmentation de l’anneau actine dérivé de RANKL des CO matures (Figure 5D).
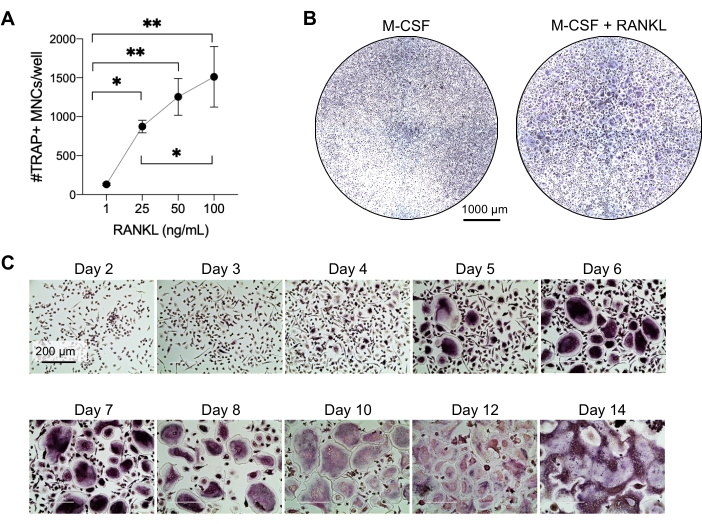
Figure 2 : Les CO se différencient efficacement des précurseurs des monocytes CD14+. Les monocytes CD14+ ont été enrichis magnétiquement, plaqués à 1 x 105 cellules/puits dans des plaques de 96 puits, et incubés pendant une nuit avec 25 ng/ml de m-CSF. (A) Les monocytes amorcés par le M-CSF ont été stimulés avec des concentrations croissantes de RANKL (1 ng / mL, 25 ng / mL, 50 ng / mL et 100 ng / mL), fixés et colorés pour TRAP le jour 7. Des images ont été acquises et les cellules multinucléées TRAP+ (MNC) ont été comptées. Des images représentatives de la coloration TRAP sont présentées à la figure supplémentaire 1. Les barres d’erreur indiquent ± ET moyen (n = 3). Les données ont été analysées à l’aide d’une ANOVA unidirectionnelle et du test de comparaisons multiples de Holm-Sidak pour les données appariées; * P ≤ 0,05 et ** P ≤ 0,005. (B) Image représentative d’un puits coloré par TRAP d’une plaque de 96 puits montrant la quantité typique de CO/puits attendue et leur morphologie inférieure à 25 ng/mL RANK-L par rapport aux macrophages dérivés du M-CSF au jour 7. Barres d’échelle: 1000 μm. (C) Images représentatives de la formation d’OC sous 50 ng / mL RANKL évaluées par coloration TRAP du jour 2 au jour 14. Les CO sont visibles à partir du jour 5. Des CO géants anormalement fusionnés sont présents après 10 jours. Barres d’échelle: 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
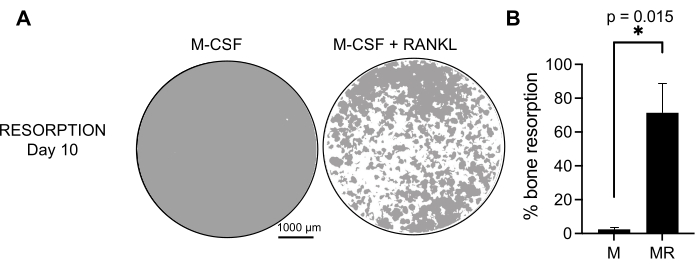
Figure 3 : CO résorptifs différenciés des monocytes CD14+. Les cellules CD14+ isolées des PBMC ont été différenciées pendant 10 jours en CO en présence de 25 ng/ml de m-CSF (m) et de RANKL(R) sur des plaques minérales de surface (ostéo-essai). (A) Images de puits reconstruits représentatifs prises à un grossissement de 10x pour analyser la résorption au jour 10 (substrat minéral en gris; fosses de résorption en blanc). Barres d’échelle: 1000 μm. (B) Quantification du pourcentage de surface résorbée. Les données de résorption ont été analysées avec une analyse par paires de Wilcoxon. Les barres d’erreur indiquent ± ET moyen (n = 7). Veuillez cliquer ici pour voir une version agrandie de cette figure.
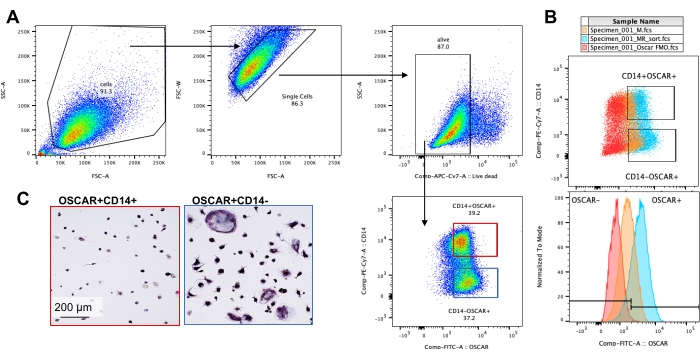
Figure 4 : Enrichissement en cytométrie en flux des CO CD14−OSCAR+. Les monocytes CD14+ ont été enrichis à partir de PBMC, et les CO ont été différenciés comme décrit précédemment. Les cultures OC adhérentes ont été détachées avec de l’accutase et colorées pour la cytométrie en flux. (A-C) Les CO du jour 8 ont été triés en fonction de CD14 et de l’expression OSCAR. (A) Stratégie représentative de tri des points de contrôle. Les cellules ont été fermées sous forme de singlets, négatives pour la coloration morte, et les sous-ensembles CD14+ OSCAR+ (rouge) et CD14− OSCAR+ (bleu) ont été triés. (B) Graphiques représentatifs montrant le chevauchement de la coloration OSCAR des CO dérivés de RANKL (cyan) et des macrophages témoins dérivés du M-CSF (orange). En rouge se trouve le contrôle coloré par l’isotype OSCAR des CO dérivés de RANKL. (C) Les populations triées ont été plaquées sur du plastique et laissées adhérer pendant 2 h dans un milieu pro-OC (25 ng/mL M-CSF et 50 ng/mL RANKL), suivies d’une coloration TRAP et d’une visualisation. Les images représentatives montrent un manque de cellules TRAP+ dans le sous-ensemble CD14+ (rouge) et de pré-CO et OC TRAP+ mononucléés et multinucléés dans le sous-ensemble CD14− (bleu). Barres d’échelle: 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
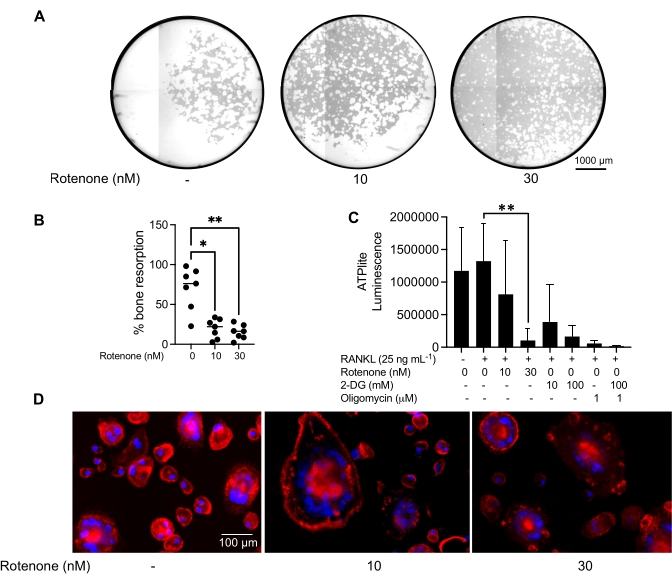
Figure 5 : Essais pour évaluer la fonction des CO matures. Pour évaluer la fonction des CO matures, les cellules CD14+ isolées des PBMC ont été cultivées soit avec du M-CSF (M) seul, soit avec du RANKL(R) pendant 7 jours, les CO ont été enrichis par cytométrie en flux et les CO ont ensuite été traités avec l’inhibiteur roténone pendant 24 h. (A) Les CO matures ont été triés par cytométrie de flux (CD14−OSCAR+) et ont été cultivées sur une surface d’essai minéral en présence ou en l’absence de roténone pendant 3 jours, après quoi les cellules ont été blanchies et imagées à 10x pour révéler la zone résorbée (fosses de résorption en blanc). (A) Images représentatives reconstruites de puits. Barres d’échelle: 1000 μm. (B) La quantification du pourcentage de surface résorbée. Les données en (B) ont été analysées avec une ANOVA unidirectionnelle avec le test de comparaisons multiples de Dunn (n = 7); * P ≤ 0,05 et** P ≤ 0,01. Les barres d’erreur montrent la moyenne ± écart-type. (C) Teneur totale en ATP intracellulaire des CO matures indifférenciés et différenciés du jour 7 différenciés avec RANKL et traités avec le véhicule ou la roténone (10 nM et 30 nM). Ici, le 2DG et l’oligomycine ont été utilisés comme témoins positifs pour le test et ont été ajoutés 30 minutes avant la lyse cellulaire et la quantification de l’ATP. Les barres d’erreur indiquent la moyenne ± ET (n = 4). Les données ont été analysées avec une ANOVA unidirectionnelle et le test de comparaison multiple de Dunnett pour les données appariées. ** P ≤ 0,01. (D) Une image représentative 20x des CO matures colorés pour la formation du cycle actine (rouge) et des noyaux (bleu), montrant la perte du cycle actine avec l’inhibiteur. Barres d’échelle: 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Format de plaque | 96 puits-plaque | 48 puits-plaque | 24 puits-plaque | 12 plaques de puits | 6 plaques de puits |
| volume | 100 μL | 225 à 250 μL | 450 à 500 μL | 0,8 à 1 mL | 1,8 à 2 mL |
Tableau 1 : Volume de la suspension cellulaire pour différents formats de plaques. Les volumes sont calculés à partir d’une solution 1 x 106 cellules/ml et fournissent une densité optimale pour la fusion cellule-cellule.
| Fluorophore, clone | Volume (μL) par 106 cellules | |
| CD14 | PE/Cyanine7, HCD14 | 5 μL |
| OSCAR | FITC, REA494 | 10 μL |
| Tampon de tri cellulaire | 80 μL |
Tableau 2 : Solution de mélange principal d’anticorps.
Figure supplémentaire 1 : coloration TRAP de la relation dose-réponse RANKL. Les monocytes CD14+ ont été enrichis magnétiquement, plaqués à 1 x 105 cellules/puits dans des plaques de 96 puits, et incubés pendant une nuit avec 25 ng/ml de m-CSF, comme le montre la figure 2. Des images représentatives de la coloration TRAP montrent des monocytes amorcés par MCSF stimulés par des concentrations croissantes de RANKL (1 ng / mL, 25 ng / mL, 50 ng / mL et 100 ng / mL), fixés et colorés pour TRAP le jour 7. Barres d’échelle: 400 μm. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Coloration de l’anneau agissante dans les CO entièrement différenciés. (A) Un grossissement 10x des CO différenciés sur du plastique TC et colorés avec de la phalloïdine AF647 (en rouge). Barre d’échelle : 400 μm. (B) Un grossissement 40x des CO différencié sur des lames de chambre en verre et coloré avec de la phalloïdine AF488 (en jaune). Barre d’échelle: 100 μm.Les noyaux sont colorés au DAPI, représenté en bleu en (A) et en cyan en (B). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Effet de différents lots FBS sur l’efficacité de la différenciation du CO. Les CO ont été différenciés des monocytes CD14+ en présence de 25 ng/mL DE M-CSF et de 50 ng/mL RANKL (MR) pendant 7 jours. Les puits de contrôle ne contenaient que du M-CSF (M). (A) grossissements représentatifs de 10x (barres d’échelle: 400 μm) et (B) quantification des CO colorés par TRAP différenciés d’un donneur dans deux lots différents de FBS. Les barres d’erreur montrent la moyenne ± SD de trois répétitions techniques. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La culture et l’isolement faciles d’un grand nombre de CO fonctionnels in vitro sont importants pour faire progresser la compréhension de la biologie osseuse et des maladies médiées par le CO. Classiquement, les CO étaient générés en co-cultures avec des ostéoblastes ou des cellules stromales et des cellules hématopoïétiques de la rate ou de la moelle osseuse38,39. Une percée significative dans la compréhension de l’ostéoclastogenèse a été l’identification de RANKL comme principal régulateur de la formation, de la différenciation et de la surviedu CO 40. Les premiers protocoles des systèmes de culture dépendants de RANKL utilisaient des PBMC pour la génération de CO21,41,42. Cependant, ces cultures mixtes sont longues et présentent de nombreux facteurs de confusion qui limitent la capacité de tester les effets directs sur la différenciation et la fonction du CO. Ce protocole décrit un modèle in vitro efficace et fiable d’ostéoclastogenèse à partir de monocytes CD14+ périphériques humains dans lequel une ostéoclastogenèse optimale peut être obtenue en 7 jours (Figure 1 et Figure 2), ce qui est considérablement plus rapide par rapport à certains autres protocoles43,44,45,46. Les principales caractéristiques distinctives de ce protocole sont (1) l’utilisation de monocytes CD14+ purifiés, (2) l’amorçage des monocytes avec du M-CSF avant l’exposition au RANKL, (3) la durée de la culture (<7 jours) et (4) la détection fiable de l’inhibition de la formation d’OC (coloration TRAP) et de la fonction (résorption, production d’ATP, réorganisation du cycle actine) avec des inhibiteurs.
Lors de l’optimisation de la méthodologie, plusieurs points critiques ont été identifiés. Il a été observé que la différenciation in vitro des CO dépend en grande partie de la densité d’ensemencement des monocytes CD14+. Ainsi, dans ce protocole, les cellules sont ensemencées à haute densité (1 x 105 cellules/puits d’une plaque de 96 puits, dans 100 μL de milieu), car il est essentiel que les cellules puissent interagir les unes avec les autres et être à proximité de fusionner et devenir des CO matures. De même, l’ensemencement des cellules à une densité trop élevée limite leur différenciation et leur croissance en raison de limitations moyennes et d’un manque d’espace requis. De plus, pour obtenir un succès maximal avec ce protocole, il est important d’effectuer soigneusement la séparation du gradient de densité et de s’assurer que la population enrichie de cellules CD14+ est aussi pure que possible. Par exemple, des étapes de lavage inadéquates entraînent un manque d’élimination des plaquettes, ce qui inhibe par conséquent la différenciation du CO47,48. De même, la présence d’une contamination mineure par les lymphocytes T dans des préparations isolées de CD14+ stimulées par le M-CSF seul peut entraîner une différenciation du CO, potentiellement via la sécrétion de RANKL par les lymphocytes T49. Par conséquent, il est important d’inclure un contrôle M-CSF pour chaque expérience. Un contrôle de pureté de routine, en particulier lors de l’utilisation d’un nouveau kit d’isolation, est également recommandé pour assurer la pureté de l’échantillon.
Les nombres OC optimaux (plage : ~200-1 600 OC/puits) sont obtenus en utilisant un milieu α-MEM enrichi en nucléosides et en L-glutamine. D’autres milieux de culture conventionnels, y compris le milieu aigle modifié de Dulbecco (DMEM) et le milieu 1640 du Roswell Park Memorial Institute (RPMI), affectent le rendement en CO. La source de FBS peut également influencer l’ostéoclastogenèse. Différents lots de FBS peuvent entraîner une réduction de l’ostéoclastogenèse dérivée de RANK-L, ainsi que l’apparition d’un faible nombre de cellules multinucléées TRAP+ chez les témoins M-CSF (Figure supplémentaire 3). Par conséquent, pour obtenir des résultats cohérents, il est conseillé de tester de nouveaux lots FBS avant utilisation et de continuer avec le même lot tout au long des expériences afin de minimiser les variations dans le processus de différenciation. De plus, la variabilité d’un donneur à l’autre, en termes de nombre total de CO différenciés obtenus au point final, constitue une limite lors de l’utilisation de ce protocole pour comparer, par exemple, les donneurs sains aux patients. Dans ces cas, il est impératif d’utiliser exactement les mêmes conditions et le même lot de milieu, FBS et autres réactifs.
Une autre étape nécessaire pour une différenciation et une maturation optimales du CO consiste à amorcer les monocytes avec du M-CSF avant l’ajout de RANKL. L’exposition des cellules au M-CSF 18-24 h avant RANKL incite les monocytes à réguler positivement l’expression de RANK 15,26. L’ajout de RANKL à ce moment assure une différenciation optimale du CO d’une manière dose-dépendante. Le degré de différenciation du CO varie d’un donneur à l’autre; cependant, 25 ng/mL de RANKL est généralement suffisant pour différencier un nombre élevé de CO chez la plupart des donneurs. De plus, 25 ng/mL de RANKL peut être utilisé dans les essais pour le criblage initial des composés, car il facilite l’évaluation des effets améliorants et inhibiteurs des composés d’essai. D’autres systèmes de culture ont utilisé des temps de pré-incubation du M-CSF plus longs avant l’ajout de RANKL, mais cela entraîne un temps de culture plus long pour l’ostéoclastogenèse50. De plus, laisser les monocytes amorcés incuber pendant la nuit leur permet de se fixer à la plaque, mais pas dans un état d’adhérence complète. Par conséquent, lorsque RANKL est introduit pour la première fois, le milieu doit être à moitié changé très soigneusement plutôt que complètement changé pour éviter le détachement et la perte des monocytes amorcés. Le milieu doit également être rafraîchi tous les 3-4 jours pour éviter l’épuisement moyen et prévenir la mort cellulaire. De plus, en raison du faible volume utilisé dans cet essai (100 μL/puits dans une plaque de 96 puits), il est de la plus haute importance d’avoir un cadre de puits vides remplis d’une solution aqueuse (c.-à-d.H2Oou PBS distillé stérile) autour des puits d’essai. Cela empêche l’évaporation moyenne et les effets de bord.
Enfin, pour les tests métaboliques (p. ex., les tests ATP), il est impératif que les cellules soient viables pour éviter un écart type énorme entre les répétitions (Figure 5). Une viabilité élevée des cellules est également importante pour le tri des cellules et pour la poursuite de la culture des CO triés (Figure 4). Cette méthode présente toutefois plusieurs limites. Les CO complètement matures sont très adhérents et difficiles à détacher des plaques. Les CO plus grands sont souvent impossibles à détacher, ce qui peut entraîner une baisse du rendement cellulaire. Par conséquent, les cellules doivent être comptées après le tri et avant le placage à la concentration requise. En outre, dans le protocole actuel, une méthode non enzymatique (accutase) pour détacher les CO est utilisée pour prévenir les altérations membranaires de la coloration de surface en aval pour la cytométrie en flux. L’utilisation de grattoirs cellulaires (à la fois avec des terminaisons molles ou dures) a également été testée et a conduit à une mort cellulaire élevée. Le décollement enzymatique utilisant des solutions de trypsine/EDTA à 0,05 % peut être utilisé pour un rendement plus élevé des CO détachés lorsque l’intégrité de la membrane n’est pas requise pour les applications en aval. De plus, pour éviter que les CO ne s’agglutinent, l’utilisation d’une concentration élevée d’EDTA dans tous les tampons après le décollement cellulaire, ainsi qu’un filtrage approprié avant l’acquisition de la cytométrie en flux, sont fortement recommandés. Il est important de noter que les cultures de CO sont une population hétérogène de cellules constituées de CO matures, de précurseurs de CO et de macrophages. Les macrophages peuvent être facilement distingués des CO, bien que les CO mononucléaires pré-OC et les CO multinucléaires expriment OSCAR et ne puissent pas être distingués avec la présente méthode (Figure 4). En effet, cette dernière question constitue la principale limite de cette méthode. En outre, une faible expression d’OSCAR est également présente dans les cultures de M-CSF (Figure 4B) et pourrait indiquer des macrophages qui sont préparés pour l’engagement de la lignée OC. Il est important de régler la grille des cellules OSCAR+ en fonction du signal de coloration FMO, comme illustré à la figure 4B.
En résumé, ce protocole décrit une méthode optimisée et robuste pour la production efficace de CO actifs et fonctionnellement matures à partir de monocytes humains primaires circulants. La force de ce protocole est sa capacité à générer des CO dans un court laps de temps et à produire un nombre élevé de CO différenciés. Cette méthode ouvre la voie à l’étude des mécanismes de base sous-jacents à la différenciation et à la fonction du CO.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Les auteurs remercient le Flow Core Facility et le Glasgow Imaging Facility (GIF) de la School of Infection and Immunity pour leur soutien et leur assistance dans ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 well chamber slides | ibidi | 81816 | |
| 8-well glass chamber slides | Ibidi | 80807 | |
| 96-well TC plate | Corning | 3596 | |
| 96-well osteo assay stripwell plate | Corning | 3989 | |
| Acetate solution | Sigma Aldrich | 386-3 | from kit Cat No. 387A-1KT |
| Acetone | VWR | 20066.330 | |
| Acid phosphatase, Leukocyte (TRAP) kit | SIGMA-ALDRICH | 387A-1KT | |
| Alexa Fluor 488 Phalloidin | Theremo Fisher - Invitrogen | A12379 | AF488 |
| Alexa Fluor 647 Phalloidin | Thermo Fisher - Invitrogen | A22287 | AF647 |
| Alfa Aesar 2-Deoxy-D-glucose | Fisher Scientific | 11321867 | 2DG, 98% |
| Alpha minimum essential medium | gibco | 22571-020 | |
| ATPlite 1step | PerkinElmer | 6016731 | Luminiscence ATP detection assay system |
| BD FACSAria III cell sorter | BD Biosciences | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418-100G | |
| Cell culture microplate, 96-well, PS, F-bottom | Greiner bio-one | 655083 | White-bottom plates |
| Citrate solution | Sigma Aldrich | 91-5 | from kit Cat No. 387A-1KT |
| Corning 6ml round-bottom polystyrene test tubes | Fisher Scientific | 352054 | |
| Corning osteo assay surface multiple well plate | Sigma-Aldrich | CLS3989 | |
| Corning osteo assay Surface multiple well plate 1 x 8 stripwell | Corning | CLS3989-2EA | |
| DAPI | Theremo Fisher | D3571 | |
| EasySep human CD14 positive selection kit | STEMCELL Technologies | 17858 | |
| EasySep red blood cell lysis buffer (10x) | StemCell Technologies | 20110 | |
| eBioscience fixable viability dye eFluor 780 | Theremo Fisher - Invitrogen | 65-0865-14 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E7889-100ML | |
| EVOS FL auto imaging system | Thermo Fisher | A32678 | |
| Falcon round-bottom polypropylene test tubes with cap | Fisher Scientific | 10314791 | |
| Falcon tubes 15 mL | Corning | 430790 | |
| Falcon tubes 50 mL | Corning | 430828 | |
| Fast Garnet GBC base solution | Sigma Aldrich | 387-2 | from kit Cat No. 387A-1KT |
| Fetal bovine serum | gibco | 10500-064 | FBS |
| Ficoll-Paque Plus | cytiva | 17144003 | |
| Formaldehyde | Sigma-Aldrich | F-8775 | |
| Human sRANK ligand | PEPROTECH | 310-01-100UG | Receptor activator of nuclear factor kappa-B ligand (RANKL) |
| ImageJ Image analysis software | Image J | version 2.9.0 | |
| L-glutamine | gibco | 25030-024 | |
| Lithium heparin tubes (9 mL) | VACUETTE | 455084 | |
| Macrophage colony-stimulating factor | PEPROTECH | 300-25-100UG | M-CSF |
| Napthol AS-BI phosphoric acid solution | Sigma Aldrich | 387-1 | from kit Cat No. 387A-1KT |
| Neubauer hemacytometer counting chamber | Camlab | SKU 1127885 | |
| Oligomycin from Streptomyces Diastatochromogenes | Sigma-Aldrich | Q4876-5MG | |
| OSCAR Antibody, anti-human, Vio Bright FITC, REAfinit | Miltenyi Biotec | 130-107-661 and 130-107-617 | Clone REA494 |
| PE/Cyanine7 anti-human CD14 antibody | Biolegend | 325618 | Clone HCD14 |
| Penicilin/streptomycin | SIGMA | P0781 | |
| PHERAstar machine and software | BMG LABTECH | ||
| Phosphate-buffered saline (DPBS, 1x) | gibco | 14190-094 | |
| REA control antibody (S), human IgG1, Vio Bright FITC, REAfinity | Miltenyi Biotec | 130-113-443 | |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044-1L | |
| Sodium nitrite solution | Sigma Aldrich | 91-4 | from kit Cat No. 387A-1KT |
| Tartrate solution | Sigma Aldrich | 387-3 | from kit Cat No. 387A-1KT |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Trypan blue | Sigma-Aldrich | T8154-100ML |
Références
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Boyce, B. F., Xing, L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives Of Biochemistry and Biophysics. 473 (2), 139-146 (2008).
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Agemura, T., Hasegawa, T., Yari, S., Kikuta, J., Ishii, M. Arthritis-associated osteoclastogenic macrophages (AtoMs) participate in pathological bone erosion in rheumatoid arthritis. Immunological Medicine. 45 (1), 22-26 (2022).
- Hasegawa, T., et al. Identification of a novel arthritis-associated osteoclast precursor macrophage regulated by FoxM1. Nature Immunology. 20 (12), 1631-1643 (2019).
- Walsh, N. C., Crotti, T. N., Goldring, S. R., Gravallese, E. M. Rheumatic diseases: The effects of inflammation on bone. Immunological Reviews. 208 (1), 228-251 (2005).
- Gravallese, E. M., et al. Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis. The American Journal of Pathology. 152 (4), 943-951 (1998).
- Bromley, M., Woolley, D. E. Chondroclasts and osteoclasts at subchondral sites of erosion in the rheumatoid joint. Arthritis & Rheumatism. 27 (9), 968-975 (1984).
- Kleyer, A., Schett, G. Arthritis and bone loss: A hen and egg story. Current Opinion in Rheumatology. 26 (1), 80-84 (2014).
- Kawai, V. K., Stein, C. M., Perrien, D. S., Griffin, M. R. Effects of anti-tumor necrosis factor α (anti-TNF) agents on bone. Current Opinion in Rheumatology. 24 (5), 576-585 (2012).
- Siebert, S., Tsoukas, A., Robertson, J., McInnes, I. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases. Pharmacological Reviews. 67 (2), 280-309 (2015).
- Smiljanovic, B., et al. Monocyte alterations in rheumatoid arthritis are dominated by preterm release from bone marrow and prominent triggering in the joint. Annals of the Rheumatic Diseases. 77 (2), 300-308 (2018).
- Anderson, J. R., et al. 1H NMR metabolomics identifies underlying inflammatory pathology in osteoarthritis and rheumatoid arthritis synovial joints. Journal of Proteome Research. 17 (11), 3780-3790 (2018).
- McGarry, T., et al. Rheumatoid arthritis CD14+ monocytes display metabolic and inflammatory dysfunction, a phenotype that precedes clinical manifestation of disease. Clinical & Translational Immunology. 10 (1), 1237 (2021).
- Ansalone, C., et al. TNF is a homoeostatic regulator of distinct epigenetically primed human osteoclast precursors. Annals of the Rheumatic Diseases. 80 (6), 748-757 (2021).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis and Rheumatology. 73 (7), 1145-1154 (2021).
- Allard-Chamard, H., et al. Osteoclasts and their circulating precursors in rheumatoid arthritis: Relationships with disease activity and bone erosions. Bone Reports. 12, 100282 (2020).
- Takegahara, N., et al. Involvement of receptor activator of nuclear factor-κB ligand (RANKL)-induced incomplete cytokinesis in the polyploidization of osteoclasts. The Journal of Biological Chemistry. 291 (7), 3439-3454 (2016).
- Jansen, I. D. C., Vermeer, J. A. F., Bloemen, V., Stap, J., Everts, V. Osteoclast fusion and fission. Calcified Tissue International. 90 (6), 515-522 (2012).
- McDonald, M. M., et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 184 (5), 1330-1347 (2021).
- Lacey, D. L., et al. Bench to bedside: Elucidation of the OPG-RANK-RANKL pathway and the development of denosumab. Nature Reviews Drug Discovery. 11 (5), 401-419 (2012).
- Zhao, B., Grimes, S. N., Li, S., Hu, X., Ivashkiv, L. B. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J. The Journal of Experimental Medicine. 209 (2), 319-334 (2012).
- Zhao, B. Does TNF promote or restrain osteoclastogenesis and inflammatory bone resorption. Critical Reviews in Immunology. 38 (4), 253-261 (2018).
- Crotti, T. N., et al. Receptor activator NF-κB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Annals of the Rheumatic Diseases. 61 (12), 1047-1054 (2002).
- Kim, H. R., et al. Reciprocal activation of CD4+ T cells and synovial fibroblasts by stromal cell-derived factor 1 promotes RANKL expression and osteoclastogenesis in rheumatoid arthritis. Arthritis and Rheumatology. 66 (3), 538-548 (2014).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor κB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Hayman, A. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
- Nedeva, I. R., Vitale, M., Elson, A., Hoyland, J. A., Bella, J. Role of OSCAR signaling in osteoclastogenesis and bone disease. Frontiers in Cell and Developmental Biology. 9, 780 (2021).
- Boyce, B. F., Yoneda, T., Lowe, C., Soriano, P., Mundy, G. R. Requirement of pp60c-src expression for osteoclasts to form ruffled borders and resorb bone in mice. The Journal of Clinical Investigation. 90 (4), 1622-1627 (1992).
- Matsubara, T., et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin. Biochemical and Biophysical Research Communications. 489 (4), 472-476 (2017).
- Roscher, A., et al. The F-actin modulator SWAP-70 controls podosome patterning in osteoclasts. Bone Reports. 5, 214-221 (2016).
- Jurdic, P., Saltel, F., Chabadel, A., Destaing, O. Podosome and sealing zone: Specificity of the osteoclast model. European Journal of Cell Biology. 85 (3-4), 195-202 (2006).
- Francis, M. J. O., et al. ATPase pumps in osteoclasts and osteoblasts. The International Journal of Biochemistry & Cell Biology. 34 (5), 459-476 (2002).
- Kwak, H. B., et al. Inhibition of osteoclast differentiation and bone resorption by rotenone, through down-regulation of RANKL-induced c-Fos and NFATc1 expression. Bone. 46 (3), 724-731 (2010).
- Massey, H. M., Flanagan, A. M. Human osteoclasts derive from CD14-positive monocytes. British Journal of Haematology. 106 (1), 167-170 (1999).
- Xue, J., et al. CD14+CD16-monocytes are the main precursors of osteoclasts in rheumatoid arthritis via expressing Tyro3TK. Arthritis Research and Therapy. 22 (1), 221 (2020).
- Marco-Casanova, P., et al. Preparation of peripheral blood mononuclear cell pellets and plasma from a single blood draw at clinical trial sites for biomarker analysis. Journal of Visualized Experiments. (169), e60776 (2021).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Matsuzaki, K., et al. Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. Biochemical and Biophysical Research Communications. 246 (1), 199-204 (1998).
- Shalhoub, V., et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell precursors. Journal of Cellular Biochemistry. 72 (2), 251-261 (1999).
- Neale, S. D., Smith, R., Wass, J. A. H., Athanasou, N. A. Osteoclast differentiation from circulating mononuclear precursors in Paget's disease is hypersensitive to 1,25-dihydroxyvitamin D3 and RANKL. Bone. 27 (3), 409-416 (2000).
- Abdallah, D., et al. An optimized method to generate human active osteoclasts from peripheral blood monocytes. Frontiers in Immunology. 9, 632 (2018).
- Komano, Y., Nanki, T., Hayashida, K., Taniguchi, K., Nobuyuki, M. Identification of a human peripheral blood monocyte subset that differentiates into osteoclasts. Arthritis Research and Therapy. 8 (5), 152 (2006).
- Kylmäoja, E., et al. Peripheral blood monocytes show increased osteoclast differentiation potential compared to bone marrow monocytes. Heliyon. 4 (9), 00780 (2018).
- Wang, D., et al. Platelet-rich plasma inhibits RANKL-induced osteoclast differentiation through activation of Wnt pathway during bone remodeling. International Journal of Molecular Medicine. 41 (2), 729-738 (2018).
- Cenni, E., Avnet, S., Fotia, C., Salerno, M., Baldini, N. Platelet-rich plasma impairs osteoclast generation from human precursors of peripheral blood. Journal of Orthopaedic Research. 28 (6), 792-797 (2010).
- D'Amico, L., Roato, I. Cross-talk between T cells and osteoclasts in bone resorption. BoneKEy Reports. 1 (6), 82 (2012).
- Quinn, J. M. W., Elliott, J., Gillespie, M. T., Martin, T. J. A combination of osteoclast differentiation factor and macrophage-colony stimulating factor is sufficient for both human and mouse osteoclast formation in vitro. Endocrinology. 139 (10), 4424-4427 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon