Method Article
הבחנה של אוסטאוקלסטים פונקציונליים ממונוציטים של דם היקפי אנושי CD14+
* These authors contributed equally
In This Article
Summary
אוסטאוקלסטים הם תאי מפתח סופחי עצם בגוף. פרוטוקול זה מתאר שיטה אמינה להבחנה חוץ גופית של אוסטאוקלסטים ממונוציטים של דם היקפי אנושי. שיטה זו יכולה לשמש ככלי חשוב להבנה נוספת של הביולוגיה של אוסטאוקלסטים בהומאוסטזיס ובמחלות.
Abstract
אוסטאוקלסטים (OCs) הם תאים סופחי עצם הממלאים תפקיד מרכזי בהתפתחות השלד ובעיצוב מחדש של עצמות בוגרות. מספר הפרעות עצם נגרמות על ידי התמיינות מוגברת והפעלה של OCs, ולכן עיכוב של פתולוגיה זו הוא עיקרון טיפולי מרכזי. שני גורמים עיקריים מניעים את ההבחנה של OCs ממבשרי מיאלואידים: גורם מגרה מושבת מקרופאגים (M-CSF) ומפעיל קולטן של ליגנד קאפה-B (RANKL). מונוציטים CD14+ במחזור אנושי ידועים מזה זמן רב כמתמיינים לOCs במבחנה. עם זאת, זמן החשיפה וריכוז ה- RANKL משפיעים על יעילות הבידול. אכן, תוארו פרוטוקולים ליצירת OCs אנושיים במבחנה , אך לעתים קרובות הם גורמים לתהליך בידול גרוע וממושך. בזאת, מסופק פרוטוקול חזק וסטנדרטי ליצירת OCs אנושיים בוגרים פעילים פונקציונלית בזמן. מונוציטים CD14+ מועשרים מתאי דם חד-גרעיניים היקפיים אנושיים (PBMCs) ודרוכים עם M-CSF כדי לווסת את RANK. חשיפה עוקבת ל- RANKL יוצרת OCs באופן תלוי מינון וזמן. OCs מזוהים ומכומתים על ידי צביעה עם phosphatase עמיד חומצה טרטרט (TRAP) וניתוח מיקרוסקופ אור. צביעה אימונופלואורסצנטית של גרעינים ו-F-actin משמשת לזיהוי OCs פעילים מבחינה תפקודית. בנוסף, OCs בוגרים של OSCAR+CD14− מועשרים עוד יותר באמצעות מיון תאי ציטומטריה של זרימה, ופונקציונליות OC המכומתת על ידי מבחני ספיגה מינרליים (או דנטין/עצם) והיווצרות טבעות אקטינים. לבסוף, מעכב OC ידוע, רוטנון, משמש על OCs בוגרים, מה שמוכיח כי ייצור אדנוזין טריפוספט (ATP) חיוני לשלמות טבעת האקטין ולתפקוד OC. לסיכום, במחקר זה נקבע מבחן חזק להבחנה בין מספר גבוה של OCs, אשר בשילוב עם צביעת טבעת אקטין ובדיקת ATP מספק מודל שימושי במבחנה להערכת תפקוד OC ולסינון תרכובות טיפוליות חדשניות שיכולות לווסת את תהליך ההתמיינות.
Introduction
אוסטאוקלסטים (OCs) הם תאי ענק מרובי גרעינים של שושלת המטופויטית עם יכולת ייחודית לספוח עצם. הם אחראים על פיתוח ושיפוץ מתמשך של השלד 1,2. בשלבי ההתפתחות של השלד, OCs ומקרופאגים שוכני רקמות נגזרים מאבות אריתרו-מיאלואידים ומאכלסים את נישת העצם ורקמות האיברים. במצבים פיזיולוגיים, אבות אריתרו-מיאלואידים נדרשים להתפתחות עצם תקינה ולבקיעת שיניים, בעוד שזרם מונוציטים במחזור הדם לתוך נישת העצם מספק תחזוקה לאחר הלידה של OCs, מסת העצם וחלל מח העצם3. בתנאים פתולוגיים, מונוציטים מגויסים לאתרים של דלקת פעילה ויכולים לתרום להרס עצם פתולוגי 4,5.
חולים עם מספר צורות של דלקת פרקים חווים דלקת מפרקים, המובילה להרס מפרקים מתקדם הנגרם על ידי OCs6. לדוגמה, בדלקת מפרקים שגרונית (RA), OCs מופעלים יתר על המידה אחראים לשחיקת עצם פתולוגית והרס מפרקים7,8, והטיפולים הנוכחיים לעתים קרובות אינם משפרים או עוצרים את הנזק לעצם9,10,11. שינויים במונוציטים במחזור הן מבחינת התפלגות האוכלוסייה והן מבחינת חתימות שעתוק ואפיגנטיות דווחו בחולי RA12,13,14. יתר על כן, דווח כי תגובות מונוציטים משתנות לגירוי דלקתי משפיעות על אוסטאוקלסטוגנזה בחולי RA עם מחלה פעילה15,16,17.
התמיינות של OCs היא תהליך מורכב ורב-שלבי הכולל את המחויבות של תאים מקדימים מיאלואידים להתמיין למבשרי OC. במהלך אוסטאוקלסטוגנזה, OCs הופכים לענקים ומרובי גרעינים באמצעות איחוי תאים, ציטוקינזיס לא שלם, ותהליך מחזור גרעיני המתואר כביקוע ואיחוי18,19,20. היכולת להבדיל בין OCs במבחנה אפשרה התקדמות משמעותית בהבנת הביולוגיה של העצם21. OCs נבדלים מקודמנים בחשיפה לגורם מגרה מושבת מקרופאגים (M-CSF) ומפעיל קולטן של גורם גרעיני קאפה-B ליגנד (RANKL). האחרון חיוני להתפתחות ותפקוד תקין של OCs במבחנה ו in vivo, גם בתנאים דלקתיים 6,22,23. RANKL מוצג על ידי אוסטאובלסטים ואוסטיאוציטים, כמו גם על ידי תאי T פעילים ופיברובלסטים בסינוביום RA מודלק 2,24,25. במהלך תהליך התמיינות OC, מונוציטים שנחשפו ל-M-CSF משפרים את מפעיל הקולטן של ביטוי גורם גרעיני קאפה-B (RANK) על קרום התא שלהם, ותחת גירוי עוקב עם RANKL, מתמיינים לקדם-OCs חד-גרעיניים חד-גרעיניים עמידים לטרטרט (TRAP) ולאחר מכן ל-OCs15,26 מרובי גרעינים. OCs מייצרים מספר אנזימים, העיקרי שבהם הוא TRAP, המאפשר פירוק של פוספופרוטאינים בתוך עצם27. וסת וסמן של התמיינות OC הוא קולטן הקשור ל-OC (OSCAR). הוא מווסת בשלב מוקדם בתאים מקדימים המתחייבים לשושלת OC28. OCs מרובי גרעינים ענקיים בוגרים יכולים לפרק (לספוג מחדש) את מטריצת השלד על ידי יצירת אזור איטום גדול, העשוי מטבעת אקטין המקיפה גבול פרוע21,29,30. יכולת ספיגת העצם של OCs דורשת ארגון מחדש של השלד הציטו-שלד וכתוצאה מכך קיטוב והיווצרות של קרום מפותל, שהוא מה שנקרא גבול פרוע. הגבול הפרוע מוקף ברצועה עגולה גדולה של מבנה עשיר באקטין F, שהוא טבעת האקטין או אזור האיטום. שלמות טבעת אקטין חיונית עבור OCs כדי לספוח מחדש את העצם הן במבחנה והן in vivo, והיווצרות גבול פרועה פגומה קשורה לביטוי אדנוזין טריפוספטאז ואקולרי תחתון (V-ATPase)31,32,33. יתר על כן, OCs הם תאים עשירים במיטוכונדריה, ואדנוזין טריפוספט (ATP) קשור למבנים דמויי מיטוכונדריה בOCs הממוקמים בגבול הפרוע31,32,33. רוטנון פועל כמעכב חזק של קומפלקס המיטוכונדריה I ומשפיע על ייצור ATP. רוטנון הוכח גם כמעכב התמיינות OC ותפקוד34.
פרוטוקול זה מתאר שיטה יעילה ואופטימלית של אוסטאוקלסטוגנזה חוץ גופית מדגימות דם היקפיות אנושיות. בדם היקפי אנושי, מונוציטים CD14+ הם המקור העיקרי של OCs15,35,36. בפרוטוקול זה, הקינטיקה של החשיפה והריכוזים של M-CSF ו-RANKL הותאמו לאוסטאוקלסטוטנזה אופטימלית. תאים חד-גרעיניים מופרדים תחילה מן אריתרוציטים גרנולוציטים נוכח דם שלם על ידי שיפוע צפיפות; לאחר מכן הם מועשרים עבור מונוציטים CD14+ באמצעות ברירה חיובית על ידי חרוזים מגנטיים. המונוציטים המבודדים CD14+ מודגרים למשך הלילה עם M-CSF. זה מכין את המונוציטים כדי לווסת את הביטוי של דרגה15,26. התוספת הבאה של RANKL גורמת לאוסטאוקלסטוגנזה ורב-גרעינים באופן תלוי זמן. OCs סופגים פעילים מראים את הפיזור האופייני של טבעות F-actin בקצה קרום התא30,32 ואת הצביעה עבור TRAP. OCs בוגרים מנותחים על ידי כימות תאים מרובי גרעינים TRAP+ (יותר משלושה גרעינים). ניתן להעריך את היכולת התפקודית של OCs בוגרים על ידי ספיגתם, שלמות טבעות האקטין וייצור ATP. יתר על כן, ניתן להעשיר OCs CD14-OSCAR+ מובחנים ולהשתמש בהם כדי להעריך את ההשפעות של תרכובות מסוימות על פונקציונליות OC באמצעות ספיגת מינרלים (או דנטין) וארגון F-actin. בנוסף, בעבודה זו, מעכב OC ידוע, רוטנון, משמש כדוגמה לתרכובת המשפיעה על הפונקציונליות של OCs. פעילות ספיגת OC מופחתת תחת רוטנון קשורה לייצור ATP מופחת ולפיצול טבעת אקטין (actin ring). לסיכום, פרוטוקול זה קובע בדיקה חזקה שיכולה לשמש כשיטת התייחסות לחקר מספר היבטים ביולוגיים של התמיינות OC ותפקוד במבחנה.
מתודולוגיה זו יכולה לשמש כדי להעריך (1) את הפוטנציאל של מונוציטים במחזור להתמיין לOCs בבריאות ובמחלות, כמו גם (2) את ההשפעה של מועמדים טיפוליים על התמיינות OC ותפקוד. פרוטוקול אוסטאוקלסטוגנזה חזק זה מאפשר לקבוע את היעילות והמנגנונים של טיפולים ממוקדי עצם הן על התמיינות OC מתאים מקדימים והן על תפקודם של OCs בוגרים.
Protocol
מעילי באפי המתקבלים משירות עירוי הדם הלאומי הסקוטי (אדינבורו) וקונוסים לויקוציטים המתקבלים מ- NHS דם והשתלות (ניוקאסל) מסופקים לחוקרי אוניברסיטת גלזגו בצורה אנונימית לחלוטין (לא ניתנת לזיהוי) מתורמי דם NHS בהסכמה מלאה. מעיל באפי ורכיבי דם חרוט לויקוציטים מיוצרים מתרומת דם סטנדרטית של NHS הניתנת במרכז תורמי דם של NHS בסקוטלנד או באנגליה. תורם הדם נותן הסכמה מדעת בעת תרומת הדם לעודפי דם שאינם משמשים בפרקטיקה הקלינית הסטנדרטית של NHS לשימוש במחקרים רפואיים מאושרים. האישור האתי מוועדת האתיקה למחקר של NHS וטפסי הסכמת התורמים החתומים לשימוש בתרומות דם אלה מוחזקים על ידי שירות תרומת הדם של NHS. אישור לגשת ולהשתמש בתרומות דם מוסכמות אלה במחקרים רפואיים מאושרים התבקש והושג באמצעות תהליך היישום והסקירה הפנימי הסטנדרטי של שירות עירוי הדם הלאומי (סקוטלנד) ו- NHS דם ותחבורה (אנגליה). לא נדרש אישור נוסף של NHS REC או אישור פנימי של ועדת האתיקה של אוניברסיטת גלזגו כדי להשתמש במרכיבי הדם למחקרים הרפואיים שאושרו.
1. הערות כלליות לפני תחילת העבודה
- המשך עם כל העבודה עם דם בזהירות. שקול את הסיכונים הפוטנציאליים של גורמים זיהומיים שונים שעשויים להיות נוכחים דגימות.
- יש לבצע את כל העבודה בזהירות במעבדה לבטיחות ביולוגית בתנאים סטריליים תוך לבישת כפפות ומעילי מעבדה.
- לבצע סילוק בטיחות ביולוגית בהתאם להנחיות המקומיות.
- קבלת הסכמה מתאימה ואישורים אתיים לפני איסוף הדגימות בהתאם לתקנות הרשות המקומית.
- בדרך כלל, 1 מ"ל של דם טרי יניב 1 מיליון PBMCs, ומונוציטים CD14+ מהווים כ 10%-30% של PBMCs. לשם השוואה, 10 מ"ל של חרוט לויקוציטים יכול להכיל 5 x 108-15 x 108 PBMCs. לפרטים נוספים על בידוד PBMC, עיין בפרוטוקול37 קודם.
2. בידוד תאי דם חד-גרעיניים היקפיים (PBMCs) מדם שלם
- לאסוף את הנפח הדרוש של דם טרי מתורמים בריאים לתוך צינורות איסוף ליתיום הפרין.
הערה: ניתן להשתמש גם בצינורות איסוף אחרים עם נוגדי קרישה מתאימים (למשל, צינורות נתרן הפרין). עבור ספירת תאים גבוהה יותר, קונוסים לויקוציטים או מעילים באפי ניתן להשתמש. - כדי לבודד את PBMCs, להעביר את הדם לתוך צינור חדש 50 מ"ל, ולדלל אותו עם סטרילי 1x פוספט-buffered מלוחים (PBS) ביחס של 1:1 או 1:3 עבור דם טרי או מדוכי לויקוציטים/מעילי באפי, בהתאמה.
- מערבבים בעדינות את התאים מספר פעמים על ידי היפוך.
- הכן צינורות 15 מ"ל המכילים 3 מ"ל של מדיום שיפוע צפיפות. שכבה איטית של 8-10 מ"ל של דם מדולל בחלק העליון של מדיום שיפוע הצפיפות, וצנטריפוגה ב 400 x גרם במשך 30 דקות בטמפרטורת החדר (RT) ללא בלם.
הערה: יש למרוח את הדם בזהירות על גבי מדיום שיפוע הצפיפות כדי למנוע ערבוב. ערבוב עלול לגרום לאובדן PBMCs. - יש להשליך בזהירות את השכבה העליונה (המכילה את הפלזמה) בעזרת פיפטת פסטר, לאסוף את השכבה הבין-פאזית שמתחתיה המכילה את ה-PBMCs (מבנה לבן דמוי טבעת), ולהעביר שכבה זו לצינור חדש של 50 מ"ל.
- השהה את התאים עם PBS סטרילי 1x עד 50 מ"ל, ושטוף את מדיום שיפוע הצפיפות השיורית על ידי צנטריפוגה ב 300 x גרם למשך 10 דקות ב- RT עם בלימה מלאה.
- כדי להסיר טסיות דם שיוריות, חזור על התהליך עם סיבוב איטי נוסף ב 200 x גרם במשך 10 דקות ב- RT ללא בלם.
- אופציונלי: כדי להסיר את שאריות תאי הדם האדומים, יש לדלל את מאגר הליזה של תאי הדם האדומים (10x, טבלת חומרים) ביחס 1:10 במים מזוקקים, ולמרוח 3 מ"ל של החיץ המדולל על הכדורית. מערבבים, ודוגרים במשך 3 דקות. שטף את הגלולה בעד 50 מ"ל של 1x PBS, וצנטריפוגה ב 300 x גרם במשך 10 דקות ב- RT עם בלימה מלאה.
- השהה מחדש את ה- PBMCs המבודדים והמטוהרים ב- 20 מ"ל של PBS 1x וספור אותם באמצעות המציטומטר או בשיטות סטנדרטיות אחרות.
הערה: יש להתאים את שיטות דילול התאים וספירת התאים בהתאם בהתבסס על צפיפות התא ומכשיר הספירה שבו נעשה שימוש.
3. העשרת מונוציטים CD14+ ממרכזיות מרכזיות
- בודד מונוציטים CD14+ מהמרכזיות באמצעות ערכת בחירה אנושית CD14+ בהתאם לפרוטוקול היצרן (רשימת חומרים).
הערה: מונוציטים קלאסיים CD14+CD16− הם המקור העיקרי למבשרי OC35; ניתן לשקול שיטות טיהור חלופיות. - מעבירים 1 x 107 PBMCs לתוך צינור פוליסטירן עגול מתאים (כלומר, זה מתאים מגנט ערכת בחירה), ו pellet את התאים ב 300 x גרם במשך 5 דקות.
- יש להשליך את הסופרנטנט, להשהות מחדש את כדורית התא במאגר הפרדת תאים (PBS, סרום בקר עוברי 2% [FBS], 1 mM ethylenediaminetetraacetic acid [EDTA]) לריכוז סופי של 1 x 108 תאים/מ"ל, ולדגור עם קוקטייל נוגדנים 10 μL לכל 100 μL עם המכסה למשך 10 דקות.
הערה: התאים מושעים מחדש בגודל 1 x 108 תאים/מ"ל; כוונן את עוצמת הקול בהתאם. - לאחר הדגירה, יש להוסיף 10 μL של חרוזי ננו-חלקיקים מגנטיים לכל 100 μL, ולדגור במשך 3 דקות עם המכסה על.
הערה: התאם את נפחי קוקטייל הנוגדנים והחרוזים המגנטיים כדי לקבל ריכוז של 10 μL/mL. - ממלאים את הנפח ל-2.5 מ"ל עם מאגר הפרדת התא, מכניסים את הצינור למגנט (ללא המכסה) ודגרים במשך 3 דקות. השליכו את אוכלוסיית התאים השלילית על ידי תנועה רציפה אחת על ידי היפוך כאשר הצינור עדיין במגנט.
הערה: אם אתה משתמש במרכזיות >2 x 108 PBMC ובמגנט גדול יותר, טען עד 5 מ"ל או 10 מ"ל במאגר הפרדת תאים בהתאם להוראות היצרן. - הסר את הצינור מהמגנט, ושטוף את המונוציטים המועשרים CD14+ המחוברים לחרוזים המגנטיים על ידי השעייתם מחדש ב -2.5 מ"ל של מאגר הפרדת התא. דגרו במשך 3 דקות בתוך המגנט כמו קודם, השליכו את החלק השלילי וחזרו על הפעולה פעם נוספת.
- צנטריפוגה את כל התאים שנאספו ב 300 x גרם במשך 5 דקות, להשליך את supernatant, ולהשהות מחדש את התאים ב 5 מ"ל של תווך אלפא מינימלי חיוני (α-MEM; טבלת חומרים) בתוספת 1% L-גלוטמין, 1% פניצילין/סטרפטומיצין (α-MEM מלא) ו-10% FBS.
הערה: מומלץ לבצע בדיקת טוהר לאחר העשרה באמצעות ציטומטריית זרימה, ולצפות לטוהר של ≥96%. שלבי כביסה נוספים (שלב 3.6) יכולים להגביר את הטוהר.
4. בידול OC במבחנה
- ספור את מונוציטים מועשרים CD14+ באמצעות hemacytometer.
- גלול את התאים ב 300 x גרם במשך 5 דקות, והשהה מחדש ב 1 x 106 תאים / מ"ל ב α-MEM מלא בתוספת 10% FBS.
- כדי להבדיל בין OCs, הוסף M-CSF בריכוז סופי של 25 ng/mL לתרחיף התא.
הערה: עבור 1 מ"ל של תרחיף תאים, הוסף 0.25 μL של M-CSF מריכוז מלאי של 100 מיקרוגרם / מ"ל. - מערבבים על ידי צנרת ביסודיות כדי ליצור הומוגניות של תרחיף התא וצלחת 100 μL/well בצלחת שטוחה בעלת 96 בארות לצפיפות תאים סופית של 1 x 105 תאים/באר.
- הוסף 200 μL / באר של מים מזוקקים סטריליים לתוך הבארות סביב התאים המצופים כדי למנוע אידוי בינוני והשפעות קצה במערכת התרבית.
- לדגור על התאים במשך הלילה, במשך כ 18-20 שעות, ב 37 ° C עם 5% CO2.
- לאחר הדגירה למשך הלילה, יש להסיר בזהירות מחצית מהתווך (50 מיקרוליטר/באר) על ידי שאיפה באמצעות פיפטה P200, להימנע מנגיעה בתחתית הבאר, ולהחליף ב-α-MEM מלא וחם טרי המכיל 10% FBS, 25 ננוגרם/מ"ל M-CSF ו-50 ננוגרם/מ"ל רנקל לקבלת ריכוז סופי של 25 ננוגרם/מ"ל
הערה: עבור 1 מ"ל של בינוני, הוסף 0.25 μL של M-CSF ו- 0.5 μL של RANKL מריכוז מלאי של 100 מיקרוגרם / מ"ל. - שנו את המדיה כל 3 ימים והתמיינו את התאים לOCs במשך 7-14 ימים (איור 1).
הערה: שמור על ריכוזי M-CSF ו- RANKL עקביים בכל התרבית.
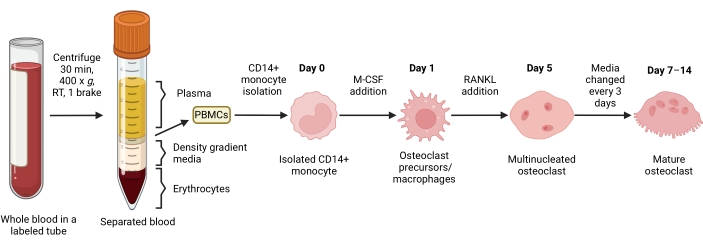
איור 1: זרימת עבודה של בידול המהרה (OC). סקירה סכמטית של בידוד מונוציטים CD14+ מ- PBMCs והתמיינות ל- OCs בוגרים בנוכחות M-CSF ו- RANKL למשך 7-14 ימים. RT = טמפרטורת החדר. התמונה נוצרה באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. צביעת מלכודת לאוסטאוקלסטים
- הסר בזהירות את המדיום, תקן את OCs דבק מובחן עם 100 μL / באר של פתרון קיבוע מוכן מראש, ודגר במשך 1 דקה. אין לגעת בתחתית הבארות כדי למנוע שריטה של התאים הדבקים.
הערה: הפתרון המקבע מוכן כדלקמן: 12.5 מ"ל של תמיסת ציטראט (כלולה בערכת צביעת TRAP), 32.5 מ"ל של אצטון, ו 5 מ"ל של 37% פורמלדהיד. - לשטוף את הבארות שלוש פעמים עם 300 μL של מים מזוקקים סטריליים. יש לייבש את הצלחות לאחר הכביסה.
- הכנת תמיסת צביעה בהתאם להוראות היצרן (טבלת חומרים); הוסף 5 μL של Garnet מהיר ו 5 μL של ניטריט נתרן כדי להפוך את הפתרון Garnet מהיר; מערבבים בהיפוך, ודגרים במשך 3 דקות ב-RT. מכינים 1 מ"ל של תמיסת צביעה על ידי ערבוב 900 מיקרוליטר מים מזוקקים סטריליים, 10 מיקרוליטר נפתול, 40 מיקרוליטר תמיסת אצטט, 50 מיקרוליטר תמיסת טרטרט ו-10 מיקרוליטר תמיסת גרנט מהירה.
- מוסיפים 100 μL/well של תמיסת צביעה טרייה, ודגרים על הצלחת ב-37°C בחושך למשך 20 דקות.
- לאחר הדגירה מסירים את תמיסת הצביעה בהיפוך, ושוטפים את הצלחת שלוש פעמים עם 300 מיקרוליטר/באר מים מזוקקים.
- מוציאים את עודפי המים על ידי הקשה על הצלחות על מגבות נייר. השאירו את הצלחות פתוחות ומוגנות מפני האור לייבוש באוויר למשך הלילה.
הערה: ניתן לאחסן צלחות יבשות עד 6 חודשים. לפעמים, חוצצים שיוריים יכולים לקדם את התפתחות העובש, אשר נראה מתחת למיקרוסקופ; ניתן להסיר זאת בכל עת על ידי שטיפת הבארות המושפעות במים מזוקקים ולתת להם להתייבש שוב באוויר. - צלם תמונות במהירות של 10x או 20x באמצעות מיקרוסקופ brightfield עם אפשרות אריח כדי ללכוד את כל משטח הבאר.
- ספור ידנית את OCs המזוהים כתאים מוכתמים בסגול TRAP+ עם יותר משלושה גרעינים באמצעות תוכנת ניתוח תמונה עם תוסף מונה תאים.
הערה: מספר OCs TRAP+ לכל באר תלוי תורם ועשוי לנוע בין ~ 200-1,600 OCs / באר, עם ממוצע של כ -1,000 OCs / באר. יתר על כן, כדי לנתח את הנתונים, יש לקבוע את מספרי OC בשלוש בארות שונות (שכפולים טכניים), ויש לחשב את הממוצע עבור כל מצב ועבור כל שכפול ביולוגי.
6. בדיקת ספיגת עצם
- צלחת את מונוציטים מועשרים טריים CD14+ על 96 באר osteo-assay צלחות מצופות פוספט סידן ב 1 x 105 תאים / טוב, ולהבדיל את OCs במשך 7-14 ימים, כפי שמצוין בשלבים 4.1-4.8, ולשנות את המדיום כל 3 ימים.
הערה: ניתן להשתמש בפרוסות עצם דנטין/שנהב או בקר בקליפת המוח במקום לוחות בדיקת אוסטאו. אם כן, יש להאריך את הזמן הכולל של התרבית ל 14-21 ימים בשל המצע המורכב יותר שיש לשחזר. - בנקודת הזמן הסופית, בזהירות להסיר את המדיום, הימנעות לגעת בתחתית הבאר, ו lyse את התאים עם 10% תמיסת hypochlorite נתרן. לשטוף את הבארות שלוש פעמים עם מים מזוקקים.
- סרוק את הלוחות היבשים באמצעות מיקרוסקופ שדה בהיר, ונתח/כמת את התמונות שנרכשו של בורות הספיגה באמצעות תוכנת ניתוח תמונה.
7. צביעה פלואורסצנטית של טבעת אקטין
- צלחת 100 μL / באר של מונוציטים CD14+ מבודדים בשקופית תא 18 באר בצפיפות תאים של 1 x 105 תאים / באר. להבדיל בין OCs בנוכחות M-CSF ו- RANKL כמתואר קודם (שלבים 4.1-4.8), כולל החלפת המדיום כל 3 ימים.
- בנקודת הזמן הסופית, להסיר בעדינות את המדיום, ולשטוף כל באר פעמיים עם 200 μL / באר של PBS מחומם מראש, pH 7.4. אל תתנו לבארות להתייבש בין כל השלבים.
- תקן את הדגימה עם 100 μL / well של תמיסת פורמלדהיד 4% ב- PBS, ודגר במשך 10 דקות ב- RT על שייקר אורביטלי עם טלטול עדין.
הערה: מתנול יכול לשבש אקטין במהלך תהליך הקיבוע. לכן, עדיף להימנע מכל קיבוע המכיל מתנול. הקיבוע המועדף הוא פורמלדהיד ללא מתנול. השייקר האורביטלי ששימש בשלב זה של הפרוטוקול נקבע בהספק של 3 מתוך 10. - יש לשטוף פעמיים עם 200 μL/well של PBS, לחדור את התאים עם 100 μL/well של 0.1% תמיסת Triton X-100 מדוללת ב-PBS, ולדגור במשך 10 דקות ב-RT על שייקר אורביטלי עם טלטול עדין.
- יש לשטוף פעמיים עם 200 מיקרוליטר/באר של PBS. כדי לחסום קשירה לא ספציפית ולהגדיל את האות, הוסף 100 μL / באר של תמיסת חסימה המיוצרת עם 2% אלבומין בסרום בקר (BSA)/PBS תמיסה. יש לדגור במשך 20 דקות ב-RT על שייקר אורביטלי עם רעידות עדינות.
- הסר את תמיסת החסימה, והוסף 100 μL / באר של תמיסת פלואידין מצומדת פלואורסצנטית מדוללת בתמיסת 2% BSA/PBS. יש לדגור במשך 20 דקות ב-RT על שייקר מסלולי, עם טלטול עדין ומוגן מפני אור.
הערה: התאימו את ריכוז צבע הפלואידין בהתאם להמלצות היצרן. - יש לשטוף פעמיים עם 200 μL/well של PBS, לצבוע את הגרעינים ב-100 μL/well של תמיסה של PBS המכילה 300 nM DAPI, ולדגור במשך 10-15 דקות ב-RT על שייקר אורביטלי עם טלטול עדין ומוגן מפני אור.
הערה: DAPI מדולל במים מזוקקים כדי לייצר תמיסת מלאי DAPI של 14.3 מ"מ (5 מ"ג/מ"ל). פתרון המלאי מדולל עוד יותר לריכוז הסופי של 300 מיקרומטר. לבסוף, תמיסת DAPI של 300 מיקרומטר מדוללת פעם נוספת ב- PBS לריכוז סופי של 300 ננומטר. - לאחר 10-15 דקות, הסר את תמיסת DAPI והחלף אותה ב- PBS של 100 מיקרוליטר / באר.
הערה: בהתאם לשקופיות התא שנבחרו, יש לאחסן בנפח מתאים של PBS (100 μL/well עבור שקופיות קאמריות של 18 בארות), או להרכיב את השקופית עם כיסויים ואמצעי הרכבה מתאים. ניתן לאחסן את המגלשות הקאמריות עד שבוע במקרר. עבור שקופיות תא 18 בארות, השתמש בנפח צביעה של 50-100 μL ו- 200-300 μL לכביסה. התרחב בהתאם לגדלי השקופיות הקאמריות האחרות. כדי למנוע אידוי, יש לשמור את הכיסויים בתוך מיכל מכוסה במהלך זמני הדגירה. השימוש בשייקר אורביטלי מומלץ אך לא חיוני. - דמיינו את הצביעה באמצעות מיקרוסקופים אימונופלואורסצנטיים או קונפוקליים מתאימים והגדלות בין 4x ל-40x.
8. העשרת OCs בוגרים ומבשרי OC באמצעות מיון ציטומטריית זרימה
- השהה מחדש את המונוציטים המועשרים החדשים של CD14+ ב- 1 x 106 תאים / מ"ל, והמיין אותם ל- OCs בוגרים בנוכחות M-CSF ו- RANKL באותו אופן שתואר לעיל (שלבים 4.1-4.8).
הערה: בעת שינוי קנה מידה מצלחת של 96 בארות לגודל צלחת גדול יותר, עקוב אחר טבלה 1; נפחים אלה מחושבים החל מתמיסת 1 x 106 תאים/מ"ל ומספקים צפיפות אופטימלית לאיחוי תאים. - ביום 7, לשטוף את הבארות פעם אחת עם PBS חם, ולהוסיף 50 μL ל 1 מ"ל (נפח נקבע על ידי גודל הצלחת בשימוש) של accutase. לדגור על התאים ב 37 ° C עם 5% CO2 במשך 20 דקות.
- לאחר הדגירה, בדקו את הלוחות תחת מיקרוסקופ אור כדי לראות אם התאים התנתקו. יתר על כן, נתק את התאים על ידי הקשה על הצלחות מכל הצדדים ו pipeting אותם למעלה ולמטה.
- לאסוף את השעיית התא בצינור חרוטי 15 מ"ל. שטפו את הבארות עם PBS חם (לא Ca2+, לא Mg2+), ושלבו אותם עם השעיית התא. חזור על שלבים 8.2-8.3 פעם או פעמיים עד שרוב התאים יתנתקו.
הערה: Accutase, השיטה המומלצת לפני צביעת פני השטח לאנליזה ציטומטרית של זרימה, אינה מנתקת OCs גדולים מאוד. שיעור ההחלמה הוא ~ 50%-70%. - צנטריפוגה את התאים ב 300 x גרם במשך 5 דקות, להשעות מחדש את גלולת התא ב 1 מ"ל של PBS, ולספור את התאים על ידי הרחקת כחול טריפאן.
- להשהות מחדש את התאים ב 1 x 106 תאים / מ"ל, להסיר 100 μL המתאים 1 x 105 תאים, ולהעביר תאים אלה לתוך מבחנה חדשה פוליפרופילן. הוסף 200 μL של מאגר מיון התא, ושים אותו בצד על קרח כבקרה לא מוכתמת.
- הכתימו את שאר התאים בצבע חי/מת מדולל בשעה 1:750 למשך 10 דקות ב-RT ומוגן מפני אור.
הערה: יש לבצע צביעה חיה/מתה בהיעדר FBS כדי למנוע צביעת רקע גבוהה. - מלא את צינור האיסוף של 15 מ"ל המכיל את תרחיף התאים המוכתמים החי/מת עם חיץ מיון תאים חמים (1x PBS, ללא Ca 2+, ללא Mg2+, 1% FBS ו- 5 mM EDTA), וצנטריפוגה ב- 300 x g למשך 5 דקות כדי לגלול את התאים.
הערה: ריכוז גבוה של EDTA וריכוז נמוך של FBS מומלצים במאגר המיון כדי למנוע גושי תאים. - הסר נפח המתאים 1 x 105 תאים, ולהעביר אותם לתוך מבחנה חדשה פוליפרופילן הבדיקה עבור בקרת איזוטיפ OSCAR. מעבירים את כל התאים הנותרים למבחנה נוספת מפוליפרופילן לצורך צביעה ומיון תאים.
הערה: מבחנות פוליפרופילן משמשות למיון מכיוון שהתאים נוטים פחות להיצמד לצינורות אלה מאשר לצינורות פוליסטירן. - סובבו את הצינורות במהירות של 400 x גרם במשך 5 דקות כדי לגרוף את התאים, והשליכו את עודפי הסופרנאטנט על ידי היפוך.
- השהה מחדש את גלולת התא בתמיסת תערובת אב לנוגדנים שהוכנה לפי טבלה 2. הכתימו את צינור בקרת האיזוטיפ OSCAR עם נוגדן CD14 ובקרת איזוטיפ OSCAR במקום נוגדן OSCAR.
- יש לדגור על התאים בטמפרטורה של 4°C המוגנים מפני האור למשך 30 דקות.
- לאחר 30 דקות, שטוף את התאים על ידי הוספת חמישה נפחים של מאגר מיון התא, וצנטריפוגה ב 400 x גרם במשך 5 דקות ב 4 ° C.
- השהה מחדש את התאים במאגר מיון תאים קרים של 300-1,000 מיקרוליטר, ורכוש את התאים באמצעות מכונת מיון ציטומטריית זרימה המצוידת בפייה של 100μM.
הערה: OCs הם תאים דביקים מאוד, ולכן חשוב לסנן אותם דרך קרום סטרילי של 70 מיקרומטר לפני המיון. - שער OCs ו pre-OCs כמו CD14−OSCAR+. הגדר את שער OSCAR+ בהתבסס על צינור בקרת האיזוטיפ של OSCAR.
- יש לאסוף את התאים הממוינים במבחנות פוליפרופילן המכילות α-MEM מלא בתוספת FBS של 20% ב-8°C.
- לאחר המיון, גלול את התאים על ידי צנטריפוגה ב 300 x גרם במשך 5 דקות ב RT, לספור את התאים, ולהשהות מחדש עבור יישומים במורד הזרם.
הערה: בדרך כלל, כדי לקבל ~ 1 x 105 pre-OCs / OCs ממוינים, התחל מ ~ 10 x 106 תאים מצופים ביום 0. שיעור ההחלמה הנמוך מושפע מאיבוד תאים במהלך הניתוק עם אקוטאז ומהעיבוד לצביעה ומיון. מומלץ לבצע את כל ההליך באמצעות מאגרים סטריליים וריאגנטים, ולעבוד בתנאים סטריליים.
9. בדיקת ATP לפעילות מיטוכונדריאלית
- לדגור על מונוציטים מועשרים CD14+ בנוכחות M-CSF ו- RANKL בלוח 96 בארות באותו אופן שתואר קודם לכן (שלבים 4.1-4.8). לוחית ארבעה תנאים נוספים בטריפליקטים לשימוש כפקדים.
- בצע את בדיקת ה- ATP עם ערכת בדיקת זיהוי ATP זוהרת בהתאם למדריך היצרן. בקצרה, כדי להכין את תמיסת ה- ATP, הוסף 10 מ"ל מתמיסת חיץ המצע למצע הליופילי, והשאר אותו לדגור ב- RT למשך 30 דקות.
הערה: ניתן להשתמש בשיטות שונות כדי למדוד את ייצור ה-ATP התוך-תאי. כאן, השתמשנו בזיהוי של ייצור ATP על ידי luminescence. - במהלך הדגירה, הכן והוסף את הפקדים ישירות לבארות הבקרה כדלקמן: 2-Deoxy-D-גלוקוז (2DG) ב- 10 mM ו- 100 mM, אוליגומיצין ב- 1 μM, ו- 100 mM 2DG בשילוב עם אוליגומיצין 1 מיקרומטר. יש לדגור במשך 30 דקות ב-37°C עם 5% CO2.
הערה: 2DG חוסם גליקוליזה, בעוד אוליגומיצין הוא מעכב של זרחן חמצוני. שילוב שני מעכבים אלה גורם לאובדן מוחלט של ייצור ATP באמצעות גליקוליזה וזרחן חמצוני, כלומר הם משמשים כבקרה פנימית עבור בדיקת ATP. עבור פקדי 2DG של 10 mM ו- 100 mM, הוסף 0.5 μL ו- 5 μL של תמיסת מלאי 2DG של 2M לכל תרבית של 100 μL, בהתאמה. עבור אוליגומיצין של 1 מיקרומטר, דלל את תמיסת המלאי של 5 מיקרומטר ביחס של 1:100 בתווך, והוסף 2 מיקרוליטר/באר לבארות הבקרה הייעודיות. עבור הבקרה האחרונה, להוסיף 5 μL של 2DG ו 2 μL של תמיסת אוליגומיצין מדולל לכל באר. - הוסף 50 μL של תמיסת ATP לכל באר כדי לעצור את התגובה, ודגר ב- RT על שייקר ב 700 סל"ד במשך 5-10 דקות מוגן מפני אור.
- העבירו 100 μL של הסופרנאטנט ללוח לבן בעל 96 בארות ספציפיות לבדיקת ATP, וקראו את הצלחת באמצעות קורא זוהר.
תוצאות
יצירת המהרה ממונוציטים CD14+
שיטה זו נועדה להבדיל בקלות בין מספר רב של OCs לבין מונוציטים CD14+ בדם היקפי אנושי במבחנה, בדרך כלל בשבוע אחד. ראשית, מונוציטים CD14+ הועשרו מ-PBMCs והוכשרו עם M-CSF בן לילה כדי להעלות את רמת ה-RANK, כפי שדווח בעבר15. לאחר פריימינג מונוציטים, כדי לקבוע את הריכוז האופטימלי של RANKL עבור התמיינות OC והבשלה, נעשה שימוש בריכוזי RANKL של 1 ng/mL, 25 ng/mL, 50 ng/mL ו-100 ng/mL, יחד עם 25ng/mL M-CSF. התוספת של RANKL יצרה מספר גדל והולך של OCs מרובי גרעינים חיוביים גדולים ל-TRAP באופן תלוי מינון, וזה הוערך באמצעות צביעת TRAP. OCs בוגרים מוגדרים כתאים חיוביים למלכודת עם גרעינים מרובים (בדרך כלל יותר משלושה; איור 2A,B ואיור משלים 1). יתר על כן, הקינטיקה של התמיינות OC ממונוציטים נחקרה באמצעות צביעת TRAP ומיקרוסקופ אור במשך תקופת תרבית של 2-14 ימים. במקרה זה, התמיינות OC באמצעות ריכוז ביניים של 50 ng/mL RANKL נבחרה כדי להעריך באיזו מהירות OCs התמידו בתרבית. בתנאי התרבית האלה, OCs מרובי גרעינים נראו מהיום ה-5 ואילך, וההתמיינות האופטימלית הושגה ביום ה-7 (איור 2C). הדגירה הממושכת של תרביות מעבר ל-10 ימים על פלסטיק הביאה לאיחוי תאים ענקיים באופן חריג. בפרוטוקול זה, ימים 6-8 משמשים בדרך כלל כנקודת הקצה האופטימלית של יצירת OC. ניתן לכמת את הOCs או להשתמש בהם לבדיקות במורד הזרם.
הערכה תפקודית של OCs מובחנים
כדי לקבוע את הפעילות התפקודית של OCs שנוצרו, בחנו את פעילות הספיגה שלהם על ידי הבחנה בין OCs על משטח מינרלי. מכיוון שOCs גדולים נוצרים רק לאחר תקופת תרבית של 7 ימים, וכדי לאפשר מספיק זמן לספוג מחדש את מצע המינרלים, התרביות נשמרו עד היום ה-10. היווצרות חורים עגולים, או בורות ספיגה, נצפתה רק על משטחים מינרליים של בארות המכילות תאים שטופלו גם ב-M-CSF וגם ב-RANKL (איור 3). לפיכך, אחוז משטח מינרלי מומס (בורות ספיגה) מאפשר לקבוע את יכולת ספיגת OC. נוסף על כך, ה-OCs שהתבדלו בעקבות פרוטוקול זה עד ליום ה-7, הן בשקופיות פלסטיק והן בשקופיות של תאי זכוכית, הציגו מבנה טבעתי אקטין מאורגן היטב שניתן היה להמחיש באמצעות צביעה אימונופלואורסצנטית (איור משלים 2).
השפעת מעכב על תפקוד OC בוגר
תנאי ההתרבות שהוזכרו לעיל נוצלו כדי לקבוע את היכולת התפקודית של OCs שנוצרו במבחנה בנוכחות מעכב OC ידוע, רוטנון34. OCs היו מובחנים במשך 6-8 ימים, CD14-OSCAR+ OCs ומבשרי OC הועשרו באמצעות ציטומטריית זרימה (איור 4). התאים המועשרים צופו ב-50,000 תאים/לבאר על צלחת מצופה מינרלים בת 96 בארות בתווך פרו-אוסטאוקלסטוגני (25 ננוגרם/מ"ל, M-CSF ורנקל) למשך 3 ימים. טיפול ברוטנון (איור 5A,B) עיכב באופן תלוי מינון את ספיגת המשטח המינרלי בהשוואה לבאר הבקרה שלא טופלה, בהתאם למחקרים קודמים34. בנוסף, פונקציונליות OC הוערכה באמצעות ייצור ATP ויצירת טבעות אקטין (actin ring). עיכוב תלוי רוטנון של ספיגת OC היה קשור לעיכוב ייצור ATP (איור 5C). OCs סופגים מחדש הם תאים מקוטבים מאוד המווסתים את יכולת הספיגה שלהם על ידי קידום ארגון השלד הציטו-שלד. פלואידין מצומד Alexa fluor 647 שימש לסימון שלד ציטוקלטון F-actin של OCs בוגרים שגודלו בתרבית בנוכחות או היעדר רוטנון. רוטנון גרם לפיצול טבעת האקטין שמקורה ב-RANKL של OCs בוגרים (איור 5D).
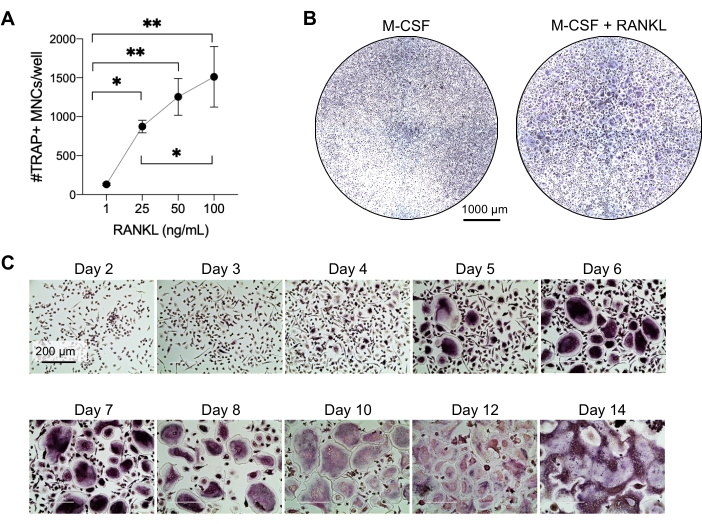
איור 2: OCs מבדילים ביעילות ממבשרי מונוציטים CD14+ . מונוציטים CD14+ הועשרו מגנטית, צופו ב 1 x 105 תאים / באר בלוחות 96 בארות, והודגרו בן לילה עם 25 ng / ml m-CSF. (A) מונוציטים מוקפצים M-CSF עוררו בריכוזים הולכים וגדלים של RANKL (1 ננוגרם/מ"ל, 25 נ"ג/מ"ל, 50 נ"ג/מ"ל ו-100 נ"ג/מ"ל), תוקנו ונצבעו ל-TRAP ביום השביעי. התמונות נרכשו, והתאים מרובי הגרעינים (MNCs) של TRAP+ נספרו. תמונות מייצגות של צביעת TRAP מוצגות באיור משלים 1. קווי השגיאה מציגים ממוצע ± SD (n = 3). הנתונים נותחו באמצעות מבחן השוואות מרובות חד-כיווני של ANOVA והולם-סידאק עבור נתונים זוגיים; * P ≤ 0.05 ו- ** P ≤ 0.005. (B) תמונה מייצגת של באר מוכתמת ב-TRAP של לוח בעל 96 בארות המראה את הכמות האופיינית של OCs/באר צפויה ואת המורפולוגיה שלהם מתחת ל-25 ng/mL RANK-L בהשוואה למקרופאגים שמקורם ב-M-CSF ביום 7. פסי קנה מידה: 1000 מיקרומטר. (C) תמונות מייצגות של היווצרות OC מתחת ל-50 ננוגרם/מ"ל RANKL שהוערכו באמצעות צביעת TRAP מהיום השני עד היום ה-14. OCs נראים מהיום החמישי ואילך. OCs ענקיים שהתמזגו באופן חריג נמצאים לאחר 10 ימים. פסי קנה מידה: 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
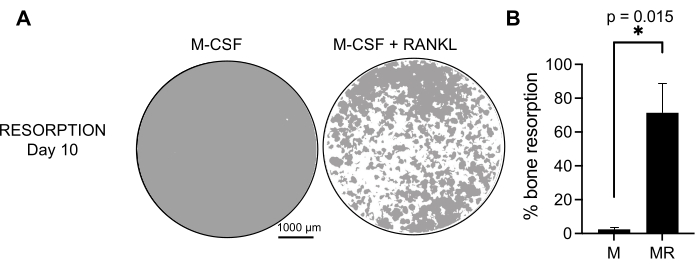
איור 3: OCs סופגים נבדלים ממונוציטים CD14+ . תאי CD14+ שבודדו מ-PBMCs התמינו במשך 10 ימים ל-OCs בנוכחות 25 ננוגרם/מ"ל, M-CSF (M) ו-RANKL (R) על פני השטח של בדיקת מינרלים (אוסטאו-אסאי). (A) תמונות של בארות ייצוגיות משוחזרות שצולמו בהגדלה של פי 10 כדי לנתח את הספיגה ביום ה-10 (מצע מינרלי באפור; בורות ספיגה בלבן). פסי קנה מידה: 1000 מיקרומטר. (B) כימות אחוז השטח שנספג. נתוני הספיגה נותחו באמצעות ניתוח זוגי של Wilcoxon. קווי השגיאה מציגים ממוצע ± SD (n = 7). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
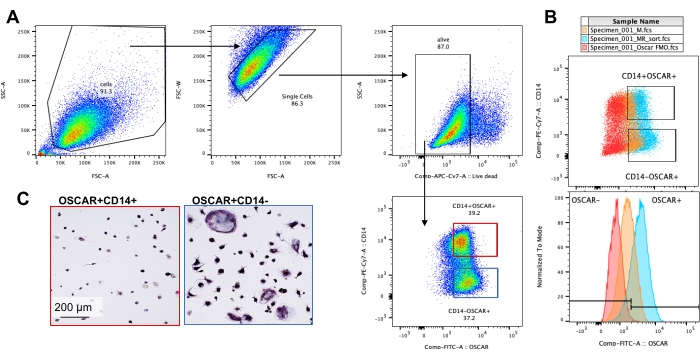
איור 4: העשרת ציטומטריה של זרימה של OCs CD14-OSCAR+. מונוציטים CD14+ הועשרו מ-PBMCs, וה-OCs נבדלו כפי שתואר קודם לכן. תרביות OC דבקות נותקו עם אקוטאז ונצבעו עבור ציטומטריית זרימה. (א-ג) OCs ביום 8 מוינו על בסיס CD14 וביטוי OSCAR. (א) אסטרטגיית מיון מייצגת. התאים גודרו כסינגלטים, שליליים לכתמים מתים, ותת-הקבוצות CD14+ OSCAR+ (אדום) ו-CD14-OSCAR+ (כחול) מוינו. (B) תרשימים מייצגים המראים את צביעת OSCAR החופפת של OCs הנגזרים מ-RANKL (ציאן) ומקרופאגים שמקורם ב-M-CSF (כתום). באדום נמצאת הבקרה המוכתמת באיזוטיפ OSCAR של OCs הנגזרים מ-RANKL. (C) האוכלוסיות הממוינות צופו על פלסטיק והורשו להיצמד במשך שעתיים בתווך פרו-OC (25 ננוגרם/מ"ל M-CSF ו-50 ננוגרם/מ"ל RANKL), ולאחר מכן צביעה והדמיה של TRAP. התמונות המייצגות מראות מחסור בתאי TRAP+ בתת-הקבוצה CD14+ (אדום) ובתת-קבוצה מונו-וגרעינית של TRAP+ קדם-OCs ו-OCs בתת-הקבוצה CD14− (כחול). פסי קנה מידה: 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
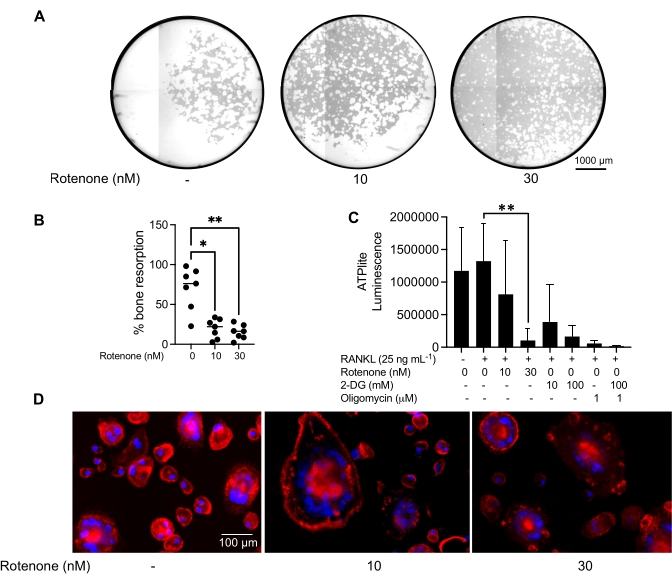
איור 5: בדיקות להערכת תפקודם של OCs בוגרים. כדי להעריך את תפקודם של OCs בוגרים, תאי CD14+ שבודדו מ- PBMCs גודלו בתרבית עם M-CSF (M) בלבד או בשילוב עם RANKL (R) במשך 7 ימים, OCs הועשרו באמצעות ציטומטריית זרימה, ולאחר מכן OCs טופלו עם רוטנון מעכב במשך 24 שעות. (A) OCs בוגרים מוינו באמצעות ציטומטריית זרימה (CD14−OSCAR+) וגודלו בתרבית על משטח בדיקת מינרלים בנוכחות או היעדר רוטנון במשך 3 ימים, ולאחר מכן התאים הולבנו וצולמו במהירות של פי 10 כדי לחשוף את האזור שנספג מחדש (בורות ספיגה בלבן). (A) תמונות משוחזרות מייצגות של בארות. פסי קנה מידה: 1000 מיקרומטר. (B) כימות אחוז השטח שנספג. הנתונים ב-(B) נותחו באמצעות ANOVA חד-כיווני עם מבחן ההשוואות המרובות של דאן (n = 7); * P ≤ 0.05 ו** P ≤ 0.01. פסי השגיאה מציגים את הממוצע ± SD. (C) תכולת ATP תוך-תאית כוללת של OCs בוגרים לא מובחנים ויום 7 מובחנים עם RANKL ומטופלים ברכב או ברוטנון (10 ננומטר ו-30 ננומטר). כאן, 2DG ואוליגומיצין שימשו כבקרות חיוביות לבדיקה ונוספו 30 דקות לפני ליזה התאית וכימות ATP. קווי השגיאה מציגים את הממוצע ± SD (n = 4). הנתונים נותחו באמצעות ANOVA חד-כיווני ומבחן השוואה מרובה של Dunnett עבור נתונים זוגיים. ** P ≤ 0.01. (D) תמונה מייצגת של 20x OCs בוגרים מוכתמת להיווצרות טבעת אקטין (אדום) וגרעינים (כחול), המראה את אובדן טבעת האקטין עם המעכב. פסי קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| פורמט צלחת | 96 צלחת באר | 48 צלחת באר | 24 צלחת באר | 12 צלחת באר | 6 צלחת באר |
| נפח | 100 מיקרוליטר | 225–250 מיקרוליטר | 450–500 מיקרוליטר | 0.8–1 מ"ל | 1.8–2 מ"ל |
טבלה 1: נפח מתלה התא עבור תבניות לוחות שונות. אמצעי האחסון מחושבים החל מתמיסת 1 x 106 תאים/מ"ל ומספקים צפיפות אופטימלית לאיחוי תאים.
| פלואורופור, שיבוט | נפח (μL) לכל 106 תאים | |
| CD14 | PE/ציאנין7, הידרוכלוריד14 | 5 מיקרוליטר |
| אוסקר | FITC, REA494 | 10 מיקרוליטר |
| מאגר מיון תאים | 80 מיקרוליטר |
טבלה 2: תמיסת תערובת אב נוגדנים.
איור משלים 1: צביעת TRAP של תגובת מינון RANKL. מונוציטים CD14+ הועשרו מגנטית, צופו ב-1 x 105 תאים/באר בלוחות של 96 בארות, והודגרו בן לילה עם 25 ננוגרם/מ"ל m-csf, כמו באיור 2. תמונות מייצגות של צביעת TRAP מראות מונוציטים מוקצים MCSF עם ריכוזים הולכים וגדלים של RANKL (1 ng/mL, 25 ng/mL, 50 ng/mL ו-100 ng/mL), קבועים ומוכתמים עבור TRAP ביום השביעי. פסי קנה מידה: 400 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: צביעת טבעות משחק ב-OCs מובחנים לחלוטין. (A) הגדלה של OCs פי 10 המובחנת על פלסטיק TC ומוכתמת בפלואידין AF647 (באדום). סרגל קנה מידה: 400 מיקרומטר. (B) הגדלה של OCs פי 40 המובחנת בשקופיות תא זכוכית ומוכתמת בפלואידין AF488 (בצהוב). סרגל קנה מידה: 100 מיקרומטר.הגרעינים מוכתמים ב-DAPI, מוצגים בכחול ב-(A) ובציאן ב-(B). אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 3: ההשפעה של אצוות FBS שונות על יעילות התמיינות OC. OCs נבדלו מונוציטים CD14+ בנוכחות 25 ng / mL M-CSF ו 50 ng / mL RANKL (MR) במשך 7 ימים. בארות הבקרה היו M-CSF בלבד (M). (A) הגדלות מייצגות של 10x (פסי קנה מידה: 400 מיקרומטר) ו-(B) כימות של OCs מוכתמים במלכודת המובחנים מתורם אחד בשתי קבוצות שונות של FBS. קווי השגיאה מציגים את ממוצע ± SD של שלושה עותקים טכניים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
התרבית הקלה והבידוד של מספר גדול של OCs פונקציונליים במבחנה חשובים לקידום ההבנה של ביולוגיה של העצם ומחלות בתיווך OC. באופן קלאסי, OCs נוצרו בתרביות משותפות עם אוסטאובלסטים או תאי סטרומה ותאים המטופויטיים מהטחול או מח העצם38,39. פריצת דרך משמעותית בהבנת אוסטאוקלסטוגנזה הייתה זיהויו של RANKL כמווסת העיקרי של היווצרות, התמיינות והישרדותOC 40. פרוטוקולים מוקדמים של מערכות תרבות תלויות RANKL השתמשו במרכזיות עבור דור OC21,41,42. עם זאת, תרבויות מעורבות אלה הן ארוכות ומציגות גורמים מבלבלים רבים המגבילים את היכולת לבחון את ההשפעות הישירות על התמיינות OC ותפקודו. פרוטוקול זה מתאר מודל יעיל ואמין במבחנה של אוסטאוקלסטוגנזה ממונוציטים היקפיים אנושיים CD14+ שבו ניתן להשיג אוסטאוקלסטוגנזה אופטימלית תוך 7 ימים (איור 1 ואיור 2), שהוא מהיר משמעותית בהשוואה לפרוטוקולים אחרים43,44,45,46. המאפיינים העיקריים של פרוטוקול זה הם (1) השימוש במונוציטים מטוהרים CD14+, (2) הקדמת המונוציטים עם M-CSF לפני החשיפה ל- RANKL, (3) אורך התרבית (<7 ימים), ו- (4) זיהוי אמין של עיכוב היווצרות OC (צביעת TRAP) ותפקוד (ספיגה מחדש, ייצור ATP, ארגון מחדש של טבעת אקטין עם מעכבים.
במהלך אופטימיזציה של המתודולוגיה זוהו מספר נקודות קריטיות. נצפה כי התמיינות במבחנה של OCs תלויה במידה רבה בצפיפות הזריעה של מונוציטים CD14+. לכן, בפרוטוקול זה, התאים נזרעים בצפיפות גבוהה (1 x 105 תאים / באר של צלחת 96 באר, ב 100 μL של תווך), כפי שהוא חיוני עבור התאים להיות מסוגלים לתקשר אחד עם השני ולהיות בקרבת נתיך ולהיות OCs בוגרים. באופן דומה, זריעה של תאים בצפיפות גבוהה מדי מגבילה את התמוותם וצמיחתם בשל מגבלות בינוניות ומחסור במקום הנדרש. יתר על כן, כדי להשיג הצלחה מרבית עם פרוטוקול זה, חשוב לבצע את הפרדת שיפוע הצפיפות בזהירות ולהבטיח כי האוכלוסייה המועשרת של תאי CD14+ היא טהורה ככל האפשר. לדוגמה, שלבי שטיפה לא מספקים גורמים לחוסר הסרה של טסיות, מה שכתוצאה מכך מעכב התמיינות OC47,48. באופן דומה, נוכחות של זיהום תאי T מינורי בתכשירי CD14+ מבודדים המעוררים עם M-CSF בלבד יכולה לגרום להתמיינות OC, אולי באמצעות הפרשת RANKL על ידי תאי T49. לכן, חשוב לכלול בקרת M-CSF לכל ניסוי. בדיקת טוהר שגרתית, במיוחד בעת שימוש בערכת בידוד חדשה, מומלצת גם היא כדי לוודא את טוהר הדגימה.
מספרי OC אופטימליים (טווח: ~200-1,600 OCs / באר) מושגים באמצעות מדיום α-MEM מועשר בנוקלאוזידים ו- L-גלוטמין. אמצעי תרבות קונבנציונליים אחרים, כולל מדיום הנשר המעובד של דולבקו (DMEM) ומדיום הזיכרון של רוזוול פארק (RPMI) 1640, משפיעים על תפוקת OC. המקור של FBS יכול גם להשפיע על osteoclastogenesis. אצוות שונות של FBS יכולות להוביל לירידה באוסטאוקלסטוגנזה שמקורה ב-RANK-L, כמו גם להופעה של מספר נמוך של תאים מרובי גרעינים מסוג TRAP+ בפקדי M-CSF (איור משלים 3). לכן, כדי להשיג תוצאות עקביות, מומלץ לבדוק אצוות FBS חדשות לפני השימוש ולהמשיך עם אותה אצווה לאורך כל הניסויים כדי למזער שינויים בתהליך ההתמיינות. בנוסף, השונות בין תורם לתורם, במונחים של המספר הכולל של OCs מובחנים המתקבלים בנקודת זמן הסיום, מהווה מגבלה בעת שימוש בפרוטוקול זה כדי להשוות, למשל, תורמים בריאים לחולים. במקרים אלה, זה הכרחי להשתמש בדיוק באותם תנאים ואת אותו הרבה של בינוני, FBS, ריאגנטים אחרים.
צעד הכרחי נוסף להתמיינות והבשלה אופטימלית של OC הוא הכנת המונוציטים עם M-CSF לפני הוספת RANKL. חשיפת התאים ל-M-CSF 18-24 שעות לפני RANKL גורמת למונוציטים לווסת את ביטוי RANK15,26. התוספת של RANKL בנקודת זמן זו מבטיחה התמיינות אופטימלית של OC באופן תלוי מינון. מידת התמיינות OC משתנה מתורם לתורם; עם זאת, 25 ננוגרם/מ"ל רנקל בדרך כלל מספיקים כדי להבדיל בין מספר גבוה של OCs ברוב התורמים. בנוסף, ניתן להשתמש ב- 25 ng/mL RANKL בבדיקות לסינון ראשוני של תרכובות, מכיוון שהוא מאפשר הערכה של ההשפעות המשפרות והמעכבות של תרכובות הבדיקה. מערכות תרבית אחרות השתמשו בזמני M-CSF ארוכים יותר לפני הדגירה לפני הוספת RANKL, אך התוצאה היא זמן גידול ארוך יותר עבור אוסטאוקלסטוגנזה50. בנוסף, השארת מונוציטים דרוכים לדגור לילה מאפשר להם להתחבר לצלחת, אם כי לא במצב דבק לחלוטין. לכן, כאשר RANKL הוא הציג בפעם הראשונה, המדיום חייב להיות חצי שונה בזהירות רבה ולא שונה לחלוטין כדי למנוע ניתוק ואובדן של מונוציטים דרוך. המדיום גם צריך להיות רענן כל 3-4 ימים כדי למנוע דלדול בינוני ולמנוע מוות תאי. יתר על כן, בשל הנפח הנמוך המשמש בבדיקה זו (100 μL / באר בצלחת 96 בארות), יש חשיבות עליונה למסגרת של בארות ריקות המלאות בתמיסה מימית (כלומר, H2O או PBS מזוקק סטרילי) סביב בארות הבדיקה. זה מונע אידוי בינוני ואפקטים בקצוות.
לבסוף, עבור בדיקות מטבוליות (למשל, מבחני ATP), הכרחי שהתאים יהיו בני קיימא כדי להימנע מסטיית תקן עצומה בין עותקים משוכפלים (איור 5). כדאיות גבוהה של התאים חשובה גם למיון התאים ולהמשך ההתרבות של OCs ממוינים (איור 4). עם זאת, לשיטה זו מספר מגבלות. OCs בוגרים לחלוטין הם מאוד דבקים וקשה לנתק מן הצלחות. לעתים קרובות לא ניתן לנתק את הOCs הגדולים יותר, מה שעלול להוביל לתפוקת תאים נמוכה יותר. לכן, יש לספור את התאים לאחר מיון ולפני ציפוי בריכוז הנדרש. יתר על כן, בפרוטוקול הנוכחי, שיטה לא אנזימטית (accutase) לניתוק OCs משמשת למניעת שינויים בממברנות בצביעת פני השטח במורד הזרם עבור ציטומטריית זרימה. השימוש במגרדי תאים (שניהם בעלי קצוות רכים או קשים) נבדק גם הוא והוביל למוות תאי גבוה. ניתן להשתמש בניתוק אנזימטי באמצעות תמיסות טריפסין/EDTA של 0.05% לקבלת תפוקה גבוהה יותר של OCs מנותקים כאשר שלמות הממברנה אינה נדרשת עבור יישומים במורד הזרם. בנוסף, כדי למנוע מהOCs להתגבש יחד, מומלץ מאוד להשתמש בריכוז גבוה של EDTA בכל המאגרים לאחר ניתוק התא, כמו גם סינון מתאים לפני רכישת ציטומטריית זרימה. חשוב לציין כי תרביות OC הן אוכלוסייה הטרוגנית של תאים המורכבת מOCs בוגרים, מבשרי OC ומקרופאגים. ניתן להבחין בקלות בין מקרופאגים לבין OCs, אף על פי שגם קדם-OCs חד-גרעיניים וגם OCs רב-גרעיניים מבטאים OSCAR ולא ניתן להבחין ביניהם בשיטה הנוכחית (איור 4). אכן, סוגיה אחרונה זו מהווה את המגבלה העיקרית של שיטה זו. נוסף על כך, ביטוי נמוך של OSCAR קיים גם בתרביות M-CSF (איור 4B), והוא עשוי להצביע על מקרופאגים שמוכנים למחויבות לשושלת OC. חשוב להגדיר את השער לתאי OSCAR+ בהתבסס על אות הצביעה של FMO, כפי שמוצג באיור 4B.
לסיכום, פרוטוקול זה מתאר שיטה אופטימלית וחזקה לייצור יעיל של OCs פעילים ובשלים מבחינה תפקודית ממונוציטים אנושיים ראשוניים במחזור. חוזקו של פרוטוקול זה הוא ביכולתו לייצר OCs בפרק זמן קצר ולהניב מספר גבוה של OCs מובחנים. שיטה זו פותחת את הדרך לחקר המנגנונים הבסיסיים העומדים בבסיס התמיינות OC ותפקודו.
Disclosures
המחברים מצהירים כי אין להם אינטרסים מתחרים.
Acknowledgements
המחברים מודים בהכרת תודה למתקן Flow Core ולמתקן ההדמיה של גלזגו (GIF) בתוך בית הספר לזיהום וחסינות על תמיכתם ועזרתם בעבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 well chamber slides | ibidi | 81816 | |
| 8-well glass chamber slides | Ibidi | 80807 | |
| 96-well TC plate | Corning | 3596 | |
| 96-well osteo assay stripwell plate | Corning | 3989 | |
| Acetate solution | Sigma Aldrich | 386-3 | from kit Cat No. 387A-1KT |
| Acetone | VWR | 20066.330 | |
| Acid phosphatase, Leukocyte (TRAP) kit | SIGMA-ALDRICH | 387A-1KT | |
| Alexa Fluor 488 Phalloidin | Theremo Fisher - Invitrogen | A12379 | AF488 |
| Alexa Fluor 647 Phalloidin | Thermo Fisher - Invitrogen | A22287 | AF647 |
| Alfa Aesar 2-Deoxy-D-glucose | Fisher Scientific | 11321867 | 2DG, 98% |
| Alpha minimum essential medium | gibco | 22571-020 | |
| ATPlite 1step | PerkinElmer | 6016731 | Luminiscence ATP detection assay system |
| BD FACSAria III cell sorter | BD Biosciences | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418-100G | |
| Cell culture microplate, 96-well, PS, F-bottom | Greiner bio-one | 655083 | White-bottom plates |
| Citrate solution | Sigma Aldrich | 91-5 | from kit Cat No. 387A-1KT |
| Corning 6ml round-bottom polystyrene test tubes | Fisher Scientific | 352054 | |
| Corning osteo assay surface multiple well plate | Sigma-Aldrich | CLS3989 | |
| Corning osteo assay Surface multiple well plate 1 x 8 stripwell | Corning | CLS3989-2EA | |
| DAPI | Theremo Fisher | D3571 | |
| EasySep human CD14 positive selection kit | STEMCELL Technologies | 17858 | |
| EasySep red blood cell lysis buffer (10x) | StemCell Technologies | 20110 | |
| eBioscience fixable viability dye eFluor 780 | Theremo Fisher - Invitrogen | 65-0865-14 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E7889-100ML | |
| EVOS FL auto imaging system | Thermo Fisher | A32678 | |
| Falcon round-bottom polypropylene test tubes with cap | Fisher Scientific | 10314791 | |
| Falcon tubes 15 mL | Corning | 430790 | |
| Falcon tubes 50 mL | Corning | 430828 | |
| Fast Garnet GBC base solution | Sigma Aldrich | 387-2 | from kit Cat No. 387A-1KT |
| Fetal bovine serum | gibco | 10500-064 | FBS |
| Ficoll-Paque Plus | cytiva | 17144003 | |
| Formaldehyde | Sigma-Aldrich | F-8775 | |
| Human sRANK ligand | PEPROTECH | 310-01-100UG | Receptor activator of nuclear factor kappa-B ligand (RANKL) |
| ImageJ Image analysis software | Image J | version 2.9.0 | |
| L-glutamine | gibco | 25030-024 | |
| Lithium heparin tubes (9 mL) | VACUETTE | 455084 | |
| Macrophage colony-stimulating factor | PEPROTECH | 300-25-100UG | M-CSF |
| Napthol AS-BI phosphoric acid solution | Sigma Aldrich | 387-1 | from kit Cat No. 387A-1KT |
| Neubauer hemacytometer counting chamber | Camlab | SKU 1127885 | |
| Oligomycin from Streptomyces Diastatochromogenes | Sigma-Aldrich | Q4876-5MG | |
| OSCAR Antibody, anti-human, Vio Bright FITC, REAfinit | Miltenyi Biotec | 130-107-661 and 130-107-617 | Clone REA494 |
| PE/Cyanine7 anti-human CD14 antibody | Biolegend | 325618 | Clone HCD14 |
| Penicilin/streptomycin | SIGMA | P0781 | |
| PHERAstar machine and software | BMG LABTECH | ||
| Phosphate-buffered saline (DPBS, 1x) | gibco | 14190-094 | |
| REA control antibody (S), human IgG1, Vio Bright FITC, REAfinity | Miltenyi Biotec | 130-113-443 | |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044-1L | |
| Sodium nitrite solution | Sigma Aldrich | 91-4 | from kit Cat No. 387A-1KT |
| Tartrate solution | Sigma Aldrich | 387-3 | from kit Cat No. 387A-1KT |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Trypan blue | Sigma-Aldrich | T8154-100ML |
References
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Boyce, B. F., Xing, L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives Of Biochemistry and Biophysics. 473 (2), 139-146 (2008).
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Agemura, T., Hasegawa, T., Yari, S., Kikuta, J., Ishii, M. Arthritis-associated osteoclastogenic macrophages (AtoMs) participate in pathological bone erosion in rheumatoid arthritis. Immunological Medicine. 45 (1), 22-26 (2022).
- Hasegawa, T., et al. Identification of a novel arthritis-associated osteoclast precursor macrophage regulated by FoxM1. Nature Immunology. 20 (12), 1631-1643 (2019).
- Walsh, N. C., Crotti, T. N., Goldring, S. R., Gravallese, E. M. Rheumatic diseases: The effects of inflammation on bone. Immunological Reviews. 208 (1), 228-251 (2005).
- Gravallese, E. M., et al. Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis. The American Journal of Pathology. 152 (4), 943-951 (1998).
- Bromley, M., Woolley, D. E. Chondroclasts and osteoclasts at subchondral sites of erosion in the rheumatoid joint. Arthritis & Rheumatism. 27 (9), 968-975 (1984).
- Kleyer, A., Schett, G. Arthritis and bone loss: A hen and egg story. Current Opinion in Rheumatology. 26 (1), 80-84 (2014).
- Kawai, V. K., Stein, C. M., Perrien, D. S., Griffin, M. R. Effects of anti-tumor necrosis factor α (anti-TNF) agents on bone. Current Opinion in Rheumatology. 24 (5), 576-585 (2012).
- Siebert, S., Tsoukas, A., Robertson, J., McInnes, I. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases. Pharmacological Reviews. 67 (2), 280-309 (2015).
- Smiljanovic, B., et al. Monocyte alterations in rheumatoid arthritis are dominated by preterm release from bone marrow and prominent triggering in the joint. Annals of the Rheumatic Diseases. 77 (2), 300-308 (2018).
- Anderson, J. R., et al. 1H NMR metabolomics identifies underlying inflammatory pathology in osteoarthritis and rheumatoid arthritis synovial joints. Journal of Proteome Research. 17 (11), 3780-3790 (2018).
- McGarry, T., et al. Rheumatoid arthritis CD14+ monocytes display metabolic and inflammatory dysfunction, a phenotype that precedes clinical manifestation of disease. Clinical & Translational Immunology. 10 (1), 1237(2021).
- Ansalone, C., et al. TNF is a homoeostatic regulator of distinct epigenetically primed human osteoclast precursors. Annals of the Rheumatic Diseases. 80 (6), 748-757 (2021).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis and Rheumatology. 73 (7), 1145-1154 (2021).
- Allard-Chamard, H., et al. Osteoclasts and their circulating precursors in rheumatoid arthritis: Relationships with disease activity and bone erosions. Bone Reports. 12, 100282(2020).
- Takegahara, N., et al. Involvement of receptor activator of nuclear factor-κB ligand (RANKL)-induced incomplete cytokinesis in the polyploidization of osteoclasts. The Journal of Biological Chemistry. 291 (7), 3439-3454 (2016).
- Jansen, I. D. C., Vermeer, J. A. F., Bloemen, V., Stap, J., Everts, V. Osteoclast fusion and fission. Calcified Tissue International. 90 (6), 515-522 (2012).
- McDonald, M. M., et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 184 (5), 1330-1347 (2021).
- Lacey, D. L., et al. Bench to bedside: Elucidation of the OPG-RANK-RANKL pathway and the development of denosumab. Nature Reviews Drug Discovery. 11 (5), 401-419 (2012).
- Zhao, B., Grimes, S. N., Li, S., Hu, X., Ivashkiv, L. B. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J. The Journal of Experimental Medicine. 209 (2), 319-334 (2012).
- Zhao, B. Does TNF promote or restrain osteoclastogenesis and inflammatory bone resorption. Critical Reviews in Immunology. 38 (4), 253-261 (2018).
- Crotti, T. N., et al. Receptor activator NF-κB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Annals of the Rheumatic Diseases. 61 (12), 1047-1054 (2002).
- Kim, H. R., et al. Reciprocal activation of CD4+ T cells and synovial fibroblasts by stromal cell-derived factor 1 promotes RANKL expression and osteoclastogenesis in rheumatoid arthritis. Arthritis and Rheumatology. 66 (3), 538-548 (2014).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor κB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Hayman, A. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
- Nedeva, I. R., Vitale, M., Elson, A., Hoyland, J. A., Bella, J. Role of OSCAR signaling in osteoclastogenesis and bone disease. Frontiers in Cell and Developmental Biology. 9, 780(2021).
- Boyce, B. F., Yoneda, T., Lowe, C., Soriano, P., Mundy, G. R. Requirement of pp60c-src expression for osteoclasts to form ruffled borders and resorb bone in mice. The Journal of Clinical Investigation. 90 (4), 1622-1627 (1992).
- Matsubara, T., et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin. Biochemical and Biophysical Research Communications. 489 (4), 472-476 (2017).
- Roscher, A., et al. The F-actin modulator SWAP-70 controls podosome patterning in osteoclasts. Bone Reports. 5, 214-221 (2016).
- Jurdic, P., Saltel, F., Chabadel, A., Destaing, O. Podosome and sealing zone: Specificity of the osteoclast model. European Journal of Cell Biology. 85 (3-4), 195-202 (2006).
- Francis, M. J. O., et al. ATPase pumps in osteoclasts and osteoblasts. The International Journal of Biochemistry & Cell Biology. 34 (5), 459-476 (2002).
- Kwak, H. B., et al. Inhibition of osteoclast differentiation and bone resorption by rotenone, through down-regulation of RANKL-induced c-Fos and NFATc1 expression. Bone. 46 (3), 724-731 (2010).
- Massey, H. M., Flanagan, A. M. Human osteoclasts derive from CD14-positive monocytes. British Journal of Haematology. 106 (1), 167-170 (1999).
- Xue, J., et al. CD14+CD16-monocytes are the main precursors of osteoclasts in rheumatoid arthritis via expressing Tyro3TK. Arthritis Research and Therapy. 22 (1), 221(2020).
- Marco-Casanova, P., et al. Preparation of peripheral blood mononuclear cell pellets and plasma from a single blood draw at clinical trial sites for biomarker analysis. Journal of Visualized Experiments. (169), e60776(2021).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Matsuzaki, K., et al. Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. Biochemical and Biophysical Research Communications. 246 (1), 199-204 (1998).
- Shalhoub, V., et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell precursors. Journal of Cellular Biochemistry. 72 (2), 251-261 (1999).
- Neale, S. D., Smith, R., Wass, J. A. H., Athanasou, N. A. Osteoclast differentiation from circulating mononuclear precursors in Paget's disease is hypersensitive to 1,25-dihydroxyvitamin D3 and RANKL. Bone. 27 (3), 409-416 (2000).
- Abdallah, D., et al. An optimized method to generate human active osteoclasts from peripheral blood monocytes. Frontiers in Immunology. 9, 632(2018).
- Komano, Y., Nanki, T., Hayashida, K., Taniguchi, K., Nobuyuki, M. Identification of a human peripheral blood monocyte subset that differentiates into osteoclasts. Arthritis Research and Therapy. 8 (5), 152(2006).
- Kylmäoja, E., et al. Peripheral blood monocytes show increased osteoclast differentiation potential compared to bone marrow monocytes. Heliyon. 4 (9), 00780(2018).
- Wang, D., et al. Platelet-rich plasma inhibits RANKL-induced osteoclast differentiation through activation of Wnt pathway during bone remodeling. International Journal of Molecular Medicine. 41 (2), 729-738 (2018).
- Cenni, E., Avnet, S., Fotia, C., Salerno, M., Baldini, N. Platelet-rich plasma impairs osteoclast generation from human precursors of peripheral blood. Journal of Orthopaedic Research. 28 (6), 792-797 (2010).
- D'Amico, L., Roato, I. Cross-talk between T cells and osteoclasts in bone resorption. BoneKEy Reports. 1 (6), 82(2012).
- Quinn, J. M. W., Elliott, J., Gillespie, M. T., Martin, T. J. A combination of osteoclast differentiation factor and macrophage-colony stimulating factor is sufficient for both human and mouse osteoclast formation in vitro. Endocrinology. 139 (10), 4424-4427 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved