Method Article
Diferenciación de osteoclastos funcionales de monocitos CD14+ de sangre periférica humana
* Estos autores han contribuido por igual
En este artículo
Resumen
Los osteoclastos son células clave de reabsorción ósea en el cuerpo. Este protocolo describe un método fiable para la diferenciación in vitro de osteoclastos a partir de monocitos de sangre periférica humana. Este método se puede utilizar como una herramienta importante para comprender mejor la biología de los osteoclastos en la homeostasis y en las enfermedades.
Resumen
Los osteoclastos (AO) son células de reabsorción ósea que desempeñan un papel fundamental en el desarrollo esquelético y la remodelación ósea adulta. Varios trastornos óseos son causados por una mayor diferenciación y activación de los AO, por lo que la inhibición de esta patobiología es un principio terapéutico clave. Dos factores clave impulsan la diferenciación de los AO de los precursores mieloides: el factor estimulante de colonias de macrófagos (M-CSF) y el activador del receptor del ligando del factor nuclear kappa-B (RANKL). Se sabe desde hace tiempo que los monocitos CD14+ circulantes humanos se diferencian en AO in vitro. Sin embargo, el tiempo de exposición y la concentración de RANKL influyen en la eficiencia de diferenciación. De hecho, se han descrito protocolos para la generación de AO humanos in vitro , pero a menudo resultan en un proceso de diferenciación pobre y prolongado. En este documento, se proporciona un protocolo robusto y estandarizado para generar AO humanos maduros funcionalmente activos de manera oportuna. Los monocitos CD14+ están enriquecidos a partir de células mononucleares de sangre periférica humana (PBMC) y preparados con M-CSF para regular al alza el RANK. La exposición posterior a RANKL genera AO de una manera dependiente de la dosis y el tiempo. Los AO se identifican y cuantifican mediante tinción con fosfatasa resistente al ácido tartrato (TRAP) y análisis de microscopía óptica. La tinción por inmunofluorescencia de núcleos y actina F se utiliza para identificar AO funcionalmente activos. Además, los AO maduros OSCAR+CD14− se enriquecen aún más mediante la clasificación celular por citometría de flujo y la funcionalidad de OC cuantificada mediante ensayos de reabsorción mineral (o dentina/hueso) y formación de anillos de actina. Finalmente, un inhibidor conocido de OC, rotenona, se usa en AO maduros, lo que demuestra que la producción de trifosfato de adenosina (ATP) es esencial para la integridad del anillo de actina y la función de OC. En conclusión, en este trabajo se establece un ensayo robusto para diferenciar un alto número de AO, que en combinación con la tinción con anillo de actina y un ensayo de ATP proporciona un modelo in vitro útil para evaluar la función de OC y detectar nuevos compuestos terapéuticos que pueden modular el proceso de diferenciación.
Introducción
Los osteoclastos (AO) son células gigantes multinucleadas de linaje hematopoyético con una capacidad única para reabsorber hueso. Son responsables del desarrollo y remodelación continua del esqueleto 1,2. En las fases esqueléticas del desarrollo, los AO y los macrófagos residentes en el tejido se derivan de progenitores eritromieloides y colonizan el nicho óseo y los tejidos de los órganos. En condiciones fisiológicas, los progenitores eritromieloides son necesarios para el desarrollo óseo normal y la erupción dental, mientras que la afluencia de monocitos sanguíneos circulantes en el nicho óseo proporciona el mantenimiento postnatal de los AO, la masa ósea y la cavidad de la médula ósea3. En condiciones patológicas, los monocitos son reclutados en sitios de inflamación activa y pueden contribuir a la destrucción ósea patológica 4,5.
Los pacientes con varias formas de artritis experimentan inflamación articular, lo que lleva a la destrucción progresiva de las articulaciones causada por los AO6. Por ejemplo, en la artritis reumatoide (AR), los AO sobreactivados son responsables de la erosión ósea patológica y la destrucción articular 7,8, y los tratamientos actuales a menudo no mejoran ni detienen el daño óseo9,10,11. Se han descrito alteraciones en los monocitos circulantes tanto en términos de distribución poblacional como de firmas transcriptómicas y epigenéticas en pacientes con AR12,13,14. Además, se ha descrito que las respuestas alteradas de los monocitos a la estimulación inflamatoria afectan la osteoclastogénesis en pacientes con AR con enfermedad activa15,16,17.
La diferenciación de los AO es un proceso complejo de varios pasos que comprende el compromiso de las células precursoras mieloides con la diferenciación en precursores de AO. Durante la osteoclastogénesis, los AO se vuelven gigantes y multinucleados a través de la fusión célula-célula, citocinesis incompleta y un proceso de reciclaje nuclear descrito como fisión y fusión18,19,20. La capacidad de diferenciar los AO in vitro ha permitido avances significativos en la comprensión de la biología ósea21. Los AO se diferencian de los precursores tras la exposición al factor estimulante de colonias de macrófagos (M-CSF) y al activador del receptor del ligando del factor nuclear kappa-B (RANKL). Este último es esencial para el desarrollo y la función normal de los AO in vitro e in vivo, incluso en condiciones inflamatorias 6,22,23. RANKL es presentado por osteoblastos y osteocitos, así como por células T activadas y fibroblastos en la membrana sinovial de la AR inflamada 2,24,25. Durante el proceso de diferenciación de AO, los monocitos expuestos a M-CSF regulan al alza el activador del receptor de la expresión del factor nuclear kappa-B (RANK) en su membrana celular y, bajo estimulación posterior con RANKL, se diferencian en pre-OC mononucleares positivos para fosfatasa ácida resistente al tartrato (TRAP) y luego en OC multinucleados15,26. Los AO producen varias enzimas, la principal de ellas es TRAP, que permite la degradación de fosfoproteínas dentro del hueso27. Un regulador y marcador de diferenciación de OC es el receptor asociado a OC (OSCAR). Se regula al alza temprano en las células precursoras que se comprometen con el linaje OC28. Los OC multinucleados gigantes maduros pueden degradar (reabsorber) la matriz esquelética generando una gran zona de sellado, que está hecha de un anillo de actina que rodea un borde erizado21,29,30. La capacidad de resorción ósea de los AO requiere la reorganización del citoesqueleto y la consiguiente polarización y formación de una membrana enrevesada, que es el llamado borde erizado. El borde erizado está rodeado por una gran banda circular de una estructura rica en actina F, que es el anillo de actina o zona de sellado. La integridad del anillo de actina es esencial para que los AO reabsorban el hueso tanto in vitro como in vivo, y la formación defectuosa del borde erizado se asocia con la expresión de adenosina trifosfatasa vacuolar inferior (V-ATPasa)31,32,33. Además, los AO son células ricas en mitocondrias, y el trifosfato de adenosina (ATP) se asocia con estructuras similares a las mitocondrias en los AO localizados en el borde erizado31,32,33. La rotenona actúa como un fuerte inhibidor del complejo mitocondrial I e impacta la producción de ATP. También se ha demostrado que la rotenona inhibe la diferenciación y función de la AO34.
Este protocolo describe un método eficiente y optimizado de osteoclastogénesis in vitro a partir de muestras de sangre periférica humana. En la sangre periférica humana, los monocitos CD14+ son la principal fuente de AO15,35,36. En este protocolo, la cinética de exposición y las concentraciones de M-CSF y RANKL se han ajustado para una osteoclastogénesis óptima. Las células mononucleares se separan primero de los eritrocitos y granulocitos presentes en la sangre total por gradiente de densidad; luego se enriquecen para monocitos CD14 + utilizando selección positiva por perlas magnéticas. Los monocitos CD14+ aislados se incuban durante la noche con M-CSF. Esto prepara a los monocitos para regular al alza la expresión de RANK15,26. La adición posterior de RANKL induce osteoclastogénesis y multinucleación de una manera dependiente del tiempo. Los AO de reabsorción activa muestran la distribución característica de los anillos de actina F en el borde de la membrana celular30,32 y la tinción para TRAP. Los AO maduros se analizan cuantificando células multinucleadas TRAP+ (más de tres núcleos). La capacidad funcional de los AO maduros puede evaluarse por su reabsorción, integridad del anillo de actina y producción de ATP. Además, los OC CD14− OSCAR+ diferenciados pueden enriquecerse y utilizarse para evaluar los efectos de ciertos compuestos sobre la funcionalidad de OC a través de la reabsorción mineral (o dentina) y la organización de la actina F. Además, en este trabajo, un conocido inhibidor de OC, rotenona, se utiliza como ejemplo de un compuesto que afecta la funcionalidad de los AO. La reducción de la actividad de reabsorción de OC bajo rotenona se asocia con una reducción de la producción de ATP y la fragmentación del anillo de actina. En conclusión, este protocolo establece un ensayo robusto que puede ser utilizado como método de referencia para estudiar varios aspectos biológicos de la diferenciación y función de OC in vitro.
Esta metodología se puede utilizar para evaluar (1) el potencial de los monocitos circulantes para diferenciarse en AO en salud y enfermedades, así como (2) el impacto de los candidatos terapéuticos en la diferenciación y función de AO. Este robusto protocolo de osteoclastogénesis permite determinar la eficacia y los mecanismos de las terapias dirigidas al hueso tanto en la diferenciación de AO a partir de células precursoras como en la función de los AO maduros.
Protocolo
Las abrigos leucocitarios obtenidos del Servicio Nacional Escocés de Transfusión de Sangre (Edimburgo) y los conos de leucocitos obtenidos del NHS Blood and Transplant (Newcastle) se proporcionan a los investigadores de la Universidad de Glasgow en una forma totalmente anónima (no identificable) de donantes de sangre del NHS que dan su consentimiento total. La capa leucocitaria y los componentes sanguíneos del cono leucocitario se producen a partir de una donación de sangre estándar del NHS administrada en un centro de donación de sangre del NHS en Escocia o Inglaterra. El donante de sangre da su consentimiento informado en el momento de la donación de sangre para el excedente de sangre no utilizada en la práctica clínica estándar del NHS para ser utilizada para estudios de investigación médica aprobados. La aprobación ética del Comité de Ética de Investigación del NHS y los formularios de consentimiento firmados por el donante para usar estas donaciones de sangre están en manos del servicio de donación de sangre del NHS. La aprobación para acceder y utilizar estas donaciones de sangre consentidas en estudios de investigación médica aprobados se buscó y obtuvo utilizando el proceso interno estándar de solicitud y revisión del Servicio Nacional de Transfusión de Sangre (Escocia) y NHS Blood and Transport (Inglaterra). No se requirió ninguna aprobación adicional del NHS REC o la aprobación interna del comité ético de la Universidad de Glasgow para usar los componentes sanguíneos para los estudios de investigación médica aprobados.
1. Notas generales antes de empezar
- Proceda con todo el trabajo con sangre con precaución. Considere los peligros potenciales de varios agentes infecciosos que pueden estar presentes en las muestras.
- Realice todo el trabajo con precaución en el laboratorio de bioseguridad en condiciones estériles mientras usa guantes y batas de laboratorio.
- Realizar la eliminación de bioseguridad de acuerdo con las pautas locales.
- Obtener el consentimiento apropiado y las aprobaciones éticas antes de la recolección de muestras de acuerdo con las regulaciones de las autoridades locales.
- En general, 1 ml de sangre fresca producirá 1 millón de PBMC, y los monocitos CD14 + representan aproximadamente el 10% -30% de los PBMC. En comparación, 10 ml de un cono leucocitario pueden contener 5 x 10 8-15 x 108 PBMC. Para obtener más detalles sobre el aislamiento PBMC, consulte un protocolo37 anterior.
2. Aislamiento de células mononucleares de sangre periférica (PBMC) de sangre total
- Recoja el volumen requerido de sangre fresca de donantes sanos en tubos de recolección de heparina de litio.
NOTA: También se pueden usar otros tubos de recolección con anticoagulantes apropiados (por ejemplo, tubos de heparina sódica). Para recuentos celulares más altos, se pueden usar conos leucocitarios o capas leucocitarias. - Para aislar las PBMC, transfiera la sangre a un nuevo tubo de 50 ml y dilúyala con solución salina estéril 1x tamponada con fosfato (PBS) en una proporción de 1: 1 o 1: 3 para sangre fresca o conos leucocitarios / capas leucocitarias, respectivamente.
- Mezclar suavemente las células varias veces por inversión.
- Prepare tubos de 15 ml que contengan 3 ml de medio de gradiente de densidad. Coloque lentamente 8-10 ml de sangre diluida en la parte superior del medio de gradiente de densidad, y centrifugar a 400 x g durante 30 minutos a temperatura ambiente (RT) sin freno.
NOTA: Aplique la sangre con cuidado sobre el medio de gradiente de densidad para evitar la mezcla. La mezcla puede resultar en la pérdida de PBMCs. - Deseche cuidadosamente la capa superior (que contiene el plasma) con una pipeta Pasteur, recoja la capa de interfase inferior que contiene las PBMC (estructura blanca en forma de anillo) y transfiera esta capa a un nuevo tubo de 50 ml.
- Suspender las células con 1x PBS estéril hasta 50 ml y lavar el medio de gradiente de densidad residual centrifugando a 300 x g durante 10 min a RT con freno completo.
- Para eliminar las plaquetas residuales, repita el proceso con un giro adicional más lento a 200 x g durante 10 minutos a RT sin freno.
- Opcional: Para eliminar el arrastre de glóbulos rojos, diluya el tampón de lisis de glóbulos rojos (10x, Tabla de materiales) 1:10 en agua destilada y aplique 3 ml del tampón diluido en el pellet. Mezclar e incubar durante 3 min. Lave el pellet en hasta 50 ml de 1x PBS y centrifugar a 300 x g durante 10 min en RT con el freno completo.
- Resuspender las PBMC aisladas y purificadas en 20 ml de 1x PBS y contarlas usando un hemacitómetro o siguiendo otros métodos estándar.
NOTA: Los métodos de dilución y recuento de células deben ajustarse en consecuencia en función de la densidad celular y el dispositivo de conteo utilizados.
3. Enriquecimiento de monocitos CD14+ a partir de PBMCs
- Aísle los monocitos CD14+ de las PBMC con un kit de selección de CD14+ humano según el protocolo del fabricante (Tabla de materiales).
NOTA: Los monocitos CD14+CD16− clásicos son la principal fuente de precursores de AO35; Se pueden considerar métodos alternativos de purificación. - Transfiera 1 x 107 PBMC a un tubo de fondo redondo de poliestireno adecuado (es decir, que se ajuste al imán del kit de selección) y granule las celdas a 300 x g durante 5 min.
- Desechar el sobrenadante, resuspender el pellet celular en tampón de separación celular (PBS, suero bovino fetal al 2% [FBS], ácido etilendiaminotetraacético [EDTA] al 2%, hasta una concentración final de 1 x 108 células/ml, e incubar con 10 μL de cóctel de anticuerpos por 100 μL con la tapa puesta durante 10 min.
NOTA: Las células se resuspenden a 1 x 108 células/ml; Ajuste los volúmenes en consecuencia. - Después de la incubación, añadir 10 μL de las perlas de nanopartículas magnéticas por cada 100 μL, e incubar durante 3 minutos con la tapa puesta.
NOTA: Ajuste los volúmenes del cóctel de anticuerpos y las perlas magnéticas para obtener una concentración de 10 μL/ml. - Aumente el volumen a 2,5 ml con el tampón de separación celular, coloque el tubo en un imán (sin la tapa) e incube durante 3 minutos. Deseche la población celular negativa por un movimiento continuo por inversión mientras el tubo todavía está en el imán.
NOTA: Si utiliza >2 x 108 PBMC y un imán más grande, rellene hasta 5 ml o 10 ml con tampón de separación celular siguiendo las instrucciones del fabricante. - Retire el tubo del imán y lave los monocitos CD14+ enriquecidos unidos a las perlas magnéticas resuspendiéndolas en 2,5 ml del tampón de separación celular. Incubar durante 3 minutos dentro del imán como antes, desechar la fracción negativa y repetir una vez más.
- Centrifugar todas las células recogidas a 300 x g durante 5 min, desechar el sobrenadante y resuspender las células en 5 mL de medio esencial mínimo alfa (α-MEM; Tabla de materiales) suplementado con 1% de L-glutamina, 1% de penicilina/estreptomicina (completo α-MEM) y 10% de FBS.
NOTA: Se recomienda una verificación de pureza posterior al enriquecimiento a través de citometría de flujo, y se debe esperar una pureza de ≥96%. Los pasos de lavado adicionales (paso 3.6) pueden aumentar la pureza.
4. Diferenciación de CO in vitro
- Contar los monocitos CD14+ enriquecidos con un hemacitómetro.
- Granular las células a 300 x g durante 5 min, y resuspender a 1 x 106 células/ml en α-MEM completo suplementado con 10% de FBS.
- Para diferenciar los AO, agregue M-CSF a una concentración final de 25 ng / ml a la suspensión celular.
NOTA: Para 1 ml de suspensión celular, añadir 0,25 μL de M-CSF de una concentración madre de 100 μg/ml. - Mezclar bien pipeteando para homogeneizar la suspensión celular y la placa de 100 μL/pocillo en una placa de fondo plano de 96 pocillos hasta una densidad celular final de 1 x 105 células/pocillo.
- Agregue 200 μL/pocillo de agua destilada estéril en los pocillos alrededor de las celdas plateadas para evitar la evaporación del medio y los efectos de borde en el sistema de cultivo.
- Incubar las células durante la noche, durante aproximadamente 18-20 h, a 37 °C con 5% deCO2.
- Después de la incubación durante la noche, retire cuidadosamente la mitad del medio (50 μL/pocillo) por aspiración con una pipeta P200, evitando tocar el fondo del pozo, y reemplácelo con α-MEM completa y caliente fresca que contenga 10% de FBS, 25 ng/mL DE M-CSF y 50 ng/ml de RANKL para una concentración final de 25 ng/mL.
NOTA: Para 1 ml de medio, añadir 0,25 μL de M-CSF y 0,5 μL de RANKL a partir de una concentración madre de 100 μg/ml. - Cambie los medios cada 3 días y diferencie las células en AO durante 7-14 días (Figura 1).
NOTA: Mantenga las concentraciones de M-CSF y RANKL consistentes durante todo el cultivo.
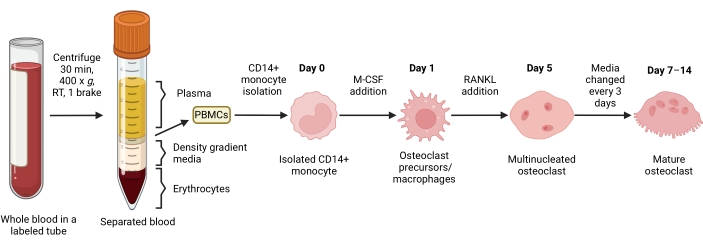
Figura 1: Flujo de trabajo de diferenciación de OC. Resumen esquemático del aislamiento de monocitos CD14+ de PBMC y diferenciación en AO maduros en presencia de M-CSF y RANKL durante 7-14 días. RT = temperatura ambiente. Imagen creada con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
5. Tinción TRAP para osteoclastos
- Retire con cuidado el medio, fije los AO adherentes diferenciados con 100 μL/pocillo de la solución fijadora previamente preparada e incube durante 1 min. No toque el fondo de los pocillos para evitar rayar las células adherentes.
NOTA: La solución fijadora se prepara de la siguiente manera: 12,5 ml de solución de citrato (incluida en el kit de tinción TRAP), 32,5 ml de acetona y 5 ml de formaldehído al 37%. - Lave los pocillos tres veces con 300 μL de agua destilada estéril. Seque los platos después del lavado.
- Prepare una solución de tinción de acuerdo con las instrucciones del fabricante (Tabla de materiales); añadir 5 μL de granate rápido y 5 μL de nitrito de sodio para hacer la solución de granate rápido; mezclar por inversión e incubar durante 3 min a RT. Preparar 1 ml de solución de tinción mezclando 900 μL de agua destilada estéril, 10 μL de naftol, 40 μL de solución de acetato, 50 μL de solución de tartrato y 10 μL de solución de granate rápido.
- Añadir 100 μL/pocillo de solución de tinción recién preparada e incubar la placa a 37 °C en la oscuridad durante 20 min.
- Después de la incubación, retirar la solución de tinción por inversión y lavar la placa tres veces con 300 μL/pocillo de agua destilada.
- Retire el exceso de agua golpeando los platos sobre toallas de papel. Deje las placas abiertas y protegidas de la luz para que se sequen al aire durante la noche.
NOTA: Las placas secas se pueden almacenar hasta por 6 meses. A veces, los amortiguadores residuales pueden promover el desarrollo de moho, que es visible bajo el microscopio; Esto se puede eliminar en cualquier momento lavando los pozos afectados con agua destilada y dejándolos secar al aire nuevamente. - Tome imágenes a 10x o 20x usando un microscopio de campo claro con una opción de mosaico para capturar toda la superficie del pozo.
- Cuente manualmente los OC identificados como células teñidas de púrpura TRAP + con más de tres núcleos utilizando un software de análisis de imágenes con un complemento de contador de celdas.
NOTA: El número de TRAP+ OC por pocillo depende del donante y puede variar de ~200 a 1,600 AO/pocillo, con un promedio de aproximadamente 1,000 AO/pocillo. Además, para analizar los datos, los números de AO deben determinarse en tres pozos diferentes (réplicas técnicas), y el promedio debe calcularse para cada condición y para cada réplica biológica.
6. Ensayo de resorción ósea
- Colocar en placa los monocitos CD14+ recién enriquecidos en placas osteo-ensayo de 96 pocillos recubiertas con fosfato de calcio a 1 x 105 células/pocillo, y diferenciar los AO durante 7-14 días, como se indica en los pasos 4.1-4.8, y cambiando el medio cada 3 días.
NOTA: Se pueden usar rodajas óseas corticales de dentina/marfil o bovino en lugar de placas de osteoensayo. Si es así, el tiempo total del cultivo debe prolongarse a 14-21 días debido al sustrato más complejo a reabsorber. - En el punto final, retire con cuidado el medio, evitando tocar el fondo del pozo, y lisar las células con una solución de hipoclorito de sodio al 10%. Lave los pozos tres veces con agua destilada.
- Escanee las placas secas con un microscopio de campo claro y analice / cuantifique las imágenes adquiridas de los pozos de reabsorción utilizando un software de análisis de imágenes.
7. Tinción fluorescente del anillo de actina
- Placa de 100 μL/pocillo de los monocitos CD14+ aislados en un portaobjetos de cámara de 18 pocillos con una densidad celular de 1 x 105 células/pocillo. Diferenciar los AO en presencia de M-CSF y RANKL como se describió anteriormente (pasos 4.1-4.8), incluyendo el cambio del medio cada 3 días.
- En el punto final, retire suavemente el medio y lave cada pocillo dos veces con 200 μL/pocillo de PBS precalentado, pH 7.4. No deje que los pozos se sequen entre ninguno de los pasos.
- Fijar la muestra con 100 μL/pocillo de solución de formaldehído al 4% en PBS, e incubar durante 10 min a RT en un agitador orbital con agitación suave.
NOTA: El metanol puede interrumpir la actina durante el proceso de fijación. Por lo tanto, es mejor evitar cualquier fijador que contenga metanol. El fijador preferido es el formaldehído libre de metanol. El agitador orbital utilizado en este paso del protocolo se estableció en un ajuste de potencia de 3 sobre 10. - Lavar dos veces con 200 μL/pocillo de PBS, permeabilizar las células con 100 μL/pocillo de solución Triton X-100 al 0,1% diluida en PBS, e incubar durante 10 min a RT en un agitador orbital con agitación suave.
- Lavar dos veces con 200 μL/pocillo de PBS. Para bloquear la unión no específica y aumentar la señal, agregue 100 μL/pocillo de solución de bloqueo hecha con albúmina sérica bovina (BSA)/solución PBS al 2%. Incubar durante 20 min en RT en un agitador orbital con agitación suave.
- Retire la solución de bloqueo y agregue 100 μL/pocillo de solución de faloidina conjugada fluorescentemente diluida en solución BSA/PBS al 2%. Incubar durante 20 minutos a RT en un agitador orbital con agitación suave y protegido de la luz.
NOTA: Ajuste la concentración del colorante faloidina de acuerdo con las recomendaciones del fabricante. - Lavar dos veces con 200 μL/pocillo de PBS, teñir los núcleos con 100 μL/pocillo de una solución de PBS que contenga 300 nM DAPI, e incubar durante 10-15 min a RT en un agitador orbital con agitación suave y protegido de la luz.
NOTA: DAPI se diluye en agua destilada para hacer una solución madre de DAPI de 14,3 mM (5 mg/ml). La solución madre se diluye hasta alcanzar la concentración final de 300 μM. Finalmente, la solución de DAPI de 300 μM se diluye una vez más en PBS hasta una concentración final de 300 nM. - Después de 10-15 min, retire la solución DAPI y reemplácela con PBS de 100 μL/pocillo.
NOTA: Dependiendo de los portaobjetos de cámara elegidos, almacene con un volumen apropiado de PBS (100 μL/pocillo para portaobjetos de cámara de 18 pocillos) o monte el portaobjetos con cubreobjetos y un medio de montaje apropiado. Los portaobjetos de la cámara se pueden almacenar hasta 1 semana en la nevera. Para portaobjetos de cámara de 18 pocillos, use un volumen de tinción de 50-100 μL y 200-300 μL para el lavado. Escale verticalmente para los otros tamaños de diapositivas de cámara en consecuencia. Para evitar la evaporación, mantenga los cubreobjetos dentro de un recipiente cubierto durante los tiempos de incubación. Se recomienda el uso de un agitador orbital, pero no es esencial. - Visualice la tinción utilizando microscopios de inmunofluorescencia o confocales apropiados y aumentos entre 4x y 40x.
8. Enriquecimiento de AO maduros y precursores de AO mediante clasificación por citometría de flujo
- Resuspender los monocitos CD14+ recién enriquecidos a 1 x 106 células/ml, y diferenciarlos en AO maduros en presencia de M-CSF y RANKL de la misma manera que se describió anteriormente (pasos 4.1-4.8).
NOTA: Al escalar de una placa de 96 pocillos a un tamaño de placa más grande, siga la Tabla 1; estos volúmenes se calculan a partir de una solución de 1 x 106 células/ml y proporcionan una densidad óptima para la fusión célula-célula. - El día 7, lave los pocillos una vez con PBS tibio y agregue de 50 μL a 1 ml (volumen determinado por el tamaño de la placa utilizada) de accutasa. Incubar las células a 37 °C con 5% deCO2 durante 20 min.
- Después de la incubación, revise las placas bajo un microscopio óptico para ver si las células se han desprendido. Además, separe las celdas golpeando las placas en todos los lados y pipeteándolas hacia arriba y hacia abajo.
- Recoger la suspensión celular en un tubo cónico de 15 ml. Lave los pocillos con PBS tibio (sin Ca 2+, sin Mg2+) y combínelos con la suspensión celular. Repita los pasos 8.2-8.3 una o dos veces hasta que la mayoría de las celdas se hayan desprendido.
NOTA: Accutase, el método recomendado antes de la tinción superficial para el análisis citométrico de flujo, no desprende AO muy grandes. La tasa de recuperación es ~ 50% -70%. - Centrifugar las células a 300 x g durante 5 min, resuspender el pellet celular en 1 ml de PBS y contar las células por exclusión de azul de tripano.
- Resuspender las células a 1 x 106 células/ml, extraer 100 μL correspondientes a 1 x 105 células y transferir esas células a un nuevo tubo de ensayo de polipropileno. Agregue 200 μL del tampón de clasificación celular y déjelo a un lado en hielo como control no teñido.
- Manchar el resto de las células con colorante vivo/muerto diluido a 1:750 durante 10 min a RT y protegido de la luz.
NOTA: La tinción viva / muerta debe realizarse en ausencia de FBS para evitar una alta tinción de fondo. - Rellene el tubo de recolección de 15 ml que contiene la suspensión de células teñidas vivas/muertas con tampón de clasificación de células calientes (1x PBS, sin Ca 2+, sin Mg2+, 1% FBS y 5 mM EDTA), y centrifugar a 300 x g durante 5 min para granular las células.
NOTA: Se recomienda una alta concentración de EDTA y una baja concentración de FBS en el tampón de clasificación para prevenir grupos celulares. - Extraer un volumen correspondiente a 1 x 105 células y transferirlas a un nuevo tubo de ensayo de polipropileno para el control del isotipo OSCAR. Transfiera todas las células restantes a otro tubo de ensayo de polipropileno para teñir y clasificar las células.
NOTA: Los tubos de ensayo de polipropileno se utilizan para la clasificación, ya que es menos probable que las células se adhieran a estos tubos que a los tubos de poliestireno. - Gire los tubos a 400 x g durante 5 minutos para granular las células y deseche el sobrenadante por inversión.
- Resuspender la gránula celular en una solución de mezcla maestra de anticuerpos preparada siguiendo la Tabla 2. Manchar el tubo de control del isotipo OSCAR con el anticuerpo CD14 y el control del isotipo OSCAR en lugar del anticuerpo OSCAR.
- Incubar las celdas a 4 °C protegidas de la luz durante 30 min.
- Después de 30 minutos, lavar las celdas añadiendo cinco volúmenes del tampón de clasificación celular y centrifugar a 400 x g durante 5 min a 4 °C.
- Resuspender las células en 300-1.000 μL de tampón de clasificación de células frías y adquirir las células utilizando una máquina clasificadora de citometría de flujo equipada con una boquilla de 100 μM.
NOTA: Los AO son células muy pegajosas, por lo que es importante filtrarlas a través de una membrana estéril de 70 μm antes de la clasificación. - Puerta de los OC y pre-OC como CD14−OSCAR+. Ajuste la puerta OSCAR+ en función del tubo de control del isotipo OSCAR.
- Recoger las células clasificadas en tubos de ensayo de polipropileno que contengan α-MEM completo suplementado con 20% de FBS a 8 °C.
- Después de la clasificación, granular las células por centrifugación a 300 x g durante 5 minutos en RT, contar las células y resuspender para aplicaciones posteriores.
NOTA: Por lo general, para obtener ~1 x 105 pre-OCs/OCs ordenados, comience desde ~10 x 106 celdas plateadas en el día 0. La baja tasa de recuperación está influenciada por la pérdida de células durante el desprendimiento con accutase y por el procesamiento para la tinción y clasificación. Se recomienda llevar a cabo todo el procedimiento utilizando tampones y reactivos estériles, y trabajar en condiciones estériles.
9. Ensayo de ATP para la actividad mitocondrial
- Incubar los monocitos CD14+ enriquecidos en presencia de M-CSF y RANKL en una placa de 96 pocillos de la misma manera que se describió anteriormente (pasos 4.1-4.8). Coloque cuatro condiciones adicionales en triplicados para usar como controles.
- Realice el ensayo de ATP con el kit de ensayo de detección de ATP de luminiscencia de acuerdo con el manual del fabricante. Brevemente, para preparar la solución de ATP, agregue 10 ml de la solución tampón de sustrato al sustrato liofilizado y déjela incubar a RT durante 30 minutos.
NOTA: Se pueden utilizar diferentes métodos para medir la producción intracelular de ATP. En este documento, hemos utilizado la detección de la producción de ATP por luminiscencia. - Durante la incubación, prepare y agregue los controles directamente a los pocillos de control de la siguiente manera: 2-desoxi-D-glucosa (2DG) a 10 mM y 100 mM, oligomicina a 1 μM y 100 mM 2DG en combinación con 1 μM de oligomicina. Incubar durante 30 min a 37 °C con 5% deCO2.
NOTA: La 2DG bloquea la glucólisis, mientras que la oligomicina es un inhibidor de la fosforilación oxidativa. La combinación de estos dos inhibidores da como resultado la pérdida completa de la producción de ATP a través de la glucólisis y la fosforilación oxidativa, lo que significa que sirven como un control interno para el ensayo de ATP. Para controles 2DG de 10 mM y 100 mM, añadir 0,5 μL y 5 μL de solución madre 2M 2DG por pocillo de cultivo de 100 μL, respectivamente. Para 1 μM de oligomicina, diluir la solución madre de 5 mM 1:100 en medio y añadir 2 μL/pocillo a los pocillos de control dedicados. Para el último control, añadir 5 μL de 2DG y 2 μL de solución diluida de oligomicina por pocillo. - Añadir 50 μL de la solución de ATP a cada pocillo para detener la reacción, e incubar a RT en un agitador a 700 rpm durante 5-10 min protegido de la luz.
- Transfiera 100 μL del sobrenadante a una placa de fondo blanco de 96 pocillos específica para el ensayo de ATP, y lea la placa utilizando un lector de luminiscencia.
Resultados
Generación de OC a partir de monocitos CD14+
Este método tenía como objetivo diferenciar fácilmente un gran número de AO de los monocitos CD14+ de sangre periférica humana in vitro, generalmente en 1 semana. En primer lugar, los monocitos CD14 + se enriquecieron a partir de PBMC y se prepararon con M-CSF durante la noche para regular al alza el RANK, como se informó anteriormente15. Después del cebado de monocitos, para determinar la concentración óptima de RANKL para la diferenciación y maduración de OC, se utilizaron concentraciones de RANKL de 1 ng / ml, 25 ng / ml, 50 ng / ml y 100 ng / ml, junto con 25 ng / mL M-CSF. La adición de RANKL produjo un número creciente de grandes AO multinucleados positivos para TRAP de una manera dependiente de la dosis, y esto se evaluó mediante tinción TRAP. Los AO maduros se definen como células TRAP-positivas con múltiples núcleos (típicamente más de tres; Figura 2A, B y Figura complementaria 1). Además, la cinética de la diferenciación de OC de monocitos se investigó mediante tinción TRAP y microscopía óptica durante un período de cultivo de 2-14 días. En este caso, se eligió la diferenciación de OC utilizando una concentración intermedia de 50 ng/ml RANKL para evaluar qué tan rápido se diferenciaron los AO en cultivo. En estas condiciones de cultivo, los AO multinucleados fueron visibles desde el día 5 en adelante, y la diferenciación óptima se alcanzó el día 7 (Figura 2C). La incubación prolongada de cultivos más allá de 10 días en plásticos dio como resultado células fusionadas anormalmente gigantes. En este protocolo, los días 6-8 se utilizan generalmente como el punto final óptimo de la generación de AO. Los AO pueden cuantificarse o utilizarse para ensayos posteriores.
Evaluación funcional de los AO diferenciados
Para determinar la actividad funcional de los AO generados, examinamos su actividad resortiva diferenciando los OC en una superficie mineralizada. Como los AO grandes solo se generan después de un período de cultivo de 7 días, y para permitir el tiempo suficiente para reabsorber el sustrato mineral, los cultivos se mantuvieron hasta el día 10. La formación de agujeros redondos, o pozos de reabsorción, se observó solo en las superficies mineralizadas de pozos que contenían células que habían sido tratadas con M-CSF y RANKL (Figura 3). Por lo tanto, el porcentaje de superficie mineralizada disuelta (pozos de reabsorción) permite determinar la capacidad de reabsorción de OC. Además, los AO diferenciados siguiendo este protocolo hasta el día 7, tanto en portaobjetos de cámara de plástico como de vidrio, mostraron una estructura de anillo de actina bien organizada que podía visualizarse mediante tinción inmunofluorescente (Figura complementaria 2).
Efecto de un inhibidor sobre la función madura de OC
Las condiciones de cultivo mencionadas anteriormente se utilizaron para determinar la capacidad funcional de los AO generados in vitro en presencia del inhibidor conocido de AO, rotenona34. Los AO se diferenciaron durante 6-8 días, y los AO CD14-OSCAR+ y los precursores de AO se enriquecieron mediante citometría de flujo (Figura 4). Las células enriquecidas se colocaron a 50,000 células / por pocillo en una placa de 96 pocillos recubierta de minerales en medio pro-osteoclastogénico (25 ng / mL M-CSF y RANKL) durante 3 días. El tratamiento con rotenona (Figura 5A,B) inhibió dosis-dependiente de la reabsorción de la superficie mineralizada en comparación con el pozo control no tratado, consistente con estudios previos34. Además, la funcionalidad de OC se evaluó a través de la producción de ATP y la formación de anillos de actina. La inhibición dependiente de rotenona de la reabsorción de OC se asoció con la inhibición de la producción de ATP (Figura 5C). Los AO reabsorbentes son células altamente polarizadas que regulan su capacidad de absorción promoviendo la organización citoesquelética. La faloidina conjugada Alexa fluor 647 se utilizó para marcar el citoesqueleto de actina F de los AO maduros cultivados en presencia o ausencia de rotenona. La rotenona causó la fragmentación del anillo de actina derivado de RANKL de los AO maduros (Figura 5D).
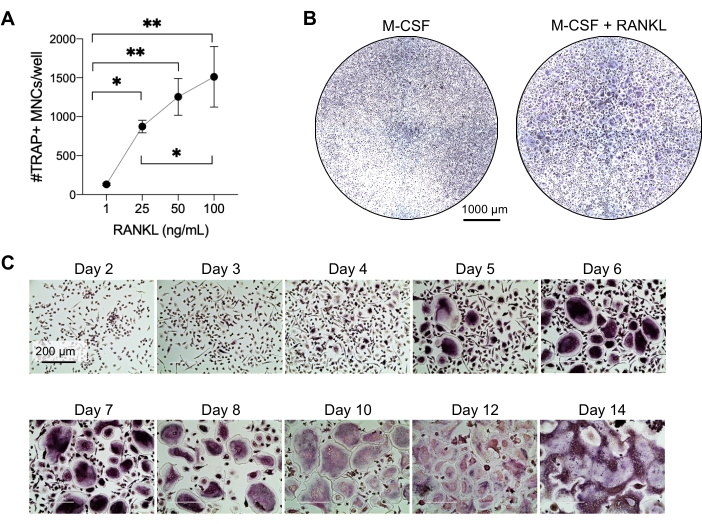
Figura 2: AO diferenciando eficientemente de los precursores de monocitos CD14+ . Los monocitos CD14+ se enriquecieron magnéticamente, se colocaron en 1 x 105 células/pocillo en placas de 96 pocillos y se incubaron durante la noche con 25 ng/mL M-CSF. (A) Los monocitos preparados para M-CSF fueron estimulados con concentraciones crecientes de RANKL (1 ng/mL, 25 ng/mL, 50 ng/mL y 100 ng/mL), fijados y teñidos para TRAP el día 7. Se adquirieron imágenes y se contaron las células multinucleadas (MNC) TRAP+ . En la Figura suplementaria 1 se muestran imágenes representativas de la tinción TRAP. Las barras de error muestran la media ± SD (n = 3). Los datos se analizaron con un ANOVA unidireccional y la prueba de comparaciones múltiples de Holm-Sidak para datos pareados; * P ≤ 0,05 y ** P ≤ 0,005. (B) Imagen representativa de un pocillo teñido con TRAP de una placa de 96 pocillos que muestra la cantidad típica de AO/pocillo esperado y su morfología por debajo de 25 ng/ml de RANK-L en comparación con los macrófagos derivados de M-CSF en el día 7. Barras de escala: 1000 μm. (C) Imágenes representativas de la formación de CO por debajo de 50 ng/ml RANKL evaluadas mediante tinción TRAP desde el día 2 hasta el día 14. Los AO son visibles desde el día 5 en adelante. Los AO gigantes anormalmente fusionados están presentes después de 10 días. Barras de escala: 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
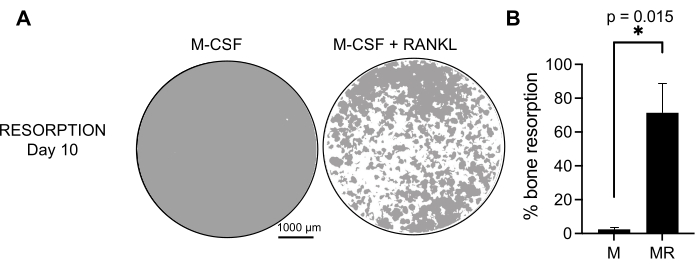
Figura 3: AO resorpresivos diferenciados de los monocitos CD14+ . Las células CD14+ aisladas de PBMC se diferenciaron durante 10 días en AO en presencia de 25 ng/mL M-CSF (M) y RANKL (R) en placas de superficie de ensayo mineral (osteoensayo). (A) Imágenes de pozos reconstruidos representativos tomadas con un aumento de 10x para analizar la reabsorción en el día 10 (sustrato mineral en gris; pozos de reabsorción en blanco). Barras de escala: 1000 μm. (B) Cuantificación del porcentaje de área reabsorbida. Los datos de reabsorción se analizaron con un análisis pareado de Wilcoxon. Las barras de error muestran la media ± SD (n = 7). Haga clic aquí para ver una versión más grande de esta figura.
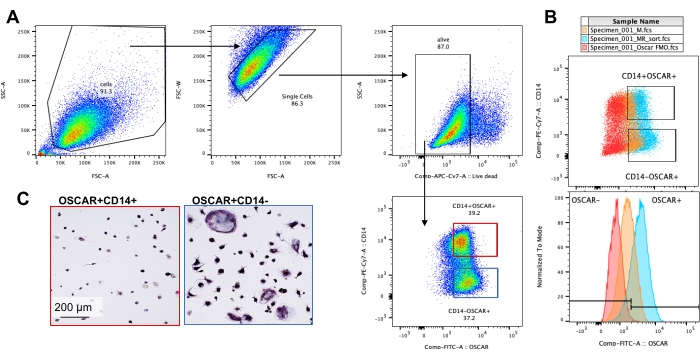
Figura 4: Enriquecimiento por citometría de flujo de CD14−OSCAR+ OCs. Los monocitos CD14+ se enriquecieron a partir de PBMC, y los AO se diferenciaron como se describió anteriormente. Los cultivos de AO adherentes se separaron con atasa y se tiñeron para citometría de flujo. (A-C) Los AO del día 8 se clasificaron según la expresión de CD14 y OSCAR. (A) Estrategia representativa de clasificación de compuertas. Las células se cerraron como singletes, negativas para tinción muerta, y se clasificaron los subconjuntos CD14+ OSCAR+ (rojo) y CD14− OSCAR+ (azul). (B) Gráficos representativos que muestran la tinción OSCAR superpuesta de OC derivados de RANKL (cian) y macrófagos derivados de M-CSF de control (naranja). En rojo está el control teñido con isotipo OSCAR de los OC derivados de RANKL. (C) Las poblaciones clasificadas se colocaron en plástico y se dejaron adherir durante 2 h en medio pro-OC (25 ng/mL M-CSF y 50 ng/mL RANKL), seguido de tinción y visualización de TRAP. Las imágenes representativas muestran una falta de células TRAP+ en el subconjunto CD14+ (rojo) y TRAP+ mono y multinucleadas pre-OCs y OCs en el subconjunto CD14− (azul). Barras de escala: 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
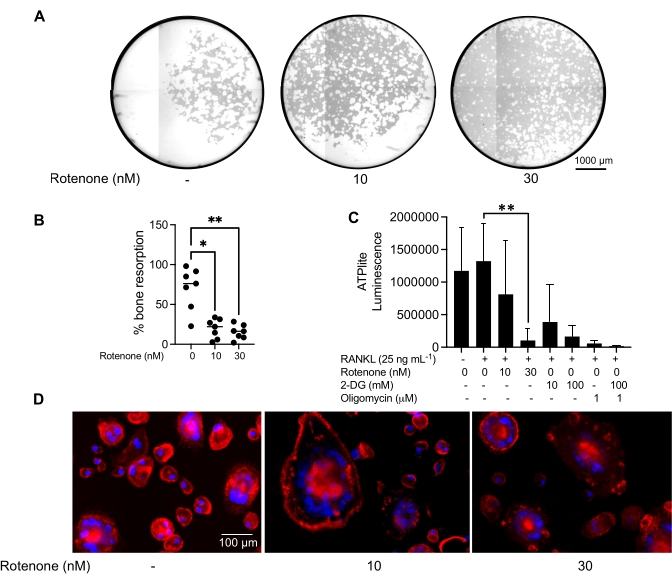
Figura 5: Ensayos para evaluar la función de los AO maduros. Para evaluar la función de los AO maduros, las células CD14+ aisladas de PBMC se cultivaron con M-CSF (M) solo o combinado con RANKL (R) durante 7 días, los AO se enriquecieron mediante citometría de flujo y los AO se trataron con el inhibidor rotenona durante 24 h. (A) Los AO maduros se clasificaron mediante citometría de flujo (CD14−OSCAR+) y se cultivaron en una superficie de ensayo mineral en presencia o ausencia de rotenona durante 3 días, después de lo cual las células se blanquearon y se obtuvieron imágenes a 10x para revelar el área reabsorbida (pozos de reabsorción en blanco). (A) Imágenes representativas reconstruidas de pozos. Barras de escala: 1000 μm. (B) La cuantificación del porcentaje de área reabsorbida. Los datos en (B) se analizaron con un ANOVA unidireccional con la prueba de comparaciones múltiples de Dunn (n = 7); * P ≤ 0,05 y** P ≤ 0,01. Las barras de error muestran la media ± DE. (C) Contenido total de ATP intracelular de AO maduros indiferenciados y diferenciados para el día 7 diferenciados con RANKL y tratados con vehículo o rotenona (10 nM y 30 nM). Aquí, 2DG y oligomicina se utilizaron como controles positivos para el ensayo y se agregaron 30 minutos antes de la lisis celular y la cuantificación de ATP. Las barras de error muestran la media ± SD (n = 4). Los datos se analizaron con un ANOVA unidireccional y la prueba de comparación múltiple de Dunnett para datos pareados. ** P ≤ 0,01. (D) Una imagen representativa de 20x de OCs maduros teñidos para la formación de anillos de actina (rojo) y núcleos (azul), que muestra la pérdida del anillo de actina con el inhibidor. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Formato de placa | 96 placa de pozo | 48 placa de pozo | 24 placa de pozo | 12 placa de pozo | 6 placas de pozo |
| volumen | 100 μL | 225–250 μL | 450–500 μL | 0.8–1 ml | 1.8–2 ml |
Tabla 1: Volumen de suspensión celular para diferentes formatos de placa. Los volúmenes se calculan a partir de una solución de 1 x 106 células/ml y proporcionan una densidad óptima para la fusión célula-célula.
| Fluoróforo, clon | Volumen (μL) por 106 células | |
| CD14 | PE/cianina7, HCD14 | 5 μL |
| OSCAR | FITC, REA494 | 10 μL |
| Búfer de clasificación de celdas | 80 μL |
Tabla 2: Solución de mezcla maestra de anticuerpos.
Figura complementaria 1: Tinción TRAP de la respuesta a dosis de RANKL. Los monocitos CD14+ se enriquecieron magnéticamente, se colocaron en 1 x 105 células/pocillo en placas de 96 pocillos y se incubaron durante la noche con 25 ng/mL M-CSF, como en la Figura 2. Las imágenes representativas de la tinción con TRAP muestran monocitos cebados con MCSF estimulados con concentraciones crecientes de RANKL (1 ng / ml, 25 ng / ml, 50 ng / ml y 100 ng / ml), fijados y teñidos para TRAP el día 7. Barras de escala: 400 μm. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Tinción en anillo de actuación en AO totalmente diferenciados. (A) Un aumento de 10x de OC diferenciado en plástico TC y teñido con faloidina AF647 (en rojo). Barra de escala: 400 μm. (B) Un aumento de 40x de OCs diferenciados en portaobjetos de cámara de vidrio y teñidos con faloidina AF488 (en amarillo). Barra de escala: 100 μm.Los núcleos están teñidos con DAPI, que se muestra en azul en (A) y en cian en (B). Haga clic aquí para descargar este archivo.
Figura complementaria 3: Efecto de diferentes lotes de FBS en la eficiencia de diferenciación de OC. Los AO se diferenciaron de los monocitos CD14+ en presencia de 25 ng/mL M-CSF y 50 ng/mL RANKL (MR) durante 7 días. Los pocillos de control tenían M-CSF solamente (M). (A) aumentos representativos de 10x (barras de escala: 400 μm) y (B) cuantificación de AO teñidos con TRAP diferenciados de un donante en dos lotes diferentes de FBS. Las barras de error muestran la media ± SD de tres réplicas técnicas. Haga clic aquí para descargar este archivo.
Discusión
El cultivo fácil y el aislamiento de un gran número de AO funcionales in vitro son importantes para avanzar en la comprensión de la biología ósea y las enfermedades mediadas por AO. Clásicamente, los AO se generaron en cocultivos con osteoblastos o células estromales y células hematopoyéticas del bazo o la médula ósea38,39. Un avance significativo en la comprensión de la osteoclastogénesis fue la identificación de RANKL como el principal regulador de la formación, diferenciación y supervivencia de AO40. Los primeros protocolos de los sistemas de cultivo dependientes de RANKL utilizaron PBMC para la generación de CO21,41,42. Sin embargo, estos cultivos mixtos son largos y presentan muchos factores de confusión que limitan la capacidad de probar los efectos directos sobre la diferenciación y función de AO. Este protocolo describe un modelo in vitro eficiente y fiable de osteoclastogénesis a partir de monocitos CD14+ periféricos humanos en el que se puede obtener una osteoclastogénesis óptima en 7 días (Figura 1 y Figura 2), que es considerablemente más rápida en comparación con otros protocolos43,44,45,46. Las principales características distintivas de este protocolo son (1) el uso de monocitos CD14+ purificados, (2) el cebado de los monocitos con M-CSF antes de la exposición a RANKL, (3) la duración del cultivo (<7 días) y (4) la detección fiable de la inhibición de la formación de CO (tinción TRAP) y la función (reabsorción, producción de ATP, reorganización del anillo de actina) con inhibidores.
Durante la optimización de la metodología, se identificaron varios puntos críticos. Se ha observado que la diferenciación in vitro de los AO depende en gran medida de la densidad de siembra de los monocitos CD14+. Así, en este protocolo, las células se siembran a una alta densidad (1 x 105 células/pocillo de una placa de 96 pocillos, en 100 μL de medio), ya que es esencial que las células puedan interactuar entre sí y estar cerca de fusionarse y convertirse en AOs maduros. Del mismo modo, la siembra de células a una densidad demasiado alta limita su diferenciación y crecimiento debido a las limitaciones del medio y la falta del espacio requerido. Además, para lograr el máximo éxito con este protocolo, es importante realizar la separación del gradiente de densidad cuidadosamente y garantizar que la población enriquecida de células CD14 + sea lo más pura posible. Por ejemplo, pasos de lavado inadecuados resultan en una falta de eliminación de plaquetas, lo que consecuentemente inhibe la diferenciación de AO47,48. Del mismo modo, la presencia de contaminación menor de células T en preparaciones aisladas de CD14+ estimuladas con M-CSF solo puede resultar en la diferenciación de OC, potencialmente a través de la secreción de RANKL por las células T49. Por lo tanto, es importante incluir un control M-CSF para cada experimento. También se recomienda un control de pureza de rutina, especialmente cuando se utiliza un nuevo kit de aislamiento, para garantizar la pureza de la muestra.
Los números óptimos de OC (rango: ~ 200-1,600 OC / pocillo) se logran utilizando α-MEM medio enriquecido con nucleósidos y L-glutamina. Otros medios de cultivo convencionales, incluyendo el medio de águila modificada de Dulbecco (DMEM) y el medio Roswell Park Memorial Institute (RPMI) 1640, afectan el rendimiento de OC. La fuente de FBS también puede influir en la osteoclastogénesis. Diferentes lotes de FBS pueden conducir a una reducción de la osteoclastogénesis derivada de RANK-L, así como a la aparición de un bajo número de células multinucleadas TRAP+ en los controles de M-CSF (Figura complementaria 3). Por lo tanto, para lograr resultados consistentes, se recomienda probar nuevos lotes de FBS antes de su uso y continuar con el mismo lote durante los experimentos para minimizar las variaciones en el proceso de diferenciación. Además, la variabilidad de donante a donante, en términos del número total de AO diferenciados obtenidos en el punto de tiempo final, constituye una limitación cuando se utiliza este protocolo para comparar, por ejemplo, donantes sanos con pacientes. En estos casos, es imperativo utilizar exactamente las mismas condiciones y el mismo lote de medios, FBS y otros reactivos.
Otro paso necesario para una diferenciación y maduración óptimas de OC es preparar los monocitos con M-CSF antes de la adición de RANKL. La exposición de las células a M-CSF 18-24 h antes de RANKL prepara los monocitos para regular al alza la expresión de RANK 15,26. La adición de RANKL en este punto de tiempo garantiza una diferenciación óptima de AO de una manera dependiente de la dosis. El grado de diferenciación de la CO varía de un donante a otro; sin embargo, 25 ng/ml de RANKL suele ser suficiente para diferenciar un alto número de AO en la mayoría de los donantes. Además, se pueden utilizar 25 ng/ml de RANKL en ensayos para el cribado inicial de compuestos, ya que facilita la evaluación de los efectos potenciadores e inhibitorios de los compuestos de ensayo. Otros sistemas de cultivo han utilizado tiempos de preincubación de M-CSF más largos antes de la adición de RANKL, pero esto resulta en un tiempo de cultivo más largo para la osteoclastogénesis50. Además, dejar que los monocitos cebados se incuben durante la noche les permite adherirse a la placa, aunque no en un estado completamente adherente. Por lo tanto, cuando se introduce RANKL por primera vez, el medio debe cambiarse a medias con mucho cuidado en lugar de cambiarse completamente para evitar el desprendimiento y la pérdida de los monocitos cebados. El medio también debe actualizarse cada 3-4 días para evitar el agotamiento del medio y prevenir la muerte celular. Además, debido al bajo volumen utilizado en este ensayo (100 μL/pocillo en una placa de 96 pocillos), es de suma importancia tener un marco de pocillos vacíos que se llenen con una solución acuosa (es decir,H2Odestilado estéril o PBS) alrededor de los pocillos de ensayo. Esto evita la evaporación media y los efectos de borde.
Finalmente, para los ensayos metabólicos (por ejemplo, ensayos de ATP), es imperativo que las células sean viables para evitar una gran desviación estándar entre las réplicas (Figura 5). La alta viabilidad de las células también es importante para clasificar las células y para el cultivo posterior de los AO ordenados (Figura 4). Este método, sin embargo, tiene varias limitaciones. Los AO completamente maduros son muy adherentes y difíciles de separar de las placas. Los AO más grandes a menudo son imposibles de separar, lo que puede conducir a un menor rendimiento celular. Por lo tanto, las células deben contarse después de la clasificación y antes del recubrimiento a la concentración requerida. Además, en el presente protocolo, se utiliza un método no enzimático (accutasa) para separar los AO para prevenir alteraciones de la membrana en la tinción superficial aguas abajo para la citometría de flujo. El uso de raspadores celulares (ambos con terminaciones blandas o duras) también se probó y condujo a una alta muerte celular. El desprendimiento enzimático utilizando soluciones de tripsina/EDTA al 0,05% se puede utilizar para un mayor rendimiento de OC desprendidos cuando no se requiere integridad de membrana para aplicaciones posteriores. Además, para evitar que los AO se agrupen, se recomienda encarecidamente el uso de una alta concentración de EDTA en todos los tampones después del desprendimiento celular, así como el filtrado adecuado antes de la adquisición de citometría de flujo. Es importante tener en cuenta que los cultivos de AO son una población heterogénea de células que consiste en AO maduros, precursores de AO y macrófagos. Los macrófagos pueden distinguirse fácilmente de los AO, aunque tanto los pre-OC mononucleares como los OC multinucleares expresan OSCAR y no pueden distinguirse con el método actual (Figura 4). De hecho, esta última cuestión constituye la principal limitación de este método. Además, una baja expresión de OSCAR también está presente en cultivos de M-CSF (Figura 4B) y podría indicar macrófagos que están preparados para el compromiso del linaje de AO. Es importante establecer la puerta para las celdas OSCAR+ en función de la señal de tinción FMO, como se muestra en la Figura 4B.
En resumen, este protocolo describe un método optimizado y robusto para la producción eficiente de AO activos y funcionalmente maduros a partir de monocitos humanos primarios circulantes. La fortaleza de este protocolo es su capacidad para generar AO en un corto período de tiempo y producir un alto número de AO diferenciados. Este método abre el camino para investigar los mecanismos básicos que subyacen a la diferenciación y función de la AO.
Divulgaciones
Los autores declaran que no tienen intereses contrapuestos.
Agradecimientos
Los autores agradecen a Flow Core Facility y Glasgow Imaging Facility (GIF) dentro de la Escuela de Infección e Inmunidad por su apoyo y asistencia en este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 well chamber slides | ibidi | 81816 | |
| 8-well glass chamber slides | Ibidi | 80807 | |
| 96-well TC plate | Corning | 3596 | |
| 96-well osteo assay stripwell plate | Corning | 3989 | |
| Acetate solution | Sigma Aldrich | 386-3 | from kit Cat No. 387A-1KT |
| Acetone | VWR | 20066.330 | |
| Acid phosphatase, Leukocyte (TRAP) kit | SIGMA-ALDRICH | 387A-1KT | |
| Alexa Fluor 488 Phalloidin | Theremo Fisher - Invitrogen | A12379 | AF488 |
| Alexa Fluor 647 Phalloidin | Thermo Fisher - Invitrogen | A22287 | AF647 |
| Alfa Aesar 2-Deoxy-D-glucose | Fisher Scientific | 11321867 | 2DG, 98% |
| Alpha minimum essential medium | gibco | 22571-020 | |
| ATPlite 1step | PerkinElmer | 6016731 | Luminiscence ATP detection assay system |
| BD FACSAria III cell sorter | BD Biosciences | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418-100G | |
| Cell culture microplate, 96-well, PS, F-bottom | Greiner bio-one | 655083 | White-bottom plates |
| Citrate solution | Sigma Aldrich | 91-5 | from kit Cat No. 387A-1KT |
| Corning 6ml round-bottom polystyrene test tubes | Fisher Scientific | 352054 | |
| Corning osteo assay surface multiple well plate | Sigma-Aldrich | CLS3989 | |
| Corning osteo assay Surface multiple well plate 1 x 8 stripwell | Corning | CLS3989-2EA | |
| DAPI | Theremo Fisher | D3571 | |
| EasySep human CD14 positive selection kit | STEMCELL Technologies | 17858 | |
| EasySep red blood cell lysis buffer (10x) | StemCell Technologies | 20110 | |
| eBioscience fixable viability dye eFluor 780 | Theremo Fisher - Invitrogen | 65-0865-14 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E7889-100ML | |
| EVOS FL auto imaging system | Thermo Fisher | A32678 | |
| Falcon round-bottom polypropylene test tubes with cap | Fisher Scientific | 10314791 | |
| Falcon tubes 15 mL | Corning | 430790 | |
| Falcon tubes 50 mL | Corning | 430828 | |
| Fast Garnet GBC base solution | Sigma Aldrich | 387-2 | from kit Cat No. 387A-1KT |
| Fetal bovine serum | gibco | 10500-064 | FBS |
| Ficoll-Paque Plus | cytiva | 17144003 | |
| Formaldehyde | Sigma-Aldrich | F-8775 | |
| Human sRANK ligand | PEPROTECH | 310-01-100UG | Receptor activator of nuclear factor kappa-B ligand (RANKL) |
| ImageJ Image analysis software | Image J | version 2.9.0 | |
| L-glutamine | gibco | 25030-024 | |
| Lithium heparin tubes (9 mL) | VACUETTE | 455084 | |
| Macrophage colony-stimulating factor | PEPROTECH | 300-25-100UG | M-CSF |
| Napthol AS-BI phosphoric acid solution | Sigma Aldrich | 387-1 | from kit Cat No. 387A-1KT |
| Neubauer hemacytometer counting chamber | Camlab | SKU 1127885 | |
| Oligomycin from Streptomyces Diastatochromogenes | Sigma-Aldrich | Q4876-5MG | |
| OSCAR Antibody, anti-human, Vio Bright FITC, REAfinit | Miltenyi Biotec | 130-107-661 and 130-107-617 | Clone REA494 |
| PE/Cyanine7 anti-human CD14 antibody | Biolegend | 325618 | Clone HCD14 |
| Penicilin/streptomycin | SIGMA | P0781 | |
| PHERAstar machine and software | BMG LABTECH | ||
| Phosphate-buffered saline (DPBS, 1x) | gibco | 14190-094 | |
| REA control antibody (S), human IgG1, Vio Bright FITC, REAfinity | Miltenyi Biotec | 130-113-443 | |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044-1L | |
| Sodium nitrite solution | Sigma Aldrich | 91-4 | from kit Cat No. 387A-1KT |
| Tartrate solution | Sigma Aldrich | 387-3 | from kit Cat No. 387A-1KT |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Trypan blue | Sigma-Aldrich | T8154-100ML |
Referencias
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Boyce, B. F., Xing, L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives Of Biochemistry and Biophysics. 473 (2), 139-146 (2008).
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Agemura, T., Hasegawa, T., Yari, S., Kikuta, J., Ishii, M. Arthritis-associated osteoclastogenic macrophages (AtoMs) participate in pathological bone erosion in rheumatoid arthritis. Immunological Medicine. 45 (1), 22-26 (2022).
- Hasegawa, T., et al. Identification of a novel arthritis-associated osteoclast precursor macrophage regulated by FoxM1. Nature Immunology. 20 (12), 1631-1643 (2019).
- Walsh, N. C., Crotti, T. N., Goldring, S. R., Gravallese, E. M. Rheumatic diseases: The effects of inflammation on bone. Immunological Reviews. 208 (1), 228-251 (2005).
- Gravallese, E. M., et al. Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis. The American Journal of Pathology. 152 (4), 943-951 (1998).
- Bromley, M., Woolley, D. E. Chondroclasts and osteoclasts at subchondral sites of erosion in the rheumatoid joint. Arthritis & Rheumatism. 27 (9), 968-975 (1984).
- Kleyer, A., Schett, G. Arthritis and bone loss: A hen and egg story. Current Opinion in Rheumatology. 26 (1), 80-84 (2014).
- Kawai, V. K., Stein, C. M., Perrien, D. S., Griffin, M. R. Effects of anti-tumor necrosis factor α (anti-TNF) agents on bone. Current Opinion in Rheumatology. 24 (5), 576-585 (2012).
- Siebert, S., Tsoukas, A., Robertson, J., McInnes, I. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases. Pharmacological Reviews. 67 (2), 280-309 (2015).
- Smiljanovic, B., et al. Monocyte alterations in rheumatoid arthritis are dominated by preterm release from bone marrow and prominent triggering in the joint. Annals of the Rheumatic Diseases. 77 (2), 300-308 (2018).
- Anderson, J. R., et al. 1H NMR metabolomics identifies underlying inflammatory pathology in osteoarthritis and rheumatoid arthritis synovial joints. Journal of Proteome Research. 17 (11), 3780-3790 (2018).
- McGarry, T., et al. Rheumatoid arthritis CD14+ monocytes display metabolic and inflammatory dysfunction, a phenotype that precedes clinical manifestation of disease. Clinical & Translational Immunology. 10 (1), 1237 (2021).
- Ansalone, C., et al. TNF is a homoeostatic regulator of distinct epigenetically primed human osteoclast precursors. Annals of the Rheumatic Diseases. 80 (6), 748-757 (2021).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis and Rheumatology. 73 (7), 1145-1154 (2021).
- Allard-Chamard, H., et al. Osteoclasts and their circulating precursors in rheumatoid arthritis: Relationships with disease activity and bone erosions. Bone Reports. 12, 100282 (2020).
- Takegahara, N., et al. Involvement of receptor activator of nuclear factor-κB ligand (RANKL)-induced incomplete cytokinesis in the polyploidization of osteoclasts. The Journal of Biological Chemistry. 291 (7), 3439-3454 (2016).
- Jansen, I. D. C., Vermeer, J. A. F., Bloemen, V., Stap, J., Everts, V. Osteoclast fusion and fission. Calcified Tissue International. 90 (6), 515-522 (2012).
- McDonald, M. M., et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 184 (5), 1330-1347 (2021).
- Lacey, D. L., et al. Bench to bedside: Elucidation of the OPG-RANK-RANKL pathway and the development of denosumab. Nature Reviews Drug Discovery. 11 (5), 401-419 (2012).
- Zhao, B., Grimes, S. N., Li, S., Hu, X., Ivashkiv, L. B. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J. The Journal of Experimental Medicine. 209 (2), 319-334 (2012).
- Zhao, B. Does TNF promote or restrain osteoclastogenesis and inflammatory bone resorption. Critical Reviews in Immunology. 38 (4), 253-261 (2018).
- Crotti, T. N., et al. Receptor activator NF-κB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Annals of the Rheumatic Diseases. 61 (12), 1047-1054 (2002).
- Kim, H. R., et al. Reciprocal activation of CD4+ T cells and synovial fibroblasts by stromal cell-derived factor 1 promotes RANKL expression and osteoclastogenesis in rheumatoid arthritis. Arthritis and Rheumatology. 66 (3), 538-548 (2014).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor κB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Hayman, A. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
- Nedeva, I. R., Vitale, M., Elson, A., Hoyland, J. A., Bella, J. Role of OSCAR signaling in osteoclastogenesis and bone disease. Frontiers in Cell and Developmental Biology. 9, 780 (2021).
- Boyce, B. F., Yoneda, T., Lowe, C., Soriano, P., Mundy, G. R. Requirement of pp60c-src expression for osteoclasts to form ruffled borders and resorb bone in mice. The Journal of Clinical Investigation. 90 (4), 1622-1627 (1992).
- Matsubara, T., et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin. Biochemical and Biophysical Research Communications. 489 (4), 472-476 (2017).
- Roscher, A., et al. The F-actin modulator SWAP-70 controls podosome patterning in osteoclasts. Bone Reports. 5, 214-221 (2016).
- Jurdic, P., Saltel, F., Chabadel, A., Destaing, O. Podosome and sealing zone: Specificity of the osteoclast model. European Journal of Cell Biology. 85 (3-4), 195-202 (2006).
- Francis, M. J. O., et al. ATPase pumps in osteoclasts and osteoblasts. The International Journal of Biochemistry & Cell Biology. 34 (5), 459-476 (2002).
- Kwak, H. B., et al. Inhibition of osteoclast differentiation and bone resorption by rotenone, through down-regulation of RANKL-induced c-Fos and NFATc1 expression. Bone. 46 (3), 724-731 (2010).
- Massey, H. M., Flanagan, A. M. Human osteoclasts derive from CD14-positive monocytes. British Journal of Haematology. 106 (1), 167-170 (1999).
- Xue, J., et al. CD14+CD16-monocytes are the main precursors of osteoclasts in rheumatoid arthritis via expressing Tyro3TK. Arthritis Research and Therapy. 22 (1), 221 (2020).
- Marco-Casanova, P., et al. Preparation of peripheral blood mononuclear cell pellets and plasma from a single blood draw at clinical trial sites for biomarker analysis. Journal of Visualized Experiments. (169), e60776 (2021).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Matsuzaki, K., et al. Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. Biochemical and Biophysical Research Communications. 246 (1), 199-204 (1998).
- Shalhoub, V., et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell precursors. Journal of Cellular Biochemistry. 72 (2), 251-261 (1999).
- Neale, S. D., Smith, R., Wass, J. A. H., Athanasou, N. A. Osteoclast differentiation from circulating mononuclear precursors in Paget's disease is hypersensitive to 1,25-dihydroxyvitamin D3 and RANKL. Bone. 27 (3), 409-416 (2000).
- Abdallah, D., et al. An optimized method to generate human active osteoclasts from peripheral blood monocytes. Frontiers in Immunology. 9, 632 (2018).
- Komano, Y., Nanki, T., Hayashida, K., Taniguchi, K., Nobuyuki, M. Identification of a human peripheral blood monocyte subset that differentiates into osteoclasts. Arthritis Research and Therapy. 8 (5), 152 (2006).
- Kylmäoja, E., et al. Peripheral blood monocytes show increased osteoclast differentiation potential compared to bone marrow monocytes. Heliyon. 4 (9), 00780 (2018).
- Wang, D., et al. Platelet-rich plasma inhibits RANKL-induced osteoclast differentiation through activation of Wnt pathway during bone remodeling. International Journal of Molecular Medicine. 41 (2), 729-738 (2018).
- Cenni, E., Avnet, S., Fotia, C., Salerno, M., Baldini, N. Platelet-rich plasma impairs osteoclast generation from human precursors of peripheral blood. Journal of Orthopaedic Research. 28 (6), 792-797 (2010).
- D'Amico, L., Roato, I. Cross-talk between T cells and osteoclasts in bone resorption. BoneKEy Reports. 1 (6), 82 (2012).
- Quinn, J. M. W., Elliott, J., Gillespie, M. T., Martin, T. J. A combination of osteoclast differentiation factor and macrophage-colony stimulating factor is sufficient for both human and mouse osteoclast formation in vitro. Endocrinology. 139 (10), 4424-4427 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados