Method Article
Diferenciação de Osteoclastos Funcionais de Monócitos CD14+ do Sangue Periférico Humano
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os osteoclastos são células-chave de reabsorção óssea no corpo. Este protocolo descreve um método confiável para a diferenciação in vitro de osteoclastos de monócitos de sangue periférico humano. Este método pode ser utilizado como uma importante ferramenta para o entendimento da biologia dos osteoclastos na homeostase e nas doenças.
Resumo
Os osteoclastos (COs) são células reabsorvedoras de osso que desempenham um papel fundamental no desenvolvimento esquelético e na remodelação óssea do adulto. Vários distúrbios ósseos são causados pelo aumento da diferenciação e ativação dos CO, de modo que a inibição dessa patobiologia é um princípio terapêutico fundamental. Dois fatores-chave direcionam a diferenciação de OCs de precursores mieloides: fator estimulador de colônias de macrófagos (M-CSF) e ativador do receptor do ligante do fator nuclear kappa-B (RANKL). Os monócitos CD14+ circulantes humanos são conhecidos por se diferenciarem em CO in vitro. Entretanto, o tempo de exposição e a concentração de RANKL influenciam na eficiência da diferenciação. De fato, protocolos para a geração de CO humanos in vitro têm sido descritos, mas muitas vezes resultam em um processo de diferenciação pobre e demorado. Aqui, um protocolo robusto e padronizado para gerar OCs humanos maduros funcionalmente ativos em tempo hábil é fornecido. Os monócitos CD14+ são enriquecidos a partir de células mononucleares do sangue periférico humano (PBMCs) e preparados com M-CSF para upregulation RANK. A exposição subsequente ao RANKL gera CO de maneira dose-dependente e tempo-dependente. Os CO são identificados e quantificados por coloração com fosfatase resistente ao ácido tartarato (TRAP) e análise por microscopia óptica. A coloração por imunofluorescência de núcleos e F-actina é usada para identificar OCs funcionalmente ativos. Além disso, os OCs maduros OSCAR+CD14− são ainda mais enriquecidos por meio da classificação celular por citometria de fluxo e funcionalidade do OC quantificada por ensaios de reabsorção mineral (ou dentina/osso) e formação de anéis de actina. Finalmente, um conhecido inibidor de CO, a rotenona, é usado em CO maduros, demonstrando que a produção de trifosfato de adenosina (ATP) é essencial para a integridade do anel de actina e função do CO. Em conclusão, um ensaio robusto para diferenciar altos números de CO é estabelecido neste trabalho, que em combinação com a coloração com anel de actina e um ensaio de ATP fornece um modelo in vitro útil para avaliar a função dos CO e selecionar novos compostos terapêuticos que possam modular o processo de diferenciação.
Introdução
Os osteoclastos (OCs) são células gigantes multinucleadas de linhagem hematopoética com capacidade única de reabsorção óssea. São responsáveis pelo desenvolvimento e remodelação contínua do esqueleto1,2. Nas fases esqueléticas do desenvolvimento, os CO e macrófagos residentes no tecido são derivados de progenitores eritro-mieloides e colonizam o nicho ósseo e os tecidos orgânicos. Em condições fisiológicas, progenitores eritromieloides são necessários para o desenvolvimento ósseo normal e erupção dentária, enquanto o influxo de monócitos sanguíneos circulantes para o nicho ósseo proporciona manutenção pós-natal dos COs, da massa óssea e da cavidade da medula óssea3. Em condições patológicas, monócitos são recrutados para locais de inflamação ativa e podem contribuir para a destruição óssea patológica 4,5.
Pacientes com várias formas de artrite experimentam inflamação articular, levando à destruição articular progressiva causada por CO6. Por exemplo, na artrite reumatoide (AR), as CO superativadas são responsáveis pela erosão óssea patológica e destruiçãoarticular7,8, e os tratamentos atuais muitas vezes não melhoram ou interrompem o dano ósseo9,10,11. Alterações nos monócitos circulantes, tanto em termos de distribuição populacional quanto de assinaturas transcriptômicas e epigenéticas, têm sido relatadas em pacientes com AR12,13,14. Além disso, tem sido relatado que respostas alteradas de monócitos à estimulação inflamatória afetam a osteoclastogênese em pacientes com AR com doença ativa15,16,17.
A diferenciação de COs é um processo complexo de várias etapas que compreende o comprometimento das células precursoras mieloides com a diferenciação em precursores de CO. Durante a osteoclastogênese, os CO tornam-se gigantes e multinucleados através da fusão célula-célula, citocinese incompleta e um processo de reciclagem nuclear descrito como fissão e fusão18,19,20. A capacidade de diferenciar CO in vitro tem permitido avanços significativos no entendimento da biologiaóssea21. Os OCs diferenciam-se dos precursores após exposição ao fator estimulador de colônias de macrófagos (M-CSF) e ao receptor ativador do ligante do fator nuclear kappa-B (RANKL). Esta última é essencial para o desenvolvimento e função normais dos CO in vitro e in vivo, mesmo em condições inflamatórias6,22,23. O RANKL é apresentado por osteoblastos e osteócitos, bem como por células T ativadas e fibroblastos na sinóvia da AR inflamada2,24,25. Durante o processo de diferenciação do CO, monócitos expostos ao receptor M-CSF upregulate ativador da expressão do fator nuclear kappa-B (RANK) em sua membrana celular e, sob estimulação subsequente com RANKL, diferenciam-se em pré-OCs mononucleares positivos para fosfatase ácida resistente ao tartarato (TRAP) e, em seguida, em OCs multinucleados15,26. Os CO produzem várias enzimas, sendo a principal delas a TRAP, que possibilita a degradação de fosfoproteínas no interior do osso27. Um regulador e marcador de diferenciação de OC é o receptor associado ao OC (OSCAR). É upregulated precocemente em células precursoras que se comprometem com a linhagem OC28. OCs gigantes multinucleados maduros podem degradar (reabsorver) a matriz esquelética gerando uma grande zona de vedação, que é feita de um anel de actina ao redor de uma borda babada21,29,30. A capacidade de reabsorção óssea dos CO requer a reorganização do citoesqueleto e a consequente polarização e formação de uma membrana contorcida, que é a chamada borda babada. A borda babada é cercada por uma grande faixa circular de uma estrutura rica em F-actina, que é o anel de actina ou zona de vedação. A integridade do anel de actina é essencial para que os COs reabsorvam osso tanto in vitro quanto in vivo, e a formação defeituosa de bordas babadas está associada à menor expressão vacuolar de adenosina trifosfatase (V-ATPase)31,32,33. Além disso, os CO são células ricas em mitocôndrias, e o trifosfato de adenosina (ATP) associa-se a estruturas mitocondriais semelhantes às CO localizadas na borda babada31,32,33. A rotenona atua como um forte inibidor do complexo mitocondrial I e afeta a produção de ATP. Também foi demonstrado que a rotenona inibe a diferenciação e a função da CO34.
Este protocolo descreve um método eficiente e otimizado de osteoclastogênese in vitro a partir de amostras de sangue periférico humano. No sangue periférico humano, os monócitos CD14+ são a principal fonte de FO15,35,36. Neste protocolo, a cinética de exposição e as concentrações de M-CSF e RANKL foram ajustadas para osteoclastogênese ótima. As células mononucleares são primeiramente separadas dos eritrócitos e granulócitos presentes no sangue total por gradiente de densidade; eles são então enriquecidos para monócitos CD14+ usando seleção positiva por esferas magnéticas. Os monócitos CD14+ isolados são então incubados durante a noite com M-CSF. Isso prepara os monócitos para upregulation da expressão de RANK15,26. A adição subsequente de RANKL induz osteoclastogênese e multinucleação de forma tempo-dependente. Os OCs de reabsorção ativa mostram a distribuição característica dos anéis de actina F na borda da membrana celular30,32 e coloração para TRAP. Os CO maduros são analisados quantificando-se as células multinucleadas (mais de três núcleos) TRAP+. A capacidade funcional de CO maduros pode ser avaliada por sua reabsorção, integridade do anel de actina e produção de ATP. Além disso, OCs CD14− OSCAR+ diferenciados podem ser enriquecidos e usados para avaliar os efeitos de certos compostos na funcionalidade do OC via reabsorção mineral (ou dentina) e organização da F-actina. Além disso, neste trabalho, um conhecido inibidor de CO, a rotenona, é usado como um exemplo de um composto que afeta a funcionalidade de COs. A redução da atividade de reabsorção de CO sob rotenona está associada à redução da produção de ATP e fragmentação do anel de actina. Em conclusão, este protocolo estabelece um ensaio robusto que pode ser usado como um método de referência para estudar vários aspectos biológicos da diferenciação e função dos CO in vitro.
Essa metodologia pode ser usada para avaliar (1) o potencial dos monócitos circulantes para se diferenciarem em CO na saúde e na doença, bem como (2) o impacto de candidatos terapêuticos na diferenciação e função dos CO. Este robusto protocolo de osteoclastogênese permite determinar a eficácia e os mecanismos das terapias-alvo ósseas tanto na diferenciação de CO de células precursoras quanto na função de COs maduros.
Protocolo
Casacos de buffy obtidos do Serviço Nacional de Transfusão de Sangue da Escócia (Edimburgo) e cones de leucócitos obtidos do NHS Blood and Transplant (Newcastle) são fornecidos aos pesquisadores da Universidade de Glasgow de forma totalmente anônima (não identificável) de doadores de sangue do NHS totalmente consentidos. O buffy coat e os componentes sanguíneos do cone de leucócitos são produzidos a partir de uma doação de sangue padrão do NHS dada em um centro de doadores de sangue do NHS na Escócia ou na Inglaterra. O dador de sangue dá consentimento informado no momento da dádiva de sangue para o sangue excedentário não utilizado na prática clínica padrão do NHS para ser utilizado em estudos de investigação médica aprovados. A aprovação ética do Comitê de Ética em Pesquisa do NHS e o termo de consentimento assinado pelo doador para o uso dessas doações de sangue são de posse do serviço de doação de sangue do NHS. A aprovação para acessar e usar essas doações de sangue consentidas em estudos de pesquisa médica aprovados foi buscada e obtida usando o processo interno padrão de solicitação e revisão do Serviço Nacional de Transfusão de Sangue (Escócia) e NHS Blood and Transport (Inglaterra). Nenhuma outra aprovação do NHS REC ou aprovação interna do comitê de ética da Universidade de Glasgow foi necessária para usar os componentes sanguíneos para os estudos de pesquisa médica aprovados.
1. Notas gerais antes de iniciar
- Prossiga com todo o trabalho com sangue com cautela. Considere os perigos potenciais de vários agentes infecciosos que podem estar presentes nas amostras.
- Realizar todo o trabalho com cautela no laboratório de biossegurança em condições estéreis, usando luvas e jalecos.
- Realizar o descarte de biossegurança de acordo com as orientações locais.
- Obter consentimento adequado e aprovações éticas antes da coleta de amostras, de acordo com os regulamentos das autoridades locais.
- Geralmente, 1 mL de sangue fresco produzirá 1 milhão de CMSP, e os monócitos CD14+ representam aproximadamente 10%-30% das CMSP. Em comparação, 10 mL de um cone de leucócitos podem conter 5 x 10 8-15 x 108 PBMCs. Para obter mais detalhes sobre o isolamento do PBMC, consulte um protocolo anterior37.
2. Isolamento de células mononucleares do sangue periférico (CMSP) do sangue total
- Coletar o volume necessário de sangue fresco de doadores saudáveis em tubos de coleta de heparina de lítio.
NOTA: Outros tubos de coleta com anticoagulantes apropriados também podem ser usados (por exemplo, tubos de heparina sódica). Para contagens de células mais altas, podem ser usados cones de leucócitos ou buffy coats. - Para isolar as CMSP, transfira o sangue para um novo tubo de 50 mL e dilua-o com solução salina estéril 1x tamponada com fosfato (PBS) em uma proporção de 1:1 ou 1:3 para sangue fresco ou cones de leucócitos/buffy coats, respectivamente.
- Misture suavemente as células várias vezes por inversão.
- Preparar tubos de 15 mL contendo 3 mL de meio de gradiente de densidade. Colocar lentamente 8-10 mL de sangue diluído no topo do meio de gradiente de densidade e centrifugar a 400 x g por 30 min à temperatura ambiente (TR) sem freio.
NOTA: Aplique o sangue cuidadosamente sobre o meio de gradiente de densidade para evitar a mistura. A mistura pode resultar na perda de PBMCs. - Descarte cuidadosamente a camada superior (contendo o plasma) com uma pipeta de Pasteur, colete a camada interfásica inferior que contém os PBMCs (estrutura branca, em forma de anel) e transfira essa camada para um novo tubo de 50 mL.
- Suspender as células com PBS estéril 1x até 50 mL e lavar o meio de gradiente de densidade residual centrifugando a 300 x g por 10 min em TR com freio total.
- Para remover as plaquetas residuais, repita o processo com um giro mais lento adicional a 200 x g por 10 min no RT sem freio.
- Opcional: Para remover o transporte de glóbulos vermelhos, diluir o tampão de lise de hemácias (10x, Tabela de Materiais) 1:10 em água destilada e aplicar 3 mL do tampão diluído sobre o pellet. Misture e incube por 3 min. Lave o pellet em até 50 mL de 1x PBS e centrifugue a 300 x g por 10 min em RT com freio completo.
- Ressuspender as CMSP isoladas e purificadas em 20 mL de PBS 1x e contá-las usando um hemacitômetro ou seguindo outros métodos padrão.
NOTA: Os métodos de diluição e contagem de células devem ser ajustados em conformidade com base na densidade celular e no dispositivo de contagem utilizado.
3. Enriquecimento de monócitos CD14+ de CMSP
- Isolar monócitos CD14+ das CMSP com um kit de seleção de CD14+ humano de acordo com o protocolo do fabricante (Tabela de Materiais).
NOTA: Os monócitos CD14+CD16− clássicos são a principal fonte de precursores do OC35; métodos alternativos de purificação podem ser considerados. - Transfira 1 x 107 PBMCs para um tubo de fundo redondo de poliestireno adequado (ou seja, que se encaixe no ímã do kit de seleção) e pastilha as células a 300 x g por 5 min.
- Eliminar o sobrenadante, ressuspender o pellet celular em tampão de separação celular (PBS, soro fetal bovino a 2% [SFB], ácido etilenodiaminotetracético 1 mM [EDTA]) até uma concentração final de 1 x 108 células/mL e incubar com 10 μL de coquetel de anticorpos por 100 μL com a tampa ligada por 10 min.
NOTA: As células são ressuspensas em 1 x 108 células/mL; ajustar os volumes de acordo. - Após a incubação, adicionar 10 μL das esferas de nanopartículas magnéticas por 100 μL e incubar por 3 min com a tampa ligada.
NOTA: Ajustar os volumes do cocktail de anticorpos e das esferas magnéticas para obter uma concentração de 10 μL/mL. - Completar o volume para 2,5 mL com o tampão de separação celular, colocar o tubo em um ímã (sem a tampa) e incubar por 3 min. Descarte a população celular negativa por um movimento contínuo por inversão enquanto o tubo ainda está no ímã.
NOTA: Se estiver a utilizar >2 x 108 PBMCs e um íman maior, carregue até 5 ml ou 10 ml com tampão de separação celular seguindo as instruções do fabricante. - Retire o tubo do ímã e lave os monócitos CD14+ enriquecidos ligados às esferas magnéticas ressuspendendo-os em 2,5 mL do tampão de separação celular. Incube por 3 min dentro do ímã como antes, descarte a fração negativa e repita mais uma vez.
- Centrifugar todas as células coletadas a 300 x g por 5 min, descartar o sobrenadante e ressuspender as células em 5 mL de meio essencial mínimo alfa (α-MEM; Tabela de Materiais) suplementado com 1% de L-glutamina, 1% de penicilina/estreptomicina (α-MEM completa) e 10% de SFB.
NOTA: Recomenda-se uma verificação de pureza pós-enriquecimento por citometria de fluxo e ≥96% de pureza deve ser esperada. Etapas adicionais de lavagem (passo 3.6) podem aumentar a pureza.
4. Diferenciação de CO in vitro
- Conte os monócitos CD14+ enriquecidos usando um hemicômetro.
- Pellet as células a 300 x g por 5 min, e ressuspender a 1 x 106 células/mL em α-MEM completo suplementado com FBS a 10%.
- Para diferenciar os COs, adicionar M-CSF a uma concentração final de 25 ng/mL à suspensão celular.
NOTA: Para 1 mL de suspensão celular, adicionar 0,25 μL de M-CSF a partir de uma concentração estoque de 100 μg/mL. - Misturar por pipetagem abundante para homogeneizar a suspensão celular e a placa de 100 μL/poço numa placa de fundo plano de 96 poços até uma densidade celular final de 1 x 105 células/poço.
- Adicionar 200 μL/poço de água destilada estéril nos poços ao redor das células plaqueadas para evitar evaporação do meio e efeitos de borda no sistema de cultura.
- Incubar as células durante a noite, por aproximadamente 18-20 h, a 37 °C com 5% de CO2.
- Após a incubação durante a noite, remova cuidadosamente metade do meio (50 μL/poço) por aspiração usando uma pipeta P200, evitando tocar o fundo do poço, e substitua por α-MEM completo fresco contendo 10% FBS, 25 ng/mL M-CSF e 50 ng/mL RANKL para uma concentração final de 25 ng/mL
NOTA: Para 1 mL de meio, adicionar 0,25 μL de M-CSF e 0,5 μL de RANKL a partir de uma concentração estoque de 100 μg/mL. - Troque a mídia a cada 3 dias e diferencie as células em COs por 7-14 dias (Figura 1).
NOTA: Manter as concentrações de M-CSF e RANKL consistentes durante toda a cultura.
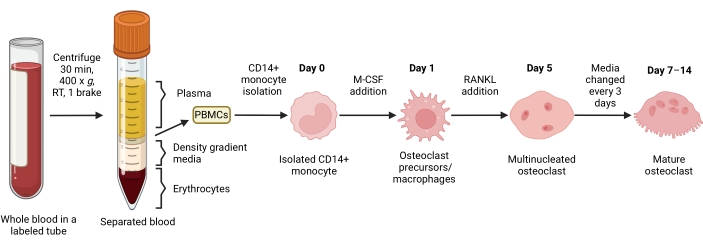
Figura 1: Fluxo de trabalho de diferenciação de OC. Visão geral esquemática do isolamento de monócitos CD14+ de PBMCs e diferenciação em OCs maduros na presença de M-CSF e RANKL por 7-14 dias. TR = temperatura ambiente. Imagem criada com BioRender.com. Clique aqui para ver uma versão maior desta figura.
5. Coloração TRAP para osteoclastos
- Retire cuidadosamente o meio, fixe os OCs aderentes diferenciados com 100 μL/poço da solução fixadora previamente preparada e incube por 1 min. Não toque no fundo dos poços para evitar arranhar as células aderentes.
NOTA: A solução fixadora é preparada da seguinte forma: 12,5 mL de solução de citrato (incluída no kit de coloração TRAP), 32,5 mL de acetona e 5 mL de formaldeído a 37%. - Lavar os poços três vezes com 300 μL de água destilada estéril. Seque as placas após a lavagem.
- Preparar uma solução corante de acordo com as instruções do fabricante (Tabela de Materiais); adicionar 5 μL de Fast Garnet e 5 μL de nitrito de sódio para fazer a solução de Fast Garnet; misturar por inversão e incubar por 3 min em RT. Preparar 1 mL de solução corante misturando 900 μL de água destilada estéril, 10 μL de naftol, 40 μL de solução de acetato, 50 μL de solução de tartarato e 10 μL de solução de Fast Garnet.
- Adicionar 100 μL/poço de solução corante recém-preparada e incubar a placa a 37 °C no escuro durante 20 minutos.
- Após a incubação, retirar a solução corante por inversão e lavar a placa três vezes com 300 μL/poço de água destilada.
- Retire o excesso de água batendo os pratos em papel toalha. Deixe as placas abertas e protegidas da luz para secar ao ar durante a noite.
OBS: As placas secas podem ser armazenadas por até 6 meses. Às vezes, tampões residuais podem promover o desenvolvimento de mofo, que é visível sob o microscópio; Isso pode ser removido a qualquer momento, lavando os poços afetados com água destilada e deixando-os secar ao ar novamente. - Tire fotos a 10x ou 20x usando um microscópio de campo brilhante com uma opção de telha para capturar toda a superfície do poço.
- Conte manualmente os OCs identificados como células coradas de roxo TRAP+ com mais de três núcleos usando um software de análise de imagem com um plugin de contador de células.
NOTA: O número de OCs TRAP+ por poço é dependente do doador e pode variar de ~200-1.600 OCs/poço, com uma média de cerca de 1.000 OCs/poço. Além disso, para análise dos dados, os números de CO devem ser determinados em três poços diferentes (réplicas técnicas), e a média deve ser calculada para cada condição e para cada réplica biológica.
6. Ensaio de reabsorção óssea
- Planear os monócitos CD14+ recém-enriquecidos em placas de ososensaio de 96 poços revestidas com fosfato de cálcio a 1 x 105 células/poço e diferenciar os COs por 7-14 dias, conforme indicado nas etapas 4.1-4.8, e trocar o meio a cada 3 dias.
NOTA: Dentina/marfim ou cortes de osso cortical bovino podem ser usados no lugar de placas de ossoensaio. Nesse caso, o tempo total da cultura deve ser prolongado para 14-21 dias devido ao substrato mais complexo a ser reabsorvido. - Ao final, remova cuidadosamente o meio, evitando tocar no fundo do poço, e lise as células com solução de hipoclorito de sódio a 10%. Lave os poços três vezes com água destilada.
- Digitalize as placas secas usando um microscópio de campo claro e analise/quantifique as imagens adquiridas das cavidades de reabsorção usando um software de análise de imagens.
7. Coloração fluorescente com anel de actina
- Placa 100 μL/poço dos monócitos CD14+ isolados em lâmina de câmara de 18 poços a uma densidade celular de 1 x 105 células/poço. Diferenciar os COs na presença de M-CSF e RANKL conforme descrito anteriormente (passos 4.1-4.8), incluindo a troca do meio a cada 3 dias.
- No ponto final, remova suavemente o meio e lave cada poço duas vezes com 200 μL/poço de PBS pré-aquecido, pH 7,4. Não deixe os poços secarem entre nenhuma das etapas.
- Fixar a amostra com 100 μL/poço de solução de formaldeído a 4% em PBS e incubar durante 10 minutos em RT num agitador orbital com agitação suave.
NOTA: O metanol pode interromper a actina durante o processo de fixação. Portanto, é melhor evitar quaisquer fixadores contendo metanol. O fixador preferido é o formaldeído livre de metanol. O agitador orbital utilizado nesta etapa do protocolo foi ajustado para uma configuração de potência de 3 em 10. - Lavar duas vezes com 200 μL/poço de PBS, permeabilizar as células com 100 μL/poço de solução de Triton X-100 a 0,1% diluída em PBS e incubar por 10 min em RT em um agitador orbital com agitação suave.
- Lavar duas vezes com 200 μL/poço de PBS. Para bloquear a ligação inespecífica e aumentar o sinal, adicionar 100 μL/poço de solução de bloqueio feita com albumina de soro bovino a 2% (BSA)/solução de PBS. Incubar por 20 min no RT em um agitador orbital com agitação suave.
- Remover a solução de bloqueio e adicionar 100 μL/poço de solução de faloidina conjugada fluorescentemente diluída em solução de BSA/PBS a 2%. Incubar por 20 min em RT em um agitador orbital com agitação suave e protegido da luz.
NOTA: Ajustar a concentração do corante faloidina de acordo com as recomendações do fabricante. - Lavar duas vezes com 200 μL/poço de PBS, manchar os núcleos com 100 μL/poço de uma solução de PBS contendo 300 nM DAPI e incubar por 10-15 min em RT em um agitador orbital com agitação suave e protegido da luz.
NOTA: DAPI é diluído em água destilada para fazer uma solução-mãe DAPI de 14,3 mM (5 mg/mL). A solução-mãe é posteriormente diluída até à concentração final de 300 μM. Finalmente, a solução de 300 μM DAPI é diluída mais uma vez em PBS até uma concentração final de 300 nM. - Após 10-15 min, remova a solução DAPI e substitua-a por PBS de 100 μL/poço.
NOTA: Dependendo das lâminas da câmara escolhidas, armazene com um volume apropriado de PBS (100 μL/poço para lâminas de câmara de 18 poços) ou monte a lâmina com lamínulas e um meio de montagem apropriado. As corrediças da câmara podem ser armazenadas por até 1 semana na geladeira. Para lâminas de câmara de 18 poços, use um volume de coloração de 50-100 μL e 200-300 μL para lavagem. Aumente a escala para os outros tamanhos de lâmina da câmara de acordo. Para evitar a evaporação, mantenha as lamínulas dentro de um recipiente coberto durante os tempos de incubação. O uso de um agitador orbital é recomendado, mas não essencial. - Visualize a coloração usando imunofluorescência apropriada ou microscópios confocais e aumentos entre 4x a 40x.
8. Enriquecimento de OCs maduros e precursores de CO via classificação por citometria de fluxo
- Ressuspender os monócitos CD14+ recém-enriquecidos em 1 x 106 células/mL e diferenciá-los em COs maduros na presença de M-CSF e RANKL da mesma forma como descrito acima (passos 4.1-4.8).
NOTA: Ao escalar de uma placa de 96 poços para um tamanho de placa maior, siga a Tabela 1; esses volumes são calculados a partir de uma solução de 1 x 106 células/mL e fornecem uma densidade ótima para a fusão célula-célula. - No dia 7, lavar os poços uma vez com PBS aquecido e adicionar 50 μL a 1 mL (volume determinado pelo tamanho da placa utilizada) de accutase. Incubar as células a 37 °C com 5% de CO2 durante 20 min.
- Após a incubação, verifique as placas sob um microscópio de luz para ver se as células se destacaram. Além disso, desprenda as células batendo as placas em todos os lados e pipetando-as para cima e para baixo.
- Recolher a suspensão celular num tubo cónico de 15 ml. Lave os poços com PBS quente (sem Ca 2+, sem Mg2+) e combine-os com a suspensão celular. Repita as etapas 8.2-8.3 uma ou duas vezes até que a maioria das células se desprenda.
NOTA: Accutase, o método recomendado antes da coloração de superfície para análise por citometria de fluxo, não destaca OCs muito grandes. A taxa de recuperação é de ~50%-70%. - Centrifugar as células a 300 x g por 5 min, ressuspender o pellet celular em 1 mL de PBS e contar as células por exclusão de azul de tripano.
- Ressuspender as células a 1 x 106 células/mL, remover 100 μL correspondentes a 1 x 105 células e transferir essas células para um novo tubo de ensaio de polipropileno. Adicione 200 μL do tampão de classificação celular e reserve-o no gelo como controle sem manchas.
- Manchar o restante das células com corante vivo/morto diluído a 1:750 por 10 min no TR e protegido da luz.
NOTA: A coloração viva/morta precisa ser realizada na ausência de FBS para evitar alta coloração de fundo. - Completar o tubo de coleta de 15 mL contendo a suspensão de células vivas/mortas coradas com tampão de triagem de células quentes (1x PBS, sem Ca 2+, sem Mg2+, 1% FBS e 5 mM EDTA) e centrifugando a 300 x g por 5 min para pellet as células.
NOTA: Uma alta concentração de EDTA e uma baixa concentração de FBS são recomendadas no tampão de classificação para evitar aglomerados celulares. - Remover um volume correspondente a 1 x 105 células e transferi-las para um novo tubo de ensaio de polipropileno para o controle do isotipo OSCAR. Transfira todas as células restantes para outro tubo de ensaio de polipropileno para coloração e classificação celular.
NOTA: Os tubos de ensaio de polipropileno são usados para a classificação, pois as células são menos propensas a aderir a esses tubos do que aos tubos de poliestireno. - Gire os tubos a 400 x g por 5 min para pellet as células, e descarte o sobrenadante em excesso por inversão.
- Ressuspender o pellet de células em uma solução de mistura mestre de anticorpos preparada a seguir à Tabela 2. Manchar o tubo de controle do isotipo OSCAR com o anticorpo CD14 e o controle do isotipo OSCAR no lugar do anticorpo OSCAR.
- Incubar as células a 4 °C protegidas da luz durante 30 minutos.
- Após 30 min, lavar as células adicionando cinco volumes do tampão de triagem celular e centrifugar a 400 x g por 5 min a 4 °C.
- Ressuspenda as células em 300-1.000 μL de tampão de triagem de células frias e adquira as células usando uma máquina de classificação por citometria de fluxo equipada com um bico de 100μM.
NOTA: OCs são células muito pegajosas, por isso é importante filtrá-las através de uma membrana estéril de 70 μm antes da classificação. - Porte os OCs e pré-OCs como CD14−OSCAR+. Ajuste o portão OSCAR+ com base no tubo de controle do isotipo OSCAR.
- Coletar as células selecionadas em tubos de ensaio de polipropileno contendo α-MEM completo suplementado com 20% de FBS a 8 °C.
- Após a triagem, granule as células por centrifugação a 300 x g por 5 min em RT, conte as células e ressuspenda para aplicações a jusante.
NOTA: Normalmente, para obter ~1 x 105 pré-OCs/OCs classificados, comece a partir de ~10 x 106 células plaqueadas no dia 0. A baixa taxa de recuperação é influenciada pela perda celular durante o desprendimento com acutase e pelo processamento para coloração e classificação. Recomenda-se realizar todo o procedimento usando tampões e reagentes estéreis, e trabalhar em condições estéreis.
9. Ensaio de ATP para atividade mitocondrial
- Incubar os monócitos CD14+ enriquecidos na presença de M-CSF e RANKL em uma placa de 96 poços da mesma forma como descrito anteriormente (passos 4.1-4.8). Placa quatro condições extras em triplicatas para usar como controles.
- Realizar o ensaio de ATP com o kit de ensaio de detecção de ATP de luminescência de acordo com o manual do fabricante. Resumidamente, para preparar a solução de ATP, adicione 10 mL da solução tampão de substrato ao substrato liofilizado e deixe incubar em TR por 30 min.
NOTA: Diferentes métodos podem ser usados para medir a produção de ATP intracelular. Neste trabalho, utilizamos a detecção da produção de ATP por luminescência. - Durante a incubação, preparar e adicionar os controles diretamente aos poços de controle da seguinte forma: 2-Deoxi-D-glicose (2DG) a 10 mM e 100 mM, oligomicina a 1 μM e 2DG 100 mM em combinação com oligomicina 1 μM. Incubar durante 30 min a 37 °C com 5% de CO2.
NOTA: A 2DG bloqueia a glicólise, enquanto a oligomicina é um inibidor da fosforilação oxidativa. A combinação desses dois inibidores resulta na perda completa da produção de ATP via glicólise e fosforilação oxidativa, o que significa que eles servem como um controle interno para o ensaio de ATP. Para controles 2DG 10 mM e 100 mM, adicionar 0,5 μL e 5 μL de solução-estoque 2M 2DG por poço de cultura de 100 μL, respectivamente. Para 1 μM de oligomicina, diluir a solução-mãe de 5 mM 1:100 em meio e adicionar 2 μL/poço aos poços de controle dedicados. Para o último controle, adicionar 5 μL de 2DG e 2 μL de solução diluída de oligomicina por poço. - Adicionar 50 μL da solução de ATP a cada poço para parar a reação e incubar em RT em um agitador a 700 rpm por 5-10 min protegido da luz.
- Transfira 100 μL do sobrenadante para uma placa de fundo branco de 96 poços específica para o ensaio de ATP e leia a placa usando um leitor de luminescência.
Resultados
Geração de OC a partir de monócitos CD14+
Este método visou diferenciar facilmente um grande número de CO de monócitos CD14+ do sangue periférico humano in vitro, tipicamente em 1 semana. Primeiramente, monócitos CD14+ foram enriquecidos a partir de CMSP e preparados com M-CSF durante a noite para upregulation RANK, como relatado anteriormente15. Após o condicionamento de monócitos, para determinar a concentração ótima de RANKL para diferenciação e maturação de CO, foram utilizadas concentrações de RANKL de 1 ng/mL, 25 ng/mL, 50 ng/mL e 100 ng/mL, juntamente com 25ng/mL M-CSF. A adição de RANKL produziu um número crescente de grandes OCs multinucleados positivos para TRAP de maneira dose-dependente, e isso foi avaliado usando a coloração TRAP. OCs maduros são definidos como células positivas para TRAP com múltiplos núcleos (tipicamente mais de três; Figura 2A,B e Figura Suplementar 1). Além disso, a cinética de diferenciação de CO de monócitos foi investigada usando coloração TRAP e microscopia de luz durante um período de cultura de 2-14 dias. Neste caso, a diferenciação de CO usando uma concentração intermediária de 50 ng/mL RANKL foi escolhida para avaliar quão rapidamente os CO se diferenciaram em cultura. Nessas condições de cultura, os CO multinucleados foram visíveis a partir do 5º dia, e a diferenciação ótima foi alcançada no 7º dia (Figura 2C). A incubação prolongada das culturas além de 10 dias em plásticos resultou em células fundidas anormalmente gigantes. Neste protocolo, os dias 6-8 são geralmente usados como o ponto final ideal da geração de CO. Os CO podem ser quantificados ou utilizados para ensaios a jusante.
Avaliação funcional de COs diferenciados
Para determinar a atividade funcional dos COs gerados, examinamos sua atividade reabsortiva diferenciando os COs em uma superfície mineralizada. Como os grandes COs só são gerados após um período de 7 dias de cultivo, e para permitir tempo suficiente para reabsorver o substrato mineral, as culturas foram mantidas até o 10º dia. A formação de orifícios redondos, ou cavas de reabsorção, foi observada apenas nas superfícies mineralizadas dos poços contendo células tratadas com M-CSF e RANKL (Figura 3). Assim, a porcentagem de superfície mineralizada dissolvida (poços de reabsorção) permite determinar a capacidade reabsortiva do CO. Além disso, os COs diferenciados seguindo esse protocolo até o 7º dia, tanto em lâminas de plástico quanto em câmaras de vidro, apresentaram uma estrutura de anel de actina bem organizada que pôde ser visualizada pela coloração por imunofluorescência (Figura 2 Suplementar).
Efeito de um inibidor na função madura do CO
As condições de cultivo acima mencionadas foram utilizadas para determinar a capacidade funcional dos CO gerados in vitro na presença do conhecido inibidor de CO, a rotenona34. Os COs foram diferenciados por 6-8 dias, e os CD14−OSCAR+ OCs e precursores de OC foram enriquecidos por citometria de fluxo (Figura 4). As células enriquecidas foram então plaqueadas a 50.000 células/poço em uma placa de 96 poços revestida com minerais em meio pró-osteoclastogênico (25 ng/mL, M-CSF e RANKL) por 3 dias. O tratamento com rotenona (Figura 5A,B) inibiu dose-dependente a reabsorção da superfície mineralizada em comparação com o poço controle não tratado, consistente com estudos prévios34. Adicionalmente, a funcionalidade do CO foi avaliada através da produção de ATP e formação de anéis de actina. A inibição da reabsorção de CO dependente de rotenona foi associada à inibição da produção de ATP (Figura 5C). As OCs reabsorvedoras são células altamente polarizadas que regulam sua capacidade reabsortiva promovendo a organização do citoesqueleto. A faloidina conjugada Alexa fluor 647 foi usada para marcar o citoesqueleto de actina F dos COs maduros cultivados na presença ou ausência de rotenona. A rotenona causou a fragmentação do anel de actina derivado de RANKL dos CO maduros (Figura 5D).
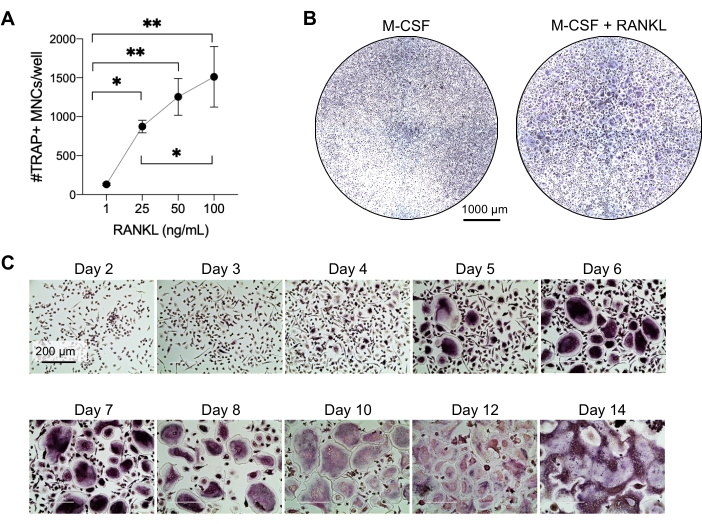
Figura 2: OCs diferenciando-se eficientemente dos precursores de monócitos CD14+ . Os monócitos CD14+ foram enriquecidos magneticamente, plaqueados a 1 x 105 células/poço em placas de 96 poços e incubados durante a noite com 25 ng/mL M-CSF. (A) Monócitos com priming M-CSF foram estimulados com concentrações crescentes de RANKL (1 ng/mL, 25 ng/mL, 50 ng/mL e 100 ng/mL), fixados e corados para TRAP no dia 7. As imagens foram adquiridas e as células multinucleadas (CMN) TRAP+ foram contadas. Imagens representativas da coloração TRAP são mostradas na Figura Suplementar 1. As barras de erro mostram a média ± DP (n = 3). Os dados foram analisados com ANOVA one-way e teste de comparações múltiplas de Holm-Sidak para dados pareados; * P ≤ 0,05 e ** P ≤ 0,005. (B) Imagem representativa de um poço corado com TRAP de uma placa de 96 poços mostrando a quantidade típica de OCs/poço esperado e sua morfologia abaixo de 25 ng/mL RANK-L em comparação com macrófagos derivados de M-CSF no dia 7. Barras de escala: 1000 μm. (C) Imagens representativas da formação de CO sob RANKL de 50 ng/mL avaliadas pela coloração TRAP do dia 2 ao dia 14. Os OCs são visíveis a partir do dia 5. OCs gigantes anormalmente fundidos estão presentes após 10 dias. Barras de escala: 200 μm. Clique aqui para ver uma versão maior desta figura.
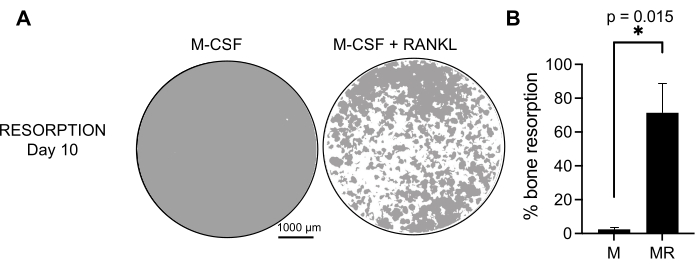
Figura 3: OCs reabsortivos diferenciados de monócitos CD14+ . Células CD14+ isoladas de CMSP foram diferenciadas por 10 dias em CO na presença de 25 ng/mL M-CSF (M) e RANKL (R) em placas de superfície de ensaio mineral (osteoensaio). (A) Imagens de poços reconstruídos representativos captadas em aumento de 10x para análise da reabsorção no 10º dia (substrato mineral na cor cinza; fossas de reabsorção na cor branca). Barras de escala: 1000 μm. (B) Quantificação da porcentagem de área reabsorvida. Os dados de reabsorção foram analisados com análise pareada de Wilcoxon. As barras de erro mostram a média ± DP (n = 7). Clique aqui para ver uma versão maior desta figura.
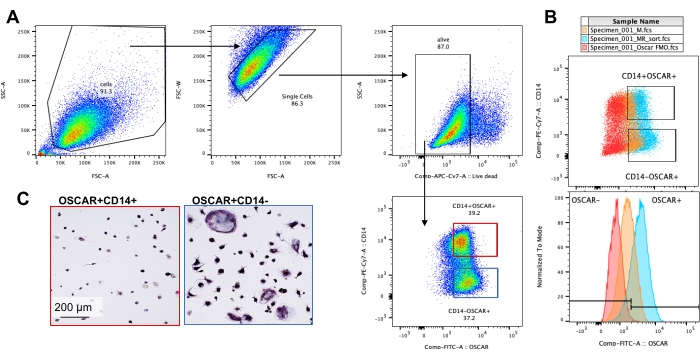
Figura 4: Enriquecimento por citometria de fluxo de CD14−OSCAR+ OCs. Os monócitos CD14+ foram enriquecidos a partir de CMSP, e os CO foram diferenciados conforme descrito anteriormente. Culturas de CO aderentes foram destacadas com acutase e coradas para citometria de fluxo. (A-C) Os CO no 8º dia foram classificados com base na expressão de CD14 e OSCAR. (A) Estratégia representativa de triagem. As células foram fechadas como singletes, negativas para coloração morta, e os subgrupos CD14+ OSCAR+ (vermelho) e CD14− OSCAR+ (azul) foram classificados. (B) Gráficos representativos mostrando a sobreposição de coloração OSCAR de OCs derivados de RANKL (ciano) e macrófagos derivados de M-CSF de controle (laranja). Em vermelho está o controle corado pelo isótipo OSCAR dos OCs derivados do RANKL. (C) As populações selecionadas foram plaqueadas em plástico e deixadas aderir por 2 h em meio pró-OC (25 ng/mL M-CSF e 50 ng/mL RANKL), seguido de coloração e visualização por TRAP. As imagens representativas mostram uma falta de células TRAP+ no subconjunto CD14+ (vermelho) e pré-OCs e OCs TRAP+ mono e multinucleados no subconjunto CD14− (azul). Barras de escala: 200 μm. Clique aqui para ver uma versão maior desta figura.
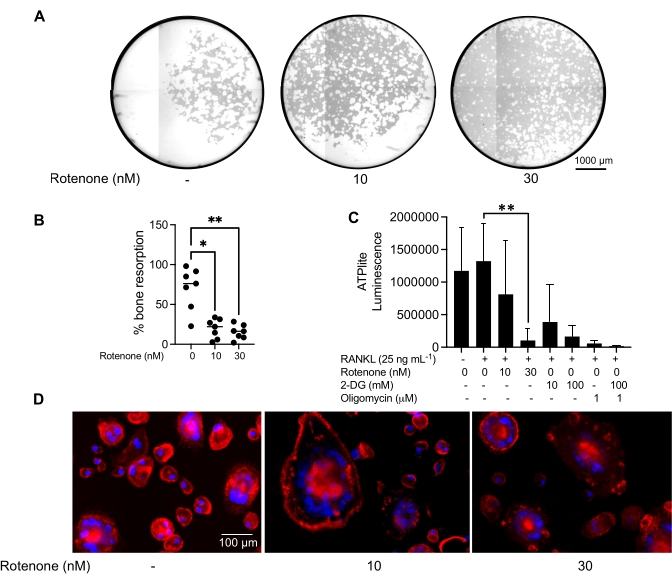
Figura 5: Ensaios para avaliar a função de COs maduros. Para avaliar a função de COs maduros, células CD14+ isoladas de CMSP foram cultivadas com M-CSF (M) isoladamente ou combinadas com RANKL (R) por 7 dias, as CO foram enriquecidas por citometria de fluxo e as COs foram então tratadas com o inibidor rotenona por 24 h. (A) Os CO maduros foram selecionados por citometria de fluxo (CD14−OSCAR+) e cultivadas em superfície de ensaio mineral na presença ou ausência de rotenona por 3 dias, após os quais as células foram clareadas e imageadas a 10x para revelar a área reabsorvida (fossas de reabsorção em branco). (A) Imagens representativas reconstruídas de poços. Barras de escala: 1000 μm. (B) A quantificação da porcentagem de área reabsorvida. Os dados em (B) foram analisados com ANOVA one-way com teste de comparações múltiplas de Dunn (n = 7); * P ≤ 0,05 e ** P ≤ 0,01. As barras de erro mostram a média ± DP. (C) Conteúdo de ATP intracelular total de OCs maduros diferenciados indiferenciados e dia 7 diferenciados com RANKL e tratados com veículo ou rotenona (10 nM e 30 nM). Aqui, 2DG e oligomicina foram usados como controles positivos para o ensaio e foram adicionados 30 minutos antes da lise celular e quantificação de ATP. As barras de erro mostram a média ± DP (n = 4). Os dados foram analisados com ANOVA one-way e teste de comparações múltiplas de Dunnett para dados pareados. ** P ≤ 0,01. (D) Imagem representativa de 20x de OCs maduros corados para formação de anel de actina (vermelho) e núcleos (azul), mostrando a perda do anel de actina com o inibidor. Barras de escala: 100 μm. Clique aqui para ver uma versão maior desta figura.
| Formato da chapa | 96 placa de poço | 48 placa de poço | 24 placa de poço | 12 placas de poço | 6 placas de poço |
| volume | 100 μL | 225–250 μL | 450–500 μL | 0,8–1 mL | 1,8–2 mL |
Tabela 1: Volume de suspensão celular para diferentes formatos de placa. Os volumes são calculados a partir de uma solução de 1 x 106 células/mL e fornecem uma densidade ótima para a fusão célula-célula.
| Fluoróforo, clone | Volume (μL) por 106 células | |
| CD14 | PE/Cianina7, HCD14 | 5 μL |
| OSCAR | FITC, REA494 | 10 μL |
| Buffer de classificação de células | 80 μL |
Tabela 2 : Solução de mistura mestra de anticorpos.
Figura suplementar 1: Coloração TRAP da resposta à dose RANKL. Os monócitos CD14+ foram enriquecidos magneticamente, plaqueados a 1 x 105 células/poço em placas de 96 poços e incubados durante a noite com 25 ng/mL M-CSF, como na Figura 2. Imagens representativas da coloração TRAP mostram monócitos primed MCSF estimulados com concentrações crescentes de RANKL (1 ng/mL, 25 ng/mL, 50 ng/mL e 100 ng/mL), fixados e corados para TRAP no dia 7. Barras de escala: 400 μm. Clique aqui para baixar este arquivo.
Figura Suplementar 2: Coloração do anel atuante em OCs totalmente diferenciados. (A) Aumento de 10x dos COs diferenciados em plástico TC e corados com faloidina AF647 (em vermelho). Barra de escala: 400 μm. (B) Aumento de 40x dos COs diferenciados em lâminas de câmara de vidro e corados com faloidina AF488 (em amarelo). Barra de escala: 100 μm.Os núcleos são corados com DAPI, mostrados em azul em (A) e em ciano em (B). Clique aqui para baixar este arquivo.
Figura suplementar 3: Efeito de diferentes lotes FBS na eficiência de diferenciação do OC. Os CO foram diferenciados dos monócitos CD14+ na presença de 25 ng/mL M-CSF e 50 ng/mL RANKL (MR) por 7 dias. Os poços controle possuíam apenas M-CSF (M). (A) Aumentos representativos de 10x (barras de escala: 400 μm) e (B) quantificação de CO corados com TRAP diferenciados de um doador em dois lotes diferentes de SFB. As barras de erro mostram o DP médio ± de três réplicas técnicas. Clique aqui para baixar este arquivo.
Discussão
A fácil cultura e o isolamento de um grande número de CO funcionais in vitro são importantes para o avanço da compreensão da biologia óssea e das doenças mediadas por CO. Classicamente, as CO eram geradas em coculturas com osteoblastos ou células estromais e células hematopoéticas do baço ou da medula óssea38,39. Um avanço significativo no entendimento da osteoclastogênese foi a identificação do RANKL como o principal regulador da formação, diferenciação e sobrevida do CO40. Os primeiros protocolos de sistemas de cultura dependentes de RANKL utilizavam CMSP para geração de CO21,41,42. No entanto, essas culturas mistas são longas e apresentam muitos fatores de confusão que limitam a capacidade de testar os efeitos diretos sobre a diferenciação e função do CO. Este protocolo descreve um modelo in vitro eficiente e confiável de osteoclastogênese a partir de monócitos CD14+ periféricos humanos, no qual a osteoclastogênese ótima pode ser obtida em até 7 dias (Figura 1 e Figura 2), o que é consideravelmente mais rápido quando comparado a alguns outros protocolos43,44,45,46. As principais características distintivas deste protocolo são (1) o uso de monócitos CD14+ purificados, (2) o priming dos monócitos com M-CSF antes da exposição ao RANKL, (3) o comprimento da cultura (<7 dias) e (4) a detecção confiável da inibição da formação de OC (coloração TRAP) e função (reabsorção, produção de ATP, reorganização do anel de actina) com inibidores.
Durante a otimização da metodologia, vários pontos críticos foram identificados. Tem sido observado que a diferenciação in vitro de CO é amplamente dependente da densidade de semeadura dos monócitos CD14+. Assim, neste protocolo, as células são semeadas em alta densidade (1 x 105 células/poço de uma placa de 96 poços, em 100 μL de meio), pois é essencial que as células possam interagir entre si e estar próximas de se fundir e se tornarem OCs maduras. Da mesma forma, semear células em uma densidade muito alta limita sua diferenciação e crescimento devido a limitações médias e à falta do espaço necessário. Além disso, para obter o máximo sucesso com este protocolo, é importante realizar a separação do gradiente de densidade cuidadosamente e garantir que a população enriquecida de células CD14+ seja a mais pura possível. Por exemplo, etapas inadequadas de lavagem resultam na falta de remoção de plaquetas, o que, consequentemente, inibe a diferenciação das CO47,48. Da mesma forma, a presença de menor contaminação de células T em preparações CD14+ isoladas estimuladas apenas com M-CSF pode resultar em diferenciação de CO, potencialmente via secreção de RANKL por células T49. Portanto, é importante incluir um controle M-CSF para cada experimento. Uma verificação de pureza de rotina, especialmente ao usar um novo kit de isolamento, também é recomendada para garantir a pureza da amostra.
Os números ótimos de OC (intervalo: ~200-1.600 OCs/poço) são obtidos usando meio α-MEM enriquecido com nucleosídeos e L-glutamina. Outros meios de cultura convencionais, incluindo o meio de águia modificado de Dulbecco (DMEM) e o meio Roswell Park Memorial Institute (RPMI) 1640, afetam a produção de CO. A fonte de SFB também pode influenciar a osteoclastogênese. Diferentes lotes de SFB podem levar à redução da osteoclastogênese derivada do RANK-L, bem como ao aparecimento de baixo número de células multinucleadas TRAP+ nos controles M-CSF (Figura 3 Suplementar). Portanto, para obter resultados consistentes, recomenda-se testar novos lotes de FBS antes do uso e continuar com o mesmo lote ao longo dos experimentos para minimizar as variações no processo de diferenciação. Além disso, a variabilidade doador-doador, em termos do número total de CO diferenciados obtidos no ponto de tempo final, constitui uma limitação ao usar esse protocolo para comparar, por exemplo, doadores saudáveis com pacientes. Nesses casos, é imprescindível usar exatamente as mesmas condições e o mesmo lote de meio, FBS e outros reagentes.
Outra etapa necessária para a diferenciação e maturação ótima do CO é o condicionamento dos monócitos com M-CSF antes da adição de RANKL. A exposição das células ao M-CSF 18-24 h antes do RANKL prepara os monócitos para upregulation da expressão de RANK15,26. A adição de RANKL neste momento garante a diferenciação ideal do OC de forma dose-dependente. O grau de diferenciação das CO varia de doador para doador; no entanto, 25 ng/mL de RANKL geralmente é suficiente para diferenciar um alto número de CO na maioria dos doadores. Adicionalmente, 25 ng/mL de RANKL podem ser utilizados em ensaios para a triagem inicial de compostos, pois facilita a avaliação dos efeitos potencializadores e inibitórios dos compostos teste. Outros sistemas de cultura utilizaram tempos mais longos de pré-incubação do M-CSF antes da adição de RANKL, mas isso resulta em um tempo de cultivo mais longo para osteoclastogênese50. Além disso, deixar os monócitos preparados incubarem durante a noite permite que eles se fixem à placa, embora não em um estado totalmente aderente. Portanto, quando o RANKL é introduzido pela primeira vez, o meio deve ser trocado pela metade com muito cuidado, em vez de completamente trocado para evitar o desprendimento e a perda dos monócitos primados. O meio também precisa ser atualizado a cada 3-4 dias para evitar a depleção do meio e evitar a morte celular. Além disso, devido ao baixo volume utilizado neste ensaio (100 μL/poço em uma placa de 96 poços), é de extrema importância ter uma estrutura de poços vazios que sejam preenchidos com uma solução aquosa (isto é, destilado estéril H2O ou PBS) ao redor dos poços de ensaio. Isso evita a evaporação média e os efeitos de borda.
Finalmente, para ensaios metabólicos (por exemplo, ensaios de ATP), é imperativo que as células sejam viáveis para evitar grandes desvios-padrão entre réplicas (Figura 5). A alta viabilidade das células também é importante para a classificação das células e para a posterior cultura dos COs triados (Figura 4). Esse método, no entanto, tem várias limitações. OCs totalmente maduros são muito aderentes e difíceis de se desprender das placas. Os OCs maiores são muitas vezes impossíveis de destacar, o que pode levar a um menor rendimento celular. Portanto, as células precisam ser contadas após a triagem e antes do plaqueamento na concentração necessária. Além disso, no presente protocolo, um método não enzimático (accutase) para desprender os COs é usado para prevenir alterações de membrana na coloração da superfície a jusante para citometria de fluxo. O uso de raspadores celulares (com terminações macias ou duras) também foi testado e levou à alta morte celular. O descolamento enzimático usando soluções de tripsina/EDTA a 0,05% pode ser usado para um maior rendimento de OCs destacados quando a integridade da membrana não é necessária para aplicações a jusante. Além disso, para evitar que os COs se agrupem, o uso de uma alta concentração de EDTA em todos os tampões após o desprendimento celular, bem como a filtragem apropriada antes da aquisição por citometria de fluxo, são altamente recomendados. É importante notar que as culturas de CO são uma população heterogênea de células consistindo de COs maduros, precursores de CO e macrófagos. Macrófagos podem ser facilmente distinguidos de COs, embora tanto pré-OCs mononucleares quanto COs multinucleares expressem OSCAR e não possam ser distinguidos com o presente método (Figura 4). De fato, esta última questão constitui a principal limitação desse método. Além disso, uma baixa expressão de OSCAR também está presente em culturas de M-CSF (Figura 4B) e pode indicar macrófagos preparados para o comprometimento da linhagem OC. É importante definir a porta para as células OSCAR+ com base no sinal de coloração FMO, como mostrado na Figura 4B.
Em resumo, este protocolo descreve um método otimizado e robusto para a produção eficiente de CO ativos e funcionalmente maduros a partir de monócitos humanos primários circulantes. O ponto forte deste protocolo é sua capacidade de gerar OCs em um curto período de tempo e produzir um alto número de OCs diferenciados. Este método abre caminho para a investigação dos mecanismos básicos subjacentes à diferenciação e função dos CO.
Divulgações
Os autores declaram não ter interesses concorrentes.
Agradecimentos
Os autores agradecem ao Flow Core Facility e ao Glasgow Imaging Facility (GIF) dentro da Escola de Infecção e Imunidade por seu apoio e assistência neste trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 well chamber slides | ibidi | 81816 | |
| 8-well glass chamber slides | Ibidi | 80807 | |
| 96-well TC plate | Corning | 3596 | |
| 96-well osteo assay stripwell plate | Corning | 3989 | |
| Acetate solution | Sigma Aldrich | 386-3 | from kit Cat No. 387A-1KT |
| Acetone | VWR | 20066.330 | |
| Acid phosphatase, Leukocyte (TRAP) kit | SIGMA-ALDRICH | 387A-1KT | |
| Alexa Fluor 488 Phalloidin | Theremo Fisher - Invitrogen | A12379 | AF488 |
| Alexa Fluor 647 Phalloidin | Thermo Fisher - Invitrogen | A22287 | AF647 |
| Alfa Aesar 2-Deoxy-D-glucose | Fisher Scientific | 11321867 | 2DG, 98% |
| Alpha minimum essential medium | gibco | 22571-020 | |
| ATPlite 1step | PerkinElmer | 6016731 | Luminiscence ATP detection assay system |
| BD FACSAria III cell sorter | BD Biosciences | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418-100G | |
| Cell culture microplate, 96-well, PS, F-bottom | Greiner bio-one | 655083 | White-bottom plates |
| Citrate solution | Sigma Aldrich | 91-5 | from kit Cat No. 387A-1KT |
| Corning 6ml round-bottom polystyrene test tubes | Fisher Scientific | 352054 | |
| Corning osteo assay surface multiple well plate | Sigma-Aldrich | CLS3989 | |
| Corning osteo assay Surface multiple well plate 1 x 8 stripwell | Corning | CLS3989-2EA | |
| DAPI | Theremo Fisher | D3571 | |
| EasySep human CD14 positive selection kit | STEMCELL Technologies | 17858 | |
| EasySep red blood cell lysis buffer (10x) | StemCell Technologies | 20110 | |
| eBioscience fixable viability dye eFluor 780 | Theremo Fisher - Invitrogen | 65-0865-14 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E7889-100ML | |
| EVOS FL auto imaging system | Thermo Fisher | A32678 | |
| Falcon round-bottom polypropylene test tubes with cap | Fisher Scientific | 10314791 | |
| Falcon tubes 15 mL | Corning | 430790 | |
| Falcon tubes 50 mL | Corning | 430828 | |
| Fast Garnet GBC base solution | Sigma Aldrich | 387-2 | from kit Cat No. 387A-1KT |
| Fetal bovine serum | gibco | 10500-064 | FBS |
| Ficoll-Paque Plus | cytiva | 17144003 | |
| Formaldehyde | Sigma-Aldrich | F-8775 | |
| Human sRANK ligand | PEPROTECH | 310-01-100UG | Receptor activator of nuclear factor kappa-B ligand (RANKL) |
| ImageJ Image analysis software | Image J | version 2.9.0 | |
| L-glutamine | gibco | 25030-024 | |
| Lithium heparin tubes (9 mL) | VACUETTE | 455084 | |
| Macrophage colony-stimulating factor | PEPROTECH | 300-25-100UG | M-CSF |
| Napthol AS-BI phosphoric acid solution | Sigma Aldrich | 387-1 | from kit Cat No. 387A-1KT |
| Neubauer hemacytometer counting chamber | Camlab | SKU 1127885 | |
| Oligomycin from Streptomyces Diastatochromogenes | Sigma-Aldrich | Q4876-5MG | |
| OSCAR Antibody, anti-human, Vio Bright FITC, REAfinit | Miltenyi Biotec | 130-107-661 and 130-107-617 | Clone REA494 |
| PE/Cyanine7 anti-human CD14 antibody | Biolegend | 325618 | Clone HCD14 |
| Penicilin/streptomycin | SIGMA | P0781 | |
| PHERAstar machine and software | BMG LABTECH | ||
| Phosphate-buffered saline (DPBS, 1x) | gibco | 14190-094 | |
| REA control antibody (S), human IgG1, Vio Bright FITC, REAfinity | Miltenyi Biotec | 130-113-443 | |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044-1L | |
| Sodium nitrite solution | Sigma Aldrich | 91-4 | from kit Cat No. 387A-1KT |
| Tartrate solution | Sigma Aldrich | 387-3 | from kit Cat No. 387A-1KT |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Trypan blue | Sigma-Aldrich | T8154-100ML |
Referências
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Boyce, B. F., Xing, L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives Of Biochemistry and Biophysics. 473 (2), 139-146 (2008).
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Agemura, T., Hasegawa, T., Yari, S., Kikuta, J., Ishii, M. Arthritis-associated osteoclastogenic macrophages (AtoMs) participate in pathological bone erosion in rheumatoid arthritis. Immunological Medicine. 45 (1), 22-26 (2022).
- Hasegawa, T., et al. Identification of a novel arthritis-associated osteoclast precursor macrophage regulated by FoxM1. Nature Immunology. 20 (12), 1631-1643 (2019).
- Walsh, N. C., Crotti, T. N., Goldring, S. R., Gravallese, E. M. Rheumatic diseases: The effects of inflammation on bone. Immunological Reviews. 208 (1), 228-251 (2005).
- Gravallese, E. M., et al. Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis. The American Journal of Pathology. 152 (4), 943-951 (1998).
- Bromley, M., Woolley, D. E. Chondroclasts and osteoclasts at subchondral sites of erosion in the rheumatoid joint. Arthritis & Rheumatism. 27 (9), 968-975 (1984).
- Kleyer, A., Schett, G. Arthritis and bone loss: A hen and egg story. Current Opinion in Rheumatology. 26 (1), 80-84 (2014).
- Kawai, V. K., Stein, C. M., Perrien, D. S., Griffin, M. R. Effects of anti-tumor necrosis factor α (anti-TNF) agents on bone. Current Opinion in Rheumatology. 24 (5), 576-585 (2012).
- Siebert, S., Tsoukas, A., Robertson, J., McInnes, I. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases. Pharmacological Reviews. 67 (2), 280-309 (2015).
- Smiljanovic, B., et al. Monocyte alterations in rheumatoid arthritis are dominated by preterm release from bone marrow and prominent triggering in the joint. Annals of the Rheumatic Diseases. 77 (2), 300-308 (2018).
- Anderson, J. R., et al. 1H NMR metabolomics identifies underlying inflammatory pathology in osteoarthritis and rheumatoid arthritis synovial joints. Journal of Proteome Research. 17 (11), 3780-3790 (2018).
- McGarry, T., et al. Rheumatoid arthritis CD14+ monocytes display metabolic and inflammatory dysfunction, a phenotype that precedes clinical manifestation of disease. Clinical & Translational Immunology. 10 (1), 1237(2021).
- Ansalone, C., et al. TNF is a homoeostatic regulator of distinct epigenetically primed human osteoclast precursors. Annals of the Rheumatic Diseases. 80 (6), 748-757 (2021).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis and Rheumatology. 73 (7), 1145-1154 (2021).
- Allard-Chamard, H., et al. Osteoclasts and their circulating precursors in rheumatoid arthritis: Relationships with disease activity and bone erosions. Bone Reports. 12, 100282(2020).
- Takegahara, N., et al. Involvement of receptor activator of nuclear factor-κB ligand (RANKL)-induced incomplete cytokinesis in the polyploidization of osteoclasts. The Journal of Biological Chemistry. 291 (7), 3439-3454 (2016).
- Jansen, I. D. C., Vermeer, J. A. F., Bloemen, V., Stap, J., Everts, V. Osteoclast fusion and fission. Calcified Tissue International. 90 (6), 515-522 (2012).
- McDonald, M. M., et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 184 (5), 1330-1347 (2021).
- Lacey, D. L., et al. Bench to bedside: Elucidation of the OPG-RANK-RANKL pathway and the development of denosumab. Nature Reviews Drug Discovery. 11 (5), 401-419 (2012).
- Zhao, B., Grimes, S. N., Li, S., Hu, X., Ivashkiv, L. B. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J. The Journal of Experimental Medicine. 209 (2), 319-334 (2012).
- Zhao, B. Does TNF promote or restrain osteoclastogenesis and inflammatory bone resorption. Critical Reviews in Immunology. 38 (4), 253-261 (2018).
- Crotti, T. N., et al. Receptor activator NF-κB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Annals of the Rheumatic Diseases. 61 (12), 1047-1054 (2002).
- Kim, H. R., et al. Reciprocal activation of CD4+ T cells and synovial fibroblasts by stromal cell-derived factor 1 promotes RANKL expression and osteoclastogenesis in rheumatoid arthritis. Arthritis and Rheumatology. 66 (3), 538-548 (2014).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor κB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Hayman, A. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
- Nedeva, I. R., Vitale, M., Elson, A., Hoyland, J. A., Bella, J. Role of OSCAR signaling in osteoclastogenesis and bone disease. Frontiers in Cell and Developmental Biology. 9, 780(2021).
- Boyce, B. F., Yoneda, T., Lowe, C., Soriano, P., Mundy, G. R. Requirement of pp60c-src expression for osteoclasts to form ruffled borders and resorb bone in mice. The Journal of Clinical Investigation. 90 (4), 1622-1627 (1992).
- Matsubara, T., et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin. Biochemical and Biophysical Research Communications. 489 (4), 472-476 (2017).
- Roscher, A., et al. The F-actin modulator SWAP-70 controls podosome patterning in osteoclasts. Bone Reports. 5, 214-221 (2016).
- Jurdic, P., Saltel, F., Chabadel, A., Destaing, O. Podosome and sealing zone: Specificity of the osteoclast model. European Journal of Cell Biology. 85 (3-4), 195-202 (2006).
- Francis, M. J. O., et al. ATPase pumps in osteoclasts and osteoblasts. The International Journal of Biochemistry & Cell Biology. 34 (5), 459-476 (2002).
- Kwak, H. B., et al. Inhibition of osteoclast differentiation and bone resorption by rotenone, through down-regulation of RANKL-induced c-Fos and NFATc1 expression. Bone. 46 (3), 724-731 (2010).
- Massey, H. M., Flanagan, A. M. Human osteoclasts derive from CD14-positive monocytes. British Journal of Haematology. 106 (1), 167-170 (1999).
- Xue, J., et al. CD14+CD16-monocytes are the main precursors of osteoclasts in rheumatoid arthritis via expressing Tyro3TK. Arthritis Research and Therapy. 22 (1), 221(2020).
- Marco-Casanova, P., et al. Preparation of peripheral blood mononuclear cell pellets and plasma from a single blood draw at clinical trial sites for biomarker analysis. Journal of Visualized Experiments. (169), e60776(2021).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Matsuzaki, K., et al. Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. Biochemical and Biophysical Research Communications. 246 (1), 199-204 (1998).
- Shalhoub, V., et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell precursors. Journal of Cellular Biochemistry. 72 (2), 251-261 (1999).
- Neale, S. D., Smith, R., Wass, J. A. H., Athanasou, N. A. Osteoclast differentiation from circulating mononuclear precursors in Paget's disease is hypersensitive to 1,25-dihydroxyvitamin D3 and RANKL. Bone. 27 (3), 409-416 (2000).
- Abdallah, D., et al. An optimized method to generate human active osteoclasts from peripheral blood monocytes. Frontiers in Immunology. 9, 632(2018).
- Komano, Y., Nanki, T., Hayashida, K., Taniguchi, K., Nobuyuki, M. Identification of a human peripheral blood monocyte subset that differentiates into osteoclasts. Arthritis Research and Therapy. 8 (5), 152(2006).
- Kylmäoja, E., et al. Peripheral blood monocytes show increased osteoclast differentiation potential compared to bone marrow monocytes. Heliyon. 4 (9), 00780(2018).
- Wang, D., et al. Platelet-rich plasma inhibits RANKL-induced osteoclast differentiation through activation of Wnt pathway during bone remodeling. International Journal of Molecular Medicine. 41 (2), 729-738 (2018).
- Cenni, E., Avnet, S., Fotia, C., Salerno, M., Baldini, N. Platelet-rich plasma impairs osteoclast generation from human precursors of peripheral blood. Journal of Orthopaedic Research. 28 (6), 792-797 (2010).
- D'Amico, L., Roato, I. Cross-talk between T cells and osteoclasts in bone resorption. BoneKEy Reports. 1 (6), 82(2012).
- Quinn, J. M. W., Elliott, J., Gillespie, M. T., Martin, T. J. A combination of osteoclast differentiation factor and macrophage-colony stimulating factor is sufficient for both human and mouse osteoclast formation in vitro. Endocrinology. 139 (10), 4424-4427 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados