Method Article
Differenziazione degli osteoclasti funzionali dai monociti CD14+ del sangue periferico umano
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Gli osteoclasti sono cellule chiave che riassorbono le ossa nel corpo. Questo protocollo descrive un metodo affidabile per la differenziazione in vitro degli osteoclasti dai monociti del sangue periferico umano. Questo metodo può essere utilizzato come uno strumento importante per comprendere ulteriormente la biologia degli osteoclasti nell'omeostasi e nelle malattie.
Abstract
Gli osteoclasti (OC) sono cellule che riassorbono l'osso e svolgono un ruolo fondamentale nello sviluppo scheletrico e nel rimodellamento osseo adulto. Diversi disturbi ossei sono causati da una maggiore differenziazione e attivazione degli OC, quindi l'inibizione di questa patobiologia è un principio terapeutico chiave. Due fattori chiave guidano la differenziazione degli OC dai precursori mieloidi: il fattore stimolante le colonie di macrofagi (M-CSF) e l'attivatore del recettore del ligando kappa-B del fattore nucleare (RANKL). I monociti CD14+ circolanti umani sono noti da tempo per differenziarsi in OC in vitro. Tuttavia, il tempo di esposizione e la concentrazione di RANKL influenzano l'efficienza di differenziazione. In effetti, sono stati descritti protocolli per la generazione di OC umani in vitro , ma spesso si traducono in un processo di differenziazione scarso e lungo. Qui viene fornito un protocollo robusto e standardizzato per generare OC umani maturi funzionalmente attivi in modo tempestivo. I monociti CD14+ sono arricchiti da cellule mononucleate del sangue periferico umano (PBMC) e innescati con M-CSF per sovraregolare RANK. La successiva esposizione a RANKL genera OC in modo dipendente dalla dose e dal tempo. Gli OC sono identificati e quantificati mediante colorazione con fosfatasi resistente agli acidi tartrati (TRAP) e analisi al microscopio ottico. La colorazione a immunofluorescenza dei nuclei e della F-actina viene utilizzata per identificare OC funzionalmente attivi. Inoltre, gli OC maturi OSCAR+CD14− sono ulteriormente arricchiti attraverso la selezione delle cellule di citometria a flusso e la funzionalità OC quantificata mediante saggi di riassorbimento minerale (o dentina/osso) e formazione di anelli di actina. Infine, un noto inibitore OC, il rotenone, viene utilizzato su OC maturi, dimostrando che la produzione di adenosina trifosfato (ATP) è essenziale per l'integrità dell'anello di actina e la funzione OC. In conclusione, in questo lavoro viene stabilito un robusto saggio per differenziare un numero elevato di OC, che in combinazione con la colorazione dell'anello di actina e un test ATP fornisce un utile modello in vitro per valutare la funzione OC e per lo screening di nuovi composti terapeutici in grado di modulare il processo di differenziazione.
Introduzione
Gli osteoclasti (OC) sono cellule giganti multinucleate di linea ematopoietica con una capacità unica di riassorbire l'osso. Sono responsabili dello sviluppo e del continuo rimodellamento dello scheletro 1,2. Nelle fasi scheletriche dello sviluppo, gli OC e i macrofagi residenti nei tessuti derivano da progenitori eritro-mieloidi e colonizzano la nicchia ossea e i tessuti degli organi. In condizioni fisiologiche, i progenitori eritromieloidi sono necessari per il normale sviluppo osseo e l'eruzione dei denti, mentre l'afflusso di monociti circolanti nella nicchia ossea fornisce il mantenimento postnatale degli OC, della massa ossea e della cavità del midollo osseo3. In condizioni patologiche, i monociti vengono reclutati in siti di infiammazione attiva e possono contribuire alla distruzione ossea patologica 4,5.
I pazienti con diverse forme di artrite sperimentano infiammazione articolare, che porta alla progressiva distruzione articolare causata da OCs6. Ad esempio, nell'artrite reumatoide (RA), gli OC iperattivati sono responsabili dell'erosione ossea patologica e della distruzione articolare 7,8 e i trattamenti attuali spesso non migliorano o arrestano il danno osseo 9,10,11. Alterazioni dei monociti circolanti sia in termini di distribuzione della popolazione che di firme trascrittomiche ed epigenetiche sono state riportate nei pazienti con AR12,13,14. Inoltre, è stato riportato che le risposte alterate dei monociti alla stimolazione infiammatoria influenzano l'osteoclastogenesi nei pazienti con AR con malattia attiva15,16,17.
La differenziazione delle OC è un complesso processo a più fasi che comprende l'impegno delle cellule precursori mieloidi nella differenziazione in precursori OC. Durante l'osteoclastogenesi, gli OC diventano giganti e multinucleati attraverso la fusione cellula-cellula, citochinesi incompleta e un processo di riciclaggio nucleare descritto come fissione e fusione18,19,20. La capacità di differenziare gli OC in vitro ha permesso progressi significativi nella comprensione della biologia ossea21. Gli OC si differenziano dai precursori dopo esposizione al fattore stimolante le colonie di macrofagi (M-CSF) e all'attivatore del recettore del ligando kappa-B del fattore nucleare (RANKL). Quest'ultimo è essenziale per il normale sviluppo e funzione delle OC in vitro e in vivo, anche in condizioni infiammatorie 6,22,23. RANKL è presentato da osteoblasti e osteociti, nonché da cellule T attivate e fibroblasti nella sinovia infiammata RA 2,24,25. Durante il processo di differenziazione OC, i monociti esposti a M-CSF sovraregolano l'attivatore del recettore dell'espressione del fattore nucleare kappa-B (RANK) sulla loro membrana cellulare e, sotto successiva stimolazione con RANKL, si differenziano in pre-OC mononucleati positivi alla fosfatasi acida resistente ai tartrati (TRAP) e quindi in OC multinucleati15,26. Gli OC producono diversi enzimi, il principale tra questi è TRAP, che consente la degradazione delle fosfoproteine all'interno dell'osso27. Un regolatore e marcatore della differenziazione OC è il recettore associato all'OC (OSCAR). È sovraregolata precocemente nelle cellule precursori che si impegnano nella linea OC28. Gli OC multinucleati giganti maturi possono degradare (riassorbire) la matrice scheletrica generando una grande zona di tenuta, che è costituita da un anello di actina che circonda un bordo arruffato21,29,30. La capacità di riassorbimento osseo degli OC richiede la riorganizzazione del citoscheletro e la conseguente polarizzazione e formazione di una membrana contorta, che è il cosiddetto bordo arruffato. Il bordo arruffato è circondato da una grande fascia circolare di una struttura ricca di F-actina, che è l'anello di actina o zona di sigillatura. L'integrità dell'anello di actina è essenziale per gli OC per riassorbire l'osso sia in vitro che in vivo, e la formazione difettosa del bordo arruffato è associata a una minore espressione vacuolare di adenosina trifosfatasi (V-ATPasi)31,32,33. Inoltre, gli OC sono cellule ricche di mitocondri e l'adenosina trifosfato (ATP) si associa a strutture simili ai mitocondri negli OC localizzati sul bordo arruffato31,32,33. Il rotenone agisce come un forte inibitore del complesso mitocondriale I e influisce sulla produzione di ATP. Rotenone ha anche dimostrato di inibire la differenziazione OC e la funzione34.
Questo protocollo descrive un metodo efficiente e ottimizzato di osteoclastogenesi in vitro da campioni di sangue periferico umano. Nel sangue periferico umano, i monociti CD14+ sono la principale fonte di OCs15,35,36. In questo protocollo, la cinetica di esposizione e le concentrazioni di M-CSF e RANKL sono state regolate per un'osteoclastogenesi ottimale. Le cellule mononucleate vengono prima separate dagli eritrociti e dai granulociti presenti nel sangue intero per gradiente di densità; vengono quindi arricchiti per i monociti CD14+ utilizzando la selezione positiva mediante sfere magnetiche. I monociti CD14+ isolati vengono quindi incubati durante la notte con M-CSF. Questo prepara i monociti a sovraregolare l'espressione di RANK15,26. La successiva aggiunta di RANKL induce osteoclastogenesi e multinucleazione in modo dipendente dal tempo. Gli OC a riassorbimento attivo mostrano la distribuzione caratteristica degli anelli F-actina sul bordo della membrana cellulare30,32 e la colorazione per TRAP. Gli OC maturi vengono analizzati quantificando le cellule multinucleate TRAP+ (più di tre nuclei). La capacità funzionale degli OC maturi può essere valutata dal loro riassorbimento, dall'integrità dell'anello di actina e dalla produzione di ATP. Inoltre, gli OC CD14− OSCAR+ differenziati possono essere arricchiti e utilizzati per valutare gli effetti di alcuni composti sulla funzionalità OC attraverso il riassorbimento minerale (o dentinale) e l'organizzazione F-actina. Inoltre, in questo lavoro, un noto inibitore OC, rotenone, viene utilizzato come esempio di un composto che influenza la funzionalità degli OC. La ridotta attività di riassorbimento OC sotto rotenone è associata a una ridotta produzione di ATP e alla frammentazione dell'anello di actina. In conclusione, questo protocollo stabilisce un saggio robusto che può essere utilizzato come metodo di riferimento per studiare diversi aspetti biologici del differenziamento e della funzione OC in vitro.
Questa metodologia può essere utilizzata per valutare (1) il potenziale dei monociti circolanti di differenziarsi in OC in salute e malattie, nonché (2) l'impatto dei candidati terapeutici sulla differenziazione e sulla funzione OC. Questo robusto protocollo di osteoclastogenesi consente di determinare l'efficacia e i meccanismi delle terapie mirate all'osso sia sulla differenziazione OC dalle cellule precursori che sulla funzione delle OC mature.
Protocollo
I cappotti Buffy ottenuti dallo Scottish National Blood Transfusion Service (Edimburgo) e i coni leucocitari ottenuti dal NHS Blood and Transplant (Newcastle) sono forniti ai ricercatori dell'Università di Glasgow in una forma completamente anonima (non identificabile) da donatori di sangue NHS pienamente consenzienti. Il mantello buffy e i componenti del sangue del cono dei leucociti sono prodotti da una donazione di sangue standard del NHS data in un centro di donazione di sangue NHS in Scozia o in Inghilterra. Il donatore di sangue dà il consenso informato al momento della donazione di sangue per il sangue in eccesso non utilizzato nella pratica clinica standard del NHS da utilizzare per studi di ricerca medica approvati. L'approvazione etica da parte del Comitato etico di ricerca del NHS e i moduli di consenso dei donatori firmati per utilizzare queste donazioni di sangue sono detenuti dal servizio di donazione di sangue del NHS. L'approvazione per accedere e utilizzare queste donazioni di sangue autorizzate in studi di ricerca medica approvati è stata richiesta e ottenuta utilizzando l'applicazione interna standard e il processo di revisione del National Blood Transfusion Service (Scozia) e del NHS Blood and Transport (Inghilterra). Non è stata richiesta alcuna ulteriore approvazione NHS REC o approvazione interna del comitato etico dell'Università di Glasgow per utilizzare i componenti del sangue per gli studi di ricerca medica approvati.
1. Note generali prima di iniziare
- Procedere con tutto il lavoro con il sangue con cautela. Considerare i potenziali pericoli di vari agenti infettivi che possono essere presenti nei campioni.
- Condurre tutto il lavoro con cautela nel laboratorio di biosicurezza in condizioni sterili indossando guanti e camici da laboratorio.
- Eseguire lo smaltimento di biosicurezza secondo le linee guida locali.
- Ottenere il consenso appropriato e le approvazioni etiche prima della raccolta dei campioni in base alle normative delle autorità locali.
- Generalmente, 1 ml di sangue fresco produrrà 1 milione di PBMC e i monociti CD14+ rappresentano circa il 10% -30% delle PBMC. In confronto, 10 ml di un cono leucocitario possono contenere 5 x 10 8-15 x 108 PBMC. Per ulteriori dettagli sull'isolamento PBMC, fare riferimento a un precedente protocollo37.
2. Isolamento delle cellule mononucleate del sangue periferico (PBMC) dal sangue intero
- Raccogliere il volume richiesto di sangue fresco da donatori sani in provette di raccolta dell'eparina di litio.
NOTA: Possono essere utilizzate anche altre provette di raccolta con anticoagulanti appropriati (ad es. provette di eparina sodica). Per un numero maggiore di cellule, è possibile utilizzare coni leucocitari o strati di buffy. - Per isolare le PBMC, trasferire il sangue in un nuovo tubo da 50 ml e diluirlo con soluzione salina sterile tamponata con fosfato 1x (PBS) in un rapporto 1: 1 o 1: 3 per sangue fresco o coni leucocitari / buffy coat, rispettivamente.
- Mescolare delicatamente le cellule più volte per inversione.
- Preparare tubi da 15 mL contenenti 3 mL di mezzo con gradiente di densità. Posizionare lentamente 8-10 ml di sangue diluito sulla parte superiore del mezzo con gradiente di densità e centrifugare a 400 x g per 30 minuti a temperatura ambiente (RT) senza freno.
NOTA: Applicare il sangue con attenzione sopra il mezzo di gradiente di densità per evitare la miscelazione. La miscelazione potrebbe comportare la perdita di PBMC. - Scartare con cautela lo strato superiore (contenente il plasma) con una pipetta Pasteur, raccogliere lo strato interfase sottostante contenente le PBMC (struttura bianca ad anello) e trasferire questo strato in un nuovo tubo da 50 ml.
- Sospendete le celle con 1x PBS sterile fino a 50 ml e lavate via il mezzo del gradiente di densità residua centrifugando a 300 x g per 10 minuti a RT con freno pieno.
- Per rimuovere le piastrine residue, ripetere il processo con un'ulteriore rotazione più lenta a 200 x g per 10 minuti a RT senza freno.
- Facoltativo: Per rimuovere il trascinamento dei globuli rossi, diluire il tampone di lisi dei globuli rossi (10x, tabella dei materiali) 1:10 in acqua distillata e applicare 3 ml del tampone diluito sul pellet. Mescolare e incubare per 3 min. Lavare il pellet fino a 50 ml di 1x PBS e centrifugare a 300 x g per 10 minuti a RT con freno pieno.
- Risospendere le PBMC isolate e purificate in 20 ml di 1x PBS e contarle utilizzando un ematocitometro o seguendo altri metodi standard.
NOTA: I metodi di diluizione e conteggio delle cellule devono essere regolati di conseguenza in base alla densità delle celle e al dispositivo di conteggio utilizzato.
3. Arricchimento di monociti CD14+ da PBMCs
- Isolare i monociti CD14+ dalle PBMC con un kit di selezione CD14+ umano secondo il protocollo del produttore (Table of Materials).
NOTA: I monociti classici CD14+CD16− sono la principale fonte di precursori OC35; Possono essere presi in considerazione metodi di purificazione alternativi. - Trasferire 1 x 107 PBMC in un tubo di fondo rotondo in polistirene adatto (cioè che si adatta al magnete del kit di selezione) e pellettare le celle a 300 x g per 5 minuti.
- Scartare il surnatante, risospendere il pellet cellulare nel tampone di separazione cellulare (PBS, siero bovino fetale al 2% [FBS], 1 mM di acido etilendiamminotetraacetico [EDTA]) ad una concentrazione finale di 1 x 108 cellule/ml e incubare con 10 μL di cocktail di anticorpi per 100 μL con il coperchio per 10 minuti.
NOTA: Le celle vengono risospese a 1 x 108 celle/ml; Regolare i volumi di conseguenza. - Dopo l'incubazione, aggiungere 10 μL delle sfere di nanoparticelle magnetiche per 100 μL e incubare per 3 minuti con il coperchio.
NOTA: Regolare i volumi del cocktail di anticorpi e delle sfere magnetiche per ottenere una concentrazione di 10 μL/ml. - Riempire il volume a 2,5 ml con il tampone di separazione cellulare, posizionare il tubo in un magnete (senza coperchio) e incubare per 3 minuti. Scartare la popolazione cellulare negativa con un movimento continuo per inversione mentre il tubo è ancora nel magnete.
NOTA: se si utilizzano >2 x 108 PBMC e un magnete più grande, riempire fino a 5 ml o 10 ml con il buffer di separazione delle celle seguendo le istruzioni del produttore. - Rimuovere il tubo dal magnete e lavare i monociti CD14+ arricchiti attaccati alle sfere magnetiche risospendendoli in 2,5 ml del tampone di separazione cellulare. Incubare per 3 minuti all'interno del magnete come prima, scartare la frazione negativa e ripetere ancora una volta.
- Centrifugare tutte le cellule raccolte a 300 x g per 5 minuti, scartare il surnatante e risospendere le cellule in 5 ml di mezzo essenziale minimo alfa (α-MEM; Tabella dei materiali) integrato con 1% di L-glutammina, 1% di penicillina / streptomicina (completa α-MEM) e 10% FBS.
NOTA: Si raccomanda un controllo della purezza post-arricchimento tramite citometria a flusso e ci si deve aspettare una purezza del ≥96%. Ulteriori fasi di lavaggio (fase 3.6) possono aumentare la purezza.
4. Differenziazione OC in vitro
- Contare i monociti CD14+ arricchiti utilizzando un emiacitometro.
- Pellettare le cellule a 300 x g per 5 minuti e risospendere a 1 x 106 cellule / ml in α-MEM completo integrato con FBS al 10%.
- Per differenziare gli OC, aggiungere M-CSF ad una concentrazione finale di 25 ng/mL alla sospensione cellulare.
NOTA: Per 1 mL di sospensione cellulare, aggiungere 0,25 μL di M-CSF da una concentrazione di stock di 100 μg/mL. - Miscelare mediante pipettaggio accuratamente per omogeneizzare la sospensione cellulare e placcare 100 μL/pozzetto in una piastra a fondo piatto a 96 pozzetti fino a una densità cella finale di 1 x 105 celle/pozzetto.
- Aggiungere 200 μL/pozzetto di acqua distillata sterile nei pozzetti attorno alle cellule placcate per prevenire l'evaporazione media e gli effetti dei bordi nel sistema di coltura.
- Incubare le cellule durante la notte, per circa 18-20 ore, a 37 °C con il 5% di CO2.
- Dopo l'incubazione durante la notte, rimuovere con cautela metà del terreno (50 μL/pozzetto) mediante aspirazione utilizzando una pipetta P200, evitando di toccare il fondo del pozzetto, e sostituire con α-MEM completo caldo fresco contenente il 10% di FBS, 25 ng/mL M-CSF e 50 ng/mL RANKL per una concentrazione finale di 25 ng/mL
NOTA: Per 1 mL di terreno, aggiungere 0,25 μL di M-CSF e 0,5 μL di RANKL da una concentrazione di 100 μg/mL. - Cambiare il supporto ogni 3 giorni e differenziare le celle in OC per 7-14 giorni (Figura 1).
NOTA: Mantenere le concentrazioni di M-CSF e RANKL coerenti in tutta la coltura.
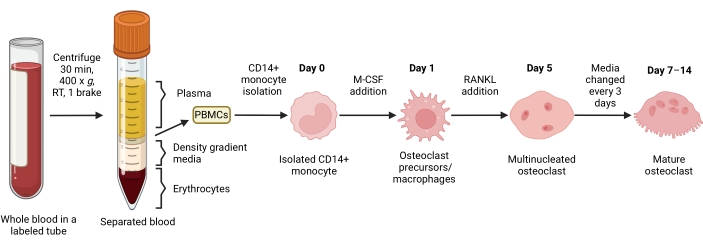
Figura 1: flusso di lavoro di differenziazione OC. Panoramica schematica dell'isolamento dei monociti CD14+ dalle PBMC e differenziazione in OC maturi in presenza di M-CSF e RANKL per 7-14 giorni. RT = temperatura ambiente. Immagine creata con BioRender.com. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Colorazione TRAP per osteoclasti
- Rimuovere con cautela il mezzo, fissare gli OC aderenti differenziati con 100 μL/pozzetto della soluzione fissativa precedentemente preparata e incubare per 1 minuto. Non toccare il fondo dei pozzetti per evitare di graffiare le cellule aderenti.
NOTA: La soluzione fissativa viene preparata come segue: 12,5 ml di soluzione di citrato (inclusa nel kit di colorazione TRAP), 32,5 ml di acetone e 5 ml di formaldeide al 37%. - Lavare i pozzetti tre volte con 300 μL di acqua distillata sterile. Picchiettare i piatti asciutti dopo il lavaggio.
- Preparare una soluzione colorante secondo le istruzioni del produttore (tabella dei materiali); aggiungere 5 μL di granato veloce e 5 μL di nitrito di sodio per ottenere la soluzione di granato veloce; mescolare per inversione e incubare per 3 minuti a RT. Preparare 1 ml di soluzione colorante mescolando 900 μL di acqua distillata sterile, 10 μL di naftolo, 40 μL di soluzione di acetato, 50 μL di soluzione di tartrato e 10 μL di soluzione Fast Garnet.
- Aggiungere 100 μL/pozzetto di soluzione colorante appena preparata e incubare la piastra a 37 °C al buio per 20 minuti.
- Dopo l'incubazione, rimuovere la soluzione colorante per inversione e lavare la piastra tre volte con 300 μL/pozzetto di acqua distillata.
- Rimuovere l'acqua in eccesso picchiettando i piatti su carta assorbente. Lasciare le piastre aperte e protette dalla luce per asciugare all'aria durante la notte.
NOTA: Le piastre asciutte possono essere conservate fino a 6 mesi. A volte, i tamponi residui possono favorire lo sviluppo di muffe, che è visibile al microscopio; Questo può essere rimosso in qualsiasi momento lavando i pozzetti interessati con acqua distillata e lasciandoli asciugare nuovamente all'aria. - Scatta immagini a 10x o 20x utilizzando un microscopio a campo chiaro con un'opzione piastrella per catturare l'intera superficie del pozzo.
- Conta manualmente gli OC identificati come cellule colorate di viola TRAP + con più di tre nuclei utilizzando un software di analisi delle immagini con un plug-in di contatore di celle.
NOTA: Il numero di OC TRAP + per pozzetto dipende dal donatore e può variare da ~ 200-1.600 OC / pozzo, con una media di circa 1.000 OC / pozzo. Inoltre, per analizzare i dati, i numeri OC dovrebbero essere determinati in tre diversi pozzi (repliche tecniche), e la media dovrebbe essere calcolata per ogni condizione e per ogni replica biologica.
6. Saggio di riassorbimento osseo
- Placcare i monociti CD14+ appena arricchiti su piastre osteo-dosatrici a 96 pozzetti rivestite con fosfato di calcio a 1 x 105 cellule/pozzetto e differenziare gli OC per 7-14 giorni, come indicato nei punti 4.1-4.8, e cambiare il terreno ogni 3 giorni.
NOTA: Le fette di osso corticale di dentina/avorio o bovino possono essere utilizzate al posto delle piastre osteo-saggistiche. In tal caso, il tempo totale della coltura dovrebbe essere prolungato a 14-21 giorni a causa del substrato più complesso da riassorbire. - Al punto di fine tempo, rimuovere con attenzione il mezzo, evitando di toccare il fondo del pozzetto, e lisare le cellule con una soluzione di ipoclorito di sodio al 10%. Lavare i pozzetti tre volte con acqua distillata.
- Scansiona le lastre asciutte utilizzando un microscopio a campo chiaro e analizza / quantifica le immagini acquisite delle fosse di riassorbimento utilizzando un software di analisi delle immagini.
7. Colorazione fluorescente dell'anello di actina
- Piastra 100 μL/pozzetto dei monociti CD14+ isolati in un vetrino a 18 pozzetti ad una densità cellulare di 1 x 105 cellule/pozzetto. Differenziare gli OC in presenza di M-CSF e RANKL come descritto in precedenza (fasi 4.1-4.8), compresa la sostituzione del terreno ogni 3 giorni.
- Al punto temporale finale, rimuovere delicatamente il mezzo e lavare ogni pozzetto due volte con 200 μL/pozzetto di PBS preriscaldato, pH 7,4. Non lasciare che i pozzetti si asciughino tra uno qualsiasi dei passaggi.
- Fissare il campione con 100 μL/pozzetto di soluzione di formaldeide al 4% in PBS e incubare per 10 minuti a RT su uno shaker orbitale con agitazione delicata.
NOTA: Il metanolo può interrompere l'actina durante il processo di fissazione. Pertanto, è meglio evitare qualsiasi fissativo contenente metanolo. Il fissativo preferito è la formaldeide priva di metanolo. Lo scuotitore orbitale utilizzato in questa fase del protocollo è stato impostato su un'impostazione di potenza di 3 su 10. - Lavare due volte con 200 μL/pozzetto di PBS, permeabilizzare le cellule con 100 μL/pozzetto di soluzione Triton X-100 allo 0,1% diluita in PBS e incubare per 10 minuti a RT su uno shaker orbitale con agitazione delicata.
- Lavare due volte con 200 μL/pozzetto di PBS. Per bloccare il legame non specifico e aumentare il segnale, aggiungere 100 μL/pozzetto di soluzione bloccante prodotta con soluzione di albumina sierica bovina (BSA)/PBS al 2%. Incubare per 20 minuti a RT su uno shaker orbitale con leggero scuotimento.
- Rimuovere la soluzione bloccante e aggiungere 100 μL/pozzetto di soluzione di falloidina coniugata fluorescentmente diluita in soluzione BSA/PBS al 2%. Incubare per 20 minuti a RT su uno shaker orbitale con scuotimento delicato e protetto dalla luce.
NOTA: Regolare la concentrazione del colorante falloidina secondo le raccomandazioni del produttore. - Lavare due volte con 200 μL/pozzetto di PBS, colorare i nuclei con 100 μL/pozzetto di una soluzione di PBS contenente 300 nM DAPI, e incubare per 10-15 minuti a RT su uno shaker orbitale con agitazione delicata e al riparo dalla luce.
NOTA: DAPI viene diluito in acqua distillata per ottenere una soluzione madre DAPI da 14,3 mM (5 mg/ml). La soluzione madre viene ulteriormente diluita fino alla concentrazione finale di 300 μM. Infine, la soluzione DAPI da 300 μM viene diluita ancora una volta in PBS fino a una concentrazione finale di 300 nM. - Dopo 10-15 minuti, rimuovere la soluzione DAPI e sostituirla con 100 μL/pozzetto PBS.
NOTA: a seconda dei vetrini della camera scelti, conservare con un volume appropriato di PBS (100 μL/pozzetto per vetrini a 18 pozzetti) oppure montare la guida con vetrini di copertura e un supporto di montaggio appropriato. I vetrini da camera possono essere conservati fino a 1 settimana in frigorifero. Per vetrini a 18 pozzetti, utilizzare un volume di colorazione di 50-100 μL e 200-300 μL per il lavaggio. Aumentare di conseguenza le dimensioni delle altre diapositive della camera. Per evitare l'evaporazione, tenere i coperchi all'interno di un contenitore coperto durante i tempi di incubazione. L'uso di uno shaker orbitale è raccomandato ma non essenziale. - Visualizza la colorazione utilizzando microscopi immunofluorescenziali o confocali appropriati e ingrandimenti tra 4x e 40x.
8. Arricchimento di OC maturi e precursori di OC mediante selezione citometrica a flusso
- Risospendere i monociti CD14+ appena arricchiti a 1 x 106 cellule/ml e differenziarli in OC maturi in presenza di M-CSF e RANKL nello stesso modo descritto sopra (fasi 4.1-4.8).
NOTA: quando si passa da una piastra da 96 pozzetti a una dimensione della piastra più grande, seguire la Tabella 1; questi volumi sono calcolati a partire da una soluzione 1 x 106 cellule/mL e forniscono una densità ottimale per la fusione cellula-cellula. - Il giorno 7, lavare i pozzetti una volta con PBS caldo e aggiungere 50 μL a 1 mL (volume determinato dalla dimensione della piastra utilizzata) di accutasi. Incubare le cellule a 37 °C con il 5% di CO2 per 20 minuti.
- Dopo l'incubazione, controllare le piastre al microscopio ottico per vedere se le cellule si sono staccate. Inoltre, staccare le celle toccando le piastre su tutti i lati e pipettandole su e giù.
- Raccogliere la sospensione cellulare in un tubo conico da 15 ml. Lavare i pozzetti con PBS caldo (no Ca 2+, no Mg2+) e combinarli con la sospensione cellulare. Ripetere i passaggi 8.2-8.3 una o due volte fino a quando la maggior parte delle celle non si è staccata.
NOTA: L'accutasi, il metodo raccomandato prima della colorazione superficiale per l'analisi citometrica a flusso, non stacca OC molto grandi. Il tasso di recupero è ~ 50% -70%. - Centrifugare le cellule a 300 x g per 5 minuti, risospendere il pellet cellulare in 1 mL di PBS e contare le cellule per esclusione del blu tripano.
- Risospendere le celle a 1 x 106 celle/ml, rimuovere 100 μL corrispondenti a 1 x 105 celle e trasferire tali celle in una nuova provetta in polipropilene. Aggiungere 200 μL del tampone di selezione delle celle e metterlo da parte sul ghiaccio come controllo non colorato.
- Colorare il resto delle cellule con colorante vivo / morto diluito a 1:750 per 10 minuti a RT e protetto dalla luce.
NOTA: la colorazione viva / morta deve essere eseguita in assenza di FBS per evitare un'elevata colorazione dello sfondo. - Rabboccare la provetta di raccolta da 15 mL contenente la sospensione di cellule colorate vive/morte con tampone di selezione a celle calde (1x PBS, no Ca 2+, no Mg2+, 1% FBS e 5 mM EDTA) e centrifugare a 300 x g per 5 minuti per pellettare le celle.
NOTA: Un'alta concentrazione di EDTA e una bassa concentrazione di FBS sono raccomandate nel tampone di selezione per prevenire l'accumulo di cellule. - Rimuovere un volume corrispondente a 1 x 105 celle e trasferirlo in una nuova provetta in polipropilene per il controllo dell'isotipo OSCAR. Trasferire tutte le celle rimanenti in un'altra provetta in polipropilene per la colorazione e la selezione delle cellule.
NOTA: le provette in polipropilene vengono utilizzate per la selezione poiché le celle hanno meno probabilità di aderire a queste provette rispetto alle provette di polistirolo. - Ruotare i tubi a 400 x g per 5 minuti per pellettare le cellule e scartare il surnatante in eccesso per inversione.
- Risospendere il pellet cellulare in una soluzione master mix di anticorpi preparata seguendo la Tabella 2. Colorare il tubo di controllo dell'isotipo OSCAR con l'anticorpo CD14 e il controllo dell'isotipo OSCAR al posto dell'anticorpo OSCAR.
- Incubare le cellule a 4 °C al riparo dalla luce per 30 minuti.
- Dopo 30 minuti, lavare le celle aggiungendo cinque volumi del tampone di selezione delle celle e centrifugare a 400 x g per 5 minuti a 4 °C.
- Risospendere le cellule in 300-1.000 μL di tampone di selezione a celle fredde e acquisire le cellule utilizzando una selezionatrice per citometria a flusso dotata di un ugello da 100 μM.
NOTA: GLI OC sono cellule molto appiccicose, quindi è importante filtrarli attraverso una membrana sterile da 70 μm prima della selezione. - Eseguire il gate degli OC e dei pre-OC come CD14−OSCAR+. Impostare il gate OSCAR+ in base al tubo di controllo isotipo OSCAR.
- Raccogliere le celle selezionate in provette di polipropilene contenenti α-MEM completo integrato con FBS al 20% a 8 °C.
- Dopo la selezione, pellettare le celle mediante centrifugazione a 300 x g per 5 minuti a RT, contare le celle e risospendere per le applicazioni a valle.
NOTA: Di solito, per ottenere ~ 1 x 105 pre-OC / OC ordinati, iniziare da ~ 10 x 106 celle placcate al giorno 0. Il basso tasso di recupero è influenzato dalla perdita cellulare durante il distacco con accutasi e dalla lavorazione per la colorazione e la selezione. Si raccomanda di eseguire l'intera procedura utilizzando tamponi e reagenti sterili e lavorare in condizioni sterili.
9. Saggio ATP per l'attività mitocondriale
- Incubare i monociti CD14+ arricchiti in presenza di M-CSF e RANKL in una piastra da 96 pozzetti nello stesso modo descritto in precedenza (fasi 4.1-4.8). Piastra quattro condizioni extra in triplice copia da utilizzare come controlli.
- Condurre il test ATP con il kit di rilevamento ATP a luminescenza secondo il manuale del produttore. In breve, per preparare la soluzione di ATP, aggiungere 10 ml della soluzione tampone del substrato al substrato liofilizzato e lasciarlo incubare a RT per 30 minuti.
NOTA: Diversi metodi possono essere utilizzati per misurare la produzione intracellulare di ATP. Qui, abbiamo utilizzato il rilevamento della produzione di ATP per luminescenza. - Durante l'incubazione, preparare e aggiungere i controlli direttamente ai pozzetti di controllo come segue: 2-Deossi-D-glucosio (2DG) a 10 mM e 100 mM, oligomicina a 1 μM e 100 mM 2DG in combinazione con 1 μM di oligomicina. Incubare per 30 minuti a 37 °C con il 5% di CO2.
NOTA: Il 2DG blocca la glicolisi, mentre l'oligomicina è un inibitore della fosforilazione ossidativa. La combinazione di questi due inibitori comporta la completa perdita della produzione di ATP attraverso la glicolisi e la fosforilazione ossidativa, il che significa che servono come controllo interno per il test dell'ATP. Per i controlli 2DG da 10 mM e 100 mM, aggiungere rispettivamente 0,5 μL e 5 μL di soluzione madre 2DG 2M per pozzetto di coltura da 100 μL. Per 1 μM di oligomicina, diluire la soluzione madre da 5 mM 1:100 in mezzo e aggiungere 2 μL/pozzetto ai pozzetti di controllo dedicati. Per l'ultimo controllo, aggiungere 5 μL di 2DG e 2 μL di soluzione diluita di oligomicina per pozzetto. - Aggiungere 50 μL della soluzione di ATP a ciascun pozzetto per fermare la reazione e incubare a RT su uno shaker a 700 rpm per 5-10 minuti al riparo dalla luce.
- Trasferire 100 μL del surnatante su una piastra a fondo bianco a 96 pozzetti specifica per il test ATP e leggere la piastra utilizzando un lettore di luminescenza.
Risultati
Generazione di OC da monociti CD14+
Questo metodo mirava a differenziare facilmente un gran numero di OC dai monociti CD14+ del sangue periferico umano in vitro, tipicamente in 1 settimana. In primo luogo, i monociti CD14+ sono stati arricchiti da PBMC e innescati con M-CSF durante la notte per sovraregolare RANK, come precedentemente riportato15. Dopo l'adescamento dei monociti, per determinare la concentrazione ottimale di RANKL per la differenziazione e la maturazione OC, sono state utilizzate concentrazioni RANKL di 1 ng / mL, 25 ng / mL, 50 ng / mL e 100 ng / mL, insieme a 25ng / mL M-CSF. L'aggiunta di RANKL ha prodotto un numero crescente di grandi OC multinucleati TRAP-positivi in modo dose-dipendente, e questo è stato valutato utilizzando la colorazione TRAP. Gli OC maturi sono definiti come cellule TRAP-positive con nuclei multipli (tipicamente più di tre; Figura 2A, B e figura supplementare 1). Inoltre, la cinetica della differenziazione OC dai monociti è stata studiata utilizzando la colorazione TRAP e la microscopia ottica per un periodo di coltura di 2-14 giorni. In questo caso, è stata scelta la differenziazione OC utilizzando una concentrazione intermedia di 50 ng/mL RANKL per valutare la velocità con cui gli OC si differenziano in coltura. In queste condizioni di coltura, gli OC multinucleati erano visibili dal giorno 5 in poi e la differenziazione ottimale è stata raggiunta il giorno 7 (Figura 2C). L'incubazione prolungata di colture oltre i 10 giorni sulla plastica ha portato a cellule fuse anormalmente giganti. In questo protocollo, i giorni 6-8 vengono solitamente utilizzati come endpoint ottimale della generazione di OC. Gli OC possono essere quantificati o utilizzati per saggi a valle.
Valutazione funzionale dei CO differenziati
Per determinare l'attività funzionale degli OC generati, abbiamo esaminato la loro attività di riassorbimento differenziando gli OC su una superficie mineralizzata. Poiché i grandi OC vengono generati solo dopo un periodo di coltura di 7 giorni e per consentire un tempo sufficiente per riassorbire il substrato minerale, le colture sono state mantenute fino al giorno 10. La formazione di fori rotondi, o pozzi di riassorbimento, è stata osservata solo sulle superfici mineralizzate di pozzetti contenenti cellule che erano state trattate sia con M-CSF che con RANKL (Figura 3). Pertanto, la percentuale di superficie mineralizzata disciolta (pozzi di riassorbimento) consente di determinare la capacità di riassorbimento OC. Inoltre, gli OC differenziati seguendo questo protocollo fino al giorno 7, sia su vetrini in plastica che in vetro, hanno mostrato una struttura ad anello di actina ben organizzata che potrebbe essere visualizzata mediante colorazione immunofluorescente (Figura supplementare 2).
Effetto di un inibitore sulla funzione OC matura
Le condizioni di coltura sopra menzionate sono state utilizzate per determinare la capacità funzionale degli OC generati in vitro in presenza del noto inibitore OC, rotenone34. Le OC sono state differenziate per 6-8 giorni e le OC CD14-OSCAR+ e i precursori OC sono stati arricchiti tramite citometria a flusso (Figura 4). Le cellule arricchite sono state quindi placcate a 50.000 cellule/per pozzetto su una piastra a 96 pozzetti rivestita di minerali in mezzo pro-osteoclastogenico (25 ng/mL M-CSF e RANKL) per 3 giorni. Il trattamento con rotenone (Figura 5A,B) ha inibito in modo dose-dipendente il riassorbimento della superficie mineralizzata rispetto al pozzo di controllo non trattato, coerentemente con gli studi precedenti34. Inoltre, la funzionalità OC è stata valutata tramite la produzione di ATP e la formazione di anelli di actina. L'inibizione rotenone-dipendente del riassorbimento OC è stata associata all'inibizione della produzione di ATP (Figura 5C). Gli OC riassorbenti sono cellule altamente polarizzate che regolano la loro capacità di riassorbimento promuovendo l'organizzazione citoscheletrica. La falloidina coniugata Alexa fluor 647 è stata utilizzata per marcare il citoscheletro F-actina degli OC maturi coltivati in presenza o assenza di rotenone. Il rotenone ha causato la frammentazione dell'anello di actina derivato da RANKL degli OC maturi (Figura 5D).
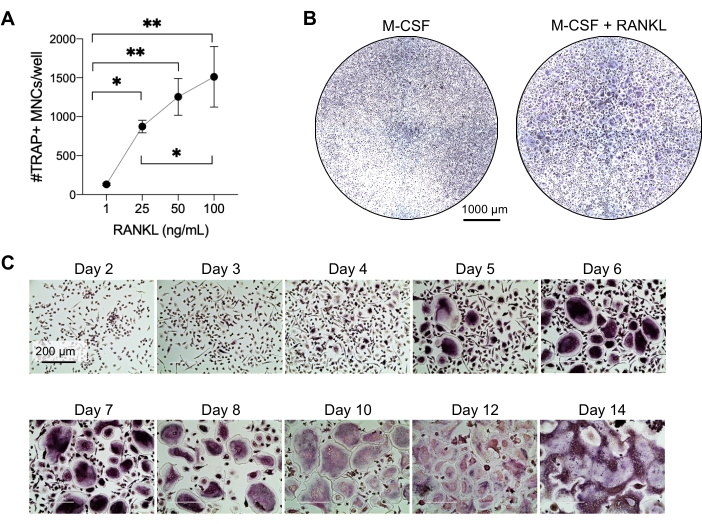
Figura 2: OC che si differenziano efficacemente dai precursori dei monociti CD14+ . I monociti CD14+ sono stati arricchiti magneticamente, placcati a 1 x 105 cellule/pozzetto in piastre a 96 pozzetti e incubati durante la notte con 25 ng/mL M-CSF. (A) I monociti M-CSF-innescati sono stati stimolati con concentrazioni crescenti di RANKL (1 ng / mL, 25 ng / mL, 50 ng / mL e 100 ng / mL), fissati e colorati per TRAP il giorno 7. Sono state acquisite immagini e sono state contate le cellule multinucleate (MNC) TRAP+ . Le immagini rappresentative della colorazione TRAP sono mostrate nella Figura supplementare 1. Le barre di errore mostrano la media ± SD (n = 3). I dati sono stati analizzati con un test unidirezionale di confronto multiplo di ANOVA e Holm-Sidak per i dati accoppiati; * P ≤ 0,05 e ** P ≤ 0,005. (B) Immagine rappresentativa di un pozzetto colorato con TRAP di una piastra a 96 pozzetti che mostra la quantità tipica di OC/pozzo atteso e la loro morfologia inferiore a 25 ng/mL RANK-L rispetto ai macrofagi derivati da M-CSF al giorno 7. Barre della scala: 1000 μm. (C) Immagini rappresentative della formazione di OC sotto 50 ng/mL RANKL valutate tramite colorazione TRAP dal giorno 2 al giorno 14. Gli OC sono visibili dal giorno 5 in poi. OC giganti anormalmente fusi sono presenti dopo 10 giorni. Barre di scala: 200 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
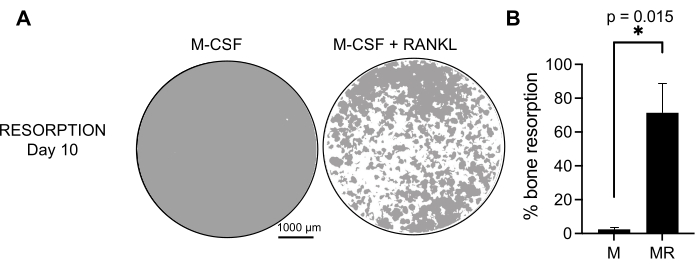
Figura 3: OC di riassorbimento differenziati dai monociti CD14+ . Le cellule CD14+ isolate dalle PBMC sono state differenziate per 10 giorni in OC in presenza di 25 ng/mL M-CSF (M) e RANKL (R) su piastre di superficie di saggio minerale (osteo-assay). (A) Immagini di pozzi rappresentativi ricostruiti presi a ingrandimento 10x per analizzare il riassorbimento il giorno 10 (substrato minerale in grigio; pozzi di riassorbimento in bianco). Barre della scala: 1000 μm. (B) Quantificazione della percentuale di area riassorbita. I dati di riassorbimento sono stati analizzati con un'analisi accoppiata di Wilcoxon. Le barre di errore mostrano la media ± SD (n = 7). Fare clic qui per visualizzare una versione ingrandita di questa figura.
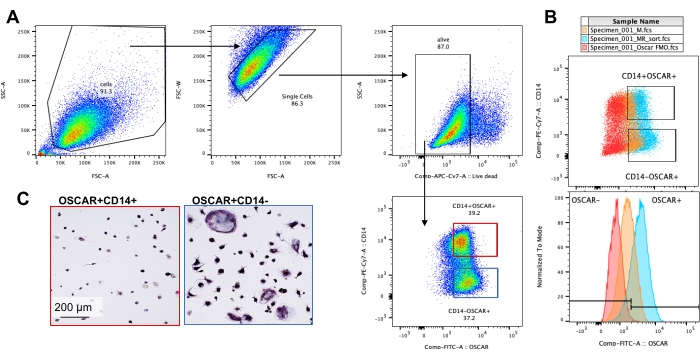
Figura 4: Arricchimento citometrico a flusso di OC CD14−OSCAR+. I monociti CD14+ sono stati arricchiti dalle PBMC e gli OC sono stati differenziati come descritto in precedenza. Le colture OC aderenti sono state staccate con accutasi e colorate per citometria a flusso. (A-C) Gli OC al giorno 8 sono stati ordinati in base all'espressione CD14 e OSCAR. (A) Strategia di smistamento rappresentativa. Le cellule sono state contrassegnate come singoletto, negative per la colorazione morta, e sono stati ordinati i sottogruppi CD14+ OSCAR+ (rosso) e CD14− OSCAR+ (blu). (B) Grafici rappresentativi che mostrano la sovrapposizione della colorazione OSCAR degli OC derivati da RANKL (ciano) e dei macrofagi derivati da M-CSF di controllo (arancione). In rosso è riportato il controllo OSCAR colorato con isotipo degli OC derivati da RANKL. (C) Le popolazioni selezionate sono state placcate su plastica e lasciate aderire per 2 ore in mezzo pro-OC (25 ng / mL M-CSF e 50 ng / mL RANKL), seguite da colorazione e visualizzazione TRAP. Le immagini rappresentative mostrano una mancanza di cellule TRAP+ nel sottogruppo CD14+ (rosso) e pre-OC e OC TRAP+ mono- e multinucleati nel sottogruppo CD14− (blu). Barre di scala: 200 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
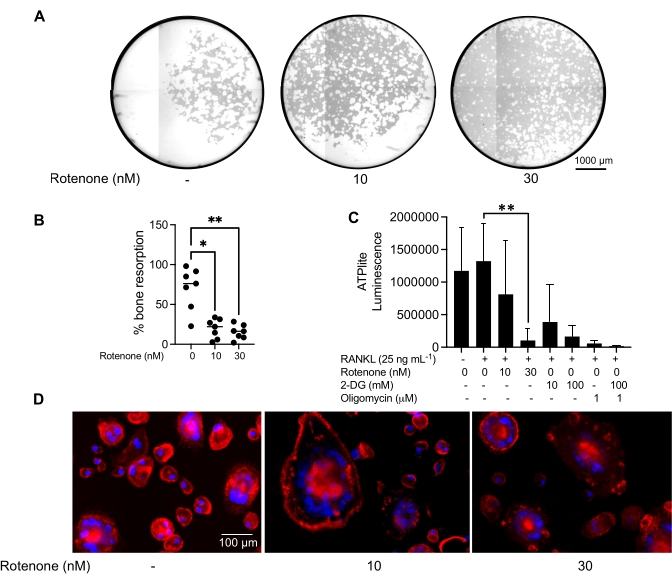
Figura 5: Saggi per valutare la funzione degli OC maturi. Per valutare la funzione delle OC mature, le cellule CD14+ isolate dalle PBMC sono state coltivate con M-CSF (M) da solo o combinate con RANKL (R) per 7 giorni, le OC sono state arricchite tramite citometria a flusso e le OC sono state quindi trattate con l'inibitore rotenone per 24 ore. (A) Le OC mature sono state selezionate tramite citometria a flusso (CD14-OSCAR+) e sono stati coltivati su una superficie di saggio minerale in presenza o assenza di rotenone per 3 giorni, dopo di che le cellule sono state sbiancate e visualizzate a 10x per rivelare l'area riassorbita (pozzi di riassorbimento in bianco). (A) Immagini rappresentative ricostruite dei pozzi. Barre di scala: 1000 μm. (B) La quantificazione della percentuale di area riassorbita. I dati in (B) sono stati analizzati con un ANOVA unidirezionale con il test di confronto multiplo di Dunn (n = 7); * P ≤ 0,05 e** P ≤ 0,01. Le barre di errore mostrano la media ± DS. (C) Contenuto totale di ATP intracellulare di OC maturi indifferenziati e al giorno 7 differenziati differenziati con RANKL e trattati con veicolo o rotenone (10 nM e 30 nM). Qui, 2DG e oligomicina sono stati utilizzati come controlli positivi per il test e sono stati aggiunti 30 minuti prima della lisi cellulare e della quantificazione dell'ATP. Le barre di errore mostrano la media ± SD (n = 4). I dati sono stati analizzati con un test di confronto multiplo ANOVA unidirezionale e Dunnett per i dati accoppiati. ** P ≤ 0,01. (D) Un'immagine rappresentativa 20x di OC maturi colorati per la formazione dell'anello di actina (rosso) e dei nuclei (blu), che mostra la perdita dell'anello di actina con l'inibitore. Barre di scala: 100 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Formato piastra | 96 pozzetti | 48 pozzetti | 24 pozzetti | 12 pozzetti | 6 pozzetti |
| volume | 100 μL | 225–250 μL | 450–500 μL | 0,8–1 mL | 1,8–2 ml |
Tabella 1: Volume della sospensione di celle per diversi formati di piastre. I volumi sono calcolati a partire da una soluzione 1 x 106 cellule/mL e forniscono una densità ottimale per la fusione cellula-cellula.
| Fluoroforo, clone | Volume (μL) per 106 celle | |
| CD14 | PE/Cianina7, HCD14 | 5 μL |
| OSCAR | FITC, REA494 | 10 μL |
| Buffer di ordinamento delle celle | 80 μL |
Tabella 2 : Soluzione master mix di anticorpi.
Figura supplementare 1: Colorazione TRAP della risposta alla dose RANKL. I monociti CD14+ sono stati arricchiti magneticamente, placcati a 1 x 105 cellule/pozzetto in piastre da 96 pozzetti e incubati durante la notte con 25 ng/mL M-CSF, come in Figura 2. Le immagini rappresentative della colorazione TRAP mostrano monociti MCSF-innescati stimolati con concentrazioni crescenti di RANKL (1 ng / mL, 25 ng / mL, 50 ng / mL e 100 ng / mL), fissi e colorati per TRAP il giorno 7. Barre scala: 400 μm. Clicca qui per scaricare questo file.
Figura supplementare 2: Colorazione dell'anello ad azione in OC completamente differenziati. (A) Un ingrandimento 10x di OC differenziati su plastica TC e colorati con falloidina AF647 (in rosso). Barra della scala: 400 μm. (B) Ingrandimento 40x di OC differenziati su vetrini a camera di vetro e colorati con falloidina AF488 (in giallo). Barra della scala: 100 μm.I nuclei sono colorati con DAPI, mostrati in blu in (A) e in ciano in (B). Clicca qui per scaricare questo file.
Figura supplementare 3: Effetto di diversi lotti FBS sull'efficienza di differenziazione OC. Gli OC sono stati differenziati dai monociti CD14+ in presenza di 25 ng/mL M-CSF e 50 ng/mL RANKL (MR) per 7 giorni. I pozzi di controllo avevano solo M-CSF (M). (A) Ingrandimenti rappresentativi 10x (barre della scala: 400 μm) e (B) quantificazione degli OC colorati con TRAP differenziati da un donatore in due diversi lotti di FBS. Le barre di errore mostrano la media ± SD di tre repliche tecniche. Clicca qui per scaricare questo file.
Discussione
La facile coltura e l'isolamento di un gran numero di OC funzionali in vitro sono importanti per far progredire la comprensione della biologia ossea e delle malattie mediate da OC. Classicamente, gli OC sono stati generati in co-colture con osteoblasti o cellule stromali e cellule ematopoietiche dalla milza o dal midollo osseo38,39. Un significativo passo avanti nella comprensione dell'osteoclastogenesi è stata l'identificazione di RANKL come il principale regolatore della formazione, differenziazione e sopravvivenza dell'OC40. I primi protocolli dei sistemi di coltura dipendenti da RANKL utilizzavano PBMC per la generazione di OC21,41,42. Tuttavia, queste colture miste sono lunghe e presentano molti fattori confondenti che limitano la capacità di testare gli effetti diretti sulla differenziazione e sulla funzione OC. Questo protocollo descrive un modello in vitro efficiente e affidabile di osteoclastogenesi da monociti CD14+ periferici umani in cui l'osteoclastogenesi ottimale può essere ottenuta entro 7 giorni (Figura 1 e Figura 2), che è considerevolmente più veloce rispetto ad altri protocolli43,44,45,46. Le principali caratteristiche distintive di questo protocollo sono (1) l'uso di monociti CD14+ purificati, (2) l'adescamento dei monociti con M-CSF prima dell'esposizione a RANKL, (3) la durata della coltura (<7 giorni) e (4) il rilevamento affidabile dell'inibizione della formazione di OC (colorazione TRAP) e della funzione (riassorbimento, produzione di ATP, riorganizzazione dell'anello di actina) con inibitori.
Durante l'ottimizzazione della metodologia sono stati identificati diversi punti critici. È stato osservato che la differenziazione in vitro degli OC dipende in gran parte dalla densità di semina dei monociti CD14+. Pertanto, in questo protocollo, le cellule sono seminate ad alta densità (1 x 105 cellule / pozzetto di una piastra a 96 pozzetti, in 100 μL di mezzo), poiché è essenziale che le cellule siano in grado di interagire tra loro e di essere in prossimità di fondersi e diventare OC maturi. Allo stesso modo, la semina di cellule a una densità troppo elevata limita la loro differenziazione e crescita a causa delle limitazioni medie e della mancanza dello spazio richiesto. Inoltre, per ottenere il massimo successo con questo protocollo, è importante eseguire attentamente la separazione del gradiente di densità e garantire che la popolazione arricchita di cellule CD14+ sia il più pura possibile. Ad esempio, fasi di lavaggio inadeguate provocano una mancanza di rimozione delle piastrine, che di conseguenza inibisce la differenziazione OC47,48. Allo stesso modo, la presenza di contaminazione minore delle cellule T in preparati CD14+ isolati stimolati con M-CSF da solo può provocare la differenziazione OC, potenzialmente attraverso la secrezione di RANKL da parte delle cellule T49. Pertanto, è importante includere un controllo M-CSF per ogni esperimento. Si raccomanda inoltre un controllo di purezza di routine, soprattutto quando si utilizza un nuovo kit di isolamento, per garantire la purezza del campione.
I numeri OC ottimali (intervallo: ~200-1.600 OC/pozzetto) sono ottenuti utilizzando mezzo α-MEM arricchito con nucleosidi e L-glutammina. Altri terreni di coltura convenzionali, tra cui il terreno di coltura modificato di Dulbecco (DMEM) e il terreno di coltura 1640 del Roswell Park Memorial Institute (RPMI), influenzano la resa OC. La fonte di FBS può anche influenzare l'osteoclastogenesi. Diversi lotti di FBS possono portare a una riduzione dell'osteoclastogenesi derivata da RANK-L, nonché alla comparsa di un basso numero di cellule multinucleate TRAP+ nei controlli M-CSF (Figura 3 supplementare). Pertanto, per ottenere risultati coerenti, si consiglia di testare nuovi lotti FBS prima dell'uso e di continuare con lo stesso lotto durante gli esperimenti per ridurre al minimo le variazioni nel processo di differenziazione. Inoltre, la variabilità da donatore a donatore, in termini di numero totale di OC differenziati ottenuti al punto temporale finale, costituisce una limitazione quando si utilizza questo protocollo per confrontare, ad esempio, donatori sani con pazienti. In questi casi, è imperativo utilizzare esattamente le stesse condizioni e lo stesso lotto di mezzo, FBS e altri reagenti.
Un altro passo necessario per la differenziazione e la maturazione ottimale dell'OC è l'adescamento dei monociti con M-CSF prima dell'aggiunta di RANKL. L'esposizione delle cellule a M-CSF 18-24 ore prima di RANKL prepara i monociti a sovraregolare l'espressione di RANK15,26. L'aggiunta di RANKL in questo momento garantisce una differenziazione OC ottimale in modo dose-dipendente. Il grado di differenziazione OC varia da donatore a donatore; tuttavia, 25 ng/mL RANKL sono di solito sufficienti per differenziare un numero elevato di OC nella maggior parte dei donatori. Inoltre, 25 ng/mL RANKL possono essere utilizzati nei saggi per lo screening iniziale dei composti, in quanto facilita la valutazione degli effetti potenzianti e inibitori dei composti in esame. Altri sistemi di coltura hanno utilizzato tempi di pre-incubazione M-CSF più lunghi prima dell'aggiunta di RANKL, ma ciò si traduce in un tempo di coltura più lungo per l'osteoclastogenesi50. Inoltre, lasciare i monociti innescati per incubare durante la notte consente loro di attaccarsi alla piastra, anche se non in uno stato completamente aderente. Pertanto, quando RANKL viene introdotto per la prima volta, il terreno deve essere cambiato a metà con molta attenzione piuttosto che completamente cambiato per prevenire il distacco e la perdita dei monociti innescati. Il terreno deve anche essere rinfrescato ogni 3-4 giorni per evitare l'esaurimento del mezzo e prevenire la morte cellulare. Inoltre, a causa del basso volume utilizzato in questo test (100 μL/pozzetto in una piastra da 96 pozzetti), è della massima importanza disporre di una struttura di pozzetti vuoti riempiti con una soluzione acquosa (cioè H2O o PBS distillato sterile) attorno ai pozzetti di analisi. Ciò impedisce l'evaporazione media e gli effetti dei bordi.
Infine, per i saggi metabolici (ad esempio, i saggi ATP), è imperativo che le cellule siano vitali per evitare un'enorme deviazione standard tra le repliche (Figura 5). Un'elevata vitalità delle cellule è importante anche per la selezione delle cellule e per l'ulteriore coltura degli OC selezionati (Figura 4). Questo metodo, tuttavia, ha diverse limitazioni. Gli OC completamente maturi sono molto aderenti e difficili da staccare dalle piastre. Gli OC più grandi sono spesso impossibili da staccare, il che può portare a una minore resa cellulare. Pertanto, le cellule devono essere contate dopo la selezione e prima della placcatura alla concentrazione richiesta. Inoltre, nel presente protocollo, viene utilizzato un metodo non enzimatico (accutasi) per staccare gli OC per prevenire alterazioni della membrana nella colorazione superficiale a valle per la citometria a flusso. Anche l'uso di raschiatori cellulari (sia con terminazioni morbide che dure) è stato testato e ha portato a un'elevata morte cellulare. Il distacco enzimatico con soluzioni di tripsina/EDTA allo 0,05% può essere utilizzato per una maggiore resa di OC distaccati quando l'integrità della membrana non è richiesta per applicazioni a valle. Inoltre, per evitare che gli OC si aggreghino, l'uso di un'alta concentrazione di EDTA in tutti i tamponi dopo il distacco della cellula, nonché un appropriato filtraggio prima dell'acquisizione della citometria a flusso, sono altamente raccomandati. È importante notare che le colture OC sono una popolazione eterogenea di cellule costituite da OC maturi, precursori OC e macrofagi. I macrofagi possono essere facilmente distinti dagli OC, sebbene sia i pre-OC mononucleati che gli OC multinucleari esprimano OSCAR e non possano essere distinti con il presente metodo (Figura 4). In effetti, quest'ultima questione costituisce il principale limite di questo metodo. Inoltre, una bassa espressione di OSCAR è presente anche nelle colture M-CSF (Figura 4B) e potrebbe indicare macrofagi che sono pronti per l'impegno del lignaggio OC. È importante impostare il gate per le celle OSCAR+ in base al segnale di colorazione FMO, come mostrato nella Figura 4B.
In sintesi, questo protocollo descrive un metodo ottimizzato e robusto per la produzione efficiente di OC attivi e funzionalmente maturi da monociti umani primari circolanti. Il punto di forza di questo protocollo è la sua capacità di generare OC in una breve durata di tempo e produrre un numero elevato di OC differenziati. Questo metodo apre la strada allo studio dei meccanismi di base alla base della differenziazione e della funzione OC.
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Gli autori ringraziano con gratitudine la Flow Core Facility e la Glasgow Imaging Facility (GIF) all'interno della School of Infection and Immunity per il loro supporto e assistenza in questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 well chamber slides | ibidi | 81816 | |
| 8-well glass chamber slides | Ibidi | 80807 | |
| 96-well TC plate | Corning | 3596 | |
| 96-well osteo assay stripwell plate | Corning | 3989 | |
| Acetate solution | Sigma Aldrich | 386-3 | from kit Cat No. 387A-1KT |
| Acetone | VWR | 20066.330 | |
| Acid phosphatase, Leukocyte (TRAP) kit | SIGMA-ALDRICH | 387A-1KT | |
| Alexa Fluor 488 Phalloidin | Theremo Fisher - Invitrogen | A12379 | AF488 |
| Alexa Fluor 647 Phalloidin | Thermo Fisher - Invitrogen | A22287 | AF647 |
| Alfa Aesar 2-Deoxy-D-glucose | Fisher Scientific | 11321867 | 2DG, 98% |
| Alpha minimum essential medium | gibco | 22571-020 | |
| ATPlite 1step | PerkinElmer | 6016731 | Luminiscence ATP detection assay system |
| BD FACSAria III cell sorter | BD Biosciences | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418-100G | |
| Cell culture microplate, 96-well, PS, F-bottom | Greiner bio-one | 655083 | White-bottom plates |
| Citrate solution | Sigma Aldrich | 91-5 | from kit Cat No. 387A-1KT |
| Corning 6ml round-bottom polystyrene test tubes | Fisher Scientific | 352054 | |
| Corning osteo assay surface multiple well plate | Sigma-Aldrich | CLS3989 | |
| Corning osteo assay Surface multiple well plate 1 x 8 stripwell | Corning | CLS3989-2EA | |
| DAPI | Theremo Fisher | D3571 | |
| EasySep human CD14 positive selection kit | STEMCELL Technologies | 17858 | |
| EasySep red blood cell lysis buffer (10x) | StemCell Technologies | 20110 | |
| eBioscience fixable viability dye eFluor 780 | Theremo Fisher - Invitrogen | 65-0865-14 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E7889-100ML | |
| EVOS FL auto imaging system | Thermo Fisher | A32678 | |
| Falcon round-bottom polypropylene test tubes with cap | Fisher Scientific | 10314791 | |
| Falcon tubes 15 mL | Corning | 430790 | |
| Falcon tubes 50 mL | Corning | 430828 | |
| Fast Garnet GBC base solution | Sigma Aldrich | 387-2 | from kit Cat No. 387A-1KT |
| Fetal bovine serum | gibco | 10500-064 | FBS |
| Ficoll-Paque Plus | cytiva | 17144003 | |
| Formaldehyde | Sigma-Aldrich | F-8775 | |
| Human sRANK ligand | PEPROTECH | 310-01-100UG | Receptor activator of nuclear factor kappa-B ligand (RANKL) |
| ImageJ Image analysis software | Image J | version 2.9.0 | |
| L-glutamine | gibco | 25030-024 | |
| Lithium heparin tubes (9 mL) | VACUETTE | 455084 | |
| Macrophage colony-stimulating factor | PEPROTECH | 300-25-100UG | M-CSF |
| Napthol AS-BI phosphoric acid solution | Sigma Aldrich | 387-1 | from kit Cat No. 387A-1KT |
| Neubauer hemacytometer counting chamber | Camlab | SKU 1127885 | |
| Oligomycin from Streptomyces Diastatochromogenes | Sigma-Aldrich | Q4876-5MG | |
| OSCAR Antibody, anti-human, Vio Bright FITC, REAfinit | Miltenyi Biotec | 130-107-661 and 130-107-617 | Clone REA494 |
| PE/Cyanine7 anti-human CD14 antibody | Biolegend | 325618 | Clone HCD14 |
| Penicilin/streptomycin | SIGMA | P0781 | |
| PHERAstar machine and software | BMG LABTECH | ||
| Phosphate-buffered saline (DPBS, 1x) | gibco | 14190-094 | |
| REA control antibody (S), human IgG1, Vio Bright FITC, REAfinity | Miltenyi Biotec | 130-113-443 | |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044-1L | |
| Sodium nitrite solution | Sigma Aldrich | 91-4 | from kit Cat No. 387A-1KT |
| Tartrate solution | Sigma Aldrich | 387-3 | from kit Cat No. 387A-1KT |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Trypan blue | Sigma-Aldrich | T8154-100ML |
Riferimenti
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Boyce, B. F., Xing, L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives Of Biochemistry and Biophysics. 473 (2), 139-146 (2008).
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Agemura, T., Hasegawa, T., Yari, S., Kikuta, J., Ishii, M. Arthritis-associated osteoclastogenic macrophages (AtoMs) participate in pathological bone erosion in rheumatoid arthritis. Immunological Medicine. 45 (1), 22-26 (2022).
- Hasegawa, T., et al. Identification of a novel arthritis-associated osteoclast precursor macrophage regulated by FoxM1. Nature Immunology. 20 (12), 1631-1643 (2019).
- Walsh, N. C., Crotti, T. N., Goldring, S. R., Gravallese, E. M. Rheumatic diseases: The effects of inflammation on bone. Immunological Reviews. 208 (1), 228-251 (2005).
- Gravallese, E. M., et al. Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis. The American Journal of Pathology. 152 (4), 943-951 (1998).
- Bromley, M., Woolley, D. E. Chondroclasts and osteoclasts at subchondral sites of erosion in the rheumatoid joint. Arthritis & Rheumatism. 27 (9), 968-975 (1984).
- Kleyer, A., Schett, G. Arthritis and bone loss: A hen and egg story. Current Opinion in Rheumatology. 26 (1), 80-84 (2014).
- Kawai, V. K., Stein, C. M., Perrien, D. S., Griffin, M. R. Effects of anti-tumor necrosis factor α (anti-TNF) agents on bone. Current Opinion in Rheumatology. 24 (5), 576-585 (2012).
- Siebert, S., Tsoukas, A., Robertson, J., McInnes, I. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases. Pharmacological Reviews. 67 (2), 280-309 (2015).
- Smiljanovic, B., et al. Monocyte alterations in rheumatoid arthritis are dominated by preterm release from bone marrow and prominent triggering in the joint. Annals of the Rheumatic Diseases. 77 (2), 300-308 (2018).
- Anderson, J. R., et al. 1H NMR metabolomics identifies underlying inflammatory pathology in osteoarthritis and rheumatoid arthritis synovial joints. Journal of Proteome Research. 17 (11), 3780-3790 (2018).
- McGarry, T., et al. Rheumatoid arthritis CD14+ monocytes display metabolic and inflammatory dysfunction, a phenotype that precedes clinical manifestation of disease. Clinical & Translational Immunology. 10 (1), 1237 (2021).
- Ansalone, C., et al. TNF is a homoeostatic regulator of distinct epigenetically primed human osteoclast precursors. Annals of the Rheumatic Diseases. 80 (6), 748-757 (2021).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis and Rheumatology. 73 (7), 1145-1154 (2021).
- Allard-Chamard, H., et al. Osteoclasts and their circulating precursors in rheumatoid arthritis: Relationships with disease activity and bone erosions. Bone Reports. 12, 100282 (2020).
- Takegahara, N., et al. Involvement of receptor activator of nuclear factor-κB ligand (RANKL)-induced incomplete cytokinesis in the polyploidization of osteoclasts. The Journal of Biological Chemistry. 291 (7), 3439-3454 (2016).
- Jansen, I. D. C., Vermeer, J. A. F., Bloemen, V., Stap, J., Everts, V. Osteoclast fusion and fission. Calcified Tissue International. 90 (6), 515-522 (2012).
- McDonald, M. M., et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 184 (5), 1330-1347 (2021).
- Lacey, D. L., et al. Bench to bedside: Elucidation of the OPG-RANK-RANKL pathway and the development of denosumab. Nature Reviews Drug Discovery. 11 (5), 401-419 (2012).
- Zhao, B., Grimes, S. N., Li, S., Hu, X., Ivashkiv, L. B. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J. The Journal of Experimental Medicine. 209 (2), 319-334 (2012).
- Zhao, B. Does TNF promote or restrain osteoclastogenesis and inflammatory bone resorption. Critical Reviews in Immunology. 38 (4), 253-261 (2018).
- Crotti, T. N., et al. Receptor activator NF-κB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Annals of the Rheumatic Diseases. 61 (12), 1047-1054 (2002).
- Kim, H. R., et al. Reciprocal activation of CD4+ T cells and synovial fibroblasts by stromal cell-derived factor 1 promotes RANKL expression and osteoclastogenesis in rheumatoid arthritis. Arthritis and Rheumatology. 66 (3), 538-548 (2014).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor κB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Hayman, A. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
- Nedeva, I. R., Vitale, M., Elson, A., Hoyland, J. A., Bella, J. Role of OSCAR signaling in osteoclastogenesis and bone disease. Frontiers in Cell and Developmental Biology. 9, 780 (2021).
- Boyce, B. F., Yoneda, T., Lowe, C., Soriano, P., Mundy, G. R. Requirement of pp60c-src expression for osteoclasts to form ruffled borders and resorb bone in mice. The Journal of Clinical Investigation. 90 (4), 1622-1627 (1992).
- Matsubara, T., et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin. Biochemical and Biophysical Research Communications. 489 (4), 472-476 (2017).
- Roscher, A., et al. The F-actin modulator SWAP-70 controls podosome patterning in osteoclasts. Bone Reports. 5, 214-221 (2016).
- Jurdic, P., Saltel, F., Chabadel, A., Destaing, O. Podosome and sealing zone: Specificity of the osteoclast model. European Journal of Cell Biology. 85 (3-4), 195-202 (2006).
- Francis, M. J. O., et al. ATPase pumps in osteoclasts and osteoblasts. The International Journal of Biochemistry & Cell Biology. 34 (5), 459-476 (2002).
- Kwak, H. B., et al. Inhibition of osteoclast differentiation and bone resorption by rotenone, through down-regulation of RANKL-induced c-Fos and NFATc1 expression. Bone. 46 (3), 724-731 (2010).
- Massey, H. M., Flanagan, A. M. Human osteoclasts derive from CD14-positive monocytes. British Journal of Haematology. 106 (1), 167-170 (1999).
- Xue, J., et al. CD14+CD16-monocytes are the main precursors of osteoclasts in rheumatoid arthritis via expressing Tyro3TK. Arthritis Research and Therapy. 22 (1), 221 (2020).
- Marco-Casanova, P., et al. Preparation of peripheral blood mononuclear cell pellets and plasma from a single blood draw at clinical trial sites for biomarker analysis. Journal of Visualized Experiments. (169), e60776 (2021).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Matsuzaki, K., et al. Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. Biochemical and Biophysical Research Communications. 246 (1), 199-204 (1998).
- Shalhoub, V., et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell precursors. Journal of Cellular Biochemistry. 72 (2), 251-261 (1999).
- Neale, S. D., Smith, R., Wass, J. A. H., Athanasou, N. A. Osteoclast differentiation from circulating mononuclear precursors in Paget's disease is hypersensitive to 1,25-dihydroxyvitamin D3 and RANKL. Bone. 27 (3), 409-416 (2000).
- Abdallah, D., et al. An optimized method to generate human active osteoclasts from peripheral blood monocytes. Frontiers in Immunology. 9, 632 (2018).
- Komano, Y., Nanki, T., Hayashida, K., Taniguchi, K., Nobuyuki, M. Identification of a human peripheral blood monocyte subset that differentiates into osteoclasts. Arthritis Research and Therapy. 8 (5), 152 (2006).
- Kylmäoja, E., et al. Peripheral blood monocytes show increased osteoclast differentiation potential compared to bone marrow monocytes. Heliyon. 4 (9), 00780 (2018).
- Wang, D., et al. Platelet-rich plasma inhibits RANKL-induced osteoclast differentiation through activation of Wnt pathway during bone remodeling. International Journal of Molecular Medicine. 41 (2), 729-738 (2018).
- Cenni, E., Avnet, S., Fotia, C., Salerno, M., Baldini, N. Platelet-rich plasma impairs osteoclast generation from human precursors of peripheral blood. Journal of Orthopaedic Research. 28 (6), 792-797 (2010).
- D'Amico, L., Roato, I. Cross-talk between T cells and osteoclasts in bone resorption. BoneKEy Reports. 1 (6), 82 (2012).
- Quinn, J. M. W., Elliott, J., Gillespie, M. T., Martin, T. J. A combination of osteoclast differentiation factor and macrophage-colony stimulating factor is sufficient for both human and mouse osteoclast formation in vitro. Endocrinology. 139 (10), 4424-4427 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon