Method Article
기능성 파골세포와 인간 말초 혈액 CD14+ 단핵구의 분화
요약
파골세포는 신체의 주요 뼈 흡수 세포입니다. 이 프로토콜은 인간 말초 혈액 단핵구로부터 파골세포의 시험관내 분화를 위한 신뢰할 수 있는 방법을 설명합니다. 이 방법은 항상성 및 질병에서 파골세포 생물학을 더 깊이 이해하는 데 중요한 도구로 사용될 수 있습니다.
초록
파골세포(OC)는 골격 발달과 성인 뼈 리모델링에 중추적인 역할을 하는 뼈 흡수 세포입니다. 여러 뼈 질환은 OC의 분화 및 활성화 증가로 인해 발생하므로 이 병리학의 억제가 핵심 치료 원리입니다. 골수 전구체에서 OC의 분화를 유도하는 두 가지 핵심 요인은 대식세포 집락 자극 인자(M-CSF)와 핵 인자 카파-B 리간드의 수용체 활성화제(RANKL)입니다. 인간 순환 CD14+ 단핵구는 시험관 내에서 OC로 분화하는 것으로 오랫동안 알려져 왔습니다. 그러나 노출 시간과 RANKL의 농도는 분화 효율에 영향을 미칩니다. 실제로, 시험관 내에서 인간 OC를 생성하기 위한 프로토콜이 설명되었지만 종종 열악하고 긴 분화 과정을 초래합니다. 여기서, 기능적으로 활성인 성숙한 인간 OC를 적시에 생성하기 위한 견고하고 표준화된 프로토콜이 제공된다. CD14+ 단핵구는 인간 말초 혈액 단핵 세포(PBMC)에서 농축되고 M-CSF로 프라이밍되어 RANK를 상향 조절합니다. RANKL에 대한 후속 노출은 용량 및 시간 의존적 방식으로 OC를 생성합니다. OC는 타르타르산염 내산성 포스파타제(TRAP) 및 광학 현미경 분석으로 염색하여 식별 및 정량화합니다. 핵 및 F-액틴의 면역형광 염색은 기능적으로 활성인 OC를 식별하는 데 사용됩니다. 또한 OSCAR+CD14- 성숙 OC는 유세포 분석 세포 분류 및 광물(또는 상아질/뼈) 흡수 분석 및 액틴 고리 형성으로 정량화된 OC 기능을 통해 더욱 풍부해집니다. 마지막으로, 알려진 OC 억제제인 로테논이 성숙한 OC에 사용되어 아데노신 삼인산(ATP) 생성이 액틴 고리 무결성 및 OC 기능에 필수적임을 보여줍니다. 결론적으로, 많은 수의 OC를 감별하기 위한 강력한 분석법이 이 연구에서 확립되었으며, 이는 액틴 고리 염색 및 ATP 분석과 함께 OC 기능을 평가하고 분화 과정을 조절할 수 있는 새로운 치료 화합물을 스크리닝하는 데 유용한 시험관 내 모델을 제공합니다.
서문
파골세포(OC)는 뼈를 재흡수하는 독특한 능력을 가진 조혈 계통의 다핵 거대 세포입니다. 그들은 골격 1,2의 개발과 지속적인 리모델링을 담당합니다. 발달의 골격 단계에서 OC와 조직에 상주하는 대식세포는 적혈구-골수 전구체에서 파생되며 뼈 틈새와 장기 조직을 식민지화합니다. 생리학적 조건에서 정상적인 뼈 발달과 치아 맹출을 위해서는 적혈구-골수 전구체가 필요하며, 순환하는 혈액 단핵구가 뼈 틈새로 유입되면 OC, 골량 및 골수강이 출생 후 유지된다3. 병리학 적 조건 하에서, 단핵구는 활동성 염증 부위로 모집되어 병리학 적 뼈 파괴에 기여할 수 있습니다 4,5.
여러 형태의 관절염 환자는 관절 염증을 경험하여 OC로 인한 점진적인 관절 파괴를 유발합니다6. 예를 들어, 류마티스 관절염(RA)에서 과활성화된 OC는 병적인 뼈 침식과 관절 파괴의 원인이 되며7,8, 현재의 치료법은 종종 뼈 손상을 개선하거나 중지시키지 않습니다9,10,11. 집단 분포와 전사체 및 후성유전학적 시그니처 측면에서 순환 단핵구의 변화가 RA 환자에서 보고되었습니다12,13,14. 더욱이, 염증 자극에 대한 변경된 단핵구 반응이 활동성 질환을 갖는 RA 환자에서 파골세포 형성에 영향을 미친다고 보고되었다15,16,17.
OC의 분화는 골수 전구체 세포가 OC 전구체로 분화하는 것을 포함하는 복잡한 다단계 과정입니다. 파골세포 형성 동안 OC는 세포-세포 융합, 불완전한 사이토키네시스, 핵분열 및 융합으로 설명되는 핵 재활용 과정을 통해 거대해지고 다핵화됩니다18,19,20. 시험관 내에서 OC를 구별하는 능력은 뼈 생물학에 대한 이해에 상당한 발전을 가져왔다21. OC는 대식세포 집락 자극 인자(M-CSF) 및 핵 인자 카파-B 리간드의 수용체 활성화제(RANKL)에 노출되면 전구체와 구별됩니다. 후자는 염증 상태 하에서도 시험관 내 및 생체 내에서 OC의 정상적인 발달 및 기능에 필수적입니다 6,22,23. RANKL은 조골세포 및 골세포뿐만 아니라 염증이 있는 RA 활막 2,24,25에서 활성화된 T 세포 및 섬유아세포에 의해 제시된다. OC 분화 과정에서 M-CSF에 노출된 단핵구는 세포막에서 핵 인자 카파-B(RANK) 발현의 수용체 활성화제를 상향 조절하고, RANKL에 의한 후속 자극 하에서 타르타르산염 내성 산 포스파타제(TRAP) 양성 단핵 pre-OC로 분화한 다음 다핵 OC15,26. OC는 여러 효소를 생성하며, 그 중 가장 중요한 것은 TRAP으로, 뼈27 내에서 인단백질을 분해할 수 있습니다. OC 분화의 조절자 및 마커는 OC 관련 수용체(OSCAR)입니다. OC 계통에 전념하는 전구체 세포 초기에 상향 조절됩니다28. 성숙한 거대 다핵 OC는 주름진 경계21,29,30을 둘러싸는 액틴 고리로 만들어진 큰 밀봉 영역을 생성함으로써 골격 매트릭스를 분해(재흡수)할 수 있습니다. OC의 골 흡수 능력은 세포 골격 재구성과 그에 따른 분극 및 소위 주름진 경계인 나선형 막의 형성을 필요로 합니다. 주름진 테두리는 액틴 링 또는 밀봉 영역인 F-액틴이 풍부한 구조의 큰 원형 밴드로 둘러싸여 있습니다. 액틴 고리 무결성은 OC가 시험관 내 및 생체 내에서 뼈를 재흡수하는 데 필수적이며, 결함이 있는 주름진 경계 형성은 하부 액포 아데노신 트리포스파타제(V-ATPase) 발현과 관련이 있습니다31,32,33. 또한, OC는 미토콘드리아가 풍부한 세포이며, 아데노신 삼인산(ATP)은 주름진 경계31,32,33에 국한된 OC에서 미토콘드리아 유사 구조와 결합합니다. 로테논은 미토콘드리아 복합체 I의 강력한 억제제로 작용하여 ATP 생산에 영향을 미칩니다. 로테논은 또한 OC 분화와 기능을 억제하는 것으로 나타났다34.
이 프로토콜은 인간 말초 혈액 샘플에서 시험관내 파골세포 형성의 효율적이고 최적화된 방법을 설명합니다. 인간 말초 혈액에서 CD14+ 단핵구는 OC15,35,36의 주요 공급원입니다. 이 프로토콜에서 노출 동역학과 M-CSF 및 RANKL의 농도는 최적의 파골세포 형성을 위해 조정되었습니다. 단핵 세포는 먼저 밀도 구배에 의해 전혈에 존재하는 적혈구 및 과립구로부터 분리됩니다. 그런 다음 자성 비드에 의한 양성 선택을 사용하여 CD14+ 단핵구에 대해 농축됩니다. 그런 다음 분리된 CD14+ 단핵구를 M-CSF와 함께 밤새 배양합니다. 이것은 단핵구가 RANK15,26의 발현을 상향 조절하도록 프라이밍합니다. RANKL의 후속 추가는 시간 의존적 방식으로 파골세포 형성 및 다핵 형성을 유도합니다. 활성 흡수 OC는 세포막30,32의 가장자리에서 F-액틴 고리의 특징적인 분포와 TRAP에 대한 염색을 보여줍니다. 성숙한 OC는 TRAP+ 다핵(3개 이상의 핵) 세포를 정량화하여 분석합니다. 성숙한 OC의 기능적 능력은 흡수, 액틴 고리 무결성 및 ATP 생성으로 평가할 수 있습니다. 또한, 차별화된 CD14- OSCAR+ OC를 농축하여 미네랄(또는 상아질) 흡수 및 F-액틴 조직을 통해 OC 기능에 대한 특정 화합물의 효과를 평가하는 데 사용할 수 있습니다. 또한, 이 연구에서, 알려진 OC 억제제인 로테논은 OC의 기능에 영향을 미치는 화합물의 예시로서 사용된다. 로테논 하에서 감소된 OC 흡수 활성은 감소된 ATP 생산 및 액틴 고리 단편화와 관련이 있습니다. 결론적으로, 이 프로토콜은 시험관 내에서 OC 분화 및 기능의 여러 생물학적 측면을 연구하기 위한 참조 방법으로 사용할 수 있는 강력한 분석을 설정합니다.
이 방법론은 (1) 건강 및 질병에서 OC로 분화할 수 있는 순환 단핵구의 가능성과 (2) OC 분화 및 기능에 대한 치료 후보의 영향을 평가하는 데 사용할 수 있습니다. 이 강력한 파골세포 형성 프로토콜을 사용하면 전구체 세포로부터의 OC 분화와 성숙한 OC의 기능 모두에 대한 뼈 표적 치료의 효능과 메커니즘을 결정할 수 있습니다.
프로토콜
스코틀랜드 국립 수혈 서비스 (에딘버러)에서 얻은 버피 코트와 NHS 혈액 및 이식 (뉴캐슬)에서 얻은 백혈구 원뿔은 완전히 동의 한 NHS 헌혈자로부터 완전히 익명화 된 (식별 불가능한) 형태로 글래스고 대학 연구원에게 제공됩니다. 버피 코트와 백혈구 원뿔 혈액 성분은 스코틀랜드 또는 영국의 NHS 헌혈 센터에서 제공되는 NHS 표준 헌혈에서 생산됩니다. 헌혈자는 승인된 의학 연구에 사용하기 위해 표준 NHS 임상 실습에서 사용되지 않은 잉여 혈액에 대해 헌혈 시 정보에 입각한 동의를 제공합니다. NHS 연구 윤리위원회의 윤리적 승인과 이러한 헌혈을 사용하기 위해 서명 된 기증자 동의서는 NHS 헌혈 서비스에서 보유합니다. 승인된 의학 연구에서 이러한 동의된 헌혈에 접근하고 사용하기 위한 승인은 National Blood Transfusion Service(스코틀랜드) 및 NHS Blood and Transport(영국)의 표준 내부 신청 및 검토 프로세스를 사용하여 구하고 획득했습니다. 승인된 의학 연구에 혈액 성분을 사용하기 위해 더 이상 NHS REC 승인 또는 글래스고 대학교 윤리 위원회 승인이 필요하지 않았습니다.
1. 시작하기 전 일반 참고 사항
- 피를 사용하는 모든 작업을 주의해서 진행하십시오. 샘플에 존재할 수 있는 다양한 감염원의 잠재적 위험을 고려하십시오.
- 장갑과 실험복을 착용한 상태에서 무균 상태의 생물안전 실험실에서 모든 작업을 조심스럽게 수행하십시오.
- 현지 지침에 따라 생물학적 안전 폐기를 수행하십시오.
- 현지 당국 규정에 따라 샘플을 채취하기 전에 적절한 동의와 윤리적 승인을 받으십시오.
- 일반적으로 1mL의 신선한 혈액은 100만 개의 PBMC를 생성하며 CD14+ 단핵구는 PBMC의 약 10%-30%를 차지합니다. 이에 비해 백혈구 원뿔 10mL에는 5 x 10 8-15 x 108 PBMC가 포함될 수 있습니다. PBMC 격리에 대한 자세한 내용은 이전 프로토콜37을 참조하십시오.
2. 전혈에서 말초 혈액 단핵 세포(PBMC) 분리
- 건강한 기증자로부터 필요한 양의 신선한 혈액을 리튬 헤파린 수집 튜브에 수집합니다.
참고: 적절한 항응고제가 포함된 다른 수집 튜브(예: 나트륨 헤파린 튜브)도 사용할 수 있습니다. 더 높은 세포 수를 위해 백혈구 원뿔 또는 버피 코트를 사용할 수 있습니다. - PBMC를 분리하려면 혈액을 새 50mL 튜브로 옮기고 신선한 혈액 또는 백혈구 원뿔/버피 코트에 대해 각각 1:1 또는 1:3 비율로 멸균된 1x 인산염 완충 식염수(PBS)로 희석합니다.
- 반전으로 세포를 여러 번 부드럽게 혼합하십시오.
- 3mL의 밀도 구배 배지가 들어 있는 15mL 튜브를 준비합니다. 밀도 구배 배지 위에 희석된 혈액 8-10mL를 천천히 겹치고 브레이크 없이 실온(RT)에서 30분 동안 400 x g 에서 원심분리합니다.
알림: 혼합을 방지하기 위해 밀도 구배 배지 위에 혈액을 조심스럽게 바르십시오. 혼합하면 PBMC가 손실될 수 있습니다. - 파스퇴르 피펫으로 최상층(혈장 포함)을 조심스럽게 버리고 PBMC(흰색, 고리 모양 구조)가 포함된 하부 간기 층을 수집한 다음 이 층을 새 50mL 튜브로 옮깁니다.
- 세포를 멸균된 1x PBS로 최대 50 mL까지 현탁하고, 완전 브레이크로 RT에서 10분 동안 300 x g 에서 원심분리하여 잔류 밀도 구배 배지를 세척합니다.
- 잔류 혈소판을 제거하려면 브레이크 없이 RT에서 200분 동안 10 x g 에서 추가로 느린 회전으로 이 과정을 반복합니다.
- 선택 사항: 적혈구의 이월을 제거하려면 적혈구 용해 완충액(10x, 재료 표)을 증류수에 1:10으로 희석하고 희석된 완충액 3mL를 펠릿에 바릅니다. 혼합하고 3분 동안 배양합니다. 펠릿을 최대 50mL의 1x PBS로 세척하고 완전 브레이크를 사용하여 RT에서 300 x g 에서 10분 동안 원심분리합니다.
- 분리 및 정제된 PBMC를 20mL의 1x PBS에 재현탁하고 혈구측정기를 사용하거나 다른 표준 방법에 따라 계산합니다.
알림: 세포 희석 및 세포 계수 방법은 사용된 세포 밀도 및 계수 장치에 따라 적절하게 조정되어야 합니다.
3. PBMC에서 CD14+ 단핵구의 농축
- 제조업체의 프로토콜(재료 표)에 따라 인간 CD14+ 선택 키트를 사용하여 PBMC에서 CD14+ 단핵구를 분리합니다.
참고: 고전적인 CD14+CD16- 단핵구는 OC 전구체35의 주요 공급원입니다. 대체 정제 방법을 고려할 수 있습니다. - 1 x 107 PBMC를 적절한 폴리스티렌 둥근 바닥 튜브(즉, 선택 키트 자석에 맞음)에 옮기고 300 x g 에서 5분 동안 셀을 펠릿화합니다.
- 상층액을 버리고 세포 분리 완충액(PBS, 2% 소 태아 혈청[FBS], 1 mM 에틸렌디아민테트라아세트산[EDTA])에 세포 펠릿을 1 x 108 cells/mL의 최종 농도로 재현탁하고 뚜껑을 덮은 상태에서 100μL당 항체 칵테일 10μL와 함께 10분 동안 배양합니다.
참고: 세포는 1 x 108 cells/mL에서 재현탁됩니다. 그에 따라 볼륨을 조정하십시오. - 배양 후 자성 나노입자 비드 100μL당 10μL를 넣고 뚜껑을 덮은 상태에서 3분간 배양합니다.
참고: 항체 칵테일과 마그네틱 비드의 부피를 조정하여 10μL/mL의 농도를 얻습니다. - 세포 분리 완충액으로 부피를 2.5mL로 채우고 튜브를 자석(뚜껑 없음)에 넣고 3분 동안 배양합니다. 튜브가 여전히 자석에 있는 동안 반전에 의해 한 번의 연속 이동으로 음의 세포 집단을 버립니다.
알림: >2 x 108 PBMC와 더 큰 자석을 사용하는 경우 제조업체의 지침에 따라 세포 분리 버퍼로 최대 5mL 또는 10mL를 채웁니다. - 자석에서 튜브를 제거하고 자성 비드에 부착된 농축 CD14+ 단핵구를 2.5mL의 세포 분리 완충액에 재현탁하여 세척합니다. 이전과 같이 자석 내부에서 3분 동안 배양하고 음수 분획을 버리고 한 번 더 반복합니다.
- 수집된 모든 세포를 300 x g 에서 5분 동안 원심분리하고, 상층액을 버리고, 세포를 5mL의 알파 최소 필수 배지(α-MEM; 재료표) 1% L-글루타민, 1% 페니실린/스트렙토마이신(완전한 α-MEM) 및 10% FBS로 보충됩니다.
참고: 유세포 분석을 통한 농축 후 순도 검사가 권장되며 ≥96% 순도를 기대해야 합니다. 추가의 세척 단계(단계 3.6)는 순도를 증가시킬 수 있다.
4. OC in vitro 분화
- hemacytometer를 사용하여 농축된 CD14+ 단핵구를 계산합니다.
- 세포를 300 x g 에서 5분 동안 펠렛화하고 10% FBS가 보충된 완전한 α-MEM에서 1 x 106 cells/mL로 재현탁합니다.
- OC를 분화하려면 최종 농도 25ng/mL의 M-CSF를 세포 현탁액에 추가합니다.
참고: 1mL의 세포 현탁액에 대해 0.25μg/mL의 스톡 농도에서 100μL의 M-CSF를 추가합니다. - 세포 현탁액을 균질화하기 위해 피펫팅으로 완전히 혼합하고 평평한 바닥 96웰 플레이트에서 100μL/웰의 최종 세포 밀도가 1 x 105 세포/웰이 되도록 플레이트합니다.
- 200μL/웰의 멸균 증류수를 도팅된 세포 주변의 웰에 추가하여 배양 시스템에서 배지 증발 및 가장자리 효과를 방지합니다.
- 세포를 5%CO2와 함께 37°C에서 약 18-20시간 동안 밤새 인큐베이션한다.
- 하룻밤 배양 후 P200 피펫을 사용하여 흡인하여 배지의 절반(50μL/웰)을 웰 바닥을 만지지 않도록 조심스럽게 제거하고 최종 농도 25ng/mL에 대해 10% FBS, 25ng/mL M-CSF 및 50ng/mL RANKL을 포함하는 신선하고 따뜻한 완전한 α-MEM으로 교체합니다
알림: 배지 1mL의 경우 스톡 농도 0.25μg/mL에서 M-CSF 0.5μL과 RANKL 100μL을 추가합니다. - 3일마다 배지를 교체하고 7-14일 동안 세포를 OC로 분화합니다(그림 1).
참고: 배양 전반에 걸쳐 M-CSF 및 RANKL 농도를 일관되게 유지하십시오.
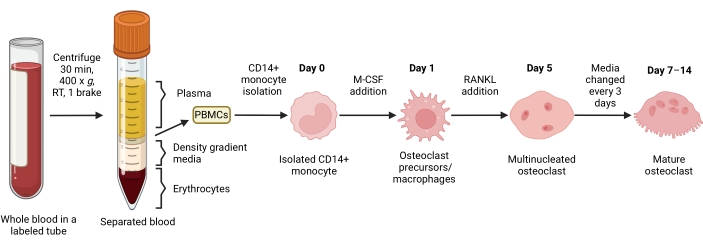
그림 1: OC 차별화 워크플로우. 7-14일 동안 M-CSF 및 RANKL이 있는 상태에서 PBMC에서 CD14+ 단핵구 분리 및 성숙한 OC로의 분화에 대한 개략도. RT = 실온. BioRender.com 로 만든 이미지입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 파골세포에 대한 TRAP 염색
- 배지를 조심스럽게 제거하고 분화된 부착성 OC를 미리 준비된 고정액 100μL/well로 고정한 후 1분 동안 배양합니다. 부착 세포가 긁히지 않도록 웰 바닥을 만지지 마십시오.
참고: 고정 용액은 구연산염 용액 12.5mL(TRAP 염색 키트에 포함), 아세톤 32.5mL, 37% 포름알데히드 5mL와 같이 준비됩니다. - 300 μL의 멸균 증류수로 웰을 세 번 세척한다. 세척 후 접시를 두드려 말리십시오.
- 제조자의 지시에 따라 염색 용액을 준비한다 (재료의 표); 패스트 가넷 5μL와 아질산나트륨 5μL를 첨가하여 패스트 가넷 용액을 만듭니다. 반전으로 혼합하고 RT에서 3분 동안 배양합니다. 멸균 증류수 900μL, 나프톨 10μL, 아세테이트 용액 40μL, 타르타르산염 용액 50μL, 패스트 가넷 용액 10μL를 혼합하여 염색 용액 1mL를 준비합니다.
- 새로 준비된 염색 용액 100μL/well을 추가하고 플레이트를 37°C의 암실에서 20분 동안 배양합니다.
- 배양 후, 염색 용액을 반전으로 제거하고, 300 μL/well의 증류수로 플레이트를 3회 세척한다.
- 종이 타월에 접시를 두드려 여분의 물을 제거하십시오. 플레이트를 열어 두고 빛으로부터 보호하여 밤새 공기 건조시킵니다.
알림: 건판은 최대 6개월 동안 보관할 수 있습니다. 때때로 잔류 완충액은 현미경으로 볼 수 있는 곰팡이의 발달을 촉진할 수 있습니다. 이것은 영향을받는 우물을 증류수로 씻고 다시 공기 건조시킴으로써 언제든지 제거 할 수 있습니다. - 타일 옵션이 있는 명시야 현미경을 사용하여 10x 또는 20x로 이미지를 촬영하여 전체 웰 표면을 캡처합니다.
- 세포 계수기 플러그인이 있는 이미지 분석 소프트웨어를 사용하여 3개 이상의 핵을 가진 TRAP+ 보라색 염색 세포로 식별된 OC를 수동으로 계산합니다.
알림: 웰당 TRAP+ OC의 수는 기증자에 따라 다르며 ~200-1,600 OC/웰에서 다양할 수 있으며 평균 약 1,000 OC/웰입니다. 또한 데이터를 분석하려면 OC 번호를 3개의 서로 다른 웰(기술 복제)에서 결정해야 하며 각 조건 및 각 생물학적 복제물에 대해 평균을 계산해야 합니다.
6. 골흡수 분석
- 갓 농축된 CD14+ 단핵구를 1 x 105 세포/ 웰에서 인산칼슘으로 코팅된 96웰 골 분석 플레이트에 플레이트하고 4.1-4.8단계에 표시된 대로 7-14일 동안 OC를 분화하고 3일마다 배지를 교체합니다.
참고: 상아질/상아 또는 소 피질 뼈 조각은 골 분석 플레이트 대신 사용할 수 있습니다. 그렇다면, 배양의 총 시간은 재 흡수 될 더 복잡한 기질 때문에 14-21 일로 연장되어야한다. - 종료 시점에서, 우물의 바닥을 만지지 않도록 조심스럽게 배지를 제거하고, 10% 차아염소산나트륨 용액으로 세포를 용해시킨다. 증류수로 우물을 세 번 씻으십시오.
- 명시야 현미경을 사용하여 건판을 스캔하고 이미지 분석 소프트웨어를 사용하여 흡수 피트의 획득 이미지를 분석/정량화합니다.
7. 액틴고리 형광염색
- 분리된 CD14+ 단핵구의 100μL/웰을 1 x 10 5 세포/웰의 세포 밀도 로 18웰 챔버 슬라이드에 플레이트합니다. 3일마다 배지를 교체하는 것을 포함하여 이전에 설명한 대로(4.1-4.8단계) M-CSF 및 RANKL이 있는 상태에서 OC를 구별합니다.
- 종료 시점에서, 배지를 부드럽게 제거하고, 예열된 PBS, pH 7.4의 200 μL/well로 각 웰을 2회 세척한다. 단계 사이에 우물을 말리지 마십시오.
- PBS에서 4% 포름알데히드 용액 100μL/웰로 샘플을 고정하고 부드럽게 흔들면서 오비탈 셰이커에서 RT에서 10분 동안 배양합니다.
참고: 메탄올은 고정 과정에서 액틴을 방해할 수 있습니다. 따라서 메탄올 함유 고정제를 피하는 것이 가장 좋습니다. 바람직한 고정제는 메탄올이 없는 포름알데히드이다. 프로토콜의 이 단계에서 사용된 오비탈 셰이커는 10점 만점에 3점의 전력 설정으로 설정되었습니다. - 200 μL/웰의 PBS로 2회 세척하고, PBS에 희석된 0.1% 트리톤 X-100 용액의 100 μL/웰로 세포를 투과시키고, 부드럽게 흔들면서 오비탈 셰이커에서 RT에서 10분 동안 배양합니다.
- PBS 200μL/well로 2회 세척합니다. 비특이적 결합을 차단하고 신호를 증가시키려면 2% 소혈청알부민(BSA)/PBS 용액으로 만든 차단 용액 100μL/웰을 추가합니다. RT에서 부드럽게 흔들면서 궤도 셰이커에서 20분 동안 배양합니다.
- 블로킹 용액을 제거하고 2% BSA/PBS 용액에 희석한 형광 공액 팔로이딘 용액 100μL/웰을 추가합니다. RT에서 부드럽게 흔들고 빛으로부터 보호하면서 궤도 셰이커에서 20분 동안 배양합니다.
알림: 제조업체의 권장 사항에 따라 팔로이딘 염료의 농도를 조정하십시오. - 200 μL/웰의 PBS로 2회 세척하고, 300 nM DAPI를 함유하는 PBS의 용액 100 μL/웰로 핵을 염색하고, 부드럽게 흔들고 빛으로부터 보호하면서 오비탈 셰이커에서 RT에서 10-15분 동안 배양한다.
참고: DAPI를 증류수에 희석하여 14.3mM(5mg/mL) DAPI 원액을 만듭니다. 원액은 최종 농도 300 μM까지 더 희석된다. 마지막으로, 300 μM DAPI 용액을 PBS에서 300 nM의 최종 농도로 한 번 더 희석한다. - 10-15분 후 DAPI 용액을 제거하고 100μL/웰 PBS로 교체합니다.
알림: 선택한 챔버 슬라이드에 따라 적절한 양의 PBS(100웰 챔버 슬라이드의 경우 18μL/웰)와 함께 보관하거나 커버슬립과 적절한 장착 매체를 사용하여 슬라이드를 장착합니다. 챔버 슬라이드는 냉장고에 최대 1주일 동안 보관할 수 있습니다. 18웰 챔버 슬라이드의 경우 50-100 μL 염색 부피와 200-300 μL의 세척을 사용합니다. 그에 따라 다른 챔버 슬라이드 크기에 맞게 확장합니다. 증발을 방지하려면 배양 시간 동안 덮개를 덮은 용기 안에 보관하십시오. 오비탈 셰이커를 사용하는 것이 권장되지만 필수는 아닙니다. - 적절한 면역형광 또는 컨포칼 현미경을 사용하여 염색을 시각화하고 4x에서 40x 사이의 배율을 측정합니다.
8. 유세포 분석을 통한 성숙한 OC 및 OC 전구체의 농축
- 갓 농축된 CD14+ 단핵구를 1 x 106 cells/mL로 재현탁하고 위에서 설명한 것과 동일한 방식으로 M-CSF 및 RANKL이 있는 상태에서 성숙한 OC로 분화합니다(4.1-4.8단계).
알림: 96웰 플레이트에서 더 큰 플레이트 크기로 확장할 때 표 1을 따르십시오. 이 부피는 1 x 106 cells/mL 용액에서 시작하여 계산되며 세포-세포 융합을 위한 최적의 밀도를 제공합니다. - 7일째에, 웰을 따뜻한 PBS로 한 번 세척하고, 50 μL를 1 mL(사용된 플레이트 크기에 의해 결정된 부피)의 아쿠타제를 첨가한다. 세포를 5%CO2 와 함께 37°C에서 20분 동안 인큐베이션한다.
- 배양 후 광학 현미경으로 플레이트를 확인하여 세포가 분리되었는지 확인합니다. 또한 플레이트의 모든 면을 두드리고 위아래로 피펫팅하여 세포를 분리합니다.
- 15mL 원뿔형 튜브에 세포 현탁액을 수집합니다. 웰을 따뜻한 PBS(Ca2+ 없음, Mg2+ 없음)로 세척하고 세포 현탁액과 결합합니다. 대부분의 셀이 분리될 때까지 8.2-8.3단계를 한두 번 반복합니다.
참고: 유세포 분석을 위해 표면 염색 전에 권장되는 방법인 Accutase는 매우 큰 OC를 분리하지 않습니다. 회수율은 ~50%-70%입니다. - 세포를 300 x g 에서 5분 동안 원심분리하고, 세포 펠릿을 PBS 1mL에 재현탁하고, 트립판 블루 배제로 세포를 계수합니다.
- 세포를 1 x 106 cells/mL로 재현탁하고 1 x 105 세포에 해당하는 100μL를 제거한 다음 해당 세포를 새 폴리프로필렌 시험관으로 옮깁니다. 200 μL의 세포 분류 완충액을 첨가하고, 이를 염색되지 않은 대조군으로 얼음 위에 따로 보관합니다.
- RT에서 1:750에서 10분 동안 희석한 살아있는/죽은 염료로 나머지 세포를 얼룩지게 하고 빛으로부터 보호합니다.
알림: 높은 배경 염색을 피하기 위해 FBS가 없을 때 라이브/데드 염색을 수행해야 합니다. - 살아있는/죽은 염색 세포 현탁액이 들어 있는 15mL 수집 튜브에 따뜻한 세포 분류 완충액(1x PBS, no Ca 2+, no Mg2+, 1% FBS 및 5mM EDTA)을 채우고 300 x g에서 5분 동안 원심분리하여 세포를 펠릿화합니다.
참고: 세포 덩어리를 방지하기 위해 분류 완충액에 고농도의 EDTA와 저농도의 FBS를 권장합니다. - 1 x 105 셀에 해당하는 부피를 제거하고 OSCAR 아이소타입 제어를 위해 새 폴리프로필렌 테스트 튜브로 옮깁니다. 염색 및 세포 분류를 위해 나머지 모든 세포를 다른 폴리프로필렌 시험관으로 옮깁니다.
알림: 폴리프로필렌 시험관은 셀이 폴리스티렌 관보다 이 관에 부착될 가능성이 적기 때문에 분류에 사용됩니다. - 튜브를 400 x g 에서 5분 동안 회전시켜 세포를 펠릿화하고 반전으로 과잉 상청액을 버립니다.
- 표 2에 따라 제조된 항체 마스터 믹스 용액에 세포 펠렛을 재현탁한다. OSCAR 항체 대신 CD14 항체 및 OSCAR 이소타입 대조군으로 OSCAR 이소타입 제어 튜브를 염색합니다.
- 세포를 빛으로부터 보호하여 4°C에서 30분 동안 인큐베이션한다.
- 30분 후, 세포 분류 완충액 5개를 첨가하고, 4°C에서 5분 동안 400 x g 에서 원심분리하여 세포를 세척하였다.
- 300-1,000 μL의 저온 세포 분류 완충액에 세포를 재현탁하고 100μM 노즐이 장착된 유세포 분석 선별기를 사용하여 세포를 획득합니다.
참고: OC는 매우 끈적끈적한 세포이므로 분류하기 전에 멸균된 70μm 멤브레인을 통해 여과하는 것이 중요합니다. - OC 및 pre-OC를 CD14−OSCAR+로 게이트합니다. OSCAR 아이소타입 컨트롤 튜브를 기반으로 OSCAR+ 게이트를 설정합니다.
- 8°C에서 20% FBS가 보충된 완전한 α-MEM이 포함된 폴리프로필렌 시험관에서 분류된 세포를 수집합니다.
- 분류 후, RT에서 5분 동안 300 x g에서 원심분리하여 세포를 펠릿화하고, 세포를 계수하고, 다운스트림 적용을 위해 재현탁합니다.
참고: 일반적으로 ~1 x 105 개의 정렬된 pre-OC/OC를 얻으려면 10일에 도금된 ~10 x6 0 셀에서 시작합니다. 낮은 회수율은 아큐타제로 분리하는 동안 세포 손실과 염색 및 분류를 위한 처리에 의해 영향을 받습니다. 멸균 완충액과 시약을 사용하여 전체 절차를 수행하고 멸균 상태에서 작업하는 것이 좋습니다.
9. 미토콘드리아 활성에 대한 ATP 분석
- 이전에 설명한 것과 동일한 방식으로 M-CSF 및 RANKL의 존재 하에 농축된 CD14+ 단핵구를 96웰 플레이트에서 배양합니다(단계 4.1-4.8). 컨트롤로 사용하기 위해 4개의 추가 조건을 세 번 플레이트합니다.
- 제조업체의 설명서에 따라 발광 ATP 검출 분석 키트로 ATP 분석을 수행합니다. 간략하게, ATP 용액을 제조하기 위해, 10 mL의 기질 완충 용액을 동결건조된 기질에 첨가하고, 이를 RT에서 30분 동안 인큐베이션하도록 방치한다.
참고: 세포 내 ATP 생산을 측정하기 위해 다양한 방법을 사용할 수 있습니다. 여기서, 발광에 의한 ATP 생산의 검출을 이용하였다. - 인큐베이션 동안, 대조군을 다음과 같이 대조군 웰에 직접 첨가하고 첨가한다: 10 mM 및 100 mM의 2-데옥시-D-글루코스(2DG), 1 μM의 올리고마이신, 및 1 μM 올리고마이신과 조합된 100 mM 2DG. 5%CO2와 함께 37°C에서 30분 동안 인큐베이션한다.
참고: 2DG는 해당과정을 차단하는 반면 올리고마이신은 산화적 인산화 억제제입니다. 이 두 억제제를 결합하면 해당 과정과 산화적 인산화를 통해 ATP 생산이 완전히 손실되므로 ATP 분석을 위한 내부 제어 역할을 합니다. 10 mM 및 100 mM 2DG 대조군의 경우, 100 μL 배양 웰당 각각 0.5 μL 및 5 μL의 2M 2DG 저장 용액을 추가합니다. 1μM 올리고마이신의 경우 5mM 원액을 배지에서 1:100으로 희석하고 전용 대조군 웰에 2μL/웰을 추가합니다. 마지막 대조군의 경우 웰당 5μL의 2DG와 2μL의 희석된 올리고마이신 용액을 추가합니다. - ATP 용액 50 μL를 각 웰에 첨가하여 반응을 중지시키고, 빛으로부터 보호하면서 5-10분 동안 700rpm의 진탕기 상에서 RT에서 인큐베이션한다.
- 상청액 100 μL를 ATP 분석에 특이적인 96-웰 백색 바닥 플레이트로 옮기고, 발광 판독기를 사용하여 플레이트를 판독하였다.
결과
CD14+ 단핵구에서 OC 생성
이 방법은 일반적으로 1주일 내에 시험관 내에서 많은 수의 OC를 인간 말초 혈액 CD14+ 단핵구와 쉽게 구별하는 것을 목표로 했습니다. 첫째, CD14+ 단핵구는 PBMC에서 농축되었고 이전에 보고된 바와 같이 RANK를 상향 조절하기 위해 밤새 M-CSF로 프라이밍되었습니다15. 단핵구 프라이밍 후, OC 분화 및 성숙을 위한 RANKL의 최적 농도를 결정하기 위해 1ng/mL, 25ng/mL, 50ng/mL 및 100ng/mL의 RANKL 농도와 25ng/mL M-CSF를 사용했습니다. RANKL의 추가는 용량 의존적 방식으로 증가하는 수의 큰 TRAP 양성 다핵 OC를 생성했으며 이는 TRAP 염색을 사용하여 평가되었습니다. 성숙한 OC는 여러 핵(일반적으로 3개 이상; 그림 2A, B 및 보충 그림 1). 또한, 단핵구로부터의 OC 분화의 동역학은 2-14일 배양 기간 동안 TRAP 염색 및 광학 현미경을 사용하여 조사되었습니다. 이 경우, 50ng/mL RANKL의 중간 농도를 사용한 OC 분화는 배양에서 OC가 얼마나 빨리 분화되는지 평가하기 위해 선택되었습니다. 이러한 배양 조건에서 다핵 OC는 5일째부터 볼 수 있었고 7일째에 최적의 분화에 도달했습니다(그림 2C). 플라스틱에 대한 배양을 10일 이상 장기간 배양하면 비정상적으로 거대한 융합 세포가 생성되었습니다. 이 프로토콜에서 6-8일은 일반적으로 OC 생성의 최적 종점으로 사용됩니다. OC는 정량화하거나 다운스트림 분석에 사용할 수 있습니다.
차별화된 OC의 기능적 평가
생성된 OC의 기능적 활성을 결정하기 위해 광물화된 표면에서 OC를 구별하여 흡수 활성을 조사했습니다. 큰 OC는 7일의 배양 기간 후에만 생성되므로, 미네랄 기질을 재흡수하기에 충분한 시간을 허용하기 위해, 배양은 10일까지 유지되었다. 둥근 구멍 또는 흡수 구덩이의 형성은 M-CSF와 RANKL로 처리된 세포를 포함하는 웰의 광물화된 표면에서만 관찰되었습니다(그림 3). 따라서, 용해된 광물화된 표면(흡수 구덩이)의 백분율은 OC 흡수 능력을 결정할 수 있게 한다. 또한, 플라스틱 및 유리 챔버 슬라이드 모두에서 7일까지 이 프로토콜에 따라 분화된 OC는 면역형광 염색으로 시각화할 수 있는 잘 조직화된 액틴 고리 구조를 나타냈습니다(보충 그림 2).
성숙한 OC 기능에 대한 억제제의 효과
위에서 언급한 배양 조건은 공지된 OC 억제제인 로테논34의 존재 하에서 시험관 내에서 생성된 OC의 기능적 능력을 결정하기 위해 활용되었습니다. OC는 6-8일 동안 분화되었고 CD14-OSCAR+ OC 및 OC 전구체는 유세포 분석을 통해 농축되었습니다(그림 4). 그런 다음 농축된 세포를 3일 동안 pro-파골세포 형성 배지(25ng/mL, M-CSF 및 RANKL)에서 미네랄 코팅된 96웰 플레이트에 웰당 50,000개의 세포로 도말했습니다. 로테논(그림 5A,B)으로 처리하면 치료되지 않은 대조군과 비교하여 용량 의존적으로 광물화된 표면의 재흡수가 억제되었으며, 이는 이전 연구와 일치합니다34. 또한 OC 기능은 ATP 생산 및 액틴 고리 형성을 통해 평가되었습니다. OC 흡수의 로테논 의존성 억제는 ATP 생산의 억제와 관련이 있었습니다(그림 5C). 재흡수 OC는 세포골격 조직을 촉진하여 흡수 능력을 조절하는 고도로 분극된 세포입니다. Alexa fluor 647 conjugated phalloidin은 로테논의 존재 또는 부재 하에 배양된 성숙 OC의 F-액틴 세포골격을 표지하는 데 사용되었습니다. 로테논은 성숙한 OC의 RANKL 유래 액틴 고리의 단편화를 일으켰습니다(그림 5D).
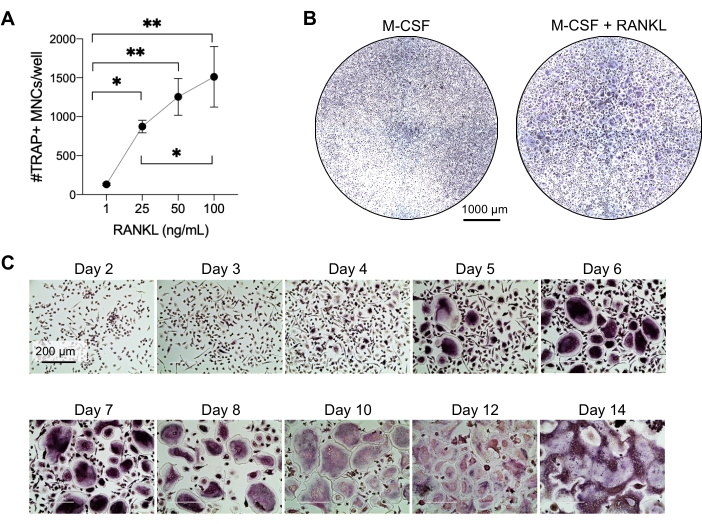
그림 2: CD14+ 단핵구 전구체와 효율적으로 구별되는 OC. CD14+ 단핵구는 자기적으로 농축되었고, 96웰 플레이트에서 1 x 105 세포/웰로 플레이팅되었고, 25 ng/mL M-CSF 와 함께 밤새 배양되었다. (A) M-CSF 프라이밍 단핵구를 RANKL(1ng/mL, 25ng/mL, 50ng/mL 및 100ng/mL)의 농도 증가로 자극하고 고정하고 7일째에 TRAP에 대해 염색했습니다. 이미지를 획득하고 TRAP+ 다핵 세포(MNC)를 계수했습니다. TRAP 염색의 대표적인 이미지는 보충 그림 1에 나와 있습니다. 오차 막대는 평균 ± SD(n = 3)를 나타냅니다. 데이터는 쌍을 이루는 데이터에 대한 일원 분산 분석과 Holm-Sidak의 다중 비교 테스트로 분석되었습니다. * P ≤ 0.05 및 ** P ≤ 0.005. (B) 7일째 M-CSF 유래 대식세포와 비교하여 예상되는 OC/웰의 일반적인 양과 25ng/mL RANK-L 미만의 형태를 보여주는 96웰 플레이트의 TRAP 염색 웰의 대표 이미지. 스케일 바: 1000μm. (C) 2일부터 14일까지 TRAP 염색을 통해 평가한 50ng/mL RANKL 하에서 OC 형성의 대표 이미지. OC는 5일차부터 볼 수 있습니다. 거대하고 비정상적으로 융합된 OC는 10일 후에 존재합니다. 스케일 바: 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
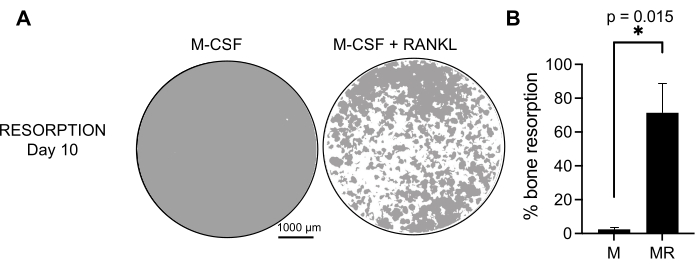
그림 3: CD14+ 단핵구와 분화된 재흡수성 OC. PBMC에서 분리된 CD14+ 세포는 광물 분석(osteo-assay) 플레이트에서 25ng/mL M-CSF(M) 및 RANKL(R)의 존재 하에 10일 동안 OC로 분화되었습니다. (A) 10일째 재흡수를 분석하기 위해 10배 배율로 촬영한 대표적인 재건된 우물의 이미지(회색의 광물 기질, 흰색의 재흡수 구덩이). 스케일 바: 1000 μm. (B) 재흡수된 면적의 백분율의 정량화. 재흡수 데이터는 Wilcoxon 쌍 분석으로 분석되었습니다. 오차 막대는 평균 ± SD(n = 7)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
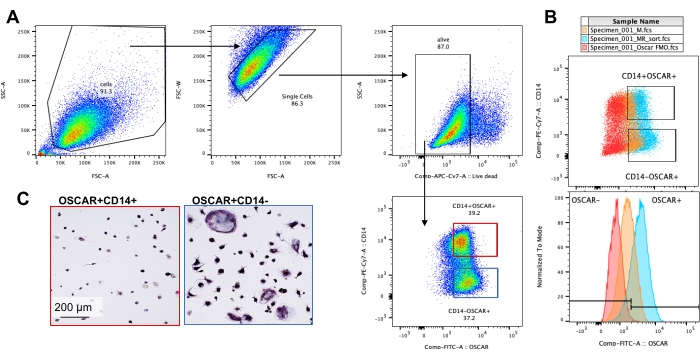
그림 4: CD14−OSCAR+ OC의 유세포 분석 농축. CD14+ 단핵구는 PBMC로부터 농축되었고, OC는 이전에 기술된 바와 같이 분화되었다. 부착성 OC 배양물을 아큐타제로 분리하고 유세포 분석을 위해 염색했습니다. (ᄀ씨) 8일째의 OC는 CD14 및 OSCAR 발현에 기초하여 분류되었다. (A) 대표적인 분류 게이팅 전략. 세포를 단일항으로 게이팅하고, 죽은 염색에 대해 음성으로 게이트하고, CD14+ OSCAR+(빨간색) 및 CD14- OSCAR+(파란색) 하위 집합을 분류했습니다. (B) RANKL 유래 OC(청록색)와 대조군 M-CSF 유래 대식세포(주황색)의 중첩 OSCAR 염색을 보여주는 대표적인 플롯. 빨간색은 RANKL 유래 OC의 OSCAR 동형 염색 대조군입니다. (C) 분류된 모집단을 플라스틱에 도말하고 pro-OC 배지(25ng/mL M-CSF 및 50ng/mL RANKL)에서 2시간 동안 부착한 다음 TRAP 염색 및 시각화를 수행했습니다. 대표 이미지는 CD14+ 하위 집합(빨간색)의 TRAP+ 세포 부족과 CD14- 하위 집합(파란색)의 단일 및 다핵 TRAP+ pre-OC 및 OC를 보여줍니다. 스케일 바: 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
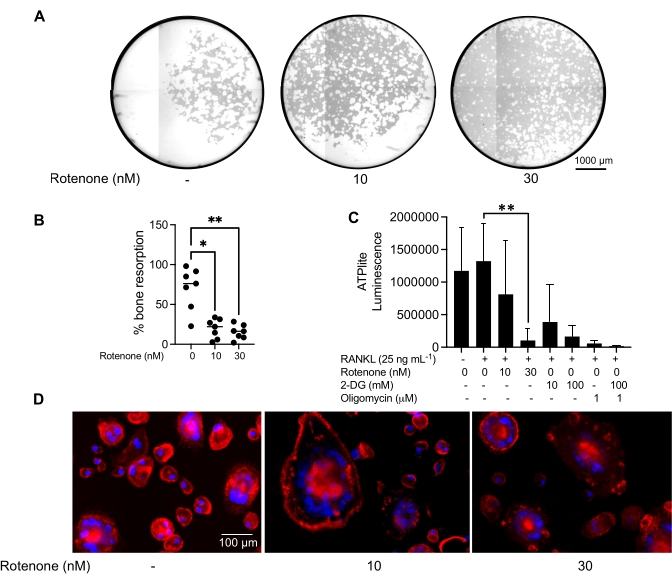
그림 5: 성숙한 OC의 기능을 평가하기 위한 분석. 성숙 OC의 기능을 평가하기 위해 PBMC에서 분리된 CD14+ 세포를 M-CSF(M) 단독으로 또는 RANKL(R)과 함께 7일 동안 배양하고, OC를 유세포 분석을 통해 농축한 다음 OC를 억제제 로테논으로 24시간 동안 처리했습니다. (A) 성숙한 OC는 유세포 분석을 통해 분류되었습니다(CD14−OSCAR+) 및 로테논의 존재 또는 부재 하에 광물 분석 표면 상에서 3일 동안 배양한 후, 세포를 표백하고 10x에서 이미지화하여 재흡수된 영역(백색의 흡수 구덩이)을 드러냈다. (A) 우물의 대표적인 재구성 이미지. 스케일 바: 1000 μm. (B) 재흡수된 면적의 백분율의 정량화. (B)의 데이터는 Dunn의 다중 비교 검정(n = 7)을 사용하여 일원 분산 분석으로 분석되었습니다. * P ≤ 0.05 및 ** P ≤ 0.01. 오차 막대는 평균 ± SD를 나타낸다. (C) RANKL로 분화되고 비히클 또는 로테논(10nM 및 30nM)으로 처리된 미분화 및 7일째 분화된 성숙 OC의 총 세포내 ATP 함량. 여기서, 2DG 및 올리고마이신을 분석에 대한 양성 대조군으로 사용하였고, 세포 용해 및 ATP 정량화 30분 전에 첨가하였다. 오차 막대는 평균 ± SD(n = 4)를 나타냅니다. 데이터는 쌍체 데이터에 대한 일원 분산 분석과 Dunnett의 다중 비교 테스트로 분석되었습니다. ** P ≤ 0.01입니다. (D) 액틴 고리 형성(빨간색) 및 핵(파란색)에 대해 염색된 성숙 OC의 대표적인 20x 이미지로, 억제제로 액틴 고리의 손실을 보여줍니다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 플레이트 형식 | 96 웰 플레이트 | 48 웰 플레이트 | 24 웰 플레이트 | 12 웰 플레이트 | 6 웰 플레이트 |
| 음량 | 100 μL | 225–250 μL | 450–500 μL | 0.8–1 mL | 1.8–2 mL |
표 1: 다양한 플레이트 형식에 대한 세포 현탁액의 부피. 부피는 1 x 106 cells/mL 용액에서 시작하여 계산되며 세포 간 융합을 위한 최적의 밀도를 제공합니다.
| 형광단, 클론 | 106 세포 당 부피 (μL) | |
| CD14 (CD14) | PE/시아닌7, HCD14 | 5 μL |
| 오스카 | FITC, REA494 | 10 μL |
| 셀 정렬 버퍼 | 80 μL |
표 2: 항체 마스터 믹스 용액.
보충 그림 1: RANKL 용량 반응의 TRAP 염색. CD14+ 단핵구는 자기적으로 농축되었고, 96웰 플레이트에서 1 x 105 세포/웰로 플레이팅되었고, 그림 2와 같이 25 ng/mL M-CSF 와 함께 밤새 배양되었습니다. TRAP 염색의 대표 이미지는 7일째에 RANKL(1ng/mL, 25ng/mL, 50ng/mL 및 100ng/mL)의 농도가 증가함에 따라 자극된 MCSF 프라이밍 단핵구를 보여주고, 고정하고, TRAP에 대해 염색했습니다. 스케일 바: 400 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 완전히 분화된 OC에서 연기 고리 염색. (A) TC 플라스틱에서 분화되고 AF647 팔로이딘(빨간색)으로 염색된 OC의 10배 배율. 스케일 바: 400μm. (B) 유리 챔버 슬라이드에서 분화되고 AF488 팔로이딘(노란색)으로 염색된 OC의 40배 배율. 스케일 바: 100 μm.핵은 DAPI로 염색되며, (A)에는 파란색으로, (B)에는 청록색으로 표시됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: OC 분화 효율에 대한 다양한 FBS 배치의 영향. OC는 7일 동안 25ng/mL M-CSF 및 50ng/mL RANKL(MR)의 존재 하에 CD14+ 단핵구와 분화되었습니다. 대조군 웰은 M-CSF (M) 만 가졌다. (A) 대표적인 10x 배율(스케일 바: 400μm) 및 (B) FBS의 두 가지 다른 배치에서 한 기증자와 구별된 TRAP 염색 OC의 정량화. 오차 막대는 세 번의 기술 반복실험의 평균 ± SD를 보여줍니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
시험관 내에서 많은 수의 기능적 OC를 쉽게 배양하고 분리하는 것은 뼈 생물학 및 OC 매개 질환에 대한 이해를 높이는 데 중요합니다. 고전적으로, OC는 조골세포 또는 기질 세포 및 비장 또는 골수로부터의 조혈 세포와의 공동 배양에서 생성되었다38,39. 파골세포 형성에 대한 이해에서 중요한 돌파구는 RANKL이 OC 형성, 분화 및 생존의 주요 조절자임을 확인한 것입니다40. RANKL 의존성 배양 시스템의 초기 프로토콜은 OC 생성 21,41,42를 위해 PBMC를 활용했습니다. 그러나 이러한 혼합 배양은 길고 OC 분화 및 기능에 대한 직접적인 효과를 테스트하는 능력을 제한하는 많은 교란 요인을 나타냅니다. 이 프로토콜은 7일 이내에 최적의 파골세포 형성을 얻을 수 있는 인간 말초 CD14+ 단핵구로부터의 파골세포 형성의 효율적이고 신뢰할 수 있는 시험관 내 모델을 설명하며(그림 1 및 그림 2), 이는 일부 다른 프로토콜과 비교할 때 상당히 빠릅니다43,44,45,46. 이 프로토콜의 주요 특징은 (1) 정제된 CD14+ 단핵구의 사용, (2) RANKL에 노출되기 전에 M-CSF로 단핵구의 프라이밍, (3) 배양 기간(<7일), (4) 억제제를 사용한 OC 형성 억제(TRAP 염색) 및 기능(재흡수, ATP 생산, 액틴 고리 재구성)의 신뢰할 수 있는 검출입니다.
방법론을 최적화하는 동안 몇 가지 중요한 점이 확인되었습니다. OC의 시험관 내 분화는 CD14+ 단핵구의 파종 밀도에 크게 의존하는 것으로 관찰되었습니다. 따라서 이 프로토콜에서 세포는 고밀도(96웰 플레이트의 1 x 105 세포/웰, 배지 100μL)로 파종되며, 이는 세포가 서로 상호 작용할 수 있고 융합에 근접하여 성숙한 OC가 되는 것이 필수적이기 때문입니다. 유사하게, 너무 높은 밀도의 파종 세포는 배지 제한과 필요한 공간 부족으로 인해 분화 및 성장을 제한합니다. 또한, 이 프로토콜로 최대한의 성공을 거두려면 밀도 구배 분리를 신중하게 수행하고 CD14+ 세포의 농축된 집단이 가능한 한 순수한지 확인하는 것이 중요합니다. 예를 들어, 부적절한 세척 단계는 혈소판 제거의 부족을 초래하며, 이는 결과적으로 OC 분화를 억제한다47,48. 유사하게, M-CSF 단독으로 자극된 분리된 CD14+ 제제에서 경미한 T 세포 오염의 존재는 잠재적으로 T 세포에 의한 RANKL 분비를 통해 OC 분화를 초래할 수 있다49. 따라서 모든 실험에 M-CSF 대조군을 포함하는 것이 중요합니다. 특히 새로운 분리 키트를 사용할 때 샘플의 순도를 보장하기 위해 일상적인 순도 검사도 권장됩니다.
최적의 OC 수(범위: ~200-1,600 OC/웰)는 뉴클레오사이드와 L-글루타민이 풍부한 α-MEM 배지를 사용하여 달성됩니다. Dulbecco's modified eagle medium(DMEM) 및 Roswell Park Memorial Institute(RPMI) 1640 배지를 포함한 다른 기존 배양 배지는 OC 수율에 영향을 미칩니다. FBS의 근원은 또한 파골세포 형성에 영향을 미칠 수 있습니다. FBS의 다른 배치는 RANK-L 유래 파골세포 형성을 감소시킬 수 있을 뿐만 아니라 M-CSF 대조군에서 적은 수의 TRAP+ 다핵 세포의 출현을 유발할 수 있습니다(보충 그림 3). 따라서 일관된 결과를 얻으려면 사용하기 전에 새로운 FBS 배치를 테스트하고 실험 전반에 걸쳐 동일한 배치를 계속 사용하여 분화 과정의 변화를 최소화하는 것이 좋습니다. 또한, 종료 시점에서 얻은 차별화된 OC의 총 수 측면에서 기증자 대 기증자 가변성은 예를 들어 건강한 기증자와 환자를 비교하기 위해 이 프로토콜을 사용할 때 제한을 구성합니다. 이러한 경우 정확히 동일한 조건과 동일한 로트의 배지, FBS 및 기타 시약을 사용하는 것이 필수적입니다.
최적의 OC 분화 및 성숙을 위한 또 다른 필요한 단계는 RANKL 첨가 전에 M-CSF로 단핵구를 프라이밍하는 것입니다. RANKL 전에 M-CSF 18-24h에 세포를 노출시키면 단핵구가 RANK 발현15,26을 상향 조절하도록 프라이밍됩니다. 이 시점에서 RANKL을 추가하면 용량 의존적 방식으로 최적의 OC 분화가 보장됩니다. OC 분화의 정도는 기증자마다 다릅니다. 그러나 25ng/mL RANKL은 일반적으로 대부분의 기증자에서 많은 수의 OC를 구별하기에 충분합니다. 또한 25ng/mL RANKL은 테스트 화합물의 강화 및 억제 효과의 평가를 용이하게 하기 때문에 화합물의 초기 스크리닝을 위한 분석에 사용할 수 있습니다. 다른 배양 시스템은 RANKL 첨가 전에 더 긴 M-CSF 사전 배양 시간을 사용했지만, 이는 파골세포 형성을 위한 더 긴 배양 시간을 초래한다50. 또한, 프라이밍 된 단핵구를 밤새 배양하도록 두면 완전히 부착 된 상태는 아니지만 플레이트에 부착 할 수 있습니다. 따라서 RANKL을 처음 도입할 때 프라이밍된 단핵구의 박리 및 손실을 방지하기 위해 배지를 완전히 교체하기보다는 매우 조심스럽게 반쯤 교체해야 합니다. 또한 배지 고갈을 방지하고 세포 사멸을 방지하기 위해 배지를 3-4일마다 새로 고쳐야 합니다. 또한, 이 분석에 사용되는 부피가 적기 때문에(96웰 플레이트에서 100μL/웰), 분석 웰 주위에 수용액(즉, 멸균 증류된 H2O또는 PBS)으로 채워진 빈 웰 프레임을 갖는 것이 가장 중요합니다. 이렇게 하면 매체 증발 및 가장자리 효과를 방지할 수 있습니다.
마지막으로, 대사 분석(예: ATP 분석)의 경우, 세포가 복제 간의 큰 표준 편차를 피할 수 있어야 합니다(그림 5). 세포의 높은 생존율은 세포를 분류하고 분류된 OC의 추가 배양에도 중요합니다(그림 4). 그러나 이 방법에는 몇 가지 제한 사항이 있습니다. 완전히 성숙한 OC는 접착력이 매우 뛰어나 플레이트에서 분리하기 어렵습니다. 더 큰 OC는 분리가 불가능한 경우가 많으며, 이로 인해 세포 수율이 낮아질 수 있습니다. 따라서 셀은 분류 후 필요한 농도로 도금하기 전에 계수해야 합니다. 또한, 본 프로토콜에서는 OC를 분리하는 비효소적 방법(accutase)을 사용하여 유세포 분석을 위한 다운스트림 표면 염색에서 막 변경을 방지합니다. 세포 스크레이퍼 (소프트 엔드 또는 하드 엔딩 모두)의 사용도 테스트되었으며 높은 세포 사멸을 초래했습니다. 0.05% 트립신/EDTA 용액을 사용한 효소 분리는 다운스트림 응용 분야에서 멤브레인 무결성이 필요하지 않을 때 분리된 OC의 더 높은 수율에 사용할 수 있습니다. 또한 OC가 함께 뭉치는 것을 방지하기 위해 세포 분리 후 모든 완충액에서 고농도의 EDTA를 사용하고 유세포 분석 전에 적절한 필터링을 수행하는 것이 좋습니다. OC 배양은 성숙한 OC, OC 전구체 및 대식세포로 구성된 이질적인 세포 집단이라는 점에 유의하는 것이 중요합니다. 대식세포는 OC와 쉽게 구별할 수 있지만, 단핵 pre-OC와 다핵 OC는 모두 OSCAR를 발현하며 현재 방법으로는 구별할 수 없습니다(그림 4). 실제로 이 후자의 문제가 이 방법의 주요 한계를 구성합니다. 또한, OSCAR의 낮은 발현은 M-CSF 배양에도 존재하며(그림 4B) OC 계통 투입을 위해 준비된 대식세포를 나타낼 수 있습니다. 그림 4B와 같이 FMO 염색 신호를 기반으로 OSCAR+ 세포에 대한 게이트를 설정하는 것이 중요합니다.
요약하면, 이 프로토콜은 순환하는 1차 인간 단핵구로부터 활성 및 기능적으로 성숙한 OC의 효율적인 생산을 위한 최적화되고 강력한 방법을 설명합니다. 이 프로토콜의 강점은 짧은 시간 내에 OC를 생성하고 많은 수의 차별화된 OC를 생성할 수 있다는 것입니다. 이 방법은 OC 분화 및 기능의 기본 메커니즘을 조사하는 길을 열어줍니다.
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
저자는 이 작업에 대한 지원과 지원에 대해 감염 및 면역 학교 내의 Flow Core Facility와 Glasgow Imaging Facility(GIF)에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 well chamber slides | ibidi | 81816 | |
| 8-well glass chamber slides | Ibidi | 80807 | |
| 96-well TC plate | Corning | 3596 | |
| 96-well osteo assay stripwell plate | Corning | 3989 | |
| Acetate solution | Sigma Aldrich | 386-3 | from kit Cat No. 387A-1KT |
| Acetone | VWR | 20066.330 | |
| Acid phosphatase, Leukocyte (TRAP) kit | SIGMA-ALDRICH | 387A-1KT | |
| Alexa Fluor 488 Phalloidin | Theremo Fisher - Invitrogen | A12379 | AF488 |
| Alexa Fluor 647 Phalloidin | Thermo Fisher - Invitrogen | A22287 | AF647 |
| Alfa Aesar 2-Deoxy-D-glucose | Fisher Scientific | 11321867 | 2DG, 98% |
| Alpha minimum essential medium | gibco | 22571-020 | |
| ATPlite 1step | PerkinElmer | 6016731 | Luminiscence ATP detection assay system |
| BD FACSAria III cell sorter | BD Biosciences | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418-100G | |
| Cell culture microplate, 96-well, PS, F-bottom | Greiner bio-one | 655083 | White-bottom plates |
| Citrate solution | Sigma Aldrich | 91-5 | from kit Cat No. 387A-1KT |
| Corning 6ml round-bottom polystyrene test tubes | Fisher Scientific | 352054 | |
| Corning osteo assay surface multiple well plate | Sigma-Aldrich | CLS3989 | |
| Corning osteo assay Surface multiple well plate 1 x 8 stripwell | Corning | CLS3989-2EA | |
| DAPI | Theremo Fisher | D3571 | |
| EasySep human CD14 positive selection kit | STEMCELL Technologies | 17858 | |
| EasySep red blood cell lysis buffer (10x) | StemCell Technologies | 20110 | |
| eBioscience fixable viability dye eFluor 780 | Theremo Fisher - Invitrogen | 65-0865-14 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E7889-100ML | |
| EVOS FL auto imaging system | Thermo Fisher | A32678 | |
| Falcon round-bottom polypropylene test tubes with cap | Fisher Scientific | 10314791 | |
| Falcon tubes 15 mL | Corning | 430790 | |
| Falcon tubes 50 mL | Corning | 430828 | |
| Fast Garnet GBC base solution | Sigma Aldrich | 387-2 | from kit Cat No. 387A-1KT |
| Fetal bovine serum | gibco | 10500-064 | FBS |
| Ficoll-Paque Plus | cytiva | 17144003 | |
| Formaldehyde | Sigma-Aldrich | F-8775 | |
| Human sRANK ligand | PEPROTECH | 310-01-100UG | Receptor activator of nuclear factor kappa-B ligand (RANKL) |
| ImageJ Image analysis software | Image J | version 2.9.0 | |
| L-glutamine | gibco | 25030-024 | |
| Lithium heparin tubes (9 mL) | VACUETTE | 455084 | |
| Macrophage colony-stimulating factor | PEPROTECH | 300-25-100UG | M-CSF |
| Napthol AS-BI phosphoric acid solution | Sigma Aldrich | 387-1 | from kit Cat No. 387A-1KT |
| Neubauer hemacytometer counting chamber | Camlab | SKU 1127885 | |
| Oligomycin from Streptomyces Diastatochromogenes | Sigma-Aldrich | Q4876-5MG | |
| OSCAR Antibody, anti-human, Vio Bright FITC, REAfinit | Miltenyi Biotec | 130-107-661 and 130-107-617 | Clone REA494 |
| PE/Cyanine7 anti-human CD14 antibody | Biolegend | 325618 | Clone HCD14 |
| Penicilin/streptomycin | SIGMA | P0781 | |
| PHERAstar machine and software | BMG LABTECH | ||
| Phosphate-buffered saline (DPBS, 1x) | gibco | 14190-094 | |
| REA control antibody (S), human IgG1, Vio Bright FITC, REAfinity | Miltenyi Biotec | 130-113-443 | |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044-1L | |
| Sodium nitrite solution | Sigma Aldrich | 91-4 | from kit Cat No. 387A-1KT |
| Tartrate solution | Sigma Aldrich | 387-3 | from kit Cat No. 387A-1KT |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | |
| Trypan blue | Sigma-Aldrich | T8154-100ML |
참고문헌
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Boyce, B. F., Xing, L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives Of Biochemistry and Biophysics. 473 (2), 139-146 (2008).
- Jacome-Galarza, C. E., et al. Developmental origin, functional maintenance and genetic rescue of osteoclasts. Nature. 568 (7753), 541-545 (2019).
- Agemura, T., Hasegawa, T., Yari, S., Kikuta, J., Ishii, M. Arthritis-associated osteoclastogenic macrophages (AtoMs) participate in pathological bone erosion in rheumatoid arthritis. Immunological Medicine. 45 (1), 22-26 (2022).
- Hasegawa, T., et al. Identification of a novel arthritis-associated osteoclast precursor macrophage regulated by FoxM1. Nature Immunology. 20 (12), 1631-1643 (2019).
- Walsh, N. C., Crotti, T. N., Goldring, S. R., Gravallese, E. M. Rheumatic diseases: The effects of inflammation on bone. Immunological Reviews. 208 (1), 228-251 (2005).
- Gravallese, E. M., et al. Identification of cell types responsible for bone resorption in rheumatoid arthritis and juvenile rheumatoid arthritis. The American Journal of Pathology. 152 (4), 943-951 (1998).
- Bromley, M., Woolley, D. E. Chondroclasts and osteoclasts at subchondral sites of erosion in the rheumatoid joint. Arthritis & Rheumatism. 27 (9), 968-975 (1984).
- Kleyer, A., Schett, G. Arthritis and bone loss: A hen and egg story. Current Opinion in Rheumatology. 26 (1), 80-84 (2014).
- Kawai, V. K., Stein, C. M., Perrien, D. S., Griffin, M. R. Effects of anti-tumor necrosis factor α (anti-TNF) agents on bone. Current Opinion in Rheumatology. 24 (5), 576-585 (2012).
- Siebert, S., Tsoukas, A., Robertson, J., McInnes, I. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases. Pharmacological Reviews. 67 (2), 280-309 (2015).
- Smiljanovic, B., et al. Monocyte alterations in rheumatoid arthritis are dominated by preterm release from bone marrow and prominent triggering in the joint. Annals of the Rheumatic Diseases. 77 (2), 300-308 (2018).
- Anderson, J. R., et al. 1H NMR metabolomics identifies underlying inflammatory pathology in osteoarthritis and rheumatoid arthritis synovial joints. Journal of Proteome Research. 17 (11), 3780-3790 (2018).
- McGarry, T., et al. Rheumatoid arthritis CD14+ monocytes display metabolic and inflammatory dysfunction, a phenotype that precedes clinical manifestation of disease. Clinical & Translational Immunology. 10 (1), 1237(2021).
- Ansalone, C., et al. TNF is a homoeostatic regulator of distinct epigenetically primed human osteoclast precursors. Annals of the Rheumatic Diseases. 80 (6), 748-757 (2021).
- Yokota, K., et al. Characterization and function of tumor necrosis factor and interleukin-6-induced osteoclasts in rheumatoid arthritis. Arthritis and Rheumatology. 73 (7), 1145-1154 (2021).
- Allard-Chamard, H., et al. Osteoclasts and their circulating precursors in rheumatoid arthritis: Relationships with disease activity and bone erosions. Bone Reports. 12, 100282(2020).
- Takegahara, N., et al. Involvement of receptor activator of nuclear factor-κB ligand (RANKL)-induced incomplete cytokinesis in the polyploidization of osteoclasts. The Journal of Biological Chemistry. 291 (7), 3439-3454 (2016).
- Jansen, I. D. C., Vermeer, J. A. F., Bloemen, V., Stap, J., Everts, V. Osteoclast fusion and fission. Calcified Tissue International. 90 (6), 515-522 (2012).
- McDonald, M. M., et al. Osteoclasts recycle via osteomorphs during RANKL-stimulated bone resorption. Cell. 184 (5), 1330-1347 (2021).
- Lacey, D. L., et al. Bench to bedside: Elucidation of the OPG-RANK-RANKL pathway and the development of denosumab. Nature Reviews Drug Discovery. 11 (5), 401-419 (2012).
- Zhao, B., Grimes, S. N., Li, S., Hu, X., Ivashkiv, L. B. TNF-induced osteoclastogenesis and inflammatory bone resorption are inhibited by transcription factor RBP-J. The Journal of Experimental Medicine. 209 (2), 319-334 (2012).
- Zhao, B. Does TNF promote or restrain osteoclastogenesis and inflammatory bone resorption. Critical Reviews in Immunology. 38 (4), 253-261 (2018).
- Crotti, T. N., et al. Receptor activator NF-κB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Annals of the Rheumatic Diseases. 61 (12), 1047-1054 (2002).
- Kim, H. R., et al. Reciprocal activation of CD4+ T cells and synovial fibroblasts by stromal cell-derived factor 1 promotes RANKL expression and osteoclastogenesis in rheumatoid arthritis. Arthritis and Rheumatology. 66 (3), 538-548 (2014).
- Arai, F., et al. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-Fms and receptor activator of nuclear factor κB (RANK) receptors. Journal of Experimental Medicine. 190 (12), 1741-1754 (1999).
- Hayman, A. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
- Nedeva, I. R., Vitale, M., Elson, A., Hoyland, J. A., Bella, J. Role of OSCAR signaling in osteoclastogenesis and bone disease. Frontiers in Cell and Developmental Biology. 9, 780(2021).
- Boyce, B. F., Yoneda, T., Lowe, C., Soriano, P., Mundy, G. R. Requirement of pp60c-src expression for osteoclasts to form ruffled borders and resorb bone in mice. The Journal of Clinical Investigation. 90 (4), 1622-1627 (1992).
- Matsubara, T., et al. Regulation of osteoclast differentiation and actin ring formation by the cytolinker protein plectin. Biochemical and Biophysical Research Communications. 489 (4), 472-476 (2017).
- Roscher, A., et al. The F-actin modulator SWAP-70 controls podosome patterning in osteoclasts. Bone Reports. 5, 214-221 (2016).
- Jurdic, P., Saltel, F., Chabadel, A., Destaing, O. Podosome and sealing zone: Specificity of the osteoclast model. European Journal of Cell Biology. 85 (3-4), 195-202 (2006).
- Francis, M. J. O., et al. ATPase pumps in osteoclasts and osteoblasts. The International Journal of Biochemistry & Cell Biology. 34 (5), 459-476 (2002).
- Kwak, H. B., et al. Inhibition of osteoclast differentiation and bone resorption by rotenone, through down-regulation of RANKL-induced c-Fos and NFATc1 expression. Bone. 46 (3), 724-731 (2010).
- Massey, H. M., Flanagan, A. M. Human osteoclasts derive from CD14-positive monocytes. British Journal of Haematology. 106 (1), 167-170 (1999).
- Xue, J., et al. CD14+CD16-monocytes are the main precursors of osteoclasts in rheumatoid arthritis via expressing Tyro3TK. Arthritis Research and Therapy. 22 (1), 221(2020).
- Marco-Casanova, P., et al. Preparation of peripheral blood mononuclear cell pellets and plasma from a single blood draw at clinical trial sites for biomarker analysis. Journal of Visualized Experiments. (169), e60776(2021).
- Takahashi, N., et al. Osteoblastic cells are involved in osteoclast formation. Endocrinology. 123 (5), 2600-2602 (1988).
- Yasuda, H., et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 3597-3602 (1998).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Matsuzaki, K., et al. Osteoclast differentiation factor (ODF) induces osteoclast-like cell formation in human peripheral blood mononuclear cell cultures. Biochemical and Biophysical Research Communications. 246 (1), 199-204 (1998).
- Shalhoub, V., et al. Osteoprotegerin and osteoprotegerin ligand effects on osteoclast formation from human peripheral blood mononuclear cell precursors. Journal of Cellular Biochemistry. 72 (2), 251-261 (1999).
- Neale, S. D., Smith, R., Wass, J. A. H., Athanasou, N. A. Osteoclast differentiation from circulating mononuclear precursors in Paget's disease is hypersensitive to 1,25-dihydroxyvitamin D3 and RANKL. Bone. 27 (3), 409-416 (2000).
- Abdallah, D., et al. An optimized method to generate human active osteoclasts from peripheral blood monocytes. Frontiers in Immunology. 9, 632(2018).
- Komano, Y., Nanki, T., Hayashida, K., Taniguchi, K., Nobuyuki, M. Identification of a human peripheral blood monocyte subset that differentiates into osteoclasts. Arthritis Research and Therapy. 8 (5), 152(2006).
- Kylmäoja, E., et al. Peripheral blood monocytes show increased osteoclast differentiation potential compared to bone marrow monocytes. Heliyon. 4 (9), 00780(2018).
- Wang, D., et al. Platelet-rich plasma inhibits RANKL-induced osteoclast differentiation through activation of Wnt pathway during bone remodeling. International Journal of Molecular Medicine. 41 (2), 729-738 (2018).
- Cenni, E., Avnet, S., Fotia, C., Salerno, M., Baldini, N. Platelet-rich plasma impairs osteoclast generation from human precursors of peripheral blood. Journal of Orthopaedic Research. 28 (6), 792-797 (2010).
- D'Amico, L., Roato, I. Cross-talk between T cells and osteoclasts in bone resorption. BoneKEy Reports. 1 (6), 82(2012).
- Quinn, J. M. W., Elliott, J., Gillespie, M. T., Martin, T. J. A combination of osteoclast differentiation factor and macrophage-colony stimulating factor is sufficient for both human and mouse osteoclast formation in vitro. Endocrinology. 139 (10), 4424-4427 (1998).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유