Method Article
توليد عضويات الأوعية الدموية البشرية من الخلايا الجذعية متعددة القدرات
In This Article
Summary
يصف هذا البروتوكول توليد الأوعية الدموية ذاتية التنظيم من الخلايا الجذعية البشرية متعددة القدرات والمستحثة. تظهر شبكات الأوعية الدموية هذه شبكة بطانية واسعة ومتصلة محاطة بالخلايا المحيطة ، وأكتين العضلات الملساء ، وغشاء قاعدي مستمر.
Abstract
يتم تعريف العضو العضوي على أنه نسيج متعدد الخلايا في المختبر يحاكي العضو المقابل له في الجسم الحي بحيث يمكن استخدامه لدراسة جوانب محددة من هذا العضو في طبق زراعة الأنسجة. تقدم اتساع وتطبيق أبحاث الخلايا الجذعية البشرية المشتقة من الخلايا الجذعية متعددة القدرات (hPSC) بشكل كبير لتشمل الدماغ والشبكية والقناة الدمعية والقلب والرئة والأمعاء والبنكرياس والكلى والأوعية الدموية ، من بين العديد من الأنسجة الأخرى. وقد فتح تطوير طرق لتوليد الأوعية الدقيقة البشرية، على وجه التحديد، الطريق لنمذجة تطور الأوعية الدموية البشرية والمرض في المختبر ولاختبار وتحليل الأدوية الجديدة أو انتحاء الأنسجة في عدوى الفيروسات، بما في ذلك SARS-CoV-2. البروتوكولات المعقدة والطويلة التي تفتقر إلى التوجيه البصري تعيق استنساخ العديد من الكائنات العضوية المشتقة من الخلايا الجذعية. بالإضافة إلى ذلك ، فإن العشوائية المتأصلة في عمليات تكوين الأعضاء والتنظيم الذاتي تستلزم إنشاء بروتوكولات بصرية لتعزيز فهم اكتساب مصير الخلية وبرمجتها. هنا ، يتم تقديم بروتوكول موجه بصريا لتوليد عضويات الأوعية الدموية البشرية 3D (BVOs) المهندسة من hPSCs. من خلال تقديم غشاء قاعدي مستمر ، وخلايا بطانة الأوعية الدموية ، والتعبير المنظم مع الخلايا الجدارية ، تظهر BVOs السمات الوظيفية والمورفولوجية والجزيئية للأوعية الدموية الدقيقة البشرية. يبدأ تكوين BVO من خلال تكوين الركام ، يليه الأديم المتوسط والحث الوعائي. يتم بدء نضوج الأوعية الدموية وتشكيل الشبكة ودعمها من خلال تضمين المجاميع في الكولاجين 3D ومصفوفة الغشاء القاعدي القابلة للذوبان. تتشكل شبكات الأوعية البشرية في غضون 2-3 أسابيع ويمكن زراعتها في أنظمة استزراع قابلة للتطوير. الأهم من ذلك ، أن BVOs المزروعة في مفاغرة الفئران التي تعاني من نقص المناعة مع دوران الفئران الداخلية وتحديدها في الشرايين الوظيفية والأوردة والشرايين. سيعمل البروتوكول الحالي الموجه بصريا على تطوير أبحاث الكائنات العضوية البشرية ، لا سيما فيما يتعلق بالأوعية الدموية في التطور الطبيعي ، والأوعية الدموية للأنسجة ، والمرض.
Introduction
ضعف الأوعية الدموية وأمراض الأوعية الدموية الحالية مع مضاعفات ملحوظة في وظائف الجهاز. أمراض القلب والأوعية الدموية (CVD) هي السبب الرئيسي للوفاة في جميع أنحاء العالم1 وهي أيضا العامل الرئيسي المساهم في زيادة تكاليف الرعاية الصحية في الولايات المتحدة. تتزايد أعداد حالات الأمراض القلبية الوعائية سنويا، وتحدث أعداد متزايدة من هذه الحالات في الفئات العمرية الأصغر (20-45 سنة)2. تم تطوير نماذج متعددة في الجسم الحي لاستكشاف تطور ونضج الأوعية الدموية وأمراض الأوعية الدموية والخلل البطاني 3,4. في الوقت الحالي ، يمكن للطرق التي تجمع بين الخلايا المفردة والمتعددة المحددة بالنسب إما المشتقة من الخلايا الجذعية أو المعزولة من الأنسجة البالغة في الجسم الحي إنشاء شبكات الأوعية الدموية التي تكرر جوانب وظيفة الأوعية الدموية البشرية والتشريح 5,6. ظهرت الأوعية الدموية كواحدة من الأنظمة الوظيفية الأولى أثناء التطور من الأديم المتوسط ، وهي تنظم إما من خلال عملية تجميع تسمى "تكوين الأوعية الدموية" أو عن طريق التوسع والتفرع من الأوعية الموجودة مسبقا ، والتي تسمى "تولد الأوعية"7.
الاستفادة من قوة علم الأحياء التنموي والتجميع الموجه ذاتيا ، Wimmer et al. ذكرت أول عضويات الأوعية الدموية البشرية 3D ذاتية التنظيم من hPSCs التي تظهر الخصائص الوظيفية والمورفولوجية والجزيئية للأوعية الدموية الدقيقةالبشرية 8. على غرار الأوعية الدمويةالبشرية 9 ، يتم إنشاء هذه hBVOs وموجودة مع البطانة ، والغشاء القاعدي المستمر ، والخلايا الجدارية المحيطة 8,10. يمكن زرع hBVOs في الجسم الحي ومفاغرة مع الدورة الدموية الذاتية. يمكن أن تخضع أيضا للنضج في المختبر وتكون بمثابة نماذج لأمراض القلب والأوعية الدموية (أي مرض السكري)8 أو انتحاء الأنسجة في عدوى الفيروسات مثل SARS-CoV-211. بينما نشرنا سابقا بروتوكولا مكتوبا10 ، لا يوجد بروتوكول فيديو متاح لهذه التقنية المعقدة.
من خلال تقدم تدريجي موجز ، يتم تحقيق تكوين hBVO من خلال التكوين الكلي ، وتحريض الأديم المتوسط باستخدام ناهض WNT ، و Chiron (CHIR99021) ، والبروتين المورفجيني للعظام - 4 (BMP4) 12,13 ، وتحريض الأوعية الدموية عبر عامل نمو بطانة الأوعية الدموية A (VEGFA) و Forskolin (Fors) 12 ، والتضمين في مصفوفة تنبت مخصصة 8,10. يتبع نضوج الأوعية الدموية وتشكيل الشبكة تضمين الركام في مصفوفة التنبت. تتشكل شبكات الأوعية البشرية هذه في غضون 2-3 أسابيع ويمكن إزالتها من مصفوفة البراعم وتنميتها في أنظمة استزراع قابلة للتطوير لمدة تصل إلى 6 أشهر. هنا ، يتم توفير إجراءات موجهة بصريا لتشكيل وتطبيق الأوعية الدموية المشتقة من الخلايا الجذعية البشرية.
Protocol
استخدمت جميع التجارب التي أجريت هنا خط H9 البشري iPSC المتاح تجاريا. كما تم اختبار خطوط الخلايا الجذعية البشرية متعددة القدرات الشائعة المتاحة تجاريا وغير تجاريا (أي H9 ، NC8) وأثبتت فعاليتها في توليد عضويات الأوعية الدموية البشرية باستخدام هذا البروتوكول. لمزيد من التفاصيل ، يرجى الرجوع إلى تقاريرنا المنشورةسابقا 8,10.
1. صياغة الوسائط والكاشف لتوليد عضويات الأوعية الدموية البشرية
- تحضير وسيط التجميع.
- امزج 40 مل من DMEM / F12 بالضربة القاضية (وسط منخفض الأسمولية بدون L-glutamine أو HEPES buffer محسن لنمو ESC و iPSC البشري) ، 10 مل من بديل مصل الضربة القاضية (KOSR) ، 0.5 مل من 200 مللي مول L-alanyl-L-glutamine dipeptide في 0.85٪ كلوريد الصوديوم ، 0.5 مل من الأحماض الأمينية غير الأساسية (NEAA) ، 35 ميكرولتر من بيتا ميركابتوإيثانول (BME ، 100 ميكرولتر من 2-ميركابتوإيثانول في 10 مل من PBS المعقم) ، و Y-27632 (مثبط منفذ للخلايا وانتقائي لبروتين كيناز مرتبط ب Rho ، ملفوف يحتوي على بروتين كيناز [ROCK] 14 [10 mM] في 1: 200) (انظر جدول المواد).
- تحضير N2B27 (N2 و B27 تستكمل الوسط الأساسي).
- امزج 25 مل من DMEM / F12 ، و 25 مل من الوسائط العصبية القاعدية ، و 1 مل من مكمل B27 ، و 0.5 مل من مكمل N2 ، و 250 ميكرولتر من 200 mM L-alanyl-L-glutamine dipeptide في 0.85٪ كلوريد الصوديوم ، و 35 ميكرولتر من بيتا ميركابتوإيثانول (انظر جدول المواد).
- تحضير وسط تحريض الأديم المتوسط.
- مكمل N2B27 وسط مع ChiR (12 ميكرومتر ، مثبط GSK3a / b يحفز تحريض الأديم المتوسط) و BMP-4 (30 نانوغرام / مل ، منشط MSX2 يحفز سلالة الأديم المتوسط).
ملاحظة: المخزون (ChiR): 10 مللي مول (استخدم 1: 833 ، أو 1.2 ميكرولتر / مل N2B27). المخزون (BMP-4): 100 ميكروغرام / مل (استخدم 1: 3333 ، أو 0.3 ميكرولتر / مل N2B27) (انظر جدول المواد).
- مكمل N2B27 وسط مع ChiR (12 ميكرومتر ، مثبط GSK3a / b يحفز تحريض الأديم المتوسط) و BMP-4 (30 نانوغرام / مل ، منشط MSX2 يحفز سلالة الأديم المتوسط).
- إعداد وسط تحريض الأوعية الدموية.
- تكملة N2B27 المتوسطة مع VEGFA (100 نانوغرام/مل) وفورسكولين (2 ميكرومتر) (انظر جدول المواد).
- تحضير المصفوفة خارج الخلية (ECM).
- استخدم 1 مل من ECM لبئر واحد من صفيحة 12 بئرا (لتضمين 30-50 مجاميع). من 1 مل من محلول ECM المستخدم لكل بئر ، استخدم 0.5 مل لإنشاء طبقة سفلية ، "الطبقة 1" ، والتي ستكون بمثابة أساس ECM ، و 0.5 مل بالإضافة إلى مجاميع للطبقة العليا ، "الطبقة 2". يوفر استخدام هذا النهج ، من خلال تعليق ECM ، مساحة كافية ودعما لشبكات الأوعية الدموية البشرية لتنبت في جميع الاتجاهات.
ملاحظة: بشكل عام ، يحتوي 1 مل من ECM على 500 ميكرولتر من الكولاجين البقري المنقى من النوع الأول ، و 250 ميكرولتر من مصفوفة الغشاء القاعدي القابلة للذوبان التي تفرزها خلايا ساركوما الفأر Engelbreth-Holm-Swarm (انظر جدول المواد) ، و 250 ميكرولتر من محلول المصفوفة الأساسي (الخطوة 1.5.2). قم بإعداده طازجا واحتفظ به على الثلج حتى يصبح جاهزا للاستخدام. - لتحضير محلول المصفوفة الأساسي لأربع لوحات من 12 بئرا (48 بئرا) ، امزج 5.627 مل من 0.1 نيوتن هيدروكسيد الصوديوم ، 2.498 مل من 10x DMEM ، 473 ميكرولتر من HEPES ، 368 ميكرولتر من 7.5٪ بيكربونات الصوديوم ، 233 ميكرولتر من 200 مللي متر L-alanyl-L-الجلوتامين ثنائي الببتيد في 0.85٪ كلوريد الصوديوم ، و 3.451 مل من Ham's F-12 (انظر جدول المواد).
ملاحظة: يمكن وضع محلول المصفوفة الأساسي المتبقي في أنبوب مخروطي من مادة البولي بروبيلين عالي الوضوح سعة 50 مل وتخزينه عند 4 درجات مئوية للاستخدام لمدة تصل إلى 2 أشهر.
- استخدم 1 مل من ECM لبئر واحد من صفيحة 12 بئرا (لتضمين 30-50 مجاميع). من 1 مل من محلول ECM المستخدم لكل بئر ، استخدم 0.5 مل لإنشاء طبقة سفلية ، "الطبقة 1" ، والتي ستكون بمثابة أساس ECM ، و 0.5 مل بالإضافة إلى مجاميع للطبقة العليا ، "الطبقة 2". يوفر استخدام هذا النهج ، من خلال تعليق ECM ، مساحة كافية ودعما لشبكات الأوعية الدموية البشرية لتنبت في جميع الاتجاهات.
- تحضير وسط تنبت.
- قم بصياغة 50 مل على وجه التحديد من الوسط المرن الخالي من المصل (SFM) لدعم تطوير الخلايا المكونة للدم البشرية ، وحصة 1.3 مل من مكمل المغذيات المتوسطة المرنة الخالية من المصل ، ومصل بقري الجنين 15٪ (FBS) ، و 250 ميكرولتر من البنسلين والستربتومايسين ، و 500 ميكرولتر من 200 مللي مول من ثنائي ببتيد L-alanyl-L-glutamine في 0.85٪ كلوريد الصوديوم ، VEGFA (100 نانوغرام / مل) ، و FGF2 (100 نانوغرام / مل) (انظر جدول المواد).
- قم بإعداد المخزن المؤقت للحظر.
- امزج 0.5 جم من ألبومين مصل الأبقار ، و 1.5 مل من مصل الأبقار الجنيني ، و 250 ميكرولتر من Tween 20 ، و 250 ميكرولتر من Triton X-100 ، و 500 ميكرولتر من ديوكسي كولات الصوديوم (1٪ بالوزن / المجلد ، و 47.5 مل من 1x محلول ملحي مخزن بالفوسفات (انظر جدول المواد). ماصة صعودا وهبوطا حتى يتم دمج جميع المكونات بشكل جيد والحل واضح.
2. صيانة وثقافة الخلايا الجذعية البشرية متعددة القدرات والمستحثة
- إجراء زراعة الخلايا باستخدام مصفوفة غشاء القاعدية ذات عامل النمو المنخفض الخالي من LDEV (تخفيف 1:50) - ألواح زراعة الأنسجة ذات 6 آبار مع وسط زراعة الخلايا الجذعية (انظر جدول المواد).
- بمجرد أن تصل الخلايا إلى التقاء ~ 70٪ ، قم بتمريرها باستخدام 1 مل من إنزيم فصل خلايا الثدييات (انظر جدول المواد) لمدة 3-4 دقائق عند 37 درجة مئوية.
ملاحظة: تقسيم الخلايا بنسبة 1: 6 يعزز صلاحية الخلية ويحقق التقاء في غضون 2-4 أيام لمعظم خطوط الخلايا الجذعية البشرية. لزيادة صلاحية الخلية ، يتم استخدام وسيط الاستزراع المثبط ROCK Y-27632 (10 mM ، 1: 1,000) لمدة 24 ساعة بعد المرور. - قم بتغيير وسط الثقافة يوميا حتى يتم الوصول إلى التقاء 70٪.
ملاحظة: بالنسبة للدراسة الحالية ، عند التقاء 70٪ ، يحتوي بئر واحد من صفيحة زراعة الخلايا المكونة من 6 آبار على حوالي 1 مليون H9 hPSCs.
3. اليوم 0 - توليد الركام متعدد القدرات من تعليق أحادي الخلية
ملاحظة: سينتج عن التقاء 70٪ في بئرين من صفيحة استزراع 6 آبار حوالي 175 hBVOs.
- باستخدام إما ماصة أو نظام فراغ ، قم بشفط وسط الاستزراع ، واستبدله ب 1 مل من كاشف تفكك الخلايا (انظر جدول المواد) ، واحتضانه لمدة 5 دقائق عند 37 درجة مئوية.
- أثناء وجود الخلايا تحت كاشف تفكك الخلايا ، قم بإعداد الحجم اللازم لوسط التجميع (الخطوة 1.1) في أنبوب مخروطي سعة 15 مل حسب الحاجة للعدد المطلوب من الآبار في لوحة استزراع ارتباط منخفضة للغاية ذات 6 آبار (انظر جدول المواد).
- نضح 1 مل من كاشف تفكك الخلايا ، وتعليق الخلايا في 1 مل من وسط التجميع. قم بإنشاء تعليق أحادي الخلية مع سحب لطيف من أعلى إلى أسفل قبل عد العينات.
تنبيه: hPSCs حساسة جدا للإجهاد الميكانيكي ولا يمكنها تحمل السحب العدواني. - عد الخلايا باستخدام جهاز عد الخلاياالآلي 10 أو نظام موحد تحت المجهر. احسب رقم الخلية المطلوب للتجربة.
ملاحظة: اعتمادا على خط الخلية ، تعتبر 200000 خلية / بئر إلى 300000 خلية / بئر مثالية لتكوين الركام (أي 4 آبار = 800000 إلى 1200000 خلية في المجموع). - أضف الحجم المناسب لتعليق الخلية إلى وسط التجميع في الأنبوب المخروطي عالي الوضوح من مادة البولي بروبيلين سعة 15 مل. ماصة بلطف تعليق الخلية المخففة لأعلى ولأسفل لضمان توزيع الخلايا متجانسة.
- ماصة 3 مل من تعليق الخلية المخففة في كل بئر مرغوب فيه من لوحة ثقافة التعلق منخفضة للغاية ذات 6 آبار.
- ضع اللوحة في الحاضنة (37 درجة مئوية ، 5٪ CO2 ، >90٪ رطوبة) ، وتجنب فتح وإغلاق أبواب الحاضنة قدر الإمكان.
ملاحظة: من الأفضل إكمال هذه الخطوة الأولية في المساء أو أثناء حركة مرور الحاضنة المنخفضة. حتى الاهتزازات الطفيفة يمكن أن تؤثر على حجم وشكل الركام ، مما قد يضعف النتائج.
4. اليوم 1 - تحريض الأديم المتوسط للمجاميع
- تأكد من أن 24 ساعة بعد البذر ، يمكن رؤية الركام الصغير المكون من 2-10 خلايا تحت المجهر. اجمع الركام واتركه يستقر قبل تغيير الوسط إلى وسط تحريض الأديم المتوسط (الخطوة 1.3).
- قم بإعداد أنبوب مخروطي واحد من مادة البولي بروبيلين عالية الوضوح سعة 15 مل لكل بئر من لوحة ثقافة التعلق المنخفضة للغاية المكونة من 6 آبار.
- استخدم حركة دائرية (أي مثل شاكر المدار) لجمع الركام في وسط كل بئر ، واستخدم ماصة 1 مل لجمع الركام والوسط المحيط برفق من كل بئر ، ووضعها في أنابيب مخروطية من مادة البولي بروبيلين عالية الوضوح سعة 15 مل ، والسماح للركام بالترسبات في درجة حرارة الغرفة.
- بمجرد التجميع ، اضبط مؤقتا لمدة 1 ساعة ، وهو الوقت اللازم لمعظم خطوط الخلايا / الركام إلى الرواسب في هذه المرحلة.
ملاحظة: إذا كان الوقت أقل من 1 ساعة ، فقد يفقد المرء أي مجاميع قد لا تكون قد استقرت في قاع الأنبوب المخروطي سعة 15 مل. - بمجرد مرور الساعة ، بحذر ، قم بشفط المادة الطافية باستخدام ماصة أو مضخة شفط عالية الحساسية. تأكد من بقاء الركام دون إزعاج في الجزء السفلي من الأنبوب المخروطي سعة 15 مل.
- أعد تعليق مجاميع كل أنبوب مخروطي سعة 15 مل في 2 مل من وسط تحريض الأديم المتوسط ، ووضعها مرة أخرى في الآبار الخاصة بها في لوحة الاستزراع منخفضة للغاية المكونة من 6 آبار.
- ضع اللوحة مرة أخرى في الحاضنة (37 درجة مئوية) ، واتركها حتى اليوم 4.
ملاحظة: إذا كانت الركام تلتصق وتنمو على بعضها البعض أو في بعضها البعض ، باستخدام ماصة 1 مل ، ماصة برفق كل بئر من الركام صعودا وهبوطا مرة واحدة في اليوم للحفاظ على الركام متشابهة في الحجم.
5. اليوم 4 - تحريض الأوعية الدموية وفتيلة الركام
- اجمع الركام واتركه يستقر قبل تغيير الوسط إلى وسط تحريض الأوعية الدموية (الخطوة 1.4).
- قم بإعداد أنبوب مخروطي واحد سعة 15 مل لكل بئر من لوحة ثقافة التعلق المنخفضة للغاية ذات 6 آبار.
- استخدم حركة دائرية (أي مثل شاكر المدار) لجمع الركام في وسط كل بئر ، استخدم ماصة 1 مل لجمع الركام والوسط المحيط برفق من كل بئر ، ووضعها في الأنابيب المخروطية المقابلة لها 15 مل.
- بمجرد التجميع ، اضبط مؤقتا لمدة 30 دقيقة للسماح للركام بالترسبات.
ملاحظة: مطلوب وقت 30 دقيقة لمعظم خطوط الخلايا في هذه المرحلة. إذا كان الوقت أقل من 30 دقيقة ، فهناك خطر فقدان أي مجاميع قد لا تكون قد استقرت في قاع الأنبوب المخروطي سعة 15 مل. - بعد 30 دقيقة ، بحذر ، قم بنضح المادة الطافية باستخدام ماصة أو مضخة شفط عالية الحساسية. تأكد من بقاء الركام دون إزعاج في الجزء السفلي من الأنبوب المخروطي سعة 15 مل.
- أعد تعليق مجاميع كل أنبوب مخروطي سعة 15 مل في 2 مل من وسط تحريض الأوعية الدموية ، ووضعها مرة أخرى في الآبار الخاصة بها من لوحة الاستزراع ذات التعلق المنخفض للغاية المكونة من 6 آبار.
- ضع اللوحة مرة أخرى في الحاضنة (37 درجة مئوية) ، واتركها حتى اليوم 6.
ملاحظة: باستخدام ماصة سعة 1 مل ، قم بسحب كل بئر من الركام برفق لأعلى ولأسفل مرة واحدة يوميا للحفاظ على الركام متشابهة في الحجم ومنعها من النمو أو الالتصاق ببعضها البعض.
6. اليوم السادس - التضمين الكلي وتحريض تنبت الأوعية
- أثناء العمل على الجليد ، قم بإعداد الحجم النهائي المطلوب لمحلول ECM (الخطوة 1.5).
ملاحظة: فيما يلي بروتوكول بئر واحد من صفيحة 12 بئرا (30-50 مجاميع) ، والتي يمكن تعديلها حسب الضرورة.- بالنسبة لبئر واحد من لوحة 12 بئرا ، ضع 0.5 مل من ECM كطبقة سفلية ، واستخدم 0.5 مل من ECM بالإضافة إلى الركام على الطبقة العليا. هذا يخلق "شطيرة" ECM اللازمة لتنبت الركام 3D فعالة.
- ماصة 500 ميكرولتر من ECM في بئر واحد من لوحة 12 بئر. تأكد من عدم تشكيل فقاعات وأن الغضروف المفصلي السفلي والجانبي مطلي بالكامل. وهذا يشمل الطبقة 1 من شطيرة ECM.
- ضع اللوحة مرة أخرى على حرارة 37 درجة مئوية لمدة 2 ساعة.
ملاحظة: وقت 2 ساعة ضروري للبلمرة الفعالة. أي وقت أقصر يخاطر بالمساس بسلامة ECM. - قرب نهاية بلمرة الطبقة 1 ، استخدم حركة دائرية لجمع الركام في وسط كل بئر ، واستخدم ماصة 1 مل لجمع الركام والوسط المحيط برفق من كل بئر ، ووضعها في أنابيب مخروطية 15 مل مقابلة.
- اترك الركام يستقر لمدة 10-15 دقيقة ، واستنشق المادة الطافية.
- ضع الركام في أنبوب مخروطي سعة 15 مل على الثلج لمدة 5 دقائق. أثناء التبريد ، خذ اللوحة المكونة من 12 بئرا مع الطبقة المبلمرة الآن 1 من الحاضنة.
ملاحظة: يساعد تبريد الركام على منع البلمرة المبكرة للطبقة 2 ECM. - العمل بسرعة وحذر لمنع تكوين الفقاعات ، وإعادة تعليق الركام في 500 ميكرولتر من ECM ، وماصة تعليق ECM الكلي فوق الطبقة المبلمرة بالفعل 1. احرص على عدم لمس الطبقة 1 ، استخدم طرف ماصة سعة 200 ميكرولتر لتوزيع الطبقة 2 والركام حول البئر برفق.
- ضع اللوحة مرة أخرى على حرارة 37 درجة مئوية لمدة 2 ساعة.
ملاحظة: وقت الحضانة 2 ساعة ضروري لبلمرة ECM الفعالة. أي وقت أقصر يخاطر بالمساس بسلامة ECM وقد يمنع الالتصاق القوي بين الطبقة 1 والطبقة 2. - أضف 1 مل من وسط النبتة المسخن مسبقا (37 درجة مئوية) (الخطوة 1.6) للحث على تمايز الأوعية الدموية. يجب أن تظهر السفن تنبت 1 يوم إلى 3 أيام بعد التضمين. قم بتغيير الوسيط بعد 3 أيام ثم كل يومين.
ملاحظة: يجب تسخين الوسط المنبت مسبقا ؛ خلاف ذلك ، قد يحدث انفصال الطبقة ، وقد تتأثر سلامة ECM.
7. اليوم 11 - عزل ونضج BVOs
- العمل في ظل ظروف معقمة ، استخدم الطرف المستدير لملعقة معقمة لتخفيف مصفوفة تنبت ECM التي تحتوي على شبكات الأوعية الدموية. في هذه المرحلة ، يجب أن يشبه الجل قرصا عائما حرا.
- باستخدام ملقط معقم ونهاية مستديرة لملعقة معقمة ، انقل قرص الهلام بعناية (بما في ذلك شبكات الأوعية الدموية) إلى غطاء طبق ثقافة 10 سم.
- ضع الغطاء بالإضافة إلى الجل تحت مجهر مجسم تم تعديله وفقا للتكبير والتركيز المطلوبين ، واستخدم الإبر المعقمة لقطع شبكات الأوعية الدموية المفردة ، في محاولة للحد من كمية ECM غير الوعائية التي تم الحصول عليها في هذه العملية.
ملاحظة: الخلايا تتحلل بشكل طبيعي ECM المحيطة مع مرور الوقت. ومع ذلك ، فإن تقليل الكمية المقطوعة مع كل عضو عضوي يزيد من جودة الصورة وسلامة شبكة السفينة القائمة بذاتها. - بمجرد عزل جميع المواد العضوية من الجل ، قم بنقلها برفق مرة أخرى إلى بئر واحدة من صفيحة 6 آبار منخفضة للغاية مع 3 مل من وسط الإنبات . في هذه المرحلة ، يمكن ترك المواد العضوية بين عشية وضحاها ، أو قد يستمر المرء على الفور في الخطوة 7.4.
- استخدم ماصة سعة 1 مل لنقل المواد العضوية المفردة من اللوحة المكونة من 6 آبار إلى آبار لوحة 96 بئرا منخفضة للغاية. بمجرد النقل ، أضف 200 ميكرولتر من وسط النبت الذي تم تسخينه مسبقا (37 درجة مئوية) إلى كل بئر من لوحة 96 بئرا.
ملاحظة: يجب أن يملأ بئر واحد من الكائنات العضوية الوعائية من صفيحة 12 بئرا 30-40 بئرا من صفيحة 96 بئرا. - في 4-6 أيام بعد العزلة في لوحات 96 بئر ، تأكد من أن المواد العضوية تمتلك مورفولوجيا مستديرة وصحية. في هذه المرحلة ، تكون المواد العضوية جاهزة للإصلاح والاستعداد للتلطيخ.
8. اليوم 15 - تثبيت وحجب وتلطيخ BVOs
- باستخدام طرف مقطوع سعة 1 مل ، انقل المواد العضوية إلى أنبوب طرد مركزي دقيق سعة 1.5 مل.
- مع الحرص على تجنب طموح أي BVOs ، استخدم ماصة 200 ميكرولتر أو 1000 ميكرولتر لإزالة وسط النبتة المتبقي في أنبوب الطرد المركزي الدقيق ، ثم أضف 1 مل من 4٪ PFA في PBS لمدة 1 ساعة.
ملاحظة: يوصى بالتثبيت على شاكر مداري (125 دورة في الدقيقة) في درجة حرارة الغرفة. بحد أقصى 60 BVOs / أنبوب طرد مركزي دقيق مقبول. أي المزيد من BVOs سوف يضعف التثبيت وفعالية الغسيل.
تنبيه: PFA مادة كيميائية ضارة. استخدمه بحذر في غطاء الدخان ، واتبع إرشادات الشركة المصنعة للاستخدام وطرق التخلص المناسبة. - اغسل BVOs الثابتة حديثا 3x لمدة 15 دقيقة في كل مرة باستخدام 0.25٪ PBS-Tween.
- إذا كان قطر الكائنات العضوية أكبر من 1 مم ، فقم بتخلل BVOs بنسبة 1٪ Triton X-100 في PBS لمدة 30-60 دقيقة في درجة حرارة الغرفة.
- نضح كل 0.25٪ PBS-Tween ، وأضف 1 مل من المخزن المؤقت للحظر (الخطوة 1.7).
ملاحظة: على الرغم من اعتمادها على الأجسام المضادة ، إلا أن 2 ساعة في درجة حرارة الغرفة على شاكر مداري (125 دورة في الدقيقة) كافية لتقليل ارتباط الأجسام المضادة غير المحددة أثناء عملية التلطيخ. يمكن ترك المواد العضوية في المخزن المؤقت للحجب عند 4 درجات مئوية لمدة تصل إلى 2 أسابيع. - قم بإزالة المخزن المؤقت للحظر ، وأضف الجسم المضاد الأساسي (1: 100) المخفف في 1 مل من المخزن المؤقت للحظر. احتفظ طوال الليل عند 4 درجات مئوية على شاكر مداري (12 دورة في الدقيقة) ، مما يضمن بقاء العضو (الأعضاء) مغمورا في محلول الأجسام المضادة الأساسي.
ملاحظة: حضانة الأجسام المضادة الأولية بين عشية وضحاها مناسبة للأجسام المضادة المستخدمة في هذه الدراسة. يتم توفير الأجسام المضادة الأولية والثانوية اللازمة والتخفيفات الخاصة بها في جدول المواد. - بعد حضانة الأجسام المضادة الأولية طوال الليل ، قم بإزالة محلول الأجسام المضادة الأساسي واغسل 3x لمدة 15 دقيقة في كل مرة باستخدام 0.25٪ PBS-Tween.
- أضف الجسم المضاد الثانوي (1: 250) بالإضافة إلى DAPI (1: 1,000) المخفف في 1 مل من المخزن المؤقت المانع ، واحتضانه لمدة ساعتين في درجة حرارة الغرفة أو عند 4 درجات مئوية طوال الليل.
ملاحظة: إذا تم تحضير العينات بشكل صحيح (كما هو موضح أعلاه) ، فإن الحضانة لمدة 2 ساعة في درجة حرارة الغرفة أو عند 4 درجات مئوية طوال الليل مناسبة للأجسام المضادة المستخدمة في هذه الدراسة. - بعد الحضانة ، قم بإزالة محلول الأجسام المضادة الثانوي ، واغسل 3 مرات لمدة 15 دقيقة في كل مرة باستخدام 0.25٪ PBS-Tween.
ملاحظة: بعد تلطيخ، يمكن أن تبقى المواد العضوية في برنامج تلفزيوني لمدة تصل إلى 2 أسابيع.
9. تركيب عضويات الأوعية الدموية (BVOs)
- قم بلصق فواصل التثبيت على أغطية التصوير المطلوبة (انظر جدول المواد).
- باستخدام طرف ماصة مقطوع 1 مم ، استخدم ماصة 1 مل لنقل المواد العضوية المفردة إلى آبار المباعد ، واستنشاق PBS المتبقي.
- املأ البئر ب 150-200 ميكرولتر من محلول المقاصة (انظر جدول المواد) الذي تم تسخينه إلى 75 درجة مئوية ، مع غمر العضو العضوي بالكامل.
ملاحظة: يجب أن تصبح العينات واضحة في غضون 1 ساعة من التعرض لمحلول المقاصة الدافئ.- اترك المواد العضوية لتصبح واضحة في صندوق مغطى في الظلام في درجة حرارة الغرفة لمدة 6 ساعات إلى ليلة وضحاها إذا كان وقت التطهير 1 ساعة غير كاف. في حالة ترك العينة طوال الليل ، تأكد من وجود محلول تنظيف كاف لتجنب الجفاف.
- بعد التطهير ، قم بشفط محلول المقاصة بعناية باستخدام طرف ماصة 100-200 ميكرولتر. قم بمناورة العضو العضوي برفق إلى مركز البئر المباعد ، وأضف قطرات من هلام التركيب (انظر جدول المواد) (تم تسخينه إلى 75 درجة مئوية في كتلة تسخين يتم التحكم فيها) حتى يمتلئ البئر.
- ضع غطاء الغطاء الثاني برفق أعلى فاصل التثبيت لإغلاق العينات في الفراغ بين أغطية الغطاء السفلية والعلوية. دع الجل المتصاعد يشفى في الظلام عند 4 درجات مئوية طوال الليل.
ملاحظة: بعد المعالجة ، يمكن استخدام طلاء الأظافر الخفيف لمزيد من إغلاق العينات المركبة.
النتائج
تم تطوير الخطوات الموضحة في هذا البروتوكول خصيصا للحصول على طريقة مضبوطة ودقيقة لتوليد عضويات الأوعية الدموية البشرية من hPSCs. يمثل توليد مجاميع قطرها 30-100 ميكرومتر من ثقافات hPSC نقطة البداية للبروتوكول (الشكل 1 ، الشكل 2 ب). يتم توجيه الركام من خلال تحريض تدريجي نحو الأديم المتوسط (اليوم 1-اليوم 4) والسلالات الوعائية (اليوم 4-اليوم 6) قبل التضمين (اليوم 6) (الشكل 2A-D) ، وهو أمر ضروري لتشكيل شبكة الأوعية. يجب أن يكون نبت الوعاء شبه المتماثل شعاعيا مرئيا بواسطة d7 أو d8 (الشكل 2E) ويستمر حتى d10 (الشكل 2F ، G). إن نقل hBVOs من ECM إلى لوحات التثبيت منخفضة للغاية ذات 96 بئرا يقلل من هشاشة شبكات الانتشار ويسمح بالصيانة المستمرة في ظروف ثقافة التعليق (الشكل 2H) لمدة تصل إلى 6 أشهر. بحلول d15 ، تظهر hBVOs شبكة بطانية واسعة ومتصلة (CD31 +) محاطة بالخلايا المحيطة (PDGFR-ß +) وأكتين العضلات الملساء (SMA +) (الشكل 3A-D). يغلف الغشاء القاعدي المستمر للكولاجين الوريدي (ColIV +) شبكات الأوعية الدموية (الشكل 3E). تشكل الخلايا البطانية (CD31 + ، VE-Cadherin +) والخلايا المحيطة (PDGFR-ß +) حوالي 30٪ -35٪ و 60٪ -65٪ من مجموعات الخلايا العضوية ، على التوالي8. يحدث النبت النشط للأوعية تحت إشراف مجموعة خلايا طرفية منظمة داخليا (CD31 +) تظهر مع مورفولوجيا خلايا الطرف النموذجية ، مثل filipodiaالمفرط 8,10. يمكن رؤية عرض الخلايا الجدارية PDGFR-ß + و SMA + التي تغلف شبكات الأوعية البطانية بواسطة d15 من عملية النضج العضوي (الشكل 3A ، C). بعد الإزالة من ECM والنضج في ثقافة التعليق (أي d15) ، يمكن الدفاع عن hBVOs للتحليلات أو الزرع تحت كبسولة الكلى الفأر.

الشكل 1: رسم تخطيطي لبروتوكول hBVO يسلط الضوء على التوقيت والتقدم التدريجي. من ثقافات hPSC أو hiPSC المتجانسة على ما يبدو ، يحدث التكوين الكلي في وجود مثبط Rho-kinase Y27632. يستخدم الوسط المكمل BMP4 و CHiR لتوجيه الركام نحو مصير الأديم المتوسط. يتم استبدال وسط تحريض الأديم المتوسط ب VEGFA ووسط مكمل بفورسكولين لتحفيز الركام نحو سلالة الأوعية الدموية. الطوابير الميكانيكية والكيميائية التي تحققت من خلال تضمين الركام في الكولاجين I ومصفوفة الغشاء القاعدي القابلة للذوبان والتعرض للوسط المحتوي على VEGFA و FGF2 يؤدي إلى ظهور أوعية دموية شبه متماثلة شعاعيا من الجسم الكلي. يمكن إزالة شبكات الأوعية المتولدة من الكولاجين I والغشاء القاعدي القابل للذوبان ووضعها في ثقافة التعليق لمزيد من النضج أو التحليل أو الزرع في الجسم الحي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التقدم التدريجي لجيل hBVO الذي تم التقاطه تحت برايتفيلد. (أ) التشكل النموذجي لمستعمرات hPSC (H9) في اليوم −1. (ب) توليد مجاميع hPSC (اليوم 0) على ألواح ربط منخفضة للغاية ذات 6 آبار في وجود Y-27632. (ج) تحريض الأديم المتوسط للركام باستخدام BMP4 والوسط المكمل ل ChiR (اليوم 1). يمكن أيضا ملاحظة تغييرات طفيفة في الحجم والشكل الكلي. (د) مجاميع اليوم 4 مهيأة نحو سلالة وعائية باستخدام VEGFA ووسط مكمل بفورسكولين. (ه) تنبت السفينة المبكرة في اليوم 7 ، بعد يوم واحد من تضمين الركام في مصفوفة الإنبات والتعرض لوسط تنبت VEGFA و FGF2 المكمل (اليوم 7). (و) مورفولوجيا عضوية صحية واستمرار تنبت الأوعية في اليوم 9. (ز) سفينة في مرحلة متأخرة تنبت في اليوم 10. من الناحية المثالية ، اختفت هياكل الخلايا الكثيفة في مركز العضو بحلول هذا الوقت. (H) التشكل النموذجي لعضويات الأوعية الدموية البشرية الناضجة (اليوم 15). تعمل إزالة المصفوفة المحيطة عن طريق القطع والنضج في ألواح استزراع 96 بئرا منخفضة للغاية على تشكيل الكائنات العضوية كرويا ، مع وجود شبكات الأوعية داخليا. قضبان المقياس: (أ ، ب ، ه ، و) 250 ميكرومتر ؛ (C,D) 500 ميكرومتر؛ (G ، H) 200 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
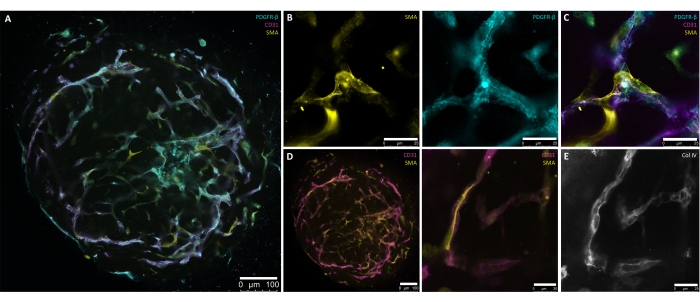
الشكل 3: تلطيخ كامل التركيب لعضويات الأوعية الدموية البشرية الناضجة (اليوم 15). (أ) عرض عضويات الأوعية الدموية البشرية الناضجة (اليوم 15) مع شبكات بطانة ذاتية التنظيم (CD31 + ، أرجواني) وتغطية pericyte المحيطة (PDGFR-β+ ، سماوي) وأكتين العضلات الملساء ألفا (SMA + ، أصفر). (B) تكبير أعلى ل A يوضح بالتفصيل تعبير SMA + (الأصفر) و PDGFR-β+ (السماوي) لشبكات السفينة. (ج) عرض مفصل للتفاعل البطاني (CD31 + ، أرجواني) ، pericyte (PDGFR-β+ ، سماوي) ، وأكتين العضلات الملساء ألفا (SMA + ، أصفر). (د) تلطيخ كامل التركيب للبطانة الوعائية (CD31 + ، أرجواني) - تفاعل العضلات الملساء (SMA + ، أصفر) في مقطع عرضي (يسار) وتكبير أعلى (يمين) لعضويات الأوعية الدموية الناضجة. (ه) التكوين الذاتي الموجه للغشاء القاعدي الوعائي (Col IV+ ، التدرج الرمادي) من خلال الارتباط الوثيق للخلايا الجدارية والأنابيب البطانية. قضبان المقياس: (A,D[يسار]) 100 ميكرومتر; (B,D[right],E) 25 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
قدمت الاختراقات الحديثة في مزارع الخلايا الجذعية العضوية المشتقة من إطار لنماذج أكثر تقدما وذات صلة من الناحية الفسيولوجية للأوعية الدموية البشرية. يوفر نموذج الأوعية الدموية البشرية (hBVO) المقدم هنا ، والذي تم تطويره في مختبرنا 8،10 ، وسيلة قوية لاستكشاف ليس فقط الجوانب الإضافية لتكوين الأوعية الدموية البشرية ولكن أيضا طرق جديدة لنمذجة الأمراض والعلاج التجديدي8،10،11. تم استخدام نماذج متعددة في الجسم الحي لاستكشاف تطور ونضج الأوعية الدموية وأمراض الأوعية الدموية والخلل البطاني 3,4. تجمع الأساليب المختلفة بين الخلايا المفردة والمتعددة المحددة بالنسب إما المشتقة من الخلايا الجذعية أو المعزولة من الأنسجة البالغة في الجسم الحي لإنشاء شبكات الأوعية الدموية البشرية المتماثلة 5,6. يستفيد البروتوكول المقدم هنا من مبدأ علم الأحياء التنموي والتنظيم الذاتي لإنتاج أول شبكات أوعية دموية بشرية متعددة الخلايا يمكن إنشاؤها ، في جوهرها ، من hPSCواحد 8,10.
كل خط من الخلايا الجذعية له تركيبة جينية فريدة ويختلف عن الآخرين من حيث مصادره ووظيفته واستجابته15. لذلك ، تم تطوير بروتوكول عضويات الأوعية الدموية البشرية (hBVOs) وتحسينه لضمان توافق بروتوكول قوي وقابل للتكرار مع خطوط hPSC مختلفة (>12) 8,10. الطريقة الموصوفة هنا تولد عضويات الأوعية الدموية المشتقة من hPSC على مدى 2 أسابيع. ومع ذلك ، قد تؤدي التغييرات في تكوين الوسائط و / أو التقنيات في توليد hBVO إلى شبكة أوعية غير فعالة وتوليد عضوي. كما تؤثر معدلات الانتشار المتفاوتة لخطوط الخلايا الجذعية الفردية بشكل ملحوظ على قابلية استنساخ تجارب الخلايا الجذعية15 ، وبالتالي ، الثقافات العضوية. على سبيل المثال ، عند توليد BVOs ، تخضع الخلايا الأكثر تكاثرا أو أعدادا أكبر من مجاميع اليوم 1 الكبيرة بطبيعتها لبيئات التمثيل الغذائي المختلفة ومعلمات انتشار الغاز والمغذيات. وهذا بدوره يغير أوقات التعرض لعامل النمو وكفاءته ، ودرجة التمايز والتحضير الوعائي ، والأهم من ذلك ، القدرة على تكوين شبكات الأوعية الدموية عند تضمين الركام في الكولاجين 1 ومصفوفة الغشاء القاعدي القابل للذوبان.
إن الانتشار السلبي للأكسجين وإدارة العناصر الغذائية الأساسية من بيئة خارجية ليس مثاليا لنمو الخلايا على المدى الطويل من المواد العضوية ثلاثية الأبعاد وتشكل الأنسجة في المختبر16. على الرغم من اعتمادها على عدة عوامل (أي معدل التمثيل الغذائي للأنسجة ، والتوافر البيولوجي للمغذيات والغاز ، والبيئة الثابتة أو الديناميكية) ، فقد تم تحديد حد عام 150 ميكرومتر O2 وحد انتشار المغذيات للأنسجة المزروعة في المختبر ، مع الأخذ في الاعتبار أنه ، من الناحية الفسيولوجية ، تقدم الأنسجة البشرية حبالا من الخلايا الحية في غضون 150 ميكرومتر من الأوعية الدموية المثقوبة17. على الرغم من أن مسافات انتشار الغاز والمغذيات الفعالة من 70-200 ميكرومتر قد تم اقتراحها أيضا18،19،20،21 ، فإن كثافة البناء ودرجة الحرارة ودرجة الحموضة وتكوين الوسائط تؤثر بشكل كبير على فعالية الانتشار. نظرا لتحسين مساحة السطح واتصال مستقبلات integrin-beta بعد تضمين اليوم 6 ، فإن الركام التي يبلغ قطرها 250-300 ميكرومتر تعمل بشكل أفضل من تلك التي يبلغ قطرها >500-600 ميكرومتر ، مما يؤدي إلى عملية تنبت كاملة للأوعية ونواة عضوية مكثفة إلى الحد الأدنى. وبالتالي ، فإن حجم الركام أمر بالغ الأهمية ويمكن أن يتأثر بكل من عدد الخلايا المستخدمة أثناء البذر الأولي والوقت المخصص لتشكيل الركام. تعد ألواح Microwell التي تسمح بالتحكم في حجم الركام والرقم22 بديلا قابلا للتطبيق لتقنية تكوين الركام العشوائي الناتجة عن استخدام ألواح 6 آبار ذات التعلق المنخفض للغاية في هذا البروتوكول. يعد الاتساق في التوقيت وإدارة الأحجام الإجمالية خلال أول 6 أيام من بروتوكول hBVO أحد المؤشرات الحاسمة ، إن لم يكن أكثرها أهمية ، لتطوير عضويات الأوعية الدموية الحسنة النية بنجاح.
يجب إكمال التغييرات المتوسطة في اليوم 1 (تحريض الأديم المتوسط) واليوم 4 (تحريض الأوعية الدموية) بالاقتران مع ترسيب الركام. على الرغم من أن الطرد المركزي هو بديل مغري ، إلا أن القوى الإضافية المطبقة على التجمعات ضعيفة التجميع يمكن أن تسبب تكتلا وتجميعا وقصا غير مرغوب فيه ، مما يؤثر سلبا على التمايز والنضج وفعالية النبتة في المراحل اللاحقة من البروتوكول. يعد العمل على الجليد خلال عملية تضمين اليوم 6 أمرا بالغ الأهمية للحفاظ على بلمرة ECM المناسبة وتشكيل الطبقة. أثناء تضمين الركام وتحريض النبتة ، فإن تعريض ECM لدرجات حرارة أعلى من 4 درجات مئوية و / أو درجة حموضة ECM بخلاف 7.4 لن يؤثر فقط على معدلات البلمرة وسلامة طبقة ECM ولكن أيضا على كفاءة تنبت الركام المدمج. تسمح الطبيعة المرنة لمصفوفة تنبت ECM بالانفصال والنقل بسهولة من طبق الاستزراع المكون من 12 بئرا إلى سطح القطع المعقم. ستستهلك المواد العضوية الفردية التي تمت إزالتها من المصفوفة ونقلها إلى ألواح 96 بئرا منخفضة للغاية ما تبقى من ECM المحيط وتحتفظ بشبكات الأوعية الدقيقة البطانية المغلفة بالخلايا الجدارية ذاتية التنظيم مع غشاء قاعدي مستمر.
على الرغم من عدم تغطيتها في هذا الاقتراح ، إلا أن التعديلات على تركيبات الوسائط يمكن أن تكرر الأمراض التي بدورها تثير استجابات مرضية في hBVOs 8,11. حدود نمذجة الأمراض باستخدام نظام hBVO بعيدة كل البعد عن أن تكون معروفة جيدا ، وهذا بالتأكيد مجال يحتاج إلى استكشاف. إن تطبيق تقنية الأوعية الدموية العضوية الخاصة بنا في الأوعية الدموية للتركيبات العضوية اللاوعائية سابقا23 له أيضا تأثير واهتمام كبيران.
Disclosures
لا توجد علاقة بين المصالح المالية للمؤلفين والبحث الذي يتم تقديمه. تم ترخيص تقنية الأوعية الدموية العضوية لشركة Stemcell Technologies. JMP هو مؤسس ومساهم في Angios Biotech التي تطور عضويات الأوعية الدموية كعلاج لزراعة الأوعية الدموية. تم تقديم طلب براءة اختراع يتعلق بهذا العمل تحت رقم Pat. US20200199541A1 ، إدراج راينر أ. ويمر وجوزيف إم بينينجر ودونتشو كيرجاشكي كمخترعين.
Acknowledgements
نشكر جميع أعضاء مختبراتنا على المدخلات والمناقشات الهامة. تلقت JMP تمويلا من مؤسسة T. von Zastrow ، وجائزة FWF Wittgenstein (Z 271-B19) ، والأكاديمية النمساوية للعلوم ، والتعهد المشترك لمبادرة الأدوية المبتكرة 2 (JU) بموجب اتفاقية المنحة رقم 101005026 ، وشبكات Leducq عبر المحيط الأطلسي للتميز في أبحاث القلب والأوعية الدموية ، وبرنامج الباحث المتميز لمعهد ألين ، وبرنامج كراسي البحث الكندية 150 F18-01336 بالإضافة إلى منح المعاهد الكندية للبحوث الصحية COVID-19 F20-02343 و F20-02015.
Materials
| Name | Company | Catalog Number | Comments |
| 1 M HEPES | Gibco | 15630080 | |
| 2-Mercaptoethanol | Millipore | 60-24-2 | |
| 7.5% sodium bicarbonate | Gibco | 5080094 | |
| Accutase | Gibco | A1110501 | cell dissociation reagent |
| Albumin fraction V (BSA) | AppliChem | A1391, 0100 | |
| Alexa Fluor 488–anti-rabbit IgG (Fab′)2 fragment | — | Jackson Immuno Research | 711-546-152 |
| Alexa Fluor 488–anti-sheep IgG | — | Life Technologies | A11015 |
| Alexa Fluor 647–anti-goat IgG (Fab′)2 fragment | — | Jackson Immuno Research | 705-606-147 |
| Automated cell counter | Invitrogen | Countess II | |
| B27 supplement | Gibco | 12587010 | |
| Biological safety cabinet | Faster | SafeFAST Premium 212 | |
| BMP4 | Miltenyi BioTec | 130-111-165 | |
| CD31 | Endothelial cell | DAKO | M0823 |
| CD31 | Endothelial cell | R&D | AF806 |
| Cellulose wipes | |||
| Centrifuge | Heraeus | Multifuge 4 KR | |
| CHIR99021 | Tocris Bioscience | 4423 | |
| Clear nail polish (essence, the gel, 01 absolute pure) | |||
| CO2 incubator | New Brunswick | Galaxy 170S | |
| Collagen type IV | Basement membrane | Millipore | AB769 |
| Confocal microscope (10x, 20x, 63x objectives) | Leica | SP8 | |
| Counting chamber slides- including 0.1% Trypan blue | Invitrogen | C10283 | |
| Coverslips (22 x 50 mm) | |||
| Cy3–anti-mouse IgG (Fab′)2 fragment | — | Jackson Immuno Research | 715-166-150 |
| DAPI | Sigma | D9542 | |
| DMEM/F12 | Gibco | 11330-032 | |
| Dulbecco's Modefied Eagle's Medium (DMEM) | Sigma | D5648-10L | |
| Eppendorf tubes | |||
| Falcon tubes | Fisher Scientific | 14-432-22 | |
| Fetal Bovien Serum (FBS) | Gibco | 10270-106 | |
| FGF2 | Miltenyi BioTec | 130-093-841 | |
| Fine forceps | FST | 11254-20 | |
| Fisherbrand Superfrost Clipped Corner Slides | Fisher Scientific | 12-550-016 | |
| Forskolin | Sigma | F3917 | |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Fisher Scientific | A1413302 | |
| Glutamax | Gibco | 35050061 | |
| Ham's F12 | Gibco | 11765054 | |
| Horizontal laminar flow station, if stereomicroscope cannot fit in BSC | Thermo Scientific | Heraguard | |
| Inverted contrasting tissue culture microscope | Zeiss | Vert.A1 | |
| iSpacer | SunJinLab | IS009 | |
| KnockOut DMEM/F12 | Gibco | 12660012 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| N2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| non-essential amino acids (NEAAs) | Gibco | 11140035 | |
| Orbital shaker | |||
| Parafilm | |||
| Paraformaldehyde (4%) in PBS | Boston BioProducts | BM-155 | |
| PDGFR-β | Pericyte | R&D | AF385 |
| PDGFR-β | Pericyte | Cell Signaling | 3169S |
| Penicillin-streptomycin | Gibco | 15140122 | |
| pH indicator strips (6.5-10) | Mquant, Millipore | 109543 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Pipettes (P1000, P200 and P20) | Gilson, Integra Pipetboy | ||
| Prime Surface-U 96-well plates | Sumilon | MS9096-U | |
| PurCol | Advanced BioMatrix | 5005 | |
| RapiClear CS gel | SunJinLab | RCCS005 | |
| RapiClear CS mounting solution | SunJinLab | RCCS002 | |
| Serological pipettes (5, 10 and 25 mL) | Falcon | 357529, 357530, 357515 | |
| SMA | vSMC/Pericyte | Sigma | 2547 |
| Sodium deoxycholate | Sigma | D6750 | |
| Sodium hydroxide solution (NaOH, 1.0 N) | Sigma | S2770 | |
| Solubilized Basement Membrane Matrix (i.e., Matrigel) | Corning | 356231 | |
| Stainless steel micro spatula (rounded end) | Fisher Scientific | 21-401-5 | |
| Stainless steel spoon (double-ended) | Fisher Scientific | BelArt H367290018 | |
| Stemflex medium | Thermo Scientific | A3349401 | stem cell culture medium |
| StemPro-34 SFM | Gibco | 10639011 | flexible serum-free medium |
| Stereomicroscope | Zeiss | Stemi 2000 | |
| Sterile filter pipette tips (1,000, 300 and 20 μL) | Biozym, Surphob | VT0270, VT0250, VT0220 | |
| Tissue culture–treated 12-well plates TC | BD Falcon | 353043 | |
| Tissue culture–treated 6-well plates | Eppendorf | 30720113 | |
| Triton X-100 | Sigma | 93420 | |
| Tryple Express Enzyme (1x), Phenol Red | Thermo Scientific | 12605010 | mammalian cell dissociating enzyme |
| Tween 20 | Sigma | P7949 | |
| Ultra-low-attachment 6-well plates | Corning | 3471 | |
| VEGFA | Peprotech | 100-20 | |
| Water bath (37 °C) | Fisher Scientific | Isotemp 210 | |
| Y-27632 | Calbiochem | 688000 |
References
- Okwuosa, I. S., Lewsey, S. C., Adesiyun, T., Blumenthal, R. S., Yancy, C. W. Worldwide disparities in cardiovascular disease: Challenges and solutions. International Journal of Cardiology. 202, 433-440 (2016).
- Page, R. L., Ghushchyan, V., Nair, K. A call to action: Responding to the future forecasting of cardiovascular disease in America. American Health & Drug Benefits. 4 (5), 280-288 (2011).
- Ferrara, N., Davis-Smyth, T. The biology of vascular endothelial growth factor. Endocrine Reviews. 18 (1), 4-25 (1997).
- Ishitobi, H., et al. Flk1-GFP BAC Tg mice: An animal model for the study of blood vessel development. Experimental Animals. 59 (5), 615-622 (2010).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Xu, Y., et al. A novel strategy for creating tissue-engineered biomimetic blood vessels using 3D bioprinting technology. Materials. 11 (9), 1581 (2018).
- Risau, W. Mechanisms of angiogenesis. Nature. 386 (6626), 671-674 (1997).
- Wimmer, R. A., et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 565 (7740), 505-510 (2019).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From arteries to capillaries: Approaches to engineering human vasculature. Advanced Functional Materials. 30 (37), 1910811 (2020).
- Wimmer, R. A., Leopoldi, A., Aichinger, M., Kerjaschki, D., Penninger, J. M. Generation of blood vessel organoids from human pluripotent stem cells. Nature Protocols. 14 (11), 3082-3100 (2019).
- Monteil, V., et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 181 (4), 905-913 (2020).
- Patsch, C., et al. generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Bruveris, F. F., Ng, E. S., Stanley, E. G., Elefanty, A. G. VEGF, FGF2, and BMP4 regulate transitions of mesoderm to endothelium and blood cells in a human model of yolk sac hematopoiesis. Experimental Hematology. 103, 30-39 (2021).
- Julian, L., Olson, M. F. Rho-associated coiled-coil containing kinases (ROCK): Structure, regulation, and functions. Small GTPases. 5, 29846 (2014).
- Anitua, E., Prado, R. Addressing reproducibility in stem cell and PRP therapies. Trends in Biotechnology. 37 (4), 340-344 (2019).
- McMurtrey, R. J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids. Tissue Engineering Part C: Methods. 22 (3), 221-249 (2016).
- McKeown, S. R. Defining normoxia, physoxia and hypoxia in tumours-Implications for treatment response. The British Journal of Radiology. 87 (1035), 20130676 (2014).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. British Journal of Cancer. 9 (4), 539-549 (1955).
- Olive, P. L., Vikse, C., Trotter, M. J. Measurement of oxygen diffusion distance in tumor cubes using a fluorescent hypoxia probe. International Journal of Radiation Oncology. 22 (3), 397-402 (1992).
- Torres Filho, I. P., Leunig, M., Yuan, F., Intaglietta, M., Jain, R. K. Noninvasive measurement of microvascular and interstitial oxygen profiles in a human tumor in SCID mice. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2081-2085 (1994).
- Lanzen, J., et al. Direct demonstration of instabilities in oxygen concentrations within the extravascular compartment of an experimental tumor. Cancer Research. 66 (4), 2219-2223 (2006).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), 1565 (2008).
- Sun, X. Y., et al. generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, 76707 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved